Журнал общей биологии, 2020, T. 81, № 1, стр. 31-36
Влияние голодания, как популяционного стресс-фактора, на активацию скрытой бакуловирусной инфекции непарного шелкопряда
С. В. Павлушин 1, *, И. А. Белоусова 1, Е. А. Черткова 1, Ю. Б. Аханаев 1, В. В. Мартемьянов 1, В. В. Глупов 1
1 Институт систематики и экологии животных СО РАН
630091 Новосибирск, ул. Фрунзе, 11, Россия
* E-mail: sergey-pavlushin@mail.ru
Поступила в редакцию 23.07.2019
После доработки 14.10.2019
Принята к публикации 22.10.2019
Аннотация
Условия персистенции энтомопатогенов в организме насекомых-хозяев и механизмы их перехода в острую форму инфекции – одни из важнейших вопросов в понимании механизмов функционирования эпизоотий. В данной работе мы оценили динамику физиологических показателей непарного шелкопряда (Lymantria dispar L.), ответственных за противовирусную защиту насекомых, под воздействием стресс-фактора голодания и ее сопряженность с активацией скрытой формы ядерного полиэдроза. Было обнаружено увеличение концентрации дофамина в гемолимфе гусениц при голодании и снижение общего числа гемоцитов на фоне высокой некротической гибели клеток. Оценено количество вирусоносителей в изучаемой популяции и уровень их активации при голодании (более 70%). ПЦР-анализ показал увеличение количества вирус-положительных особей уже с первых суток голодания. При этом неспецифическая гибель насекомых начиналась только после семи суток голодания, тогда как от активированного вируса уже после двух–трех суток. Таким образом, показано, что при нарастании численности насекомых ведущую роль в активации вирусной инфекции играет нехватка кормового ресурса. Анализируя динамику физиологических параметров, мы предполагаем, что переход скрытой бакуловирусной инфекции в острую форму заражения может запускаться триггерами, вовлеченными в некротические процессы, индуцируемые голоданием.
Бакуловирусы являются представителями сем. Baculoviridae согласно современной международной классификации вирусов, поражают только насекомых, преимущественно чешуекрылых (International Committee Virus Taxonomy, 2013), вызывая острые инфекции с летальным исходом (Blissard, 1996; Cory, Myers, 2003). Данные видоспецифические вирусы способны вызывать массовые эпизоотии в популяциях своих хозяев и длительно сохраняться в окружающей среде, что определило их широкое применение в качестве биопестицидов против массовых видов листогрызущих насекомых (Бахвалов, 2001; Бахвалов и др., 2010). Возникновение массовых эпизоотий в популяциях хозяев обычно наблюдается после пика численности хозяина в фазе популяционного коллапса. Поскольку вирус имеет две стратегии поддержания своей популяции (длительно сохраняться в окружающей среде и горизонтально инфицировать других особей; либо сохраняться в организме хозяина в виде скрытой инфекции и активироваться в острую инфекцию при действии стресс-факторов), то исследователями рассматривается вклад обеих стратегий в формирование эпизоотий. И если на конец 2000-х годов превалировало мнение, что скрытые формы бакуловирусных инфекций слабо влияют на развитие эпизоотий (Kukan, 1999), то на сегодняшний день данная парадигма меняется, и вклад скрытой формы инфекции в регуляцию популяции хозяина пересматривается (Ильиных, Поленогова, 2012; Martemyanov et al., 2015; Williams et al., 2017; Ильиных, 2019). В качестве факторов, активирующих скрытую инфекцию, рассматривают влияние патогенов/паразитов и химического состава растений (Fuxa et al., 1999; Бахвалов, 2001; Cory, Myers, 2004; и др.).
Отдельно стоит упомянуть факторы, напрямую сопряженные со вспышками массового размножения насекомых, такие как голодание (недоедание) и сама плотность особей. Воздействие этих факторов на течение инфекций неоднозначно. Так, в случае экзогенного заражения на непарном шелкопряде было показано снижение устойчивости к бакуловирусу при увеличении плотности насекомых (Reilly, Hajek, 2008). Однако в нашей недавней работе мы рассмотрели влияние переуплотнения насекомых на активацию скрытого вируса в чистом виде, исключая действие “недоедания”, и не выявили активирующего эффекта данного фактора (Pavlushin et al., 2019). Голодание – наиболее сильное стрессовое воздействие, очевидно истощающее организм, делающее его уязвимым. Тем не менее было показано, что голодание может ухудшать течение бакуловирусного патогенеза (Kang et al., 2011) или вовсе не оказывать влияние на чувствительность к инфекции (Myers et al., 2011).
Таким образом, для понимания и управления механизмами возникновения эпизоотий необходимо тщательное изучение свойств патогенов и их взаимодействия с иммунными параметрами насекомого, которые позволяют патогену перейти от персистенции к острой форме инфекции. На сегодняшний день эти аспекты изучены весьма слабо. Данное исследование посвящено изучению динамики иммунологических параметров непарного шелкопряда Lymantria dispar L. при разной продолжительности действия плотностно-зависимого фактора – дефицита кормового ресурса (голодание), который зачастую сопряжен со вспышкой массового размножения хозяина, и ее взаимосвязи с активацией скрытой формы бакуловирусной инфекции.
МАТЕРИАЛЫ И МЕТОДЫ
Работа проводилась на личинках непарного шелкопряда L. dispar 4-го возраста (насекомые отбирались через сутки после линьки) и вирусе ядерного полиэдроза непарного шелкопряда (ВЯПНШ) с 2015 по 2017 год. В работе участвовало две популяции непарного шелкопряда, собранные на территории Новосибирской области, в Карасукском районе (53°44′ с.ш. 78°02′ в.д.) в 2015 и 2016 гг. Обе популяции находились на фазе вспышки.
В качестве стресс-фактора, активирующего переход скрытой формы инфекции в организме насекомых в острую, рассматривалось голодание (Myers et al., 2011), которое зачастую встречается в очагах массового размножения непарного шелкопряда при достижении гусеницами старших возрастов (полная дефолиация кормовых растений) и при их миграции в поисках доступных кормовых ресурсов. В 2015 г. была проведена оценка голодания как активатора скрытой инфекции. В эксперименте использовалось 40 насекомых, по 10 на каждые сутки. Гибель от полиэдроза наступала с третьих суток голодания (рис. 1а; см. подробно в разделе “Результаты”). Таким образом, интервал голодания в основных экспериментах (2016 г.) был выбран от 1 до 4 сут. Данная временная шкала выбрана с учетом того, что после 5 сут полного голодания на гусениц 4-го возраста начинает оказывать существенное воздействие неспецифическая смертность, индуцированная самой голодовкой (рис. 1а). Для исключения действия переуплотнения и исключения каннибализма насекомые содержались индивидуально. Более того, наше предыдущее исследование не выявило влияния группового содержания на активацию вирусной инфекции (Pavlushin et al., 2019). До достижения 4-го возраста насекомые содержались группами в сосудах (20 насекомых/5 л сосуд) и питались на срезанных побегах березы повислой Betula pendula. Для характеристики общего состояния насекомого, оценки силы воздействия стресс-фактора и оценки состояния антивирусного потенциала были изучены нижеуказанные физиологические параметры в соответствии с приведенными в ссылках методами. Общее количество гемоцитов оценивали с помощью камеры Горяева и отображали как число клеток на 1 мл гемолимфы (Martemyanov et al., 2012a, b), выборка составила по 20 насекомых в контроле и опыте на каждые сутки голодания (всего 160 насекомых). Соотношение гемоцитов, погибших от апоптоза и некроза, измеряли с помощью набора реактивов “Annexin V-FITC Apoptosis Detection Kit” (Pavlushin et al., 2019), выборка составила в среднем по 5 насекомых в контроле и опыте (всего 53 насекомых). В среднем просматривалось по 10 полей зрения каждого образца. Показано, что оба оцениваемых параметра могут определять устойчивость насекомых к бакуловирусам (Washburn et al., 1996; Trudeau et al., 2001; McNeil et al., 2010b). Концентрацию дофамина в гемолимфе насекомых как общего показателя уровня воздействия стресс-фактора измеряли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием электрохимического детектора (Gruntenko et al., 2005), выборка составила по 10 насекомых в контроле и голодающей группе на каждые сутки (всего 80 насекомых).
Рис. 1.
Воздействие голодания на смертность (а) гусениц 4-го возраста от скрытой формы вируса ядерного полиэдроза непарного шелкопряда и процент активированных вирусоносителей (б) в популяции после 4-суточного голодания.
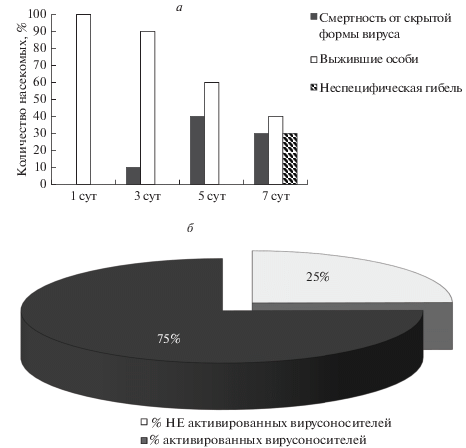
Степень активации вируса определяли относительно доли скрытых вирусоносителей в изучаемой популяции шелкопряда. Для этого выращивали две группы насекомых из одной популяции 2016 г. У первой группы насекомых по достижению 4-го возраста (на следующие сутки после линьки) была взята часть кутикулы с жировым телом для ПЦР-анализа согласно разработанному нами методу (Kasianov et al., 2017; Pavlushin et al., 2019). Всего было проанализировано 364 насекомых. Параллельно выращивали вторую группу насекомых, где после четырехдневного голодания учитывали гибель от полиэдроза (100 гусениц в контроле и 100 в голодающей группе). Все гусеницы содержались индивидуально. Активацию скрытой инфекции фиксировали с помощью световой микроскопии, анализируя ткани погибших насекомых, так как размеры формируемых белковых полиэдров позволяют их визуализировать с помощью данного метода. В результате удалось сопоставить общее количество вирусоносителей с количеством погибших от полиэдроза, т.е. от активации скрытой инфекции, и вычислить, какой процент занимают активированные вирусоносители от общего количества вирусоносителей (рис. 1б). Общий уровень скрытого вирусоносительства популяции определяли с помощью ПЦР в режиме реального времени согласно упомянутой методике (Kasianov et al., 2017; Pavlushin et al., 2019), так как флуоресцентный метод намного чувствительней, чем метод с применением бромфенолового синего. Кроме того, мы провели дополнительный эксперимент, демонстрирующий, насколько абсолютна чувствительность используемого метода для диагностики скрытых инфекций. Для этого мы проанализировали частоту встречаемости скрытого вируса у контрольных и голодающих гусениц 4-го возраста. На каждые сутки голодания было проанализировано по 50 насекомых в контроле и голодающей группе (всего 400 насекомых). На рис. 2 представлен процент вирус-положительных гусениц в контроле и при голодании.
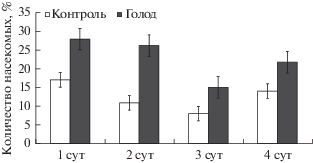
Рис. 2.
Количество обнаруженных вирусоносителей среди гусениц 4-го возраста во время голодания. Различия между контролем и голоданием внутри каждых суток статистически значимы (р ≤ 0.05).
Биохимические показатели (концентрация дофамина и общее количество гемоцитов) были приведены к нормальному распределению путем логарифмирования и вычислены с помощью однофакторного анализа ANOVA из стандартного пакета программы Statistica 7.0 (Kasianov et al., 2017; Pavlushin et al., 2019). Процентные значения (количество вирус-положительных гусениц, количество некротических клеток) сравнивались тестом Манна–Уитни, степень апоптоза оценивали методом хи-квадрат (Pavlushin et al., 2019). В каждом анализе использовались индивидуально содержащиеся насекомые, которые были объединены в одну повторность, что позволило более корректно отследить динамику показателей, отталкиваясь от результатов наших предыдущих исследований, близких по методам (Martemyanov et al., 2015; Kasianov et al., 2017; Pavlushin et al., 2019).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Мы провели предварительную оценку голодания как стресс-фактора, активирующего скрытую вирусную инфекцию на изучаемой модельной системе. На популяции непарного шелкопряда с высоким уровнем вирусоносительства наблюдалась гибель от вируса после 3 сут голодания (рис. 1а). После 5 сут специфическая гибель от вируса достигала 40%. Неспецифическая гибель при этом начиналась только после 7 сут голодания (рис. 1а).
В дальнейшей работе на популяции 2016 г. мы провели ПЦР-диагностику гусениц 4-го возраста и показали, что средний уровень скрытого вирусоносительства изучаемой популяции составил 17%. В то же время при голодании длительностью до 4 сут гусеницы 4-го возраста начинали погибать от активации скрытой формы ВЯПНШ в 13% случаев. Таким образом, голодание приводило к активации скрытого вируса более чем у 70% вирусоносителей данной популяции (рис. 1б).
Интересно, что при анализе вирусоносительства гусениц во всех голодающих группах насекомых (в том числе и на 1-е сутки) вирусная ДНК фиксировалась в среднем в 1.5 раза чаще, чем в контроле (рис. 2). Следовательно, данный вид провокации может быть дополнительно использован для увеличения чувствительности метода. Важно, что уже к первым суткам голодания происходит запуск процессов в организме хозяина, усиливающих репликацию вируса, что и наблюдалось при его обнаружении.
Таким образом, показано, что тотальное голодание является эффективным стресс-фактором активации скрытой бакуловирусной инфекции. В литературе встречаются и противоположные данные. Исследование на тутовом шелкопряде свидетельствует о том, что голодание ухудшает патогенез и распространение бакуловируса по организму насекомого (Kang et al., 2011), но важно отметить, что авторы этой работы проводили экзогенное заражение. Более того, недавние исследования показывают, что скрытая форма инфекции может существенно отличаться генетически от горизонтально передаваемого вируса (Williams et al., 2017). На чешуекрылом Malacosoma pluviale californicum показано отсутствие активации скрытой бакуловирусной инфекции при частичном голодании (Myers et al., 2011). Возможно, выбранный этими исследователями вид обладал большей устойчивостью к голоданию как стресс-фактору. К тому же данные авторы использовали метод “недоедания”, лишая насекомых половины ежедневной нормы корма, что также, вероятно, смягчало действие изучаемого фактора по сравнению с нашими исследованиями.
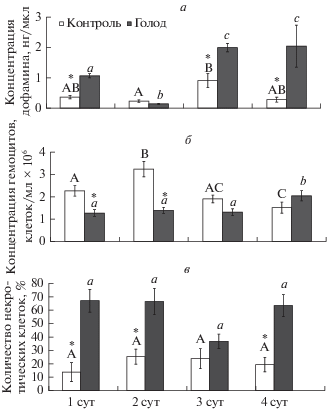
Среди физиологических параметров при голодании (т.е. в случае успешной активации инфекции) и при одиночном содержании насекомых (отсутствие активации) (Pavlushin et al., 2019, fig. 3a, b) наблюдалось повышение уровня дофамина в гемолимфе и снижение общего числа гемоцитов (рис. 3а, б). Данные изменения в целом говорят о стрессовом состоянии насекомого, при этом гемоциты нередко рассматривают как вовлеченные в противовирусную защиту (Trudeau et al., 2001; McNeil et al., 2010a). При оценке влияния голодания мы предполагали, что полученные изменения могут быть сопряжены с активацией скрытой инфекции, но в дальнейшем, при групповом содержании, это предположение не подтвердилось. Однако следует отметить, что в случае активации инфекции, т.е. во время голодания, происходит резкое увеличение некротической гибели клеток (рис. 3в). При этом активность апоптоза достоверно не отличалась от контроля (χ2, p > 0.191). Известно, что бакуловирусы обладают так называемыми iaps-генами (inhibitor of apoptosis genes), блокирующими апоптоз клеток хозяина. Отсюда следует, что апоптоз проявит себя как показатель активации бакуловируса, тем более что апоптоз – один из наиболее часто рассматриваемых механизмов противовирусной защиты (Clem, 2005; Yamada et al., 2012; Ikeda et al., 2013; Hillyer, 2016). Но, вероятно, при скрытой инфекции большее значение имеет снижение численности гемоцитов через некротическую гибель. Таким образом, параметры, традиционно считающиеся вовлеченными в противовирусную защиту насекомых, не всегда сопряжены с активацией скрытой формы инфекции, и не каждое стрессовое воздействие ее провоцирует.
Рис. 3.
Воздействие голодания на концентрацию дофамина (а) в плазме гемолимфы гусениц 4-го возраста, общее количество гемоцитов (б) в гемолимфе насекомых и на количество некрозных клеток (в). Достоверные отличия (р ≤ 0.05) между сравниваемыми вариантами обозначены разными буквами: между сутками контрольных вариантов – прописными буквами, между опытными – строчными; * обозначает статистически значимые отличия внутри каждых суток.
Отдельного внимания заслуживает активность фенолоксидазы (ФО) в гемолимфе голодающих насекомых. При голодании уже с первых суток происходит резкое и многократное возрастание ее активности (Kasianov et al., 2017, fig. 5 ). Активность данного фермента традиционно считается вовлеченной в противовирусную защиту (McNeil et al., 2010a, b; Zhao et al., 2011), поэтому ее всплеск на фоне успешной активации бакуловируса выглядел более чем неожиданно. Мы провели серию экспериментов, опубликованных в отдельной работе (Kasianov et al., 2017), для получения четкой картины о роли данного фермента в устойчивости к ВЯПНШ и считаем, что у данного вида фенолоксидаза не вовлечена в формирование устойчивости к вирусу.
Как указано во введении, голодание и переуплотнение насекомых зачастую неизбежно сопряжены друг с другом. В текущем и предыдущем (Pavlushin et al., 2019) исследованиях мы методически разделили эти факторы. Результаты однозначно свидетельствуют о том, что при нарастании численности ведущую роль в активации вируса играет именно голодание, так как даже при использовании популяции непарного шелкопряда со 100%-ным уровнем вирусоносительства в случае исключительного переуплотнения смертность, как общая, так и от активированного вируса, не отличалась (Pavlushin et al., 2019). Анализ же динамики физиологических параметров дает основания полагать, что переход скрытой бакуловирусной инфекции в острую форму заражения может запускаться триггерами, вовлеченными в некротические процессы, индуцируемые голоданием.
Работа выполнена при финансовой поддержке гранта РФФИ (№ 15-04-08197а) и гранта РНФ (№ 17-46-07002 – финансирование ПЦР-диагностики вируса ядерного полиэдроза непарного шелкопряда).
Список литературы
Бахвалов С.А., 2001. Вирозы насекомых // Патогены насекомых: структурные и функциональные аспекты / Под ред. Глупова В.В. М.: Круглый год. С. 20–75.
Бахвалов С.А., Колтунов Е.В., Мартемьянов В.В., 2010. Факторы и экологические механизмы популяционной динамики лесных насекомых-филлофагов. Новосибирск: Изд-во СО РАН. 299 с.
Ильиных А.В., 2019. Вертикальная передача бакуловирусов // Изв. РАН. Сер. биол. № 3. С. 321–330.
Ильиных А.В., Поленогова О.В., 2012. Демонстрация отдаленного эффекта вертикальной передачи бакуловируса на примере непарного шелкопряда Lymantria dispar L. (Lepidoptera, Lymantriidae) // Журн. общ. биологии. Т. 73. № 5. С. 389–395.
Blissard G.W., 1996. Baculovirus-insect cell interactions // Cytotechnology. V. 20. P. 73–93.
Clem R.J., 2005. The role of apoptosis in defense against baculovirus infection in insects // Curr. Top. Microbiol. Immunol. V. 289 P. 113–129.
Cory J.S., Myers J.H., 2003. The ecology and evolution of insect baculoviruses // Annu. Rev. Ecol. Evol. Syst. V. 34. P. 239–272.
Cory J.S., Myers J.H., 2004. Adaptation in an insect host-plant pathogen interaction // Ecol. Lett. V. 7. P. 632–639.
Fuxa J.R., Sun J.Z., Weidner E.H., LaMotte L.R., 1999. Stressors and rearing diseases of Trichoplusia ni: Evidence of vertical transmission of NPV and CPV // J. Invertebr. Pathol. V. 74. P. 149–155.
Gruntenko N.E., Karpova E.K., Alekseev A.A., Chentsova N.A., Saprykina Z.V. et al., 2005. Effects of dopamine on juvenile hormone metabolism and fitness in Drosophila virilis // J. Insect Physiol. V. 51. P. 959–968.
Hillyer J.F., 2016. Insect immunology and hematopoiesis // Dev. Comp. Immunol. V. 58. P. 102–118.
Ikeda M., Yamada H., Hamajima R., Kobayashi M., 2013. Baculovirus genes modulating intracellular innate antiviral immunity of lepidopteran insect cells // Virology. V. 435. P. 1–13.
International Committee Virus Taxonomy, 2013. https://talk.ictvonline.org/taxonomy/
Kang K.D., Kamita S.G., Suzuki K., Seong S.I., 2011. Effect of starvation upon baculovirus replication in larval Bombyx mori and Heliothis virescens // J. Invertebr. Pathol. V. 106. P. 205–210.
Kasianov N.S., Belousova I.A., Pavlushin S.V., Dubovskiy I.M., Podgwaite J.D. et al., 2017. The activity of phenoloxidase in haemolymph plasma is not a predictor of Lymantria dispar resistance to its baculovirus // Plos One. V. 12. P. e0183940.
Kukan B., 1999. Vertical transmission of nucleopolyhedrovirus in insects // J. Invertebr. Pathol. V. 74. P. 103–111.
Martemyanov V.V., Dubovskiy I.M., Belousova I.A., Pavlushin S.V., Domrachev D.V. et al., 2012a. Rapid induced resistance of silver birch affects both innate immunity and performance of gypsy moths: The role of plant chemical defenses // Arthropod. Plant. Interact. V. 6. P. 507–518.
Martemyanov V.V., Dubovskiy I.M., Rantala M.J., Salminen J.P., Belousova I.A. et al., 2012b. The effects of defoliation-induced delayed changes in silver birch foliar chemistry on gypsy moth fitness, immune response, and resistance to baculovirus infection // J. Chem. Ecol. V. 38. P. 295–305.
Martemyanov V.V., Pavlushin S.V., Dubovskiy I.M., Yushkova Y.V., Morosov S.V. et al., 2015. Asynchrony between host plant and insects-defoliator within a tritrophic system: The role of herbivore innate immunity // Plos One. V. 10. P. e0130988.
McNeil J., Cox-Foster D., Slavicek J., Hoover K., 2010a. Contributions of immune responses to developmental resistance in Lymantria dispar challenged with baculovirus // J. Insect Physiol. V. 56. P. 1167–1177.
McNeil J., Cox-Foster D., Gardner M., Slavicek J., Thiem S., Hoover K., 2010b. Pathogenesis of Lymantria dispar multiple nucleopolyhedrovirus in L. dispar and mechanisms of developmental resistance // J. Gen. Virol. V. 91. P. 1590–1600.
Myers J.H., Cory J.S., Ericsson J.D., Tseng M.L., 2011. The effect of food limitation on immunity factors and disease resistance in the western tent caterpillar // Oecologia. V. 167. P. 647–655.
Pavlushin S.V., Belousova I.A., Chertkova E.A., Kryukova N.A., Glupov V.V., Martemyanov V.V., 2019. The effect of population density of Lymantria dispar (Lepidoptera: Erebidae) on its fitness, physiology and activation of the covert nucleopolyhedrovirus // Eur. J. Entomol. V. 116. P. 85–91.
Reilly J.R., Hajek A.E., 2008. Density-dependent resistance of the gypsy moth Lymantria dispar to its nucleopolyhedrovirus, and the consequences for population dynamics // Oecologia. V. 154. P. 691–701.
Trudeau D., Washburn J.O., Volkman L.E., 2001. Central role of hemocytes in Autographa californica M nucleopolyhedrovirus pathogenesis in Heliothis virescens and Helicoverpa zea // J. Virol. V. 75. P. 996–1003.
Washburn J.O., Kirkpatrick B.A., Volkman L.E., 1996. Insect protection against viruses // Nature. V. 383. P. 767–767.
Williams T., Virto C., Murillo R., Caballero P., 2017. Covert infection of insects by baculoviruses // Front. Microbiol. V. 8. P. 1337.
Yamada H., Shibuya M., Kobayashi M., Ikeda M., 2012. Baculovirus Lymantria dispar multiple nucleopolyhedrovirus IAP2 and IAP3 do not suppress apoptosis, but trigger apoptosis of insect cells in a transient expression assay // Virus Genes. V. 45. P. 370–379.
Zhao P.C., Lu Z.Q., Strand M.R., Jiang H.B., 2011. Antiviral, anti-parasitic, and cytotoxic effects of 5,6-dihydroxyindole (DHI), a reactive compound generated by phenoloxidase during insect immune response // Insect Biochem. Mol. Biol. V. 41. P. 645–652.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


