Журнал общей биологии, 2020, T. 81, № 2, стр. 96-107
Распределение мультипотентных мезенхимных стромальных клеток и их детрита по организму после подкожного введения
И. В. Майбородин 1, *, Р. В. Маслов 1, Т. В. Михеева 1, С. В. Хоменюк 1, В. И. Майбородина 2, В. В. Морозов 1, М. Е. Рягузов 1, С. В. Марчуков 1, Ю. Н. Козлова 1
1 Институт химической биологии и фундаментальной медицины СО РАН
630090 Новосибирск, пр. ак. Лаврентьева, 8, Россия
2 Федеральный исследовательский центр фундаментальной и трансляционной медицины,
Институт молекулярной патологии и патоморфологии
630117 Новосибирск, ул. ак. Тимакова, 2, Россия
* E-mail: imai@mail.ru
Поступила в редакцию 25.07.2019
После доработки 01.12.2019
Принята к публикации 14.12.2019
Аннотация
Методом световой люминесцентной микроскопии изучено распределение мультипотентных мезенхимных стромальных клеток костномозгового происхождения (ММСК) или их детрита по различным отдаленным органам после подкожного введения в интактные ткани крыс. После простой инъекции ММСК, меченных Vybrant CM-Dil, детрит этих клеточных элементов, а, возможно, и сами ММСК попадают в кровь через одну–две недели, о чем свидетельствует появление окрашенных Vybrant CM-Dil объектов в легких. Присутствие ММСК или их дебриса в легочной капиллярной сети не сводится к простой временной “задержке”, там происходит макрофагальный фагоцитоз с накоплением флюоресцентной метки в фагоцитах. В остальные органы детрит ММСК транспортируется с кровью и уже после фильтрации макрофагами легких. После введения ММСК в ткани на фоне венозной блокады детрит этих клеток попадает в кровеносное русло позже и в меньшем количестве. В печени, почках и селезенке ММСК, введенные подкожно, отсутствуют. По-видимому, ММСК и их дебрис при попадании в кровоток оседают в капиллярной сети малого круга кровообращения – в легких. В почках животных после применения ММСК отмечено прогрессирование восходящей бактериальной инфекции мочевых путей, что может быть обусловлено иммуномодуляторным или даже иммуносупрессивным влиянием самих ММСК или их детрита.
Очень часто мезенхимные стромальные клетки (МСК) применяют в косметологии для улучшения состояния кожных покровов, коррекции возрастных изменений и воздействия на рубцы, шрамы (Fang et al., 2016; Seo, Jung, 2016) и стрии (Майбородин и др., 2010). Считается общепринятым, что при локальном введении МСК остаются в месте применения, а при системной (внутривенной) инфузии происходит их распространение по всему организму. При этом МСК попадают главным образом в легкие, где происходит их временная “задержка” в связи с узостью легочных капилляров и большим размером МСК (Gonçalves et al., 2017; Hong et al., 2019), потом МСК попадают в большой круг кровообращения, распределяются по всем органам и тканям, но уже в меньшем количестве, и за счет хоминга мигрируют в поврежденные ткани или красный костный мозг. Только единичные работы сообщают о возможности отдаленной биодистрибуции МСК после внутриорганного введения (Mitsutake et al., 2017) или о деструкции в капиллярной сети легких (Gonçalves et al., 2017).
Вместе с этим остается неисследованной вероятность диссеминации введенных по косметологическим и другим показаниям в кожу (дерму) или подкожно МСК в удаленные органы и ткани. Ранее была доказана миграция мультипотентных МСК костномозгового происхождения (ММСК) или их детрита в ближайшие регионарные лимфатические узлы (ЛУ) (Майбородин и др., 2016, 2017а) и их паранодальную клетчатку с макрофагальной адсорбцией из крово- и лимфотока (Майбородин и др., 2018). А Митсутаке с соавторами (Mitsutake et al., 2017) при различных путях введения МСК в сердце (чрескожный трансэндокардиальный, трансэпикардиальный или внутрикоронарный) обнаружили эти клеточные элементы кроме миокарда в печени и почках, но в значительно меньшем количестве, чем в легких.
В связи с вышеизложенным изучали распределение ММСК или их детрита по различным отдаленным органам после подкожной инъекции этих клеточных элементов в интактные ткани паховой области крыс и на фоне венозного застоя. Также вызывает сомнение и требует дополнительного изучения описанная в литературе простая “задержка” МСК в легких с последующим высвобождением этих клеточных элементов. Аутологичные МСК, вследствие их культивирования и стимулированной пролиферации, а тем более чужеродные МСК, иммунологически могут отличаться от клеток реципиента. Имеются данные о выработке антител против трансплантированных МСК с отторжением их (Badillo et al., 2007; Camp et al., 2009), хотя это происходит и медленнее, чем элиминация других аллогенных типов клеток, таких как фибробласты (Ankrum et al., 2014). Реципиент даже может приобрести иммунитет к МСК после многократного введения через увеличение процента Т-клеток памяти (Zangi et al., 2009). Другими словами, МСК могут (должны) адсорбироваться из просвета капилляров легких иммунокомпетентными клетками, в том числе и макрофагами.
МАТЕРИАЛ И МЕТОДЫ
Работа основана на результатах морфологического исследования различных органов крыс-самцов инбредной линии Wag весом 180–200 г. возрастом 6 месяцев в разные сроки после только подкожного введения ММСК и инъекции в условиях острой венозной недостаточности. Все манипуляции с крысами осуществляли под общим ингаляционным эфирным наркозом в условиях чистой операционной с соблюдением “Правил проведения работ с использованием экспериментальных животных”.
Получение, характеристика и подготовка ММСК
ММСК получали от крысы указанной линии, характеризовали и культивировали в соответствии с нашими прошлыми работами (Майбородин и др., 2013, 2015, 2016, 2017а, б, в, 2018). На втором пассаже к культуре ММСК добавляли краситель Vybrant CM-Dil (Thermo Fisher Scientific, USA) (максимальная абсорбция на 553 нм, эмиссия на 570 нм), который окрашивает мембраны живых суспензионных или прикрепившихся клеток, из расчета 5 мкл раствора на 1 × 106 клеток в 1 мл среды без сыворотки, мягко тщательно перемешивали пипетированием и оставляли на 20 мин в СО2-инкубаторе при 37°С в условиях насыщенной влажности. Затем ММСК центрифугировали 5 мин при 1500 оборотов в минуту, среду с красителем удаляли, к ММСК добавляли новую порцию теплой среды. Процедуру удаления красителя повторяли 3 раза. Затем ММСК ресуспендировали в теплой среде в объеме из расчета 1 × 106 клеток в 1 мл (Майбородин и др., 2017а, б, в, 2018). В культуре неделящихся клеток прослежено сохранение флюоресценции Vybrant CM-Dil высокой интенсивности в течение 3 месяцев.
Хирургическое вмешательство для моделирования острой венозной недостаточности и введение ММСК в эксперименте
Для моделирования острой венозной недостаточности осуществляли хирургический доступ к бедренной вене, перевязывали ее поливолоконным плетеным шовным материалом “Викрил 3/0” (который сохранялся в месте применения вплоть до окончания эксперимента) как можно ближе к месту впадения в глубокую вену, огибающую подвздошную кость, и ушивали кожную рану. Через сутки без удаления лигатуры после дезинфекции кожи спиртом подкожно в область лигированной вены инсулиновым шприцом вводили 100 мкл суспензии ММСК в культуральной среде (1 × 106 клеток на 1 мл с жизнеспособностью не менее 92%). Животных выводили из эксперимента через 4 суток, 1, 2, 3, 4 и 5 недель после инъекции ММСК. В качестве групп сравнения использовали интактных крыс, животных с перевязанной веной без использования ММСК и только с введением ММСК без какого-либо дополнительного воздействия (т.е. без предварительного лигирования вены). В каждой группе на каждую точку эксперимента было 10–12 животных. Гибели крыс от хирургического вмешательства не было, гнойно-воспалительные осложнения в месте операции не отмечены.
Подготовка объектов для изучения морфологическими методами
Для морфологического исследования выделяли фрагменты легких, печени, почек, селезенки, подмышечные и брыжеечные ЛУ. Регионарные паховые ЛУ при таком способе введения ММСК описаны в литературе (Майбородин и др., 2017а), поэтому на них еще раз останавливаться нецелесообразно. Объекты фиксировали в 4%-ном растворе параформальдегида на фосфатном буфере (рН 7.4) не менее 24 ч, обезвоживали в серии этанола возрастающей концентрации, просветляли в ксилоле и заключали в гистопласт. Срезы толщиной 5–7 мкм окрашивали гематоксилином и эозином, изучали на световом микроскопе Axioimager M1 (Zeiss, Германия) при увеличении до 1200 раз.
Кроме того, неокрашенные срезы исследовали на том же микроскопе в режиме люминесценции с фильтрами Alexa Fluor 488 (диапазон возбуждения 450–490 нм, диапазон регистрации 515–∞ нм) или для родамина (Rhod; диапазон возбуждения 540–552 нм, диапазон регистрации 575–640 нм). Изучение тканей в условиях воздействия ультрафиолетовым светом через фильтр Alexa Fluor 488 было предпринято для получения зеленой фоновой аутофлюоресценции, что, во-первых, дает хорошее контрастирование объектов с люминесценцией при установке фильтра для родамина (красный цвет и его оттенки хорошо видны на зеленом фоне), а во-вторых, имеется возможность получить представление о структуре исследуемых тканей и местоположении светящихся красным цветом объектов в том или ином органе.
При получении микрофотографий использовали автоматическую экспозицию, в процессе совмещения изображений с применением фильтров Alexa Fluor 488 и для родамина можно получить зеленый и красный (или оранжевый и желтый) цвет в зависимости от преобладания интенсивности свечения при том или ином фильтре. Зеленый цвет дает более яркая флюоресценция при использовании фильтра Alexa Fluor 488, красный цвет – на фоне применения родаминового фильтра, желтый и его оттенки получаются в результате смешения зеленого и красного цветов в той или другой пропорции (Майбородин и др., 2017а, б, в, 2018).
Микробиологические исследования
Забор материала для бактериологического исследования проводили над спиртовкой в стерильном вытяжном шкафу с избыточным давлением фильтрованного воздуха. Кожу крыс после эвтаназии обрабатывали 70%-ным водным раствором этанола, после удаления кожи на мышцы передней брюшной стенки снова наносили указанный антисептик. Выделяли почки и помещали их в стерильные пробирки. Затем почки разрезали, примерно пополам, вдоль через лоханку, и каждой стороной среза делали отпечатки на стерильные чашки Петри со средами: агар CLED, сабуро-агар (Laboratorios Conda S.A. Madrid, Spain), агар маннит-солевой, сердечно-мозговой агар (Oxoid, United Kingdom), питательный агар – СПА (Микроген, Россия), агар ЭНДО-ГРМ и Левина-ГРМ (Оболенск ФБУН ГНЦ ПМБ, Россия), кровяной агар (Panreac, Spain). Учет выросших колоний производили на вторые–третьи сутки роста бактерий в термостате при 37°С в аэробных и анаэробных (в стеклянном закрытом сосуде после выжигания кислорода открытым пламенем) условиях. Затем с поверхности культуральных сред готовили мазки, окрашивали по Граму и анализировали на вышеупомянутом микроскопе.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В печени, почках и селезенке введенные подкожно ММСК или их фрагменты отсутствуют независимо от состояния венозного оттока. По-видимому, эти объекты даже при попадании в кровоток или не доходят до указанных органов, так как оседают в капиллярной сети малого круга кровообращения – в легких, или макрофаги этих органов в силу каких-то причин не адсорбируют из крови такие антигены, как ММСК и их дебрис.
Распределение ММСК в легких и ЛУ при инъекции в интактные ткани
На сроке в 4 суток после инъекции ММСК в интактные ткани объекты с красными оттенками флюоресценции при использовании родаминового фильтра в ткани легких полностью отсутствовали.
Через неделю в легких возле сосудов появляются единичные клеточные элементы разных форм и размеров со слабым свечением отдельных включений в цитоплазме в условиях применения фильтра для родамина. Спустя 2 недели таких светящихся клеток становится значительно больше. К 3–4 неделям их количество еще более увеличивается, интенсивность флюоресценции становится очень яркой (рис. 1а, б). На сроке в 3 недели светящиеся клетки появляются не только рядом с сосудами (рис. 1а), но и в стенках альвеол (рис. 1), опять же, там, где много капилляров и макрофагов. На 5-й неделе численность клеток с более интенсивным свечением в оранжево-красной области несколько уменьшается, но остается все еще значительной.
Рис. 1.
Легкие и ЛУ животных в различные сроки после подкожного введения ММСК. Результат компьютерного совмещения изображений, полученных в люминесцентном режиме микроскопа с фильтрами Alexa 488 и для родамина. а – через 3 недели в периваскулярно расположенных клетках легкого многочисленные включения значительно ярче флюоресцируют при использовании фильтра для родамина (стрелка). б – в клетках альвеол легкого спустя 3 недели многочисленные включения значительно интенсивнее светятся на фоне применения родаминового фильтра (стрелки). в – аксиллярный ЛУ на 3-й неделе, в клетках в просвете мозгового синуса включения более интенсивно светятся при установке фильтра для родамина (стрелки). г – в клетках, расположенных паравазально рядом с капсулой подмышечного ЛУ, через 4 недели присутствуют единичные включения с несколько более яркой флюоресценцией при использовании родаминового фильтра (стрелки). д – спустя 3 недели отдельные клетки рядом с сосудами паранодальных тканей мезентериального ЛУ светятся более интенсивно на фоне применения фильтра для родамина (стрелки). е – в отдельных клеточных элементах в просвете мозговых синусов брыжеечного ЛУ на 3-й неделе присутствуют включения с более яркой флюоресценцией при установке родаминового фильтра.
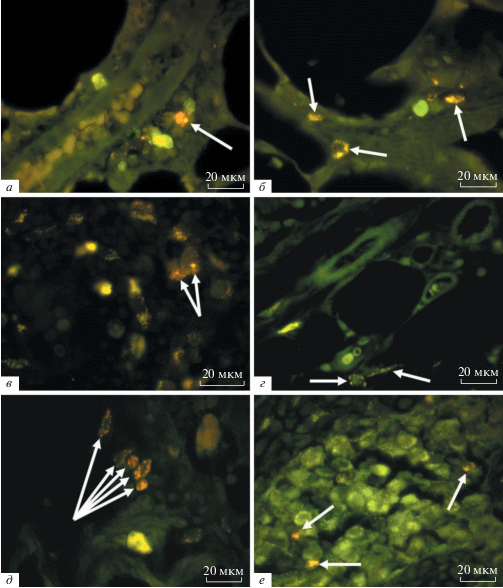
Скорее всего, клеточные элементы со свечением в оранжево-красной области являются макрофагами. Такое заключение сделано на основании следующих визуальных данных:
1. Размер клеток. Только очень немногие клетки могут превышать по размеру 20 мкм, и среди таких клеточных элементов – макрофаги.
2. Наличие множества овальных, четко ограниченных, разнокалиберных включений, которые, по всей видимости, являются лизосомами.
3. Неправильная форма клеток.
Кроме того, макрофагальная природа подобных объектов ранее была подтверждена с использованием моноклональных антител против CD68-антигена, но для других органов, в том числе ЛУ (Майбородин и др., 2016, 2017а). Наиболее вероятно, что ММСК, меченные Vybrant CM-Dil, после введения в интактные ткани рано или поздно проникают в кровоток (Майбородин и др., 2018), вместе с током крови через сердце попадают в легкие, где адсорбируются из крови многочисленными периваскулярными макрофагами (Майбородин и др., 2018). Наиболее вероятно, что светящиеся овальные разнокалиберные включения с четкими границами в макрофагах являются лизосомами, которые получают способность к люминесценции при воздействии ультрафиолетовым светом через родаминовый фильтр за счет фагоцитированного флюоресцентного материала (Luhmann et al., 2009; Lei et al., 2012), не исключено и окрашивание мембран макрофагов Vybrant CM-Dil.
Также существует возможность, вследствие непродолжительного времени существования введенных ММСК в тканях (Rodrigues et al., 2013; Майбородин и др., 2016, 2017а; Yates et al., 2017), диссеминации не самих клеток, а их детрита посредством крови в малый круг кровообращения, откуда этот дебрис ММСК также адсорбируется макрофагами легких с окрашиванием их структур.
Имеется и вероятность миграции в легкие нагруженных антигенами макрофагов, в том числе и окрашенным Vybrant CM-Dil дебрисом ММСК, непосредственно из тканей в месте инъекции ММСК.
В любом случае ткани и структуры легких, скорее всего, содержат не сами меченые ММСК с относительно равномерно окрашенной Vybrant CM-Dil цитоплазмой (Шевела и др., 2017), а клеточные элементы с четко ограниченными флюоресцирующими включениями.
Динамика нарастания количества подобным образом флюоресцирующих клеточных элементов в легких хорошо объясняется с позиции постепенного замещения введенных ММСК и структур, созданных при дифференцировании, собственными клетками реципиентного организма. Максимально этот процесс у крыс выражен спустя 2–3 недели после введения ММСК, когда постепенно исчезают меченые клеточные элементы из тканей, а численность светящихся макрофагов в регионарных ЛУ становится наибольшей (Майбородин и др., 2016, 2017а). Сначала в легкие из места введения поступает детрит введенных ММСК, которые изначально были нежизнеспособными или погибли вскоре после попадания в ткани из-за резкой смены условий существования (Rodrigues et al., 2013; Майбородин и др., 2016, 2017а; Yates et al., 2017).
Затем, начиная с 3-й недели, когда происходит массивная элиминация меченых клеточных элементов из тканей (Майбородин и др., 2016, 2017а), резко возрастает содержание светящихся при использовании фильтра для родамина объектов в легких. Существует вероятность, что на более поздних сроках поступление окрашенных ММСК или их детрита в легкие уже прекратилось, а флюоресцируют макрофаги, ранее поглотившие большой объем меченых объектов. В течение какого-то срока интенсивность свечения и число флюоресцирующих клеток будут снижаться как за счет элиминации таких макрофагов через просвет альвеол и бронхов наружу, так и, возможно, за счет постепенного лизиса окрашенных структур.
Необходимо обратить внимание, что на 3-й неделе светящиеся в условиях применения фильтра для родамина макрофаги расположены не только вблизи сосудов, но и в стенках альвеол. В связи с этим существует возможность прохождения отдельных окрашенных фрагментов ММСК через фильтр легких и их распространения по всему организму уже посредством большого круга кровообращения. В тканях, структурах и органах макрофаги также будут адсорбировать меченый детрит из кровотока и за счет этого приобретать способность к красной флюоресценции при использовании фильтра для родамина. Это должно быть основной причиной появления подобным образом флюоресцирующих фагоцитов практически во всех органах.
В процессе деления введенных ММСК Vybrant CM-Dil должен был распределяться между дочерними клетками, его концентрация должна уменьшаться, и, соответственно, должна снижаться интенсивность флюоресценции. Напротив, в объектах с флюоресценцией, найденных в легких, яркость свечения оставалась очень высокой, из чего был сделан вывод о нарастании содержания красителя в них. Нарастание интенсивности люминесценции легочных макрофагов объясняется тем, что макрофаги могут фагоцитировать несколько инъецированных маркированных ММСК или большое количество их детрита, особенно при условии одновременного лизиса адсорбированного материала.
В аксиллярных ЛУ первые единичные объекты с красным свечением при использовании фильтра для родамина появляются только через 3 недели после инъекции. На этом сроке в просвете мозговых синусов ЛУ в отдельных крупных клеточных элементах, по всей видимости, макрофагах, появляются единичные включения с преимущественным свечением на фоне установки фильтра для родамина (рис. 1в).
К 4-й неделе в подмышечных ЛУ были найдены клеточные элементы с более интенсивной люминесценцией на фоне применения родаминового фильтра уже во всех структурах органов: возле сосудов паранодальной жировой клетчатки, в краевом синусе и в клеточных элементах лимфоидных узелков с центрами размножения (рис. 1г).
К 5-й неделе в капсуле ЛУ и рядом расположенных тканях можно было найти только единичные объекты с незначительно более ярким свечением при использовании родаминового фильтра, чем на фоне применения фильтра Alexa 488.
Возможно, на 3-й неделе после инъекции, после попадания в легкие большого объема детрита ММСК, меченного Vybrant CM-Dil, не все фрагменты адсорбируются легочными периваскулярными и альвеолярными макрофагами. Какая-то часть дебриса проходит через легкие и диссеминируется по всему организму. Эти фрагменты ММСК попадают в ткани и оттуда вместе с током лимфы поступают в различные ЛУ, в том числе и аксиллярные.
Далее, на следующем сроке, флюоресцирующие в оранжево-красной области клетки (макрофаги с меченым детритом ММСК) присутствуют в различных структурах ЛУ по току лимфы, в том числе и окружающей орган клетчатке рядом с ее сосудами. Здесь возможна адсорбция перивазальными макрофагами детрита ММСК как из кровеносных сосудов, так и из лимфатических, как это описано в случае регионарных к месту инъекции ММСК ЛУ (Майбородин и др., 2018). Лимфа из тканей поступает в краевой и далее промежуточный синусы ЛУ, где по ходу синусной системы расположено множество макрофагов, фагоцитирующих антигены, в том числе и окрашенный детрит ММСК, из протекающей лимфы.
Кроме того, макрофаги, расположенные в лимфоидных узелках и участвующие в активации В-лимфоцитов, инициации и поддержании гуморального иммунитета, также могут фагоцитировать (или получать от других фагоцитов, адсорбировавших антигены в тканях или иных различных участках ЛУ) детрит ММСК. Таким образом, возможно создание иммунной защиты против какого-то антигена ММСК.
К 5-й неделе поступление детрита из места инъекции ММСК уменьшается, видимо, все их фрагменты адсорбируются макрофагами легких. В большой круг кровообращения попадает минимальное количество объектов, окрашенных Vybrant CM-Dil, и, соответственно, в подмышечных ЛУ также снижается содержание клеточных элементов со свечением в оранжево-красной области.
На 2-й неделе после инъекции ММСК в интактные ткани слабо светящиеся красным цветом объекты были найдены рядом с сосудами в паранодальной клетчатке брыжеечных ЛУ. Однако такие объекты встречались крайне редко, их флюоресценция была недостаточно яркой, и результаты были расценены как сомнительные.
Спустя 3 недели красная, более интенсивная флюоресценция при использовании родаминового фильтра, относительно результатов применения фильтра Alexa 488, включений в крупных клеточных элементах, расположенных паравазально в клетчатке вокруг брыжеечных ЛУ, уже не вызывала сомнений. Одновременно появились таким же образом светящиеся объекты среди клеток содержимого мозговых синусов этих органов (рис. 1д, е).
На 4-й и 5-й неделях после введения ММСК расположенные поодиночке объекты с четкой преимущественной флюоресценцией в оранжево-красной области зарегистрированы только возле сосудов паранодальной жировой ткани. В данных органах лимфатической системы, как и в аксиллярных ЛУ, отмечена практически такая же динамика появления и уменьшения числа объектов с фрагментами введенных ММСК. Основной причиной появления таких включений в макрофагах брыжеечных ЛУ, скорее всего, также является большой выброс детрита ММСК из места введения в кровь, прохождение этого дебриса мимо фильтра капилляров легочной ткани и диссеминация по всему организму.
Таким образом, при локальной инъекции в подкожную клетчатку крыс ММСК и их детрит также попадают в кровоток и диссеминируются по всему организму с фильтрацией основной массы в капиллярах легких, как описано в литературе при системной инфузии этих клеток. Но скорее всего, присутствие ММСК вместе с дебрисом в капиллярной сети не сводится к простой временной “задержке” (Gonçalves et al., 2017; Hong et al., 2019), там происходит макрофагальный фагоцитоз с накоплением флюоресцентной метки в фагоцитах с окрашиванием их мембран.
Особенности распределения ММСК после подкожного введения в условиях венозной блокады
После инъекции ММСК в интактные ткани первые, еще сомнительные, признаки попадания окрашенного детрита ММСК в кровоток и легкие появляются на 1-й неделе, а спустя 2 недели там присутствуют объекты с хорошо выраженным интенсивным свечением при установке родаминового фильтра. После введения ММСК в ткани с предварительной блокадой венозного кровотока светящиеся клеточные элементы появляются только на 3-й неделе, только рядом с сосудами и сразу в большом количестве. Флюоресценция крупных клеток была достаточно интенсивной и не вызывала сомнений, иногда светились многочисленные включения, а в других случаях – единичные мелкие внутриклеточные объекты (рис. 2а).
Рис. 2.
Органы крыс в различные сроки после подкожной инъекции ММСК в условиях острой венозной блокады. Результат компьютерного совмещения изображений, полученных в люминесцентном режиме микроскопа с фильтрами Alexa 488 и для родамина. а – в крупных клетках рядом с сосудом легкого через 3 недели разное количество включений очень ярко флюоресцирует при использовании родаминового фильтра. б – спустя 5 недель в единичных, паравазально расположенных крупных клетках рядом с сосудом легкого отдельные включения ярко светятся на фоне применения родаминового фильтра (стрелка). в – в различных клетках краевого синуса аксиллярного ЛУ на 4-й неделе включения интенсивно флюоресцируют при использовании родаминового фильтра (стрелки). г – слабое свечение в условиях применения фильтра для родамина отдельных включений в клеточных элементах паранодальных тканей (стрелка) подмышечного ЛУ через 5 недель. д – единичный объект с флюоресценцией при использовании фильтра для родамина (стрелка) в капсуле брыжеечного ЛУ спустя 3 недели. е – на 4-й неделе рядом с капсулой мезентериального ЛУ единичные включения в клеточных элементах слабо светятся на фоне установки родаминового фильтра, при этом есть очень интенсивно флюоресцирующие объекты, расположенные рядом с сосудами (стрелка).
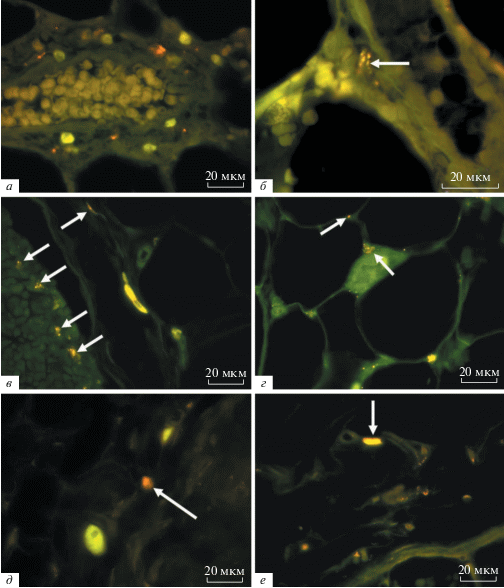
Скорее всего, подобные флюоресцирующие клетки, расположенные паравазально, являются макрофагами, которые фагоцитируют детрит ММСК, меченный Vybrant CM-Dil, из кровотока, и за счет накопления люминесцентного материала в лизосомах светящиеся (Luhmann et al., 2009; Lei et al., 2012) даже более ярко, чем инъецированные ММСК.
На 4-й и 5-й неделях в легких количество флюоресцирующих объектов прогрессивно уменьшается, в них сокращается количество включений с люминесценцией и снижается интенсивность самого свечения (рис. 2б).
Таким образом, при введении ММСК в ткани с нарушенным венозным оттоком в кровеносное русло и легкие детрит инъецированных клеточных элементов поступает позже и в меньшем объеме, чем после трансплантации ММСК в интактные ткани. Возможно, это связано с блокадой венозного оттока, и введенные ММСК не могут мигрировать, а их детрит не может попасть в тромбированные или просто выключенные из кровотока капилляры. Также является вероятным, что в таких условиях ММСК принимают участие как в разрешении венозной блокады через формирование новых сосудов в обход лигированных или тромбированных (Martin-Rendon et al., 2007; Hu et al., 2008; Майбородин и др., 2017б, в), так и в образовании сосудов грануляций (Майбородин и др., 2013, 2015), необходимых для репарации тканей, поврежденных при хирургическом вмешательстве по моделированию венозной блокады.
И только по мере замещения клеточных элементов, сформированных из введенных ММСК, и после инволюции грануляций окрашенный Vybrant CM-Dil детрит ММСК попадает уже в восстановленный кровоток и лимфоток. Не исключено, что сначала ММСК и их детрит адсорбируются фагоцитами на месте, и уже макрофаги со светящимися лизосомами мигрируют в легкие посредством сосудистого русла.
В структуре подмышечных ЛУ первые объекты с красным свечением при использовании фильтра для родамина появляются только на 3-й неделе после инъекции ММСК. На этом сроке крайне редко можно обнаружить единичные клеточные элементы в краевом и мозговом синусах ЛУ. Так как красная флюоресценция была слабой, в краевом синусе такие находки были единичными, а в мозговых синусах содержалось много эритроцитов, то полученные результаты расценены как сомнительные.
К 4-й неделе количество светящихся клеток при использовании фильтра для родамина в краевом синусе возросло, и появились единичные объекты рядом с ЛУ (рис. 2в). Спустя 5 недель также были найдены отдельные клеточные элементы с такой флюоресценцией в паранодальной клетчатке (рис. 2г) и в просвете мозговых синусов.
После инъекции ММСК в ткани на фоне локальной венозной блокады четкие несомненные положительные данные о распространении метки в ЛУ были получены только на 4-й неделе. Как и в легких, куда попал детрит этих клеточных элементов, меченный Vybrant CM-Dil, произошла незначительная задержка относительно результатов введения ММСК в интактные ткани. Скорее всего, такое отставание обусловлено нарушениями тока крови в месте инъекции, и когда венозная недостаточность разрешилась, детрит ММСК попал в кровь и после прохождения мимо легочных макрофагов распространился по всем структурам организма.
В аксиллярные ЛУ этот окрашенный мембранным красителем дебрис мог как попасть из региона лимфосбора вместе с лимфой или уже в цитоплазме макрофагов, так и быть адсорбирован макрофагами ЛУ непосредственно из сосудов паранодальной клетчатки или проходящих в самих органах. Скорее всего, имеют место оба пути проникновения детрита ММСК в подмышечные ЛУ: окрашенные объекты в краевом синусе свидетельствуют о фагоцитозе макрофагами ЛУ детрита из притекающей лимфы, а светящиеся клетки рядом с сосудами окружающих ЛУ тканей подтверждают возможность фагоцитоза периваскулярными макрофагами детрита непосредственно из крови (Майбородин и др., 2018).
В брыжеечных ЛУ на 3-й неделе после инъекции ММСК появились первые клеточные элементы с более интенсивным свечением при использовании фильтра для родамина. Эти клеточные элементы были единичными и располагались в капсуле органов или непосредственно рядом с ней, в местах, где много сосудов и макрофагов (рис. 2д). Через 4 недели в капсуле подобные объекты стали несколько более многочисленными, и некоторые флюоресцировали очень ярко (рис. 2е). Спустя 5 недель такие клеточные элементы опять встречались очень редко, и интенсивность их свечения значительно снизилась.
Так же, как и в других органах животных этой группы, в мезентериальных ЛУ после введения ММСК на фоне венозной блокады отмечено запаздывание появления меченного Vybrant CM-Dil детрита использованных клеточных элементов. Также стало меньше флюоресцирующих в условиях применения родаминового фильтра объектов, и снизилась яркость их люминесценции. Это, наиболее вероятно, связано с задержкой введенных ММСК в месте инъекции из-за нарушенного венозного оттока (невозможность попасть в кровь вследствие лигирования и тромбоза сосудов и нарушений микроциркуляции) и сопровождающего операцию асептического воспаления (блокада микроциркуляции для предотвращения диссеминации антигенов и токсинов из воспалительного очага). За время нахождения в тканях в месте инъекции частично ММСК и их детрит фагоцитируется и лизируется макрофагами (Майбородин и др., 2016, 2017а).
При восстановлении венозного оттока, репарации тканей и стихании воспалительной реакции в кровь и далее в ткани поступает уже меньший объем детрита ММСК, окрашенного Vybrant CM-Dil. В связи с этим в различных органах, в том числе и в брыжеечных ЛУ, макрофаги могут адсорбировать из крови и лимфы детрит инъецированных клеток несколько позже, с задержкой на процесс восстановления венозного оттока и стихания воспаления, и в меньшем объеме.
Возможные проявления иммуномодуляторного эффекта при диссеминации ММСК и их детрита по организму
У большинства (8–10 из 12) животных групп с инъекций ММСК начиная со 2-й недели при неизмененном кровотоке и после 3 недель на фоне венозной блокады в мозговом веществе почек были найдены мелкие пылевидные объекты со слабой флюоресценцией (рис. 3а, б). Это сопровождалось микроциркуляторными и лейкоцитарными реакциями, характерными для острых воспалительных процессов: лейкоцитарная инфильтрация, тромбы и стаз эритроцитов в капиллярах (рис. 3в, г). Наличие сидерофагов в сосудистых тромбах (рис. 3г) является доказательством того, что микроциркуляторные расстройства не связаны с выведением животных из эксперимента и с препаровальными процедурами, а развились несколько ранее. Описанные изменения отсутствовали у контрольных крыс.
Рис. 3.
Изменения почек крыс после применения ММСК. а – в клетках мозгового вещества почки присутствуют мелкие пылевидные объекты с несколько более яркой флюоресценцией, чем фоновая (стрелки). б – в просвете дистальных канальцев содержатся очень мелкие слабо светящиеся объекты. в – инфильтрация мозгового вещества почки сегментоядерными нейтрофилами (стрелки). г – тромбы с сидерофагами в просвете сосудов (стрелки) на границе коркового и мозгового вещества почки. д – грамположительные бактерии кокковой формы располагаются внутри клеток с гомогенной цитоплазмой и явлениями кариолизиса, некоторые грамотрицательные палочки обладают гетерохромностью (стрелки). е – незначительная часть грамотрицательных палочковидных микроорганизмов гетерохромны (стрелки). а, б – неокрашенные срезы в люминесцентном режиме микроскопа с фильтром Alexa 488; в, г – окраска гематоксилином и эозином; д, е – мазки с кровяного агара, окрашенные по Граму. а, в – спустя 2 недели после подкожной инъекции ММСК без изменений кровотока; б, г, д, е – через 4 недели после подкожного введения ММСК на фоне нарушения венозного оттока.
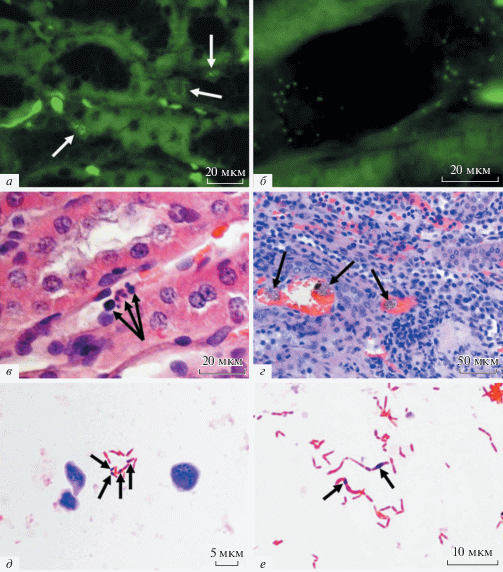
Существует возможность, что подобные частицы являются дебрисом ММСК, задержанным почками и элиминирующимся посредством их канальцевой системы. Однако в этом случае подобные светящиеся фрагменты ММСК или макрофаги с люминесцирующим детритом ММСК были бы обнаружены и в корковом веществе органов, где хорошо развита капиллярная сеть (дополнительно включающая артерио-артериальные капилляры клубочков) и где рядом с сосудами расположено множество фагоцитов. Против этого выступает и отсутствие более яркой люминесценции на фоне установки фильтра для родамина: люминисценция наблюдалась равно как в зеленой, так и в красной области. Более вероятно, что такие объекты являются микроорганизмами, попавшими в мозговое вещество почки восходящим путем. Следует отметить, что многие бактерии могут люминесцировать при воздействии ультрафиолетовым светом.
В результате культивирования отпечатков почек крыс на различных питательных средах и в разных условиях по отношению к кислороду (аэробное или анаэробное) в течение 3 суток визуального роста микроорганизмов не наблюдалось. Но после приготовления мазков, сделанных с кровяного агара по окончании культивирования в аэробных условиях, и окрашивания препаратов по методу Грама были обнаружены грамотрицательные (размером 0.5 × 2 мкм) и грамположительные (0.5 × 0.5 мкм) бактерии (рис. 3д, е). При этом часть грамположительных бактерий была расположена внутри клеточных элементов, похожих на лейкоциты с признаками деструкции (диаметр 10–12 мкм, гомогенная цитоплазма без ядер или с их фрагментами) (рис. 3д).
При изучении окрашенных мазков, изготовленных с других культуральных сред, были отмечены единичные грамотрицательные и грамположительные микроорганизмы, визуально похожие на бактерии с кровяного агара. Незначительное содержание таких объектов, по-видимому, объясняется отсутствием подходящих условий для их роста. В связи с очень слабой пролиферацией найденных бактерий и отсутствием их роста на селективных средах определение родовой принадлежности обнаруженных микроорганизмов по биохимическим свойствам является затруднительным. Видовую идентификацию обнаруженных бактерий методом секвенирования гена 16S рибосомальной РНК не проводили вследствие незначительного роста на селективных средах и малочисленности микроорганизмов.
В данном случае следует учитывать и иммуномодулирующее, и даже иммуносупрессивное влияние как самих ММСК (Shree et al., 2017; Witte et al., 2017), так и их детрита, содержащего множество микровезикул и экзосом (Shree et al., 2017; Tang et al., 2017). Такой эффект может способствовать прогрессированию инфекции мочевых путей и объясняет отсутствие подобных находок на более ранних сроках наблюдения.
После инъекции ММСК в условиях лигирования магистральной вены прогрессирование инфекции в почках отмечено на неделю позже и выражено менее значительно (ниже уровень бактериальной контаминации). Возможно, что это связано с некоторой задержкой ММСК и их детрита вследствие венозной блокады, а также с необходимостью принимать участие в формировании сосудов грануляций. По мере восстановления венозного оттока, лизиса поврежденных тканей и инволюции грануляций фрагменты ММСК попадают в кровоток, но уже в меньшем объеме, распространяются по всему организму и оказывают свое иммуномодуляторное действие (Shree et al., 2017; Tang et al., 2017) в различных органах и тканях.
В связи с этим целесообразно тщательно обследовать пациентов перед проведением лечения с применением клеточных технологий для профилактики обострения хронических инфекционных процессов, в том числе и скрытых.
ЗАКЛЮЧЕНИЕ
Таким образом, после инъекции ММСК, меченных Vybrant CM-Dil, в интакные ткани детрит этих клеточных элементов, а, возможно, и сами ММСК попадают в кровь через 1–2 недели, о чем свидетельствует обнаружение окрашенных Vybrant CM-Dil объектов в легких. Присутствие ММСК вместе с дебрисом в капиллярной сети не сводится к простой временной “задержке”, там происходит макрофагальный фагоцитоз с накоплением флюоресцентной метки в фагоцитах с окрашиванием их мембран. Количество подобным образом меченных макрофагов в легких нарастает с максимумом на 3-й неделе, затем постепенно снижается. В аксиллярных и брыжеечных ЛУ такие объекты присутствовали в минимальном количестве, очень непродолжительное время и чаще всего в краевом синусе и рядом с сосудами околоузловой клетчатки. После введения ММСК в ткани на фоне предварительно созданной венозной блокады окрашенный детрит ММСК попадает в кровеносное русло позже и в меньшем объеме, чем после инъекции ММСК в интактные ткани. По-прежнему максимальный объем детрита из крови адсорбируется макрофагами легких, и только после прохождения легких дебрис ММСК распространяется по всему организму и попадает в подмышечные и мезентериальные ЛУ. Необходимо особо отметить обнаруженное в почках животных после применения ММСК прогрессирование восходящей инфекции мочевых путей, что может быть обусловлено иммуномодуляторным или даже иммуносупрессивным влиянием как самих ММСК, так и их детрита. На фоне венозного застоя бактериальная контаминация отмечена позже и не так значительна. В печени, почках и селезенке ММСК, введенные подкожно, или их фрагменты отсутствуют независимо от состояния венозного оттока.
Работа выполнена при финансовой поддержке ПФНИ ГАН на 2017–2020 гг. “Разработка технологий получения материалов для регенеративной медицины и развитие методов восстановления репродуктивного здоровья” (VI.62.2.1, 0309-2016-0006) и “Биология бактериально-вирусных сообществ” (VI.55.1.1, 0309-201x-0002).
Список литературы
Майбородин И.В., Шевела А.И., Бабко А.Н., Морозов В.В., Загоруйко Т.Ю., Матвеева В.А., 2010. Морфологические результаты применения клеточных технологий для коррекции линейной атрофии кожи // Рос. журн. кожных и венерических болезней. № 1. С. 57–62.
Майбородин И.В., Морозов В.В., Новикова Я.В., Матвеева В.А., Артемьева Л.В. и др., 2013. Введение мезенхимальных стволовых клеток рядом с тромбированной веной в эксперименте способствует ангиогенезу в грануляциях // Флебология. Т. 7. № 1. С. 10–16.
Майбородин И.В., Морозов В.В., Новикова Я.В., Матвеева В.А., Артемьева Л.В. и др., 2015. Ангиогенез в тканях после введения стромальных стволовых клеток костномозгового происхождения рядом с тромбированной веной в эксперименте // Морфология. Т. 148. № 4. С. 12–18.
Майбородин И.В., Матвеева В.А., Маслов Р.В., Оноприенко Н.В., Кузнецова И.В. и др., 2016. Некоторые реакции регионарных лимфатических узлов крыс после имплантации в дефект костной ткани мультипотентных стромальных клеток, адсорбированных на полигидроксиалканоате // Морфология. Т. 149. № 2. С. 21–26.
Майбородин И.В., Морозов В.В., Аникеев А.А., Фигуренко Н.Ф., Маслов Р.В. и др., 2017а. Макрофагальный ответ у крыс на введение мультипотентных мезенхимальных стромальных клеток в регион хирургической травмы // Новости хирургии. Т. 25. № 3. С. 233–241.
Майбородин И.В., Морозов В.В., Матвеева В.А., Аникеев А.А., Маслов Р.В. и др., 2017б. Первые этапы ангиогенеза после использования клеточных технологий на фоне острого экспериментального локального нарушения венозного оттока // Клеточные технологии в биологии и медицине. № 1. С. 32–38.
Майбородин И.В., Морозов В.В., Матвеева В.А., Аникеев А.А., Фигуренко Н.Ф. и др., 2017в. Результаты использования клеточных технологий при лигировании магистральной вены в эксперименте // Бюл. эксперим. биологии и медицины. Т. 164. № 7. С. 73–80.
Майбородин И.В., Маслов Р.В., Михеева Т.В., Еловский А.А., Фигуренко Н.Ф. и др., 2018. Макрофагальная адсорбция мультипотентных мезенхимальных стромальных клеток как доказательство их миграции по сосудам после тканевой инъекции // Молек. медицина. Т. 16. № 4. С. 56–61.
Шевела А.А., Тодер М.С., Матвеева В.А., Артемьева Л.В., Матвеев А.Л. и др., 2017. Химически чистое кремниевое и танталовое покрытие не токсично для мезенхимальных стромальных клеток и усиливает цитосовместимость электрополированного сплава никелида титана // Вопр. реконструкт. и пласт. хирургии. № 3(62). С. 45–50.
Ankrum J.A., Ong J.F., Karp J.M., 2014. Mesenchymal stem cells: Immune evasive, not immune privileged // Nat. Biotechnol. V. 32. № 3. P. 252–260.
Badillo A.T., Beggs K.J., Javazon E.H., Tebbets J.C., Flake A.W., 2007. Murine bone marrow stromal progenitor cells elicit an in vivo cellular and humoral alloimmune response // Biol. Blood Marrow Transplant. V. 13. № 4. P. 412–422.
Camp D.M., Loeffler D.A., Farrah D.M., Borneman J.N., LeWitt P.A., 2009. Cellular immune response to intrastriatally implanted allogeneic bone marrow stromal cells in a rat model of Parkinson’s disease // J. Neuroinflammation. V. 6. P. 17.
Fang F., Huang R.L., Zheng Y., Liu M., Huo R., 2016. Bone marrow derived mesenchymal stem cells inhibit the proliferative and profibrotic phenotype of hypertrophic scar fibroblasts and keloid fibroblasts through paracrine signaling // J. Dermatol. Sci. V. 83. № 2. P. 95–105.
Gonçalves F.D.C., Luk F., Korevaar S.S., Bouzid R., Paz A.H. et al., 2017. Membrane particles generated from mesenchymal stromal cells modulate immune responses by selective targeting of pro-inflammatory monocytes // Sci. Rep. V. 7. № 1. P. 12100.
Hong K.Y., Kim I.K., Park S.O., Jin U.S., Chang H., 2019. Systemic administration of adipose-derived stromal cells concurrent with fat grafting // Plast. Reconstr. Surg. V. 143. № 5. P. 973e–982e.
Hu X., Yu S.P., Fraser J.L., Lu Z., Ogle M.E. et al., 2008. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis // J. Thorac. Cardiovasc. Surg. V. 135. № 4. P. 799–808.
Lei L., Tzekov R., Tang S., Kaushal S., 2012. Accumulation and autofluorescence of phagocytized rod outer segment material in macrophages and microglial cells // Mol. Vis. V. 18. P. 103–113.
Luhmann U.F., Robbie S., Munro P.M., Barker S.E., Duran Y. et al., 2009. The drusenlike phenotype in aging Ccl2-knockout mice is caused by an accelerated accumulation of swollen autofluorescent subretinal macrophages // Invest. Ophthalmol. Vis. Sci. V. 50. № 12. P. 5934–5943.
Martin-Rendon E., Hale S.J., Ryan D., Baban D., Forde S.P. et al., 2007. Transcriptional profiling of human cord blood CD133+ and cultured bone marrow mesenchymal stem cells in response to hypoxia // Stem Cells. V. 25. № 4. P. 1003–1012.
Mitsutake Y., Pyun W.B., Rouy D., Foo C.W.P., Stertzer S.H. et al., 2017. Improvement of local cell delivery using helix transendocardial delivery catheter in a porcine heart // Int. Heart J. V. 58. № 3. P. 435–440.
Rodrigues M., Yates C.C., Nuschke A., Griffith L., Wells A., 2013. The matrikine tenascin-C protects multipotential stromal cells/mesenchymal stem cells from death cytokines such as FasL // Tissue Eng. Part A. V. 19. № 17–18. P. 1972–1983.
Seo B.F., Jung S.N., 2016. The immunomodulatory effects of mesenchymal stem cells in prevention or treatment of excessive scars // Stem Cells Int. V. 2016. P. 6937976.
Shree N., Venkategowda S., Venkatranganna M.V., Bhonde R.R., 2017. Treatment with adipose derived mesenchymal stem cells and their conditioned media reverse carrageenan induced paw oedema in db/db mice // Biomed. Pharmacother. V. 90. P. 350–353.
Tang X.D., Shi L., Monsel A., Li X.Y., Zhu H.L. et al., 2017. Mesenchymal stem cell microvesicles attenuate acute lung injury in mice partly mediated by Ang-1 mRNA // Stem Cells. V. 35. № 7. P. 1849–1859.
Witte S.F.H., de, Merino A.M., Franquesa M., Strini T., Zoggel J.A.A., van, et al., 2017. Cytokine treatment optimises the immunotherapeutic effects of umbilical cord-derived MSC for treatment of inflammatory liver disease // Stem Cell Res. Ther. V. 8. № 1. P. 140.
Yates C.C., Nuschke A., Rodrigues M., Whaley D., Dechant J.J. et al., 2017. Improved transplanted stem cell survival in a polymer gel supplemented with Tenascin C accelerates healing and reduces scarring of murine skin wounds // Cell Transplant. V. 26. № 1. P. 103–113.
Zangi L., Margalit R., Reich-Zeliger S., Bachar-Lustig E., Beilhack A. et al., 2009. Direct imaging of immune rejection and memory induction by allogeneic mesenchymal stromal cells // Stem Cells. V. 27. № 11. P. 2865–2874.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


