Журнал общей биологии, 2020, T. 81, № 3, стр. 208-222
Смещение сроков гнездования птиц в центральной Сибири в связи с потеплением климата: фенотипическая пластичность или генетический сдвиг?
О. В. Бурский *
Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: obourski@gmail.com
Поступила в редакцию 30.12.2019
После доработки 03.02.2020
Принята к публикации 20.02.2020
Аннотация
За последние десятилетия накоплены многочисленные факты смещения сроков гнездования птиц на фоне потепления климата. Большинство исследований отмечает корреляцию сроков начала кладки в популяции с температурой определенного периода, однако причины и механизм этой связи остаются неустановленными. Индивидуально-ориентированные генетические исследования, несмотря на значительные успехи, слишком сложны и трудоемки, а их разрешающая способность пока недостаточна для доказательства направленных генетических изменений, связанных с потеплением климата. Мы реализовали популяционный подход к анализу дат начала кладки в 6054 гнездах большинства массовых видов, найденных в слабоизученном естественном регионе за период с 1974 по 2016 год. В поисках максимальной климатической зависимости мы проверили влияние трех погодных показателей, различные даты воздействия и ответную реакцию каждой доли популяции, последовательно вступающей в размножение. Обнаружено, что максимальный ответ связан с фенологическим показателем, основанным на сумме активных температур. Наибольшее влияние приходилось на день 35%-го квантиля начала кладок в сезоне, который совпадал с днем популяционной моды. Отличия фенологической обстановки от нормы в начале гнездования сохранялись и в дальнейшем, что могло служить надежным источником информации о сроках будущего сезонного изобилия. Это должно усиливать эффективность отбора на оптимальную дату по результатам размножения, тем самым объясняя механизм реакции на климат. Даты гнездования и даты достижения необходимых фенологических условий мы разложили на компоненты, связанные с многолетним трендом и ежегодными колебаниями. Сравнивая эти ряды данных, мы получили независимую оценку влияния условий на ежегодные отклонения и многолетнее смещение дат гнездования. Ежегодные отклонения в среде вызывали пропорциональный ответ: ближние мигранты компенсировали изменение среды примерно наполовину, дальние мигранты – на треть, причем восточные меньше, чем западные. При экстремальных фенологических отклонениях ответ некоторых видов был меньше пропорционального и указывал на достижение предела фенотипической пластичности. В годы, разделенные длительным интервалом, но сходные по фенологии весны, даты начала кладки смещались на существенно более ранние сроки. Смещение весенней фенологии за весь период наблюдений превысило 12 дней и вызвало такое же смещение сроков гнездования у ближних мигрантов, но дальние мигранты компенсировали его менее чем на 2/3. Многолетнее смещение сроков превысило их стандартное отклонение в популяциях в среднем в 2.7 раза. Описанные явления выходят за пределы фенотипической пластичности и предполагают существенные эволюционные изменения дат начала кладки.
Влияние современного потепления климата на особенности жизненного цикла птиц в природных популяциях стало уже очевидным, но мы все еще не знаем механизмов, лежащих за этими изменениями. Растущий поток публикаций посвящен ответным изменениям в популяциях (обзоры и метаанализы: Crick, Sparks, 1999; Both et al., 2004; Lehikoinen et al., 2004; Jonzen et al., 2006; Dunn, Winkler, 2010; Lehikoinen, Sparks, 2010; Dunn, Møller, 2014; Pearce-Higgins, Green, 2014; Usui et al., 2017). Хотя их общие тенденции ясны, разнородность ответных реакций чрезвычайно велика и нуждается в объяснении (Møller, Merilä, 2004; Visser et al., 2010; Knudsen et al., 2011). Кроме того, при интерпретации наблюдаемых закономерностей возникли методологические разногласия, которые препятствуют формированию общего представления (Møller, Merilä, 2004; Gordo, 2007).
Исследования на разных континентах показали, что весеннее развитие растений и беспозвоночных смещается на ранние сроки быстрее, чем прилет и гнездование птиц (Parmesan, Yohe, 2003), из-за чего вылет птенцов обычно запаздывает по отношению к сезонному пику обилия кормовых ресурсов (Pearce-Higgins, Green, 2014). В ряде случаев несоответствие между обилием жертв и потребностями птиц приводило к существенным отрицательным последствиям для популяций (Visser et al., 2006). Однако в других популяциях этот эффект подтвердить не удалось: размножение не отставало от пика обилия жертв (Charmantier et al., 2008), либо отставание не сказывалось на благополучии популяции (Halupka et al., 2008). Несмотря на то, что большинство популяций отвечает на потепление климата смещением весенних фаз годового цикла на более ранние сроки (Both et al., 2004), величина смещения различается между датами прилета и гнездования, между зонами и регионами, между таксонами и экологическими группами, в зависимости от избранного климатического фактора, метода исследования и принятых допущений (Pearce-Higgins, Green, 2014).
Сроки гнездования тесно связаны с приспособленностью, причем не только потому, что успех размножения зависит от совпадения выкармливания птенцов с сезонным обилием корма (Visser et al., 2006; Charmantier et al., 2008), но и по многим другим причинам (Dunn, Winkler, 2010). Среди них внутривидовая конкуренция за ресурсы, выгода от продолжительного гнездования и периода развития птенцов, обеспеченность кормом и риск гибели родителей, физиологическое состояние самки, оптимальное сочетание с предыдущей и последующей фазой годового цикла (Charmantier, Gienapp, 2014). Поэтому сроки начала гнездования наследуются, регулируются в зависимости от внешних факторов в пределах широкой нормы реакции и подлежат отбору (Charmantier, Gienapp, 2014).
Сталкиваясь с давлением отбора, – как в случае с текущим изменением климата, – популяции имеют три варианта ответа. Во-первых, они могут достичь соответствия новым условиям посредством фенотипической пластичности, не затрагивающей генетическую конституцию. Во-вторых, они могут адаптироваться к изменившимся условиям путем генетических изменений в процессе эволюции. В-третьих, они могут избежать влияния, расселяясь в другие места обитания, пригодность которых повысилась под воздействием климата (Gienapp et al., 2008). Комбинация этих способов в природе также возможна, если не более вероятна (Davis, Shaw, 2001). Даже если эволюционных изменений пока нет, то рано или поздно они должны произойти, поскольку норма реакции имеет предел, а изменение климата – не имеет, и нам важно знать, какие эволюционные перспективы возможны при столь быстрых изменениях климата.
В идеале для убедительного доказательства эволюционных изменений нужны долговременные наблюдения за меченой популяцией, данные по степени родства особей, разнообразию их фенотипов, индивидуальной приспособленности и степени наследуемости в одной и той же популяции, чтобы измерить силу отбора и связать его факторы с изменением климата (Møller, Merilä, 2004; Merilä, Hendry, 2014). Однако подобные исследования чрезвычайно трудоемки, нередко приводят к выявлению ложных трендов, дают смещенные оценки с большой статистической ошибкой (Charmantier, Gienapp, 2014). В частности, рано разоренные кладки выпадают из-под контроля, поскольку идентификация родителей у гнезда более вероятна в конце гнездования, чем в начале. Исследование индивидуальных фенотипов требует нескольких оценок реакции каждой особи. В случае с датой гнездования это означает многолетнее слежение за мечеными особями с уверенностью, что каждый раз регистрируется именно первая попытка гнездования.
По мнению популяционных генетиков (Gienapp et al., 2008), исследования без генетического анализа не могут дать удовлетворительного ответа. Однако приводимые авторами условия анализа, по-видимому, также не могут претендовать на это в обозримом будущем. Анализ литературы с целью отделить действие фенотипической пластичности от микроэволюционных изменений, спровоцированных изменением климата, привел авторов (Charmantier, Gienapp, 2014) к заключению, что до сих пор ни одно исследование не представило прямого доказательства эволюционной реакции. Более того, не было найдено убедительных подтверждений, что фенотипической изменчивости недостаточно для адекватного ответа на экстремальные фенологические изменения среды (Charmantier et al., 2008; Dunn, Winkler, 2010).
На современном этапе начального знания о генетике популяций индивидуальный подход можно с успехом заменить на популяционный (Merilä, Hendry, 2014), потому что в смежные годы, различные по условиям, ответ популяции хорошо характеризует норму реакции всех генотипов. При этом межгодовые различия необходимо отделять от тренда – тогда можно, по крайней мере, установить, достаточно ли пластических изменений для объяснения тренда (Charmantier, Gienapp, 2014). Однако всегда могут существовать и другие факторы, объясняющие тренд, например антропогенные. Когда найдена тесная корреляция между явлениями, особенно в нескольких независимых, пространственно разделенных популяциях, то это хорошо подкрепляет причинность. Экспериментальная манипуляция независимым фактором, конечно, была бы предпочтительнее, но такие эксперименты либо невозможны, либо их релевантность в отношении природной обстановки останется под вопросом (Merilä, Hendry, 2014).
Другая важнейшая трудность – поиск фактора среды, посредством которого потепление влияет на изменение сроков гнездования. Вопросы измерения явления, несмотря на призывы (Møller, Merilä, 2004; Gordo, 2007; Charmantier, Gienapp, 2014), часто оставались без внимания: какому изменению в среде соответствует тренд смещения, какова реакция на сезонные изменения без учета тренда, насколько велик сезонный градиент условий и отклонения от него, как измеряли температуру, как измеряли зависимую переменную, какой масштаб считали значимым – информация об этом зачастую просто не приводится авторами. Даже температура среды, усредненная за различные интервалы, приводила к принципиальным различиям в интерпретации фенотипического разнообразия реакций (Charmantier, Gienapp, 2014). Тем более это относится к влиянию таких масштабных явлений, как Североатлантические колебания (NAO), или использование многомесячной средней температуры при сравнении различных популяций и видов (Møller, Merilä, 2004). Использование слишком “тонкой” шкалы может не уловить нужный момент и также ограничивает возможность сравнения. Неудачный выбор независимой переменной всегда занижает оценку фенотипической пластичности (Charmantier, Gienapp, 2014).
Полевые наблюдения по срокам гнездования происходят главным образом из Западной Европы, меньше из Восточных США и Австралии (Pearce-Higgins, Green, 2014). Несмотря на разные материки, они в большинстве относятся к регионам со сглаженной сезонностью климата, с высокой плотностью народонаселения и представлены видами, заселяющими искусственные гнездовья. Неясно, насколько полученные здесь выводы, и без того противоречивые (Knudsen et al., 2011; Pearce-Higgins, Green, 2014), можно распространить на условия более континентального климата и меньшей антропогенной нагрузки.
Надеясь пролить свет на часть нерешенных проблем, мы приводим данные по срокам гнездования птиц, уникальные для обширного, слабо исследованного региона. Он не только удален на тысячи километров от других мест со сравнимыми данными, но и отличается от них малой населенностью, отсутствием антропогенной трансформации, выраженной континентальностью климата, а также набором видов, гнездящихся естественным образом и обладающих контрастными стратегиями и путями миграций.
Для решения поставленных задач применен следующий подход. Чтобы определить популяционный ответ на условия сезона, мы выделили популяционную среднюю дату первой попытки гнездования как зависимую переменную. В качестве независимого фактора использовали фенологический показатель, рассчитанный на основе суммы эффективных температур к ожидаемой дате гнездования. Многолетний тренд изменения фенологических условий к этой дате мы считали характеристикой потепления климата, а ежегодные отклонения от него – фенологическими отклонениями погодных условий сезона. Соответственно, многолетний тренд сроков гнездования характеризовал реакцию популяции на направленные изменения климата, а отклонения от него мы считали проявлением фенотипической пластичности в ответ на погодные условия сезона. Полученные оценки использовали для проверки предположения, что если многолетнее смещение дат гнездования объясняется не только фенотипической пластичностью, но и генетическим изменением фенологической реакции, то (1) многолетнее смещение гнездования должно быть больше, чем ожидаемый результат ежегодных отклонений; (2) в фенологически сходные годы, удаленные во времени, даты гнездования должны существенно различаться только под влиянием тренда; (3) ежегодная реакция на отклонение погоды должна иметь ограниченный диапазон и отставать от изменений среды при экстремальных отклонениях.
МЕТОДЫ
Материалы собраны на экологической станции Мирное (62°20′ с.ш., 89°00′ в.д.) с 1974 по 2016 год. Возраст гнезд определяли по наблюдаемым датам откладки яиц или возрасту птенцов с точностью до ±1 дня. Около 7% гнезд наблюдалось только в период насиживания; их возраст, определенный в интервале ±5 дней, по возможности уточняли по состоянию других гнезд в день находки. Всего датировано 6054 гнезда.
Зависимая переменная
Индивидуальное начало репродуктивного сезона выражается датой первой попытки гнездования, тогда как даты последующих попыток зависят от успешности первой. При непогоде самки могут задерживать откладку первого яйца даже при готовом гнезде, но откладка последующих яиц, как правило, идет с физиологически обусловленным околосуточным интервалом. Поэтому момент наибольшей зависимости популяции от сезонных изменений в среде должен приходиться на среднюю дату начала размножения – начала откладки при первой попытке гнездования. Уверенность наблюдателя в том, что найденное гнездо является первой попыткой гнездования для его хозяев, уменьшается в течение сезона из-за существенного числа повторных попыток и наличия вторых кладок у ряда видов. Даты гнездования имеют асимметричное, часто бимодальное распределение по сезону, так что и среднее, и медианное значение запаздывают по сравнению с истинной средней датой начала размножения популяции в различной степени у разных видов и в зависимости от величины выборки. Невозможность получить популяционную оценку этого показателя, важного для многих сравнительных исследований, создает проблему даже для большой выборки (Cornulier et al., 2009). Мы решали ее сравнением корреляции дат начала кладки с условиями сезона, постепенно сдвигая непараметрическую оценку даты от 10 до 90 процентилей. При достаточной выборке максимальная корреляция с погодой должна быть у такой оценки, которая в наибольшей степени учитывает истинные первые, а не повторные кладки.
Независимая переменная
У большинства птиц начало размножения определяется иерархией гормональных процессов, которые запускаются фотопериодической реакцией – реакцией на увеличение светового дня сверх некоторого порога, – после чего организм восприимчив к другим внешним сигналам, способным ускорить или задержать начало гнездования (Dawson, 2008). В умеренных широтах с достаточным увлажнением температурные показатели оказывают наибольшее влияние на ежегодную коррекцию даты начала размножения, хотя влияние других факторов также не исключается (Berthold, 1996; Dunn, Winkler, 2010; Pearce-Higgins, Green, 2014). Поэтому для конструирования независимой переменной мы использовали архив среднесуточных температур на метеостанции в 19 км к северу от места наблюдений (https://rp5.ru). Мы рассчитали погодные показатели по средней температуре за периоды от 5 до 30 дней накануне гнездования, а также ряд фенологических показателей, учитывающих сумму активных температур с начала года до заданной даты. Фенологию среды выражали отклонением (в днях) от многолетнего среднего значения: определяли, какой дате соответствует сумма температур, накопленная к данному сроку, и вычитали ее из календарной даты. Например, если к 20 мая накоплена сумма, характерная для 25 мая, то фенологический показатель равен –5 дням и означает, что к 20 мая весна идет с опережением на 5 дней. По мере разогревания земной поверхности весенние изменения охватывают все новые биологически значимые процессы, с более высоким стартовым порогом (Tuhkanen, 1980). Учитывая это, мы вывели единый усредненный фенологический показатель, в котором в качестве “активных” использованы суммы температур, превышающих 0, 5 и 10°C.
Механизм зависимости начала кладки от условий
Даже располагая полными сведениями о погодных условиях каждого дня и датах начала кладки в каждом гнезде за многие годы, мы не можем адекватно оценить зависимость между ними, пока не ответим на два вопроса, касающиеся механизма их связи в течение весны. Во-первых, надо определить, в какой момент погодные условия оказывают наибольшее влияние на начало размножения, – найти эффективную дату воздействия. Во-вторых, нужно выбрать реактивную часть популяции, которая наиболее закономерно реагирует на это влияние. В итоге мы должны отобрать для сравнения по два значения за каждый год: дату гнездования, которую выбирает реактивная часть популяции, и погодный (фенологический) показатель на эффективную дату.
Предположим, у нас есть выборка из 10 гнезд за каждый год по виду, для которого характерен один цикл размножения за сезон. Ранжируем гнезда по порядку появления кладок с 1-го по 10-е и определим для каждого номера межгодовую корреляцию с условиями сезона, измеренными для некоторой постоянной календарной даты вблизи среднего срока размножения. Первичный выбор этой даты не так важен, поскольку погодные условия соседних дней скоррелированы во времени, а фенологические условия скоррелированы еще сильнее. Теперь, найдя порядковый номер наиболее “реактивных” гнезд, мы вправе считать дату начала кладки в гнездах с этим номером лучшей оценкой средней даты начала размножения в популяции, так как предыдущие гнезда представлены более редкими индивидуальными отклонениями от оптимальной даты, а последующие, кроме того, могут оказаться повторными попытками. Далее, мы можем определить зависимость начала размножения от внешних условий в различные календарные даты, чтобы найти критический период с наибольшим влиянием.
Чтобы провести такой анализ на реальной выборке, мы отсортировали гнезда каждого вида по годам, ранжированным по фенологии весны, а в пределах года – по случайному числу. Полученную последовательность разбили на блоки по 10 (не меньше 9) гнезд так, что годы с большой выборкой разделились на случайные подвыборки. Годы, в которые найдено меньше 10 гнезд, объединяли с другими по сходству условий. Гнезда с началом кладки более чем через 20 дней после самого раннего гнезда в блоке удаляли из анализа как вероятные вторые или повторные кладки. Виды с единичными находками гнезд также исключили из анализа. По отобранным гнездам рассчитали среднюю дату начала кладки вида, ожидаемую при средней фенологии (с помощью GLM-анализа по видам и фенологии среды на дату откладки), а начало размножения в каждом гнезде выразили отклонением от средней видовой даты. Это позволило объединить данные по различным видам с выборкой меньше 100 гнезд в гильдии со сходной миграционной стратегией и обрабатывать их дальше как один вид. Затем, поскольку некоторые гнезда были исключены, процедуру разделения данных на блоки по 10 гнезд повторили. В каждом блоке гнезда упорядочили по дате откладки и присвоили им номера с 1-го по 10-й (в блоках по 9 гнезд один случайный номер считали пропущенным). В итоге получены 533 блока, представляющих 13 массовых видов и 4 сборных гильдии, объединившие еще 34 вида. Эти блоки использовали далее для установления связи между реактивным гнездом и эффективной датой.
Смещение сроков гнездования
Выборка по гнездам близка к нормальному распределению в отношении фенологии, но по времени она смещена в сторону последних лет. Поэтому мы отказались от взвешивания переменных в анализе, а использовали только точечные оценки сроков начала откладки и фенологии среды, по одной для каждого года. С помощью линейной регрессии сравнивали три ряда ежегодных данных: x – отклонение начала откладки от среднего срока, y – год наблюдения и z – отклонение фенологии среды от нормы в эффективную дату. Получали оценки трех коэффициентов регрессии: bzy – многолетний тренд изменения среды, bxy – многолетний тренд смещения сроков откладки, и bxz – ежегодную фенологическую реакцию как регрессию между остатками двух первых регрессий, т.е. между независимыми ежегодными отклонениями дат откладки и фенологии среды от их многолетних трендов.
Виды разделили на 4 группы по преобладающей миграционной стратегии и предполагаемым местам зимовки локальных гнездовых популяций (Hoyo et al., 2016). К резидентам отнесены 7 оседлых и кочующих видов, не покидающих континентальных районов Сибири. К ближним мигрантам отнесены 10 видов, зимующих в умеренном поясе Европы, Кавказа и Центральной Азии, а также овсянка-ремез (Emberiza rustica), проводящая зиму в Восточном Китае и Японии. Дальние мигранты, улетающие за пределы умеренного пояса, разделены на западных и восточных (14 и 16 видов соответственно) в зависимости от того, с какой стороны они облетают Тибет. Различия коэффициентов регрессии между группами оценивали с помощью ANOVA и LSD тестов.
Сравнение трендов за нейтральные и экстремальные годы
Если бы на большой выборке была возможность сравнить два удаленных года с одинаковой фенологией весны, то отсутствие различий в датах гнездования было бы лучшим доказательством того, что норма реакции на одни и те же условия остается неизменной, а все отклонения связаны лишь с пластической реакцией фенотипа на ежегодные фенологические отклонения. Если же, несмотря на равенство условий, будут обнаружены изменения фенотипа, то они связаны с генетическими изменениями под влиянием многолетнего изменения климата.
Мы попытались воспроизвести подобную ситуацию, разделив выборку на две примерно равные части: “нейтральные” годы с фенологическим отклонением среды в пределах ±5 дней и экстремальные годы с отклонением более чем на 5 дней от многолетнего среднего значения. Сравнение сроков начала размножения и погодных условий проводили с помощью парного t-теста для зависимых переменных.
Фенотипическая пластичность
Ежегодная реакция на фенологические отклонения рассмотрена более детально по данным последних 14 лет, когда выборка включала по 200–500 гнезд в год, а фенологические отклонения были велики. Гнезда по отдельным видам и годам были разбиты на блоки по 10 (см. выше) и для каждого блока определена ожидаемая дата откладки, а затем величина отклонения по срокам и по фенологическим условиям от ожидаемых значений (многолетние тренды обеих переменных предварительно учтены регрессией). Чтобы оценить нелинейность пластической реакции, регрессию проверяли на соответствие логистической кривой вида
РЕЗУЛЬТАТЫ
Влияние показателей погоды
По 533 блокам данных сравнили силу связи дат откладки в каждом i-м из 10 последовательно начатых гнезд с фенологией и температурой среды накануне одной и той же даты – медианы гнездования в блоке (рис. 1а). Связь начала кладки в любом i-м гнезде с фенологией была выше, чем с температурой за предыдущие 5 или 15 дней. Максимальная корреляция с фенологией приходилась на гнезда, где откладка начата раньше медианной даты. Сдвигая оценку показателей погоды на более раннее гнездо и повторяя расчеты, итеративно определили, что наибольший эффект (R2 = 0.573) достигался в день между началом кладки в 3-м и 4-м гнезде из каждого десятка. При этом начало откладки больше всего зависело от фенологии непосредственно в этот день, а зависимость от температуры за предыдущие 15 дней была существенно меньше (ΔAIC = 68). Связь с температурой за 5 дней в целом еще слабее: она повышалась в интервале за 10–5 дней до откладки, а затем непрерывно снижалась (рис. 1б). Соседние пятидневки вносили дополнительный вклад, определяя максимальное влияние 15-дневной средней перед днем откладки, с последующим снижением. В отличие от температуры, фенологические показатели оставались высоко скоррелированными со сроком начала гнездования в последующие недели.
Рис. 1.
Определение реактивной части популяции, эффективного воздействия и распределения истинных первых кладок. а – сила связи (R2) дат начала кладки в последовательных гнездах с погодными условиями достигает максимума на 3–4-м гнезде (стрелка; погодные индексы даны на день 35%-го квантиля начала кладок: P – фенология среды по сумме активных температур, T – средняя температура в последнем 15-дневном окне, t – то же в 5-дневном окне). б – связь дат 35%-го квантиля начала кладок при сезонном изменении тех же погодных индексов усиливается к дню откладки (стрелка). в – распределение числа начатых кладок по датам сезона представляет собой сумму истинных первых кладок (пунктир с центром на 35% квантиле) и повторных кладок (вне пунктира). Расчеты выполнены по 533 блокам из 10 случайно выбранных гнезд одного сезона, начатых не более чем через 20 дней после самого раннего.
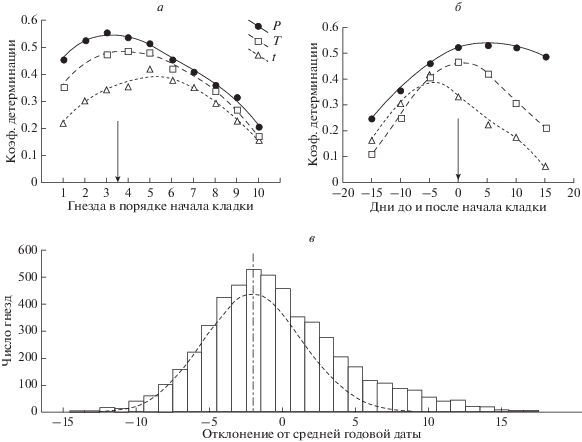
Распределение относительных дат гнездования в отобранных гнездах (см. методы) имело выраженный частотный пик на 35%-м квантиле (рис. 1в). Таким образом, максимальная реакция популяции на сезонные изменения связана с фенологией дня массового начала кладок. Если допустить, что индивидуальные отклонения распределены нормально (пунктир на рис. 1в), то на этот день приходится истинный пик первых кладок, а гнезда, начатые позже (правее пунктирной области), представляют собой повторные кладки, начатые вне связи с сезонными изменениями. В этом случае стандартное отклонение истинных дат начала размножения составляет около 71% от наблюдаемого. Совпадение максимального отклика, максимального влияния и максимальной частоты начала кладок в одной дате позволяют считать ее популяционной средней датой, а фенологическое состояние среды на этот момент – основным действующим фактором в дальнейшем анализе.
Смещение сроков гнездования
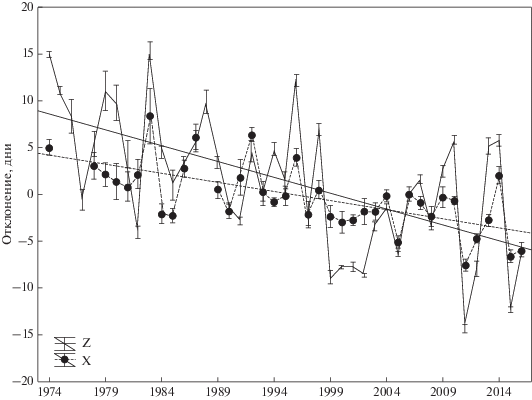
В результате потепления за период с 1974 по 2016 год средние даты фенологических событий весны сместились более чем на 12 дней, в среднем по 0.30 ± 0.02 дня в год. Сроки начала первых кладок стали за эти годы на 9 дней более ранними, смещаясь в среднем на 0.22 ± 0.02 дня ежегодно (рис. 2), что значимо меньше, чем изменение условий (t-тест для зависимых выборок: t16 = 2.62, p = 0.02). Среднегодовые отклонения от тренда (SD) составили 5.8 дней в среде обитания и 2.6 дней в сроках гнездования. Средние даты гнездования ежегодно следовали за погодой, отклоняясь по 0.32 ± 0.03 дней на каждый день фенологического отклонения в среде. Таким образом, ежегодные отклонения дат гнездования компенсировали фенологические особенности сезона менее чем на треть, в то время как многолетнее смещение сроков компенсировало изменение климата почти на ¾. Эти два фактора – тренд потепления и фенологические особенности года – вместе объясняли в среднем R2 = 0.43 ± 0.05 вариации сроков гнездования. Из них 0.27 ± 0.04 приходилось на ежегодные особенности фенологии. Разность, связанная с направленными изменениями во времени, в среднем для рассмотренных видов составила 0.16 ± 0.03 общей вариации (t-тест для зависимых выборок: t16 = 6.06, p < 0.001).
Рис. 2.
Многолетние тренды годовых отклонений фенологического состояния среды (Z) и дат начала кладки (X). Штрихами обозначены стандартные ошибки.
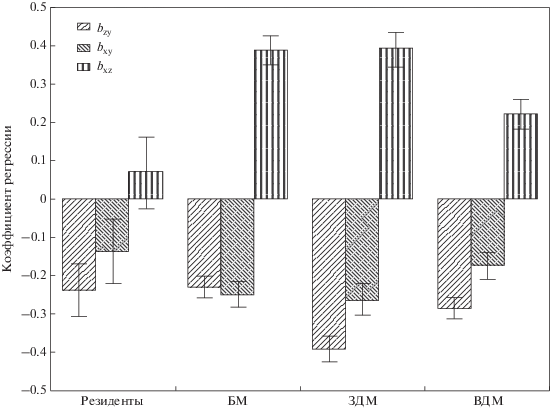
Отклонения начала кладки, обусловленные фенологией года (табл. 1), различались в зависимости от миграционной стратегии видов (ANOVA: F3,13 = 6.10, p = 0.008). У ближних и западных дальних мигрантов (рис. 3) они были существенно больше, чем у восточных дальних мигрантов и резидентов (LSD-тест, p < 0.05 для каждой пары). Многолетнее смещение начала кладки в группах видов с различными миграционными стратегиями было сходным (ANOVA: F3,13 = 1.50, p = 0.26). Однако многолетнее смещение фенологии среды различалось между группами (ANOVA: F3,13 = = 5.42, p = 0.01) в силу различия сроков гнездования (ANOVA: F3,13 = 17.75, p < 0.001). Опережение гнездования дальних мигрантов, как восточных, так и западных, отставало от многолетнего смещения условий среды (t-тест для зависимых выборок: t5 = 3.69, p = 0.01 и t3 = 3.78, p = 0.03 соответственно), тогда как ближние мигранты смещали гнездование параллельно с условиями (t-тест для зависимых выборок: t5 = 0.22, p = 0.83). Это соотношение между мигрантами по реакции на изменение среды сохранилось также при сравнении всех 27 видов с выборкой более 25 гнезд (t-тест для зависимых выборок: t17 = 2.73, p = 0.01 для дальних и t6 = 0.82, p = 0.45 для ближних мигрантов).
Таблица 1.
Влияние фенологии среды на сроки начала размножения птиц
| Виды или гильдии | Гнезда | Годы | bzy | bxy | R2 | bxz | $R_{{xz}}^{2}$ |
|---|---|---|---|---|---|---|---|
| Резиденты | |||||||
| 6 видов | 118 | 37 | –0.23 ± 0.10* | –0.14 ± 0.06* | 0.10 | 0.08 ± 0.09 | 0.01 |
| Ближние мигранты | |||||||
| Turdus pilaris | 1136 | 32 | –0.24 ± 0.11* | –0.28 ± 0.08*** | 0.50 | 0.46 ± 0.10*** | 0.35 |
| Turdus iliacus | 693 | 37 | –0.28 ± 0.10** | –0.20 ± 0.06** | 0.37 | 0.32 ± 0.10** | 0.21 |
| Turdus atrogularis | 280 | 37 | –0.29 ± 0.10** | –0.10 ± 0.06 | 0.20 | 0.28 ± 0.10** | 0.15 |
| Emberiza schoeniclus | 109 | 24 | –0.25 ± 0.16 | –0.21 ± 0.10* | 0.58 | 0.57 ± 0.12*** | 0.52 |
| Fringilla montifringilla | 91 | 25 | –0.14 ± 0.17 | –0.36 ± 0.11** | 0.38 | 0.45 ± 0.11*** | 0.25 |
| 5 других видов | 155 | 29 | –0.21 ± 0.13 | –0.33 ± 0.09** | 0.42 | 0.32 ± 0.11** | 0.19 |
| Западные дальние мигранты | |||||||
| Phylloscopus collybita | 214 | 28 | –0.42 ± 0.13** | –0.18 ± 0.09* | 0.71 | 0.46 ± 0.12*** | 0.64 |
| Sylvia curruca | 178 | 26 | –0.33 ± 0.16 | –0.24 ± 0.10* | 0.61 | 0.53 ± 0.11*** | 0.54 |
| Acrocephalus dumetorum | 124 | 27 | –0.51 ± 0.15*** | –0.41 ± 0.10*** | 0.55 | 0.27 ± 0.12* | 0.20 |
| 11 других видов | 355 | 39 | –0.33 ± 0.09*** | –0.22 ± 0.06*** | 0.59 | 0.32 ± 0.10** | 0.40 |
| Восточные дальние мигранты | |||||||
| Zoothera sibirica | 673 | 37 | –0.25 ± 0.10** | –0.21 ± 0.06** | 0.55 | 0.17 ± 0.11 | 0.15 |
| Phylloscopus borealis | 367 | 26 | –0.36 ± 0.15* | –0.25 ± 0.10* | 0.62 | 0.27 ± 0.12* | 0.37 |
| Phylloscopus inornatus | 270 | 29 | –0.20 ± 0.14 | –0.15 ± 0.09 | 0.27 | 0.29 ± 0.12* | 0.19 |
| Luscinia calliope | 159 | 31 | –0.30 ± 0.12* | –0.17 ± 0.08* | 0.27 | 0.22 ± 0.12 | 0.11 |
| Cuculus saturatus | 115 | 23 | –0.35 ± 0.19 | –0.09 ± 0.13 | 0.08 | 0.14 ± 0.13 | 0.06 |
| 11 других видов | 228 | 36 | –0.33 ± 0.10** | –0.17 ± 0.07** | 0.49 | 0.27 ± 0.11* | 0.28 |
Примечание. Коэффициенты регрессии отклонений (со стандартной ошибкой): bzy – фенологии среды по времени (дней за год), bxy – эффективной даты откладки по времени (дней за год), bxz – остаточных отклонений дат по остаточным отклонениям фенологии (дней на день); полнота объяснения вариации сроков: R2 – в целом, $R_{{xz}}^{2}$ – годовых отклонений. Годы обозначают многолетний интервал (от 2016 года назад), соответствующий выборке с учетом недостатка данных за отдельные годы. Уровни значимости: * p < 0.05, ** p < 0.01, *** p < 0.001.
Рис. 3.
Многолетнее смещение фенологии среды (bzy), дат откладки (bxy) и годовые отклонения дат откладки (bxz) у видов с различной миграционной стратегией. Средние значения и стандартные ошибки даны в соответствующих единицах. БМ – ближние мигранты, ЗДМ и ВДМ – западные и восточные дальние мигранты.
Смещение в нормальные и экстремальные годы
В годы, когда фенологическое отклонение весны не превышало ±5 дней от многолетнего среднего течения весны, тренд потепления отсутствовал (bzy = –0.02 ± 0.02 дня в год, p = 0.42), а даты гнездования смещались в среднем на –0.12 ± 0.03 дня в год (t-тест для зависимых выборок: t16 = 3.39, p = 0.004), т.е. смещение продолжалось независимо от пластической реакции на ежегодные отклонения. Вместе с тем в выборке, содержащей только экстремальные годы (с отклонениями фенологии больше чем на 5 дней в любую сторону и трендом –0.51 ± 0.18), многолетнее смещение сроков гнездования достигало –0.29 ± 0.12, хотя существенно отставало от климатических изменений в среде (t-тест для зависимых выборок: t16 = 5.62, p < 0.001). Таким образом, в обоих случаях смещение существенно отличалось от прямого фенотипического ответа на условия непосредственно в год наблюдений и наследовало влияние условий в предыдущие годы.
Фенотипическая пластичность
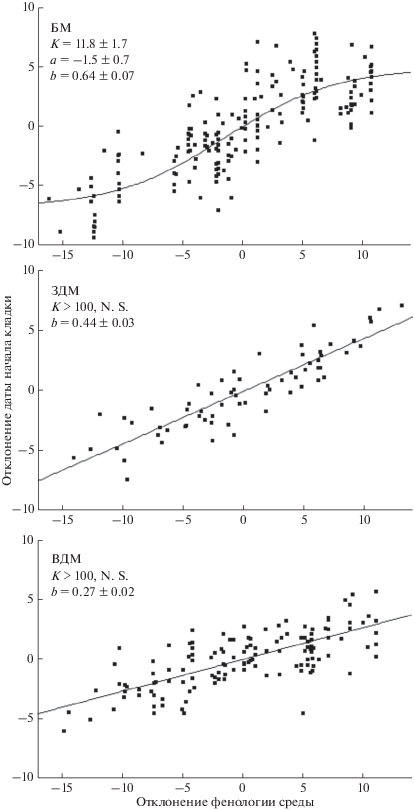
Ежегодная реакция на фенологические отклонения от тренда рассмотрена более детально по данным последних 14 лет. Средние даты откладки, вычисленные для 427 блоков по 10 гнезд (см. методы), разделили на три группы по миграционной стратегии (без резидентов) и сравнили с фенологией весны после центрирования и устранения тренда обеих переменных (рис. 4). Реакция трех групп мигрантов различалась. Ближние мигранты показали наиболее сильную фенотипическую реакцию (b: t207 = 8.27, p < 0.001), которая, однако, ослабевала при экстремальных отклонениях, обозначая границы нормы реакции. Ее диапазон составлял около 12 дней (K: t207 = 6.43, p < 0.001) и был смещен на 1.5 дня в сторону ранних сроков (a: t207 = 2.25, p = 0.03), так что опережение гнездования при ранней весне тормозилось меньше, чем запаздывание при поздней весне. Фенотипическая реакция западных дальних мигрантов имела меньший наклон регрессии, а восточных мигрантов – еще более пологий, вероятно, из-за менее выраженного тренда в среде; 95%-е доверительные интервалы наклона (b) трех групп не пересекались. Границы допустимого диапазона (K) у дальних мигрантов не определены или не достигались из-за слабого наклона.
Рис. 4.
Смещение дат гнездования в зависимости от ежегодного фенологического смещения в среде (после устранения видовых и многолетних различий) и их аппроксимация логистической функцией. K – диапазон фенотипической реакции (дни между верхним и нижним пределом), a – смещение диапазона по вертикали, b – коэффициент регрессии в точке перегиба (±SE). БМ – ближние мигранты, ЗДМ и ВДМ – западные и восточные дальние мигранты. Каждая точка соответствует дате между началом кладки в 3-м и 4-м гнезде в блоке из 10 гнезд.
Нелинейная модель реакции позволила раздельно оценить наклон регрессии (b) при нормальных и экстремальных фенологических отклонениях. Наклоны регрессии в области нормальной фенологии, полученные за последние 14 лет, оказались выше средних (ср. рис. 4 и 3) из-за большой амплитуды ежегодных изменений и более репрезентативной оценки сроков гнездования в последние годы.
ОБСУЖДЕНИЕ
Выбор переменных
В аналитических обзорах не раз отмечалось, что при растущем потоке данных о влиянии потепления на годовые циклы птиц разнородность, неполнота информации и отсутствие общего унифицированного подхода препятствует их объединению для понимания общих закономерностей (Møller, Merilä, 2004; Gordo, 2007; Lehikoinen, Sparks, 2010; Knudsen et al., 2011; Charmantier, Gienapp, 2014). Мы применили несколько новых простых элементов анализа, которые позволили приблизить оценки переменных к тем значениям, которые вступают в прямое взаимодействие в природе.
Чтобы установить зависимость между погодой и средней датой начала гнездования, мы допускали, что эта индивидуальная черта фенотипа нормально распределена в популяции. Итеративно мы установили одновременно дату наибольшего фенологического влияния на популяцию и среднюю дату истинно первых попыток гнездования. Возможно, этот подход будет полезен также для разделения первых и повторных попыток гнездования в популяционных исследованиях без тотального мечения и постоянного слежения (Cornulier et al., 2009), поскольку только первая попытка особи зависит от фенологии, в отличие от всех последующих.
Влияние температурных показателей
Хорошо известно, что весенние биологические процессы начинают развитие не раньше, чем условия достигнут определенного порога (Tuhkanen, 1980). Дальнейшее развитие может продолжаться под управлением других факторов или даже независимо от условий, путем самоорганизации. Вместе с тем среди исследований фенологии птиц известно немного примеров (Saino et al., 2011), когда изучали зависимость подобного от подобного – от фенологии внешних условий. Такой подход имеет очевидные преимущества, потому что птицы, во-первых, обладают высокой толерантностью к погодным изменениям и больше зависят не от физических, а от биотических условий, и во-вторых, сами склонны к пороговым реакциям. Продолжая принцип, мы выражали фенологию среды в подобных единицах – в днях отставания или опережения календаря, который птицы воспринимают благодаря системе фотопериодического контроля (Gwinner, 1996). Мы также полагали, что птицы начинают “отсчет времени” не по фенологическому сигналу как таковому, а используют его в период, определенный фотопериодической реакцией для внесения поправки на внешние условия (Dawson, 2008).
Погода как предиктор начала гнездования сильно уступает фенологическому показателю в любой предшествующий период весны. При усреднении погоды в более широком окне оценка ее влияния на дату гнездования возрастает, указывая на значимость других периодов. Однако эффективность погодного показателя остается низкой, потому что учитывает лишь те “волны тепла”, которые поддерживают развитие уже начатых весенних процессов. В противоположность ему фенологический показатель отражает количество биологически значимых процессов, перешедших из спящего режима в активный.
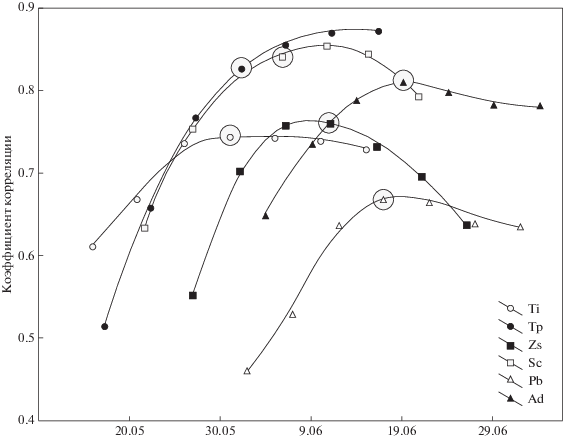
Примечательна высокая корреляция начала гнездования с фенологией среды не только в предыдущий, но и в последующий период благодаря автокорреляции во времени (рис. 1б). Следовательно, фенологические особенности года, установившиеся в начале гнездования, далее мало изменяются, несмотря на колебания температуры. Именно это позволяет предсказывать будущие условия, от которых зависит успех гнездования. Успешность размножения – ключевой детерминант приспособленности, поэтому способность оценивать оптимальные сроки для размножения должна строго поддерживаться отбором. Оптимальная дата для начала размножения наступает тогда, когда корреляция фенологии с развитием определенного вида ресурсов выходит на плато: тогда появляется возможность сделать надежный дальний прогноз динамики значимых ресурсов. По-видимому, годовой цикл каждого вида связан с той фазой весны, с которой начинается автономное развитие будущих жертв. Единый фенологический показатель изменяется по фазам весны и поэтому может служить предиктором для различных видов (рис. 5). Их связь с фенологией устанавливается в разные сроки, но имеет сходную динамику относительно даты начала размножения, которая приурочена к точке перегиба.
Рис. 5.
Корреляция сроков гнездования отдельных видов с фенологией среды в течение 15 дней до и 15 дней после эффективной даты начала гнездования (выделена). Виды: Ti – Turdus iliacus, Tp – Turdus pilaris, Zs – Zoothera sibirica, Sc – Sylvia curruca, Pb – Phylloscopus borealis, Ad – Acrocephalus dumetorum.
Фенотипическая пластичность
Исследование фенотипической пластичности подтвердило, что норма реакции на экстремальные фенологические отклонения не беспредельна, по крайней мере, у некоторых ближних мигрантов. Следовательно, в отдельные годы фенотипическая пластичность не обеспечивает адаптивный ответ, что может быть одной из причин отбора и последующих микроэволюционных изменений. Ближние мигранты проявляют самую сильную реакцию на фенологические особенности весны: они компенсируют 64% ежегодных отклонений, тогда как дальние – только 27–44%. Кроме того, пределы реакции ближних мигрантов смещены в сторону ранней весны: они более готовы продлить гнездовой сезон в аномально теплых условиях, чем сократить его при аномально поздней весне, и при задержке более чем на 5 дней начинают откладку независимо от условий. Такое поведение можно объяснить значительной селективной выгодой от продолжительного (повторного) гнездования в течение сезона, начало которого ограничено фенологией среды и потому приурочено к первой весенней возможности. В противоположность им, дальние мигранты компенсируют фенологический сдвиг весны лишь в малой степени, но всегда пропорционально отклонениям в среде. По-видимому, оптимизация сроков их гнездования направлена не на продление сезона размножения, а на максимальное совпадение потребностей единственного выводка с летним пиком изобилия (Visser et al., 2006, и др.).
Соотношение фенотипической пластичности и генетического сдвига
В наших данных внутригодовое стандартное отклонение индивидуальных сроков истинного начала гнездования в среднем составляет 3.4 дня (от 2.5 до 4.2 у разных видов), а многолетнее смещение за 42 года наблюдений – 9.1 дней, т.е. в среднем около 2.7 стандартных отклонений. Ежегодное направленное смещение сроков на –0.22 дня при смене поколений за 1.5 года дает –0.33 дня, или около –0.1 холдейна (10% стандартного отклонения признака в популяции). Это значение выше медианы в обзоре 224 известных случаев микроэволюции различных признаков позвоночных (Hendry, Kinnison, 1999), но вдвое уступает среднему смещению дат гнездования в 20 изученных популяциях птиц (Gienapp et al., 2008). Приняв наследование дат откладки примерно за 0.30 (Sheldon et al., 2003; Gienapp et al., 2008), получим дифференциал отбора –1.1 дня за генерацию, для чего необходима интенсивность отбора 0.32 (32% стандартного отклонения генотипа). Это вдвое больше медианного значения 0.16 из более чем 2500 различных оценок (Kingsolver et al., 2001), но значительно ниже, чем приводит Джинапп с соавт. для дат откладки (Gienapp et al., 2008). По их оценке, расчетная интенсивность отбора должна быть около 67% стандартного отклонения генотипа за поколение, что превосходит теоретическую возможность компенсировать селективную смертность даже в крупной популяции. Поэтому они склонны объяснять высокую скорость смещения дат гнездования исключительно пластичностью этого признака. Мы считаем свою оценку более реалистичной из-за (1) эффективного использования фенологии среды как фактора, отражающего прямое воздействие климата, (2) корректного расчета распределения дат начала кладки в популяции, (3) длительных наблюдений, включающих периоды ослабления тренда, и (4) естественной среды обитания без искусственных гнездовий. Наши данные показывают значимое, хотя и более умеренное многолетнее смещение дат гнездования, происходящее наряду с ежегодными колебаниями, но оцененное независимо от них. Направленное смещение признака за четыре десятилетия потепления далеко превзошло норму пластической реакции, что невозможно без эволюционных изменений. Риск снижения численности при интенсивном отборе (Gienapp et al., 2007; Charmantier, Gienapp, 2014) в северных широтах, по-видимому, понижен. Устойчивое потепление в регионе увеличивает продуктивность экосистем, ведет к росту и расселению большинства популяций (наши данные), благодаря чему они могут поддерживать интенсивный отбор без существенного риска.
ЗАКЛЮЧЕНИЕ
Наше исследование добавляет ряд фактов в пользу реальности эволюционных изменений, вызванных потеплением: (1) существенная часть объясненной вариации сроков гнездования – более трети – не соответствует ежегодным фенологическим изменениям в среде и обусловлена вкладом многолетнего тренда потепления; (2) даты гнездования со временем существенно смещаются на ранние сроки даже в годы со сходной фенологией весны; (3) у некоторых видов норма реакции на весеннюю фенологию достигает предела: в экстремальные годы даты откладки отклоняются от средних сроков меньше, чем ожидается на основе регрессии в обычные годы. Следовательно, растущее смещение фенологии среды не может быть компенсировано в пределах старой нормы реакции.
Фенотипическая пластичность в отношении сроков гнездования показала любопытные различия среди мигрантов. Величина реакции на особенности года уменьшается с дальностью миграции (рис. 3), но устойчивость этой зависимости (коэффициент детерминации), по-видимому, усиливается (табл. 1, рис. 4). Ближние мигранты стремятся начать гнездование как можно раньше. Они ориентируются по надежным фенологическим признакам и выбирают наиболее раннюю дату: не случайно их норма реакции сдвинута в сторону ранних сроков. Но в критически ранние сроки они часто сталкиваются с кратковременными глубокими похолоданиями, вызывающими задержку несмотря на благоприятное развитие весны. Их решение, таким образом, зависит от фенологии весны в целом и от погоды непосредственно перед началом кладки, потому что именно они могут быть факторами отбора. Дальние мигранты чутко реагируют на фенологию малыми смещениями. Их решение больше зависит от календарной даты (по длине светового дня) и фенологии весны как сигналов, позволяющих предсказать будущие факторы отбора в период выкармливания. Текущие погодные условия сказываются меньше, потому что эти виды начинают гнездование в условиях, некритических по погоде.
Различие между восточными и западными дальними мигрантами, по-видимому, объясняется влиянием североатлантических осцилляций, которое западные мигранты ощущают как на пути пролета, так и на месте гнездования. Зимовка и пролет восточных мигрантов проходит в восточном секторе материка, где погода формируется под воздействием тихоокеанских барических центров и не коррелирует с погодой на месте гнездования. Региональные различия в темпах потепления также могут оказывать влияние.
Зависимость от метеорологических факторов многогранна, однако определяющая роль в отношении сроков гнездования принадлежит фенологии среды. Она выступает как совокупность признаков, характеризующих степень развития весенних процессов. Многие из них, обладая определенной автономностью, хранят связь с прошлой погодой и определяют будущую продуктивность местообитания. Именно фенология среды обитания служит надежным каналом для передачи информации во времени. Поэтому сроки гнездования всех рассмотренных видов связаны с фенологическими показателями (такими как сумма накопленных температур) значительно более тесной корреляцией, чем с погодой за отдельный период. Динамика реакции на эти факторы (рис. 1б, 5) раскрывает механизм их влияния. Температура в различные периоды весны играет роль пускового механизма процессов, формирующих продуктивность. Различные компоненты продуктивности (например, разные виды беспозвоночных) частично компенсируют друг друга как ресурс для выкармливания птенцов. Фенологические признаки аккумулируют обобщенную информацию о будущих ресурсах и как сигнальный фактор влияют на сроки гнездования более непосредственно, чем температура. Правильность прогноза контролируется отбором по результатам размножения. Корреляция фенологии с датой откладки высока перед началом массового гнездования, а потом сохраняется на высоком уровне в течение всего сезона размножения за счет автокорреляции, обусловленной саморазвитием продуктивных процессов после старта. Это означает, что наиболее полный и дальний прогноз развития ресурсов можно сделать именно в день начала гнездования, который и закрепляется отбором как оптимальный. Температура и погода сами по себе также имеют значение, однако они, во-первых, принципиальны только для отдельных рано гнездящихся видов и часто могут компенсироваться обилием корма. Во-вторых, роль фенологии перевешивает также и для этих видов. В-третьих, фенологические маркеры включают значимое воздействие температуры и отсеивают незначимое.
Мы использовали простейший универсальный фенологический показатель. Однако каждый вид более чутко реагирует на свой фенологический маркер: например, рано прилетающие виды – на сумму положительных температур, а поздно прилетающие – на сумму температур выше +10°С. Межгодовые колебания первой суммы стабилизируются к середине весны, а второй – в начале лета, что и определяет различие дат гнездования между видами. Важна также глубина снега в начале весны, так как часть тепла (в Сибири – существенная) в этот период уходит не на продуктивные процессы, а на снеготаяние. Более точная оценка фенологии – задача для будущих исследований.
Исследование выполнено при поддержке гранта РФФИ № 18-04-00269а.
Список литературы
Berthold P., 1996. Control of Bird Migration. L.: Chapman & Hall. 355 p.
Both C., Artemyev A.V., Blaauw B., Cowie R.J., Enemar A. et al., 2004. Large-scale geographical variation confirms that climate change causes birds to lay earlier // Proc. R. Soc. Lond. B. V. 271. № 1549. P. 1657–1662.
Charmantier A., Gienapp P., 2014. Climate change and timing of avian breeding and migration: Evolutionary versus plastic changes // Evol. Appl. V. 7. № 1. P. 15–28.
Charmantier A., McCleery R.H., Cole L.R., Perrins C., Kruuk L.E., Sheldon B.C., 2008. Adaptive phenotypic plasticity in response to climate change in a wild bird population // Science. V. 320. № 5877. P. 800–803.
Cornulier T., Elston D.A., Arcese P., Benton T.G., Douglas D.J. et al., 2009. Estimating the annual number of breeding attempts from breeding dates using mixture models // Ecol. Lett. V. 12. № 11. P 1184–1193.
Crick H., Sparks T., 1999. Climate change related to egg-laying trends // Nature. V. 399. № 6. P. 423.
Davis M.B., Shaw R.G., 2001. Range shifts and adaptive responses to quaternary climate change // Science. V. 292. № 5517. P. 673–679.
Dawson A., 2008. Control of the annual cycle in birds: Endocrine constraints and plasticity in response to ecological variability // Phil. Trans. R. Soc. Lond. B. V. 363. № 1497. P. 1621–1633.
Dunn P.O., Møller A.P., 2014. Changes in breeding phenology and population size of birds // J. Anim. Ecol. V. 83. № 3. P. 729–739.
Dunn P.O., Winkler D.W., 2010. Effects of climate change on timing of breeding and reproductive success in birds // Effects of Climate Change on Birds / Eds Møller A.P., Fiedler W., Berthold P. Oxford: Oxford Univ. Press. P. 113–128.
Gienapp P., Leimu R., Merilä J., 2007. Responses to climate change in avian migration time – microevolution versus phenotypic plasticity // Clim. Res. V. 35. № 1–2. P. 35–25.
Gienapp P., Teplitsky C., Alho J.S., Mills J.A., Merilä J., 2008. Climate change and evolution: Disentangling environmental and genetic responses // Mol. Ecol. V. 17. № 1. P. 167–178.
Gordo O., 2007. Why are bird migration dates shifting? A review of weather and climate effects on avian migratory phenology // Clim. Res. V. 35. № 1–2. P. 37–58.
Gwinner E., 1996. Circannual clocks in avian reproduction and migration // Ibis. V. 138. № 1. P. 47–63.
Halupka L., Dyrcz A., Borowiec M., 2008. Climate change affects breeding of reed warblers Acrocephalus scirpaceus // J. Avian Biol. V. 39. № 1. P. 95–100.
Hendry A.P., Kinnison M.T., 1999. The pace of modern life: Measuring rates of contemporary microevolution // Evolution. V. 53. № 6. P. 1637–1653.
Hoyo J., del, Elliott A., Sargatal J., Christie D.A., Juana E., de (eds.), 2016. Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. https://www.hbw.com/.
Jonzen N., Linden A., Ergon T., Knudsen E., Vik J.O. et al., 2006. Rapid advance of spring arrival dates in long-distance migratory birds // Science. V. 312. № 5782. P. 1959–1961.
Kingsolver J.G., Hoekstra H.E., Hoekstra J.M., Berrigan D., Vignieri S.N. et al., 2001. The strength of phenotypic selection in natural populations // Am. Nat. V. 157. № 3. P. 245–261.
Knudsen E., Lindén A., Both C., Jonzén N., Pulido F. et al., 2011. Challenging claims in the study of migratory birds and climate change // Biol. Rev. V. 86. № 4. P. 928–946.
Lehikoinen E., Sparks T.H., 2010. Changes in migration // Effects of Climate Change on Birds / Eds Møller A.P., Fiedler W., Berthold P. Oxford: Oxford Univ. Press. P. 89–112.
Lehikoinen E., Sparks T.H., Zalakevicius M., 2004. Arrival and departure dates // Adv. Ecol. Res. V. 35. № 1. P. 1–31.
Merilä J., Hendry A.P., 2014. Climate change, adaptation, and phenotypic plasticity: The problem and the evidence // Evol. Appl. V. 7. № 1. P. 1–14.
Møller A.P., Merilä J., 2004. Analysis and interpretation of long-term studies investigating responses to climate change // Adv. Ecol. Res. V. 35. № 1. P. 111–130.
Parmesan C., Yohe G., 2003. A globally coherent fingerprint of climate change impacts across natural systems // Nature. V. 421. № 1. P. 37–40.
Pearce-Higgins J.W., Green R.E., 2014. Birds and Climate Change: Impacts and Conservation Responses. Cambridge: Cambridge Univ. Press. 467 p.
Saino N., Ambrosini R., Rubolini D., Hardenberg J., von, Provenzale A. et al., 2011. Climate warming, ecological mismatch at arrival and population decline in migratory birds // Proc. R. Soc. B. V. 278. № 1707. P. 835–842.
Sheldon B.C., Kruuk L.E.B., Merilä J., 2003. Natural selection and inheritance of breeding time and clutch size in the collared flycatcher // Evolution. V. 57. № 2. P. 406–420.
Tuhkanen S., 1980. Climatic parameters and indices in plant geography // Acta Phytogeographica Suecica. V. 67. № 8. P. 1–110.
Usui T., Butchart S.H.M., Phillimore A.B., 2017. Temporal shifts and temperature sensitivity of avian spring migratory phenology: A phylogenetic meta-analysis // J. Anim. Ecol. V. 86. № 2. P. 250–261.
Visser M.E., Holleman L.J.M., Gienapp P., 2006. Shifts in caterpillar biomass phenology due to climate change and its impact on the breeding biology of an insectivorous bird // Oecologia. V. 147. № 1. P. 164–172.
Visser M.E., Caro S.P., Oers K., van, Schaper S.V., Helm B., 2010. Phenology, seasonal timing and circannual rhythms: Towards a unified framework // Phil. Trans. R. Soc. Lond. B. V. 365. № 1555. P. 3113–3127.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


