Журнал общей биологии, 2020, T. 81, № 4, стр. 272-284
Половая структура и поло-специфическая выживаемость в популяциях птиц (обзор)
В. А. Паевский *
Зоологический институт РАН
199034 Санкт-Петербург, Университетская наб., 1, Россия
* E-mail: payevsky@yandex.ru
Поступила в редакцию 25.03.2020
После доработки 06.04.2020
Принята к публикации 18.04.2020
Аннотация
Анализ данных по соотношению полов у взрослых птиц 196 видов показал, что из 308 достоверных оценок большинство смещено в сторону самцов. Первичное соотношение полов (при оплодотворении и в кладках яиц) равное, но в процессе дальнейшей жизни нарушается под влиянием поло-специфичной смертности. Стойкое превышение доли самцов над долей самок сохраняется во всех возрастах, начиная с приобретения самостоятельности. Установлена более высокая выживаемость самцов по сравнению с самками, однако во многих популяциях различия не достигают уровня достоверности. Наиболее логичное объяснение разнонаправленной смертности у птиц и млекопитающих (повышенная у самок птиц и у самцов млекопитающих) – фактор детерминации пола. У тех и других смертность выше у гетерогаметного пола, но у птиц гетерогаметны самки, а у млекопитающих – самцы. Первый этап формирования соотношения полов с преобладанием самцов начинается у птиц в очень молодом возрасте, вскоре после покидания гнезда выросшими птенцами. Более выраженная натальная дисперсия самок в сочетании с их гетерогаметностью может сопровождаться большей гибелью по сравнению с самцами.
Количественное соотношение самцов и самок у взрослых животных в природных популяциях – фундаментальная концепция в популяционной биологии, ключевой фактор полового отбора. Половая структура, а также операционное соотношение полов (т.е. доля сексуально активных самцов) – одни из главных показателей размножающихся популяций. Воздействие половой структуры на процессы рождаемости, выживаемости и дисперсии (разлёта по территории обитания) занимает важное место в исследованиях регуляции численности животных и сохранения биологического разнообразия. Соотношение полов весьма вариабельно, смещение его в сторону количественного преобладания самцов или самок широко распространено и имеет существенные последствия для стратегий брачного поведения и популяционной динамики. Количественное соотношение особей разного пола во время рождения и во взрослом состоянии рассматривается популяционными биологами и демографами в качестве катализатора изменений численности и социального поведения. Понимание причин и последствий вариации в соотношении полов необходимо, поскольку половая структура не только определяет эволюцию половых ролей и брачные системы, а также регуляцию численности животных, но в конечном счете влияет на всю приспособленность популяций к условиям существования (Emlen, Oring, 1977; Мейнард-Смит, 1981; Clutton-Brock, Vincent, 1991; Székely et al., 2000; Donald, 2007; Kokko, Jennions, 2008; Pipoly et al., 2015). Несмотря на важность изучения половой структуры животных, считается, что ее изменения и вариации в популяциях разных таксонов остаются мало исследованными и неясными (Hardy, 2002; Donald, 2007; Liker et al., 2013; Székely et al., 2014; Carmona-Isunza et al., 2017; Eberhart-Phillips et al., 2017).
Основная цель данного краткого обзора состоит в формулировании основных выводов, следующих из опубликованных результатов исследований половой структуры популяций птиц и различий в выживаемости самцов и самок. Внимание уделено следующим темам: 1) эмпирические данные о соотношении полов в популяциях птиц; 2) уровень смертности птиц разного пола и причины их различной выживаемости; 3) теории полового распределения (регуляция соотношения полов потомства родителями); 4) особенности периода ювенильной смертности; 5) соответствие регистрируемой половой структуры популяций половым различиям выживаемости птиц.
ПОЛОВАЯ СТРУКТУРА ПОПУЛЯЦИЙ ПТИЦ И ЕЕ ИЗМЕНЧИВОСТЬ
Вопрос о соотношении полов у животных обрел свою научную значимость начиная с 1930-х годов, хотя еще Дарвин (Darwin, 1871) писал о том, что в популяциях есть отклонения от равного количества самцов и самок, что должно учитываться при обсуждении полового отбора. Согласно постулатам Фишера (Fisher, 1930), с теоретической точки зрения при одинаковом родительском вкладе обоих полов соотношение во время оплодотворения определяется сочетанием половых хромосом и равно 1 : 1, и это сбалансированное соотношение адаптивно, поскольку обеспечивает стратегию эволюционной стабильности. Однако впоследствии стало очевидным, что среди взрослых особей количественное смещение в сторону самцов или самок в популяциях – обычная ситуация в животном мире (Mayr, 1939; Breitwisch, 1989; Паевский, 1993; Donald, 2007; Kokko, Jennions, 2008; Székely et al., 2014). Майр (Mayr, 1939) был первым, кто заложил основы изучения соотношения полов в классе птиц. По Майру, у птиц соотношение самцов и самок при оплодотворении и в кладках яиц должно трактоваться как первичное, среди птенцов в гнезде и молодых – как вторичное, и у взрослых – как третичное. Вторичное и третичное соотношения полов предполагаются зависимыми от поло-специфичной смертности, контролируемой естественным отбором.
Половая структура взрослых размножающихся особей весьма разнообразна в животном мире: от популяций с весьма большой долей самцов до популяций, состоящих только из взрослых самок (Donald, 2007; Székely et al., 2014). При этом млекопитающие, включая человека, обычно характеризуются количественным преобладанием женского пола, а птицы – мужского, что было в ряде случаев известно уже давно, а для большинства видов и популяций птиц выяснено только в последние два десятилетия. Птицы наиболее удобны для таких исследований, поскольку они весьма разнообразны по брачным системам и родительскому поведению и дают возможность изучать их выживаемость путем индивидуального мечения – кольцевания.
Соотношение количества самцов и самок в природных популяциях птиц, обычно выражаемое как доля самцов, многократно изучалось на разных видах уже в течение 90 лет (Ларионов, 1927; Mayr, 1939; McIlhenny, 1940; Lack, 1954; Паевский, 1969, 1993, 2008; Charnov, 1982; Clutton-Brock, 1986; Чемякин, 1988; Breitwisch, 1989; Родимцев, 1997; Sheldon, 1998; Kölliker et al., 1999; Sokolov, Vysotsky, 2000; Donald, 2007; Eiby et al., 2008; Lehikoinen et al., 2008; Payevsky, 2009a, b; Veran, Beissinger, 2009; Székely et al., 2014; Pipoly et al., 2015; Morrison et al., 2016; Eberhart-Phillips et al., 2017; Ramula et al., 2018, и др.). Из обзорных публикаций наиболее тщательным и обстоятельным можно назвать обзор Дональда (Donald, 2007). Наибольшее количество эмпирических данных по соотношению полов опубликовано по взрослым птицам в сезон размножения, молодым особям после окончания сезона гнездования и по птенцам в гнездах после вылупления из яиц.
Среди взрослых размножающихся птиц в подавляющем большинстве случаев исследователи констатируют численное преобладание самцов, за исключением охотничьих видов, у которых преимущественно добываются самцы, и поэтому самок при учетах бывает больше, чем самцов. Количественное преобладание самцов по данным визуальных учетов в летний сезон некоторыми воспринимается с сомнением, поскольку самцы по сравнению с самками более заметны в природе из-за яркой окраски оперения, регулярного пения и большей подвижности в гнездовое время. Однако по данным массового отлова в сезон миграций при охвате всего периода перелетов видимое соотношение полов, скошенное в сторону самцов, сохраняется, что может свидетельствовать о реальности такого соотношения (Паевский, 1993, 2008).
Обобщенные результаты нашего анализа опубликованных данных по третичному соотношению полов, т.е. у взрослых птиц 196 видов, представлены на диаграмме (рис. 1) и в табл. 1. Подчеркнем, что эти данные были получены разными методами, для взрослых птиц разной таксономической принадлежности, в разные сезоны, и использованы здесь без какой-либо коррекции. Всего из 308 оценок в 233 случаях (76%) соотношение достоверно отличалось от 0.5, т.е. равного (1 : 1), и большинство из них (82%) было смещено в сторону самцов (χ2 = 92.7, p < 0.001). Для тех оценок, где самцы по количеству преобладали, их доля значительно варьировала у разных видов и систематических групп: превышение доли самцов над долей самок составляло от 1.1 до 37.8%. Экстремальное количественное преобладание самцов (не использовано в наших расчетах) – в 6 раз больше, чем самок, – было установлено при моделировании собранных в природе данных о морском зуйке (Charadrius alexandrinus), полиандрическом виде с обратной половой ролью – мужской заботой о потомстве (Kosztolanyi et al., 2011).
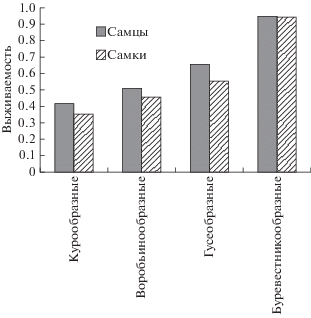
Рис. 1.
Распределение частот 308 опубликованных оценок соотношения полов у взрослых птиц из широкого спектра видов.
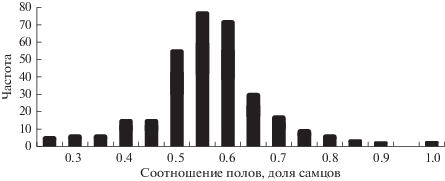
Таблица 1.
Распределение количества достоверных оценок соотношения полов взрослых птиц
| Группы | Преобладание самцов | Преобладание самок | Равное соотношение полов |
|---|---|---|---|
| Отряд Воробьинообразные | 103 | 11 | 40 |
| Птицы из других 18 отрядов | 87 | 32 | 35 |
| Всего | 190 | 43 | 75 |
Согласно обзору Дональда (Donald, 2007), оценки соотношения полов, собранные разными способами (визуальные подсчеты, отлов на местах гнездования или отлов в периоды сезонных передвижений), не имели достоверных различий между собой (критерий Крускала–Уоллиса, p > 0.05). Однако при этом различия в оценках обнаружились лишь у птиц с нормальной и сокращающейся численностью. У последних, особенно находящихся под угрозой вымирания по критериям Международного союза охраны природы, соотношение полов было в большей степени сдвинуто в сторону самцов. То же самое оказалось характерным и для небольших изолированных популяций птиц (Dale, 2001). Помимо общего соотношения полов в популяции, тщательные исследования доли активных в сексуальном плане самцов и самок дают возможность изучить и их соотношение. На примере полигамного снежного зуйка (Charadrius nivosus) было выяснено, что соотношение у сексуально активных и всех остальных птиц меняется в разные годы, хотя самцы в обеих группах преобладают (Carmona-Isunza et al., 2017).
Первичное соотношение полов обычно определяют молекулярно-генетическими методами в кладках яиц или при вылуплении птенцов (Ellegren, 1996; Sokolov, Vysotsky, 2000; Que et al., 2019). По 140 оценкам в гнездах 114 видов соотношение полов в яйцах и у только что вылупившихся птенцов отличалось от равного в 24 случаях (17%) (Donald, 2007). По данным о 819 птенцах 28 видов птиц (среди которых 24 вида – воробьинообразные), исследованных в гнездах с отсутствием гибели птенцов до исследования, соотношение полов у всех видов достоверно не отличалось от равного (Родимцев, 1997). У черного аиста (Ciconia nigra) было обнаружено в среднем 47.1% самцов среди птенцов из разных популяций видового ареала (Konovalov et al., 2015). Существуют и сезонные тренды в соотношении полов у потомства. У пяти видов хищных птиц обнаружено разное соотношение пола птенцов в зависимости от времени размножения. У одних видов в ранний период размножения количественно преобладали самки, а в поздний – самцы, но у других видов соотношение было обратным. При тенденции размножаться в раннем возрасте, как у пустельги (Falco tinnunculus), в потомстве преобладает мужской пол, а у болотного луня (Circus aeruginosus), вида с поздним размножением, – женский (Daan et al., 1996). Несмотря на существование ряда таких и других отклонений, в целом по выводам из разных публикаций можно утверждать, что у большинства птиц первичное соотношение полов равное, и лишь в процессе дальнейшей жизни это соотношение нарушается под влиянием поло-специфичной смертности.
По данным многолетнего (1958–1996 гг.) изучения путем отлова, кольцевания и повторных отловов двух наиболее многочисленных гнездящихся видов птиц на Куршской косе (Восточная Прибалтика) – зяблика (Fringilla coelebs) и пеночки-веснички (Phylloscopus trochilus) – нами были получены результаты о соотношении полов птиц в разном возрасте (Паевский, 1967, 1986, 1991; Соколов и др., 1986, 1996; Payevsky, 2000; Payevsky, Shapoval, 2000). Соотношение полов у птенцов в гнездах зяблика определено на 93 особях, составляющих 23 выводка, выкормленных вручную до возраста самостоятельности с целью изучения импринтинга территории (Соколов и др., 1984). Половая структура этих выводков оказалась самой разнообразной: от выводка, состоящего из 4 самцов, до выводка, состоящего из 5 самок. Суммарно же соотношение в этом возрасте оказалось равным (47 самцов и 46 самок). Достоверные оценки соотношения полов среди молодых зябликов в течение лета до осенней миграции варьировали по десятидневкам от 0.50 до 0.71, в среднем составляя 0.57 самцов.
Среди взрослых зябликов разного возраста соотношение полов варьировало в меньшей степени, составляя в среднем 0.55 самцов (табл. 2). Результаты свидетельствуют, что у этой популяции соотношение полов со стойким превышением доли самцов над долей самок сохранялось во всех возрастах, начиная с приобретения самостоятельности, при этом доля самцов слегка увеличивалась с возрастом птиц. То же самое обнаружили и для других видов птиц, где по мере увеличения возраста увеличивался разрыв в количестве самцов и самок (Donald, 2007). Существенное количественное преобладание самцов обнаружено и в северной популяции зяблика в Восточной Фенноскандии (Панов и др., 2019).
Таблица 2.
Соотношение полов среди взрослых зябликов разного возраста по данным повторных отловов (суммарные данные за 22 летних сезона)
| Годы жизни | Птицы, окольцованные в возрасте | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| птенцы + молодые | первый год взрослой жизни* | взрослые разного возраста | |||||||
| n | самцы, % | p | n | самцы, % | p | n | самцы, % | p | |
| 1 | 1195 | 53.8 ± 1.4 | <0.001 | 453 | 54.4 ± 1.6 | <0.001 | 957 | 54.4 ± 1.6 | <0.001 |
| 2 | 498 | 55.6 ± 2.2 | <0.001 | 279 | 55.6 ± 2.9 | <0.01 | 530 | 55.1 ± 2.2 | <0.001 |
| 3 | 274 | 55.8 ± 3.0 | <0.01 | 165 | 55.8 ± 3.9 | <0.05 | 311 | 55.6 ± 2.8 | <0.01 |
| 4 | 150 | 52.0 ± 4.1 | <0.05 | 102 | 54.9 ± 4.9 | >0.05 | 190 | 56.3 ± 3.6 | <0.05 |
| 5 | 96 | 50.0 ± 5.1 | >0.05 | 52 | 108 | 59.3 ± 4.7 | <0.01 | ||
| 6 | 42 | 19 | 59.0 ± 5.4 | <0.05 | 59 | ||||
| 7 | 24 | 9 | 23 | ||||||
| 8 | 9 | 50.6 ± 5.6 | >0.05 | 3 | 10 | 53.1 ± 5.0 | >0.05 | ||
| 9 | 4 | 5 | |||||||
| 10 | 1 | 1 | |||||||
| 11 | 1 | ||||||||
| В среднем | 53.0 ± 1.6 | 56.0 ± 1.8 | 55.6 ± 1.4 | ||||||
Такие же многолетние данные, как и по зяблику, были получены нами для пеночки-веснички (Паевский, 1991; Payevsky, 2000). В 1970–1980-е годы весничка в Восточной Прибалтике была весьма многочисленным видом со стабильной численностью, как и в других регионах Европы, и лишь впоследствии во многих местах был зарегистрирован достоверный популяционный спад. В Великобритании (Morrison et al., 2016) половое соотношение у этого вида с достоверным превышением количества самцов существовало только при сокращающейся численности популяций. В других регионах количественное преобладание самцов наблюдалось и при очень высокой численности в течение многих десятилетий (за 1958–1996 гг. на Куршской косе было поймано и обследовано 122 870 особей). Определение пола пойманных весничек проводили в период размножения по клоакальному выступу у самцов и наседному пятну у самок, а в другие сезоны – по длине крыла, предварительно установив половые различия его длины. Пол определяли, относя всех особей с длиной 68 мм и более – к самцам, а с длиной 64 мм и менее – к самкам, игнорируя зону перекрытия длин. Хотя по критерию Бартлетта было выяснено, что есть межгодовые различия численности, корреляционный анализ показал положительную связь между количеством пойманных весничек в одни и те же декады разных лет (Паевский, 1991; Payevsky, 2000). Доля самцов среди пойманных нами размножающихся весничек, с середины мая до июля, составляла в разные сроки в среднем от 55.3 ± 1.6% до 73.5 ± 1.1% (достоверно при p < 0.001). Во время кочевок после периода размножения средняя доля самцов среди взрослых составляла 58.9 ± 1.4%, а среди молодых – 57.6 ± 0.3%. На о-ве Гельголанд в Северном море было получено такое же соотношение у взрослых весничек (59% самцов), однако среди молодых соотношение оказалось равным (Niemeyer, 1969).
Итак, по результатам изучения разных видов и популяций соотношение полов у взрослых птиц в большинстве случаев количественно смещено в сторону самцов. В кладках яиц и у вылупляющихся птенцов соотношение полов равное. Одна из вероятных причин нарушения равного полового соотношения по мере взросления птиц – более высокий уровень смертности самок по сравнению с самцами, что по-разному объясняется разными авторами, и это обсуждается далее.
ПОЛО-СПЕЦИФИЧЕСКАЯ ВЫЖИВАЕМОСТЬ ПТИЦ: ОТЛИЧИЯ ОТ ДРУГИХ ЖИВОТНЫХ
Ранее было широко распространено мнение, основанное на многочисленных данных статистики, что у большинства животных разной систематической принадлежности, и в первую очередь млекопитающих, включая человека, самцам свойственна повышенная по сравнению с самками смертность и пониженная продолжительность жизни (Comfort, 1964; Case, 1978). Это иногда трактовалось как следствие недостаточного выкармливания более требовательных к ресурсам растущих мужских отпрысков. Универсальность повышенной смертности самцов, однако, была поставлена под сомнение даже для некоторых видов млекопитающих (Большаков, Кубанцев, 1984). Что же касается птиц, то это обсуждалось применительно к разным видам, и неоднократно была высказана гипотеза о более высокой выживаемости самцов по сравнению с самками (Lack, 1968; Паевский, 1985; Curio, 1989; Promislow et al., 1992; Owens, Bennett, 1994).
Тестирование этой гипотезы было проведено нами по данным о среднегодовой выживаемости особей разного пола у 10 видов птиц Восточной Прибалтики и по опубликованным данным для 62 видов мировой орнитофауны, всего из 12 отрядов, на основе 109 парных величин (Payevsky et al., 1997). Расчеты по данным кольцевания проводились разными методами для погибших птиц и для пойманных живыми в последующие годы. Во втором случае физическая выживаемость в узколокальной популяции представляет собой произведение вероятности выживания на вероятность возвращения. Обобщенные результаты показали, что в 80 случаях более высокие показатели выживаемости наблюдались у самцов, только в 19 случаях – у самок, и в 10 случаях выживаемость была равной. В разных систематических группах птиц показатели выживаемости самцов и самок соотносятся по-разному, при этом у буревестникообразных различия выживаемости полов наименьшие (рис. 2). Попытка определить на этом материале, существует ли связь между общим уровнем выживаемости и разницей в выживаемости самцов и самок, показала, что коэффициент детерминации R2 = 0.24, что говорит о невозможности сделать такой вывод.
Более высокий уровень выживаемости самцов, нежели самок, был установлен и в других исследованиях на разных видах птиц (Searcy, Yasukawa, 1981; Blums, Mednis, 1996; Siriwardena et al., 1998; Sillett, Holmes, 2002; Liker, Székely, 2005; Pipoly et al., 2015; Ramula et al., 2018). Таким образом, существует стойкая тенденция к более высокой среднегодовой выживаемости самцов птиц по сравнению с самками, однако это верно только при сравнении всех данных для многих видов. Важно подчеркнуть, что для каждой отдельной популяции, несмотря на более высокие показатели самцов, различия во многих случаях оказывались недостоверными. Это особенно характерно для популяций разных видов синиц (Orell, Ojanen, 1979; Clobert et al., 1988; Winkel, Frantzen, 1989; Hõrak, Lebreton, 1998; Dietrich et al., 2003; Payevsky, 2009a). Тем не менее можно утверждать, что для птиц не подтверждается известная концепция о повышенном уровне смертности самцов в сравнении с самками у всех животных.
Чем же можно объяснить отличия птиц от многих других животных, и в первую очередь от млекопитающих, по признаку выживаемости особей разного пола? Разумеется, самцы и самки многих видов, помимо физиологических отличий, различаются по степени участия в размножении. Весьма частое объяснение сдвинутой в сторону самцов половой структуры – более высокая репродуктивная нагрузка на самок, которая ведет к их повышенной смертности (Promislow et al., 1992; Blums, Mednis, 1996; Bennett, Owens, 2002). Самцы, тем не менее, при весьма интенсивной конкуренции и за территорию, и за самку тоже подвержены большим энергетическим затратам, что ведет к высокой стоимости размножения. Большинство специалистов все же склоняются к утверждению о более высокой смертности того пола, который несет всю тяжесть родительской заботы, а это чаще всего самки (Clutton-Brock, Vincent, 1991). Несколько исследований по репродуктивным затратам у животных разного филогенетического уровня дали противоречивые результаты в отношении высокой стоимости полового отбора у птиц (Promislow et al., 1992; Owens, Bennett, 1994, и др.). И все же сравнительный филогенетический анализ поло-специфической смертности взрослых птиц 194 видов (Liker, Székely, 2005) четко показал, что эволюционные изменения родительской заботы самок не связаны с изменениями их смертности. А у самцов вариации в уровне смертности все же достоверно зависят от конкурентных взаимоотношений в брачный период. Оценка общности годовых изменений численности популяций разных видов со сходной экологией и общими местами зимовок показала синхронность колебаний уровня смертности (Бурский, 2007). То же можно ожидать и у возрастно-половых групп птиц, но с существенными, хотя и разными поправками на возраст и пол. Кроме того, хорошо известны возрастные и половые различия в отношении протяженности осенних миграций, т.е. дальности расположения зимовок и вследствие этого разных возможностей выживания (Паевский, 2019).
В одном из обзоров (Breitwisch, 1989) высказано мнение, что несбалансированное соотношение полов у разных животных является результатом различных брачных систем. Известно, что полиандрия характеризуется количественным преобладанием самцов и заботой самца о потомстве, а полигиния – количественным преобладанием самок. Однако подавляющее большинство видов птиц моногамны, и у них половое соотношение чаще всего сдвинуто в сторону преобладания самцов. Более того, сами брачные системы могут количественно видоизменяться в зависимости от существующих изменений в соотношении полов (Donald, 2007). Еще один важный аспект разного поведения самок и самцов – различия в степени интенсивности и дальности расселения, что обсуждается ниже, в разделе о начальном периоде половых различий смертности.
Наиболее логичное объяснение разнонаправленной смертности у птиц и млекопитающих (у птиц повышенная у самок, а у млекопитающих повышенная у самцов) – генетическое, а именно фактор детерминации (становления) пола. И у тех, и у других смертность взрослых выше у гетерогаметного пола, но у птиц гетерогаметны самки (ZW), а у млекопитающих – самцы (XY). Соотношение полов с преобладанием самцов находят у видов с ZW-детерминацией пола, в отличие от видов с детерминацией XY (Паевский, 1985; Payevsky et al., 1997; Liker, Székely, 2005; Donald, 2007; Pipoly et al., 2015). У таксонов с гетерогаметностью самок доля самцов в среднем 0.55 ± 0.01, а у таксонов с гетерогаметностью самцов 0.43 ± 0.01 (Pipoly et al., 2015). Считается, что более высокая смертность гетерогаметного пола может объясняться проявлением вредоносных аллелей, подверженных действию отбора (Мейнард-Смит, 1981; Liker, Székely, 2005).
ТЕОРИИ ПОЛОВОГО РАСПРЕДЕЛЕНИЯ
Впервые идея о том, что естественный отбор благоприятствует способности родителей регулировать пол своего потомства, была выдвинута уже давно (Trivers, 1972; Trivers, Willard, 1973). В одной из существенных публикаций, теоретически развивающих эту идею (Kokko, Jennions, 2008), рассмотрены аргументы, касающиеся разных стратегий самцов и самок при размножении – приверженность самок заботе о потомстве, а самцов – конкуренции за самок. Основной вопрос при этом – связана ли забота о потомстве с инвестициями энергии до и после спаривания. Представленная интегративная модель показала взаимодействие всех сопутствующих факторов, приводящих к разным половым ролям (Kokko, Jennions, 2008). Если смертность при заботе о потомстве выше, чем при конкуренции самцов, то это снижает вероятность расхождения половых ролей, потому что сильно ограничивает успешность спаривания одного из полов.
К способности родителей регулировать пол своего потомства приводят различия в социальном статусе и физическом состоянии самок животных. Самки высокого ранга при выращивании потомства неосознанно предпочитают проявлять наибольшую заботу к тому полу, чья ожидаемая репродуктивная успешность зависит от материнской заботы; в большинстве случаев это оказывается мужской пол. А низкоранговые самки, живущие в менее благоприятных условиях, выращивают преимущественно дочерей. Разумеется, экологическое состояние окружающей среды в период выращивания потомства может определять репродуктивную успешность родителей, оказывать влияние на пол потомства и поло-специфическое регулирование будущей успешности потомства. В любом случае отбор должен благоприятствовать подгонке соотношения полов потомков в отношении их ожидаемой приспособленности (Trivers, Willard, 1973; Charnov, 1982; Leimar, 1996).
Считается (Navara, 2018), что в настоящее время есть множество доказательств возможности самок позвоночных животных регулировать, какую именно половую хромосому получат яйца в зависимости от условий окружающей среды и социальной обстановки в популяции. Несмотря на растущее количество публикаций на эту тему, результаты часто противоречивы. Тестирование этих связей на примере размножения домового крапивника (Troglodytes aedon) показало, что у самок высокого ранга количество выращенных самцов достоверно больше, чем у самок низкого ранга. Выяснено также, что на массу тела птенцов мужского пола наличие пищевых ресурсов оказывало большее влияние, чем на массу тела птенцов женского пола: самцы были тяжелее самок, когда росли в хороших условиях, но были легче самок при плохих условиях выращивания. Однако при этом родители, выращивавшие выводки с равным соотношением полов, были более продуктивны, чем родители с выводками с неравным соотношением полов. Это говорит о том, что отбор направлен на равное соотношение полов. Тем не менее различия в физическом состоянии выращенного потомка и его успешности размножения имели положительные связи с массой тела сыновей, но не дочерей (Bowers et al., 2015). В последующей публикации этих авторов (Bowers et al., 2017) на примере того же вида птиц показано, что доля самцов в выводке была отрицательно связана с размером выводка, в котором выросла мать, и с датой ее вылупления, но положительно коррелировала с качеством текущей территории размножения. Однако самки, которые вырастили больше сыновей, чем дочерей, с меньшей вероятностью возвращались размножаться на эту территорию в следующий сезон. Следовательно, окружающая среда при размножении имеет длительный эффект на последующую репродукцию и на половое распределение.
Теория полового распределения прогнозирует, что родители, выращивающие выводки, вкладывают в потомство разного пола столько из имеющихся ресурсов, сколько ожидается соответственно его будущей приспособленности при размножении. Однако на примере 1264 птенцов из 676 выводков морского зуйка (Charadrius alexandrinus) в Китае, пол которых установлен молекулярно, было показано равное соотношение полов, которое не зависело ни от даты вылупления, ни от физического состояния родителей, как отца, так и матери (Que et al., 2019).
Результат исследования этих вопросов на примере лазоревки (Cyanistes caeruleus) в Англии показал влияние качества гнездовой территории на показатели первичного соотношения полов. У потомства из 78 гнезд не обнаружено достоверного отклонения от первичного равного соотношения полов. Однако существующая вариация в соотношении полов потомства была достоверно связана с взаимодействием между качеством отца и качеством гнездовой территории. Выживаемость птенцов была связана с качеством отца в противоположность качеству матери, и физическое состояние птенцов зависело от соотношения качества территории и качества отца (Bell et al., 2014). Ранее подобные связи были показаны на примере большой синицы (Parus major), где доля сыновей в выводке достоверно увеличивалась с увеличением размера цевки и черной брюшной полосы самца (Kölliker et al., 1999).
Связи между вариацией в соотношении полов потомства и вариацией в физических качествах отца были показаны в разных исследованиях. Исходя из этого прогнозировалось количественное преобладание самцов в большинстве выводков, однако во многих случаях этого не наблюдалось (Bell et al., 2014). Тем не менее уже давно известно, что самки, образующие пару с сексуально более привлекательными внешне и/или высокоранговыми, т.е. более крепкими физически, самцами, производят больше сыновей, чем дочерей (Charnov, 1982). Тщательный обзор литературы для тестирования этой гипотезы (Booksmythe et al., 2017) привел к заключению, что средняя сила изучаемой связи была весьма небольшой, объясняя меньше 1% соотношения полов. Из всех атрибутов привлекательности самцов только размер тела и развитие особых украшений достоверно прогнозировали повышенную долю самцов среди потомства. На основании этого полагают, что есть убедительные доказательства существования поддержанной отбором наследственности особых сексуальных свойств самца, ведущих к вариациям половой структуры потомства. С другой стороны, многочисленные исследования показывают равное первичное соотношение полов у птиц. Существует ли возможность исходного изменения первичного соотношения полов у всей популяции только за счет полового распределения? На этот вопрос вряд ли можно ответить положительно.
КОГДА ВОЗНИКАЮТ ОТКЛОНЕНИЯ ОТ СБАЛАНСИРОВАННОГО ПЕРВИЧНОГО СООТНОШЕНИЯ ПОЛОВ?
Несмотря на возможность регуляции родителями полового состава кладок и выводков, большинство имеющихся данных свидетельствует о том, что первичное соотношение полов у птиц равное, а вторичное и третичное в основном отклоняется в сторону количественного преобладания самцов. Следовательно, в какой-то период включается механизм дифференцированной по полу смертности и самки погибают чаще, чем самцы. Некоторые из результатов исследований, проведенных на разных видах птиц, позволяют высказать предположение о том, что этот период – ювенильный, вскоре после покидания гнезда выросшими птенцами и приобретения самостоятельности. Этот период характеризуется, судя по ряду опубликованных данных, большей мобильностью молодых самок по сравнению с молодыми самцами, что выражается в территориальной дисперсии. Биологический смысл натальной дисперсии – расширение популяцией своего ареала и перераспределение птиц в пространстве в целях уменьшения инбридинга (Newton, 2003). Поло-специфичная дисперсия может вызывать и поло-специфичную смертность в связи с непредсказуемыми условиями жизни даже при сравнительно недалеких передвижениях.
В обзоре о натальной и гнездовой филопатрии и дисперсии птиц (Greenwood, Harvey, 1982) было показано, что самки, по сравнению с самцами, более склонны к дисперсии, за исключением некоторых видов уток. Этот вывод был поддержан в последующих статьях и обзорах по многим видам из разных семейств птиц (Clarke et al., 1997; Sokolov, 1997; Dale, 2001; Chernetsov et al., 2006; Payevsky, 2016). В ряде публикаций можно найти подтверждение предположению о том, что первый этап формирования соотношения полов с преобладанием самцов начинается у птиц в очень молодом возрасте. Так, пониженная выживаемость молодых самок в популяции попугая Forpus passerinus объяснялась их весьма значительной дисперсией из-за половых различий в филопатрии (Veran, Beissinger, 2009). На п-ове Ямал молодые самки белой куропатки (Lagopus lagopus) отлетают к югу гораздо раньше самцов и за время перелета преодолевают более длинный путь, чем самцы (Пиминов, 1986). У обыкновенной гаги (Somateria mollissima) соотношение полов при вылуплении было равным (0.5), но среди 118 мертвых утят до подъема на крыло оказалось 59% самок (Lehikoinen et al., 2008). Однако другое исследование, проведенное на этом же виде птиц, показало, что большой количественный сдвиг к доминированию взрослых самцов (65%) был инициирован пятилетними птицами с высоким репродуктивным потенциалом, а поло-специфичная дисперсия в данном случае – малоправдоподобное объяснение (Ramula et al., 2018). У снежного зуйка (Charadrius nivosus) большое отклонение соотношения в сторону самцов у взрослых птиц (0.63) формируется лучшей выживаемостью молодых самцов, нежели самок (Eberhart-Phillips et al., 2017).
Анализ изменения соотношения полов молодых зябликов и весничек по данным отлова в течение периода летних кочевок после приобретения самостоятельности (Паевский, 1967, 1986; Соколов, 1982; Payevsky, 2000, 2009b) позволяет выделить начальный период, когда количественно преобладают самки или же превышение числа самцов невысоко (рис. 3). После этого периода соотношение полов сменяется достоверным превышением доли самцов с наиболее высокими показателями. В первую очередь это может свидетельствовать о большей мобильности самок в этот период, когда недалекие кочевки сменяются широкомасштабной натальной дисперсией. Среди зябликов, окольцованных в возрасте гнездовых птенцов и пойманных в том же летнем сезоне, некоторые особи задерживались поблизости от гнезда в течение от 40 до 70 дней, другие же, преимущественно самки, перелетали за это время на 2, 4 и даже 20 км (Паевский, 1967). Задержка самцов в пределах территории рождения на большее число дней, чем у самок, была отмечена для этой же популяции и позже (Соколов, 1982). Для веснички характерно кратковременное пребывание в районе рождения после вылета из гнезда, в среднем 30–48 сут, после чего начинается широкий дисперсионный разлет. Это отмечено у разных популяций – на Полярном Урале (Рыжановский, 1997), возле Ладожского озера и в Восточной Прибалтике (Соколов и др., 1986, 1996). С конца июня и до октября среди мигрирующих весничек доля самцов изменяется в границах от 46 до 72%, возрастая к концу осенней миграции (Payevsky, 2000).
Рис. 3.
Соотношение полов (доля самцов) у молодых зябликов (Fringilla coelebs) и молодых пеночек-весничек (Phylloscopus trochilus) в период летних кочевок.
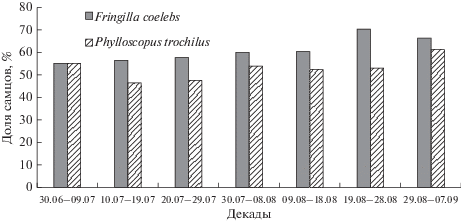
В целом можно предположить, что более выраженная натальная дисперсия самок сразу же после начала самостоятельной жизни может сопровождаться большей гибелью по сравнению с самцами. По-видимому, основная причина этого – меньшая сопротивляемость самок окружающей среде в связи с их гетерогаметностью, как обсуждалось выше. Стоимость дисперсии для молодой птицы – это затраты энергии, времени и риск гибели. Этот риск больше, чем во время осенней миграции, поскольку птица находится в более юном возрасте и передвигается в одиночку. Необходимы дальнейшие исследования для подтверждения этой гипотезы.
УРОВЕНЬ СООТВЕТСТВИЯ МЕЖДУ ПОЛОВОЙ СТРУКТУРОЙ ПОПУЛЯЦИЙ И ПОЛОВЫМИ РАЗЛИЧИЯМИ ВЫЖИВАЕМОСТИ
Из всего изложенного выше следует, что преобладание доли самцов у большинства птиц соответствует их повышенной выживаемости по сравнению с самками. Насколько это верно для разных видов и популяций птиц? Выше было указано, что, несмотря на более высокие показатели выживаемости самцов, во многих популяциях эти различия между полами статистически недостоверны. То же самое было обнаружено по многолетним данным об окольцованных певчих птицах в Англии. Оценки выживаемости взрослых самцов там были выше, чем таковые самок, у 10 из 15 видов, но при этом большинство различий в показателях были незначимы (Siriwardena et al., 1998).
Рассмотрим зависимость выживаемости от пола и ее соответствие половой структуре на многочисленных видах разного систематического положения и с разной экологией. У наиболее многочисленной европейской птицы, зяблика, выживаемость популяции из Восточной Прибалтики на протяжении 40 лет оставалась в статистическом смысле одинаковой, несмотря на годовые колебания, что говорит о стабильной численности (Высоцкий, Паевский, 2002). Это подтверждается и доминантным положением зяблика в орнитофауне Европы (Паевский, 2020). Оценки среднегодовой выживаемости взрослых самцов и самок этого вида по данным кольцевания за 30 и 35 лет (Payevsky et al., 1997) показали следующие независимые результаты: по данным о погибших птицах выживаемость самцов 0.562, самок 0.523, по отловам живых птиц у самцов 0.498, у самок 0.482. И в том и в другом случае различия в выживаемости по суммарным данным оказались статистически незначимы, хотя в некоторые периоды более высокая выживаемость самцов оказывалась достоверной.
Одни из наиболее изученных видов птиц в Евразии – большая синица (Parus major) и мухоловка-пеструшка (Ficedula hypoleuca). Среднегодовая выживаемость взрослых больших синиц из разных популяций значительно варьирует – от 0.302 до 0.650. По опубликованным данным о 13 популяциях, у которых изучены половые различия выживаемости, в девяти из них самцы выживали в большей степени по сравнению с самками, в трех выживаемость самок была выше, и в одной популяции показатели были равны (Паевский, 2008). У мухоловки-пеструшки среднегодовая выживаемость самцов в ряде популяций была значимо выше выживаемости самок, в других не достигала уровня достоверности, но всегда была выше у самцов (Sternberg, 1989; Нумеров, 1995; Payevsky et al., 1997; Высоцкий, 2000; Артемьев, 2008; Chernetsov et al., 2009). Таким образом, можно еще раз подтвердить, что, несмотря на отсутствие в ряде популяций достоверных различий выживаемости птиц разного пола, повышенная выживаемость самцов является преобладающей тенденцией у птиц самых разных видов.
Для выявления соответствия между повышенной выживаемостью самцов и их количественным преобладанием нами был использован ранговый коэффициент корреляции Спирмена на примере 14 видов воробьинообразных Восточной Прибалтики. Устанавливали связь между превышением доли численности самцов над самками и превышением доли их выживаемости. Результаты показали, что на уровне значимости p = 0.05 коэффициент корреляции оказался равным критическому значению. Поскольку нулевую гипотезу об отсутствии обсуждаемой связи нельзя отвергнуть, можно сделать вывод, что половые различия выживаемости приблизительно соответствуют количественному преобладанию самцов в популяциях.
ЗАКЛЮЧЕНИЕ
Вышеприведенный обзор, не претендующий на исчерпывающуюся полноту, свидетельствует, что половые различия выживаемости птиц относятся к ключевым компонентам их жизненных стратегий, определяющих динамику популяций. У большинства видов птиц, в отличие от млекопитающих, самкам в сравнении с самцами в среднем свойственна более высокая смертность и более дальняя дисперсия, а самцам – более высокий уровень выживаемости, что определяется в первую очередь генетической детерминацией пола. Во многих популяциях не найдено достоверных половых различий в уровне смертности, хотя показатели выживаемости самцов всегда были выше показателей самок. Тем не менее, исходя из всего вышеизложенного, можно сделать предварительный вывод о том, что у большинства изученных видов и популяций птиц, несмотря на равное соотношение полов при рождении, количественное преобладание самцов в популяциях определяется их повышенной выживаемостью по сравнению с самками. Сочетание гетерогаметности самок птиц и их более выраженной территориальной дисперсии может быть причиной их повышенной смертности по сравнению с самцами.
Исследование выполнено в рамках научного проекта “Изучение и сохранение структуры и динамики биоразнообразия амфибий, рептилий и птиц Евразии”, № АААА-А19-119020590095-9. Автор выражает глубокую признательность своим коллегам – сотрудникам Зоологического института РАН, и прежде всего орнитологам Биологической станции “Рыбачий” за дружескую помощь на всех этапах работы и за возможность использования коллективных материалов – результатов отлова и кольцевания птиц, в сборе которых автор принимал участие в 1958–1997 гг. Автор также весьма благодарен анонимному рецензенту за тщательное прочтение текста и большое количество конструктивных критических замечаний.
Список литературы
Артемьев А.В., 2008. Популяционная экология мухоловки-пеструшки в северной зоне ареала. М.: Наука. 267 с.
Большаков В.Н., Кубанцев Б.С., 1984. Половая структура популяций млекопитающих и её динамика. М.: Наука. 233 с.
Бурский О.В., 2007. Опыт многолетнего исследования сообщества птиц // Динамика численности птиц в наземных ландшафтах. М.: ИПЭЭ РАН. С. 25‒38.
Высоцкий В.Г., 2000. Структура локальной популяции у птиц на примере мухоловки-пеструшки (Ficedula hypoleuca). Автореф. дисс. … канд. биол. наук. СПб.: ЗИН РАН. 25 с.
Высоцкий В.Г., Паевский В.А., 2002. Долговременные изменения годовой выживаемости зяблика в восточной части Балтийского региона // Многолетняя динамика численности птиц и млекопитающих в связи с глобальными изменениями климата. Казань: Новое знание. С. 200–207.
Ларионов В.Ф., 1927. К вопросу об определении численного соотношения полов у птиц в природе // Тр. лабор. эксперим. биол. Московск. зоопарка. Т. 3. М.; Л.: КОИЗ. С. 119–136.
Мейнард-Смит Д., 1981. Эволюция полового размножения. М.: Мир. 272 с.
Нумеров А.Д., 1995. Популяционная экология мухоловки-пеструшки на территории Окского заповедника // Тр. Окского биосфер. заповедника. № 19. С. 75–100.
Паевский В.А., 1967. О территориальном поведении молодых птиц лесных видов в послегнездовое время // Миграции птиц Прибалтики. Л.: Наука. С. 87–95.
Паевский В.А., 1969. Количественное соотношение самцов и самок в природе у некоторых видов воробьиных // Орнитология в СССР. Ч. 2. Ашхабад: Илым. С. 482–484.
Паевский В.А., 1985. Демография птиц. Л.: Наука. 285 с.
Паевский В.А., 1986. Соотношение полов в популяции зяблика на Куршской косе // Экол. и фаунист. исслед. птиц. Тр. Зоол. ин-та АН СССР. Т. 147. С. 39–45.
Паевский В.А., 1991. Определение пола, соотношение полов и смертность в популяции пеночки-веснички // Орнитология. № 25. С. 89–93.
Паевский В.А., 1993. Половая структура популяций птиц и ее изменчивость // Зоол. журн. Т. 72. № 1. С. 85–97.
Паевский В.А., 2008. Демографическая структура и популяционная динамика певчих птиц. М.: Т-во науч. изд. КМК. 235 с.
Паевский В.А., 2019. Дифференциальная миграция птиц: разнообразие и противоречивость // Зоол. журн. Т. 98. № 12. С. 1420–1431.
Паевский В.А., 2020. Феномен зяблика (Fringilla coelebs) как абсолютного доминанта в сообществах лесных птиц Европы // Экология. № 1. С. 72–80.
Панов И.Н., Пушкин Д.А., Накул Г.Л. и др., 2019. Особенности экологии и популяционные характеристики группировок зяблика Fringilla coelebs у северных пределов ареала в восточной Фенноскандии // Вестн. Тверск. ун-та. Сер. Биол. и экол. № 1(53). С. 148–168.
Пиминов В.Н., 1986. Половая структура популяции и избирательность промысла белой куропатки // Изучение птиц СССР. Тезисы IX Всесоюз. орнит. конф. С. 147–148.
Родимцев А.С., 1997. Соотношение полов у птенцов некоторых видов птиц // Рус. орнит. журн. Т. 6. № 17. С. 3–8.
Рыжановский В.Н., 1997. Экология послегнездового периода жизни воробьиных птиц Субарктики. Екатеринбург: Изд-во Уральск. ун-та. 288 с.
Соколов Л.В., 1982. Послегнездовые перемещения и постоянство мест гнездования у зяблика на Куршской косе // Популяционная экология зяблика. Л.: Наука. С. 215–228.
Соколов Л.В., Лапшин Н.В., Резвый С.П., 1986. Территориальное поведение веснички на Куршской косе Балтийского моря и в юго-восточном Приладожье // Актуальные проблемы орнитологии. M.: Наука. С. 190–206.
Соколов Л.В., Большаков К.В., Виноградова Н.В. и др., 1984. Проверка способности молодых зябликов запечатлевать и находить территорию будущего гнездования // Зоол. журн. Т. 63. № 11. С. 1671–1681.
Соколов Л.В., Паевский В.А., Марковец М.Ю. и др., 1996. Сравнительный анализ уровня филопатрии, дисперсии и численности у двух видов пеночек – веснички Phylloscopus trochilus и трещотки Ph. sibilatrix на Куршской косе Балтийского моря // Зоол. журн. Т. 75. № 4. С. 565–578.
Чемякин Р.Г., 1988. К соотношению численности полов у воробьиных птиц (Passeriformes) по данным отлова // Зоол. журн. Т. 67. № 7. С. 1046–1055.
Bell S., Owens I.P.F., Lord A.M., 2014. Quality of breeding territory mediates the influence of paternal quality on sex ratio bias in a free-living bird population // Behav. Ecol. V. 25. № 2. P. 352–358.
Bennett P.M., Owens I.P.F., 2002. Evolutionary Ecology of Birds (Life Histories, Mating Systems and Extinction). Oxford: Oxford Univ. Press. 278 p.
Blums P., Mednis A., 1996. Secondary sex ratio in Anatinae // Auk. V. 113. P. 505–511.
Booksmythe I., Mautz B., Davis J. et al., 2017. Facultative adjustment of the offspring sex ratio and male attractiveness: A systematic review and meta-analysis // Biol. Rev. V. 92. № 1. P. 108–134.
Bowers E.K., Thompson C.F., Sakaluk S.K., 2015. Persistent sex-by-environment effects on offspring fitness and sex-ratio adjustment in a wild bird population // J. Anim. Ecol. V. 84. P. 473–486.
Bowers E.K., Thompson C.F., Sakaluk S.K., 2017. Maternal natal environment and breeding territory predict the condition and sex ratio of offspring // J. Evol. Biol. V. 44. P. 11–20.
Breitwisch R., 1989. Mortality patterns, sex ratios and parental investment in monogamous birds // Curr. Ornithol. V. 6. P. 1–50.
Carmona-Isunza M.-C., Ancona S., Székely T. et al., 2017. Adult sex ratio and operational sex ratio exhibit different temporal dynamics in the wild // Behav. Ecol. V. 28. № 2. P. 523–532.
Case T.J., 1978. On the evolution and adaptive significance of post-natal growth rates in the terrestrial vertebrates // Quart. Rev. Biol. V. 53. P. 253–282.
Charnov E.L., 1982. The Theory of Sex Allocation. Princeton: Princeton Univ. Press. 355 p.
Chernetsov N., Sokolov L.V., Kosarev V., 2009. Local survival rates of Pied Flycatchers Ficedula hypoleuca depend on their immigration status // Avian Ecol. Behav. V. 16. P. 11–20.
Chernetsov N., Sokolov L.V., Kosarev V. et al., 2006. Sex-related natal dispersal of Pied Flycatchers: How far away from home? // Condor. V. 108. P. 711–717.
Clarke A.L., Saether B.-E., Røskaft E., 1997. Sex biases in avian dispersal: A reappraisal // Oikos. V. 79. № 3. P. 429–438.
Clobert J., Perrins C.M., McCleery R.H., Gosler A.G., 1988. Survival rate in the great tit Parus major in relation to sex, age, and immigration status // J. Anim. Ecol. V. 57. № 1. P. 287–306.
Clutton-Brock T.H., 1986. Sex-ratio variation in birds // Ibis. V. 128. P. 317–329.
Clutton-Brock T.H., Vincent A.C.J., 1991. Sexual selection and the potential reproductive rates of males and females // Nature. V. 351. P. 58–60.
Comfort A., 1964. Ageing: The Biology of Senescence. N.-Y.: Holt, Rinehart & Winston, Inc. 380 p.
Curio E., 1989. Some aspects of avian mortality patterns // Mitt. Zool. Mus. Berlin. Annivers. Ornith. Bd. 65. Suppl. 13. P. 47–70.
Daan S., Dijkstra C., Weissing F.J., 1996. An evolutionary explanation for seasonal trends in avian sex ratios // Behav. Ecol. V. 7. № 4. P. 426–430.
Dale S., 2001. Female-biased dispersal, low female recruitment, unpaired males, and the extinction of small and isolated bird populations // Oikos. V. 92. P. 344–356.
Darwin C., 1871. The Descent of Man and Selection in Relation to Sex. L.: John Murray. 424 p.
Dietrich V.C.J., Schmoll T., Winkel W., Lubjuhn T., 2003. Survival to first breeding is not sex-specific in the Coal Tit (Parus ater) // J. Ornithol. V. 144. № 2. P. 148–156.
Donald P.F., 2007. Adult sex ratios in wild bird populations // Ibis. V. 149. P. 671–692.
Eberhart-Phillips L.J., Küpper C., Miller T.E.X. et al., 2017. Sex-specific early survival drives adult sex ratio bias in snowy plovers and impacts mating system and population growth // PNAS. V. 114. № 27. P. E5474–E5481.
Eberhart-Phillips L.J., Küpper C., Carmona-Isunza M.C. et al., 2018. Demographic causes of adult sex ratio variation and their consequences for parental cooperation // Nat. Commun. V. 9. № 1. P. 1651.
Eiby Y.A., Worthington-Wilmer J., Booth D.T., 2008. Temperature-dependent sex-biased embryo mortality in a bird // Proc. R. Soc. B. V. 275. P. 2703–2706.
Ellegren H., 1996. First gene on the avian W chromosome (CHD) provides a tag for universal sexing of non-ratite birds // Proc. R. Soc. B. V. 263. P. 1635–1641.
Emlen S.T., Oring L.W., 1977. Ecology, sexual selection, and the evolution of mating systems // Science. V. 197. P. 215–223.
Fisher R.A., 1930. The Genetical Theory of Natural Selection: A Complete Variorum Edition. Oxford: Clarendon Press. 308 p.
Greenwood P.J., Harvey P.H., 1982. The natal and breeding dispersal of birds // Annu. Rev. Ecol. Evol. Syst. V. 13. P. 1–21.
Hardy I.C.W. (ed.), 2002. Sex ratios. Concepts and Research Methods. Cambridge: Cambridge Univ. Press. 424 p.
Hõrak P., Lebreton J.-D., 1998. Survival of adult Great Tits Parus major in relation to sex and habit: a comparison of urban and rural populations // Ibis. V. 140. № 2. P. 205–209.
Kokko H., Jennions M.D., 2008. Parental investment, sexual selection and sex ratios // J. Evol. Biol. V. 21. P. 919–948.
Kölliker M., Heeb P., Werner I. et al., 1999. Offspring sex ratio is related to male body size in the great tit (Parus major) // Behav. Ecol. V. 10. № 1. P. 68–72.
Konovalov A., Kaldma K., Bokotey A. et al., 2015. Spatio-temporal variation in nestling sex ratio among the Black Stork Ciconia nigra populations across Europe // J. Ornithol. V. 156. № 2. P. 381–387.
Kosztolanyi A., Barta Z., Küpper C., Székely T., 2011. Persistence of an extreme male-biased adult sex ratio in a natural population of polyandrous bird // J. Evol. Biol. V. 24. № 8. P. 1842–1846.
Lack D., 1954. The Natural Regulation of Animal Numbers. Oxford: Oxford Univ. Press. 343 p.
Lack D., 1968. Ecological Adaptations for Breeding in Birds. L.: Methuen. 409 p.
Lehikoinen A., Öst M., Hollmen T., Kilpi M., 2008. Does sex-specific duckling mortality contribute to male bias in adult common eiders? // Condor. V. 110. № 3. P. 574–578.
Leimar O., 1996. Life-history analysis of the Trivers-Willard sex-ratio problem // Behav. Ecol. V. 7. № 3. P. 316–325.
Liker A., Székely T., 2005. Mortality costs of sexual selection and parental care in natural populations of birds // Evolution. V. 59. P. 890–897.
Liker A., Freckleton R.P., Székely T., 2013. The evolution of sex roles in birds is related to adult sex ratio // Nat. Commun. V. 4. P. 1587.
Mayr E., 1939. The sex ratio in wild birds // Am. Nat. V. 73. P. 156–179.
McIlhenny E.A., 1940. Sex ratio in wild birds // Auk. V. 57. P. 85–93.
Morrison C.A., Robinson R.A., Clark J.A., Gill J.A., 2016. Causes and consequences of spatial variation in sex ratios in a declining bird species // J. Anim. Ecol. V. 85. № 5. P. 1298–1306.
Navara K.J., 2018. Choosing Sexes. Mechanisms and Adaptive Patterns of Sex Allocation in Vertebrates. Springer. 240 p.
Newton I., 2003. The Speciation and Biogeography of Birds. L.: Acad. Press. 668 p.
Niemeyer H., 1969. Statistische Untersuchungen zu Geschlechtsverhältnis und Zugordnung des Fitislaubsängers (Phylloscopus trochilus) auf Helgoland // Zool. Anzeiger. B. 183. S. 342–354.
Orell M., Ojanen M., 1979. Mortality rates of the Great Tit Parus major in a northern population // Ardea. V. 67. № 3–4. P. 130–133.
Owens I.P.F., Bennett P.M., 1994. Mortality costs of parental care and sexual dimorphism in birds // Proc. R. Soc. B. V. 257. P. 1–8.
Payevsky V.A., 2000. Willow Warbler Phylloscopus trochilus on the Courish Spit, Eastern Baltic: Demographic parameters, breeding biology, and comparison of adaptations in the genus Phylloscopus // Avian Ecol. Behav. V. 5. P. 1–26.
Payevsky V.A., 2009a. Songbird Demography. Sofia, Moscow: Pensoft. 260 p.
Payevsky V.A., 2009b. Sex-specific survival rate in the Chaffinch, Fringilla coelebs: When do the females die? // 7th Confer. Europ. Ornith. Union. Zurich. P. 133.
Payevsky V.A., 2016. Sex-biased survival and philopatry in birds: Do they interact? // Biol. Bull. V. 43. № 8. P. 808–816.
Payevsky V.A., Shapoval A.P., 2000. Age structure of passerine populations according to ringing results // Avian Ecol. Behav. V. 4. P. 55–66.
Payevsky V.A., Vysotsky V.G., Yefremov V.D. et al., 1997. Sex-specific survival rates in birds // J. Gen. Biol. V. 58. № 6. P. 5–20.
Pipoly I., Bokony V., Kirkpatrick M. et al., 2015. The genetic sex-determination system predicts adult sex ratios in tetrapods // Nature. V. 527. № 7576. P. 91–94.
Promislow D.E.L., Montgomerie R., Martin T.E., 1992. Mortality costs of sexual dimorphism in birds // Proc. R. Soc. B. V. 250. P. 143–150.
Que P., Székely T., Wang P. et al., 2019. Offspring sex ratio is unrelated to parental quality and time of breeding in a multiple-breeding shorebird // J. Ornithol. V. 160. № 2. P. 443–452.
Ramula S., Öst M., Linde A. et al., 2018. Increased male bias in eider ducks can be explained by sex-specific survival of prime-age breeders // PLoS One. V. 13. № 4. P. e0195415.
Searcy W.A., Yasukawa K., 1981. Sexual size dimorphism and survival of male and female Blackbirds (Icteridae) // Auk. V. 98. P. 457–465.
Sheldon B.C., 1998. Recent studies of avian sex ratios // Heredity. V. 80. P. 397–402.
Sillett T.S., Holmes R.T., 2002. Variation in survivorship of a migratory songbird throughout its annual cycle // J. Anim. Ecol. V. 71. P. 296–308.
Siriwardena G.M., Baillie S.R., Wilson J.D., 1998. Variation in the survival rates of some British passerines with respect to their population trends on farmland // Bird Study. V. 45. № 3. P. 276–292.
Sokolov L.V., 1997. Philopatry of migratory birds. Review // Physiol. Gen. Biol. Rev. V. 11. Amsterdam: Harwood Acad. Publishers. 58 p.
Sokolov E.P., Vysotsky V.G., 2000. Non-invasive method of molecular sex determination in passerines // Avian Ecol. Behav. V. 4. P. 81–84.
Sternberg H., 1989. Pied Flycatcher // Lifetime Reproduction in Birds / Ed. Newton I. L.: Acad. Press. P. 55–74.
Székely T., Webb J.N., Cuthill I.C., 2000. Mating patterns, sexual selection and parental care: An integrative approach // Vertebrate Mating Systems / Eds Apollonio M., Festa-Bianchet M., Mainardi D. L.: World Science Press. P. 194–223.
Székely T., Weissing F.J., Komdeur J., 2014. Adult sex ratio variation: Implications for breeding system evolution // J. Evol. Biol. V. 27. P. 1500–1512.
Trivers R.L., 1972. Parental investment and sexual selection // Sexual Selection and the Descent of Man 1871–1971 / Ed. Campbell B. Chicago: Aldine Press. P. 139–179.
Trivers R.L., Willard D.E., 1973. Natural selection of parental ability to vary sex-ratio of offspring // Science. V. 179. P. 90–92.
Veran S., Beissinger S.R., 2009. Demographic origins of skewed operational and adult sex ratios: Perturbation analyses of two-sex models // Ecol. Lett. V. 12. P. 129–143.
Winkel W., Frantzen M., 1989. Ortstreue, Emigration und Lebensalter von Kohlmeisen (Parus major) im Braunschweiger Raum // Vogelwarte. Bd. 35. H. 1. S. 64–79.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии