Журнал общей биологии, 2020, T. 81, № 4, стр. 285-296
Остракоды (Ostracoda, Crustacea) как модельные объекты для изучения эволюции полового диморфизма
Я. А. Шурупова 1, *, Е. М. Тесакова 2, 3
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет,
кафедра биологической эволюции
119234 Москва, Ленинские горы, 1-12, Россия
2 Московский государственный университет им. М.В. Ломоносова, геологический факультет,
кафедра региональной геологии и истории Земли
119234 Москва, Ленинские горы, 1, Россия
3 Геологический институт РАН
119017 Москва, Пыжевский пер., 7, Россия
* E-mail: shurupova.ya@yandex.ru
Поступила в редакцию 06.03.2020
После доработки 02.04.2020
Принята к публикации 09.04.2020
Аннотация
Остракоды являются идеальным объектом для изучения микроэволюционных процессов, в частности эволюции полового диморфизма, поскольку имеют длительную и непрерывную палеонтологическую летопись, хорошо диагностируемые морфологические признаки, наличие полового диморфизма и четко различимые возрастные стадии. Для некоторых ракушковых раков от миоцена до современности показано, что первыми в эволюционный процесс вовлекаются самцы. Это выражается в сохранении ювенильных признаков в строении замка раковины у самцов вследствие педоморфоза. Этот феномен впервые выявлен у мезозойских представителей – позднекелловейского вида Lophocythere acrolophos из разреза Михайловцемент (Рязанская обл.). В статье приводится обзор работ по эволюции полового диморфизма у остракод и новые данные.
Половой отбор – особая форма естественного отбора и один из важнейших механизмов эволюции, благодаря которому возникает половой диморфизм – морфологические различия между самками и самцами, иногда не несущие адаптивной функции, но предоставляющие преимущество при спаривании носителю тех или иных признаков. Это явление было впервые описано Дарвином в “Происхождении видов” и более подробно, с множеством примеров, разобрано в двухтомнике “Происхождение человека и половой отбор” (Darwin, 1859, 1871).
В большинстве случаев инвестиции самок превышают инвестиции самцов, начиная с асимметрии половых клеток. Они вкладывают больше ресурсов в производство и/или выращивание потомства, поэтому за доступ к спариванию преимущественно борется противоположный пол, но именно самки чаще производят окончательный выбор партнера, хотя известны и противоположные примеры, когда самки конкурируют за самцов (Darwin, 1871; Bateman, 1948; Jones, Avise, 2001).
Проследить эволюцию полового диморфизма весьма проблематично, так как длительные эволюционные процессы сложно изучать на живых объектах в режиме реального времени. Ископаемые объекты тоже обладают рядом ограничений, затрудняющих подобные исследования: 1) неполнота геологической летописи; 2) плохая сохранность мягких тканей (копулятивные органы, окраска, половые клетки лишь в единичных случаях сохраняются в ископаемом виде); 3) недостаточное количество экземпляров для статистически достоверной выборки в случае изучения макрофауны, например, позвоночных, моллюсков и т.д.; 4) сложность в интерпретации данных и установлении функций признаков, которые возникли в результате полового отбора. Представители видов, обладающие сильно выраженным половым диморфизмом, иногда даже описывались как разные виды, в том числе и остракоды (например, Любимова, 1955, с. 63, табл. 6 , фиг. 9 и с. 65, табл. 7 , фиг. 2; Занина и др., 1960, рис. 683 и 684 ; Cohen, 1989; Knell et al., 2013).
Наиболее перспективными объектами для подобных исследований являются микроскопические организмы, сохраняющиеся в горных породах в массовых количествах, имеющие длительную геологическую историю и хорошо различимый половой диморфизм. Всем этим критериям в полной мере отвечают ракушковые раки (Ostracoda, Crustacea). Один из последних обзоров литературы по изучению полового диморфизма остракод был сделан в 2013 г. японским исследователем Озавой (Ozawa, 2013), где широко освещались исследования по изучению эволюции полового диморфизма остракод, но не были включены многие результаты наших соотечественников и, соответственно, данные, полученные за последние семь лет. Поэтому в настоящей статье приводится дополненный и расширенный обзор, а также собственные результаты, полученные при изучении остракод р. Lophocythere Silvester-Bradley, 1948 из опорного разреза для верхнего келловея (средняя юра) Русской плиты Михайловцемент (Рязанская обл.).
Ископаемая летопись остракод охватывает огромный временной промежуток, начиная с раннего кембрия, при условии, если брадориид относить к классу остракод (Melnikova et al., 1997; Vannier et al., 2005; Williams et al., 2007). Палеокопиды, миодокопиды и подокопиды известны из более поздних отложений (Harvey et al., 2012; Nowak et al., 2018).
Другие достоинства остракод (обилие ископаемого материала и ярко выраженный половой диморфизм) отмечались уже в 1932 г. (Alexander, 1932). Самые древние копулятивные органы, найденные в ископаемом состоянии, принадлежат именно остракодам из лагерштетта, образовавшегося в морских силурийских отложениях (425 млн лет) на территории современного Херефордшира в Англии в результате пеплопада. У миодокопид Colymbosathon ecplecticos Siveter et al., 2003 половые органы занимают значительную часть раковины и отличаются крупным размером, что подчеркивается в названии (Siveter et al., 2003). А самые древние фоссилизированные половые клетки ракушковых принадлежат остракодам Heterocypris collaris Matzke-Karasz et al., 2013 из пресноводных пещерных отложений миоцена Австралии (Matzke-Karasz et al., 2014). Сперматозоиды у этих остракод отличаются гигантским размером, вытянутой головкой и длинным хвостом. Для копуляции у самцов имеется зенкеров орган, минерализованные слепки которого встречаются в раковинах с мелового периода и свидетельствуют о том, что гигантские половые клетки у ципридидных остракод были уже тогда (Matzke-Karasz et al., 2009). Гигантизм мужских половых клеток известен и в других группах беспозвоночных, например у некоторых насекомых (Miller, Pitnick, 2002; Polilov, 2016).
Половой диморфизм раковин остракод зависит от половой активности (плавательной активности, положения раковин самок и самцов при спаривании, строения копулятивных органов) и/или вынашивания яиц (Cohen, Morin, 1990; Abe, Vanier, 1991). Направление и давление отбора может быть разным у самок и самцов (Badyaev, Martin, 2000).
РАЗЛИЧИЯ МОРФОЛОГИИ МЯГКОГО ТЕЛА И ПОВЕДЕНИЯ САМОК И САМЦОВ
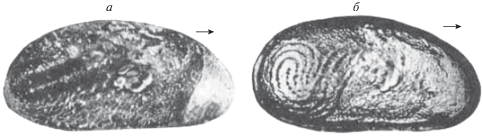
Половые органы остракод, как правило, полностью размещаются внутри тела, поэтому их отпечатки на раковинах не остаются. Но у некоторых кайнозойских (современные и миоценовые виды) пресноводных ципридокопин яичники и семенники свободно располагаются в полости створок, поэтому иногда на их внутренней стороне остаются отпечатки, которые сохраняются в ископаемом виде (рис. 1). По этим отпечаткам может быть реконструировано строение половых органов (Moore, 1961; Николаева, Аладин, 1989).
Рис. 1.
Правые створки раковин пресноводных и солоноватоводных миоценовых Moenocypris francofurtana Triеbel, 1959. Вид снаружи, стрелкой отмечен передний конец. а – самка с отпечатком яичника, б – самец с отпечатком семенников (по: Moore, 1961).
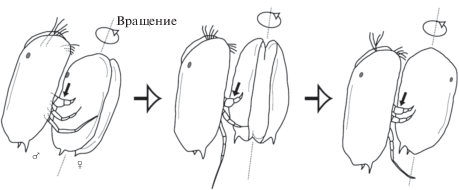
Половой диморфизм может проявляться в асимметрии конечностей, например, у подокопид вида Bicornucythere bisanensis Okubo, 1975, известного из солоноватоводного бассейна Японии, подомер правой первой грудной конечности у самцов в 1.5 раза крупнее и более мускулистый, чем у самок. Это явление получило объяснение при видеозаписи копуляции. Такая конечность оказалась адаптацией к брачному ухаживанию. Перед спариванием самец вращает раковину самки три или четыре раза, используя эту конечность (рис. 2) (Abe, Vanier, 1991; Ozawa, 2013).
Рис. 2.
Схематическое изображение брачного поведения современных Bicornucythere bisanensis из солоноватоводного мелководья Японии (по: Abe, Vannier, 1991 из Ozawa, 2013).
У морских миодокопид Vargula hilgendorfii (Mueller, 1890), известных как морские светлячки, конечности самок и самцов также различаются. Фурка у последних крупнее. По видеозаписям удалось установить, что перед спариванием самец активно плавает вокруг самки, отталкиваясь от дна фуркой, как бы “подпрыгивая” (Ozawa, 2013).
Самцы планктонных остракод Cypridinidae Baird, 1850 во время ухаживания за самками используют биолюминесценцию и плавают по различным траекториям, выделяя светящийся секрет с разной частотой. Такие брачные танцы видоспецифичны и четко различаются самками (Morin, Cohen, 2010).
Считается, что эволюционно стабильное соотношение полов среди взрослых особей у большинства организмов, размножающихся половым путем, 1 : 1 (Fisher, 1930; Shaw, Mohler, 1953; Futuyma, 2005), но это соотношение может меняться в разных группах в масштабах эволюции (его называют экстраординарным, или нефишеровским) (Hamilton, 1967). У остракод соотношение 1 : 1 не всегда выдерживается (Yamaguchi, 2017) и зависит от сезонных колебаний, а также отличается у морских и пресноводных представителей (у последних существуют партеногенетические виды). Обычно у морских остракод это соотношение 1 : 2, где самцов в 2 раза меньше (Martins, 2019). На ископаемом материале неравное соотношение самцов и самок еще заметнее. Например, у юрского вида Lophocythere acrolophos Whatley, Ballent, Armitage, 2001 соотношение полов составило 1 : 4, где самцов в 4 раза меньше (Shurupova, Tesakova, 2019).
Обычно именно самцы остракод инициируют спаривание (McGregor, Kesling, 1969; Cohen, Morin, 1990; Horne et al., 1998), они чаще активно плавают в толще воды в поисках партнера и с большей вероятностью попадают под пресс пелагических хищников. Поэтому продолжительность жизни у самок и самцов может различаться, что также влияет на соотношение полов. И хотя элиминация активных самцов будет сильнее, такое поведение поддерживается половым отбором, так как дает репродуктивное преимущество (Abe, 1983; Kamiya, 1988; Abe, Vannier, 1991; Rivers, Morin, 2008; Speiser et al., 2013).
Строение зрительных органов также может различаться у полов. Например, меньший размер глаз, вплоть до полного их отсутствия, или меньший размер и выпуклость глазных бугорков у самок (Bonaduce, Danielopol, 1988; Rivera, Oakley, 2009; Arenz et al., 2018). У самцов некоторых миодокопид хорошо развитые органы зрения помогают не только в поисках партнера или идентификации потенциального конкурента, но и в избегании хищников. Вследствие таких различий в морфологии сильно отличается и поведение (что позволяет избежать острой внутривидовой конкуренции) (Cohen, Morin, 1990; Speiser et al., 2013).
В планктонных и бентосных пробах иногда наблюдается разное соотношение полов у одних и тех же видов миодокопид: в планктоне преобладают самцы, а в бентосе – оплодотворенные самки. У последних морфология изменяется после спаривания – они теряют плавательные щетинки, вследствие чего ограничиваются только бентосным образом жизни. Возможно, такая адаптация возникла в результате конфликта полов, так как оплодотворенная самка в таком состоянии не может привлекать других самцов (Cohen, Morin, 1990; Speiser et al., 2013).
ТИПЫ ПОЛОВОГО ДИМОРФИЗМА И РАЗЛИЧИЯ МОРФОЛОГИИ РАКОВИН САМОК И САМЦОВ ОСТРАКОД
Представителей разных полов можно различить не только по строению мягкого тела и поведению, но и по морфологии раковины, что особенно информативно при работе с ископаемым материалом. Строение раковин самок и самцов в разных группах могут различаться по размерам, форме, скульптуре, очертанию, строению замка, выраженности (или отсутствию) различных структур.
Отличительной особенностью ракушковых раков является наличие разных типов полового диморфизма, который был особенно разнообразен у представителей палеозойских групп и чаще всего не имеет аналогов у современных представителей. В работах последних десятилетий в англоязычной литературе типы полового диморфизма не рассматриваются подробно (например, Armstrong, Brasier, 2013; Ozawa, 2013), но эти морфологические различия очень важны для систематики. Разными авторами предлагаются разные классификации типов/надтипов полового диморфизма, но не вызывают сомнений два самых основных: эстрадомицилярный (который также называют наружным) и домицилярный (или внутренний) (Иванова, 1979; Практическое руководство…, 1990).
Экстрадомицилярный надтип известен только у палеозойских остракод и связан с образованием разных структур (ребер или открытых полостей), чаще всего на брюшной стороне, которые находятся снаружи раковины и не связаны непосредственно с мягким телом рачка (Сарв, 1966; Иванова, 1979; Ozawa, 2013). Морфология раковин палеозойских остракод сильно отличается в разных группах, поэтому в пределах экстрадомицилярного надтипа выделяли разные типы (Scott et al., 1961; Сарв, 1966; Иванова, 1979; Armstrong, Brasier, 2013). Например, в работе В.А. Ивановой (1979) выделяются три типа:
а) Долональный диморфизм – наличие ребра у обоих полов (преимущественно в переднебрюшном или брюшном крае створки, реже на заднем крае), которое у самок может быть выпуклым или выглядеть как вздутие, такая структура называется “долон” (рис. 3а, б);
Рис. 3.
Экстрадомицилярный надтип полового диморфизма, все раковины снаружи: долональный диморфизм, левые створки сбоку (а, б); антральный диморфизм, правые створки (в–е), в, г – вид сбоку, д, е – вид с брюшной стороны; маргинальный диморфизм, левые створки (ж–к), ж, з – вид сбоку, и, к – вид с брюшной стороны (по: Иванова, 1979).
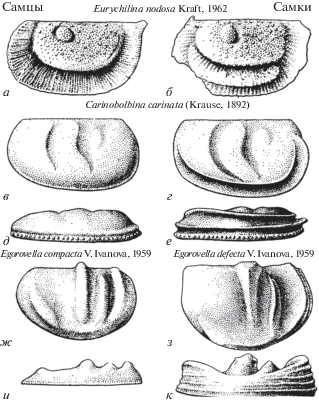
б) Антральный диморфизм – проявляется только на раковинах самок, у которых развивается полость с вогнутым дном (антрум) и двумя ребрами по бокам. Иногда формируются две параллельные полости, состоящие из трех ребер (рис. 3в–е);
в) Маргинальный диморфизм – проявляется только на створках самок, у которых брюшная поверхность створки расширяется. На створке находятся три низких продольных ребрышка одинаковой величины (рис. 3ж–к).
При долональном диморфизме, так как выпуклости на створках самок находились не в полости раковины, то, предположительно, яйца после оплодотворения перемещались с помощью конечностей из задней части раковины к переднебрюшной, потом выталкивались в выводковую камеру и прикреплялись к ее стенкам с помощью липкого секрета. И хотя многие ракообразные, как вымершие, так и современные, тоже носят яйца после оплодотворения в специальных выводковых камерах, современных аналогов такого репродуктивного поведения палеозойских остракод нет (Иванова, 1979).
Второй надтип полового диморфизма – домицилярный – встречается на протяжении всего фанерозоя. При домицилярном диморфизме отличия раковин самок и самцов связаны с морфометрическими параметрами и/или выражаются в формировании выпуклости и вздутия на створках самок для вынашивания потомства непосредственно в полости раковины (Moore, 1961; Henningsmoen, 1965; Иванова, 1971, 1979; Jaanusson, 1985; Pokorný, 1998; Armstrong, Brasier, 2013). Также могут отличаться очертания, размеры, высота и/или ширина заднего конца раковин самок и самцов. У некоторых видов с таким типом диморфизма раковины разных полов могут дополнительно различаться по скульптуре и/или замку (Андреев, 1966; Сарв, 1966; Шорников, 1966, 2016; Schornikov, Tsareva, 2002; Ozawa, 2013). Внутри этого надтипа можно выделить еще четыре типа (Иванова, 1979):
а) Апархитидный диморфизм – наличие вздутия или расширение задней части раковины самок (рис. 4а–г);
Рис. 4.
Домицилярный диморфизм: апархитидный диморфизм, левые створки (а–г), а, б – вид сбоку, в, г – вид с заднего конца; бейрихиидный диморфизм, левые створки, вид сбоку (д, е); клоденеллидный диморфизм, правые створки (ж–к), ж, з – вид сбоку, и, к – вид с брюшного края; контурный диморфизм, левые створки, вид сбоку (л, м) (по: Иванова, 1979).
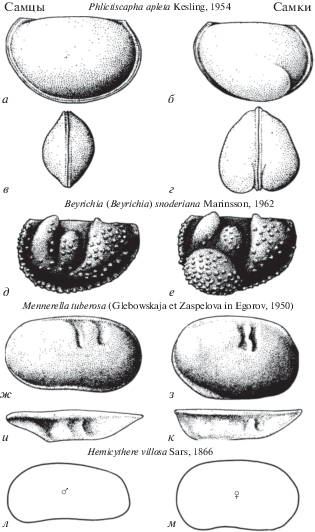
б) Бейрехиидный диморфизм (или круминальный; Сарв, 1966) – развитие выпуклости (крумины) в переднебрюшной части раковин самок (рис. 4д, е);
в) Клоденеллидный диморфизм – развитие полости в задней части раковины самок (рис. 4ж–к);
г) Контурный диморфизм (или размерно-пропорциональный) – различие в очертаниях и величинах соотношений раковин самок и самцов (рис. 4л, м).
При домицилярном диморфизме раковины самцов могут иметь более крупную и вытянутую форму из-за крупных гемипенисов, зенкерова органа и огромных сперматозоидов, но иногда встречается и обратное соотношение в размерах раковин самок и самцов (Howe et al., 1961; Karanovic, 2012; Martins et al., 2017). Например, у мезо-кайнозойских подокопид (в том числе современных) в большинстве случаев раковины самцов узкие и более длинные, а у самок задний конец раковины обычно более высокий и широкий. Но у пресноводного вида Cypridea subvaldensis Hanai, 1951 из мела Китая раковины самцов мельче и уже, чем у самок (Ozawa, 2013). У представителей юрского р. Mandelstamia Lyubimova, 1955 раковины самцов отличаются не только большей длиной, но и более высоким и широким задним концом (Malz, 1958; Neale, Kilenyi, 1961; Wilkinson et al., 1998), в то время как у р. Palaeocytheridea Mandelstam, 1947 раковины самцов длиннее раковин самок, но с более низким задним концом (Tesakova, 2013a, b).
Также у разных полов может отличаться скульптура раковины. Например, у современных солоноватоводных подокопид Callistocythere pumila Hanai, 1957, известных из устьев рек бассейна Японского моря, скульптура раковин самок, состоящая из ямок, выражена гораздо ярче. У самцов она развита слабее (рис. 5). Из-за этих различий особи разного пола изначально были даже описаны как разные виды (Okubo, 1979). Но при более подробном изучении строения мягкого тела эта неточность была устранена (Ozawa, 2013; Шорников, 2017).
Рис. 5.
Левые створки современных солоноватоводных остракод Callistocythere pumila, вид снаружи, стрелками отмечена передняя часть раковины. а – схематическое изображение скульптуры, б – SEM-фото (по: Ozawa, 2013).
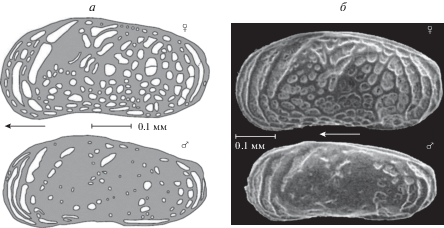
Аналогичные наблюдения над вариацией скульптуры на раковинах разных полов у современных и ископаемых представителей р. Leptocythere Sars, 1925 выявили ряд форм (например, L. (L.) cymbula (Livental, 1929), L. propinqua (Livental, 1929), L. accurata Schneider, 1959, L. aediculata Stepanaitys, 1962) с совершенно идентичным строением конечностей, т.е. относящиеся к одному виду L. (L.) cymbula, но первоначально описанные как разные виды из-за различия скульптуры раковин самок и самцов и высокой вариабельности скульптуры именно у самок. Полиморфизм остракод, ограниченный полом, как правило, сильнее выражен у самок (Шорников, 1966, 2017). Но изредка, например, у представителей р. Gomphocythere Sars, 1924 из нижнего мела Западной Европы, наоборот, изменчивость скульптуры у самцов проявляется сильнее (Wischer, 1957).
Например, у представителей сем. Beyrichiidae Jones, 1855 (Palaeocopida), известных с силура (Практическое руководство…, 1990), в передней половине раковин взрослых самок образуются крупные полости, которые интерпретируются как выводковые камеры. Однако есть и альтернативное (или дополняющее) объяснение, связанное с тем, что некоторые остракоды, возможно, использовали эти камеры для поддержания плавучести (Ozawa, 2013).
В ордовикских (425 млн лет) отложениях штата Нью-Йорк (США) найдены раковины остракод, в увеличенной заднебрюшной части которых находились яйца и ювенильные особи самых ранних стадий того же вида, это вздутие интерпретируется как выводковая камера (Siveter et al., 2014). Подобная находка раковины самки с ювенильной особью внутри выводковой камеры известна и с территории Сибири (средний ордовик) (Иванова, 1971).
Выводковые камеры у самок возникали независимо в разных группах остракод, начиная с ордовика. Такое поведение свидетельствует о репродуктивной K-стратегии – возникновении заботы о потомстве, самка защищает яйца от хищников и изменений условий окружающей среды (Ozawa, 2013; Siveter et al., 2014).
ЭВОЛЮЦИЯ ПОЛОВОГО ДИМОРФИЗМА
Различия в морфологии раковин самок и самцов обычно проявляются у взрослых экземпляров, реже половые отличия возникают на поздних ювенильных стадиях (Horne et al., 2002; Ozawa, 2013). Этому явлению Уотли и Стивенс дали название “преждевременный половой диморфизм” (precocious sexual dimorphism) (Whatley, Stephens, 1977), который был обнаружен и на оригинальном материале – у мезозойских остракод (Shurupova, Tesakova, 2019).
У разных групп из пограничного интервала перми и триаса наблюдался “эффект лилипутов” (уменьшение размеров тела) (Yang et al., 1993; Hayami, 1998; Fraiser, Bottjer, 2007; Leighton, Schneider, 2008; Song et al., 2011, и др.), в том числе и у остракод, с проявлением полового диморфизма на более ранних возрастных стадиях, уже при 5–6-й линьке. Эта гетерохрония привела к более раннему половому созреванию (неотения), что рассматривается как адаптация, выработавшаяся в ответ на ухудшающиеся экологические условия (Forel et al., 2015). Известно, что неотения – это один из распространенных видов гетерохроний. Скорости эволюции у самок и самцов не всегда одинаковы. Гетерохронные сдвиги могут наблюдаться чаще у одного пола, а именно – у самцов (Darwin, 1871; Геодакян, 1965, 1974; McNamara, 2012).
Ювенильные признаки в морфологии раковины у самцов обнаружены среди пресноводных дарвинулид Vestalenula cornelia Smith et al., 2006. На брюшном крае в передней половине раковины у самцов вместо монолитного выступа наблюдается зазубренная структура, как на предыдущей возрастной стадии, у самок же есть килевидное углубление на левой (и комплементарный выступ на правой) створке, т.е. у самцов сохраняется ювенильный признак (Ozawa, 2013).
Остракоды р. Loxoconcha Sars, 1866 (сем. Loxoconchidae Sars, 1925, вымершие и современные) многочисленны и широко распространены на морском мелководье от тропиков до субарктики, в том числе в акватории Японии. У плейстоценовых Loxoconcha kamiyai Ozawa et Ishii, 2008 также выявлен половой диморфизм, возникший из-за гетерохронии. Первый замковый зуб в передней половине правой створки у взрослого самца меньше и округлее, чем у взрослой самки. По своему строению он схож с замком предыдущей возрастной стадии. У взрослой самки зуб в этой части замка крупнее и более прямоугольной формы (рис. 6).
Рис. 6.
Сравнение раковин самок и самцов Loxoconcha kamiyai из четвертичных отложений центральной Японии, вид изнутри. Верхний ряд – взрослая самка, средний – ювенильная стадия, нижний – самец. a – SEM-фото, черной стрелкой отмечен изменчивый элемент замка; б – SEM-фото переднего зуба замка раковины; в – схематическое изображение переднего зуба замка раковины (по: Ozawa, 2013).
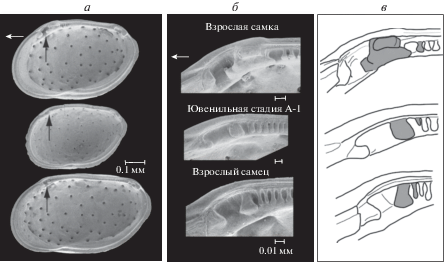
Такой же половой диморфизм в строении замка раковины выявлен у близкородственного вида Loxoconcha mutsuense Ishizaki, 1971. Эти различия возникли вследствие гетерохронии, которая сформировалась за счет педоморфоза (ювенилизации). Этот признак находится внутри раковины (в передней половине на спинном крае) и не связан напрямую с репродуктивными функциями и поведением (Ozawa, 2013).
У представителей р. Loxoconcha замок по своему строению один из самых сложных среди подокопид. Его упрощение у некоторых самцов локсоконхид можно считать проявлением атавистических черт, которые возникли в результате сохранения у взрослых особей ювенильных признаков (педоморфоза) (Ozawa, 2013).
Подобные отличия замков раковины у самок и самцов обнаружены в разных семействах (Cytheridae, Leptocytheridae, Hemicytheridae, Cytheruridae, Loxoconchidae), причем в широких временных рамках – от миоцена до современности (Tsukagoshi, 1994, 2007; Tsukagoshi, Kamiya, 1996; Ozawa, 2013).
Среди юрских остракод сем. Neurocytheridae Gruendel, 1975 половой диморфизм проявился в строении замка у вида Lophocythere acrolophos. Трехчленный гемимеродонтный замок L. acrolophos на правой створке состоит из крупных насеченных на семь частей краевых зубов и срединного желобка, который у самок осложнен 10 ямко-группами, а у самцов – четырьмя ямко-группами в передней части и множеством мелких ямок в задней части (рис. 7) (Shurupova, Tesakova, 2019).
Рис. 7.
Правые створки взрослых представителей вида Lophocythere acrolophos из верхнего келловея (средняя юра) разреза Михайловцемент (Рязанская обл.). Сверху – схематичное изображение замка раковины: серым цветом отмечены элементы краевых зубов, белым – элементы желобка; SEM-фото замка и створки экземпляров: а – самки, б – самца (по: Shurupova, Tesakova, 2019).
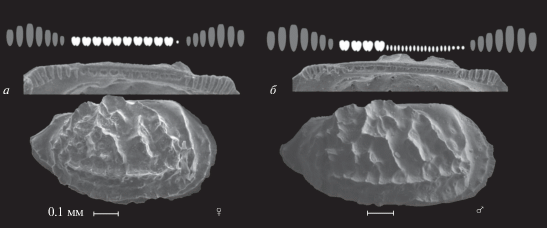
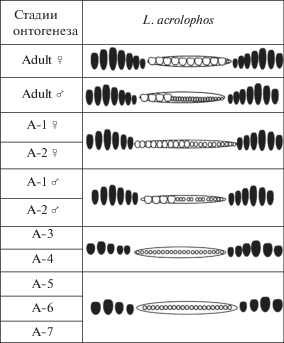
В строении замка самцов сохраняются ювенильные черты (мелкие ямки в задней половине желобка), которые наблюдаются в онтогенезе L. acrolophos с первой по шестую возрастную стадию у обоих полов (рис. 8). И только начиная с седьмой ювенильной стадии по строению желобка можно различать створки разных полов, т.е. наблюдается преждевременный половой диморфизм, возникший за счет гетерохронии, а именно педоморфоза.
Рис. 8.
Схематичное изображение замка правой створки и его онтогенез у вида Lophocythere acrolophos. Стадии онтогенеза: Adult – взрослые представители, A-1–А-7 –ювенильные стадии. Черным цветом отмечены элементы краевых зубов, белым – элементы желобка (по: Shurupova, Tesakova, 2019).
Признаки, возникшие при половом отборе, например как результат “спермовых войн” у самцов и ответ на них у самок, могут действовать в противоход естественному отбору и снижать адаптивность других признаков. Это было показано на цитероидных остракодах из позднемеловых (86–66 млн лет назад) отложений США (Martins et al., 2018). Ископаемая летопись остракод в этих разрезах представлена очень детально. Анализировалось распространение видового состава (93 вида) по изученным разрезам, где уровень исчезновения вида в конкретном разрезе условно принимался за его вымирание. У видов с наиболее ярко выраженным половым диморфизмом средние темпы вымирания оказались выше в 10 раз, чем у видов со слабо выраженным половым диморфизмом. Скорость вымирания растет, если половой диморфизм затрагивает размеры раковины и самцы крупнее самок. Если самцы мельче, то темпы вымирания, напротив, немного снижаются. Крупная раковина самцов свидетельствует о том, что они вкладывают больше ресурсов в производство половых клеток. Они выигрывают в краткосрочной перспективе размножения индивидуумов, но не в долгосрочной перспективе существования видов. В этом случае самцы сталкиваются с проблемой распределения ресурсов: репродуктивный успех или выживание. Предполагается, что на темпы вымирания влияет и история вида: если виды произошли от короткоживущих предков, они вымирают быстрее, и наоборот. Это подтверждено и на других организмах в палеонтологической летописи, разные таксоны имеют свои скорости вымирания и видообразования (Марков, Наймарк, 1994; Martins et al., 2018).
ЗАКЛЮЧЕНИЕ
Таким образом, в результате работы показано, что остракоды, как модельный объект для изучения эволюции полового диморфизма, имеют ряд преимуществ. А именно: длительная геологическая история (более 500 млн лет), карбонатные раковины, которые хорошо сохраняются в ископаемом состоянии, наличие полового диморфизма и разнообразие его типов (особенно у палеозойских представителей) и четкое разграничение возрастных стадий – все это позволяет изучать развитие признаков и возникновение гетерохроний у самок и самцов отдельно. Например, японскими исследователями были выявлены гетерохронии, затрагивающие строение замка раковин самцов у некоторых позднекайнозойских остракод. Но это явление оказалось гораздо древнее и проявляется уже с середины мезозоя (со средней юры). По-видимому, это говорит о том, что самцы вкладывают много ресурсов в репродуктивную систему, поэтому при последней линьке в морфологии раковины остаются ювенильные черты.
Рассмотренные выше многочисленные работы позволяют оценить перспективы использования остракод в эволюционных исследованиях при изучении не только уникальных для этой группы явлений (разнообразие типов полового диморфизма), но и общих закономерностей эволюции полового диморфизма.
Авторы глубоко признательны Л.М. Мельниковой (ПИН РАН) и А.Ю. Журавлёву (МГУ) за обсуждение результатов, ценные замечания и всестороннюю помощь.
Работа выполнена в рамках темы госзаданий АААА-А16-116021660031-5 и АААА-А16-116033010096-8 (МГУ), 0135-2018-0036 (ГИН РАН), при частичной поддержке РФФИ № 18-05-00501.
Список литературы
Андреев Ю.Н., 1966. Половой диморфизм меловых остракод из Гиссаро-Таджикской области // Ископаемые остракоды. Киев: Наукова Думка. С. 50–66.
Геодакян В.А., 1965. Роль полов в передаче и преобразовании генетической информации // Проблемы передачи информации. Т. 1. № 1. С. 105–112.
Геодакян В.А., 1974. Дифференциальная смертность и норма реакции мужского и женского пола // Журн. общ. биологии. Т. 35. № 3. С. 376–385.
Занина И.Е., Нецкая А.И., Поленова Е.Н., 1960. Надсемейство Beyrichiacea // Основы палеонтологии. Членистоногие – трилобитообразные и ракообразные. М.: Изд-во АН СССР. С. 300–314.
Иванова В.А., 1971. Новый среднеордовикский род остракод // Палеонтол. журн. Т. 1. С. 62–66.
Иванова В.А., 1979. Остракоды раннего и среднего ордовика. Подотряд Hollinomorpha. М.: Наука. 217 с.
Любимова П.С., 1955. Остракоды мезозойских отложений Среднего Поволжья и Общего Сырта // Тр. ВНИГРИ. Нов. сер. Т. 84. С. 3–190.
Марков А.В., Наймарк Е.Б., 1994. Избирательное вымирание специализированных таксонов и его роль в эволюции биоты // Журн. общ. биологии. Т. 55. № 6. С. 673–683.
Николаева И.А., Аладин Н.В., 1989. Общая характеристика кайнозойских остракод // Практическое руководство по микрофауне СССР. Остракоды кайнозоя. СПб.: Изд-во Недра. С. 7–26.
Практическое руководство по микрофауне СССР, 1990. Т. 4. Остракоды палеозоя. Л.: Недра. 356 с.
Сарв Л.И., 1966. Половой диморфизм у древнепалеозойских остракод // Ископаемые остракоды. Киев: Наукова думка. С. 14–21.
Шорников Е.И., 1966. О половом диморфизме и изменчивости представителей рода Leptocythere // Ископаемые остракоды. Киев: Наукова думка. С. 73–79.
Шорников Е.И., 2016. Новый паратетический род остракод подсемейства Loxoconchinae (Podocopida, Сytheroidea) // Палеонтол. журн. Т. 6. С. 60–65.
Шорников Е.И., 2017. Таксономические замечания в отношении остракод Понто-Каспийского бассейна // Палеонтол. журн. Т. 5. С. 56–63.
Abe K., 1983. Population structure of Keljella bisanensis (Okubo) (Ostracoda, Crustacea) – An inquiry into how far the population structure will be preserved in the fossil record // J. Fac. Sci. Tokyo Univ. V. 20. № 5. P. 443–488.
Abe K., Vannier J., 1991. Mating behavior in the podocopid ostracode Bicornucythere bisanensis (Okubo, 1975): Rotation of a female by a male with asymmetric fifth limbs // J. Crustac. Biol. V. 11. № 2. P. 250–260.
Alexander C.I., 1932. Sexual dimorphism in fossil Ostracoda // Am. Midl. Nat. V. 13. № 5. P. 302–311.
Arenz A.L., Tran T., Koyama K.H., Marin Gomez A.M., Rivera A.S., 2018. Sexually dimorphic eye-loss driven by ecological selection in an ostracod crustacean: Support for the reproductive role hypothesis // Integr. Comp. Biol. V. 58. № 3. P. 431–440.
Armstrong H., Brasier M., 2013. Microfossils. John Wiley & Sons. P. 219–248.
Badyaev A.V., Martin T.E., 2000. Sexual dimorphism in relation to current selection in the house finch // Evolution. V. 54. P. 987–997.
Bateman A.J., 1948. Intra-sexual selection in Drosophila // Heredity. V. 2. P. 349–368.
Bonaduce G., Danielopol D.L., 1988. To see and not to be seen: The evolutionary problems of the Ostracoda Xestoleberididae // Developments in Palaeontology and Stratigraphy. V. 11. P. 375–398.
Cohen A.C., 1989. Comparison of myodocopid ostracodes in two zones of the Belize barrier reef near Carrie Bow Cay with changes in distribution 1978–1981 // Bull. Mar. Sci. V. 45. P. 316–337.
Cohen A.C., Morin J.G., 1990. Patterns of reproduction in ostracodes: A review // J. Crustac. Biol. V. 10. P. 184–211.
Darwin Ch., 1859. On the Origin of Species (1st ed.). Chapter 4. 88 p.
Darwin Ch., 1871. The Descent of Man, and Selection in Relation to Sex. V. 2. L.: Murray. 475 p.
Fisher R.A., 1930. The Genetical Theory of Natural Selection. Oxford: Clarendon Press. 308 p.
Forel M.B., Crasquin S., Chitnarin A., Angiolini L., Gaetani M., 2015. Precocious sexual dimorphism and the Lilliput effect in Neo-Tethyan Ostracoda (Crustacea) through the Permian–Triassic boundary // Palaeontology. V. 58. № 3. P. 409–454.
Fraiser M.L., Bottjer D.J., 2007. Elevated atmospheric CO2 and the delayed biotic recovery from the End-Permian extinction // Palaeogeogr. Palaeoclimatol. Palaeoecol. V. 252. P. 164–175.
Futuyma D.J., 2005. Evolution. Sunderland, Massachusetts: Sinauer & Associates. 603 p.
Hamilton W.D., 1967. Extraordinary sex ratios // Science. V. 156. № 3774. P. 477–488.
Harvey T.H., Vélez M.I., Butterfield N.J., 2012. Exceptionally preserved crustaceans from western Canada reveal a cryptic Cambrian radiation // Proc. Natl. Acad. Sci. V. 109. № 5. P. 1589–1594.
Hayami I., 1998. Ecology of mass extinctions: The diversity and shell size of bivalves through time // Fossils. V. 52. P. 38–44. [in Japanese]
Henningsmoen G., 1965. On certain features of palaeocope ostracodes // Geologiska Föreningen i Stockholm Förhandlingar. V. 86. № 4. P. 329–394.
Horne D.J., Danielopol D.L., Martens K., 1998. Reproductive behavior // Sex and Parthenogenesis / Ed. Martens K. Leiden: Backhuys Publishers. P. 157–196.
Horne D.J., Cohen A., Martens K., 2002. Taxonomy, morphology and biology of Quaternary and living Ostracoda // The Ostracoda: Applications in Quaternary Research. V. 131. Washington: American Geophysical Union. P. 5–36.
Howe H.V., Kesling R.V., Scott H.W., 1961. Morphology of living Ostracoda // Treatise on Invertebrate Paleontology. Part Q. Arthropoda 3. Lawrence, Kansas: Geol. Soc. of America and Univ. of Kansas Press. P. 3–19.
Jaanusson V., 1985. Functional morphology of the shell in platycope ostracodes – a study of arrested evolution // Lethaia. V. 18. № 1. P. 73–84.
Jones A.G., Avise J.C., 2001. Mating systems and sexual selection in male-pregnant pipefishes and seahorses: Insights from microsatellite-based studies of maternity // J. Heredity. V. 92. № 2. P. 150–158.
Kamiya T., 1988. Different sex-ratios in two recent species of Loxoconcha (Ostracoda) // Senckenbergiana Lethea. V. 68. P. 337–345.
Karanovic I., 2012. Recent Freshwater Ostracods of the World: Crustacea, Ostracoda, Podocopida. Springer Science & Business Media. 608 p.
Knell R.J., Naish D., Tomkins J.L., Hone D.W., 2013. Sexual selection in prehistoric animals: Detection and implications // Trends Ecol. Evol. V. 28. № 1. P. 38–47.
Leighton L.R., Schneider C.L., 2008. Taxon characteristics that promote survivorship through the Permian–Triassic interval: Transition from the Paleozoic to the Mesozoic brachiopod fauna // Paleobiology. V. 34. P. 65–79.
Malz H., 1958. Die Gattung Macrodentina und einige andere Ostracoden-Arten aus dem Oberen Jura von NW-Deutschland, England und Frankreich // Abhandlungen Senckenbergischen Naturforschenden Gesellschaft. V. 497. P. 1–67.
Martins M.J.F., 2019. Adult sex-ratio in ostracods and its implications for sexual selection // Invertebr. Reprod. Dev. V. 63. № 3. P. 1–11.
Martins M.J.F., Hunt G., Lockwood R., Swaddle J.P., Horne D.J., 2017. Correlation between investment in sexual traits and valve sexual dimorphism in Cyprideis species (Ostracoda) // PLoS One. V. 12. № 7. P. 1–19.
Martins M.J.F, Puckett T.M., Lockwood R., Swaddle J.P., Hunt G., 2018. High male sexual investment as a driver of extinction in fossil ostracods // Nature. V. 556. P. 366–369.
Matzke-Karasz R., Smith R.J., Symonova R., Miller C.G., Tafforeau P., 2009. Sexual intercourse involving giant sperm in Cretaceous ostracode // Science. V. 324. № 5934. P. 1535.
Matzke-Karasz R., Neil J.V., Smith R.J., Symonová R., Mořkovský L. et al., 2014. Subcellular preservation in giant ostracod sperm from an early Miocene cave deposit in Australia // Proc. Roy. Soc. B. Biol. Sci. V. 281. № 1786. P. 1–9.
McGregor D.L., Kesling R.V., 1969. Copulatory adaptations in ostracods. Part II. Adaptations in living ostracods // Contributions from the Museum of Paleontology. Ann Arbor: The Univ. of Michigan. P. 221–239.
McNamara K.J., 2012. Heterochrony: The evolution of development // Evol. Educ. Outreach. V. 5. № 2. P. 203–218.
Melnikova L.M., Siveter D.J., Williams M., 1997. Cambrian Bradoriida and Phosphatocopida (Arthropoda) of the Former Soviet Union // J. Micropalaeontol. V. 16. № 2. P. 179–191.
Miller G.T., Pitnick S., 2002. Sperm-female coevolution in Drosophila // Science. V. 298. № 5596. P. 1230–1233.
Moore R.C., 1961. Treatise Part Q, Arthropoda 3 – Crustacea, Ostracoda. Lawrence, Kansas: Geol. Soc. of America and Univ. of Kansas Press. 442 p.
Morin J.G., Cohen A.C., 2010. It’s all about sex: Bioluminescent courtship displays, morphological variation and sexual selection in two new genera of Caribbean ostracodes // J. Crustac. Biol. V. 30. № 1. P. 56–67.
Neale J.W., Kilenyi T.I., 1961. New species of Mandelstamia (Ostracoda) from the English Mesozoic // Palaeontology. V. 3. P. 439–449.
Nowak H., Harvey T.H., Liu H.P., McKay R.M., Servais T., 2018. Exceptionally preserved arthropodan microfossils from the Middle Ordovician Winneshiek Lagerstätte, Iowa, USA // Lethaia. V. 51. № 2. P. 267–276.
Okubo I., 1979. Five Species of Callistocythere (Ostracoda) from the Inland Sea of Seto // Res. Crustacea. V. 9. P. 13–25.
Ozawa H., 2013. The history of sexual dimorphism in Ostracoda (Arthropoda, Crustacea) since the Palaeozoic // Sexual Dimorphism. Rijeka, Croatia: Tech. P. 51–80.
Pokorný V., 1998. Ostracodes // Introduction to Marine Micropaleontology. N.Y.: Elsevier Science. P. 109–149.
Polilov A.A., 2016. At the size limit-effects of miniaturization in insects. Cham, Germany: Springer. 325 p.
Rivera A.S., Oakley T.H., 2009. Ontogeny of sexual dimorphism via tissue duplication in an ostracod (Crustacea) // Evol. Develop. V. 11. № 2. P. 233–243.
Rivers T.J., Morin J.G., 2008. Complex sexual courtship displays by luminescent male marine ostracods // J. Exp. Biol. V. 211. P. 2252–2262.
Schornikov E.I., Tsareva O.A., 2002. Heterochrony in shell sculpture development within the ostracode genus Hemicythere // Russ. J. Mar. Biol. V. 28. № 1. P. 7–18.
Scott H.W., Wainwright J., Moore R.C., 1961. Dimorphism of Ostracoda // Treatise on Invertebrate Paleontology. Arthropoda 3. Ostracoda. Lawrence, Kansas: Geol. Soc. of America and Univ. of Kansas Press. P. 37–43.
Shaw R.F., Mohler J.D., 1953. The selective significance of the sex ratio // Am. Nat. V. 87. № 837. P. 337–342.
Shurupova Ya.A., Tesakova E.M., 2019. Species interrelatedness in the genus Lophocythere Silvester-Bradley, 1948 (Ostracoda) in the Late Callovian of the Russian Plate // Paleontol. J. V. 53. № 9. P. 54–59.
Siveter D.J., Sutton M.D., Briggs D.E., Siveter D.J., 2003. An ostracode crustacean with soft parts from the Lower Silurian // Science. V. 302. № 5651. P. 1749–1751.
Siveter D.J., Tanaka G., Farrell U.C., Martin M.J., Siveter D.J., Briggs D.E., 2014. Exceptionally preserved 450-million-year-old Ordovician ostracods with brood care // Curr. Biol. V. 24. № 7. P. 801–806.
Song H.J., Tong J., Chen Z.Q., Yang H., Wang Y.B., 2011. End-Permian mass extinction of foraminifers in the Nanpanjiang Basin, South China // J. Paleontol. V. 83. P. 718–738.
Speiser D.I., Lampe R.I., Lovdahl V.R., Carrillo-Zazueta B., Rivera A.S., Oakley T.H., 2013. Evasion of predators contributes to the maintenance of male eyes in sexually dimorphic Euphilomedes ostracods (Crustacea) // Integr. Comp. Biol. V. 53. P. 78–88.
Tesakova E.M., 2013a. Ostracods of the genus Palaeocytheridea Mandelstam in the Middle and Upper Jurassic of Europe: 1. Development of ideas on the content of the genus and the results of its revision // Paleontol. J. V. 47. № 3. P. 256–271.
Tesakova E.M., 2013b. Ostracods of the genus Palaeocytheridea Mandelstam in the Middle and Upper Jurassic of Europe: 2. Description of taxa // Paleontol. J. V. 47. № 5. P. 485–494.
Tsukagoshi A., 1994. Natural history of the brackish-water ostracode genus Ishizakiella from East Asia: Evidence for heterochrony // J. Crustac. Biol. V. 14. P. 295–313.
Tsukagoshi A., 2007. Chapter 2: Geobiological history perused by researches for Ostracoda // Diversity of Organisms, Organism Science in the 21th Century. Series 2 / Eds Katakura H., Mawatari S. Tokyo: Baifukan. P. 37–70. [in Japanese]
Tsukagoshi A., Kamiya T., 1996. Heterochrony of the ostracod hingement and its significance for taxonomy // Biol. J. Linn. Soc. V. 57. P. 343–370.
Vannier J., Williams M., Alvaro J.J., Viscaïno D., Monceret S., Monceret E., 2005. New Early Cambrian bivalved arthropods from southern France // Geol. Mag. V. 142. P. 751–763.
Whatley R.C., Stephens J.M., 1977. Precocious sexual dimorphism in fossil and recent Ostracoda // Aspects of Ecology and Zoogeography of Recent and Fossil Ostracoda. Hague: Junk. P. 69–91.
Wilkinson I.P., Kolpenskaya N.N., Whatley R.C., 1998. The temporal and spatial distribution of Mandelstamia, with particular emphasis on the Kimmeridgian and Volgian // Bull. Cent. Rech. Explor. Prod. Elf. V. 20. P. 329–345.
Williams M., Siveter D.J., Popov L.E., Vannier J.M.C., 2007. Biogeography and affinities of the bradoriid arthropods: Cosmopolitan microbenthos of the Cambrian seas // Palaeogeogr. Palaeoclimatol. Palaeoecol. V. 248. P. 202–232.
Wischer C.A., 1957. Die Gattung Gomphocythere in Nordwesdeutschland und das Problem der brackischen Ostracoden // Micropaleontology. V. 3. № 3. P. 269–275.
Yamaguchi T., Honda R., Matsui H., Nishi H., 2017. Sexual shape dimorphism and selection pressure on males in fossil ostracodes // Paleobiology. V. 43. № 3. P. 407–424.
Yang Z.Y., Wu S.B., Yin H.F., Xu G.R., Zhang K.X., Bi X.M., 1993. Permo-Triassic Events of South China. Beijing: Geol. Publ. House. 153 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


