Журнал общей биологии, 2020, T. 81, № 5, стр. 323-341
Гнетовые и нимфейные как модели в сценарии становления морфотипа цветковых
Павел П. Гамбарян 1, А. Н. Кузнецов 2, *
1 Институт ботаники НАН РА
0063 Ереван, ул. Ачарян, 1, Армения
2 Палеонтологический институт им. А.А. Борисяка РАН
117647 Москва, ул. Профсоюзная, 123, Россия
* E-mail: sasakuzn@mail.ru
Поступила в редакцию 21.09.2019
После доработки 14.06.2020
Принята к публикации 21.06.2020
Аннотация
Знание филогенетических взаимосвязей семенных растений, полученное недавно молекулярно-генетическими методами, не раскрывает, однако, стадий формирования базового морфотипа цветковых растений в эволюции. Эта задача может быть решена путем морфофункционального моделирования первых шагов формирования цветкового растения на основании подходящих морфотипов, существующих в современной флоре, вне зависимости от их генетического родства. Например, гнетовые примыкают на филогенетическом древе к хвойным, но р. Gnetum известен большим числом конвергентных черт с покрытосеменными и потому может быть использован в качестве модели морфологического состояния предка покрытосеменных. Морфологический анализ имеющихся данных показывает, что истинный предок покрытосеменных должен был отличаться от Gnetum по ряду важных показателей, как то: имел более примитивную ксилему и обоеполые фруктификации. В качестве “мостика”, соединяющего это предковое состояние с полноценным цветковым растением, требуется промежуточная водная стадия, моделируемая кувшинками. Опять же, эта промежуточная стадия отличалась от современных кувшинок в некоторых принципиальных отношениях, как то: сохраняла камбий и имела маленькие цветки. Предполагается, что только на этой водной стадии мог появиться околоцветник с венчиком, поскольку он расточителен с точки зрения водоснабжения. В сценарии используется концепция мегаспороносного побега, которая альтернативна более распространенной концепции мегаспороносного листа.
Существуют разные аспекты происхождения цветковых. Их как минимум три: 1) генеалогический аспект – родственные взаимосвязи между цветковыми и другими современными группами семенных растений – уже вполне раскрыт молекулярными методами: предок цветковых в равной степени далек от всех современных групп голосеменных, образующих по отношению к цветковым вполне монолитную сестринскую группу; 2) морфологический аспект – какие структурные трансформации дали архетип цветковых – рассмотрение проблемы с этой стороны восходит к Urpflanze Гете; 3) экологический аспект – за счет чего комплекс отличительных черт и многообразие форм цветковых развились в палеонтологической летописи так быстро, что Дарвин назвал его “ужасной загадкой” – ужасной в том смысле, что она выглядит почти как сальтация, которую Дарвин не признавал (Friedman, 2009).
Все эти аспекты взаимосвязаны, но не очень жестко. Так, реконструкция родственных связей не слишком помогла ответить на два других вопроса. Решению морфологического и отчасти экологического вопроса и посвящена настоящая статья.
Молекулярные заключения о родственных связях цветковых отнюдь не позволяют представить себе эволюционный процесс их формирования как целостного функционирующего организма, т.е. как жизненной формы. Чтобы решить его, нужно либо найти (и опознать!) настоящего ископаемого предка, либо предложить сценарий морфологического становления группы на основании рецентных форм. Попробуем развить сценарий становления цветковых на основании анализа их морфологических свойств, реконструировать биологически осмысленную последовательность их возникновения.
Первые шаги на пути создания развиваемой здесь морфологической теории сделаны уже давно (Гамбарян, 1970, 1975). Тогда еще не было молекулярных методов реконструкции филогении живых организмов, и вопросы как родства, так и формирования тех или иных форм в эволюции решались исключительно с использованием морфологических (фенотипических) данных. Многие ботаники в ХХ в. (в том числе: Веттштейн, 1912; Гамбарян, 1975; Nixon et al., 1994; Taylor, Hickey, 1996) придерживались “гнетовой теории” – считали, что прямым предком цветковых мог быть какой-то неизвестный науке представитель гнетовых (оболочкосеменных), предшествовавший им во времени. Основанием тому было общеизвестное сходство с цветковыми по принципиально важным морфологическим чертам именно гнетовых, и в особенности самого р. Gnetum – сходство многостороннее и не достигнутое ни в каких других группах известных голосеменных. Предполагавшийся гнетовый предок цветковых должен был жить в юрском периоде, хотя сам р. Gnetum не был известен в ископаемом состоянии; нет таких находок и сейчас (Won, Renner, 2006). Теперь известен среднеюрский р. Protognetum, комбинирующий вегетативные черты строения эфедровых с репродуктивными гнетовых (Yang et al., 2017).
Противники гнетовой теории считали черты морфологического сходства Gnetum с примитивными цветковыми результатом параллельного или конвергентного развития. Молекулярные подтверждения этому стали появляться уже в конце ХХ в. (Goremykin et al., 1996; Hansen et al., 1999). По прочитанным участкам ДНК гнетовые располагаются глубоко внутри филогенетического древа голосеменных, среди которых наиболее близкородственны хвойным (гнепиновая теория) (Bowe et al., 2000; Chaw et al., 2000). Таким образом, они не ближе к цветковым, чем хвойные или любые другие современные голосеменные, а морфологическое сходство Gnetum с цветковыми – результат конвергенции.
Поскольку морфологическую проблему происхождения цветка обычно недостаточно четко отделяют от филогенетической проблемы происхождения цветковых, то молекулярные данные о положении Gnetum и гнетовых вообще внутри филогенетического древа голосеменных ошибочно принимают за окончательный аргумент против его использования в качестве модели первичного плана строения фруктификации цветковых (Соколов, Тимонин, 2007). В процитированной работе выражается надежда, что Gnetum может быть реабилитирован в качестве морфологического прообраза цветковых, но только если его генетическая близость с хвойными окажется мнимой, а такая ошибка могла бы возникнуть из-за недоступности молекулярных данных по множеству полностью вымерших групп голосеменных (Соколов, Тимонин, 2007). Однако Койро с соавторами (Coiro et al., 2018) показывают, что палеонтологические данные тоже говорят против родства гнетовых с цветковыми, т.е. в пользу их морфологической конвергенции.
Тем не менее Gnetum остается наилучшей во всей современной флоре морфологической моделью предка цветковых. А его положение внутри голосеменных ни в коей мере не исключает его использования в качестве морфологической модели, если даже имеющиеся сходства с гипотетическим предком цветковых возникли независимо. А если глубокое неродственное сходство примитивных цветковых и Gnetum конвергентно, тогда оно, скорее всего, возникло в результате сходных адаптаций. Таким образом, если рассмотреть Gnetum как морфологическую модель предка цветковых, то гнетовая теория получает новый смысл. Особое значение приобретают недостатки Gnetum в качестве такой модели – те морфологические особенности Gnetum, которые препятствуют его рассмотрению в качестве прообраза предка цветковых, так сказать Urangiospermen в смысле Гете. Уже сам Гете обратил внимание на интересность цветка кувшинки для теоретической морфологии, и именно кувшинковые, с нашей точки зрения, восполняют недостатки Gnetum и могут служить моделью следующей стадии морфологической эволюции цветковых. Ниже под “морфотипом нимфейных” мы будем понимать организацию кувшинковых в широком смысле (т.е. Nymphaeaceae в узком смысле вместе, с Cabombaceae). Говорить о “морфотипе кувшинкоцветных”, т.е. порядка Nymphaeales в целом, не получится из-за морфологически атипичного семейства гидателловых (Hydatellaceae). Долгое время их относили к однодольным как крайне специализированные водные травы, и только недавно в них удалось молекулярными методами распознать кувшинкоцветных (Saarela et al., 2007). В том же году нашлись и тонкие морфологические подтверждения (Rudall et al., 2007).
По молекулярным данным среди всех современных цветковых “линия” кувшинкоцветных действительно обособилась от общего ствола филогенетического древа очень рано (см. обзор Doyle, 2012). Раньше них – только Amborella. Но в плане морфологической эволюции общего плана строения цветковых очередность филогенетических ответвлений не столь уж важна – важнее, в какой ветви до наших дней полнее сохранился набор морфологических и экологических признаков того предка, от которого в меловом периоде пошли разные направления специализации цветковых. Палеонтологические находки подтверждают, что среди остатков мелового периода кувшинкоцветные действительно опознаются наиболее определенно (Friis et al., 2001, 2009), наряду с хлорантовыми (Doyle, 2012). То есть они рано оформились морфологически до того состояния, в котором дожили и до наших дней. На наш взгляд (подробности будут изложены далее), все цветковые, включая Amborella, прошли кувшинкоподобную водную стадию. Исследователи молекулярных основ развития растений тоже склоняются к тому, что модельный объект, олицетворяющий примитивное цветковое, нужно выбирать из числа кувшинковых (Povilus et al., 2015). Предполагается даже, что именно генетическое исследование нимфейных позволит разрешить ту самую “ужасную загадку” Дарвина о неожиданно резком появлении первых цветковых во времени и пространстве (Chen et al., 2017).
Тем не менее специальное сравнительно-морфологическое рассмотрение гнетовых и нимфейных “в одной связке” обойдено вниманием ботаники. Попробуем показать, что тех и других можно рассмотреть как модели первых двух шагов морфологической эволюции цветковых. Ясный приспособительный смысл многих специфических морфологических особенностей гнетовых и нимфейных позволит затем дать экологическую интерпретацию морфологической реконструкции. Данный подход к построению эволюционно-морфологических сценариев среди его многочисленных противников уничижительно именуется “adaptive storytelling”, т.е. рассказыванием сказок об адаптациях. Вместо этого предлагается подход, который можно было бы симметрично назвать “parsimony storytelling”, т.е. рассказыванием сказок, экономящих мышление. Применительно к рассматриваемой проблематике альтернатива выглядит примерно следующим образом. Анализ морфологии цветковых с адаптационистских позиций наводит на мысль, что все они прошли в начале своей эволюции стадию кувшинки и лишь потом вышли на сушу. Из этого, в сочетании с известным уже древом генетического родства цветковых, в частности, вытекает, что выход на сушу из кувшинковидного состояния был независимо осуществлен Amborella и прочими цветковыми. Принцип парсимонии работает против подобных повторных событий. К тому же выход из водной среды на сушу среди цветковых растений вообще встречается редко – если уж цветковое растение уходит в воду, то обычно безвозвратно. Так что будет неэкономным мыслить выход цветковых из воды в самом начале их эволюции. Налицо принципиальное противостояние, заключающееся не только в конкретных выводах об эволюционно-морфологическом сценарии, но и, что намного важнее, в методологической основе. Так, “adaptive storytelling” исходит из проникновения во внутреннюю логику строения объекта, а “parsimony storytelling” опирается на распространение тех или иных прецедентов по эволюционному древу. Второй метод построения эволюционно-морфологических сценариев сейчас более популярен, но он и более поверхностен. К тому же он, в нарушение самого принципа парсимонии, предполагает некоторую дополнительную скрытую сущность – взаимосвязь вероятности эволюционных событий в разных ветвях эволюционного древа. Материальная основа такой взаимосвязи весьма туманна. В нашем случае она формулировалась бы так: цветковые растения не имеют обыкновения выходить из воды на сушу. Но используемая здесь методология “adaptive storytelling” не может отказать им в такой возможности.
ОСНОВНЫЕ МОРФОЛОГИЧЕСКИЕ ЧЕРТЫ ГИПОТЕТИЧЕСКОГО ПРЕДКА ЦВЕТКОВЫХ И ИХ НАЛИЧИЕ У GNETUM
Список морфологических черт, которыми должен был характеризоваться гипотетический предок цветковых, достаточно хорошо устоялся еще до появления молекулярных методов, перевернувших представления о родственных связях между семенными растениями. Не претендуя на полный охват этого списка, перечислим те основные черты, которые в дальнейшем составят основу эволюционно-морфологического сценария, и пометим, какие из этих черт есть у Gnetum, а каких нет.
1. Протоцветок должен был быть обоеполым. В современной флоре из рано обособившихся цветковых эта черта характерна для большинства кувшинкоцветных (кроме четырех двудомных видов гидателловых). У еще раньше обособившейся Amborella цветки раздельнополые, но вторично (Sauquet et al., 2017). Раздельнополые фруктификации имеют и все современные гнетовые; в мужских фруктификациях присутствуют семяпочки, но они в норме бесплодны и служат только для выделения нектара, так что можно говорить о функциональной раздельнополости. У хвойных, с которыми гнетовые связаны наиболее близким родством, обоеполые фруктификации встречаются только в качестве аномалии (Flores-Rentería et al., 2011). Среди голосеменных обоеполые фруктификации были только у части беннеттитов.
2. В семяпочке нуцеллус должен был быть покрыт поверх интегумента еще одной добавочной оболочкой, как обычно бывает у современных цветковых. Аналогично интегумент и одна или две добавочных оболочки присутствуют у гнетовых (Maheshwari, 1935; Martens, 1971). Чтобы отразить наличие этих добавочных оболочек гнетовых, их еще называют оболочкосеменными (Chlamy-dospermae) – это слово позволяет и обозначить их отличие от остальных голосеменных, имеющих вокруг нуцеллуса только интегумент, и не смешать терминологически с покрытосеменными.
3. Женский гаметофит должен был быть уже значительно редуцирован. В частности, архегонии должны были быть утрачены, как у всех без исключения цветковых, а также у Gnetum и Welwitschia (из гнетовых только у Ephedra сохраняются архегонии, свойственные голосеменным). Редукция женского гаметофита – это и экономия материала, и, главное, ускорение цикла развития за счет укорочения временного интервала между спорой и семенем (аналогично переходу насекомых от развития с метаморфозом к прямому развитию). У современных цветковых женский гаметофит в большинстве случаев образуется всего тремя митозами (получается восемь гаплоидных ядер), а иногда даже меньше (среди нимфейных встречается два митоза и четырехклеточный гаметофит; Williams, Friedman, 2002). У Gnetum к моменту оплодотворения в гаметофите происходит как минимум восемь митозов (получается 256 ядер) (Thompson, 1916; Тахтаджян, 1964). Эта, казалось бы, небольшая разница приводит к принципиальному выигрышу цветковых в скорости развития, потому что у них зародыш начинает формироваться одновременно с накоплением его пищевого запаса (оплодотворенного одновременно с яйцеклеткой вторичного эндосперма). Напротив, у голосеменных сперва начинает формироваться запас (гаметофит, он же первичный эндосперм), и только потом – зародыш. Это характерно и для Gnetum, но с некоторым сдвигом в сторону цветковых: лишь небольшая часть запаса формируется до образования зародыша (Friedman, Carmichael, 1996; Carlquist, 2012).
4. Пыльцевая трубка должна была доставлять спермии прямо к яйцеклеткам (сифоногамия). В современной флоре это присуще всем цветковым, а кроме того, Gnetum и другим высшим голосеменным (Имс, 1964). Адаптивное значение состоит в надежности оплодотворения.
5. У предка цветковых должно было быть двойное оплодотворение. Продукт второго оплодотворения – эндосперм, точнее говоря вторичный эндосперм, если первичным эндоспермом называть гаплоидный женский гаметофит голосеменных. У предка цветковых вторичный эндосперм, скорее всего, был не триплоидным (один набор хромосом с отцовской стороны, и два – с материнской), как у подавляющего большинства современных цветковых, а диплоидным (по одному набору хромосом от каждого родителя), как у Nymphaeales, а также у Austrobaileyales (Винтер, Шамров, 1991; Williams, Friedman, 2002; Friedman, Ryerson, 2009). Двойное оплодотворение с образованием двух идентичных диплоидных зигот имеет место у представителей двух родов гнетовых – Ephedra и Gnetum (Friedman, 1998). Однако, в отличие от кувшинкоцветных, вторая зигота этих гнетовых не дает эндосперм, а начинает развиваться как зародыш-близнец, но рано или поздно абортируется. Питательную часть семени образует женский гаметофит (первичный эндосперм), причем у Ephedra он формируется в основном до оплодотворения (и даже имеет архегонии, как у не-гнетовых голосеменных), а у Gnetum гаметофит дозревает уже после оплодотворения. Примерно такое же запаздывание наблюдается и у Welwitschia, но она вторично утратила двойное оплодотворение, хотя один возможный случай был зарегистрирован (Friedman, 2015).
6. Лист должен был быть простым с перистосетчатым жилкованием. Такой лист практически не претерпел изменений в ходе длительной эволюции цветковых и сохранился вплоть до многих самых высших их представителей, будучи универсальным – пригодным в широком спектре экологических условий. Простой лист с перистосетчатым жилкованием характерен также для Gnetum, чем этот род выделяется не только среди голосеменных вообще, но и среди гнетовых в частности (Тахтаджян, 1956). Более того, среди всех высших растений средняя “густота” проводящих пучков в листе превышает 5 погонных миллиметров на 1 квадратный миллиметр площади листа только у цветковых (большинства) и Gnetum; эта величина свидетельствует о высоких скоростях как транспирации, так и ассимиляции (Boyce et al., 2009). Существенно также сходство материала листьев цветковых и Gnetum, имеющее широкие экологические последствия: в отличие от хвои, такие листья охотно употребляют в пищу самые разные животные. Листья Gnetum – традиционная пища африканских народов (Ingram, 2010). Листья других голосеменных употребляются животными в пищу весьма ограниченно; редкий случай – специализированное питание сосновой и еловой хвоей у глухарей Tetrao urogallus в зимний период, когда другого корма нет. Предполагалось даже, что первой листвой, которую стали употреблять в пищу насекомые, была листва цветковых, а на листву других растений интересы насекомых распространились позже (Пономаренко, 1998). Однако по более новым данным листоедение среди насекомых появилось все же до цветковых растений (Labandeira, Currano, 2013).
7. Важным приобретением цветковых являются настоящие сосуды во вторичной ксилеме. Однако их присутствие у самых первых цветковых находится под вопросом, потому что их нет ныне у обеих наиболее рано обособившихся групп. У Amborella сосудов нет вовсе, а у нимфейных обнаружены различные переходные формы проводящих элементов между трахеидами и сосудами (Carlquist, Schneider, 2002). Зато сосуды имеются у всех гнетовых – это самое существенное их вегетативное приобретение по сравнению со всеми другими голосеменными. Из трех родов сосуды лучше всего развиты у Gnetum (Carlquist, 2012), очевидно, в связи с развитием уже упоминавшихся широких листьев, а кроме того потому, что большинство видов этого рода – лианы.
Надо сказать, что морфологические конвергенции цветковых с гнетовыми по мере изучения оказываются все разностороннее и глубже. Наблюдаются параллельные ряды изменчивости – и по анатомии ксилемы (Muhammad, Sattler, 1982), и по спорам (Tekleva, Krassilov, 2009), и по анатомии листа (Паутов, Пагода, 2015). Н.И. Вавилов назвал бы это гомологическими рядами (как в химии), С.В. Мейен – рефренами (как в музыке), а мы ограничимся скупым сравнительно-анатомическим термином “аналогия” sensu Richard Owen.
Однако между цветковыми и гнетовыми имеются и принципиальные морфологические различия, которые приходится учитывать при реконструкции строения предка цветковых.
ОСНОВНЫЕ МОРФОЛОГИЧЕСКИЕ ОТЛИЧИЯ GNETUM ОТ ГИПОТЕТИЧЕСКОГО ПРЕДКА ЦВЕТКОВЫХ
Многие различия гнетовых и цветковых сведены в работе Фриис и Эндресса (Friis, Endress, 1990, р. 150), а также Филда и Балана (Feild, Balun, 2008, р. 666). Но для нашего дальнейшего рассмотрения интереснее всего следующие три.
1. Современные гнетовые имеют раздельнополые фруктификации, более того, они – двудомные.
2. Семяпочка Gnetum со всеми ее тремя интегументами не заключена в замкнутую полость типа завязи; нет пестика с рыльцем, так что пыльца оседает на микропиле, находящемся на конце вытянутого в трубочку внутреннего интегумента (интегумента sensu stricto), выделяющего капельку нектара для улавливания пыльцы.
3. Во вторичной ксилеме Gnetum сосуды имеют точечные перфорации или простые, образованные опять же из точечных (Carlquist, 1996). Напротив, у примитивных цветковых, когда у них есть вторичная ксилема, а в ней сосуды (в этом отношении выпадают из рассмотрения как Amborella, так и нимфейные), то перфорации этих сосудов лестничные. Кроме того, окаймленные поры в трахеидах всех гнетовых, включая Gnetum, имеют торус (Мухаммед и Сэттлер (Muhammad, Sattler, 1982) ошибочно утверждают обратное). Торус является характерным прогрессивным достижением хвойных. Работая как клапан, он позволяет изолировать воздушные пузырьки в трахеидах, удерживая целостность водяного столба. Но среди цветковых торус формируется лишь иногда – вторично и независимо в нескольких ветвях (Carlquist, 2012). Цитируемый автор приходит к важнейшему выводу, что ксилема гнетовых сочетает все преимущества, имеющиеся у хвойных и цветковых. Не имея такого выгодного механизма, как торус, цветковые имеют другое преимущество, более общего стратегического характера – эволюционную лабильность в плане смены зрелого типа древесины на ювенильную и обратно (Carlquist, 2009).
ЭЛЕМЕНТЫ ЭВОЛЮЦИОННО-МОРФОЛОГИЧЕСКОГО СЦЕНАРИЯ
1. ОБОЕПОЛОСТЬ ЦВЕТКА/СТРОБИЛА: GNETUM ПРОТИВ БЕННЕТТИТОВ
Одним из самых существенных возражений против гнетовой теории происхождения цветковых была уже упоминавшаяся раздельнополость фруктификаций современного Gnetum и гнетовых вообще. Этого важного недостатка лишена беннеттитовая теория происхождения цветковых (Arber, Parkin, 1907; Zimmermann, 1959; Мейен, 1986; Meyen, 1988), так как у беннеттитовых родов Williamsoniella и Cycadeoidea функционировали обоеполые стробилы – большая редкость среди голосеменных. При использовании таких обоеполых стробилов в качестве морфологической модели обоеполого цветка предка цветковых возникают топологические трудности. У беннеттитов микроспорангии располагаются на адаксиальной поверхности микроспорофиллов, которые венчиком окружают верхушку спороносного побега, на которой располагаются мегаспорангии под плотным покровом из межсеменных чешуй. Они располагаются, можно сказать, апикально, в отличие от микроспорангиев. Напротив, у цветковых имеет место иное: и нуцеллус с внутренним интегументом располагается на адаксиальной стороне наружного интегумента (Doyle, 2006), и семяпочка (нуцеллус вместе с обоими интегументами) сидит на адаксиальной стороне плодолистика, никогда не апикально “на стебле” (Endress, 2019). Таким образом, что ни прими за мегаспорангий – нуцеллус с одним лишь внутренним интегументом или с обоими, – его положение на мегаспорофилле (в первом случае представленном наружным интегументом, во втором – плодолистиком) оказывается таким же адаксиальным, как у микроспорангиев на микроспорофиллах беннеттитовых. Из этого сходства С.В. Мейен (Мейен, 1986; Meyen, 1988) вывел теорию сальтационной гамогетеротопии – переноса принципа адаксиального расположения спорангиев с микро- на мегаспорофилл. Другой вариант той же идеи – “преимущественно мужская теория” (Frohlich, Parker, 2000), в которой предполагается перерождение микроспорофиллов в мегаспорофиллы в связи с выпадением генов семейства Needle. Две теории подробно сравниваются Д.Д. Соколовым и А.К. Тимониным (2007). В обеих выход мегаспорангиев в адаксиальное положение напоминает фокус, как и всякая сальтация: либо механизм адаксиального формирования микроспорангиев вдруг переносится на мегаспорофилл (вариант Мейена), либо сами мегаспорангии переносятся на микроспорофилл (вариант Фролиха и Паркера). Как справедливо замечают Д.Д. Соколов и А.К. Тимонин (2007), всякое сальтационное преобразование не может быть проверено методами палеоботаники и морфологии. Именно скачкообразное появление цветковых в геологической летописи дало Дарвину основание назвать это событие “ужасной загадкой” или даже “отвратительной тайной”, в зависимости от вкусов переводчика, поскольку противоречило его пониманию эволюции как принципиально плавного процесса (Friedman, 2009). Стоя на дарвиновских позициях (в отличие от придерживавшегося номогенетических воззрений Мейена), мы должны заключить, что допущение сальтации полностью сводит на нет все внешнее изящество теорий гамогетеротопии и “преимущественно мужского происхождения”. Так или иначе, ни одна из них не имеет отношения к обоеполости фруктификации: точно такой же перенос мужского плана строения на мегаспорофилл или мегаспорангиев на микроспорофилл в принципе мог бы происходить и в раздельнополых фруктификациях. Возможно, у двудомных растений это было бы даже легче осуществимо.
Если вернуться к обоеполости цветка как таковой, то беннеттиты потеряли свое преимущество перед гнетовыми в качестве прообраза (модели) предка цветковых, как только были обнаружены “частично” обоеполые стробилы, описанные как древнейший (верхнепермский) макроостаток гнетовых Palaeognetaleana (Wang, 2004; автор разъясняет, что под “частично” он подразумевает, что более половины из примерно 30 собранных шишек имели и мужские, и женские органы). К гнетовым Palaeognetaleana была отнесена главным образом на том основании, что сохранившаяся в этих шишках пыльца оказалась искривленно-складчатой и однобороздной – похожей в современной флоре только на пыльцу Welwitschia. Такая складчатость обеспечивает пыльце при высыхании и набухании аккуратную деформацию по складкам, без внутренних и внешних разрывов (гармомегатная функция) – аналогично складчатому стеблю кактусовых (Mauseth, 2000, 2006). Второй признак менее надежен: утверждается, что нуцеллус семяпочки Palaeognetaleana был “одет” в три оболочки – столько же, сколько имеет современный Gnetum. Сомнительность этого признака заключается в следующем. У современных гнетовых характерным образом только самая внутренняя из оболочек нуцеллуса образует микропиле – она-то и соответствует единственному интегументу других голосеменных, интегументу sensu stricto. Напротив, у Palaeognetaleana все три так называемые оболочки образуют микропиле и потому могут трактоваться иначе – как слои одного единственного интегумента. Так или иначе, добавив к плану строения Gnetum двуполую фруктификацию Palaeognetaleana, мы получим морфологическую модель, еще лучше приближенную к предку цветковых.
Можно добавить, что современный Gnetum иногда образует семена в мужском стробиле, что также свидетельствует о его бывшей обоеполости (Thompson, 1916; Тахтаджян, 1956). К тому же у всех трех родов современных гнетовых встречаются мужские фруктификации со стерильными семяпочками (Thompson, 1916; Mundry, Stützel, 2004; Jörgensen, Rydin, 2015). И хотя эти семяпочки стерильны, их микропиле выделяет такие же капельки нектара, как на нормальных женских фруктификациях, и эти капельки привлекают насекомых (Jörgensen, Rydin, 2015; Ickert-Bond, Renner, 2016). Однако реконструировать функционирующую обоеполую фруктификацию общего предка трех современных родов гнетовых оказывается весьма проблематично, потому что расположение стерильных семяпочек в их мужских фруктификациях трудно свести к единому плану (Mundry, Stützel, 2004; Ickert-Bond, Renner, 2016).
Среди цветковых существует немало растений, сочетающих опыление насекомыми с двудомностью; среди современных голосеменных такая же ситуация характерна для саговников. Однако в целом обоеполость фруктификаций имеет достаточно очевидные преимущества для опыления насекомыми, и поэтому переход современных гнетовых к раздельнополости можно связать с тенденцией к ветроопылению. Такой переход и по той же причине неоднократно происходил в эволюции цветковых, и такие растения становились похожими друг на друга. До некоторых пор их даже объединяли в группу так называемых сережкоцветных (Amentiferae). Именно сережкоцветные считались самыми примитивными цветковыми в первых гнетовых теориях (Веттштейн, 1912) – по сходству формы соцветий со стробилами Gnetum, по раздельнополости и по недоразвитости околоцветника. Позже стало ясно, что предки сережкоцветных были обоеполыми, с цветками, похожими на таковые нимфейных и магнолий, и что сережкоцветные – сборная (немонофилетическая) группа. Раздельнополость их цветка и упрощение околоцветника формировались конвергентно в связи с независимым переходом к ветроопылению.
С учетом обоеполости древних гнетовых, остаются ли у беннеттитов преимущества в качестве модели предка цветковых? Ротвелл с соавторами (Rothwell et al., 2009, table 1 ) представили сводку сходств и отличий беннеттитов и гнетовых, которые можно трактовать как достоинства и недостатки для модели предка цветковых. Беннеттиты проигрывают по листьям. Они были ксероморфными и перистыми, тогда как у Gnetum листья широкие, цельные, с перистосетчатым жилкованием. По древесине беннеттиты скорее выигрывают. Они не имели сосудов, зато в их трахеидах присутствовали не только точечные (как в сосудах у Gnetum), но и лестничные поры.
2. ОПЫЛЕНИЕ
Как уже упоминалось, у всех трех современных родов гнетовых в мужских фруктификациях встречаются стерильные семяпочки, и нектар, выделяемый микропиле, привлекает насекомых (Ickert-Bond, Renner, 2016). Виды Ephedra и Gnetum, не имеющие в мужских фруктификациях нектароносных стерильных семяпочек, опыляются ветром; для Ephedra это определенно показано (Bolinder et al., 2016), для Gnetum – предполагается (Jörgensen, Rydin, 2015). Есть также палеонтологические свидетельства, что еще до появления в геологической летописи цветковых растений некоторые голосеменные юрского периода, и в том числе гнетовые, уже пользовались опылением при помощи насекомых (Ren et al., 2009); в современной флоре это сохранилось у саговников. Голосеменные в качестве стандартной защиты от самоопыления имеют раздельнополые стробилы или даже двудомны. Однако очевидно, что растения с двуполыми фруктификациями (беннеттиты, Palaeognetaleana, гипотетические предки цветковых) могли бы пользоваться насекомыми эффективнее. Вероятный опылитель Williamsoniella – беннеттита с двуполыми фруктификациями – уже найден (Khramov, Lukashevich, 2019). Обоеполость при насекомоопылении выгоднее хотя бы потому, что на каждый комплект мужских и женских образований, когда они сгруппированы, уходит вдвое меньше средств привлечения опылителей – источников нектара, запаха и, на более поздних стадиях становления цветковых, цветных лепестков. Достаточно вспомнить упоминавшиеся стерильные семяпочки, встречающиеся в мужских фруктификациях всех родов современных гнетовых и исполняющие там роль нектарников (Ickert-Bond, Renner, 2016). Расход на содержание этих стерильных семяпочек есть прямая плата за раздельнополость в условиях насекомоопыления. Выигрыш в экономии на средствах привлечения насекомых при обоеполых фруктификациях, конечно, отягощен проигрышем в связи с необходимостью иметь более изощренные механизмы борьбы против самоопыления, но, как показывают современные цветковые, дело того стоит. Итак, растение с обоеполыми фруктификациями получает в лице насекомых мощный вектор для целенаправленного переноса пыльцы, так сказать, узким пучком, в отличие от широкого веера распыления ветром. Насекомоопыление позволяет поддерживать популяцию растений очень низкой плотности, потому что транспорт пыльцы между далеко стоящими растениями осуществляется направленно (Regal, 1977). В свою очередь, разреженное расположение растений – залог быстрого распространения по пригодной для жизни территории. Так что совершенно справедлива (как обычно) идея Дарвина (Friedman, 2009), что им же сформулированная “ужасная загадка” взрывообразного появления и диверсификации цветковых в меловом периоде может быть раскрыта через их изначальную тесную связь и коэволюцию с насекомыми в качестве опылителей (Crepet, 1984).
Итак, насекомые – это вектор для пыльцы, причем особенно эффективный для обоеполых фруктификаций. А на острие этого вектора находится пыльца, способная выпустить по направлению к яйцеклетке пыльцевую трубку. Механизм пыльцевой трубки есть и у гнетовых. Их пыльца оседает на капельку сахаристой жидкости на конце длинной микропилярной трубки, образованной внутренним интегументом семяпочки и выступающей из-под внешней оболочки. Пыльцевое зерно при высыхании капельки пассивно втягивается по микропилярной трубке на дно пыльцевой камеры, а там выпускает пыльцевую трубку к зародышевому мешку в нуцеллусе. Интересный исторический факт: Томпсон (Thompson, 1916) свидетельствовал о прорастании пыльцевых зерен Gnetum в пыльцевой камере. Тем не менее выступающую микропилярную трубку внутреннего интегумента он принял за рыльце пестика, а эти два дополнительных внешних интегумента – за рудименты околоцветника. В целом Томпсон полагал возможным отнести р. Gnetum прямо к покрытосеменным.
Если насекомые приносят пыльцу на такую тонкую микропилярную трубку, то они имеют шанс повредить ее своими неуклюжими движениями. Поэтому в условиях насекомоопыления вполне логичным следующим шагом морфологической эволюции было либо укрепление самой микропилярной трубки (но почему-то в природе такое не встречается), либо образование вокруг семяпочки с ее интимными деталями замкнутой завязи с пестиком на вершине. Крепкий пестик фактически нужен для счесывания пыльцы с насекомого (это и сейчас одна из обычных его функций у множества цветковых), а дальше пыльца сама находит себе дорогу благодаря уже отработанному эволюцией механизму пыльцевой трубки. То, что замкнутая завязь служит для защиты семяпочки, вряд ли когда-либо подвергалось сомнению. Вопрос – от какой опасности она защищает в первую очередь? Исходит ли главная угроза от неуклюжих насекомых-опылителей? А.Л. Тахтаджян (1964) полагал, что защищаться нужно было от челюстей насекомых-консументов. Ли (Li, 1960) в своей экстравагантной теории происхождения цветковых напрямую от красных водорослей полагал, что при выходе из воды на сушу семяпочка приобрела покров для защиты от высыхания. Напротив, П.П. Гамбарян (1975) в первой версии излагаемой здесь гипотезы предлагал трактовать замкнутую завязь как защиту в первую очередь от воды. Первая опасность – смывание пыльцы, пока она находится снаружи на микропилярной трубке. Однако от этого рыльце пестика тоже не защищено. Вторая опасность, которая грозит голосеменным от воды, связана с тем, что у них пыльца, уже попав в пыльцевую камеру, может очень долго прорастать и испортится при попадании туда влаги. Так или иначе, когда семяпочка оказалась покрытой для защиты от одной или нескольких из перечисленных опасностей, растение стало покрытосеменным.
Альтернативный вариант покрытия семяпочек реализован у беннеттитов. Женская (центральная) часть их фруктификации представляет собой сплошной купол из тесно сомкнутых в виде единого щита вершинных расширений межсеменных чешуй. Наружу между ними высовываются лишь самые кончики микропилярных трубок, тогда как “тело” семяпочек полностью спрятано под этим щитом, по-видимому, все с той же целью защиты от насекомых-опылителей. Наличие столь мощной защиты семяпочек исключает потребность в образовании еще одной защиты в виде завязи. Трудно предложить и какой-либо адаптивный смысл для замены одной защиты на другую, поскольку при этом уже проверенная эволюцией защита должна быть разрушена в пользу непроверенной. Это наличие другого типа защиты семяпочек, на наш взгляд, отвергает возможность рассмотрения беннеттитов не только в качестве предка покрытосеменных, но и в качестве модели морфотипа этого предка.
Околоцветник цветковых тоже можно прямо противопоставить его ксероморфному аналогу у беннеттитов. Околоцветник цветковых расходует весьма много воды для поддержания тургора, без которого он потеряет форму и станет бесполезен. Такой околоцветник может характеризовать цветковые как исходно ксерофобные растения (Feild, Arens, 2005; Feild et al., 2009). Можно представить, что ксероморфный “околоцветник” у беннеттитов весьма эффективно защищал спороносные части от высыхания, но ксерофобный околоцветник цветковых мог делать то же самое только ценой больших потерь воды со своей внешней (абаксиальной) поверхности. О большом расходе воды свидетельствуют мощные проводящие пучки, ведущие к элементам околоцветника цветков раннемелового возраста, когда, по-видимому, еще даже не было подразделения на лепестки и чашелистики (Friis et al., 2009). Таким образом, появление околоцветника в целом и дифференциация нежных лепестков в особенности могли скорее состояться в условиях достатка воды, например в таких, в которых сейчас живут нимфейные. Вот почему модели гнетума недостаточно, и нужна модель нимфейных. В данном контексте не столь важно, развился ли околоцветник из стерилизованных проксимальных (базальных) микроспорофиллов или из изначально неспороносных листьев. Более существенны функциональные первопричины. Пожалуй, если отбросить экстравагантный филогенетический аспект уже упомянутой теории Ли (Li, 1960), то можно с ним согласиться, что при жизни на поверхности воды околоцветник мог в первую очередь потребоваться в качестве защиты репродуктивных частей, когда они временно погружались. Околоцветник при этом должен был уже иметь “моторизацию” лепестков, чтобы своевременно замыкаться в подводную воздушную камеру, в которой могли временно запираться и насекомые-опылители. Так поступают с жуками современные нимфейные, и есть палеонтологические свидетельства, что данный механизм использовался и нимфейными конца мелового периода (Gandolfo et al., 2004).
Происхождение полноценного цветка из стробила, таким образом, можно объяснить переходом в воду. Маленький размер цветков меловых нимфейных (Friis et al., 2001, 2009) легко объясним, если принять во внимание, что в начале формирования околоцветника его водоснабжение еще не было достаточно налажено, даже несмотря на то, что все вегетативное тело могло быть погружено в воду. В дальнейшем по мере совершенствования средств подачи воды в венчик цветки укрупнялись (у некоторых современных нимфейных до гигантских размеров). Кроме того, элементы цветка приобретали более сложные функции по принципу смены функций А. Дорна. Например, у околоцветника первичная функция защиты от воды и запирания насекомых-опылителей дополнилась и заменилась функцией их привлечения через зрительный канал опылителя. Во многих условиях цветок дальше виден, чем чувствуется по запаху, а более дальнодействующая приманка усиливает векторизацию опыления, что является преимуществом при естественном отборе.
3. СЦЕНАРИЙ ФОРМИРОВАНИЯ ПЛОДОЛИСТИКА И ЗАВЯЗИ
Проблема становления покрытосемянности, т.е. заключения семяпочки внутрь завязи, обсуждается в литературе давно. Возникает впечатление, что исследователи перебрали уже все логические возможности. Если в отношении тычинок ботаники, по-видимому, пришли к единому мнению, что те так или иначе происходят из спороносных листьев-микроспорофиллов, то в отношении завязи с семяпочками продолжают дебатироваться две принципиально разные альтернативы: либо она тоже происходит из спороносного листа, в данном случае мегаспорофилла, либо же из спороносного побега, который правомерно назвать мегаспорофором. Все теории на этот счет сгруппированы И.И. Шамровым (2008) в три категории: 1) осевые теории, 2) листовые теории и 3) теории новообразования семяпочек на оси (стебле) либо листьях. В действительности то, что И.И. Шамров называет “осевыми теориями”, аккуратнее будет именовать “апикальными теориями”. Эта терминологическая поправка основана на том, что ось, т.е. стебель, при всей своей внешней внушительности является лишь вторичным продуктом развития листьев или элементов цветка в апикальной точке роста (Endress, 2019). Собственно, И.И. Шамров и сам указывает, что в “осевых теориях” нуцеллус представляет точку роста, а интегументы и плодолистик – боковые листовые зачатки. Итак, две главные альтернативы – это листовая теория мегаспорофилла и апикальная теория мегаспорофора (оппортунистического варианта новообразования семяпочек в любом месте мы касаться не будем).
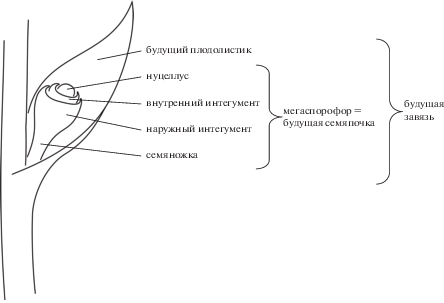
Проблема осложняется еще и тем, что семяпочка покрытосеменных “облачилась” не только плодолистиком, но и вторым интегументом. В итоге их нуцеллус имеет три покрова: первичный внутренний интегумент (только он есть у всех голосеменных), поверх него наружный интегумент, поверх которого еще и плодолистик, замкнувшийся в виде завязи. Первые два покрова имеются, так сказать, персонально у каждой семяпочки, а плодолистик у многих покрытосеменных является общим для нескольких семяпочек. В рамках листовой теории возникает дополнительная сложность: с чем соотнести предполагаемый мегаспорофилл – с наружным интегументом или с плодолистиком? Данные экспрессии генов развития указывают на листовую природу наружного интегумента и даже конкретнее на то, что мегаспорангий (нуцеллус с внутренним интегументом) сидит на адаксиальной стороне наружного интегумента (Gasser, Skinner, 2019). В свою очередь, семяпочка (нуцеллус с обоими интегументами) сидит на абаксиальной стороне плодолистика. Эндресс в самом последнем обзоре о происхождении завязи (Endress, 2019) специально подчеркивает, что у всех известных покрытосеменных семяпочки располагаются именно на плодолистиках и никогда на стеблевых частях. Таким образом, неожиданно получается, что лист сидит на листе – наружный интегумент на плодолистике. Отсюда вытекает, что их можно трактовать как части одного сложного листа, т.е. листочки (Шамров, 2008).
Одним из генетических маркеров листовой природы наружного интегумента был ген INNER NO OUTER (INO), который в вегетативной части растения экспрессируется на абаксиальной стороне обычных листьев (Gasser, Skinner, 2019). В цитируемом обзоре, однако, не дана ссылка на открытие, что у кувшинки Nymphaea этот ген экспрессируется не только в наружном интегументе, но также и во внутреннем интегументе, и даже в нуцеллусе семяпочки (Yamada et al., 2003). Это идет в разрез с листовой теорией завязи, но прекрасно согласуется с апикальной теорией. Действительно, если нуцеллус есть апикальная зона роста мегаспорофора, то она и должна порождать все листоподобные образования. Поскольку нимфейные по многим морфологическим признакам весьма примитивны и стоят у самого основания филогенетического древа покрытосеменных, такая особенность экспрессии гена INO в нуцеллусе вполне может быть наследием предков и отражать первично апикальное происхождение семяпочки, а значит и укреплять гипотезу мегаспорофора в целом. Однако в ходе дальнейшей работы участники открытия выяснили, что у Cabomba, представителя другого семейства нимфейных, ген INO не экспрессируется в нуцеллусе и внутреннем интегументе, проявляясь только в наружном интегументе – как и за пределами кувшинкоцветных, а именно у Arabidopsis (Yamada et al., 2011). На этом основании исследователи, руководствуясь принципом парсимонии, сочли первичным именно это состояние, а распространение экспрессии INO во внутренний интегумент и нуцеллус – новоприобретением Nymphaea. То, что данный факт не попал в обзор Гессера и Скиннера (Gasser, Skinner, 2019), по-видимому, объясняется именно тем, что он был сочтен особенностью узкого значения. Однако, на наш взгляд, его рано сбрасывать со счетов при обсуждении происхождения завязи. Формальный принцип парсимонии может легко повести теорию по ложному пути за счет поверхностного отношения к определению полярности состояний признака. Какое из них примитивное, а какое производное – надо решать через анализ внутренней логики объекта. В рассматриваемом случае можно определенно утверждать, что в ходе эволюции гинецея сходства его частей с листьями, если они и были, неуклонно угасали все более и более. Поэтому легко представить, что этот процесс параллельно и независимо продвигался в одинаковом направлении в разных филумах покрытосеменных. Мы имеем в виду возможность независимой утраты экспрессии INO в нуцеллусе и внутреннем интегументе Cabomba и Arabidopsis, а также каких угодно еще покрытосеменных. Напротив, нет никаких оснований ожидать, что в каком-то филуме не-листовые части гинецея стали, против общей тенденции, в чем-то уподобляться листьям. Мы имеем в виду сомнительность распространения INO во внутренний интегумент и нуцеллус у Nymphaea. Если эта особенность кувшинки в действительности является наследием предков всех покрытосеменных, то апикальная теория происхождения завязи с семяпочкой укрепляет свои позиции, и можно представить мегаспорофор предка как побег в пазухе листа, который станет плодолистиком (рис. 1). Интересно, что очень похожую картину рисуют для семязачатка Gnetum и хвойных на основании экспрессии генов AINTEGUMENTA (Yamada et al., 2008). Просматривается соответствие плодолистика покрытосеменных кроющей чешуе хвойных и наружному интегументу Gnetum, а наружного интегумента покрытосеменных – семенной чешуе хвойных и среднему интегументу Gnetum. Ямада с соавторами (Yamada et al., 2008) трактуют данную конструкцию у Gnetum как терминальную часть побега, а для шишки хвойных – как пазушное образование (в пазухе кроющей чешуи). На рис. 1 изображено такое же пазушное образование мегаспорофора для покрытосеменных, но не исключается и терминальный мегаспорофор.
В пользу предложенной трактовки можно привлечь ряд свидетельств из исследований последних пяти лет. Эндресс (Endress, 2019) склоняется к тому, что семяпочка когда-то не была связана с плодолистиком, но уже на самой ранней стадии эволюции покрытосеменных навсегда с ним связалась по функциональным соображениям. Как кажется, под этот тезис как раз подходит мегаспорофор. Однако по непонятным нам причинам Эндресс отвергает прямое подтверждение тому, что семяпочка соотносится с плодолистиком как пазушная ветвь с листом, полученное на основании уродств в развитии завязи магнолиевого цветка (Zhang et al., 2017). Даже если не доверять тератологическим данным, можно обратиться к нормальному развитию завязи у Illicium, которое тоже показывает, что завязь образуется путем срастания двух частей – “ovule-bearing branch and its subtending leaf-like structure” (Zhang et al., 2019). Онтогенез Illicium может служить иллюстрацией того, как в ходе эволюции происходил постепенный сдвиг пазушного мегаспорофора с апикальной (как у голосеменных, включая гнетовых) семяпочкой из пазухи на основание листа, охватывающего этот побег. Так лист, который ранее был стерильным, становился плодолистиком. Таким образом, обычное дефинитивное расположение семяпочек на адаксиальной стороне плодолистика, а не в его пазухе, можно трактовать как результат погружения мегаспорофора в толщу плодолистика. Образование нескольких семяпочек внутри одной завязи с этой точки зрения надо трактовать как результат дальнейшего ветвления мегаспорофора в толще плодолистика. Действительно, в эксперименте с комбинированием мутаций у Arabidopsis удавалось получить ветвящиеся семяножки с несколькими семяпочками в обнаженном виде (Yamada et al., 2016). Гипотеза ветвления бывшего мегаспорофора в толще плодолистика в некоторой степени воскрешает теорию Мелвилла (Melville, 1960, 1962), но без ее переусложнений.
В связи с образованием замкнутой завязи нельзя не упомянуть, что это эволюционное событие повлекло за собой обострение так называемой конкуренции пыльцы (pollen competition) за доступ к яйцеклетке, т.е. увеличение интенсивности естественного отбора мужских гаметофитов (Mulcahy D., Mulcahy G., 1987). По сути это – половой отбор. По мысли цитируемых авторов, проверке этим половым отбором косвенно подвергаются свойства основной фазы жизненного цикла – спорофита: по их данным, при прорастании пыльцы экспрессируется около 60% генов, экспрессирующихся в тканях спорофита. При этом на стадии гаметофита, благодаря его гаплоидности, отбор действует значительно эффективнее, чем на стадии диплоидного спорофита, скрывающего от отбора рецессивные аллели. Взаимосвязь интенсивности отбора гаметофитов с образованием закрытой завязи состоит в том, что для пыльцевой трубки путь до яйцеклетки от рыльца пестика получается более длинный, чем от микропиле и пыльцевой камеры (откуда стартует ее рост у голосеменных), а чем он длиннее, тем сильнее естественный отбор преобладает над случайностью. В последнее время высказываются сомнения во влиянии конкуренции пыльцы по крайней мере на эволюцию спорофита (Baskin J., Baskin C., 2015; Pélabon et al., 2016). Можно предположить, что этот отбор мужских гаметофитов на скорость роста пыльцевой трубки к яйцеклетке стал вещью в себе – разновидностью “битвы полов”, в которую обычно и вырождается половой отбор. Стоит обратить внимание на то, что ортотропная семяпочка по длине пути для пыльцевой трубки уступает различным продвинутым типам повернутых и загнутых семяпочек. Не исключено, что подобные деформации семяпочек служат для более эффективного отбора пыльцы путем испытания ее скорости роста на длинной дистанции. Аналогией здесь может быть известный вариант брачной игры у животных – погоня за самкой. Самка проверяет, выдержит ли самец длительное преследование, и только тогда соглашается на спаривание. Самец, со своей стороны, может получить награду за обман, если срежет путь. Аналогично этому можно трактовать халазогамию, когда пыльцевая трубка проникает в отвернувшуюся от рыльца пестика семяпочку не через микропиле, а с тыла – через халазу, которая в данной конфигурации к рыльцу ближе всего. Временная победа мужского начала.
4. КСИЛЕМА: ПРИВЛЕЧЕНИЕ МОДЕЛИ НИМФЕЙНЫХ
В домолекулярную эпоху, когда морфологические и вообще фенотипические признаки были единственным доступным источником для суждений о родственных связях между организмами, сторонники гнетовой теории происхождения цветковых в качестве одного из самых веских, с их точки зрения, аргументов приводили наличие настоящих сосудов во вторичной ксилеме гнетовых. Дело в том, что у других голосеменных сосудов нет, тогда как у цветковых присутствие сосудов во вторичной системе – это как раз правило. Противники гнетовой теории не менее веско возразили (Thompson, 1918; Bailey, 1944; Тахтаджян, 1970) – что, как уже отмечалось выше, у цветковых сосуды вторичной ксилемы имеют лестничные перфорации, а у гнетовых – точечные с окаймлением. Простые перфорации цветковых образуются из лестничных, а у гнетовых – из точечных. Примечательно то, что редкие примеры настоящих сосудов у нижестоящих сосудистых растений, плауна Selaginella и папоротника Pteridium, характеризуются такими перфорациями, как у цветковых – лестничными (Bailey, 1944). Выглядит так, будто перфорации цветковых “ниже по происхождению”, чем у гнетовых. Есть случаи, несколько размывающие границу между лестничным и точечным морфотипами сосудов. У хвощей Equisetum имеются сосуды с перфорациями от округлых до поперечно вытянутых (Bierhorst, 1958; Carlquist, Schneider, 2011). Наконец, у верхнепермской лианы с красноречивым названием Vasovinea, которую относят к гигантоптеридам, в метаксилеме есть сосуды с лестничными перфорациями, а во вторичной ксилеме – с точечными (Li, Taylor, 1999). Сообщалось, что и у Gnetum кроме сосудов с классическими точечными перфорациями встречаются сосуды, перфорации которых приближаются по форме к лестничным (Muhammad, Sattler, 1982). Однако позже было показано, что это иллюзия: на самом деле вытянутые поперек перфорации образованы слиянием истинно точечных (Carlquist, 1996). Таким образом, структурная пропасть между сосудами цветковых и гнетовых действительно существует, и если строить между ними морфологический ряд через общего предка, кем бы он ни был среди сосудистых растений и когда бы ни жил, то в середине этого ряда окажется не сосуд, а трахеида, точнее целый спектр трахеид с порами от точечных до лестничных (слово “пора” менее удачно, чем английское “pit”, т.е. ямка, потому что это не сквозное отверстие, а затянутое мембраной; сквозное же – это перфорация в сосуде). Эти морфотипы для трахеид не столь взаимоисключающи, как для сосудов. У цветковых распространены и лестничные трахеиды, и точечные. Среди голосеменных вторичная ксилема обычно состоит только из точечных трахеид, в том числе у гнетовых. Однако у цикадовых и беннеттитов к точечным в той или иной пропорции примешиваются и лестничные трахеиды (Rothwell et al., 2009). Распространена точка зрения, что точечный морфотип более продвинут, чем лестничный, но есть данные, что у семенных растений первыми, наоборот, появились точечные трахеиды (Beck, 1970; Doyle, 1978). Так или иначе, сторонникам гнетовой теории надлежало, так сказать, построить мост через пропасть между точечными сосудами вторичной ксилемы гнетовых и лестничными цветковых. В качестве такого построения в свое время была предложена гипотеза деградации вторичной древесины из точечных сосудов, в связи с переходом в воду, и развития при повторном выходе на сушу новой вторичной древесины уже из лестничных сосудов (Гамбарян, 1975). Подразумевалось, что она строилась на основе лестничных элементов, существовавших на стадии водной деградации в метаксилеме (заметим, что у реальных гнетовых таковые вторично исчезли; Bailey, 1944). Соответственно, был предложен следующий эволюционный ряд: гипотетическое гнетовое юрского периода, более всего напоминавшее современное дерево Gnetum gnemon, затем древнее нимфейное из раннего мела, а затем уже диверсификация всех остальных цветковых в связи с выходом на сушу.
В XXI в. этот сценарий подкрепляется наличием водных форм уже среди древнейших найденных на сегодняшний день покрытосеменных. Самое древнее бесспорно покрытосеменное растение, которое добыто целиком, – Archaefructus (Sun et al., 2002) – действительно обитало в воде.
В отношении филогенетических связей сценарий, однако, не подтвердился: как было сказано в начале статьи, молекулярно-генетические данные безоговорочно вывели гнетовых из числа возможных предков цветковых – гнетовые оказались крайне уклонившимися родственниками хвойных (Bowe et al., 2000; Chaw et al., 2000). Особенно уклонился р. Gnetum: от преимущественно ксерофитного образа жизни хвойных (даже болотный кипарис имеет ксероморфное строение) он перешел к мезофитному существованию в тени и влаге подлеска тропического леса (Feild, Balun, 2008). Как выяснилось, даже тонкие детали строения ксилемы современных гнетовых говорят об их родстве с хвойными, а сходства с цветковыми тем самым – самая настоящая конвергенция (Carlquist, 2012). Автор цитируемой статьи – один из крупнейших и опытнейших мировых специалистов по анатомии древесины – высказывает в этой работе мысль, которая может служить путеводной нитью для работы морфологов в эру молекулярной филогенетики. Он пишет (Carlquist, 2012, р. 33): “Однако эти конвергенции на самом деле открывают другой путь рассмотрения: в чем особенности древесины (гнетовых. – А.К.) функционально похожи на таковые покрытосеменных, а в каких отношениях они схожи с таковыми не-гнетовых хвойных?” Конкретно он приходит к уже упоминавшемуся выводу, что гнетовые совмещают преимущества ксилемы хвойных голосеменных (система торуса, точнее “torus-margo”, в порах трахеид, действующая как двусторонний клапан и предотвращающая распространение воздушной эмболии между трахеидами и сосудами) и цветковых (наличие сосудов с их более высокой пропускной способностью). Далее Карлквист ставит вопрос: почему же гнетовые при таком преимуществе проводящей системы не вытесняют цветковых? Главный ответ он видит в большей скорости воспроизводства цветковых благодаря более сильной редукции женского гаметофита – за счет этого им не требуется дополнительное время на его развитие перед оплодотворением. Но также он обращает внимание и на стратегически выгодную особенность цветковых именно по части древесины. Цветковые свободнее меняют уровень зрелости древесины и могут в зависимости от условий существования эволюционировать в педоморфное состояние, когда древесина пожизненно остается ювенильной, и обратно в зрелое. Никакие хвойные, включая гнетовых, не способны долго продуцировать ювенильную древесину, что делает их эволюционно менее лабильными.
В другой статье тот же автор (Carlquist, 2009) обращает внимание, что большинство рано отщепившихся семейств цветковых имеет педоморфную проводящую систему – ограниченный прирост вторичной ксилемы. Это связано с ослаблением камбиальной активности. Пройдя этот эволюционный путь до конца, нимфейные полностью лишились камбия и, соответственно, всей вторичной ксилемы и стали перманентно ювенильными водными обитателями. Филд и Аренс (Feild, Arens, 2005) полагают, что эта утрата настоящего двустороннего камбия безвозвратна. Это позволяет им утверждать, что водное происхождение цветковых невозможно, потому что в этом случае их камбий был бы утрачен (в воде), а потом (опять на суше) должен был бы быть сделан заново, а такой вторичный камбий, по их мнению, всегда можно отличить.
С такой аргументацией против водного предка цветковых можно поспорить. Во-первых, генетический аппарат камбия, по-видимому, кооптирован из апикальной меристемы (Groover, 2005), а значит, после исчезновения камбия кооптирование может повторяться раз за разом, как только условия потребуют восстановления вторичной ксилемы (при выходе на сушу и превращении в дерево). Вспомним о лабильности цветковых в плане ювенилизации/дозревания древесины (Carlquist, 2009, 2012). Почему у древовидных однодольных он восстановился в необычном виде и не у всех – отдельный вопрос. Во-вторых, предполагаемый нами вопреки мнению Филда и Аренса (Feild, Arens, 2005) водный предок цветковых мог еще не зайти в адаптации к водному образу жизни так далеко, как современные нимфейные, и не утратить камбий полностью. Тогда восстановить его до исходного состояния при повторном выходе на сушу было еще проще. По диаграммам самих же Филда и Аренса (Feild, Arens, 2005) можно заключить, что у древеснеющего желтокоренника Xanthorhiza simplicissima нормальный двусторонний камбий восстановился из редуцированного состояния, в которое он пришел у его травянистых предков. Черты педоморфности в древесине желтокоренника еще сохраняются (Dulin, Kirchoff, 2010).
Что касается высказанной ранее гипотезы (Гамбарян, 1975) о том, что в эволюции цветковых было две генерации сосудов – первая, которая исчезла при переходе предка цветковых в воду, и вторая, которая возникла при повторном выходе на сушу, – то сейчас она требует оговорок. Во-первых, потому, что потерял остроту предъявлявшийся к гнетовой теории вопрос о точечном характере сосудов предполагаемого гнетового предка. Такого предка не было, он был только конвергентно похож на Gnetum. Во-вторых, потому, что обе раньше всех обособившиеся ветви современных цветковых, несмотря на все их различия, не имеют сосудов во вторичной древесине. У наземного дерева Amborella проводящие элементы ксилемы представлены исключительно трахеидами, а у совершенно водных нимфейных просто нет вторичной ксилемы (как и камбия), а в первичной ксилеме имеются трахеиды и различные переходные формы проводящих элементов между трахеидами и сосудами (Carlquist, Schneider, 2002). Таким образом, на сегодняшний день приходится признать, что формальные аргументы против наличия каких-либо сосудов у базальных покрытосеменных укрепились. Однако если гнетоподобная стадия действительно предшествовала водной, то неотъемлемые от гнетового морфотипа широкие листья с богатым жилкованием и мощной транспирацией трудно помыслить без водоснабжения при помощи настоящих сосудов высокой пропускной способности. Этот аргумент вновь возвращает нас к исходному предположению П.П. Гамбаряна (1975) о двух генерациях сосудов в ксилеме покрытосеменных. Могли ли сосуды первой (гипотетической) генерации отличаться точечным характером перфораций, несмотря на отсутствие непосредственного родства цветковых с Gnetum? Это не исключено, если справедлива точка зрения, что точечные трахеиды появились в эволюции семенных растений раньше лестничных (Beck, 1970; Doyle, 1978). Наличие/отсутствие сосудов и точечный/лестничный характер перфораций на заре становления покрытосеменных остаются под вопросом до появления соответствующего палеонтологического материала.
5. ПОСЛЕДНИЙ ШАГ: ПОЯВЛЕНИЕ ОКОЛОЦВЕТНИКА
Соберем шаги эволюционного сценария развития морфотипа цветковых, которые мы уже рассмотрели выше по частям.
Шаг первый. Переход от ксерофитности исходного голосеменного типа к мезофитности гнетового типа и от факультативного насекомоопыления к облигатному. Первый аспект перехода соответствует концепции ксерофобии предка покрытосеменных (Feild et al., 2009) и затрагивает вегетативные части. Второй аспект затрагивает генеративные части. Складывая их воедино, получаем тенелюбивое древовидное растение лесного подлеска, конвергентно схожее с Gnetum gnemon – с такой же листвой и, скорее всего, необходимыми для нее сосудами во вторичной ксилеме, но отличающееся от Gnetum обоеполыми фруктификациями типа Archaefructus. В каждой завязи, по нашим представлениям, должно было содержаться всего по одной семяпочке, соответственно, плоды – односемянные, как наблюдается в части образцов Archaefructus liaoningensis (Wang, Zheng, 2012). Этот гипотетический предок предположительно существовал в юрском периоде или еще раньше. Палеонтологам он пока не известен, но в случае находки может быть опознан по указанному комплексу признаков.
Шаг второй. Переход от ксерофобии к гидрофильности, реально представленный Archaefructus. Это самое древнее полностью сохранившееся покрытосеменное растение буквально не имеет никаких признаков, которые мешают считать его именно тем самым первым покрытосеменным, от которого пошли все остальные, а не какой-то побочной ветвью эволюции. Этому мешает только наличие остатков других покрытосеменных того же возраста (Coiro et al., 2019). Будем считать для аккуратности, что Archaefructus – это ни в чем не продвинувшийся потомок их общего предка. По сравнению с предыдущей гипотетической стадией произошла мультипликация семяпочек в завязи, и, соответственно, плод стал из односемянного многосемянным. Так, у A. liaoningensis число семян 1–4, у A. eoflora – 3–8, а у A. sinensis – 8–12 (Wang, Zheng, 2012). В цитируемой статье авторы переопределили положение семян, распознав их плацентацию на средней жилке, а не на сомкнутых краях кондупликатно сложенного плодолистика. Однако они ошиблись, назвав эту сторону абаксиальной, потому что вся внутренняя поверхность плодолистика является адаксиальной, где бы на ней ни располагались семяпочки. Анатомия ксилемы Archaefructus пока не известна, но можно предположить ювенилизацию: редукцию вторичной ксилемы благодаря уменьшению активности камбия. Для справедливости отметим, что, в отличие от нас, Филд и Аренс (Field, Arens, 2005) полагают, что у Archaefructus камбий уже был утрачен. Можно догадаться, что основанием для такого суждения является тонкий стебель, видимо гибкий и неодревесневший; поддерживать растение жестким стеблем в воде не требуется.
Шаг третий. Это дальнейшая специализация по пути гидрофильности с превращением Archaefructus в древнее нимфейное. Происходит дальнейшая ювенилизация ксилемы, но без полной редукции камбия (залог для его восстановления на последующей эволюционной стадии – при выходе на сушу). Предполагают, что основной поставщик воды – не корни, а плавающие на поверхности воды листья (Feild, Arens, 2005). Для этого поверхность листа увеличена: образуется сплошная листовая пластинка нимфейного типа (например, Scutifolium; Taylor et al., 2008) вместо перистого листа Archaefructus. Достаток воды позволяет закончить формирование цветка. Незаконченность “цветка” Archaefructus состоит в рассредоточенности тычинок (базально) и завязей (терминально) по длинному генеративному побегу и в полном отсутствии околоцветника. У цветковых околоцветник, в особенности нежные, не защищенные от высыхания лепестки, является существенным потребителем воды (Feild et al., 2009). Мы полагаем, что именно водный образ жизни дал возможность первым цветковым создать столь расточительное с точки зрения расхода воды образование, как лепестки. Околоводного существования могло быть для этого недостаточно в отношении прихода воды. Легкое получение воды дало возможность сразу же сформировать и моторизацию закрывания лепестков на основе осмотических механизмов, столь характерную для нимфейных. К концу мелового периода моторизация лепестков уже позволила “брать во временный плен” насекомых-опылителей (Gandolfo et al., 2004). Закрывание генеративных частей лепестками потребовало компактизации расположения завязей и тычинок на генеративном побеге – укорочения его стеблевой компоненты, которая была сильно выражена в отсутствие околоцветника у Archaefructus. Характерно, что у раннемеловых нимфейных цветки были значительно мельче, чем у современных (Friis et al., 2001, 2009). Это легко объяснить тем, что снабжение лепестков водой, видимо, было еще не так хорошо налажено. Однако даже на этой ранней стадии развития околоцветника видно, насколько ведущие к нему проводящие пучки превышают по мощности таковые к тычинкам и пестикам (см. компьютерные томограммы, приведенные Friis et al., 2009). Когда же водоснабжение околоцветника и, главное, лепестков окончательно наладилось, появилось сразу две возможности: остаться в воде, полностью утратить камбий и формировать гигантские цветы, как у современных продвинутых нимфейных, или оставить небольшие цветы и расселиться в места, не столь богатые водой, т.е. выйти на сушу и восстановить камбий. В конкуренции с уже заселившими сушу голосеменными эти новые вселенцы имели два уже упоминавшихся преимущества: более быстрое развитие семени благодаря редукции женского гаметофита и мощно векторизованное опыление. Насекомые-опылители, привлекаемые теперь уже и цветным околоцветником, обеспечивают половые взаимодействия между индивидуальными растениями, расположенными на более далеких расстояниях, и, соответственно, интенсифицируют комбинаторику аллелей в следующем поколении, а сокращенное развитие семени дает ускоренную реализацию полученных комбинаций. За счет этого цветковые обгоняют голосеменных по скорости эволюции. Тем самым, как только в воде был сформирован полный цветок, “дни” (миллионы лет) господства голосеменных на суше были сочтены. Древние водные цветковые, распространившись по системам рек и озер, могли начать повсеместную колонизацию берегов. От этого и должен был возникнуть эффект внезапности – “ужасной загадки” Дарвина. Только плацдармом цветковых был не какой-то неизвестный континент или остров, а эта самая система рек и озер, находящаяся непосредственно “под боком” у господствовавших голосеменных. Впрочем, захват суши удался цветковым не с первого раза. Первая известная из современной флоры попытка – Amborella – не получила широкого распространения. Недостатком, по-видимому, оказался тот факт, что она не обрела сосудов в ксилеме. В данном случае неважно, существовала или нет первая генерация сосудов до предполагаемого ухода ранних покрытосеменных в воду.
Особенно надо обратить внимание на то, что три представленных шага эволюционно-морфологического сценария – это, по сути, шаги от покрытосемянности (достигается на первом шаге) к цветковости (достигается на последнем шаге). То, что закрытая завязь (покрытосемянность) возникла раньше, чем околоцветник (цветковость), вряд ли вызовет возражения среди ботаников. Более вызывающе может выглядеть наша идея о том, что между этими двумя эволюционно-морфологическими событиями произошла столь существенная смена жизненной формы – от мягкой ксерофобии до жесткой гидрофильности. С таксономической точки зрения получается, что “покрытосеменные” – более широкая категория, чем “цветковые”. Например, Archaefructus в нашей трактовке – уже покрытосеменное, но еще не цветковое растение. Симптоматичны дебаты по поводу того, является ли обоеполая фруктификация Archaefructus цветком с вариабельным расположением и количеством тычинок и завязей или соцветием с вариабельным расположением и количеством мужских, двуполых и женских цветков (Friis et al., 2003; Ji et al., 2004). На наш взгляд, сама постановка дилеммы неправомочна. Ведь цветок – это новая эволюционно-морфологическая сущность, которой на данном (втором в нашем сценарии) шаге предлагаемого эволюционного развития еще просто не существует, и тем более не существует соцветия как совокупности цветков. Фруктификация Archaefructus – это не более чем слабо упорядоченное скопление завязей и тычинок, а цветок на их основе будет сформирован только тогда (на третьем шаге), когда появится околоцветник и “обнимет” тычинки и завязи, создав тем самым новый целостный орган взаимодействия с насекомыми-опылителями. Это и есть полноценный цветок.
ЗАКЛЮЧЕНИЕ
Невозможно обойти вниманием острые споры по поводу целого спектра юрских фруктификаций и других растительных остатков, найденных в последнее десятилетие в Китае, которые китайские палеоботаники описали как принадлежности цветковых, их западные коллеги за таковые категорически не признают (Herendeen et al., 2017; Sokoloff et al., 2019; Bateman, 2020), а китайские авторы с этим неприятием столь же категорически не соглашаются (Wang, 2017). В силу указанной в первых строках нашего введения определенной независимости морфологического аспекта эволюции, наш сценарий становления цветковых не слишком затрагивается данной дискуссией. Если критика западных ботаников окажется справедливой, и происхождение цветковых действительно связано с началом мелового периода, то наш сценарий актуален в неизменном виде. Если же правы окажутся китайские ботаники, и происхождение цветковых сдвинется на более раннее время – в юрский или даже триасовый период, то потребуется следующая поправка. Мы уже не сможем трактовать мелового Archaefructus как близкого потомка прямого предка цветковых; придется считать его существенно более отдаленным реликтовым потомком каких-то пока не известных, но очень похожих на него (покрытосеменных, но нецветковых) “архефруктоидов” юрского периода или даже триасового. Если дать волю фантазии, то это могла быть загадочная верхнетриасовая Schweitzeria (s. Irania; Schweitzer, 1977; Шипунов, Соколов, 2003; Friis et al., 2011), общая конфигурация фруктификации которой замечательно похожа на таковую все того же Archaefructus. В любом случае наш сценарий происхождения цветковых, насколько это возможно, обоснован с адаптационистких позиций. Что касается дальнейших путей эволюции цветковых в различные деревья и травы, то это выходит за пределы данной статьи и широко освещено в ботанической литературе.
При подготовке статьи авторов консультировали С.В. Купцов, А.В. Бобров и Е.А. Кузьмичева. Н.В. Крюкова превратила набросок представленной схемы гипотетического мегаспорофора в изящный электронный рисунок. А.А. Панютина превратила благие намерения доделать начатое много лет назад в реальный план подготовки публикации и постоянно мешала отвлекаться от работы над рукописью, осуществляя координацию, техническую поддержку и редактирование. Неоценимую роль в усовершенствовании статьи сыграли конструктивные замечания рецензентов и их советы по привлечению дополнительной литературы, упущенной на первом этапе подготовки рукописи. Очень ценным оказался комментарий Б.Б. Жукова (https://bbzhukov.livejournal.com/110010.html).
Список литературы
Веттштейн Р., 1912. Руководство по систематике растений. Т. 2. Ч. 2. М.: Изд. М. и С. Сабашниковых. 501 с.
Винтер А.Н., Шамров И.И., 1991. Развитие семяпочки и зародышевого мешка у Nuphar lutea (Nymphaeaceae) // Бот. журн. Т. 76. № 3. С. 378–390.
Гамбарян П.П., 1970. Снова о числовой таксономии // Журн. общ. биологии. Т. 31. № 4. С. 34–38.
Гамбарян П.П., 1975. Роль водной среды в эволюции цветковых растений // Биол. журн. Армении. Т. 26. № 1. С. 60–65.
Имс А., 1964. Морфология цветковых растений. М.: Мир. 497 c. [Русский перевод Eames A.J., 1961. Morphology of the Angiosperms. N.Y.: McGraw-Hill.]
Мейен С.В., 1986. Гипотеза происхождения покрытосеменных от беннеттитов путем гамогетеротопии (переноса признаков с одного пола на другой) // Журн. общ. биологии. Т. 47. № 3. С. 291–309.
Паутов А.А., Пагода Я.О., 2015. Структурное разнообразие эпидермы листьев в роде Gnetum (Gnetaceae) // Бот. журн. Т. 100. № 2. С. 171–177.
Пономаренко А.Г., 1998. Палеобиология ангиоспермизации // Палеонтол. журн. № 4. С. 3–10.
Соколов Д.Д., Тимонин А.К., 2007. Морфологические и молекулярно-генетические данные о происхождении цветка: на пути к синтезу // Журн. общ. биологии. Т. 68. № 2. С. 83–97.
Тахтаджян А.Л., 1956. Высшие растения. Т. 1. М.; Л.: Изд-во АН СССР. 488 с.
Тахтаджян А.Л., 1964. Основы эволюционной морфологии покрытосеменных. М.; Л.: Наука. 236 с.
Тахтаджян А.Л., 1970. Происхождение и расселение цветковых растений. Л.: Наука. 146 с.
Шамров И.И., 2008. Семязачаток цветковых растений: строение, функции, происхождение. М.: Т-во науч. изд. КМК. 350 с.
Шипунов А.В., Соколов Д.Д., 2003. Schweitzeria – новое название для Irania Schweitzer (ископаемые Gymnospermae) // Бюлл. МОИП. Отд. Биол. Т. 108. № 5. С. 89–90.
Arber E.A.N., Parkin J., 1907. On the origin of angiosperms // J. Linn. Soc. Bot. V. 38. № 263. P. 29–80.
Bailey I.W., 1944. The development of vessels in angiosperms and its significance in morphological research // Am. J. Bot. V. 31. № 7. P. 421–428.
Baskin J.M., Baskin C.C., 2015. Pollen (microgametophyte) competition: An assessment of its significance in the evolution of flowering plant diversity, with particular reference to seed germination // Seed Sci. Res. V. 25. № 1. P. 1–11.
Bateman R.M., 2020. Hunting the Snark: The flawed search for mythical Jurassic angiosperms // J. Exp. Bot. V. 71. № 1. P. 22–35.
Beck C.B., 1970. The appearance of gymnospermous structure // Biol. Rev. V. 45. № 3. P. 379–400.
Bierhorst D.W., 1958. Vessels in Equisetum // Am. J. Bot. V. 45. P. 534–537.
Bolinder K., Humphreys A.M., Ehrlén J., Alexandersson R., Ickert-Bond S.M., Rydin C., 2016. From near extinction to diversification by means of a shift in pollination mechanism in the gymnosperm relict Ephedra (Ephedraceae, Gnetales) // Bot. J. Linn. Soc. V. 180. № 4. P. 461–477.
Bowe L.M., Coat G., dePamphilis C.W., 2000. Phylogeny of seed plants based on all three genomic compartments: Extant gymnosperms are monophyletic and Gnetales’ closest relatives are conifers // Proc. Natl. Acad. Sci. V. 97. № 8. P. 4092–4097.
Boyce C.K., Brodribb T.J., Feild T.S., Zwieniecki M.A., 2009. Angiosperm leaf vein evolution was physiologically and environmentally transformative // Proc. Roy. Soc. B. Biol. Sci. V. 276. № 1663. P. 1771–1776.
Carlquist S., 1996. Wood, bark, and stem anatomy of Gnetales: A summary // Int. J. Plant Sci. V. 157. № S6. P. S58–S76.
Carlquist S., 2009. Xylem heterochrony: An unappreciated key to angiosperm origin and diversifications // Bot. J. Linn. Soc. V. 161. № 1. P. 26–65.
Carlquist S., 2012. Wood anatomy of Gnetales in a functional, ecological, and evolutionary context // Aliso: J. Syst. Evol. Bot. V. 30. № 1. P. 33–47.
Carlquist S., Schneider E.L., 2002. The tracheid–vessel element transition in angiosperms involves multiple independent features: Cladistic consequences // Am. J. Bot. V. 89. № 2. P. 185–195.
Carlquist S., Schneider E.L., 2011. Equisetum xylem: SEM studies and their implications // Am. Fern J. V. 101. № 3. P. 133–141.
Chaw S.M., Parkinson C.L., Cheng Y., Vincent T.M., Palmer J.D., 2000. Seed plant phylogeny inferred from all three plant genomes: Monophyly of extant gymnosperms and origin of Gnetales from conifers // Proc. Natl. Acad. Sci. V. 97. № 8. P. 4086–4091.
Chen F., Liu X., Yu C., Chen Y., Tang H., Zhang L., 2017. Water lilies as emerging models for Darwin’s abominable mystery // Hortic. Res. V. 4. P. 17051. https://doi.org/10.1038/hortres.2017.51
Coiro M., Chomicki G., Doyle J.A., 2018. Experimental signal dissection and method sensitivity analyses reaffirm the potential of fossils and morphology in the resolution of the relationship of angiosperms and Gnetales // Paleobiology. V. 44. № 3. P. 490–510.
Coiro M., Doyle J.A., Hilton J., 2019. How deep is the conflict between molecular and fossil evidence on the age of angiosperms? // New Phytol. V. 223. № 1. P. 83–99.
Crepet W.L., 1984. Advanced (constant) insect pollination mechanisms: Pattern of evolution and implications vis-à-vis angiosperm diversity // Ann. Missouri Bot. Gard. V. 71. № 2. P. 607–630.
Doyle J.A., 1978. Origin of angiosperms // Annu. Rev. Ecol. Syst. V. 9. № 1. P. 365–392.
Doyle J.A., 2006. Seed ferns and the origin of angiosperms // J. Torrey Bot. Soc. V. 133. P. 169–209.
Doyle J.A., 2012. Molecular and fossil evidence on the origin of angiosperms // Annu. Rev. Earth Planet. Sci. V. 40. P. 301–326.
Dulin M.W., Kirchoff B.K., 2010. Paedomorphosis, secondary woodiness, and insular woodiness in plants // Bot. Rev. V. 76. № 4. P. 405–490.
Endress P.K., 2019. The morphological relationship between carpels and ovules in angiosperms: Pitfalls of morphological interpretation // Bot. J. Linn. Soc. V. 189. № 3. P. 201–227.
Feild T.S., Arens N.C., 2005. Form, function and environments of the early angiosperms: Merging extant phylogeny and ecophysiology with fossils // New Phytol. V. 166. № 2. P. 383–408.
Feild T.S., Balun L., 2008. Xylem hydraulic and photosynthetic function of Gnetum (Gnetales) species from Papua New Guinea // New Phytol. V. 177. № 3. P. 665–675.
Feild T.S., Chatelet D.S., Brodribb T.J., 2009. Ancestral xerophobia: A hypothesis on the whole plant ecophysiology of early angiosperms // Geobiology. V. 7. № 2. P. 237–264.
Flores-Rentería L., Vázquez-Lobo A., Whipple A.V., Piñero D., Márquez-Guzmán J., Dominguez C.A., 2011. Functional bisporangiate cones in Pinus johannis (Pinaceae): Implications for the evolution of bisexuality in seed plants // Am. J. Bot. V. 98. № 1. P. 130–139.
Friedman W.E., 1998. The evolution of double fertilization and endosperm: An ”historical” perspective // Sex. Plant Reprod. V. 11. № 1. P. 6–16.
Friedman W.E., 2009. The meaning of Darwin’s “abominable mystery” // Am. J. Bot. V. 96. № 1. P. 5–21.
Friedman W.E., 2015. Development and evolution of the female gametophyte and fertilization process in Welwitschia mirabilis (Welwitschiaceae) // Am. J. Bot. V. 102. № 2. P. 312–324.
Friedman W.E., Carmichael J.S., 1996. Double fertilization in Gnetales: Implications for understanding reproductive diversification among seed plants // Int. J. Plant Sci. V. 157. № S6. P. S77–S94.
Friedman W.E., Ryerson K.C., 2009. Reconstructing the ancestral female gametophyte of angiosperms: Insights from Amborella and other ancient lineages of flowering plants // Am. J. Bot. V. 96. № 1. P. 129–143.
Friis E.M., Endress P.K., 1990. Origin and evolution of angiosperm flowers // Adv. Bot. Res. V. 17. P. 99–162.
Friis E.M., Pedersen K.R., Crane P.R., 2001. Fossil evidence of water lilies (Nymphaeales) in the Early Cretaceous // Nature. V. 410. № 6826. P. 357–360.
Friis E.M., Crane P.R., Pedersen K.R., 2011. Early Flowers and Angiosperm Evolution. Cambridge Univ. Press. 596 p.
Friis E.M., Doyle J.A., Endress P.K., Leng Q., 2003. Archaefructus – angiosperm precursor or specialized early angiosperm? // Trends Plant Sci. V. 8. № 8. P. 369–373.
Friis E.M., Pedersen K.R., Balthazar M., von, Grimm G.W., Crane P.R., 2009. Monetianthus mirus gen. et sp. nov., a nymphaealean flower from the Early Cretaceous of Portugal // Int. J. Plant Sci. V. 170. № 8. P. 1086–1101.
Frohlich M.W., Parker D.S., 2000. The mostly male theory of flower evolutionary origins: From genes to fossils // Syst. Bot. V. 25. № 2. P. 155–170.
Gandolfo M.A., Nixon K.C., Crepet W.L., 2004. Cretaceous flowers of Nymphaeaceae and implications for complex insect entrapment pollination mechanisms in early angiosperms // Proc. Natl. Acad. Sci. V. 101. № 21. P. 8056–8060.
Gasser C.S., Skinner D.J., 2019. Development and evolution of the unique ovules of flowering plants // Curr. Top. Dev. Biol. V. 131. P. 373–399.
Goremykin V., Bobrova V., Pahnke J., Troitsky A., Antonov A., Martin W., 1996. Noncoding sequences from the slowly evolving chloroplast inverted repeat in addition to rbcL data do not support gnetalean affinities of angiosperms // Mol. Biol. Evol. V. 13. № 2. P. 383–396.
Groover A.T., 2005. What genes make a tree a tree? // Trends Plant Sci. V. 10. № 5. P. 210–214.
Hansen A., Hansmann S., Samigullin T., Antonov A., Martin W., 1999. Gnetum and the angiosperms: Molecular evidence that their shared morphological characters are convergent, rather than homologous // Mol. Biol. Evol. V. 16. № 7. P. 1006–1006.
Herendeen P.S., Friis E.M., Pedersen K.R., Crane P.R., 2017. Palaeobotanical redux: Revisiting the age of the angiosperms // Nat. Plants. V. 3. № 3. P. 17015.
Ickert-Bond S.M., Renner S.S., 2016. The Gnetales: Recent insights on their morphology, reproductive biology, chromosome numbers, biogeography, and divergence times // J. Syst. Evol. V. 54. № 1. P. 1–16.
Ingram V., 2010. From fossils to food: Trade in Gnetum species in the Congo Basin // SWC2010 Int. Conf. “People, Forests And The Environment: Coexisting In Harmony, Casablanca, Morocco Unasylva”. https://www.researchgate.net/publication/266597341_From_fossils_to_food_Trade_in_Gnetum_species_in_the_Congo_Basin
Ji Q., Li H., Bowe L.M., Liu Y., Taylor D.W., 2004. Early Cretaceous Archaefructus eoflora sp. nov. with bisexual flowers from Beipiao, Western Liaoning, China // Acta Geol. Sin. Engl. V. 78. № 4. P. 883–892.
Jörgensen A., Rydin C., 2015. Reproductive morphology in the Gnetum cuspidatum group (Gnetales) and its implications for pollination biology in the Gnetales // Plant Ecol. Evol. V. 148. № 3. P. 387–396.
Khramov A.V., Lukashevich E.D., 2019. A Jurassic dipteran pollinator with an extremely long proboscis // Gondwana Res. V. 71. P. 210–215.
Labandeira C.C., Currano E.D., 2013. The fossil record of plant-insect dynamics // Annu. Rev. Earth Planet. Sci. V. 41. P. 287–311.
Li H.L., 1960. A theory on the ancestry of angiosperms // Acta Biotheor. V. 13. № 4. P. 185–202.
Li H., Taylor D.W., 1999. Vessel-bearing stems of Vasovinea tianii gen. et sp. nov. (Gigantopteridales) from the Upper Permian of Guizhou Province, China // Am. J. Bot. V. 86. № 11. P. 1563–1575.
Maheshwari P., 1935. Contributions to the morphology of Ephedra foliata, Boiss // Proc. Indian Acad. Sci. Sect. B. V. 1. № 10. P. 586–606.
Martens P., 1971. Les Gnétophytes // Encyclopedia of Plant Anatomy. V. 12. № 2. Stuttgart: Borntraeger. 295 p.
Mauseth J.D., 2000. Theoretical aspects of surface-to-volume ratios and water-storage capacities of succulent shoots // Am. J. Bot. V. 87. № 8. P. 1107–1115.
Mauseth J.D., 2006. Structure–function relationships in highly modified shoots of Cactaceae // Ann. Bot. V. 98. № 5. P. 901–926.
Melville R., 1960. A new theory of the angiosperm flower // Nature. V. 188. № 4744. P. 14–18.
Melville R., 1962. A new theory of the angiosperm flower: I. Gynoecium // Kew Bull. V. 16. № 1. P. 1–50.
Meyen S.V., 1988. Origin of the angiosperm gynoecium by gamoheterotopy // Bot. J. Linn. Soc. V. 97. № 2. P. 171–178.
Muhammad A., Sattler R., 1982. Vessel structure of Gnetum and the origin of angiosperms // Am. J. Bot. V. 69. № 6. P. 1004–1021.
Mulcahy D.L., Mulcahy G.B., 1987. The effects of pollen competition // Am. Sci. V. 75. № 1. P. 44–50.
Mundry M., Stützel T., 2004. Morphogenesis of the reproductive shoots of Welwitschia mirabilis and Ephedra distachya (Gnetales), and its evolutionary implications // Org. Divers. Evol. V. 4. № 1–2. P. 91–108.
Nixon K.C., Crepet W.L., Stevenson D., Friis E.M., 1994. A reevaluation of seed plant phylogeny // Ann. Missouri Bot. Gard. V. 81. № 3. P. 484–533.
Pélabon C., Hennet L., Bolstad G.H., Albertsen E., Opedal Ø.H. et al., 2016. Does stronger pollen competition improve offspring fitness when pollen load does not vary? // Am. J. Bot. V. 103. № 3. P. 522–531.
Povilus R.A., Losada J.M., Friedman W.E., 2015. Floral biology and ovule and seed ontogeny of Nymphaea thermarum, a water lily at the brink of extinction with potential as a model system for basal angiosperms // Ann. Bot. V. 115. № 2. P. 211–226.
Regal P.J., 1977. Ecology and evolution of flowering plant dominance // Science. V. 196. № 4290. P. 622–629.
Ren D., Labandeira C.C., Santiago-Blay J.A., Rasnitsyn A., Shih C. et al., 2009. A probable pollination mode before angiosperms: Eurasian, long-proboscid scorpionflies // Science. V. 326. № 5954. P. 840–847.
Rothwell G.W., Crepet W.L., Stockey R.A., 2009. Is the anthophyte hypothesis alive and well? New evidence from the reproductive structures of Bennettitales // Am. J. Bot. V. 96. № 1. P. 296–322.
Rudall P.J., Sokoloff D.D., Remizowa M.V., Conran J.G., Davis J.I. et al., 2007. Morphology of Hydatellaceae, an anomalous aquatic family recently recognized as an early-divergent angiosperm lineage // Am. J. Bot. V. 94. № 7. P. 1073–1092.
Saarela J.M., Rai H.S., Doyle J.A., Endress P.K., Mathews S. et al., 2007. Hydatellaceae identified as a new branch near the base of the angiosperm phylogenetic tree // Nature. V. 446. № 7133. P. 312–315.
Sauquet H., Balthazar M., von, Magallón S., Doyle J.A., Endress P.K. et al., 2017. The ancestral flower of angiosperms and its early diversification // Nat. Commun. № 8. P. 16047.
Schweitzer H.J., 1977. Die räto-jurassischen Floren des Iran und Afghanistans. 4. Die rätische Zwitterblüte Irania hermaphroditica nov. spec. und ihre Bedeutung für die Phylogenie der Angiospermen // Palaeontographica. V. 161. P. 98–145.
Sokoloff D.D., Remizowa M.V., El E.S., Rudall P.J., Bateman R.M., 2019. Supposed Jurassic angiosperms lack pentamery, an important angiosperm – specific feature // New Phytol. https://doi.org/10.1111/nph.15974
Sun G., Ji Q., Dilcher D.L., Zheng S., Nixon K.C., Wang X., 2002. Archaefructaceae, a new basal angiosperm family // Science. V. 296. № 5569. P. 899–904.
Taylor D.W., Hickey L.J., 1996. Introduction: The challenge of flowering plant history // Flowering Plant Origin, Evolution & Phylogeny. Boston: Springer. P. 1–7.
Taylor D.W., Brenner G.J., Basha S.D.H., 2008. Scutifolium jordanicum gen. et sp. nov. (Cabombaceae), an aquatic fossil plant from the Lower Cretaceous of Jordan, and the relationships of related leaf fossils to living genera // Am. J. Bot. V. 95. № 3. P. 340–352.
Tekleva M.V., Krassilov V.A., 2009. Comparative pollen morphology and ultrastructure of modern and fossil gnetophytes // Rev. Palaeobot. Palynol. V. 156. № 1–2. P. 130–138.
Thompson W.P., 1916. The morphology and affinities of Gnetum // Am. J. Bot. V. 3. № 4. P. 135–184.
Thompson W.P., 1918. Independent evolution of vessels in Gnetales and angiosperms // Bot. Gaz. V. 65. № 1. P. 83–90.
Wang X., 2017. A biased, misleading review on early angiosperms // Nat. Sci. V. 9. № 12. P. 399–405.
Wang X., Zheng X.T., 2012. Reconsiderations on two characters of early angiosperm Archaefructus // Palaeoworld. V. 21. № 3–4. P. 193–201.
Wang Z.Q., 2004. A new Permian gnetalean cone as fossil evidence for supporting current molecular phylogeny // Ann. Bot. V. 94. № 2. P. 281–288.
Williams J.H., Friedman W.E., 2002. Identification of diploid endosperm in an early angiosperm lineage // Nature. V. 415. № 6871. P. 522–526.
Won H., Renner S.S., 2006. Dating dispersal and radiation in the gymnosperm Gnetum (Gnetales)—clock calibration when outgroup relationships are uncertain // Syst. Biol. V. 55. № 4. P. 610–622.
Yamada T., Ito M., Kato M., 2003. Expression pattern of INNER NO OUTER homologue in Nymphaea (water lily family, Nymphaeaceae) // Dev. Genes Evol. V. 213. № 10. P. 510–513.
Yamada T., Hirayama Y., Imaichi R., Kato M., 2008. AINTEGUMENTA homolog expression in Gnetum (gymnosperms) and implications for the evolution of ovulate axes in seed plants // Evol. Dev. V. 10. № 3. P. 280–287.
Yamada T., Sasaki Y., Hashimoto K., Nakajima K., Gasser C.S., 2016. CORONA, PHABULOSA and PHAVOLUTA collaborate with BELL1 to confine WUSCHEL expression to the nucellus in Arabidopsis ovules // Development. V. 143. № 3. P. 422–426.
Yamada T., Yokota S.Y., Hirayama Y., Imaichi R., Kato M., Gasser C.S., 2011. Ancestral expression patterns and evolutionary diversification of YABBY genes in angiosperms // Plant J. V. 67. № 1. P. 26–36.
Yang Y., Xie L., Ferguson D.K., 2017. Protognetaceae: A new gnetoid macrofossil family from the Jurassic of northeastern China // Perspect. Plant Ecol. Evol. Syst. V. 28. P. 67–77.
Zhang X., Liu W., Wang X., 2017. How the ovules get enclosed in magnoliaceous carpels // PloS One. V. 12. № 4. P. e0174955.
Zhang X., Zhang Z., Zhao Z., 2019. Floral ontogeny of Illicium lanceolatum (Schisandraceae) and its implications on carpel homology // Phytotaxa. V. 416. № 3. P. 200–210.
Zimmermann W., 1959. Die phylogenie der pflanzen: ein uberblick über Tatsachen und probleme. Stutgart: G. Fischer. 777 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии