Журнал общей биологии, 2020, T. 81, № 6, стр. 403-420
Координация морфогенетической активности в современных и ископаемых сообществах цианобактерий
Е. Л. Сумина 1, *, Д. Л. Сумин 2, А. Н. Харитонов 3, Т. Н. Греченко 3
1 Московский государственный университет им. М.В. Ломоносова, геологический факультет, кафедра палеонтологии
119991 Москва, Ленинские горы, 1, Россия
2 САНИПЭБ
125009 Москва, ул. Большая Никитская, 6, Россия
3 Институт психологии РАН
129366 Москва, Ярославская ул., 13, корп. 1, Россия
* E-mail: stromatolit@list.ru
Поступила в редакцию 19.05.2020
После доработки 18.06.2020
Принята к публикации 25.08.2020
Аннотация
Явление морфогенеза ранее исследовалось преимущественно на эукариотах, у которых он приобрел развитые и устойчивые формы. По этой причине возникновение и становление формообразования у эукариот являются областью реконструкции. Рассматриваемые нами сообщества прокариот (нитчатых цианобактерий) позволяют непосредственно наблюдать начальные этапы становления формообразования. При высокой скорости преобразования формы сообщества современных цианобактерий они путем перегруппировки нитей образуют специализированную систему управления морфогенезом в виде полигональной сети с ячейками миллиметровой размерности. Координированное поведение нитей цианобактерий обеспечивается, в частности, контактными взаимодействиями и сложной электрической коммуникацией. Описанный ранее у ископаемых цианобактериальных сообществ – строматолитов – микрорельеф поверхности, возможно, является проявлением аналогичной системы.
Длительное время сообщество нитчатых цианобактерий рассматривалось как поселение индивидуальных микроскопических организмов, форма которого полностью определяется условиями среды. Среди причин морфологической устойчивости ископаемых сообществ цианобактерий – строматолитов – рассматривались преобладающие в водоемах, где они обитали, течения (Walter, 1976; Krumbein, 1983), интенсивность освещения (Петров, 1996), влияние содержания кислорода на морфогенез (Sim et al., 2012). Однако исследователями (Еленкин, 1938; Горюнова, 1955; Комар и др., 1965; Власов, 1970; Петров, 2002) описан ряд явлений, указывающих на возможность координации вида, направления и скорости процессов морфогенеза у нитчатых цианобактерий на макроскопическом уровне, т.е. в сообществе11. Данная статья посвящена именно поведенческой составляющей процессов морфогенеза в сообществах современных и ископаемых цианобактерий.
Здесь важно отметить, что отдельные клетки цианобактерий, многоклеточные нити и их сообщества являются структурами различных уровней организации, морфогенез которых идет на базе разных способов структурно-функционального объединения входящих в них элементов. Как отмечают Урселл с соавторами (Ursell et al., 2013), исследовавшие одноклеточную цианобактерию Synechocystis sp. PCC 6803, поведение сообществ генотипически идентичных клеток не может быть предсказано на основе поведения отдельных клеток, так как во многих случаях считается, что прямая связь между клетками играет решающую роль при переходе от индивидуального поведения к поведению сообщества. Предметом нашего исследования являлась макроскопическая морфология цианобактериального сообщества дециметрового масштаба и пути ее возникновения.
Практическую значимость вопрос об устойчивости морфотипов строматолитов и их эволюции приобрел в рамках геологических исследований, имевших задачу определения относительного возраста докембрийских (более 600 млн лет назад) карбонатных пород в связи с отсутствием в них макроскопических скелетных остатков. Единственными ископаемыми, которые могли быть использованы в этих целях, являлись строматолиты – морфологически оформленные минерализованные бентосные пленки цианобактерий.
Стратиграфические исследования показали, что изменение строматолитов на протяжении трех миллиардов лет подчиняется тем же закономерностям, что и изменения скелетных организмов в более позднее геологическое время. К этим закономерностям относятся направленность, необратимость и приспособительное значение изменений, устойчивость комплексов таксономических признаков и их дискретность, а также синхронность смены таксонов строматолитов в геологическом времени на больших территориях (Крылов, 1975). Все перечисленное – черты эволюции целостных организмов. С одной стороны, это наводило на мысль о применимости к строматолитам положения, высказанного В.В. Меннером (1962), о возможности использования объекта в биостратиграфии только в том случае, если его строение определяется влиянием факторов среды в сочетании с наследственностью, фиксирующей это влияние и одновременно обеспечивающей необратимую смену морфологического облика. С другой стороны, изменение формы как ископаемых, так и современных сообществ цианобактерий показывает, что их развитие на малых промежутках времени не является необратимым, что отличает их от индивидуального развития многоклеточных эукариот.
Авторы предполагают, что такое соотношение сходств и различий связано с возникновением эквифинальности на поздних стадиях эволюции онтогенеза. Нитчатые цианобактерии же, как группа параллельная и во многом альтернативная многоклеточным эукариотам (Гусев, Гохлернер, 1980), находятся на стадии эволюционного перехода от популяции к организму, а процессы морфогенеза их сообществ – на стадии перехода от группового поведения к онтогенезу индивидуального целостного организма. Подобные явления для эукариот рассматривал В.Я. Бродский (2009). Возможно, выработка устойчивых путей морфогенеза в виде поведения организмов предыдущих иерархических уровней является универсальным механизмом, фрактально распространяющимся в эволюции живого (Сумин, Сумина, 2017).
Таким образом, морфогенез в сообществе нитчатых цианобактерий позволяет наблюдать начальные стадии становления процессов онтогенеза, которые многоклеточные эукариоты уже прошли, и частичный возврат к ним происходит только при необходимости осуществления эмбриональных регуляций.
Для выяснения механизмов координации морфогенетической активности авторами экспериментально были изучены пленки современных нитчатых цианобактерий и с точки зрения полученных результатов проанализированы литературные данные по ископаемым строматолитам из группы Thyssagetaceae Vlasov (Власов, 1977).
Некоторые замечания к истории вопроса
В настоящий момент предположение, что строматолиты являются результатом жизнедеятельности сообщества нитчатых цианобактерий при участии процессов осадконакопления, принято большинством исследователей. Однако единодушие этим и ограничивается. Существующие разногласия касаются интерпретации всех остальных аспектов изучения строматолитов как ископаемых остатков, что подтверждается, например, таким принципиально разным пониманием строматолитов как породы или как целостного организма (Комар и др., 1965; Сумина, 2002; Бурзин, 2003). Одним из путей разрешения этих копившихся в течение длительного времени противоречий стала попытка использования культуры современных нитчатых цианобактерий для моделирования аналогов ископаемых строматолитов. Она была предпринята сотрудниками двух академических институтов: Института микробиологии РАН (лаборатория реликтовых микробных сообществ) и Геологического института РАН (лаборатория верхнего докембрия).
В результате исследований было получено много новых данных по биологии цианобактерий и цианобактериальных сообществ (Орлеанский, Герасименко, 1982; Герасименко и др., 1989; Герасименко, Заварзин, 1993; Герасименко, Орлеанский, 2004), однако на один из важнейших вопросов – о причинах устойчивости морфотипов строматолитов – эти исследования ответа не дали. Возникший методологический парадокс привел к тому, что в дальнейшем внимание было сосредоточено на экспериментальном наблюдении над сообществом цианобактерий как таковым, т.е. без попыток использовать его как модельный объект для получения каких-либо аналогов ископаемых строматолитов и построения заключений на основе полученных образцов. Для сообщества цианобактерий феноменологически было описано разнообразие структур, выявлены этапы их становления и коррелятивные связи между ними, что позволило рассматривать эти явления в сообществе как дифференцировку организменного плана, имеющую размерность вплоть до дециметровой. Такой статус сообщества был обоснован и выявленной способностью сообщества к направленному изменению своей формы и положения в пространстве. От многоклеточных эукариот, на изучении которых основано большинство представлений об организмах, сообщество цианобактерий принципиально отличается отсутствием эквифинальных морфогенезов. У описанной ранее многими авторами структуры, которую мы называем “полигональная сеть”, была обнаружена механическая функция, позволяющая сообществу направленно изменять свою форму. Проведенное ранее одним из авторов изучение сообщества методами электрофизиологии показало и его электрическую целостность (Греченко, 2012).
Получив эти данные, мы вновь обратились к строматолитам. В большом арсенале работ по различным аспектам этих ископаемых остатков особое место занимают работы по микроскульптуре строматолитовых слоев. Наибольшее внимание этому уделял Ф.Я. Власов (1970, 1977), который подробно описал микроскульптуру слоев строматолитов выделенного им сем. Thyssagetaceae и ее роль в морфогенезе построек. Определяющим фактором возникновения микроскульптуры, а вслед за ней и макроструктуры, по Ф.Я. Власову, может быть только дифференцированное позиционированное биогенное выделение карбоната. Следовательно, структура поверхности строматолитового слоя и ее изменения при нарастании постройки задаются единой информационной системой, проявлением которой в ряде случаев является полигональная сеть. Данные Ф.Я. Власовым конкретные биологические интерпретации этих явлений, выявленных им на ископаемых формах, к сожалению, выглядели неправдоподобно, поскольку он прямо переносил закономерности, известные в то время для многоклеточных эукариот, на организацию строматолитообразователя.
Прямое и подробное наблюдение цианобактериального сообщества позволило выявить высокий уровень его биологической целостности и конкретную структуру – полигональную сеть, которая морфофункционально и онтогенетически соответствует микроскульптуре строматолитовых слоев, выделенных Ф.Я. Власовым.
Генетические механизмы подвижности цианобактерий
В наших экспериментах все наблюдаемые структуры в сообществе цианобактерий образовывались путем направленного движения нитей, поэтому кратко рассмотрим механизмы подвижности цианобактерий, в том числе их молекулярно-генетические аспекты (Ермилова и др., 2004). Как отмечает А.В. Пиневич (2009), у скользящих цианобактерий существуют два типа положительного фототаксиса – когда трихом периодически изменяет направление своего движения, приближаясь к источнику света (Phormidium sp.), и когда происходит устойчивое движение к источнику света (Аnabaena sp.). Механизм фототаксиса цианобактерий не выяснен, особенно это касается фоторецепторов, обеспечивающих миграционный ответ. У ретинопротеина ASR, обнаруженного у цианобактерий, отмечены необычные свойства – ретиналь под воздействием света не изомеризуется, а фоторецептор не проходит через фотоцикл (Пиневич, 2009). Скорее всего, ASR используется в фоторегуляции метаболизма, например, участвует в хроматической адаптации. Исследования генома нитчатой цианобактерии Nostoc punctiforme показали, что он кодирует 15 белков, сходных с белками, необходимыми для подвижности, с помощью филаментов – пилей IV типа, расположенных на полюсах клетки, включая белки Pil T, D, A, B, C, M, N, O, Q. В обеспечении подвижности гормогониев этого вида задействованы пили IV типа (Brahamsha, Devaki, 2013; Campbell et al., 2015).
Анализ транскрипции генов во время дифференцировки гормогониев показал, что экспрессируются пять генов, кодирующих компоненты TFP, а также локус hmp, содержащий гены, кодирующие белки, сходные с белками передачи сигнала при хемотаксисе. Кроме того, активируется кластер генов, которые кодируют предполагаемый синтез полисахаридов – локус hps (Risser, Meeks, 2013). Локус hps кодирует гликозилтрансферазы, псевдопилины и белки, содержащие препилин-пептидазные домены, и мутации в этих генах влияют на подвижность и секрецию полисахаридов. Гомологи этих генов присутствуют в геномах всех нитчатых цианобактерий, секвенированных на сегодняшний день, и, по-видимому, характерны только для этих организмов, что позволяет предполагать наличие у них общего механизма движения (Risser, Meeks, 2013). У нитчатых цианобактерий Nostoc, Anabaena и Fisherella идентифицирован ряд белков (CCRP), которые полимеризуются в нитевидные структуры и выполняют функции, подобные функциям цитоскелета (Springstein et al., 2020). Основной характеристикой филаментообразующих белков является их способность к самополимеризации как внутри, так и вне клеток. Доля генов, кодирующих CCRP в геноме цианобактерий, значительно выше у многоклеточных цианобактерий по сравнению с одноклеточными, более того, высокая частота CCRP является одной из характеристик многоклеточных цианобактерий. Описан филаментообразующий белок CCRP – Fm700, специфичный для многоклеточных (нитчатых) цианобактерий, имеющих дифференцированные или ветвящиеся трихомы (Risser, Meeks, 2013). Важно, что два белка СCRP – Fm7001 и All4981 – формируют филаменты в клетках цианобактерий разной систематической принадлежности и разных морфотипов. Некоторые белки частично регулируются белком Slr7083, что функционально напоминает роль актинового цитоскелета эукариот. Известно, что у эукариот клеточная подвижность сильно зависит от белков цитоскелета. Таким образом, возможно, что белки, образующие филаменты, также являются ключевыми факторами клеточной подвижности и у прокариот. Цианобактериальные белки CCRP часто ассоциируются с другими системами цитоскелета (MreB, FtsZ и другими CCRP, образующими филаменты) и сайтами межклеточных связей (SepJ) (Springstein et al., 2020), что позволяет предположить, что эти структуры могут быть функционально связаны в клетках цианобактерий. Примечательно, что некоторые из идентифицированных белков CCRP являются высоко консервативными у всех морфотипов цианобактерий, что позволяет предполагать их эволюционную древность (Springstein et al., 2020).
В работе Райли с соавторами (Riley et al., 2018) показано, что гены, уникальные для нитчатых цианобактерий, вовлечены в регуляцию развития гормогониев у нитчатой цианобактерии Nostoc punctiforme. Анализ делеционных штаммов показал, что HmpU и HmpV (домен STAS) усиливают подвижность и устойчивость гормогониев.
Хотя у нитчатых цианобактерий механизм скользящей подвижности не определен, предполагается, что он управляется системой секреции полисахаридов, известной как комплекс соединительных пор (JPC) (Khayatan et al., 2015). JPC представляет собой модифицированную структуру пилей IV типа, частично кодируемую генами в локусе hps. Исследование экспрессии hps и pil генов у N. punctiforme показало, что инактивация большинства генов hps и pil устраняет подвижность и отменяет или резко снижает секрецию полисахарида, а субклеточная локализация нескольких белков Pil у подвижных гормогониев соответствует участку комплекса соединительных пор. Гомологи Hps и Pil почти всегда присутствуют у нитчатых цианобактерий, причем гомологи Hps редко встречаются в одноклеточных штаммах (Khayatan et al., 2015). Эти результаты подтверждают предположение о том, что белки Hps и Pil составляют JPC, наномотор пилей IV типа, который управляет подвижностью и секрецией полисахаридов.
В работах Риссера и Чо с соавторами (Risser et al., 2014; Cho et al., 2017) представлена подробная характеристика локуса hmp у N. punctiforme, который кодирует белки, принимающие участие в процессах хемотаксиса. Инактивация генов hmpB, C, D и E устраняет дифференцировку гормогониев. Методом иммунофлуоресценции показано, что GFP-меченый вариант каждого белка локуса hmp (PilA) локализован в кольце на стыке между клетками. Фенотип делеционных мутантов по этим генам и локализация белков Hmp и предполагаемого белка PilA на выходе пор у перегородок соседних клеток согласуются с гипотезой о том, что эти белки являются частью комплекса соединительных пор, наблюдаемого у ряда нитчатых цианобактерий. Гормогонии данных делеционных мутантов теряют подвижность, не способны образовывать колониальные агрегаты и существуют в виде дисперсных суспензий.
Хойчик и Баумайстер (Hoiczyk, Baumeister, 1997) в результате проведенных исследований с применением метода электронной микроскопии показали, что поверхности трихомов скользящих нитчатых цианобактерий Phormidium uncinatum и Anabaena variabilis имеют общую структурную организацию. Они содержат S-слой, прикрепленный к внешней мембране, и массив параллельных фибрилл поверх S-слоя. У данных видов спиральное расположение этих фибрилл соответствует направлению вращения организма при скользящем движении (Hoiczyk, Baumeister, 1997; Ермилова и др., 2004; Пиневич, 2009). Методами электронной микроскопии и спектроскопии были исследованы поверхностные фибриллы P. uncinatum. Фибриллы состоят из одного стержнеобразного белка, названного осциллином – белка из 646 аминокислотных остатков (Mr 65807; pI 3.63). Анализ последовательности выявил двухдоменную структуру: домен остатка 554 содержит 46 повторов Ca2+-связывающего мотива, за ним следует C-терминальный домен из 92 остатков, который может обеспечить его экспорт. Нити, которые не экспрессируют осциллин, теряют способность к движению. Авторы исследования полагают, что подобные белки играют аналогичную роль и у других скользящих цианобактерий, например у Synechocystis и Anabaena. Внеклеточный белок осциллин формирует на поверхности клеток спирально расположенные фибриллы, которые обеспечивают скользящее движение. Спиральное расположение фибрилл создает при движении нитей вращающий момент.
В целом движение цианобактерий и его механизмы можно охарактеризовать следующим образом. Нитчатые цианобактерии скользят по твердой влажной поверхности со скоростью 10 мкм/с (Определитель бактерий Берджи, 1997) и случайным образом изменяют направление движения (Ермилова и др., 2004). В частности, представители одноклеточных цианобактерий Synechocystis движутся с использованием пилей IV типа. Подтягивающее движение клеток с их участием контролируется светом через фототактический кластер генов, и пили IV типа определяют движение в реакциях фототаксиса.
Некоторые авторы считают механизмом, альтернативным движению с помощью пилей, механизм движения благодаря выделению слизи через специальные каналы и соединительные поры, расположенные около перегородок соседних клеток и проходящие через внешнюю мембрану и клеточную стенку (Hoiczyk, Baumeister, 1998). Поры имеют диаметр 14–16 нм, располагаются рядами по кругу вблизи клеточных перегородок в многоклеточных нитях цианобактерий. Соединительные поры используются для секреции полисахаридов, направление секреции противоположно направлению движения (Ермилова и др., 2004). При скольжении некоторые цианобактерии используют механизм вращения, при котором в механизм секреции включаются осциллиновые фибриллы (Ермилова и др., 2004).
Предшествующими геологическими и палеонтологическими исследованиями была выявлена высокая (организменная) степень целостности строматолитов. Это подразумевает наличие соответствующей степени целостности образующих их сообществ микроорганизмов. Целью данной статьи является соотнесение способов достижения целостности формообразования у современных и ископаемых цианобактериальных сообществ.
МАТЕРИАЛЫ И МЕТОДЫ
В экспериментах были использованы культуры нитчатых цианобактерий, выделенных из экспедиционных проб альго-бактериальных матов термальных полей кальдеры вулкана Узон (Камчатка) (Орлеанский, Герасименко, 1982). Накопительная культура состояла из представителей двух видов цианобактерий – Oscillatoria terebriformis (Ag.) Elenk. emend., основного структурообразующего члена сообщества, и Phormidium angustissimum W. et G.S. West, подчиненного компонента, – и разнообразного населения: бактерий, инфузорий, клещей и др. (культура цианобактерий из коллекции синезеленых водорослей Института микробиологии АН СССР, Москва, IMAS (ныне Институт микробиологии им. С.Н. Виноградского РАН)).
По ботанической классификации данные цианобактерии принадлежат порядку Oscillatoriales (осциллаториевые) класса Hormogoniophyceae (гормогониевые) отдела Cyanophyta (синезеленые водоросли). По бактериальной – к группе 11 (оксигенные фототрофные бактерии), подгруппе 3 (= порядок Oscillatoriales). Осциллаториевые – микроскопические многоклеточные нитчатые фотосинтетики, имеющие средние размеры до 400 мкм в длину и 7 мкм в толщину (Oscillatoria). Способны передвигаться по субстрату в жидкой среде в обоих направлениях путем скольжения со скоростью до 100 мкм/мин. В культуре в качестве минорного компонента также присутствуют цианобактерии P. angustissimum, имеющие гораздо меньшую биомассу, размеры 0.6–0.8 мкм в толщину и более короткие нити. Морфогенетические процессы осуществляются наблюдаемым перемещением нитей O. terebriformis, из которых полностью состоят все образованные в результате этих процессов структуры пленки. P. angustissimum присутствует в биомассе, не принимая участия в морфогенетических движениях. Поэтому именно O. terebriformis является основным структурообразующим компонентом сообщества.
O. terebriformis (осциллатория буравовидная) (рис. 1) – нитчатая цианобактерия, имеющая длинные гомоцитные, как правило, прямые многоклеточные трихомы, состоящие из одинаковых по форме цилиндрических клеток. Терминальные клетки либо не отличаются от остальных клеток трихома, либо могут быть дифференцированы и имеют выпуклые перегородки. Дифференцировка распространяется на участок длиной в несколько клеток. Трихомы гибкие, особенно около концов, подвижные. Перегородки, как правило, тоньше, чем боковые клеточные стенки. Диаметр трихомов около 5 мкм. Постоянные чехлы обычно отсутствуют, но при скольжении трихома по плотной поверхности за ним остаются почти невидимые прозрачные следы слизи. В некоторых случаях вокруг трихомов образуется более заметный слизистый чехол, особенно в старых культурах. Если трихомы находятся в скоплениях или кожистых пленках, то они окружены морфологически выраженным общим чехлом. Скользящее движение возможно по поверхности твердого или уплотненного субстрата. Движение вперед или назад сопровождается лево- или правонаправленным вращением трихома. Если терминальные участки трихомов не находятся в контакте с субстратом, свободный конец может колебаться при вращении трихома, особенно если он изогнут. Скорость движения изменяется от <1 мкм/с до ≈11 мкм/с (Определитель бактерий Берджи, 1997).
Размножение – только бинарным делением клеток в одной плоскости на более короткие подвижные участки, состоящие из нескольких клеток и называемые гормогониями. Они вырастают в новые нити. Формы этого вида способны к фотоавтотрофии, а также к очень медленному росту в темноте в анаэробных условиях за счет сбраживания экзогенных сахаров (Гусев, Никитина, 1979).
Представители вида образуют темные сине-зеленого цвета дерновинки (пленки). Обитают в горячих источниках с температурой до 45°C.
Цианобактерии культивировали на среде, по составу аналогичной среде горячих источников (г/л): CaCl2 – 0.1, NaH4Cl – 0.1, MgSO4 ⋅ 7H2O – 0.2, H3BO3 – 0.1, K2HPO4 – 0.1, NaHCO3 – 0.3, Na2SiO3 ⋅ 9Н2О – 0.3, FeSO4 – 0.01, микроэлементы – 0.01 (B, Mg, Zn, Na, Cu, Co) (Орлеанский, Герасименко, 1982).
Сообщество цианобактерий выращивали в чашках Петри стандартного размера, колбах и кристаллизаторах.
Наблюдения проводили невооруженным глазом, а также с использованием бинокулярной лупы фирмы Carl Zeiss Jena и микроскопа NU 2 Carl Zeiss Jena (Carl Zeiss, г. Оберкохен, Германия). Препараты изготавливали стандартным методом с использованием предметных и покровных стекол. Растущую культуру освещали лампами накаливания с интенсивностью 2000 лк. Лампы находились на расстоянии 40–50 см от сосудов с культурой. Наблюдения проводили в двух режимах – при постоянном освещении искусственным светом и при естественном освещении с суточными колебаниями.
В электрофизиологических исследованиях применяли метод регистрации электрической активности при помощи стеклянных микроэлектродов, изготовленных из стекла марки “Pyrex” (в ряде опытов регистрацию выполнили макроэлектродами из серебряной проволоки в тефлоновой оболочке). Для изготовления стеклянных электродов применялся прибор для вытяжки микроэлектродов МЭ4. Электроды заполняли 1 М раствором KCl. Внутриклеточную регистрацию от отдельных элементов пленки осуществляли микроэлектродами, кончик которых был менее 1 мкм, сопротивление 30–40 мОм. Для регистрации полевых потенциалов применяли электроды, диаметр кончика которых не менее 2 мкм. Электроды располагали как на поверхности, так и внутри пленки.
Цианобактерии O. terebriformis находились в физиологическом растворе следующего состава (г/л): NaHCO3 – 3, Na2CO3 – 17, K2HPO4 – 0.5, NaCl – 30, KNO3 – 2.5, MgSO4 – 0.2, CaCl2 – 0.04, FeSO4 – 0.01. pH раствора 7.2–7.5.
Фрагменты записи электрической активности цианобактерий O. terebriformis оцифровывали. Частоты полевых потенциалов подвергали спектральному анализу в среде статистической обработки R 3.0 (R Development Core Team, 2011). Спектральный анализ выполнялся для исходной записи путем построения периодограммы с использованием быстрого преобразования Фурье. 95%-ные доверительные интервалы мощности спектра вычислялись на основе аппроксимации χ2 распределением.
Отдельного комментария требует вопрос о воспроизводимости экспериментов. Поскольку процессы полностью не детерминированы и не эквифинальны, в одинаковых условиях морфогенез сообщества может идти как в сходных, так и в совершенно различных направлениях, с различными результатами и в течение разного времени. В двух и более стоящих рядом сосудах могут возникать совершенно непохожие картины, поэтому авторы описывают явления, наблюдавшиеся в конкретных экспериментах. По нашему мнению, такая неоднозначность морфогенезов связана с тем, что они являются выражением сложного коллективного поведения нитей, которое не может быть сведено к прямой реакции на внешние условия.
Топология событий, происходящих в сосуде, описывается принципиально неполно, поскольку структуры, образуемые цианобактериями, не только обладают малой прочностью, но и механочувствительностью, поэтому поворот лабораторного сосуда для наблюдений и фотографирования в большинстве случаев невозможен без нарушения хода процессов. В связи с тем, что структуры обладают фоточувствительностью, затруднена также фотосъемка процессов, идущих при малом освещении, так как для этого требуется изменение освещенности.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сообщество осциллаториевых цианобактерий в естественных и лабораторных условиях обычно существует в виде пленок. Пленки, в особенности ископаемые (строматолиты), в процессе увеличения своей биомассы часто приобретают весьма сложную форму, которая заставляет предполагать наличие в ней (или у сообщества цианобактерий, что мы понимаем как синонимы) морфогенетических процессов.
Для иллюстрации морфогенетической природы изменения формы сообщества рассмотрим два варианта, в которых эти изменения выражены наиболее интенсивно. Первый – изменение формы в современном сообществе цианобактерий, второй – изменение формы сообщества, прослеженное на ископаемом материале. Оба случая сходны по высокой степени выраженности биологического контроля: у современных цианобактерий высокая степень контроля проявляется в большой скорости процесса, а у ископаемых (строматолитов) – в образовании формы постройки, наименее сходной с образуемой при абиогенном выпадении карбонатов.
Координация морфогенеза в современном сообществе нитчатых цианобактерий
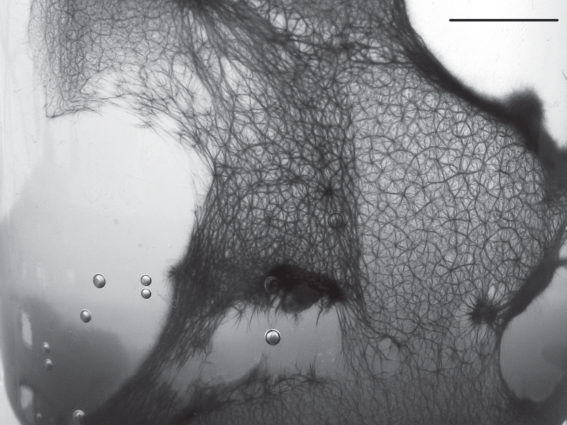
В серии экспериментов было отмечено, что при избыточном освещении пленка цианобактерий, занимающая всю поверхность лабораторного сосуда, преобразуется в систему тяжей (рис. 2г) в течение нескольких часов (Сумина, Сумин, 2013). Первой стадией процесса является образование в течение суток или двух сгущений в пленке (рис. 2а), вокруг которых впоследствии формируются лучи (рис. 2б). Затем происходит объединение лучей с образованием полигональной сети с ячейками миллиметровой размерности (рис. 2в). В сети образуются зоны сжатия и растяжения (рис. 3). На месте зон сжатия возникают тяжи, вначале неравномерные по толщине, впоследствии выравнивающиеся.
Рис. 2.
Этапы развития полигональной сети в пленке современных цианобактерий и стадии становления микрорельефа у тиссагетовых строматолитов: а – образование в пленке сгущений; б – формирование лучей вокруг сгущений; в – образование полигональной сети; г – пленка после преобразования в систему тяжей; д – образование бугорков – стигм; е – образование ребер – грамм; ж – объединение стигм и грамм в полигональную сеть; з – макроскопические формы рельефа (рис. д–з по: Власов, 1970). Масштабная линейка: а–в – 1 мм, г – 10 мм, д–ж – 5 мм, з – 50 мм.
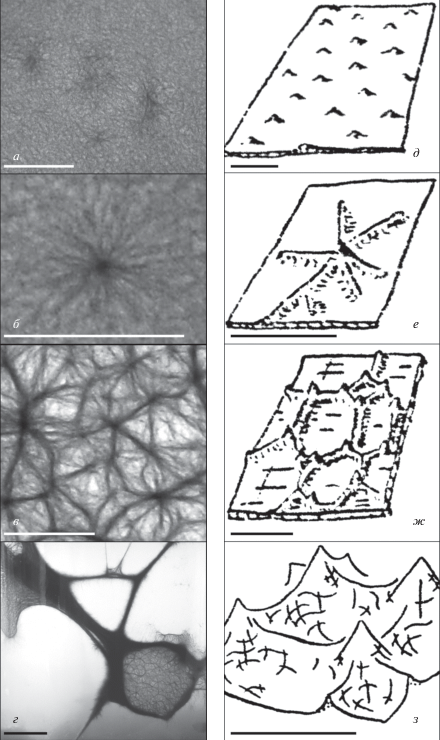
Таким образом, явления, предшествующие преобразованию формы сообщества (образование сгущений, формирование лучей, образование сети и преобразование пленки в систему тяжей), развиваются в течение нескольких суток. Вероятно, физиологический смысл этого процесса состоит в предохранении нитей цианобактерий от фотовыцветания (Гусев, Никитина, 1979). Скорость, определенность и целенаправленность этого процесса говорят о телеономическом характере преобразований, к числу которых, в частности, принадлежит и морфогенез многоклеточных эукариот (Белоусов, 2005).
Такое преобразование пленки не вызвано непосредственным действием на нее факторов среды, поскольку они не обладают дифференцированностью и постоянством действия, которые могли бы вызывать наблюдаемую дифференциацию сообщества, соответствующую его потребностям в данный момент времени. Существует переход между начальным и конечным состояниями сообщества, который осуществляется сложной системой структур, возникающих в пленке, специфической функцией которых является именно обеспечение перехода между морфологическими состояниями сообщества. Сеть возникает в несколько этапов, описанных выше, ни на одном из которых не исполняются ее механические функции – разрыв и стягивание пленки в систему тяжей. Изменение формы сообщества, как в целом, так и в отношении способа обеспечения этого изменения, имеет телеономический, целенаправленный, характер.
Сложное и целенаправленное преобразование формы, по-видимому, является внешним выражением создаваемой цианобактериями в ответ на изменение внешних условий информации, поскольку изменение формы происходит не синхронно с изменением условий, а со сдвигом на несколько суток. Кроме того, освещенность испытывала естественные суточные изменения, соответственно, информация об общем направлении изменения освещенности должна была сохраняться сообществом в течение всего времени протекания морфогенеза. Эта информация должна включать сведения о текущей форме сообщества, непосредственных условиях его существования, несоответствии текущей формы изменившимся условиям, о будущей форме сообщества, соответствующей условиям, а также о способах перехода между начальной и конечной формой. Особо подчеркнем, что структуры, сменяющие друг друга в процессе образования сети, не выполняют механических функций, прямо изменяющих состояние сообщества в необходимую ему сторону. Это преобразование осуществляет только окончательно сформированная в процессе морфогенеза полигональная сеть, выполняющая в сообществе функции управляющей системы, ответственной за координацию протекания процессов в макроскопических масштабах. Периодическое изменение условий влияет на скорость процесса, но не влияет на его направленность.
Можно выделить следующие уровни структур, создающих пространственную информацию. Первый – сама пленка. Первоначально она не имеет видимых элементов строения, но дает начало образованию сети. Второй уровень – многолучевые агрегаты. Многолучевые агрегаты являются элементарной единицей сети. Третий уровень – собственно полигональная сеть (рис. 2а–в).
В тех случаях, когда многолучевые агрегаты возникают изолированно, они способны направленно перемещаться в толще среды и по поверхности стекла. При движении по стеклу они сближаются и объединяются, что повторяется многократно. Строение многолучевых агрегатов, включающее центральное “ядро” и направленные в стороны “лучи”, при движении сохраняется. При объединении двух агрегатов в один его структура восстанавливается. Сближение происходит направленно, а не в результате хаотичного перемещения. Это позволяет предположить, что морфогенетическая информация создается и удерживается на двух уровнях – при сохранении и восстановлении строения во время движения и объединения агрегатов и при определении агрегатами взаимного положения. Взаимодействие агрегатов вне сети дополнительно подтверждает наличие у сети, состоящей из этих образований, информационной функции. Данная функция прямо не связана с механическими взаимодействиями нитей и их агрегатов, поскольку наблюдаются как контактные, так и бесконтактные взаимодействия.
Одним из проявлений коллективного взаимодействия в сообществе является формирование надорганизменных (относительно нитей) структур, важных для существования сообщества как целого. Их построение требует согласования совместной деятельности нитей. Согласованная механическая активность у других организмов обеспечивается, в частности, специфическими электрическими взаимодействиями. В связи с этим нами были исследованы электрические явления в цианобактериальной пленке.
В сообществе постоянно регистрируются сложные модулированные сигналы, которые в общих чертах сходны с электрической активностью нервной системы эукариот.
Электрические явления у нитчатых цианобактерий исследовались и ранее, но на уровне отдельных нитей. Т.В. Потаповой (1990) и К.Б. Асланиди (1998) был применен метод регистрации фотоэлектрических ответов одиночного трихома Phormidium sp. Трихом рассматривается авторами как линейная структура из клеток, связанных проницаемыми контактами. Было обнаружено, что электрическая проводимость на участках трихома значительно превышает размеры отдельной клетки. Эти участки были названы “электрическими кабелями”. Наличие электрической взаимосвязи на этих участках указывает на возможность эффективной энергетической кооперации между клетками с помощью ионных потоков через проницаемые контакты. В пределах одного трихома наблюдалось разделение на два или более “кабеля”. Исследованная электропроводимость трихома позволяет считать, что транспорт энергии через проницаемые контакты соизмерим с суммарным энергопроизводством одной клетки. Развитая электропроводимость может лежать в основе специализации клеток в пределах одного трихома, например, для гетероцистных цианобактерий, при которой одни из них являются энергетическими донорами, осуществляя фотосинтез, а другие могут потреблять эту энергию, например, для осуществления азотфиксации.
На основе изучения кинетики внеклеточных токов одиночного трихома показано, что фотоэлектрическая активность является многоступенчатым процессом. В частности, при сверхвысокой освещенности наблюдалось двухфазное нарастание внеклеточных токов с последующим спадом до некоторого постоянного значения при постоянном освещении (Асланиди, 1998).
Поскольку как современные, так и ископаемые пленки морфогенетически представляют собой целостные образования, нами проводилось электрофизиологическое изучение пленчатого сообщества как целого.
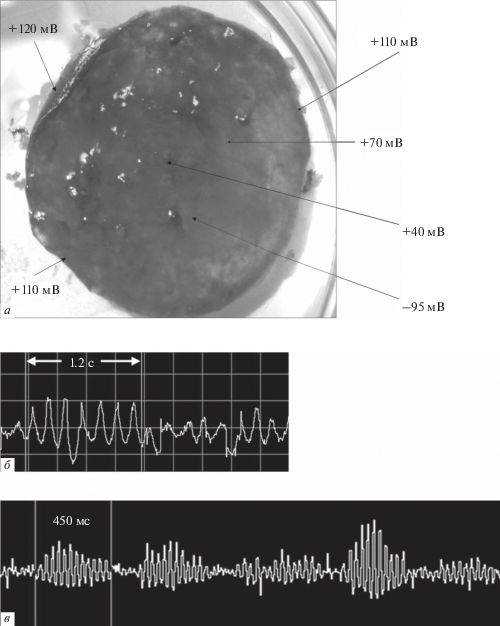
В экспериментах электрофизиологическое исследование активности сообщества цианобактерий Oscillatoria terebriformis было проведено на разных стадиях решения ими совместной задачи – создания пленки (Греченко, 2012). Электрическая активность индивидуальной цианобактерии, зарегистрированная внутриклеточным микроэлектродом, характеризуется стабильной по частоте и амплитуде ритмикой, амплитуда отдельных осцилляций достигает 50 мВ при уровне мембранного потенциала от –45 до 50 мВ. Сигнал обладает очень высокой устойчивостью по частоте и амплитуде, он монолитный, в нем нет проявлений многокомпонентности. Регистрация полевых электрических потенциалов от сообщества показала, что для зрелой пленки типичны синхронизированные осцилляции частотой от 3 до 35–40 Гц (рис. 4). Амплитуда колебаний не превышала 20 мкВ.
Рис. 4.
Электрофизиологическая активность цианобактерий: а – распределение зарядов в зрелой пленке; б – низкочастотные веретена, f – около 6 Гц; в – высокочастотные веретена, f – около 27 Гц.
Предполагается, что суммарные электрические осцилляции зависят от совместной активности цианобактерий, которая по интенсивности различна в разных местах сообщества. Поскольку предыдущими экспериментами было выявлено, что сообщество обладает способностью к регенерации, которая осуществляется направленным движением групп нитей, пленка была травмирована – надорвана в нескольких местах, чтобы спровоцировать необходимую для эксперимента активность в конкретном месте и в конкретное время. Затем в течение нескольких дней регистрировали электрическую активность различных структур при осуществлении нитями совместных действий для воссоздания целостности сообщества.
Результаты показали, что сила и выраженность электрических осцилляций зависит от места регистрации: наиболее мощная синхронизированная высокоамплитудная активность – до 50 мкВ – характерна для областей интенсивного движения нитей, в которых сформировались структуры типа тяжей, выполняющие коммутирующую функцию между восстанавливающимися краями разрыва пленки. В областях, где не происходило интенсивное образование новых структур, электрическая активность была представлена низкоамплитудными колебаниями потенциалов, амплитуда которых не превышала 5 мкВ (рис. 5).
Рис. 5.
Электрическая активность цианобактерий при высокой (а, б) и низкой (в, г) интенсивности морфогенеза (по: Греченко, 2012).
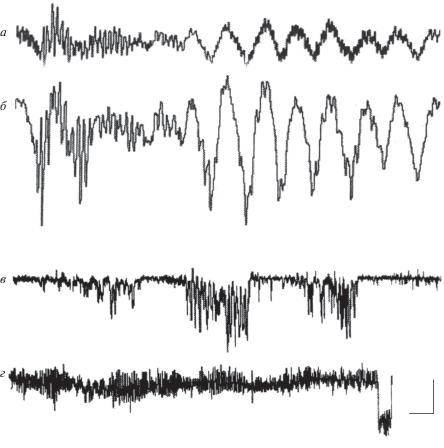
Выявлена прямая связь между выраженностью синхронизированной электрической активности (осцилляциями) цианобактерий и интенсивностью деятельности по решению задачи восстановления целостности сообщества: чем активнее электрические осцилляции, тем активнее и морфогенетические движения нитей.
С эволюционной точки зрения важно, что проявление фундаментального поведенческого механизма – эндогенной ритмической активности – наблюдается у одних из древнейших организмов, цианобактерий. Она позволяет им синхронизировать свои индивидуальные осцилляторы и осуществлять целенаправленное индивидуальное и коллективное поведение при образовании сообщества. Очевидно, что при пространственных перемещениях условия существования нитей в разных частях формируемых структур являются благоприятными в различной степени. Следовательно, поведение отдельных нитей в конкретные интервалы времени определяется приоритетами сообщества как целого.
Таким образом, у цианобактерий выявлена электрическая активность, обеспечивающая, по крайней мере, когнитивные, регулятивные и коммуникативные функции.
Поскольку цианобактериальное сообщество занимает промежуточное положение между популяцией и организмом, полученные данные подтверждают выводы В.Я. Бродского (2009) об определяющей роли развития природных информационных систем в становлении организмов.
Координация морфогенеза в ископаемых сообществах цианобактерий (строматолитах)
На ископаемом материале направленное изменение формы и структуры цианобактериальных сообществ можно проследить по изменению формы строматолитов. Большинство строматолитов обладают столь простой формой, что они вначале считались абиогенными образованиями. Однако строматолиты сложной формы (например, представители р. Gymnosolen) первоначально были отнесены к скелетам примитивных многоклеточных эукариот (Маслов, 1960). Такой разброс мнений в отношении одного объекта объясняется тем, что в течение длительного времени (до 1930-х годов) не был установлен организм-строматолитообразователь, а у самого строматолитообразователя, в свою очередь, способность к морфогенезу была обнаружена гораздо позже.
Среди строматолитов сложной формы выделяется сем. Tyssagetacea Vlasov (Власов, 1977), представители которого характеризуются не выпуклыми, присущими большинству строматолитов, а вогнутыми элементами поверхности. В целом, усложнение формы строматолитов происходит от пластовых к столбчатым при общем увеличении выпуклости слоев. Выпуклые формы поверхности возникают как при биогенном, так и абиогенном осаждении, вогнутые же формы абиогенного генезиса возникают при потере материала, например при растворении известняков или выгорании поверхности метеоритов. У тиссагетовых процесс накопления материала и форма находятся в соотношении, обратном тому, которое задается абиогенными процессами и, следовательно, предполагает наибольший биологический контроль.
Помимо общей формы, тиссагетовые отличаются от других строматолитов наличием сложного микрорельефа слоев. Унаследованное развитие микрорельефа определяет развитие макроскопических форм поверхности (рис. 2з).
Микрорельеф состоит из бугорков и ребер, названных Ф.Я. Власовым “стигмы” и “граммы”, их сочетание на поверхности строматолитового слоя образует сеть с ячейками миллиметровой размерности (Власов, 1970). Развитие сети начинается с появления стигм (рис. 2д), вокруг них затем возникает ореол грамм (рис. 2е), из которых дальнейшее развитие получают только те, что соединяют стигмы и впоследствии образуют сеть (рис. 2ж). При росте строматолита в одних участках сети карбонат откладывается с большей интенсивностью, в других – с меньшей, что приводит к образованию макроскопических форм рельефа – возвышений и впадин (по Власову “конвекс” и “конкав”) (рис. 2з). Если образование пары слоев строматолита считать сезонным циклом его роста, непрерывность морфогенеза наблюдается на протяжении десятков и сотен лет, включая формирование микроскульптуры (рис. 6). При колебаниях условий в природной обстановке план морфогенетического ответа остается постоянным в течение всего этого времени.
Рис. 6.
Микроскульптура на вертикальном срезе постройки (по: Власов, 1970). Масштабная линейка: 10 мм.

Также Ф.Я. Власовым была отмечена связь развития микрорельефа со сложностью преобразований формы слоя и у строматолитов с выпуклыми слоями. Наиболее сложным моментом роста, требующим максимального биологического контроля, является деление арки – вершины слоя. Ему также предшествует развитие вышеописанных форм микрорельефа, возникающих на месте будущего деления (рис. 7). У строматолитов с коническими слоями (р. Conophyton), имеющих выпуклую, но также наименее сходную с абиогенной форму, микрорельеф существует постоянно, определяя вершину конуса одной или несколькими стигмами, а стороны – очень длинными граммами.
Рис. 7.
Развитие микроскульптуры (слева и справа), обеспечивающее деление арки (в центре). Обобщенная схема (по: Власов, 1970).
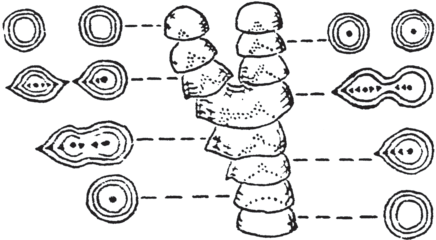
Ф.Я. Власовым было высказано предположение, что микрорельеф является ископаемыми следами управляющей системы, определявшей ход макроскопического морфогенеза. Поскольку авторами на современном материале была обнаружена подобная управляющая система и удалось непосредственно наблюдать управление ею ходом макроскопического морфогенеза, стало возможным провести сопоставление морфогенеза современных цианобактериальных пленок и ископаемых построек тиссагетовых (рис. 2).
Отдельно следует оговорить неясность физиологического смысла вогнутых форм поверхности строматолитов. Физиологический смысл выпуклых форм у строматолитов состоит в удалении осадка с поверхности фотосинтезирующей пленки и разгрузки его в межстолбиковом пространстве, уходе из зоны взмучивания и увеличении поверхности фотосинтеза. Образование вогнутой формы может быть связано с противодействием придонному волнению или с перераспределением светового потока в условиях низкой скорости осадконакопления. Более определенно на данном этапе изучения пока сказать трудно.
Как в сообществе современных цианобактерий, так и при образовании тиссагетовых строматолитов наблюдается полигональная сеть с утолщениями в узлах ячеек. Вначале возникают узлы ячеек, затем – равномерный ореол лучей вокруг них, позже преимущественное развитие получают лучи, соединяющие узлы. Далее происходит разделение функций отдельных участков сети – в сообществе цианобактерий возникают зоны сжатия и растяжения, у строматолитов наблюдаются зоны более и менее интенсивного отложения карбоната. В обоих случаях управляющая система отвечает за процессы наибольшей интенсивности: у пленок цианобактерий – за быстрые и масштабные механические перемещения, у строматолитов – за образование форм, требующих наибольшего биологического контроля. В сообществе цианобактерий и у строматолитов сеть образуется только в то время, когда происходят наиболее сложные и интенсивные морфогенетические процессы. У строматолитов существование управляющей системы прерывисто у столбчатых форм со слабо выпуклыми слоями, а у конофитонов и тиссагетовых оно непрерывно (Власов, 1970). Общим является и изменение строения на двух уровнях (микро- и макроскопическом), и опережение развития микроструктур относительно макроструктур22. При прерывистом действии факторов среды в обоих случаях план морфогенетических изменений осуществляется непрерывно.
Сходство сетчатой структуры современных цианобактериальных пленок с микроскульптурой и микроструктурой строматолитовых слоев некоторых построек привлекало внимание многих авторов (Shepard, Sumner, 2010; Sim et al., 2012; Tamulonis, Kaandorp, 2014). Однако ими, например Сим с соавт. (Sim et al., 2012), рассматривалась возможная морфогенетическая роль сгущений как самостоятельных образований, иногда соединенных между собой пучками “выровненных” нитей, а не сети в целом. Обнаружение целенаправленной механической активности сети как целостной системы, направляющей морфогенетические процессы в макроскопических масштабах, позволяет уверенно предполагать и ее ведущую роль в позиционировании и дифференциации химической активности при образовании сложных форм строматолитов.
Унаследованная дифференциация участков поверхности строматолита, приводящая к образованию макрорельефа, возможна только благодаря постоянно существующим различиям в скорости отложения карбоната, что предполагает возможность строматолитообразователей целенаправленно регулировать этот процесс, постоянно сохраняя позиционирование зон высокой и низкой скорости его протекания. В сравнении с механическим действием полигональной сети как управляющей системы, эти зоны аналогичны зонам сжатия и растяжения.
В современных сообществах цианобактерий полигональная сеть способна перераспределять кислород как в растворенном виде, так и в газообразном. Сим с коллегами (Sim et al., 2012) указывают, что в отдельных элементах сети, которые они называет сгущениями, продукция фотосинтеза и концентрация растворенного кислорода находятся не в прямом, а в обратном соотношении, что указывает на деятельность сети как распределительной системы. Также нами наблюдалась распределительная функция отдельных тяжей, в которых концентрация растворенного кислорода поднималась до его перехода в газообразное состояние, и последующий его транспорт через специализированный канал в оболочку газового пузыря (Сумина, 2006). Тяжи в морфогенезе являются структурами-предшественниками для оболочек газовых пузырей.
Контроль за отложением карбоната кальция у современных цианобактерий осуществляется при помощи фермента карбоангидразы. Этот фермент участвует в образовании карбонатного скелета и у эукариот, в частности, обеспечивает карбонатную минерализацию при образовании скелета у кокколитофорид и кораллов. Карбоангидраза известна в разных группах цианобактерий, где имеет локализацию как вне, так и внутри клетки (Куприянова, Пронина, 2011). Деятельность карбоангидразы в слизистом матриксе нитчатых цианобактерий приводит к его минерализации. Таким образом, у цианобактерий возможно управление интенсивностью отложения карбоната при помощи избирательной ферментной активности.
Формирование опорного минерального тела требует морфогенетического управления не только на макроскопическом, но и на более глубоких уровнях, включая управление ростом кристаллов. У эукариот управление на таком тонком уровне происходит при помощи органических матриц, задающих рост кристаллитов. Сходные органические пластины были выделены и из минеральных отложений цианобактерий (Голубев С.Н., Голубев С.С., 2009).
Интерпретация экспериментальных и палеонтологических данных
Таким образом, к настоящему моменту можно назвать четыре способа управления сообществом цианобактерий своей формой как в неминерализованном, так и минерализованном (строматолиты) состоянии: морфологический, матричный, электрический и биохимический, со специализированными структурами управления для каждого способа. Поскольку процесс морфогенеза является управляемым на разных уровнях (от макроморфологического до молекулярного), можно предполагать, что он происходит в рамках единого информационного пространства.
Процессы морфогенеза в конкретных современных и ископаемых сообществах цианобактерий, рассмотренные в настоящей статье, благодаря “примитивности” этих объектов позволяют затронуть также и некоторые общие вопросы, касающиеся становления формы организмов.
Несмотря на то, что форма живых организмов соответствует условиям их обитания, сами условия обитания непосредственно их форму не определяют. В отношении формообразования это, наверное, главное, что отличает живые объекты от неживых. Более того, форма организмов не определяется даже их собственным строением, так как строение многократно изменяется в течение онтогенетического развития. Онтогенез прямо не связан с текущими жизненными потребностями, ход его направлен на обеспечение потребностей организма на последующих стадиях его развития. Следовательно, в морфогенезе наблюдается то же явление “опережающего отражения” (Анохин, 1978), что и в других аспектах существования организма, объединяемых понятием “поведение”.
Установленное для многоклеточных эукариот и на их же примере явление эквифинальности онтогенеза (Белоусов, 2005) состоит в том, что конечная форма самого организма и его частей может достигаться множеством разных способов. Форма является результатом реализации ранее возникшей модели, а не осуществлением однозначной смены стадий развития. Конечная стадия онтогенеза в большинстве случаев является более сложной, чем каждая из предыдущих. Но по сравнению с суммой предыдущих стадий развития, включая способы перехода между ними, конечная стадия оказывается более простой. Иными словами, сложность пути достижения результата превышает сложность самого результата.
Это же относится и к информационным процессам обеспечения морфогенеза. Моделирование промежуточных стадий и выбор между их вариантами предполагает обработку и реализацию много большего объема информации, чем тот, который определяет вид конечной формы.
У многоклеточных эукариот исследование причин изменения формы в филогенезе, а также соотношения в этом процессе случайности и направленности затрудняется прерыванием изменения формы половым размножением, ранней дифференциацией клеток, избыточностью потомства. Иными словами, среди многоклеточных эукариот невозможно найти организм, изменяющий свою форму (в эволюционном и систематическом смысле) в соответствии с изменением внешних условий. На пути от одной формы к другой всегда будет множество организмов, разделенных сменой поколений.
Если рассматривать эукариотные клетки как специализированные многоклеточные прокариоты (Гусев, Гохлернер, 1980), то нити цианобактерий следует считать также многоклеточными прокариотами, но менее специализированными и иначе организованными. Исходя из этого, многоклеточные эукариоты (= сообщество эукариотных клеток) и сообщество нитчатых цианобактерий могут рассматриваться как объекты одного уровня организации и, следовательно, могут быть сопоставлены при исследовании причин изменения биологической формы.
Наиболее существенно то, что таксономически значимые изменения формы у строматолитов (ископаемых сообществ цианобактерий) происходят на протяжении существования одного объекта (одной особи, в том смысле, насколько это понятие применимо к строматолитам).
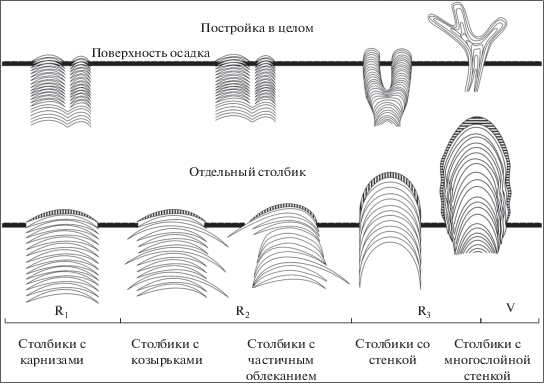
У сообществ цианобактерий, в том числе ископаемых, форма не является постоянной, но она всегда определенная и соответствует, как и у любого целостного организма, конкретным условиям существования. Поскольку в геологическом времени, например, в течение рифея (1650–650 млн лет назад) условия образования строматолитов кардинально не менялись (Семихатов, Раабен, 1996), а форма построек изменилась принципиально (рис. 8), можно с большой долей уверенности разделить влияние на эволюцию строматолитов изменения условий обитания и накопление морфогенетической информации организмами.
Рис. 8.
Принципиальное изменение формы и строения строматолитовых построек во времени (в интервале 1650 (R1) – 570 (V) млн лет).
При образовании строматолита пленка цианобактерий в процессе своей жизнедеятельности минерализуется. При сезонном засыпании осадком нити перемещаются на его поверхность и образуют следующий минерализованный слой. Таким способом возникают строматолитовые постройки, которые позволяют проследить изменение формы одной пленки во временном интервале до нескольких десятков тысяч лет. Различные отрезки построек чаще всего отвечают диагнозам различных таксонов (Крылов, 1975).
Таким образом, в пленке, образующей непрерывную постройку, можно наблюдать процесс, одновременно несущий черты как онтогенеза, так и филогенеза. Можно предположить, что сообщества нитчатых цианобактерий находятся на тех эволюционных стадиях, когда процессы онто- и филогенеза еще не дифференцированы. На этих стадиях также еще не сформировалась и эквифинальность морфогенеза.
Если в случае строматолитов такие изменения можно непрерывно наблюдать в течение десятков тысяч лет, то у современных сообществ их можно наблюдать в течение часов. И в том, и в другом случае форма объектов и способы ее образования могут являться только результатом избирательного позиционирования нитей, а оно не может быть достигнуто без общей модели, создаваемой каждой из них, и без общих для них способов изменения этой модели.
Данное положение можно проиллюстрировать на примере любого столбчатого строматолита. Для образующего его сообщества цианобактерий полезные свойства такой формы очевидны: большая часть его площади находится ближе к свету, чем поверхность осадка; уменьшается засыпание сообщества вновь выпавшим осадком; множество столбиков, например в биогерме, гасят придонное волнение и т.д. Наилучшие условия для индивидуального существования нитей цианобактерий складываются на его вершине. Если бы поведение нитей определялось фототаксисом, то нити, находящиеся на боковых сторонах, стремились бы к вершине и столбчатый строматолит просто не мог бы образоваться. Следовательно, основой поведения нитей при образовании строматолита являются не их индивидуальные потребности, а модель общей формы сообщества.
Разобщение сообщества цианобактерий на отдельные нити при образовании каждого нового слоя строматолита и сохранение общего направления изменения формы строматолита говорят о том, что носителем информации об изменении формы строматолита является не сообщество, а каждая отдельная нить.
Если рассматривать такую черту строения строматолитов, как ветвление (Раабен, 1969), то конечный его результат является вполне физиологически осмысленным для сообщества цианобактерий, поскольку позволяет поддерживать оптимальные пропорции постройки. Однако начальные стадии, начиная с ветвления макушки, выглядящего как небольшие неровности, физиологического смысла в момент образования не имеют и обслуживают будущие состояния. При ветвлении постройки “опережающее отражение” определяет избирательное позиционирование нитей. Сезонная смена условий, отражающаяся в виде чередования слоев постройки, и разобщение сообщества происходят множество раз, однако модель морфогенеза остается стабильной.
Строматолиты позволяют судить о поведении цианобактерий только по его последствиям. Поведение цианобактерий в современных сообществах можно наблюдать непосредственно. Разнообразие возникающих в них структур сопоставимо с морфологическим разнообразием элементов построек, но они совершенно другие. Здесь также наблюдаются явления избирательного позиционирования и опережающего отражения. Так, например, при образовании тяжа (Сумина, Сумин, 2013) происходит смена нескольких структур, в момент их образования не несущих функциональной нагрузки ни в отношении самих нитей, ни в отношении сообщества. Физиологическое значение имеет только функция конечной структуры – перемещение или закрепление сообщества.
ЗАКЛЮЧЕНИЕ
Координация морфогенетической активности в современных и ископаемых сообществах цианобактерий может проходить как без формирования морфологически выраженной специализированной управляющей системы, так и при ее наличии. Управляющая система позволяет осуществлять процессы формообразования наибольшей интенсивности – при высоких скоростях преобразования формы современного сообщества и образовании ископаемых построек с наиболее сложной морфологией.
И морфогенез в целом, и сам процесс образования полигональной сети имеют телеономический характер.
Выражаем сердечную благодарность В.В. Алешину, О.А. Кокшаровой и В.К. Орлеанскому за ценные замечания и консультации при подготовке статьи.
Список литературы
Анохин П.К., 1978. Философские аспекты теории функциональной системы. М.: Наука. 399 с.
Асланиди К.Б., 1998. Электрогенез в невозбудимых многоклеточных системах. Автореф. дис. … докт. физ.-мат. наук. Пущино. 48 с.
Белоусов Л.В., 2005. Основы общей эмбриологии. М.: МГУ. 367 с.
Бродский В.Я., 2009. Прямые межклеточные взаимодействия и “социальное” поведение клеток млекопитающих, протистов и бактерий. Возможные причины многоклеточности // Онтогенез. Т. 40. № 2. С. 97–106.
Бурзин М.Б., 2003. Микроорганизмы в ископаемой летописи. Практические занятия по экологии микроорганизмов. М.: МАКС Пресс. 26 с.
Власов Ф.Я., 1970. Анатомия и морфология строматолитов раннего и среднего протерозоя Южного Урала // Материалы по палеонтологии Урала. Свердловск: УФ АН СССР. С. 152–175.
Власов Ф.Я., 1977. Докембрийские строматолиты из саткинской свиты Южного Урала // Материалы по палеонтологии среднего палеозоя Урала и Сибири. Свердловск: УНЦ АН СССР. С. 101–125.
Герасименко Л.М., Заварзин Г.А., 1993. Реликтовые цианобактериальные сообщества // Проблемы эволюции ведущих компонентов биосферы. М.: Наука. С. 221–252.
Герасименко Л.М., Орлеанский В.К., 2004. Актуалистическая палеонтология цианобактерий // Тр. Ин-та микробиологии им. С.Н. Виноградского. Вып. 13. С. 80–108.
Герасименко Л.М., Орлеанский В.К., Заварзин Г.А., 1989. Геохимическая деятельность водорослей в кальдере Узон (Камчатка) // Кальдерные микроорганизмы. М.: Наука. С. 45–72.
Голубев С.Н., Голубев С.С., 2009. Взгляд на физический микромир с позиции биолога. Владивосток: Дальнаука. С. 174–201.
Горюнова С.В., 1955. Явление хищничества у синезеленых водорослей // Микробиология. Т. 24. № 3. С. 271–274.
Греченко Т.Н., 2012. Биологические механизмы социализации // Экспериментальный метод в структуре психологического знания. М.: Ин-т психологии РАН. С. 816–821.
Гусев М.В., Гохлернер Г.Б., 1980. Свободный кислород и эволюция клетки. М.: МГУ. 223 с.
Гусев М.В., Никитина К.А., 1979. Цианобактерии. М.: Наука. 228 с.
Еленкин А.А., 1938. Синезеленые водоросли СССР. М.; Л.: АН СССР. 984 с.
Ермилова Е.В., Залуцкая Ж.М., Лапина Т.В., 2004. Подвижность и поведение микроорганизмов. Т. 1. Прокариоты. СПб.: Изд-во СПбГУ. 170 с.
Комар В.А., Раабен М.А., Семихатов М.А., 1965. Конофитоны рифея СССР и их стратиграфическое значение // Тр. ГИН АН СССР. Вып. 131. 72 с.
Крылов И.Н., 1975. Строматолиты рифея и фанерозоя СССР // Тр. ГИН АН СССР. Вып. 234. 243 с.
Куприянова Е.В., Пронина Н.А., 2011. Карбоангидраза – фермент, преобразивший биосферу // Физиология растений. Т. 58. № 2. С. 163–176.
Маслов В.П., 1960. Строматолиты (их генезис, метод изучения, связь с фациями и геологическое значение на примере ордовика Сибирской платформы). М.: АН СССР. 187 с.
Меннер В.В., 1962. Биостратиграфические основы сопоставления морских, лагунных и континентальных свит // Тр. ГИН АН СССР. Вып. 65. 375 с.
Определитель бактерий Берджи, 1997. М.: Мир. Т. 1. С. 375–409.
Орлеанский В.К., Герасименко Л.М., 1982. Лабораторное моделирование термофильного цианобактериального сообщества // Микробиология. Т. 51. № 4. С. 538–542.
Петров П.Ю., 1996. Модель морфогенеза строматолитов // Литология и полезные ископаемые. № 3. С. 258–269.
Петров П.Ю., 2002. Микробные маты и микробно-минеральные системы докембрия Бактериальная палеонтология. Инструменты, методы и задачи астробиологии. М.: ПИН РАН. 60 с.
Пиневич А.В., 2009. Микробиология. Биология прокариотов. Т. 3. СПб.: Изд-во СПбГУ. С. 339–343.
Потапова Т.В., 1990. Энергетические функции проницаемых межклеточных контактов. Автореф. дис. … докт. биол. наук. Пущино: ОНТИ НЦБИ РАН. 30 с.
Раабен М.Е., 1969. Строматолиты верхнего рифея (гимносолениды) // Тр. ГИН АН СССР. Вып. 203. 100 с.
Семихатов М.А., Раабен М.Е., 1996. Динамика глобального разнообразия строматолитов протерозоя. Статья 2. Африка, Австралия, Северная Америка и общий синтез // Стратиграфия. Геол. корреляция. Т. 4. № 1. С. 26–55.
Сумин Д.Л., Сумина Е.Л., 2017. Морфогенез как фрактальная организация поведения // Эволюционная и сравнительная психология в России. М.: Когито-Центр. С. 104–116.
Сумина Е.Л., 2002. Лабораторные наблюдения над культурой цианобактерий и проблема морфогенеза строматолитов. Бактериальная палеонтология. Инструменты, методы и задачи астробиологии. М.: ПИН РАН. 75 с.
Сумина Е.Л., 2006. Поведение нитчатых цианобактерий в лабораторной культуре // Микробиология. Т. 75. № 4. С. 532–537.
Сумина Е.Л., Сумин Д.Л., 2013. Морфогенез в сообществе нитчатых цианобактерий // Онтогенез. Т. 44. № 3. С. 203–220.
Brahamsha B., Devaki B., 2013. Motility in unicellular and filamentous cyanobacteria // The Cell Biology of Cyanobacteria / Eds Flores E., Herrero A. Caister: Academic Press. P. 233–262.
Campbell E., Hagen K., Meeks J., 2015. Genetic analysis reveals the identity of the photoreceptor for phototaxis in hormogonium filaments of Nostoc punctiforme // J. Bacteriol. V. 197. № 4. P. 782–791.
Cho W., Gonzales Y., Harwood T., Huynh J., Hwang Y. et al., 2017. Dynamic localization of HmpF regulates type IV pilus activity and directional motility in the filamentous cyanobacterium Nostoc punctiforme // Mol. Microbiol. V. 106. № 2. P. 252–265.
Hoiczyk E., Baumeister W., 1997. Oscillin an extracellular, Ca2+-binding glycoprotein essential for the gliding motility of cyanobacteria // Mol. Microbiol. V. 26. P. 699–708.
Hoiczyk E., Baumeister W., 1998. The junctional pore complex, a prokaryotic secretion organelle, is the molecular motor underlying gliding motility in cyanobacteria // Curr. Biol. V. 8. № 21. P. 1161–1168.
Khayatan B., Meeks J., Risser D., 2015. Evidence that a modified type IV pilus-like system powers gliding motility and polysaccharide secretion in filamentous cyanobacteria // Mol. Microbiol. V. 98. № 6. P. 1021–1036.
Krumbein W.E., 1983. Stromatolites – the challenge of a term in space and time // Precambrian Res. V. 20. P. 493–531.
Riley K., Gonzalez A., Risser D., 2018. A partner switching regulatory system controls hormogonium development in the filamentous cyanobacterium Nostoc punctiforme // Mol. Microbiol. V. 109. № 4. P. 555–569.
Risser D., Meeks J., 2013. Comparative transcriptomics with a motility-deficient mutant leads to identification of novel polysaccharide secretion system in Nostoc punctiforme // Mol. Microbiol. V. 87. № 4. P. 884–893.
Risser D., Chew W., Meeks J., 2014. Genetic characterization of the hmp locus, a chemotaxis-like gene cluster that regulates hormogonium development and motility in Nostoc punctiforme // Mol. Microbiol. V. 92. № 2. P. 222–233.
Shepard R., Sumner D., 2010. Undirected motility of filamentous cyanobacteria produces reticulate mats // Geobiology. V. 8. № 3. P. 179–196.
Sim M., Liang B., Petroff A., Evans A., Klepac-Ceraj V. et al., 2012. Oxygen-dependent morphogenesis of modern clumped photosynthetic mats and implications for the archean stromatolite record // Geosciences. V. 2. № 4. P. 235–259.
Springstein B., Woehle C., Weissenbach J., Helbig A., Dagan T., Stucken K., 2020. Identification and characterization of novel filament-forming proteins in cyanobacteria // Sci. Rep. V. 10. P. 1894.
Tamulonis C., Kaandorp J., 2014. A model of filamentous cyanobacteria leading to reticulate pattern formation // Life. V. 4. № 3. P. 433–456.
Ursell T., Man R., Chau W., Wisen S., Devaki B., Casey K., 2013. Motility enhancement through surface modification is sufficient for cyanobacterial community organization during phototaxis // PLoS Comput. Biol. V. 9. № 9. P. e1003205.
Walter M.R., 1976. Stromatolites. Amsterdam: Elsevier. 790 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии