Журнал общей биологии, 2021, T. 82, № 1, стр. 3-12
Мезенхимные стромальные клетки менструальной крови как ресурс для регенеративной медицины
О. В. Паюшина 1, *, Д. А. Цомартова 1, Е. В. Черешнева 1, М. Ю. Иванова 1, Т. А. Ломановская 1, С. Л. Кузнецов 1
1 Первый Московский государственный медицинский университет им. И.М. Сеченова
Министерства здравоохранения РФ
119991 Москва, Трубецкая ул., 8, стр. 2, Россия
* E-mail: payushina@mail.ru
Поступила в редакцию 22.06.2020
После доработки 30.08.2020
Принята к публикации 24.09.2020
Аннотация
Развитие технологий регенеративной медицины порождает потребность в доступном источнике клеток для стимуляции восстановительных процессов в патологически измененных тканях и органах. Таким источником может служить менструальная кровь с фрагментами десквамированного эндометрия, которые содержат мезенхимные стромальные клетки (МСК), участвующие в регенерации функционального слоя эндометрия в ходе менструального цикла. Эти клетки фенотипически сходны с МСК из других клинически значимых источников (костного мозга, жировой ткани, зубной пульпы, тканей последа), способны к активному росту in vitro, обладают широким спектром потенций к дифференцировке. Секретируя паракринным образом различные биологически активные вещества, они стимулируют выживание и пролиферацию клеток поврежденных тканей, регулируют иммунные реакции и ангиогенез, предотвращают фиброз. В настоящее время активно исследуется возможность применения МСК из менструальной крови в различных областях медицины. В экспериментах на животных показана перспективность клеточной терапии с их использованием для лечения патологий сердечно-сосудистой, нервной и репродуктивной системы, кожных ран, миодистрофии, сахарного диабета, заболеваний печени, легких, кишечника и других органов. Однако для успешного внедрения МСК из менструальной крови в широкую медицинскую практику требуются дальнейшие исследования, направленные на оптимизацию протокола выделения клеток, оценку возможных рисков их введения пациенту, преодоление проблемы их низкой выживаемости в очаге поражения и выяснение клеточных и молекулярных механизмов оказываемого ими регенеративного эффекта.
Разработка клеточных технологий, направленных на структурное и функциональное восстановление патологически измененных тканей и органов, относится к приоритетным направлениям современной медицинской науки. Одним из наиболее перспективных ресурсов для клеточной терапии являются мезенхимные стромальные клетки (МСК), практически повсеместно распространенные по организму, способные к направленной миграции в зоны тканевых дефектов и комплексно воздействующие на различные аспекты восстановительного процесса, в первую очередь путем паракринной продукции биологически активных молекул. Секретируемые МСК цитокины, хемокины, факторы роста и прочие регуляторные молекулы оказывают митогенное, цитопротективное, иммуномодулирующее, проангиогенное и антифибротическое действие, обеспечивая полноценную регенерацию поврежденной ткани (Samsonraj et al., 2017). Регенеративные эффекты МСК в значительной степени связаны с продукцией ими не только растворимых факторов, воздействующих на поверхностные рецепторы, но и внеклеточных везикул, способных передавать комплекс содержащихся в них биоактивных молекул непосредственно в цитоплазму клетки-мишени при слиянии с ее плазматической мембраной (Konala et al., 2016). Обладая широким спектром потенций к дифференцировке, которые, возможно, не ограничиваются образованием клеточных элементов тканей мезенхимного происхождения (Samsonraj et al., 2017), МСК могут также замещать в поврежденных тканях погибшие клетки путем дифференцировки в соответствующем направлении. В некоторых случаях показано также слияние МСК с клетками регенерирующей ткани (Freeman et al., 2015; Huda et al., 2016). Кроме того, МСК способны передавать поврежденным клеткам митохондрии, что приводит к восстановлению нарушенного энергетического обмена (Paliwal et al., 2018). Помимо сказанного, привлекательность МСК для использования в регенеративной медицине определяется легкостью их выделения и культивирования, несклонностью к злокачественной трансформации и низкой иммуногенностью, позволяющей проводить аллогенные трансплантации (Samsonraj et al., 2017).
При оценке перспектив клинического применения МСК встает вопрос о том, из каких тканевых источников их наиболее целесообразно выделять для последующей экспансии in vitro и трансплантации пациенту. Исторически первым и, как следствие, наиболее изученным источником МСК является костный мозг, стромальные клетки которого к настоящему времени всесторонне охарактеризованы и служат своего рода эталонной популяцией для сравнения свойств МСК различной тканевой принадлежности. Выделенные из него клетки обладают выраженными потенциями к дифференцировке в основных свойственных МСК направлениях – остеогенном, адипогенном и хондрогенном (Li et al., 2015), что позволяет успешно использовать их для восстановления скелетных тканей. Однако процедура забора костного мозга достаточно травматична, а доля МСК среди его клеток крайне низка (Asatrian et al., 2015). Кроме того, численность МСК в костном мозге, а также их способность к пролиферации и дифференцировке снижаются с возрастом, что затрудняет получение клеток от пожилых пациентов (Charif et al., 2017). Значительно большее количество МСК содержится в стромально-сосудистой фракции жировой ткани, которая может быть получена в ходе абдоминопластической операции либо процедуры липосакции (Yoshimura et al., 2007; Schneider et al., 2017). МСК жировой ткани превосходят таковые из костного мозга по способности к пролиферации (Li et al., 2015) и адипогенезу (Xu et al., 2017), однако уступают им по потенциям к остеогенезу и, по некоторым данным, к хондрогенезу (Li et al., 2015; Xu et al., 2017). Клетки со свойствами МСК, характеризующиеся более высокими, чем у клеток костного мозга, эффективностью клонирования и скоростью роста, могут быть выделены также из пульпы зубов (Ercal et al., 2018). Впрочем, их применение в клинике затруднено малым количеством пульпы в зубе, что требует длительной экспансии клеток в культуре (Asatrian et al., 2015). Еще одним источником МСК для клинического применения могут служить ткани последа – плацента и пуповина, из которых клетки могут быть выделены в большом количестве неинвазивным методом и сохранены для последующего использования. МСК из различных областей пуповины и плаценты, в зависимости от локализации, несколько различаются между собой по характеру роста и дифференцировки (Beeravolu et al., 2017), но в целом уступают МСК из костного мозга по способности к адипогенезу (Jeon et al., 2016) и хондрогенезу (Bernardo et al., 2007).
Менструальная кровь, в которой также обнаружены клоногенные клетки с характерными для МСК антигенным фенотипом и потенциями к дифференцировке (Meng et al., 2007; Patel et al., 2008), имеет ряд преимуществ перед другими клинически значимыми источниками МСК. В частности, это возможность многократного получения материала от одного донора, неинвазивность процедуры его забора, легкость выделения клеток в культуру. В настоящем обзоре рассмотрены биологические характеристики МСК менструальной крови и возможности их использования в регенеративной медицине.
ЛОКАЛИЗАЦИЯ И ФУНКЦИИ МСК В ЭНДОМЕТРИИ
Как известно, на протяжении репродуктивного периода жизни женщины эндометрий многократно претерпевает циклические изменения, включающие десквамацию и регенерацию его функционального слоя, что предполагает наличие в нем стволовых и родоначальных клеток, обеспечивающих восстановление как эпителиального, так и стромального компонентов. Эпителиальные предшественники, ответственные за регенерацию маточных желез, локализуются, по-видимому, в базальном слое эндометрия и, как следствие, в менструальной крови практически не обнаруживаются (Gargett et al., 2016). В то же время клетки с характерным для МСК поверхностным фенотипом, способные к клональному росту и дифференцировке в различные мезенхимные производные, могут быть выделены не только из ткани эндометрия, полученной при гистерэктомии (Darzi et al., 2016), но и из менструальной крови (Meng et al., 2007). При этом клетки, получаемые из обоих источников, сходны по морфологии и функциональным характеристикам (Rodrigues et al., 2016), что может свидетельствовать о происхождении МСК менструальной крови из функционального слоя эндометрия. Связь МСК с десквамированным функциональным слоем была прямо продемонстрирована в эксперименте по раздельному посеву в культуру различных фракций менструальной крови: большинство клоногенных клеток обнаруживались в присутствующих в ней тканевых фрагментах отторгшегося эндометрия (Liu et al., 2018).
Клетки с характеристиками МСК, способные к клональному росту, самоподдержанию in vitro и дифференцировке во множественных направлениях, могут быть выделены из ткани эндометрия путем сортинга по антигену SUSD2 либо по сочетанию маркеров CD140b и CD146. Как показывает гистохимическое окрашивание образцов эндометрия на эти маркеры, МСК локализуются вокруг сосудов базального и функционального слоев в положении перицитов и, возможно, также адвентициальных клеток (Darzi et al., 2016). Помимо этих клеток, строма эндометрия содержит фибробласты, которые отличаются от МСК профилем экспрессии генов, отсутствием клоногенности и более ограниченными потенциями к дифференцировке (Gargett et al., 2016). Очевидно, при отторжении функционального слоя фибробласты, наряду с МСК, также попадают в менструальную кровь. Гетерогенность получаемой из нее популяции стромальных клеток следует учитывать при оценке их биологических характеристик и терапевтического потенциала.
О том, что резидентные МСК эндометрия играют ключевую роль в его росте и физиологической регенерации, может свидетельствовать их способность к формированию эндометриальной ткани при ксенотрансплантации под капсулу почки иммунодефицитных мышей (Cervelló et al., 2011), а также повышение процентной доли клоногенных стромальных клеток в эндометрии в пролиферативную фазу менструального цикла (Darzi et al., 2016). Предполагается, что недостаточность количества и/или нарушение функциональности МСК могут быть причиной таких патологических состояний, как тонкий дисфункциональный эндометрий, не отвечающий на стимуляцию эстрогенами и неспособный обеспечить имплантацию зародыша, и синдром Ашермана, характеризующийся замещением эндометрия фиброзной тканью и развитием спаечного процесса в матке (Gargett et al., 2016). Это предположение подтверждается результатами клинических испытаний, показавших значительное увеличение толщины эндометрия после трансплантации аутологичных МСК из менструальной крови пациенткам с синдромом Ашермана (Tan et al., 2016). При беременности МСК, вероятно, принимают участие в децидуализации эндометрия. Во всяком случае, показано, что эндометриальные МСК могут быть индуцированы к дифференцировке в децидуальные клетки in vitro, значительно превосходя по этой способности МСК из костного мозга и жировой ткани (Домнина и др., 2015), а их трансплантация в матку псевдобеременных крыс стимулирует развитие всех элементов децидуальной ткани (Domnina et al., 2013).
По-видимому, содержащиеся в эндометрии МСК играют важнейшую роль не только в нормальном функционировании этой ткани, но и в ее патологическом разрастании за пределами слизистой оболочки матки – эндометриозе. В качестве основной причины эндометриоза рассматривается ретроградная менструация, ведущая к проникновению в брюшную полость фрагментов десквамированного эндометрия со стволовыми клетками (Xu et al., 2015; Gargett et al., 2016), однако показана также возможность гематогенного распространения МСК из областей эктопического разрастания эндометрия с образованием новых очагов заболевания (Li et al., 2018). Обсуждается также возможное участие МСК в развитии аденомиоза (Gargett et al., 2016) и рака эндометрия (Xu et al., 2015).
ФЕНОТИПИЧЕСКИЕ И ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ МСК МЕНСТРУАЛЬНОЙ КРОВИ
МСК могут быть выделены из менструальной крови на протяжении всего периода менструации (Kovina et al., 2018). В связи с тем, что работа с менструальной кровью затруднена ее высокой вязкостью, а также присутствием сгустков и десквамированного эпителия, ряд авторов включают в протокол выделения МСК из этого источника центрифугирование в градиенте плотности с отбором фракции мононуклеарных клеток (Meng et al., 2007; Chen et al., 2015b; Mehrabani et al., 2016; Ren et al., 2016). Однако эффективность выделения МСК при этом оказывается значительно меньшей, чем при культивировании цельной крови (Dalirfardouei et al., 2018), так как МСК преимущественно содержатся во фрагментах эндометриальной ткани, которые при такой обработке теряются (Sun et al., 2019). В то же время при культивировании менструальной крови, не очищенной от эритроцитов, выходящий из них гемоглобин может оказывать токсическое действие на клетки (Kovina et al., 2018). Появившиеся в последние годы методики изоляции, включающие лизис эритроцитов в сочетании с центрифугированием в градиенте плотности (Kovina et al., 2018) или без него (Sun et al., 2019), позволяют получать МСК из менструальной крови с достаточно высокой эффективностью, однако оптимальный протокол их изоляции к настоящему времени еще не разработан.
По антигенному фенотипу клоногенные стромальные клетки, выделенные из менструальной крови, соответствуют критериям, предложенным Международным обществом клеточной терапии для идентификации мультипотентных МСК человека (Dominici et al., 2006): они экспрессируют поверхностные антигены CD73, CD90 и CD105 при отсутствии кроветворных маркеров CD45, CD34, CD14, CD19 и HLA-DR (Meng et al., 2007; Hu et al., 2014; Kovina et al., 2018; Liu et al., 2018). На их поверхности также обнаруживаются характерные для МСК антигены CD29 и CD44 (Meng et al., 2007; Ren et al., 2016; Sun et al., 2019). В целом по антигенному фенотипу МСК из менструальной крови сходны с таковыми из других клинически значимых источников, таких как костный мозг, пуповинная кровь, жировая ткань и пульпа зуба (Domnina et al., 2013; Chen et al., 2015b; Ren et al., 2016). В то же время на их поверхности отсутствует антиген STRO-1, типичный для МСК из костного мозга (Gargett et al., 2016).
Сведения об экспрессии МСК менструальной крови маркеров, свойственных плюрипотентным клеткам, неоднозначны. В первых работах по характеристике клеток из этого источника сообщалось об экспрессии ими OCT-4 при отсутствии SSEA-4, SOX-2 и NANOG (Meng et al., 2007; Patel et al., 2008), однако впоследствии SOX-2 и NANOG в них были выявлены (Sun et al., 2019). Некоторые авторы сообщают также о присутствии SSEA-4 по крайней мере на части клеток этой популяции (Земелько и др., 2011; Rossignoli et al., 2013; Sun et al., 2019), тогда как другие его не обнаруживают (Wu et al., 2014; Chen et al., 2015b). Противоречивыми остаются и данные об экспрессии этими клетками OCT-4: имеются сообщения как о наличии в них этого маркера (Wu et al., 2014; Khanjani et al., 2015), так и о его отсутствии (Земелько и др., 2011). Возможно, расхождения между данными разных авторов связаны с различиями в возрасте доноров, условиях выделения и культивирования клеток, а также использованных методах оценки антигенного фенотипа.
По оценкам разных авторов, при культивировании in vitro МСК менструальной крови способны пройти 18–27 пассажей (Meng et al., 2007; Rossignoli et al., 2013; Wu et al., 2014; Chen et al., 2015a, b; Liu et al., 2018) или не менее 45–68 удвоений популяции (Meng et al., 2007; Земелько и др., 2011), причем в ходе длительного пассирования их кариотип сохраняется стабильным (Meng et al., 2007; Земелько и др., 2011; Wu et al., 2014). Вероятно, высокий пролиферативный потенциал этих клеток связан с наличием в них теломеразы, активность которой остается достаточно высокой даже на поздних пассажах (Patel et al., 2008). Время удвоения популяции в ранние сроки культивирования составляет 20–27 ч (Meng et al., 2007; Patel et al., 2008; Земелько и др., 2011; Rossignoli et al., 2013; Wu et al., 2014; Chen et al., 2015a, b; Kovina et al., 2018). По скорости роста МСК из менструальной крови превосходят таковые из костного мозга (Wu et al., 2014) и жировой ткани (Chen et al., 2015b; Kovina et al., 2018) и сопоставимы с клетками пульпы зуба (Ren et al., 2016), но уступают клеткам пуповинной крови (Chen et al., 2015b; Ren et al., 2016). При длительном пассировании пролиферация МСК из менструальной крови замедляется (Chen et al., 2015a; Ren et al., 2016; Liu et al., 2018). Отмечена также отрицательная корреляция скорости роста и пролиферативного потенциала МСК с возрастом донора менструальной крови (Chen et al., 2015a; Mehrabani et al., 2016; Liu et al., 2018).
МСК менструальной крови обладают широким спектром потенций к дифференцировке. Они могут быть индуцированы к дифференцировке in vitro в остеогенном, адипогенном и хондрогенном направлениях с приобретением соответствующих морфологических и цитохимических характеристик (Patel et al., 2008; Rossignoli et al., 2013; Wu et al., 2014; Liu et al., 2018), что подтверждает принадлежность этих клеток к категории мультипотентных МСК. В то же время по сравнению с МСК костного мозга клетки из менструальной крови менее способны к остеогенезу (Kovina et al., 2018; Lv et al., 2018) и, по некоторым данным, к адипогенезу (Khanmohammadi et al., 2014); по адипогенным потенциям они уступают также МСК из пуповинной крови и пульпы зуба (Ren et al., 2016; Lv et al., 2018). Показана также способность МСК менструальной крови дифференцироваться в другие мезодермальные производные – кардиомиоциты (Meng et al., 2007; Patel et al., 2008; Liu et al., 2018), эндотелий и миоциты (Meng et al., 2007). При сокультивировании с соответствующими зрелыми клетками они дифференцируются в теноциты сухожилия (Zheng et al., 2017) и клетки пульпозного ядра межпозвоночного диска (Hu et al., 2014). Имеются и сообщения о возможности дифференцировки МСК менструальной крови в производные энтодермы – гепатоциты (Meng et al., 2007; Khanjani et al., 2015), клетки поджелудочной железы и респираторного эпителия (Meng et al., 2007) – и эктодермы – глиальные и нейроноподобные клетки (Meng et al., 2007; Patel et al., 2008; Liu et al., 2018) и кератиноциты (Akhavan-Tavakoli et al., 2017). Более того, в одной из работ было продемонстрировано, что при культивировании МСК из менструальной крови в присутствии фолликулярной жидкости в культуре появляются клетки, экспрессирующие специфические маркеры ооцитов, а окружающие их клетки приобретают рецепторы к гонадотропным гормонам и способность к продукции эстрогена и прогестерона, что свойственно фолликулярным клеткам яичника (Lai et al., 2016).
Способность МСК менструальной крови к дифференцировке в производные всех трех зародышевых листков, а также, возможно, в половые клетки, наряду с экспрессией по крайней мере частью из них маркеров плюрипотентности (OCT-4, SSEA-4, SOX-2, NANOG), присутствием теломеразы и высоким пролиферативным потенциалом сближает их с эмбриональными стволовыми клетками. Однако, в отличие от эмбриональных стволовых клеток, клиническое использование которых затруднено риском образования опухолей (Земелько и др., 2011), они не обладают туморогенностью, что было продемонстрировано в экспериментах по их трансплантации иммунодефицитным мышам (Liu et al., 2018). Таким образом, обладая такими преимуществами, как быстрый рост, способность к длительной пролиферации и дифференцировке во многих направлениях, МСК менструальной крови представляются относительно безопасными для клеточной терапии, что подтверждается и имеющимися на сегодняшний день результатами их введения пациентам (Chen et al., 2019).
ТЕРАПЕВТИЧЕСКИЙ ПОТЕНЦИАЛ МСК МЕНСТРУАЛЬНОЙ КРОВИ
При введении в организм реципиента МСК менструальной крови, подобно таковым из других источников, мигрируют в зоны повреждений, как это было продемонстрировано, например, на модели сахарного диабета I типа (Wu et al., 2014) и фиброза печени (Chen et al., 2017). В некоторых случаях они непосредственно участвуют в восстановлении ткани; в частности, показаны их дифференцировка в кардиомиоциты при экспериментальном инфаркте миокарда и слияние со скелетными миоцитами у мышей с миодистрофией Дюшенна (Анисимов и др., 2013). Однако основную роль в регенеративных эффектах МСК из менструальной крови играет их трофическое влияние на ткань, опосредуемое продуцируемыми ими цитокинами и другими биологически активными веществами. Они секретируют факторы роста сосудистого эндотелия, фибробластов, гепатоцитов, кератиноцитов, тромбоцитарный фактор роста PDGF-BB, эпидермальный фактор роста, трансформирующий фактор роста β, гранулоцитарно-макрофагальный колониестимулирующий фактор, ангиогенин, ангиопоэтин-2, интерлейкин-6, интерлейкин-8, интерферон-γ (Meng et al., 2007; Jiang et al., 2013; Ren et al., 2016; Liu et al., 2018). Регенеративный эффект способны оказывать также продуцируемые этими клетками внеклеточные везикулы, содержащие некодирующие РНК и регуляторные белки (Chen et al., 2019).
В экспериментах на клеточных культурах и животных с моделями повреждений различных тканей и органов неоднократно была показана способность МСК из менструальной крови стимулировать пролиферацию и дифференцировку резидентных клеток, а также регулировать их выживаемость. Так, в поджелудочной железе мышей с диабетом МСК активируют дифференцировку эндогенных предшественников в β-клетки (Wu et al., 2014). Они стимулируют пролиферацию и предотвращают апоптоз кардиомиоцитов при совместном культивировании в условиях, моделирующих ишемию; апоптотическая гибель кардиомиоцитов уменьшается также in vivo при введении МСК в область инфаркта миокарда (Jiang et al., 2013). МСК менструальной крови или их секреторные продукты подавляют индуцированный бактериальным липополисахаридом апоптоз гепатоцитов и клеток легочного эпителия и улучшают выживание гранулезных клеток при преждевременной недостаточности яичников, однако апоптоз клеток эпителиального рака яичника под их влиянием, напротив, усиливается (Chen et al., 2019).
Иммуносупрессивные свойства МСК менструальной крови выражены слабее, чем у МСК из других тканей (Luz-Crawford et al., 2016; Yang et al., 2019). Тем не менее они способны подавлять избыточные иммунные реакции, ингибируя экспрессию в пораженной ткани провоспалительных факторов, таких как фактор некроза опухолей-α, интерферон-γ, интерлейкин-2, интерлейкин-6, стимулируя секрецию оказывающих противовоспалительное действие интерлейкина-4 и интерлейкина-10, уменьшая инфильтрацию воспалительными клетками, а также способствуя повышению численности регуляторных T-клеток и макрофагов противовоспалительного фенотипа М2 (Xu et al., 2015; Lv et al., 2018). Способность МСК менструальной крови уменьшать выраженность воспаления была показана на моделях язвенного колита (Xu et al., 2015), легочного фиброза (Zhao et al., 2018), имплантации полиамидной сетки для лечения пролапса тазовых органов (Gargett et al., 2016), болезни Альцгеймера и острого повреждения легких (Chen et al., 2019). Их иммуносупрессивные свойства позволили также индуцировать толерантность к аллотрансплантату сердца у экспериментальных мышей (Lv et al., 2018).
Антифибротическое действие этих клеток было продемонстрировано на моделях хронического токсического поражения печени (Chen et al., 2017), легочного фиброза (Zhao et al., 2018), а также инфаркта миокарда и преждевременной недостаточности яичников (Chen et al., 2019). МСК менструальной крови продуцируют матриксные металлопротеиназы – MMP-1, -3, -9, -10 (Meng et al., 2007; Liu et al., 2018; Zhao et al., 2018), с которыми и может быть связана их способность препятствовать избыточному накоплению внеклеточного матрикса. Кроме того, при поражении печени МСК снижают пролиферативную активность клеток Ито, играющих главную роль в фиброгенезе (Chen et al., 2017), а при инфаркте миокарда подавляют переход эндотелиальных клеток в мезенхимные и тем самым предотвращают прогрессирование фиброза, снижая численность сердечных фибробластов (Chen et al., 2019).
Еще один механизм регенеративного действия МСК менструальной крови связан с усилением роста кровеносных сосудов в пораженной ткани. Секретируя проангиогенные факторы, МСК стимулируют формирование сосудистых структур эндотелиальными клетками in vitro и способствуют повышению плотности сосудов в области инфаркта (Jiang et al., 2013), а также усиливают их образование в кожных ранах (Chen et al., 2019). В то же время они способны подавлять патологический рост сосудов в опухоли, что приводит к замедлению ее роста, как было показано на примере глиомы (Lv et al., 2018). Сообщалось также об ингибирующем влиянии внеклеточных везикул, полученных от МСК менструальной крови, на проангиогенные свойства клеток рака простаты, тогда как везикулы от МСК костного мозга ангиогенез в данной экспериментальной системе, напротив, усиливали. Предполагается, что способность МСК из этого источника оказывать не только ангиогенный, но и ангиостатический эффект связана с их функциями в эндометрии, где они обеспечивают неодинаковое состояние сосудов функционального слоя в течение менструального цикла (Alcayaga-Miranda et al., 2016).
Помимо вышеуказанных патологических состояний, в экспериментах на животных МСК из менструальной крови продемонстрировали свою терапевтическую эффективность при ишемии нижних конечностей, болезни Паркинсона, аллергическом энцефалите (Rodrigues et al., 2016), ишемическом инсульте (Chen et al., 2019), повреждениях спинного мозга (Wu et al., 2018), периферических нервов (Farzamfar et al., 2017) и эндометрия (Hu et al., 2019), реакции трансплантат против хозяина (Luz-Crawford et al., 2016), ишемии-реперфузии почки (Sun et al., 2016), костно-хрящевых дефектах (Khanmohammadi et al., 2019). Первым случаем клинического применения этих клеток стала трансплантация четырем пациентам с множественным склерозом, показавшая безопасность их введения (Zhong et al., 2009). В дальнейшем обнадеживающие результаты были получены при трансплантации МСК менструальной крови больным с внутриматочными спайками, что привело к увеличению толщины эндометрия и позволило трем из семи пациенток забеременеть (Tan et al., 2016), а также больному с застойной сердечной недостаточностью, у которого после введения МСК наблюдалось длительное улучшение функциональных показателей сердца (Ichim et al., 2010). Однако на сегодняшний день количество клинических испытаний с использованием МСК из менструальной крови и число участвующих в них пациентов слишком малы для того, чтобы делать уверенные выводы о безопасности и эффективности терапевтического использования клеток из этого источника.
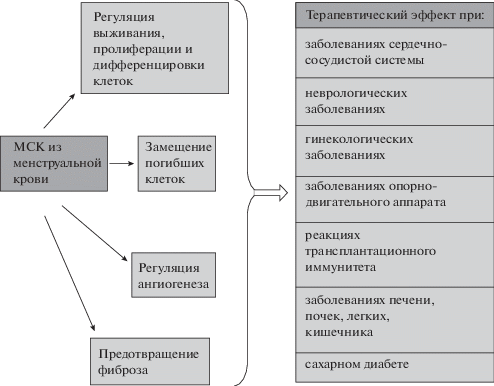
Механизмы терапевтических эффектов МСК из менструальной крови и возможности их применения в регенеративной медицине, на которые указывают имеющиеся в литературе результаты экспериментальных исследований, суммированы на рис. 1.
ЗАКЛЮЧЕНИЕ
Присутствующие в менструальной крови клетки десквамированного эндометрия с характеристиками МСК являются ценным ресурсом для регенеративной медицины ввиду их способности улучшать состояние патологически измененных тканей, прежде всего за счет продукции регуляторных молекул, комплексно влияющих на различные аспекты восстановительного процесса. По своим биологическим свойствам и характеру влияния на тканевую регенерацию МСК из менструальной крови сходны с таковыми из других клинически значимых источников, таких как костный мозг, жировая ткань, пульпа зуба и ткани последа, при этом их несомненное преимущество состоит в большей доступности и возможности многократного получения путем неинвазивной процедуры. Ценными с точки зрения возможности клинического применения являются и такие особенности этих клеток, как широкий спектр потенций к дифференцировке, высокий пролиферативный потенциал, позволяющий быстро нарастить необходимое для трансплантации число клеток из малого количества исходного материала, и генетическая стабильность в ходе культивирования.
Следует отметить, что при всей перспективности МСК менструальной крови как источника клеток для регенеративной медицины их клиническое использование сопряжено с рядом проблем. В частности, гетерогенность популяции, содержащей не только мультипотентные клетки со свойствами стволовых, но и стромальные фибробласты, и отсутствие общепринятого протокола выделения МСК затрудняют стандартизацию клеточных препаратов, получаемых из менструальной крови. Кроме того, характеристики содержащихся в ней МСК зависят от возраста донора и, вероятно, от состояния его репродуктивной системы. Влияние этих параметров на регенеративный потенциал МСК к настоящему времени исследовано недостаточно. Нельзя также исключить различные неблагоприятные последствия введения МСК менструальной крови пациенту, такие так дифференцировка в нежелательном направлении, отторжение иммунной системой, образование опухоли. Хотя результаты экспериментов на животных и первых клинических испытаний свидетельствуют об отсутствии серьезных побочных эффектов клеточной терапии с их использованием, этот вопрос должен быть исследован более тщательно. Еще одна сложность связана с низкой выживаемостью трансплантированных МСК в очаге поражения, ограничивающей их терапевтический потенциал. Эта проблема может быть отчасти преодолена путем генетической модификации клеток или их прекондиционирования культивированием в стрессовых условиях. Кроме того, преимущественно паракринный механизм регуляторного действия МСК, в том числе и из менструальной крови, на поврежденные ткани делает возможным терапевтическое применение не самих клеток, а их секреторных продуктов, в частности, внеклеточных везикул, что связано с меньшими техническими трудностями и меньшим риском для пациента. Наконец, необходимо дальнейшее исследование клеточных и молекулярных механизмов, посредством которых МСК из менструальной крови оказывают благотворное влияние на тканевую регенерацию, и сравнение их с таковыми для МСК из других, более изученных источников. Полученные знания станут теоретической основой применения этих клеток в медицине и определят спектр заболеваний, при которых их трансплантация позволит достичь оптимальных результатов.
Список литературы
Анисимов С.В., Земелько В.И., Гринчук Т.М., Никольский Н.Н., 2013. Стволовые клетки менструальной крови как потенциальный субстрат клеточной терапии // Цитология. Т. 55. № 1. С. 5–9.
Домнина А.П., Новикова П.В., Фридлянская И.И., Шилина М.А., Зенин В.В. и др., 2015. Индукция децидуальной дифференцировки в эндометриальных мезенхимных стволовых клетках // Цитология. Т. 57. № 12. С. 880–884.
Земелько В.И., Гринчук Т.М., Домнина А.П., Арцыбашева И.В., Зенин В.В. и др., 2011. Мультипотентные мезенхимные стволовые клетки десквамированного эндометрия. Выделение, характеристика и использование в качестве фидерного слоя для культивирования эмбриональных стволовых линий человека // Цитология. Т. 53. № 12. С. 919–929.
Akhavan-Tavakoli M., Fard M., Khanjani S., Zare S., Edalatkhah H. et al., 2017. In vitro differentiation of menstrual blood stem cells into keratinocytes: A potential approach for management of wound healing // Biologicals. V. 48. P. 66–73.
Alcayaga-Miranda F., González P.L., Lopez-Verrilli A., Varas-Godoy M., Aguila-Díaz C. et al., 2016. Prostate tumor-induced angiogenesis is blocked by exosomes derived from menstrual stem cells through the inhibition of reactive oxygen species // Oncotarget. V. 7. № 28. P. 44462–44477.
Asatrian G., Pham D., Hardy W.R., James A.W., Peault B., 2015. Stem cell technology for bone regeneration: current status and potential applications // Stem Cells Cloning. V. 8. P. 39–48.
Beeravolu N., McKee C., Alamri A., Mikhael S., Brown C. et al., 2017. Isolation and characterization of mesenchymal stromal cells from human umbilical cord and fetal placenta // J. Vis. Exp. № 122. P. 55224.
Bernardo M.E., Emons J.A., Karperien M., Nauta A.J., Willemze R. et al., 2007. Human mesenchymal stem cells derived from bone marrow display a better chondrogenic differentiation compared with other sources // Connect. Tissue Res. V. 48. № 3. P. 132–140.
Cervelló I., Mas A., Gil-Sanchis C., Peris L., Faus A. et al., 2011. Reconstruction of endometrium from human endometrial side population cell lines // PLoS One. V. 6. № 6. P. e21221.
Charif N., Li Y.Y., Targa L., Zhang L., Ye J.S. et al., 2017. Aging of bone marrow mesenchymal stromal/stem cells: Implications on autologous regenerative medicine // Biomed. Mater. Eng. V. 28. Suppl. 1. P. S57–S63.
Chen J., Du X., Chen Q., Xiang C., 2015a. Effects of donors' age and passage number on the biological characteristics of menstrual blood-derived stem cells // Int. J. Clin. Exp. Pathol. V. 8. № 11. P. 14584–14595.
Chen J.Y., Mou X.Z., Du X.C., Xiang C., 2015b. Comparative analysis of biological characteristics of adult mesenchymal stem cells with different tissue origins // Asian Pac. J. Trop. Med. V. 8. № 9. P. 739–746.
Chen L., Jingjing Q., Xiang C., 2019. The multi-functional roles of menstrual blood-derived stem cells in regenerative medicine // Stem Cell Res. Ther. V. 10. № 1. P. 1.
Chen L., Zhang C., Chen L., Wang X., Xiang B. et al., 2017. Human menstrual blood-derived stem cells ameliorate liver fibrosis in mice by targeting hepatic stellate cells via paracrine mediators // Stem Cells Transl. Med. V. 6. № 1. P. 272–284.
Dalirfardouei R., Jamialahmadi K., Mahdipour E., 2018. A feasible method for the isolation of mesenchymal stem cells from menstrual blood and their exosomes // Tissue Cell. V. 55. P. 53–62.
Darzi S., Werkmeister J.A., Deane J.A., Gargett C.E., 2016. Identification and characterization of human endometrial mesenchymal stem/stromal cells and their potential for cellular therapy // Stem Cells Transl. Med. V. 5. P. 1127–1132.
Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F. et al., 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement // Cytotherapy. V. 8. № 4. P. 315–317.
Domnina A.P., Zemelko V.I., Mikhailov V.M., Nikolsky N.N., 2013. Stimulation of decidua development by transplantation of endometrial stem cells // J. Biomed. Sci. Eng. V. 6. P. 59–65.
Ercal P., Pekozer G.G., Kose G.T., 2018. Dental stem cells in bone tissue engineering: Current overview and challenges // Adv. Exp. Med. Biol. V. 1107. P. 113–127.
Farzamfar S., Naseri-Nosar M., Ghanavatinejad A., Vaez A., Zarnani A.H. et al., 2017. Sciatic nerve regeneration by transplantation of menstrual blood-derived stem cells // Mol. Biol. Rep. V. 44. № 5. P. 407–412.
Freeman B.T., Kouris N.A., Ogle B.M., 2015. Tracking fusion of human mesenchymal stem cells after transplantation to the heart // Stem Cells Transl. Med. V. 4. № 6. P. 685–694.
Gargett C.E., Schwab K.E., Deane J.A., 2016. Endometrial stem/progenitor cells: The first 10 years // Hum. Reprod. Update. V. 22. № 2. P. 137–163.
Hu J., Song K., Zhang J., Zhang Y., Tan B.Z., 2019. Effects of menstrual blood derived stem cells on endometrial injury repair // Mol. Med. Rep. V. 19. № 2. P. 813–820.
Hu X., Zhou Y., Zheng X., Tian N., Xu C. et al., 2014. Differentiation of menstrual blood-derived stem cells toward nucleus pulposus-like cells in a coculture system with nucleus pulposus cells // Spine. V. 39. № 9. P. 754–760.
Huda F., Fan Y., Suzuki M., Konno A., Matsuzaki Y. et al., 2016. Fusion of human fetal mesenchymal stem cells with “degenerating” cerebellar neurons in spinocerebellar ataxia type 1 model mice // PLoS One. V. 11. № 11. P. e0164202.
Ichim T.E., Solano F., Lara F., Rodriguez J.P., Cristea O. et al., 2010. Combination stem cell therapy for heart failure // Int. Arch. Med. V. 3. № 1. P. 5.
Jeon Y.J., Kim J., Cho J.H., Chung H.M., Chae J.I., 2016. Comparative analysis of human mesenchymal stem cells derived from bone marrow, placenta, and adipose tissue as sources of cell therapy // J. Cell. Biochem. V. 117. № 5. P. 1112–1125.
Jiang Z., Hu X., Yu H., Xu Y., Wang L. et al., 2013. Human endometrial stem cells confer enhanced myocardial salvage and regeneration by paracrine mechanisms // J. Cell. Mol. Med. V. 17. № 10. P. 1247–1260.
Khanjani S., Khanmohammadi M., Zarnani A.H., Talebi S., Edalatkhah H. et al., 2015. Efficient generation of functional hepatocyte-like cells from menstrual blood-derived stem cells // J. Tissue Eng. Regen. Med. V. 9. № 11. P. E124–E134.
Khanmohammadi M., Khanjani S., Edalatkhah H., Zarnani A.H., Heidari-Vala H. et al., 2014. Modified protocol for improvement of differentiation potential of menstrual blood-derived stem cells into adipogenic lineage // Cell Prolif. V. 47. № 6. P. 615–623.
Khanmohammadi M., Golshahi H., Saffarian Z., Montazeri S., Khorasani S. et al., 2019. Repair of osteochondral defects in rabbit knee using menstrual blood stem cells encapsulated in fibrin glue: A good stem cell candidate for the treatment of osteochondral defects // Tissue Eng. Regen. Med. V. 16. № 3. P. 311–324.
Konala V.B.R., Mamidi M.K., Bhonde R., Das A.K., Pochampally R. et al., 2016. The current landscape of the mesenchymal stromal cell secretome: A new paradigm for cell-free regeneration // Cytotherapy. V. 18. № 1. P. 13–24.
Kovina M.V., Krasheninnikov M.E., Dyuzheva T.G., Danilevsky M.I., Klabukov I.D. et al., 2018. Human endometrial stem cells: High-yield isolation and characterization // Cytotherapy. V. 20. № 3. P. 361–374.
Lai D., Guo Y., Zhang Q., Chen Y., Xiang C., 2016. Differentiation of human menstrual blood-derived endometrial mesenchymal stem cells into oocyte-like cells // Acta Biochim. Biophys. Sin. V. 48. № 11. P. 998–1005.
Li C.Y., Wu X.Y., Tong J.B., Yang X.X., Zhao J.L. et al., 2015. Comparative analysis of human mesenchymal stem cells from bone marrow and adipose tissue under xeno-free conditions for cell therapy // Stem Cell Res. Ther. V. 6. P. 55.
Li F., Alderman M.H. 3rd, Tal A., Mamillapalli R., Coolidge A. et al., 2018. Hematogenous dissemination of mesenchymal stem cells from endometriosis // Stem Cells. V. 36. № 6. P. 881–890.
Liu Y., Niu R., Yang F., Yan Y., Liang S. et al., 2018. Biological characteristics of human menstrual blood-derived endometrial stem cells // J. Cell. Mol. Med. V. 22. № 3. P. 1627–1639.
Luz-Crawford P., Torres M.J., Noël D., Fernandez A., Toupet K. et al., 2016. The immunosuppressive signature of menstrual blood mesenchymal stem cells entails opposite effects on experimental arthritis and graft versus host diseases // Stem Cells. V. 34. № 2. P. 456–469.
Lv H., Hu Y., Cui Z., Jia H., 2018. Human menstrual blood: A renewable and sustainable source of stem cells for regenerative medicine // Stem Cell Res. Ther. V. 9. № 1. P. 325.
Mehrabani D., Nazarabadi R.B., Kasraeian M., Tamadon A., Dianatpour M. et al., 2016. Growth kinetics, characterization, and plasticity of human menstrual blood stem cells // Iran J. Med. Sci. V. 41. № 2. P. 132–139.
Meng X., Ichim T.E., Zhong J., Rogers A., Yin Z. et al., 2007. Endometrial regenerative cells: A novel stem cell population // J. Transl. Med. V. 5. P. 57.
Paliwal S., Chaudhuri R., Agrawal A., Mohanty S., 2018. Regenerative abilities of mesenchymal stem cells through mitochondrial transfer // J. Biomed. Sci. V. 25. P. 31.
Patel A.N., Park E., Kuzman M., Benetti F., Silva F.J. et al., 2008. Multipotent menstrual blood stromal stem cells: Isolation, characterization, and differentiation // Cell Transplant. V. 17. № 3. P. 303–311.
Ren H., Sang Y., Zhang F., Liu Z., Qi N. et al., 2016. Comparative analysis of human mesenchymal stem cells from umbilical cord, dental pulp, and menstrual blood as sources for cell therapy // Stem Cells Int. V. 2016. P. 3516574.
Rodrigues M.C., Lippert T., Nguyen H., Kaelber S., Sanberg P.R. et al., 2016. Menstrual blood-derived stem cells: In vitro and in vivo characterization of functional effects // Adv. Exp. Med. Biol. V. 951. P. 111–121.
Rossignoli F., Caselli A., Grisendi G., Piccinno S., Burns J.S. et al., 2013. Isolation, characterization, and transduction of endometrial decidual tissue multipotent mesenchymal stromal/stem cells from menstrual blood // Biomed. Res. Int. V. 2013. P. 901821.
Samsonraj R.M., Raghunath M., Nurcombe V., Hui J.H., Wijnen A.J., van, et al., 2017. Concise review: Multifaceted characterization of human mesenchymal stem cells for use in regenerative medicine // Stem Cells Transl. Med. V. 6. № 12. P. 2173–2185.
Schneider S., Unger M., Griensven M., van, Balmayor E.R., 2017. Adipose-derived mesenchymal stem cells from liposuction and resected fat are feasible sources for regenerative medicine // Eur. J. Med. Res. V. 22. № 1. P. 17.
Sun P., Liu J., Li W., Xu X., Gu X. et al., 2016. Human endometrial regenerative cells attenuate renal ischemia reperfusion injury in mice // J. Transl. Med. V. 14. P. 28.
Sun Y., Ren Y., Yang F., He Y., Liang S. et al., 2019. High-yield isolation of menstrual blood-derived endometrial stem cells by direct red blood cell lysis treatment // Biol. Open. V. 8. № 5. P. bio038885.
Tan J., Li P., Wang Q., Li Y., Li X. et al., 2016. Autologous menstrual blood-derived stromal cells transplantation for severe Asherman’s syndrome // Hum. Reprod. V. 31. № 12. P. 2723–2729.
Wu Q., Wang Q., Li Z., Li X., Zang J. et al., 2018. Human menstrual blood-derived stem cells promote functional recovery in a rat spinal cord hemisection model // Cell Death Dis. V. 9. № 9. P. 882.
Wu X., Luo Y., Chen J., Pan R., Xiang B. et al., 2014. Transplantation of human menstrual blood progenitor cells improves hyperglycemia by promoting endogenous progenitor differentiation in type 1 diabetic mice // Stem Cells Dev. V. 23. № 11. P. 1245–1257.
Xu L., Liu Y., Sun Y., Wang B., Xiong Y. et al., 2017. Tissue source determines the differentiation potentials of mesenchymal stem cells: A comparative study of human mesenchymal stem cells from bone marrow and adipose tissue // Stem Cell Res. Ther. V. 8. № 1. P. 275.
Xu Y., Zhu H., Zhao D., Tan J., 2015. Endometrial stem cells: Clinical application and pathological roles // Int. J. Clin. Exp. Med. V. 8. № 12. P. 22039–22044.
Yang X., Devianti M., Yang Y.H., Ong Y.R., Tan K.S. et al., 2019. Endometrial mesenchymal stem/stromal cell modulation of T cell proliferation // Reproduction. V. 157. № 1. P. 43–52.
Yoshimura H., Muneta T., Nimura A., Yokoyama A., Koga H. et al., 2007. Comparison of rat mesenchymal stem cells derived from bone marrow, synovium, periosteum, adipose tissue, and muscle // Cell Tissue Res. V. 327. № 3. P. 449–462.
Zhao Y., Lan X., Wang Y., Xu X., Lu S. et al., 2018. Human endometrial regenerative cells attenuate bleomycin-induced pulmonary fibrosis in mice // Stem Cells Int. V. 2018. P. 3475137.
Zheng Y., Zhou Y., Zhang X., Chen Y., Zheng X. et al., 2017. Effects of hypoxia on differentiation of menstrual blood stromal stem cells towards tenogenic cells in a co-culture system with Achilles tendon cells // Exp. Ther. Med. V. 13. № 6. P. 3195–3202.
Zhong Z., Patel A.N., Ichim T.E., Riordan N.H., Wang H. et al., 2009. Feasibility investigation of allogeneic endometrial regenerative cells // J. Transl. Med. V. 7. P. 15.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии