Журнал общей биологии, 2021, T. 82, № 4, стр. 270-282
Форма клеток бактерий. Некоторые особенности ультраструктуры, эволюции и экологии
М. Д. Павлова 1, *, А. М. Асатурова 1, А. Е. Козицын 1
1 ФГБНУ “Федеральный научный центр биологической защиты растений
350039 Краснодар, ВНИИБЗР, п/о 39, Россия
* E-mail: FridaAmely@yandex.ru
Поступила в редакцию 30.12.2020
После доработки 14.04.2021
Принята к публикации 25.04.2021
Аннотация
На форму и размер бактериальных клеток влияет множество селективных сил, что, с одной стороны, определяет морфологическое разнообразие бактерий, с другой – способствует закреплению определенной формы в той или иной их группе. Почему среди известных нам культивируемых видов преобладают именно палочки, кокки, спиральные и нитчатые формы? Ряд исследований показал, что по некоторым важнейшим параметрам, например, эффективности внутриклеточного транспорта и скорости активного передвижения в водной среде, оптимальной представляется палочковидная форма. Большое количество исследователей считают, что палочки – предковая форма для всех остальных форм бактериальных клеток. Кокки, предположительно, сформировались в результате потери некоторых цитоскелетных белков либо являются результатом “редуктивного деления”. Спиральная форма может быть результатом контролируемого лизиса некоторых поперечных пептидных сшивок между гликановыми нитями пептидогликана, а может поддерживаться исключительно за счет спирально ориентированных элементов цитоскелета; одно из возможных преимуществ такой формы – эффективное движение в вязких средах, в том числе внутренних средах других живых организмов. Образование нитчатых и ветвящихся форм, вероятно, можно рассматривать как приспособление для увеличения площади поглощающей поверхности клетки, также это выгодно для закрепления в почве, функциональной дифференциации роения и др. Форма вибриона поддерживается за счет ограничения роста клетки с одной стороны и, по ряду физических параметров оказывается наиболее эффективной формой для хемотаксиса. Морфологическое разнообразие основных известных грамположительных (монодермных) и грамотрицательных (дидермных) бактерий заметно отличается. Различия в строении клеточной стенки, по-видимому, являются ограничительными факторами для формирования той иной формы клетки у определенной группы бактерий: например, спиральной у грамположительных, нитевидной у грамотрицательных. Форма клетки может меняться в течение жизненного цикла, в особенности в ходе реакции на неблагоприятные условия среды: например, филаментация клеток при SOS-ответе или образование кокковых форм у многих грамотрицательных видов, функционально сравнимое со спорообразованием у грамположительных. В то же время форма клетки является наследуемой и характеризует таксоны достаточно высокого ранга, что говорит о большой адаптивной ценности данного признака в эволюции.
Понимание связи между формой и функциeй является одной из ключевых проблем современной биологии. Особенно сложно судить о функциональности существующего морфологического разнообразия в отношении микроорганизмов. Существует даже теория “нейтральной морфологии” (Lahr et al., 2014), согласно которой в микроскопических масштабах форма тела, как правило, не влияет на приспособленность организмов к условиям среды. Однако теория эта не получила широкого признания ввиду ряда фактов, свидетельствующих о том, что, как и у более крупных организмов, селективные факторы все же влияют на форму микробных клеток. Во-первых, форма клетки бактерий является наследуемой; во-вторых, существует большое разнообразие форм, но при этом обычно форма – консервативный признак для вида, рода и более высоких таксонов бактерий (исключая полиморфизм); наконец, известно, что форма клетки активно модифицируется в ответ на изменения в окружающей среде (Young, 2006; Schuech et al., 2019). От морфологии бактериальных клеток во многом зависят их подвижность и поведение, что определяет характер взаимодействий в бактериальных сообществах.
Отдельные аспекты морфологии бактерий исследовались многими отечественными учеными: цитоскелетные элементы микоплазм, полярность бактериальных клеток, строение и биоразнообразие ультрамикробактерий и др. (Korolev et al., 1994; Дмитриев и др., 2004; Vishnyakov et al., 2009; Дуда, 2017); однако подобных материалов не так много, они слабо систематизированы и требуют обобщения. Среди зарубежных авторов интерес к экологическим и эволюционным аспектам морфологии бактерий заметно выше: начиная с экспериментальных статей по строению и функционированию отдельных цитоскелетных элементов и заканчивая подробными обзорами по адаптивному значению всех известных для бактерий форм клетки. Примечательно, что многие теоретические выкладки имеют прямые экспериментальные подтверждения и способствуют формированию представлений о морфологической эволюции бактерий. Кроме того, интерес к морфологии бактерий вызван также и тем, что форма клетки может играть важную роль в определении патогенности для человека и животных, а также в формировании растительно-микробных взаимодействий в сообществах (Хомерики, Морозов, 2001; Justice et al., 2004; Robertson et al., 2005). Благодаря новейшим микроскопическим и цитохимическим методам – иммунофлуоресцентной микроскопии (Møller-Jensen, Löwe, 2005; Bartlett et al., 2017), сканирующей электронной микроскопии (Дмитриев и др., 2004), криоэлектронной томографии (Kürner et al., 2004; Trachtenberg et al., 2008) и др. – возможности изучения организации бактериальной клетки значительно расширились. В клетках бактерий были выявлены высокоорганизованные системы цитоскелетных элементов, обеспечивающие компартментализацию, сегрегацию ДНК и тонкую регуляцию клеточного роста и морфогенеза (Esue et al., 2005; Wickstead, Gull, 2011; Popp et al., 2012), благодаря чему в корне изменились представления о “простоте организации” бактериальных клеток.
В данной статье мы проводим анализ ряда обзоров и экспериментальных статей, выявляющий общие закономерности и отдельные интересные особенности экологии и эволюции формы клеток у бактерий. Приводим основные сведения об ультраструктуре клеток наиболее изученных бактериальных форм и обсуждаем преимущества и/или относительные “недостатки” той или иной формы в приспособлении к факторам окружающей среды. Здесь, однако, мы практически не затрагиваем тему “многоклеточности” бактерий, поскольку она, безусловно, заслуживает отдельного обзора. Также важно принять во внимание, что многие микроорганизмы пока не были выделены в чистую культуру in vitro, и тот факт, что морфология одного и того же вида при лабораторном культивировании может отличаться от природной.
ВЛИЯНИЕ ОСОБЕННОСТЕЙ ОРГАНИЗАЦИИ ЦИТОСКЕЛЕТА И КЛЕТОЧНОЙ СТЕНКИ НА ФОРМУ КЛЕТКИ БАКТЕРИЙ
Начиная с 1990-х годов и по настоящее время в ходе многочисленных исследований (Bi, Lutkenhaus, 1991; Daniel, Errington, 2003; Esue et al., 2005; Wickstead, Gull, 2011; Popp et al., 2012) было установлено, что большинство прокариот, как бактерии, так и археи, имеют цитоскелет, представленный набором белков, некоторые из которых гомологичны элементам цитоскелета эукариот, а другие – уникальны для прокариот.
Белок MreB (Murein cluster B) – наиболее хорошо изученный гомолог эукариотического актина, распространен среди палочковидных, изогнутых и спиралевидных бактерий, но не обнаружен у большинства кокков. Изначально предполагалось, что в клетке MreB образует длинные спиральные филаменты, статично расположенные непосредственно под плазмалеммой на всем протяжении клетки (Daniel, Errington, 2003; Kürner et al., 2004; Esue et al., 2005). Однако в последнее время все больше фактов свидетельствует в пользу динамичной модели функционирования MreВ, согласно которой отдельные короткие фрагменты MreB согласованно движутся по спиральной траектории вблизи плазмалеммы, скоординированно с комплексом ферментов, ответственных за синтез клеточной стенки, и структурными трансмембранными белками: PBPs, MreD, RodA, RodZ и др. (Wagstaff, Löwe, 2018).
Белок FtsZ (Filamenting temperature-sensitive mutant Z) – гомолог эукариотического тубулина, основной белок клеточного деления бактерий. Образует кольцевую структуру (Z-кольцо) в области разделения дочерних клеток и является сайтом прикрепления нескольких белков (FtsA, ZipA, FtsK, FtsR, FtsW, FtsI, AmiC и др.) (Pichoff, Lutkenhaus, 2005), обеспечивающих синтез клеточной перегородки, а также сократительную активность Z-кольца при разделении дочерних клеток (Bisson-Filho et al., 2017; Yang et al., 2017). Мутанты по гену ftsZ неограниченно растут без деления клетки и имеют нитевидную форму (Vinella, D’Ari, 1995).
Кресцетин CreS – белок, гомолог промежуточных филаментов, обнаружен у бактерий р. Caulobacter, имеющих изогнутую форму клетки. Расположен в виде пучка филаментов под плазмалеммой вдоль внутренней кривизны клетки. Полагают, что филаменты CreS каким-то образом ограничивают рост клетки с той стороны, где они расположены, из-за чего противоположная сторона опережает в росте, и таким образом формируется кривизна (Margolin, 2004). В отсутствие CreS клетка принимает палочковидную форму (Møller-Jensen, Löwe, 2005), что подтверждает, что это белок, поддерживающий ее кривизну. Бактофилины BacM, BacA, BacB, СсmA и др. – еще одна группа гомологов промежуточных филаментов, обнаруженных у палочковидных скользящих (Myxococcus xanthus; Koch et al., 2011), изогнутых (Proteus mirabilis; Hay et al., 1999), спиральных (Helicobacter pylori; Sycuro et al., 2010) и стебельковых бактерий (Caulobacter crescentus; Kühn et al., 2010). Их морфогенетическая роль на сегодня не до конца выяснена и, по-видимому, отличается у разных организмов: участие в делении клетки, переключение процессов деления и роста, формирование клеточных выростов – простек различной формы и др.
Здесь важно отметить один нюанс: все эти и другие цитоскелетные элементы сами по себе в большинстве случаев не выполняют опорную функцию, а контролируют процессы синтеза/разборки пептидогликана и деления клетки, являясь сайтами прикрепления соответствующих ферментов и регуляторных белков. Таким образом, цитоскелет можно образно уподобить “сваям” в здании, определяющим построение каркаса – клеточной стенки, которая окружает цитоплазму, уравновешивает внутриклеточное давление и поддерживает постоянство формы клетки. Причем “сваи” эти динамичны – синтезируются, движутся и функционируют по мере необходимости в определенных областях клетки: на полюсах, у боковых стенок, в области перегородки деления и т.д. (Wagstaff, Löwe, 2018). Однако в отдельных случаях форма клетки все же может поддерживаться исключительно цитоскелетными элементами, как это происходит у некоторых представителей класса Mollicutes: бактерии р. Spiroplasma имеют форму закрученной на несколько оборотов спирали, некоторые виды Mycoplasma – колбовидную или грушевидную форму (Trachtenberg, 2004; Cabeen, Jacobs-Wagner, 2005). Нестабильные L-формы бактерий возвращаются к исходной форме также за счет исключительно элементов цитоскелета.
Поскольку грамположительные и грамотрицательные бактерии имеют ряд ключевых отличий в организации клеточной стенки, может возникнуть интересный вопрос: влияет ли принадлежность бактерий к группе грамположительных (дидермных) или грамотрицательных (монодермных) на их форму? В этом контексте определяющими являются наличие/отсутствие внешней мембраны, относительная толщина пептидогликанового слоя, а также особенности строения продольных пептидных сшивок между гликановыми нитями, ориентированными перпендикулярно длинной оси клетки (Park, Uehara, 2008). У большинства грамотрицательных бактерий связующие пептиды соединены друг с другом напрямую (рис. 1), тогда как у большинства грамположительных – через дополнительные пентаглициновые мостики, кроме того, связующие пептиды отличаются по аминокислотному составу (Маянский, 2006; Cassimeris et al., 2011).
Рис. 1.
Схема строения пептидогликана грамположительных и грамотрицательных бактерий (по: Маянский, 2006).

Если проанализировать морфологическое разнообразие основных известных культивируемых видов грамположительных и грамотрицательных бактерий, можно обнаружить довольно интересные отличия, причем отмечают, что морфологическое разнообразие грамотрицательных бактерий в целом выше, чем грамположительных (Дуда, 2017). Согласно определителю бактерий Берджи (2007), среди грамположительных бактерий преобладают палочки (типичные примеры: Bacillus, Clostridium, Acetobacterium, Arthrobacter и др.), часто встречаются кокки (Lactococcus, Micrococcus, Sarcina, Streptococcus и др.) и нитевидные формы (многие Actinobacteria). Однако очень редки среди грамположительных бактерий ярко выраженные изогнутые и спиральные формы. Это лишь немногие роды и виды, например Falcivibrio и Lachnospira. Еще несколько родов грамположительных бактерий палочковидной формы описываются как слегка изогнутые (Actinomyces, Bifidobacterium, Butyrivibrio, Corynebacterium и др.).
Среди грамотрицательных бактерий также однозначно преобладают палочки (Enterobacterales, Pseudomonas, Rhizobium, Acetobacter, Legionella и др.), часто встречаются изогнутые формы (Ancylobacter, Desulfovibrio и многие Vibrionaceae) и спиральные формы (Spirochaetales, Spirillum, Azospirillum, Helicobacter и др.). Реже встречаются грамотрицательные кокки или клетки эллипсоидной формы (“коккобациллы”) – Neisseria, Brucella, Veillonella и др. Некоторые грамотрицательные палочковидные и спиральные бактерии принимают форму кокков в стационарной фазе культивирования и при неблагоприятных условиях, например Acinetobacter, Campylobacter, Treponema и др. Весьма редки, однако, среди грамотрицательных нитчатые формы – например, Acetofilamentum, Syntrophobacter. При этом “многоклеточные” нити часто встречаются среди цианобактерий, которые по строению клеточной стенки относят к грамотрицательным.
КОККИ. ОСОБЕННОСТИ УЛЬТРАСТРУКТУРЫ И АДАПТИВНОЕ ЗНАЧЕНИЕ ФОРМЫ КЛЕТКИ
В связи с тем, что существуют бактерии, сохраняющие сферическую форму клетки в течение всего жизненного цикла, и бактерии, принимающие сферическую форму лишь в стационарную фазу культивирования или в неблагоприятных условиях, предлагаем условно обозначить первых как “собственно” кокков, вторых – как “производных” (“стареющих”) кокков.
У абсолютного большинства “собственно” кокков разных систематических групп не обнаружен белок MreB, считающийся основным элементом бактериального цитоскелета, ответственным за построение палочковидной формы клетки (Kürner et al., 2004; Shih, Rothfield, 2006; Wickstead, Gull, 2011). Синтез пептидогликана клеточной стенки у них происходит только во время деления клетки в области Z-кольца за счет белка FtsZ и других белков, участвующих в процессе деления, которые определяют включение новых молекул пептидогликана в клеточную стенку по траектории, соответствующей построению сферы (Zapun et al., 2008). Таким образом, дочерние клетки кокков дорастают до размера материнской, будучи связанными друг с другом в виде диплококков (Margolin, 2009).
“Производные” же кокки, бывшие в оптимальных условиях палочковидными или спиралевидными, очевидно, содержат белок MreB и соответствующий аппарат синтеза пептидогликана в определенных точках клеточной стенки. Однако в определенных условиях наблюдается явление “редуктивного деления” (James et al., 1995) – многократных повторяющихся актов деления, не сопровождающихся последующим ростом, при этом аппарат синтеза пептидогликана переключается с синтеза боковых стенок на синтез перегородки деления.
Для Helicobacter pylori описан механизм перехода от спиральной к сферической форме: на одном из полюсов клетки происходит конденсация цитоплазматического матрикса, что приводит к одностороннему растяжению клеточной стенки и оттеснению клеточного содержимого на периферию с образованием С-образных форм, которые, постепенно расширяясь, приобретают сферическую форму (Хомерики, Морозов, 2001). Ранние кокковые формы сохраняют жгутики и подвижность, в дальнейшем они утрачиваются (Bode et al., 1993; Хомерики, Морозов, 2011).
Полагают, что кокковые формы произошли от палочковидных в результате потери MreB и/или других функционально связанных с ним белков, в результате чего они утратили способность к удлинению после деления (Margolin, 2009). В пределах филума Spirochaetaе описан р. Sphaerochaeta нетипичной сферической морфологии, в геноме которого отсутствуют гены пенициллин-связывающих белков (penicillin-binding proteins, РВР), катализирующих последние стадии образования пептидогликана клеточной стенки (Caro-Quintero et al., 2012).
С точки зрения адаптации к условиям среды для кокков можно отметить ряд интересных положений:
1. У сферических клеток наименьшее отношение площади поверхности к объему и, следовательно, минимальная площадь поглощения питательных веществ (Young, 2006).
2. Кокки наиболее подвержены броуновскому движению – передвигаются пассивно с током среды быстрее клеток любой другой формы тех же размеров. Возможно, именно поэтому они часто формируют агрегаты из нескольких клеток: диплококки, стрептококки и т.д., – чтобы противостоять случайным разнонаправленным движениям с большой скоростью (стать “потяжелее, подлиннее и понеправильнее”) (Young, 2006). Известны экспериментальные подтверждения обратной ситуации: цепочки клеток Lactococcus lactis в какой-то момент становятся слишком длинными и пассивно оседают вниз. В этом случае бактерии начинают выделять гидролазы, расщепляющие связи между отдельными клетками в цепи, в результате чего цепочки клеток укорачиваются и всплывают до оптимальной глубины (Mercier et al., 2000).
3. Кокки имеют наименьшую площадь поверхности для прикрепления к твердым поверхностям – всего около 17% общей поверхности клетки, тогда как у палочковидных клеток это как минимум 23–25% (Steinberger et al., 2002). При этом, благодаря обтекаемой форме и малым размерам, они могут иметь преимущества при закреплении в мельчайших порах на поверхности среды. Более того, показано, что мелкие кокки, в том числе кокковидные ультрамикробактерии (объемом менее 1 мкм3), часто являются доминирующей группой в микропорах различных типов почв, недоступных для бактерий “стандартных” размеров (Дмитриев и др., 2004).
4. У абсолютного большинства кокков отсутствуют жгутики и способность к активному передвижению, и это не удивительно, поскольку клетки сферической формы в силу законов физики испытывали бы наибольшее возможное сопротивление среды при активном движении (Cooper, Denny, 1997; Dusenbery, 2011).
5. Формирование кокковых форм у различных бактерий можно рассматривать как способ переживания неблагоприятных условий, в некотором смысле аналогичный формированию эндоспор. Например, кокковые формы Helicobacter pylori, наблюдаемые в стационарную фазу культивирования или при воздействии неблагоприятных физических и химических факторов, более устойчивы к колебаниям рН, способны сохраняться в анаэробных условиях и при низких температурах, а также проявляют высокую резистентность к антибиотикам (Benaissa, 1996). Интересно, что формирование эндоспор обнаружено в основном у грамположительных бактерий, тогда как формирование “производных” кокков – у грамотрицательных (Пиневич, 2009).
ПАЛОЧКИ
По мнению большинства исследователей, палочковидные клетки являются исходной формой в эволюции бактерий (Cabeen, Jacobs-Wagner, 2005; Young, 2006). Форма и длина палочковидных клеток регулируются путем последовательного переключения процессов роста и деления. При этом рост клетки в длину может происходить двумя принципиально различными способами: путем удлинения боковых стенок клетки либо путем апикального роста (Daniel, Errington, 2003).
У большинства палочковидных форм клеточная стенка синтезируется при участии белка MreB и связанных с ним регуляторных белков, направляющих рост клетки в длину путем включения новых молекул пептидогликана в области боковых стенок клеточного цилиндра. Когда же клетка дорастает до определенных размеров, аппарат синтеза пептидогликана переключается с построения боковой стенки на синтез перегородки деления и полюсов дочерних клеток (Lleo et al., 1990).
У некоторых палочковидных клеток, например Corynebacterium glutamicum (Letek, 2008), белок MreB отсутствует, и рост в длину постоянно происходит в области полюсов клетки с участием белков цитоскелета, ответственных за деление клеток, например DivIVA (Heichlinger et al., 2011).
Палочковидная форма является одной из самых широко распространенных форм для бактерий, поскольку по многим параметрам имеет ряд адаптивных преимуществ:
1. Наименьшее сопротивление среды при активном передвижении в жидких средах испытывают клетки с соотношением длины к диаметру (l/d) около 3.7 (Dusenbery, 1998; Young, 2006). Именно такому соотношению примерно соответствуют большинство палочковидных бактерий (например, у типичных Escherichia coli l/d составляет 3.9) (Cooper, Denny, 1997). При этом оказывается, что выгоднее быть длиннее, чем короче, данного соотношения: чтобы испытывать такое же сопротивление среды, как кокки, палочки должны стать в 130 раз длиннее своего диаметра (Cooper, Denny, 1997).
2. Палочковидная форма клетки с соотношением l/d от 3 до 6 представляется “среднеоптимальной” с точки зрения эффективности поглощения веществ и их внутриклеточного транспорта (Young, 2006).
3. Благодаря палочковидной форме возможна полярность клетки и оптимальная компартментализация молекул (Chang, Huang, 2014), ответственных за репликацию и сегрегацию ДНК (Chen et al., 2011), построение клеточной стенки (Chang, Huang, 2014), моторику (Davis, Waldor, 2013) и хемотаксис (Thiem et al., 2007).
4. Относительная легкость построения дочерних клеток после деления – рост клеток требует только удлинения клеточного цилиндра с исходным диаметром поперечного сечения (Chang, Huang, 2014).
5. Стержневидная форма может способствовать эффективной упаковке клеток в колониях и биопленках с точки зрения использования питательных веществ и прочности биопленок (Sha-piro, Hsu, 1989; Kearns, 2010).
НИТЕВИДНЫЕ И МИЦЕЛИАЛЬНЫЕ ФОРМЫ
По существу, это производные палочковидных клеток, у которых длина многократно превышает диаметр (в десятки и сотни раз). Переключение процессов деления и роста координируется сложным взаимодействием регуляторных и цитоскелетных белков. При воздействии некоторых антибиотиков, блокирующих клеточное деление, но не влияющих на рост клеток (например, цефалексин), были получены мутанты E. coli, в 50 раз превышающие по длине клетки дикого типа (Nakagawa et al., 2000).
Нитчатая форма, а также формирование разветвленных мицелиеподобных структур довольно широко распространены в природе среди представителей Actinobacteria. Именно у них включение новых молекул пептидогликана в клеточную стенку происходит не в области боковых стенок, а на полюсах клетки (Daniel, Errington, 2003; Heichlinger et al., 2011). Белок MreB и/или его гомологи в этом случае либо отсутствуют, либо не принимают участия в процессе вегетативного роста и выполняют иные функции (Heichlinger et al., 2011). Полярный же рост клеток определяется белком DivIVA (Letek, 2008), у большинства других бактерий вовлеченным в процессы инициации деления, локализации клеточной перегородки и полярной локализации ДНК при споруляции (Edwards, Errington, 1997). Для многих видов Actinobacteriа показано, что DivIVA у них играет основную роль в переключении процессов деления и полярного роста: олигомеры DivIVA перемещаются к полюсам клетки и там формируют “каркас” для рекрутирования белков, необходимых для синтеза пептидогликана (Flardh, 2003; Nguyen et al., 2007; Letek, 2008).
Филаментация клеток может наблюдаться у различных бактерий в случае SOS-ответа – защитной реакции на серьезные повреждения ДНК, останавливающие работу ДНК-полимеразы и, как следствие, репликацию и клеточное деление. Задержка деления при сохранении интенсивного роста клетки приводит как раз к появлению нитевидных структур, которые по окончанию SOS-ответа делятся по всей длине клетки и уже впоследствии восстанавливают исходную форму (Cushnie et al., 2016). Интересно, что и при отсутствии явных стрессовых факторов в популяциях палочковидных бактерий с низкой частотой (0–5% клеток) встречаются удлиненные и явно нитевидные клетки (Cushnie et al., 2016).
С экологической точки зрения нитевидная форма клеток может быть выгодной стратегией для бактерий в ряде случаев:
1. Увеличение как общей площади поглощающей поверхности клетки, так и удельной площади контакта с твердой поверхностью, что особенно важно для обитателей почвы – они наиболее прочно закрепляются на микроскопических неровностях почвенных частиц и проникают в мельчайшие поры и каналы (Kurtz, Netoff, 2001). Показано, что филаментация способствует более эффективному поглощению определенных элементов питания в условиях их дефицита. Так, например, Actinomyces israeli в отсутствие фосфатов в среде культивирования имеют вид тонких разветвленных нитей, в то время как на полноценной среде это среднестатистические палочки (Pine, Boone, 1967).
2. Стратегия избегания хищничества со стороны простейших. В модельных опытах Аммендола с соавторами (Ammendola et al., 1998) показан пример селективного давления хищной ресничной инфузории Tetrahymena на культуру Serratia liquefaciens: через 5 ч совместного культивирования число клеток бактерий среднего размера (2–10 мкм) снизилось с 46 до 0%, а число клеток длиннее 30 мкм возросло с 4 до 50%, так как Tetrahymena не способна поглощать клетки длиннее 15 мкм (Ammendola et al., 1998). Хищные инфузории Cyclidium плохо поедают бактериальные клетки длиннее 4–5 мкм и могут оказывать селективное давление на популяции бактерий, “выедая” клетки главным образом среднего размера и давая преимуществo наиболее мелким, легко избегающим хищничества, и наиболее длинным, которые хищник не может захватить (Shikano et al., 1990).
Некоторые патогенные виды бактерий путем филаментации избегают фагоцитоза со стороны иммунных клеток хозяина, например, это характерно для уропатогенных штаммов E. coli (Justice et al., 2004) или Mycobacterium tuberculosis (Chauhan et al., 2006).
3. Для многих видов – Bacillus subtilis (Kearns, Losick, 2003), Proteus mirabilis (Hay et al., 1999; Fraser et al., 2000), E. coli (Harshey, 1994) и др. – описан феномен роения: формирование обширных групп клеток, движущихся совместно, как единое целое, за счет согласованного движения жгутиков всех клеток. Роящиеся клетки часто приобретают нитевидную форму (в среднем 5–20 мкм, до 200–300 мкм длиной (Harshey, 1994; Fraser et al., 2000)), по-видимому, для упрочнения межклеточных контактов и облегчения совместного движения.
4. Формирование разветвленных нитевидных структур у актиномицетов дает возможность структурной и функциональной дифференциации: субстратный мицелий преимущественно для закрепления на поверхности среды и поглощения питательных веществ, воздушный – для распространения спор или частей мицелия (Определитель бактерий…, 2007).
БАКТЕРИИ, ФОРМИРУЮЩИЕ КЛЕТОЧНЫЕ ИЛИ НЕКЛЕТОЧНЫЕ ВЫРОСТЫ
Некоторые бактерии имеют форму прямых или слегка изогнутых палочек на “ножках”, благодаря наличию цитоплазматических выростов (простек) либо слизистых отростков (стебельков). Ранее их даже выделяли в отдельную группу “стебельковых” бактерий, или “простекобактерий”, хотя филогенетически большинство из них не родственники.
Простеки покрыты клеточной стенкой и имеют цитоплазму с органеллами, они могут быть одиночными или множественными. Простеки могут иметь различную толщину – у Caulobacter crescentus они тонкие и длинные, у зеленой серобактерии Prosthecochloris aestuari – короткие и широкие, содержат хлоросомы (Определитель бактерий…, 2007). Стебельки, в отличие от простек, не имеют клеточного строения, состоят из вязких полисахаридов и служат, по-видимому, в основном для прикрепления к субстрату. Бактерии р. Nevskia формируют слизистые стебельки с дихотомическим ветвлением, соответствующим делению зрелых клеток (Определитель бактерий…, 2007).
Формирование длинных и тонких выростов, по-видимому, является выгодной стратегией для эффективного пропитания клетки в условиях недостатка питательных веществ, так как это увеличивает площадь поглощающей поверхности без существенного увеличения объема цитоплазмы (Ireland et al., 2002). Простеки или стебельки также выполняют функции прикрепления к поверхности среды, ориентации клетки в пространстве в соответствии с градиентами питательных веществ и регуляции рассеивания дочерних почкующихся клеток на определенной глубине (Poindexter, 1981; Wagner et al., 2006).
Интересный феномен описан у некоторых микоплазм – клетки Mycoplasma pneumoniae и M. genitalium, будучи во взвеси более или менее сферическими, приобретают грушевидную или колбовидную форму при движении по твердой поверхности за счет формирования вытянутой “органеллы прикрепления”. В основе ее – внутриклеточная сеть филаментов цитоскелетных белков – HMW1–HMW3, P1, P30, P40 и др., выполняющих функцию поддержания формы клетки и закрепления в цитоплазматической мембране эукариотических клеток организма-хозяина (Литусов, 2017).
СПИРАЛЬНЫЕ (ИЗВИТЫЕ) ФОРМЫ. КЛЕТКИ В ФОРМЕ ПЛОСКОЙ ВОЛНЫ (“FLATWAVEFORM CELLS”)
В природе известно несколько способов формирования и поддержания спиральной формы клетки у бактерий.
У Helicobacter pylori обнаружены особые пептидазы группы Csd (Csd1, Csd2, Csd3 и др.) (Sycuro et al., 2010), которые осуществляют контролируемое разрушение части пептидных сшивок между соседними гликановыми нитями пептидогликана клеточной стенки. Гликановые нити ориентированы перпендикулярно длинной оси клетки, пептидные сшивки – параллельно, за счет чего пептидогликановый саккулюс типичной палочки имеет форму прямого цилиндра. Если же часть пептидных сшивок между гликановыми нитями разрушается, клеточный цилиндр “скручивается” вокруг своей оси и приобретает спиральную форму (рис. 2) (Huang et al., 2008; Sycuro et al., 2010). Пространственное расположение и активность пептидаз Csd, ответственных за “скручивание” клетки, регулируются внутри сложных белковых комплексов, содержащих цитоскелетные элементы – бактофилин Ccma, ферменты синтеза предшественника пептидогликана MurF, а также АТФ-синтазный комплекс (Blair et al., 2018).
Рис. 2.
Схематическое изображение пептидогликанового саккулюса Helicobacter pylori (по: Sycuro et al., 2010). Ножницами указаны сайты возможного гидролиза пептидных связей эндопептидазами Csd.
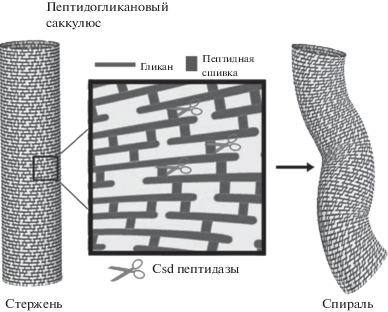
Важно, что гомологи Сsd обнаружены у многих спиральных и изогнутых видов Proteobacteria: у большинства ε-Proteobacteria и у представителей пяти порядков γ-Proteobacteria, в том числе у всех известных представителей Vibrionaceae (Sycuro et al., 2010), – что позволяет предположить универсальность механизма формирования спиральных клеток за счет регулируемой релаксации пептидных сшивок пептидогликанового саккулюса, по крайней мере у данной группы бактерий. Интересно, что белки Сsd или их гомологи, насколько нам известно, пока не обнаружены у грамположительных бактерий, что может быть возможной причиной редкости спиральных форм среди них. Тем более что у грамположительных бактерий пептидные сшивки соседних гликановых цепей отличаются по аминокислотному составу и не соединены непосредственно друг с другом, а связаны пентаглициновыми мостиками (Cassimeris et al., 2011).
Спиральная форма типична для большинства видов Spirochaetae, и традиционно ее связывали с наличием в периплазматическом пространстве спирохет эндофлагелл (внутренних жгутиков) – структур, сходных по строению со жгутиками других бактерий (Сanale-Parolа, 1977; Goldstein et al., 1994). Однако достаточно давно были получены лишенные эндофлагелл мутанты Treponema (JR1, HL51), клетки которых представляют собой правильные правозакрученные спирали (Ruby et al., 1997), в то время как клетки дикого типа имеют нерегулярную морфологию с чередованием спирально закрученных участков и участков в форме плоской волны. Похожая ситуация наблюдается и у видов Leptospira, спиральные клетки которых имеют загнутые в виде крючка или закрученные в виде спиралей второго порядка концы клеток. Мутанты Leptospira spp. c инактивированными генами flaB, лишенные внутренних жгутиков, имеют вид спиралей на всем протяжении клеточного цилиндра (Wolgemuth, 2015). На основании этого предполагают, что эндофлагеллы спирохет лишь модифицируют исходную спиральную форму клеток с образованием плоских волн, спиралей второго порядка или крючков, причем это происходит в тесном взаимодействии с наружной клеточной мембраной и связано с движением клеток при вращении “молекулярных моторов” базальных телец эндофлагелл (Wirth et al., 2016). Таким образом, основная функция эндофлагелл для спирохет, по-видимому, двигательная, и в меньшей степени структурная. Сведений о том, за счет чего поддерживается спиральная форма самого клеточного цилиндра спирохет, и связано ли это с контролируемым лизисом пептидогликана, как у Helicobacter pylori, нами в литературе не обнаружено.
Некоторые клетки, на первый взгляд напоминающие спиральные, на самом деле не образуют витков, а имеют форму плоской волны, как, например, Borrelia burgdorferi (Goldstein et al., 1994). У этих представителей Spirochaetae клеточный цилиндр как таковой имеет вид прямого стержня, поскольку мутанты по генам flaB, flgE, fliF, fliG2 и др., кодирующим соответствующие флагеллины или белки базального тела, являются палочковидными (Motaleb et al., 2000; Sal et al., 2008; Li et al., 2010). У клеток дикого типа эндофлагеллы образуют пучки, которые в виде плоских лент завернуты вокруг цитоплазматического цилиндра и как бы “стягивают” его по всей длине в волну, но без закручивания по спирали (Dombrowski et al., 2009).
Представители р. Spiroplasma (класс Mollicutes) поддерживают спиральную форму клетки без участия клеточной стенки, единственно за счет элементов цитоскелета. Со стороны отрицательной кривизны клетки вдоль клеточной мембраны у них тянется пучок фибрилл в виде плоской, спирально закрученной ленты, таким образом, что фибриллы и цитоплазматический цилиндр взаимно закручиваются друг вокруг друга (Trachtenberg, 2004). Основная структурная единица цитоскелетной ленты – 59 kDА белок – продукт гена fib, уникальный для Mollicutes, гомологов которого пока не обнаружено ни у прокариот, ни у эукариот (Trachtenberg et al., 2008).
Предполагают, что спиральные формы возникли как приспособление для передвижения в средах, более плотных и вязких, чем вода. Например, многие виды бактерий, изолированных из слизистой оболочки ЖКТ млекопитающих, являются спиральными: Сampylobacter, Helycobacter и др. (Robertson et al., 2005). Показано также, что лептоспиры в более вязкой среде движутся даже быстрее, чем в менее вязкой (Kaiser, Doetsch, 1975), тогда как у палочковидных форм – наоборот.
Спиральная форма клетки также может быть преимуществом с точки зрения увеличения площади свободной поверхности клетки по сравнению с палочками такой же длины, имеющими одинаковой объем “диффузионной сферы” (Schulz, Jørgensen, 2001; Young, 2006) – тонкого слоя жидкости, окружающего бактерию, через который преимущественно осуществляется обмен веществами с внешней средой. При этом важно, что большая поверхность дает возможность для размещения большего числа транспортных комплексов, обеспечивающих поглощение веществ в пределах “диффузионной сферы” (Schulz, Jørgensen, 2001; Young, 2006).
ИЗОГНУТЫЕ ФОРМЫ
Существует, по-видимому, несколько различных механизмов формирования кривизны бактериальной клетки.
Во-первых, вибрионы можно рассматривать как короткие спиральные формы, образующие всего ¼–¾ витка. На основании обнаружения у многих изогнутых форм гомологов Csd (Sycuro et al., 2010) можно предположить, что кривизна клетки у них обусловлена механизмами, сходными с описанными выше для Helicobacter pylori.
Во-вторых, изгиб клетки может образоваться путем ее неравномерного роста с левой и правой стороны, как это происходит у Caulobacter crescentus при участии филаментов кресцетина (Margolin, 2004). Несмотря на то, что кресцетин на сегодняшний день обнаружен только у Caulobacter, данный механизм может быть универсальным за счет других цитоскелетных белков (Wickstead, Gull, 2011). Так, например, у Vibrio cholerae совсем недавно был обнаружен еще один гомолог промежуточных филаментов – белок CrvA, ответственный за формирование кривизны клетки, сходным образом с кресцетином, каким-то образом замедляя синтез пептидогликана с той стороны клетки, где он прилегает к плазмалемме (Bartlett et al., 2017).
Форма вибрионов или слегка изогнутых палочек достаточно широко распространена среди бактерий различных систематических групп, особенно среди свободноживущих плавающих и паразитических форм (Schuech et al., 2019). Несмотря на ряд моментов, которые пока остаются неясными, большинство исследователей сходятся во мнении, что изогнутая форма является наиболее эффективной для плавания в поисках пищи и хемотаксиса (Magariyama et al., 2005; Young, 2006). Дасенбери (Dusenbery, 2011) показал, что повысить эффективность хемотаксиса можно путем удлинения клетки. Это объясняется тем, что чем дольше бактерия может сохранять свою ориентацию, тем дольше она может следовать градиенту концентрации, прежде чем броуновское движение рандомизирует направление ее движения. Однако в другой работе (Schuech et al., 2019) было показано, что удлинение уменьшает скорость и эффективность поступательно-вращательного движения клетки с помощью жгутика. Оказалось, что изгибание клетки позволяет избежать этого: по ряду физических причин даже небольшая кривизна позволяет сильно вытянутому прямолинейному стержню снизить потери в эффективности плавания более чем на 20% (Schuech et al., 2019). Таким образом, форма вибриона позволяет сочетать максимальную эффективность хемотаксиса с максимальным сохранением скорости и энергетической эффективности плавания. Интересно, что ультрамикробактерия Pelagibacter ubique, по некоторым оценкам являющаяся самой распространенной и самой многочисленной бактерией в водах Мирового океана, имеет форму как раз слегка изогнутых палочек, размером в среднем 0.12–0.2 на 0.4–0.9 мкм (Young, 2006).
По предположению ряда исследователей (Kudo et al., 2005; Young, 2007) изогнутая форма также является приспособлением к периодическому круговому движению вблизи (50–60 мкм) поверхности в водной среде, где циркулирует большее количество питательных веществ. Замечено, что клетки Vibrio alginolyticus в зоне 50–60 мкм от морского дна начинают плавать по кругу, увеличивая время контакта с богатой питательными веществами зоной (Kudo et al., 2005; Magariyama et al., 2005).
НЕОБЫЧНЫЕ ФОРМЫ. ПЛЕОМОРФИЗМ И ПОЛИМОРФИЗМ
Кокки, палочки, спиральные и нитчатые формы наиболее типичны для большинства бактерий. Однако встречаются также и весьма необычные формы: лимоновидные – Rhodomicrobium vannielii; Y-образные – Bifidobacterium; тороидальные – Rhodocyclus purpureus; плоские звездообразные – р. Stellа; лопастные, напоминающие зерна попкорна – Nitrosolobus multiformis (Watson et al., 1971); грушевидные – Mycoplasma genitalium. Относительно недавно выделен новый филум Verrucomicrobia (от лат. verruca – бугорок) – “бородавчатых” бактерий, обладающих многочисленными короткими и толстыми выростами (бугорками) на поверхности клетки. Наличие их может быть связано с регуляций гидродинамических свойств при плавании на определенной глубине, в том числе в морской воде, а также с увеличением соотношения поверхности к объему (Hedlund et al., 1997).
Многие необычные формы клеток можно свести к производным “привычных” форм: тороиды – удлиненные, сильно изогнутые вибрионы; звезды – бактерии, формирующие определенное число коротких плоских выростов; лимоновидные или стручковидные бактерии – вытянутые и заостренные с полюсов кокки или палочки и т.д. С одной стороны, такой взгляд упрощает морфологию бактерий и вносит определенную ясность, с другой – необходимо понимать, что существуют определенные механизмы формирования выростов той или иной формы или заостренных концов клетки, и что эти структуры дают какое-то преимущество клеткам, раз уж они закрепились в эволюции. Следовательно, каждая из необычных форм клеток все же заслуживает отдельного упоминания при описании морфологического разнообразия бактерий.
Важно также принять во внимание, что зачастую морфологическая эволюция той или иной группы бактерий шла по пути не изменения формы отдельной клетки, а путем формирования клеточных агрегатов из нескольких клеток типичной (исходной) формы. Например, формирование многоклеточных нитей цианобактерий – стратегия, необходимая для регуляции глубины плавания и/или удержания на поверхности воды в биопленках, а также пионерной колонизации труднодоступных субстратов (Walsby, 2005).
Наконец, для многих, если не всех, бактерий характерен плеоморфизм – способность к ненаследуемым адаптивным изменениям формы клетки в ответ на изменения условий среды, а некоторые группы, в особенности Mollicutes, отличает полиморфизм (плеоморфность) – непостоянство формы клетки в течение жизненного цикла. В силу отсутствия клеточной стенки для большинства микоплазм более или менее типична сферическая форма, однако клетки одного и того же вида в одной и той же культуре могут быть неправильной, эллипсоидной, почковидной и др. формы или образовывать длинные, иногда ветвящиеся тяжи и даже тороиды. Это может быть обусловлено тем, что деление клеток у микоплазм часто отстает от репликации, особенно при неблагоприятных условиях, в результате образуются необычные по форме мультинуклеоидные структуры (Борхсениус и др., 2016).
ЗАКЛЮЧЕНИЕ
Основными факторами, определяющими форму и размер бактериальных клеток, являются: диффузия веществ вблизи поверхности клетки и внутри нее, количество доступных питательных веществ в среде, вязкость и плотность внешней среды, влияющие на подвижность клеток, структура твердых поверхностей, с которыми контактируют бактерии, хищничество со стороны простейших или иммунных клеток организма в случае паразитизма бактерий и др.
По некоторым ключевым параметрам оптимальной оказывается форма палочки, у которой длина превосходит диаметр в 3–6 раз. В частности, палочки испытывают наименьшее сопротивление среды при активном плавании, наиболее эффективны в плане поглощения веществ и их внутриклеточного транспорта, а также компартментализации органелл в клетке и др. Тем не менее палочки далеко не универсальны и не могут быть оптимальными для всех местообитаний. По мнению многих исследователей, это некая исходная “среднеоптимальная” форма, от которой берут начало все остальные, подстраиваясь под разнообразие условий окружающей среды. Кокки сформировались, вероятно, в результате потери некоторых цитоскелетных белков, и, несмотря на ряд недостатков, в некоторых условиях они, наоборот, имеют преимущества, и потому широко распространены в природе.
Образование нитчатых и ветвящихся форм можно рассматривать как приспособление для увеличения площади поглощающей поверхности клетки, также это может быть выгодно для закрепления в почве. Форма вибриона повышает эффективность плавания в поисках пищи и, по крайней мере в некоторых случаях, оказывается выгодной для кругового движения клетки на малом расстоянии от твердых поверхностей в водоемах, где циркулирует большее количество питательных веществ. Спиральная форма считается также приспособлением к эффективному движению в вязких средах, в том числе внутри других живых организмов.
Интересно отметить, что форма клетки, с одной стороны, довольно консервативный признак, характеризующий определенные виды, роды, семейства, порядки и даже классы и отделы бактерий; с другой стороны, форма отдельной клетки может значительно изменяться в разные фазы жизненного цикла или в зависимости от условий среды. Примечательно, что одни и те же условия могут вызвать противоположные морфологические изменения у разных видов, например, в стационарную фазу культивирования многие палочковидные или спиральные бактерии: Acinetobacter (James et al., 1995), Arthrobacter (Luscombe, Gray, 1974), Helicobacter (Хомерики, Морозов, 2001) и др. – приобретают сферическую форму; другие же, например Caulobacter crescentus (Wortinger et al., 1998), наоборот, интенсивно удлиняются. Таким образом, действие селективных сил на клетки бактерий всегда вызывает сложные комбинации реакций, что может приводить к морфологическим изменениям в различных направлениях, поэтому прогнозировать изменение формы в ходе той или иной адаптивной реакции всегда рискованно. Тем не менее на популяционно-видовом уровне поддержание определенной формы клетки бактериями это интегрированный, направляемый естественным отбором процесс, осуществляемый в каждой конкретной клетке путем переключения деления, роста и тонкой регуляции взаимодействия множества цитоскелетных элементов и регуляторных белков.
Приведенные в данном обзоре положения ни в коем случае не являются абсолютной истиной, и не описывают огромного многообразия существующих форм бактерий, а также их эволюционных преобразований. Однако мы надеемся, что их можно считать некой теоретической основой, упорядочивающей знания об экологической морфологии бактерий. Надеемся также, что данный раздел науки будет интересен все большему числу исследователей.
Исследования выполнены в рамках Государственного задания Министерства науки и высшего образования РФ по теме № 0686-2019-0013: “Разработка новых биологических средств защиты растений на основе энтомоакарифагов, энтомопатогенов и микроорганизмов-антагонистов фитопатогенов и веществ биогенного происхождения” с использованием материально-технической базы УНУ “Технологическая линия для получения микробиологических средств защиты растений нового поколения” (http://ckp-rf.ru/ реестровый № 67136).
Список литературы
Борхсениус С.Н., Чернова О.А., Чернов В.М., Вишняков И.Е., 2016. Микоплазмы в биологии и медицине начала XXI века. СПб.: Наука. 328 с.
Дмитриев В.В., Сузина H.Е., Баринова Е.С., Дуда В.И., Боронин A.M., 2004. Электронно-микроскопическое изучение ультраструктуры микробных клеток in situ в экстремальных биотопах // Микробиология. Т. 73. № 6. С. 832–840.
Дуда В.И., 2017. Полярность – базовый принцип организации бактериальной клетки // Микробиология. Т. 86. № 4. С. 417–422.
Литусов Н.В., 2017. Микоплазмы. Иллюстрированное учебное пособие. Екатеринбург: Изд-во УГМУ. 19 с.
Маянский А.Н., 2006. Патогенетическая микробиология: учеб. пособие. Н. Новгород: Изд-во НГМА. 520 с.
Определитель бактерий Берджи, 2007. Под ред. Хоулта Д., Крига Н., Снитаи П. и др. М.: Мир. 444 с.
Пиневич А.В., 2009. Микробиология. Биология прокариотов. Т. 3. СПб.: Изд-во СПбГУ. 457 с.
Хомерики С.Г., Морозов И.А., 2001. Роль кокковых форм Helicobacter pylori в патогенетических механизмах и персистенции хеликобактерной инфекции // Росс. журн. гастроэнтерологии, гепатологии и колопроктологии. Т. 11. № 2. С. 99.
Ammendola A., Geisenberger O., Andersen J.B., Givskov M., Eber L.L., 1998. Serratia liquefaciens swarm cells exhibit enhanced resistance to predation by Tetrahymena sp. // FEMS Microbiol. V. 1. № 164. P. 69–75.
Bartlett T.M., Bratton B.P., Duvshani A., Miguel A., Sheng Y. et al., 2017. A periplasmic polymer curves Vibrio cholerae and promotes pathogenesis // Cell. V. 168. P. 172–185.
Benaissa M., 1996. Changes in Helicobacter pylori ultrastructure and antigens during conversion from the bacillary to the coccoid form // Infect. Immun. V. 64. № 6. P. 2331–2335.
Bi E.F., Lutkenhaus J., 1991. FtsZ ring structure associated with division in Escherichia coli // Nature. V. 354. № 6349. P. 161–164.
Bisson-Filho A.W., Hsu Y.P., Kuru E., Wu F., Jukes C., 2017. Treadmilling by FtsZ filaments drives peptidoglycan synthesis and bacterial cell division // Science. V. 355. № 6326. P. 739–743.
Blair K.M., Kevin S.M., Taylor J.A., Fero J., Jones L.A. et al., 2018. The Helicobacter pylori cell shape promoting protein Csd5 interacts with the cell wall, MurF, and the bacterial cytoskeleton // Mol. Microbiol. V. 110. № 1. P. 114–127.
Bode G., Mauch F., Malfertheiner P., 1993. The coccoid forms of Helicobacter pylori criteria for the irviability // Epidemiol. Infect. V. 111. № 3. P. 483–490.
Cabeen M.T., Jacobs-Wagner C., 2005. Bacterial cell shape // Nat. Rev. Microbiol. V. 3. № 8. P. 601–610.
Canale-Parola E., 1977. Physiology and evolution of spirochetes // Bacteriol. Rev. V. 41. № 1. P. 181–204.
Caro-Quintero A., Ritalahti K.M., Cusick K.D., 2012. The chimeric genome of Sphaerochaeta: Nonspiral spirochetes that break with the prevalent dogma in Spirochete biology // mBio. V. 3. № 3. P. 1–9.
Cassimeris L., Lingappa V.R., Plopper G., 2011. Lewin`s Cells. Burlington: Jones&Bartlett Learning. 1053 p.
Chang F., Huang K.C., 2014. How and why cells grow as rods // BMC Biol. V. 12. Art. 54.
Chauhan A., Madiraju M.V., Fol M., Maloney E., Reynolds R., Rajagopalan M., 2006. Mycobacterium tuberculosis cells growing in macrophages are filamentous and deficient in FtsZ rings // J. Bacteriol. V. 188. P. 1856–1865.
Chen Y. E., Tropini C., Jonas K., Tsokos C.G., Huang K.C., Laub M.T., 2011. Spatial gradient of protein phosphorylation underlies replicative asymmetry in a bacterium // Proc. Natl. Acad. Sci. USA. V. 108. № 3. P. 1052–1057.
Cooper S., Denny M.W., 1997. A conjecture on the relationship of bacterial shape to motility in rod-shaped bacteria // FEMS Microbiol. Lett. V. 148. № 2. P. 227–231.
Cushnie T.P., O’Driscoll N.H., Lamb A.J., 2016. Morphological and ultrastructural changes in bacterial cells as an indicator of antibacterial mechanism of action // Cell Mol. Life Sci. V. 73. № 23. P. 4471–4492.
Daniel R.A., Errington J., 2003. Control of cell morphogenesis in bacteria: Two distinct ways to make a rod-shaped cell // Cell. V. 113. № 6. P. 767–776.
Davis B.M., Waldor M.K., 2013. Establishing polar identity in gram-negative rods // Curr. Opin. Microbiol. V. 16. № 6. P. 752–759.
Dombrowski C., Kan W., Motaleb M.A., Charon N.W., Goldstein R.E., Wolgemuth C.W., 2009. The elastic basis for the shape of Borrelia burgdorferi // Biophys. J. V. 96. № 11. P. 4409–4417.
Dusenbery D.B., 1998. Fitness landscapes for effects of shape on chemotaxis and other behaviors of bacteria // J. Bacteriol. V. 180. № 22. P. 5978–5983.
Dusenbery D.B., 2011. Living at Micro Scale: The Unexpected Physics of Being Small. Cambridge: Harvard Univ. Press. 416 p.
Edwards D.H., Errington J., 1997. The Bacillus subtilis DivIVA protein targets to the division septum and controls the site specificity of cell division // Mol. Microbiol. V. 24. № 5. P. 905–991.
Esue O., Cordero M., Wirtz D., Tseng Y., 2005. The assembly of MreB, a prokaryotic homolog of actin // J. Biol. Chem. V. 280. № 4. P. 2628–2635.
Flardh K., 2003. Essential role of DivIVA in polar growth and morphogenesis in Streptomyces coelicolor A3(2) // Mol. Microbiol. V. 49. № 6. P. 1523–1536.
Fraser G.M., Furness R.B., Hughes C., 2000. Swarming migration by Proteus and related bacteria // Prokaryotic Development / Eds Brun Y.V., Shimkets L.J. Washington: American Society for Microbiology. P. 381–401.
Goldstein S.F., Charon N.W., Kreiling J.A., 1994. Borrelia burgdorferi swims with a planar waveform similar to that of eukaryotic flagella // Proc. Natl. Acad. Sci. USA. V. 91. № 8. P. 3433–3437.
Harshey R.M., 1994. Bees aren’t the only ones: Swarming in gram-negative bacteria // Mol. Microbiol. V. 13. P. 389–394.
Hay N.A., Tipper D.J., Gygi D., Hughes C., 1999. A novel membrane protein influencing cell shape and multicellular swarming of Proteus mirabilis // J. Bacteriol. V. 181. P. 2008–2016.
Hedlund B.P., Gosink J.J., Staley J.T., 1997. Verrucomicrobia div. nov., a new division of the bacteria containing three new species of Prosthecobacter // Antonie Van Leeuwenhoek. V. 72. P. 29–38.
Heichlinger A., Ammelburg M., Latus A., Maldener I., Flärdh K. et al., 2011. The MreB-like protein Mbl of Streptomyces coelicolor A3(2) depends on MreB for proper localization and contributes to spore wall synthesis // J. Bacteriol. V. 193. № 7. P. 1533–1542.
Huang K.C., Mukhopadhyay R., Wen B., Gitai Z., Wingreen N.S., 2008. Cell shape and cell-wall organization in Gram-negative bacteria // Proc. Natl. Acad. Sci. USA. V. 105. № 49. P. 19282–19287.
Ireland M.M., Karty J.A., Quardokus E.M., Reilly J.P., Brun Y.V., 2002. Proteomic analysis of the Caulobacter crescentus stalk indicates competence for nutrient uptake // Mol. Microbiol. V. 45. № 2. P. 1029–1041.
James G.A., Korber D.R., Caldwell D.E., Costerton J.W., 1995. Digital image analysis of growth and starvation responses of a surface-colonizing Acinetobacter sp. // J. Bacteriol. V. 177. P. 907–915.
Justice S.S., Hung C., Theriot J.A., Fletcher D.A., Anderson G.G. et al., 2004. Differentiation and developmental pathways of uropathogenic Escherichia coli in urinary tract pathogenesis // Proc. Natl. Acad. Sci. USA. V. 101. P. 1333–1338.
Kaiser G.E., Doetsch R.N., 1975. Enhanced translational motion of Leptospira in viscous environments // Nature. V. 255. P. 656–657.
Kearns D.B., 2010. A field guide to bacterial swarming motility // Nat. Rev. Microbiol. V. 8. № 9. P. 634–644.
Kearns D.B., Losick R., 2003. Swarming motility in undomesticated Bacillus subtilis // Mol. Microbiol. V. 49. P. 581–590.
Koch M.K., McHugh C.A., Hoiczyk E., 2011. BacM, an N-terminally processed bactofilin of Myxococcus xanthus, is crucial for proper cell shape // Mol. Microbiol. V. 80. № 4. P. 1031–1051.
Korolev E.V., Nikonov A.V., Brudnaya M.S., Snigirevskaya E.S., Komissarchik Y.Yu. et al., 1994. Tubular structures of Mycoplasma gallisepticum and their possible participation in cell motility // Microbiology. V. 140. P. 671–681.
Kudo S., Imai N., Nishitoba M., Sugiyama S., Magariyama Y., 2005. Asymmetric swimming pattern of Vibrio alginolyticus cells with single polar flagella // FEMS Microbiol. Lett. V. 242. P. 221–225.
Kühn J., Briegel A., Morschel E., Kahnt J., Leser K., Wick S., 2010. Bactofilins, a ubiquitous class of cytoskeletal proteins mediating polar localization of a cell wall synthase in Caulobacter crescentus // EMBO J. V. 29. № 2. P. 327–339.
Kürner J., Medalia O., Linaroudis A.A., Baumeister W., 2004. New insights into the structural organization of eukaryotic and prokaryotic cytoskeletons using cryo-electron tomography // Exp. Cell Res. V. 301. № 1. P. 38–42.
Kurtz H.D., Netoff D.I., 2001. Stabilization of friable sandstone surfaces in a desiccating, wind-abraded environment of south-central Utah by rock surface microorganisms // J. Arid Environ. V. 48. № 4. P. 89–100.
Lahr D.J.G., Laughinghouse H.D., Oliverio A.M., Gao F., Katz L.A., 2014. How discordant morphological and molecular evolution among microorganisms can revise our notions of biodiversity on Earth // BioEssays. V. 36. P. 950–959.
Letek M., 2008. DivIVA is required for polar growth in the MreB-lacking rod-shaped actinomycete Corynebacterium glutamicum // J. Bacteriol. V. 190. № 9. P. 3283–3292.
Li C., Xu H., Zhang K., Liang F.T., 2010. Inactivation of a putative flagellar motor switch protein FliG1 prevents Borrelia burgdorferi from swimming in highly viscous media and blocks its infectivity // Mol. Microbiol. V. 75. № 6. P. 1563–1576.
Lleo M.M., Canepari P., Satta G., 1990. Bacterial cell shape regulation: Testing of additional predictions unique to the two-competing-sites model for peptidoglycan assembly and isolation of conditional rod-shaped mutants from some wild-type cocci // J. Bacteriol. V. 172. № 7. P. 3758–3771.
Luscombe B., Gray T., 1974. Characteristics of Arthrobacter grown in continuous culture // J. Gen. Microbiol. V. 82. P. 213–222.
Magariyama Y., Ichiba M., Nakata K., Baba K., Ohtani T. et al., 2005. Difference in bacterial motion between forward and backward swimming caused by the wall effect // Biophys. J. V. 88. № 5. P. 3648–3658.
Margolin W., 2004. Bacterial shapes: Concave coiled coils curve Caulobacter // Curr. Biol. V. 14. № 6. P. 242–244.
Margolin W., 2009. Sculpting the bacterial cell // Curr. Biol. V. 19. № 17. P. 812–822.
Mercier C., Domakova E., Tremblay J., Kulakauskas S., 2000. Effects of a muramidase on a mixed bacterial community // FEMS Microbiol. Lett. V. 187. № 1. P. 47–52.
Møller-Jensen J., Löwe J., 2005. Increasing complexity of the bacterial cytoskeleton // Curr. Opin. Cell. Biol. V. 17. № 1. P. 75–81.
Motaleb M.A., Corum L., Bono J.L., Elias A.F., Rosa P., 2000. Borrelia burgdorferi periplasmic flagella have both skeletal and motility functions // Proc. Natl. Acad. Sci. USA. V. 97. № 20. P. 10899–10904.
Nakagawa M., Gestwicki J.E., Lake E.M., Kiessling L.L., Adler J., 2000. Motility and chemotaxis of filamentous cells of Escherichia coli // J. Bacteriol. V. 182. № 15. P. 4337–4342.
Nguyen L., Scherr N., Gatfield J., Walburger A., Pieters J., Thompson C.J., 2007. Antigen 84, an effector of pleiomorphism in Mycobacterium smegmatis // J. Bacteriol. V. 189. № 21. P. 7896–7910.
Park J.T., Uehara T., 2008. How bacteria consume their own exoskeletons (turnover and recycling of cell wall peptidoglycan) // Microbiol. Mol. Biol. Rev. V. 72. № 2. P. 211–227.
Pichoff S., Lutkenhaus J., 2005. Tethering the Z ring to the membrane through a conserved membrane targeting sequence in FtsA // Mol. Microbiol. V. 55. № 6. P. 1722–1734.
Pine L., Boone C.J., 1967. Comparative cell wall analyses of morphological forms within the genus Actinomyces // J. Bacteriol. V. 94. № 4. P. 875–883.
Poindexter J.S., 1981. The Caulobacters: Ubiquitous unusual bacteria // Microbiol. Rev. V. 45. № 1. P. 123–179.
Popp D., Narita A., Lee L.J., Ghoshdastider U., Xue B. et al., 2012. Novel actin-like filament structure from Clostridium tetani // J. Biol. Chem. V. 287. № 25. P. 21121–21129.
Robertson B.R., O’Rourke J.L., Neilan B.A., Vandamme P., Lee A., 2005. Mucispirillum schaedleri gen. nov., sp. nov., a spiral-shaped bacterium colonizing the mucus layer of the gastrointestinal tract of laboratory rodents // Int. J. Syst. Evol. Microbiol. V. 55. № 3. P. 1199–1204.
Ruby J.D., Li H., Kuramitsu H., Norris S.J., Goldstein S.F. et al., 1997. Relationship of Treponema denticola periplasmic flagella to irregular cell morphology // J. Bacteriol. V. 179. № 5. P. 1628–1635.
Sal M.S., Li C., Motaleb M.A., Shibata S., Aizawa S., Charon N.W., 2008. Borrelia burgdorferi uniquely regulates its motility genes and has an intricate flagellar hook-basal body structure // J. Bacteriol. V. 190. № 6. P. 1912–1921.
Schuech R., Hoehfurtner T., Smith D.J., Humphries S., 2019. Motile curved bacteria are Pareto-optimal // PNAS. V. 116. № 29. P. 14440–14447.
Schulz H.N., Jørgensen B.B., 2001. Big bacteria // Annu. Rev. Microbiol. V. 55. P. 105–137.
Shapiro J.A., Hsu C., 1989. Escherichia coli K-12 cell-cell interactions seen by time-lapse video // J. Bacteriol. V. 171. № 11. P. 5963–5974.
Shih Y.L., Rothfield L., 2006. The bacterial cytoskeleton // Microbiol. Mol. Biol. Rev. V. 70. № 3. P. 729–754.
Shikano A., Luckinbill L., Kurihara Y., 1990. Changes of traits in a bacterial population associated with protozoal predation // Microb. Ecol. V. 20. № 1. P. 75–84.
Steinberger R.E., Allen A.R., Hansma H.G., Holden P.A., 2002. Elongation correlates with nutrient deprivation in Pseudomonas aeruginosa – unsaturated biofilms // Microb. Ecol. V. 43. № 4. P. 416–423.
Sycuro L.K., Pincus Z., Gutierrez K.D., Biboy J., Stern C.A. et al., 2010. Peptidoglycan crosslinking relaxation promotes Helicobacter pylori’s helical shape and stomach colonization // Cell. V. 141. № 5. P. 822–833.
Thiem S., Kentner D., Sourjik V., 2007. Positioning of chemosensory clusters in E. coli and its relation to cell division // EMBO J. V. 26. № 6. P. 1615–1623.
Trachtenberg S., 2004. Shaping and moving a spiroplasma // J. Mol. Microbiol. Biotechnol. V. 7. № 1. P. 78–87.
Trachtenberg S., Dorward L.M., Speransky V.V., Jaffe H., Andrews S.B., Leapman R.D., 2008. Structure of the cytoskeleton of Spiroplasma melliferum BC3 and its interactions with the cell membrane // J. Mol. Biol. V. 378. № 4. P. 778–789.
Vinella D., D’Ari R., 1995. Overview of controls in the Esc-herichia coli cell cycle // BioEssays. V. 17. P. 527–536.
Vishnyakov I.E., Borchsenius S.N., Basovskii Yu.I., Levitskii S.A., Lazarev V.N. et al., 2009. Localization of division protein FtsZ in Mycoplasma hominis // Cell Tissue Biol. V. 3. № 3. P. 254–262.
Wagner J.K., Setayeshgar S., Sharon L.A., Reilly J.P., Brun Y.V., 2006. A nutrient uptake role for bacterial cell envelope extensions // Proc. Natl. Acad. Sci. USA. V. 103. № 31. P. 11772–11777.
Wagstaff J., Löwe J., 2018. Prokaryotic cytoskeletons: Protein filaments organizing small cells // Nat. Rev. Microbiol. V. 16. P. 187–201.
Walsby A.E., 2005. Stratification by cyanobacteria in lakes: A dynamic buoyancy model indicates size limitations met by Planktothrix rubescens filaments // New Phytol. V. 168. P. 365–376.
Watson S.W., Graham L.B., Remsen C.S., Valois F.W., 1971. A lobular, ammonia-oxidizing bacterium Nitrosolobus multiformis // Arch. Mikrobiol. V. 76. № 3. P. 183–203.
Wickstead B., Gull K., 2011. The evolution of the cytoskeleton // J. Cell Biol. V. 194. № 4. P. 513–525.
Wirth R., Ugele M., Wanner G., 2016. Motility and ultrastructure of Spirochaeta thermophila // Front. Microbiol. V. 7. P. 1609–1611.
Wolgemuth C.W., 2015. Flagellar motility of the pathogenic spirochetes // Semin. Cell. Dev. Biol. V. 46. P. 104–112.
Wortinger M.A., Quardokus E.M., Brun Y.V., 1998. Morphological adaptation and inhibition of cell division during stationary phase in Caulobacter crescentus // Mol. Microbiol. V. 29. P. 963–973.
Yang X., Lyu Z., Miguel A., McQuillen R., Huang K.C., Xiao J., 2017. GTPase activity-coupled treadmilling of the bacterial tubulin FtsZ organizes septal cell wall synthesis // Science. V. 355. № 6326. P. 744–747.
Young K.D., 2006. The selective value of bacterial shape // Microbiol. Mol. Biol. Rev. V. 70. № 3. P. 660–703.
Young K.D., 2007. Bacterial morphology: Why have different shapes? // Curr. Opin. Microbiol. V. 10. № 6. P. 596–600.
Zapun A., Vernet T., Pinho M.G., 2008. The different shapes of cocci // FEMS Microbiol. Rev. V. 32. № 2. P. 345–360.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


