Журнал общей биологии, 2021, T. 82, № 6, стр. 419-430
Участие липидов в адаптации высших сосудистых растений к условиям Западного Шпицбергена
Е. Ф. Марковская 1, *, О. А. Розенцвет 2, Н. Ю. Шмакова 3, А. А. Зорина 1, М. А. Ильинова 4
1 Петрозаводский государственный университет
185910 Петрозаводск, Просп. Ленина, 33, Россия
2 Самарский федеральный исследовательский центр РАН, Институт экологии Волжского бассейна РАН
445003 Тольятти, Комзина, 10, Россия
3 Полярно-альпийский ботанический сад-институт КНЦ РАН
184209 Апатиты, Ферсмана, 18А, Россия
4 Институт леса КарНЦ РАН
185910 Петрозаводск, Пушкинская, 11, Россия
* E-mail: volev10@mail.ru
Поступила в редакцию 24.05.2021
После доработки 07.08.2021
Принята к публикации 25.08.2021
Аннотация
Проанализировано содержание и состав жирных кислот (ЖК) суммарных липидов в листьях доминирующих и редко встречающихся 11 видов сосудистых растений арктических тундр Западного Шпицбергена в период активной вегетации. Виды различаются по биологии, ареалу, степени распространения и приуроченности к экотопу. Идентифицирован 21 тип ЖК c длиной цепи от 16 до 24 атомов углерода, содержащих от 2 до 4 двойных связей. Установлено, что у всех исследованных растений высокий вклад в состав ЖК вносят пальмитиновая (16:0), линоленовая (18:3(n-3)), стеариновая (18:0), пальмитоолеиновая (16:1(n-7)), олеиновая (18:1(n-9)), линолевая (18:2(n-6)) кислоты. Для 10 видов характерно присутствие длинноцепочных ЖК с более 20 атомами углерода, а у 5 арктических видов отмечено присутствие тетраеновых ЖК. При использовании кластерного анализа состава ЖК выделено 7 групп высших сосудистых растений. Показана связь между составом липидов кластера и геоботаническим показателем “активности вида”, что свидетельствует об активном участии липидной составляющей в их распространении на исследованной территории.
Разнообразие и совершенство адаптационных механизмов позволяет организмам заселять различные экологические ниши, в том числе в экстремально суровых условиях высоких и низких широт (Svoboda, Henry, 1987; Chernov, Matveeva, 1997). Основными факторами, которые лимитируют географическое распространение видов в различных экстремальных местообитаниях, являются высокие и низкие температуры (Levitt, 1980; Körner, 2003; Penfield, 2008). Анализируя климатические особенности Арктики, Антарктики, высокогорий Альп, Алтая, Тян-Шаня, Центральной Азии и Гималаев, Кернер (Körner, 2003) пришел к выводу, что в глобальной перспективе только температура может быть специфическим фактором, который дает типичную характеристику экстремальности. Растения, обитающие в суровых климатических условиях при низких температурах, испытывают ограничения для роста и развития (Hashem, Mohamed, 2020). На морфологическом уровне это карликовость, морфотипы, жизненные формы. Вместе с тем растения экстремальных территорий имеют высокую пластичность, вариабельность жизненных стратегий и высокую степень адаптивности (Körner, 2003; Василевская, 2007; Penfield, 2008).
Растения экстремальных местообитаний входят в группу психрофилов с температурным диапазоном жизнедеятельности и устойчивости от ‒20 до +15°C (Nievola et al., 2017). Диапазон существования растений ограничен приблизительным температурным диапазоном от –10 до +60°C и определяется точкой замерзания внутриклеточной воды и температурой денатурации белка (Nievola et al., 2017). Важность температуры как физического фактора для распространения организмов определяется следствием его прямого влияния на молекулярные (ДНК, белки) или супрамолекулярные (мембраны, хромосомы) структуры и является результатом термодинамического эффекта (Ruelland, Zachowski, 2010). Эти изменения обычно происходят быстро и тут же идентифицируются клеточными органеллами, включаются в биохимический и молекулярный ответы, которые интегрируются на уровне реакции клетки на изменение температуры. Для поддержания нормальной физиологической функции и выживания в неблагоприятных условиях окружающей среды растения имеют различные защитные механизмы, в том числе и физиолого-биохимические.
Липиды, как структурно-функциональные компоненты мембран и других органоидов растительной клетки, как защитные вещества, сигнальные молекулы и форма накопленного углерода и энергии, являются важными участниками адаптационного процесса (Schmid, Ohlrogge, 2002; Furt et al., 2011). Роль липидов и жирных кислот (ЖК) в поддержании текучести мембран считается одной из ведущих в адаптации растений к низкой и высокой температуре в период вегетации в широком спектре климатических условий (Лось, 2014; Rozentsvet et al., 2014; Нохсоров и др., 2015; Narayanan et al., 2016). Многочисленными исследованиями показано, что растения способны формировать функционально активную мембранную систему в разных климатических условиях (Sakai, Larcher, 1987; Körner, 2003; Петров и др., 2011; Zheng et al., 2011; Нохсоров и др., 2015; Markovskaya et al., 2019).
Так, исследование липидов арктического вида Stellaria humifusa Rottb. (Caryophyllaceae), произрастающего на скальном приморском экотопе около п. Баренцбург (архипелаг Шпицберген), показало, что в липидах доминирует фракция фосфолипидов, среди насыщенных жирных кислот (НЖК) – пальмитиновая, из ненасыщенных (ННЖК) – линоленовая кислота. Индекс ненасыщенности ЖК у гликолипидов, ответственных за структуру мембран хлоропластов фотосинтетического аппарата, равен 4.0, у фосфолипидов, образующих внепластидные мембраны, – 3.0 (Markovskaya et al., 2019). На территории Канадской Арктики отмечено, что растения реагируют не столько на климат региона, сколько на микроклимат напочвенного яруса (Svoboda, 2009). Толщина микроклиматического слоя для большинства арктических растений варьирует по высоте до 20 см и зависит от рельефа, структуры и состава растительного сообщества локального местообитания. Показано, что в июле в солнечный день около поверхности почвы в тропическом лесу и арктической тундре температура может быть одинакова – около +30°С. Но если в тропиках теплый микроклимат удерживается целый год, то в Арктике – несколько часов в течение одного или нескольких дней короткого лета.
Большое число исследований выполнено на кормовых дикорастущих растениях Российской Субарктики в Якутии – “Полюсе холода” Северного полушария. В условиях криолитозоны у растений выявлено увеличение содержания полиненасыщенных ЖК, что рассматривается как основная стратегия повышения устойчивости во время закалки к зимнему низкотемпературному стрессу (Петров и др., 2011; Нохсоров и др., 2015). Так, у кормового многолетнего хвоща обыкновенного (Equisetum variegatum) в течение вегетации доминируют НЖК (пальмитиновая) и ННЖК (олеиновая, линолевая, линоленовая). Осенью содержание ЖК увеличивается в 8.6 раз (насыщенных – в 13 раз, ненасыщенных – в 3 раза), что связано с ролью липидов и в большей степени ННЖК в процессе закаливания растений к экстремально низким температурам в зимний период (Петров и др., 2011). Исследование липидов у однолетнего вида Amaranthus retroflexus в этих же условиях показало, что содержание суммарных липидов (СЛ) варьирует по фазам развития в диапазоне от 60 до 80 мкг/г сухого веса с максимумом на этапе вегетативного развития и последующим снижением до фазы плодоношения. Во все периоды вегетации более высокие значения содержания ЖК отмечены во фракции фосфолипидов. Среди НЖК доминирует пальмитиновая (С16:0), среди ННЖК – линоленовая кислота (С18:3(n-3)). Индекс ненасыщенности изменяется от 2.4 до 3.4 с максимальным значением в фазу бутонизации (Слепцов и др., 2017). В результате обобщения собственных многолетних исследований (Petrov et al., 2010; Нохсоров и др., 2015) авторы разработали общую теорию механизмов устойчивости растений и животных к длительной гипотермии в условиях многолетней мерзлоты (криолитозоны) на примере Якутии. Эти механизмы обеспечивают формирование высокой питательной ценности замороженных естественным холодом растений. У исследованных растений отмечают высокое содержание липидов, доминирование фракции фосфолипидов и высокое содержание ненасыщенной линоленовой кислоты (18:3(n-3)). Одной из особенностей холодового закаливания многолетних растений криолитозоны является участие в качестве основных источников энергии липидов и полиеновых жирных кислот, а также накопление значительных количеств первичных и вторичных каротиноидов, являющихся антиоксидантами (Demmig-Adams, Adams, 2006).
На растениях альпийского пояса разных высокогорных районов были проведены многочисленные исследования, в которых показано повышение текучести мембран как одно из условий выживания этих растений в условиях температурных климатических стрессов (Sakai, Larcher, 1987; Wallis, Browse, 2002). Кроме того, при температуре ниже 0°C отмечено увеличение фракции лизофосфолипидов в 5–10 раз, что свидетельствует о стрессовой реакции (Welti et al., 2002). Холодовая акклимация у альпийских растений увеличивает соотношение НЖК/ННЖК, и у вида Cicer arietinum на фоне этих изменений отмечено увеличение индекса двойной связи от 1.18 до 1.54 (Bakht et al., 2006). Для некоторых альпийских видов показано, что галактолипиды, доминантные компоненты тилакоидных мембран хлоропластов, имеют больше триеновых ЖК, чем фосфолипидные мембраны, и вносят основной вклад в ненасыщенность (Murakami et al., 2000). Исследования основных физиологических функций, стресс-устойчивости, вторичных метаболитов у альпийских растений выявили широкий диапазон варьирования как между видами, так и в зависимости от условий обитания (Levitt, 1980; Körner, 2003; Василевская, 2007; Penfield, 2008). Функциональная устойчивость видов способствует поддержанию уникальной структуры арктических, субарктических и альпийских экосистем (Lütz, 2010; Марковская, Шмакова, 2017).
Растения Арктики и высокогорий в период активной вегетации наряду с низкой среднесуточной температурой воздуха часто подвергаются большим суточным температурным изменениям (Lütz, 2010). Так, для альпийских видов Saussurea medusa и Solms-Laubachia linearifolia при быстрой смене контрастных температур в суточном цикле отмечены изменения в шести классах фосфолипидов и двух классах галактолипидов, но степень ненасыщенности общих липидов и трех классов лизофосфолипидов (изменения в которых являются показателем стресса) в этот период оставались неизменными (Zheng et al., 2011). На основании обширных литературных данных и собственных результатов исследований альпийских растений авторами (Zheng et al., 2011) предложена гипотеза о разных механизмах поддержания текучести мембран. Первый механизм включает увеличение степени ненасыщенности липидов в ответ на длительное действие низкой температуры (сезонные, многосуточные изменения температуры), а второй – поддержание имеющегося уровня текучести мембран в ответ на кратковременные суточные изменения температуры за счет обмена головными группами липидов. Первый механизм хорошо изучен и исследован для разных таксономических групп растений и климатических зон (Körner, 2003; Розенцвет, 2006; Петров и др., 2011; Розенцвет и др., 2016), а второй механизм изучен у растений высокогорий, произрастающих в условиях суточного температурного градиента (Murphy, 2005; Zheng et al., 2011).
Уникальная ситуация сложилась с растениями в Антарктиде, где флора высших сосудистых растений представлена только двумя видами – Deschampsia antarctica Desv. (Poaceae) и Colobanthus quitensis (Kunth) Bartl. (Caryophyllaceae). Исследование различных механизмов адаптации на уровне структуры растения, активности фотосинтетического аппарата, особенностей липидного состава показало разные пути адаптации, но их сопоставление с уже известными механизмами позволило авторам (Parnikoza et al., 2011) сделать вывод, что никаких специфических механизмов адаптации к высоко экстремальным условиям не выявляется. Исследователи предполагают, что результат уникальности этих видов для Антарктики связан с постепенной и длительной адаптацией этих таксонов к экстремальным условиям в ледниковые периоды, их широкое распространение и почвенный банк семян обеспечивают выживание видов в снежном и ледяном покрове Антарктиды.
В отличие от многочисленных исследований в альпийских лугах разных высокогорий, исследования роли липидов в адаптации растений арктических территорий остаются единичными (Lütz, 2010; Марковская и др., 2017). К особенностям высоких широт, в отличие от других районов, относится круглосуточный полярный день, что обеспечивает высокий приход рассеянной солнечной радиации (Nilsen, 1983). Роль этого фактора представляет интерес, поскольку он регулирует морфогенез, онтогенетическое развитие растений, активность фотосинтетического аппарата, а значит и функциональную активность мембранных систем (Сысоева, Марковская, 2008).
Сезонность светового режима является самым древним экологическим фактором, существовавшим на протяжении эволюции растений на этой территории, даже во времена каменноугольного периода (Герман, 2009). В реакции растений на сезонность климата в те далекие эпохи липиды должны были принимать активное участие в поддержании функциональной активности мембран как в период вегетации при наличии полярного дня, так и в период полярной ночи. Важно отметить, что в настоящее время в период активной вегетации за счет круглосуточного полярного дня в течение трех–пяти месяцев приход солнечной радиации такой же, как в низких широтах. Доминирующий рассеянный свет лучше поглощается при фотосинтезе (Nilsen, 1983). Реакции жирных кислот, а значит и функциональная активность мембранных систем растений на круглосуточное освещение в период активной вегетации остаются не исследованными, хотя участие антиоксидантных систем в защите мембранных систем растений Арктики изучается (Lütz, 2010; Марковская, Шмакова, 2017). Вместе с тем флора одного из регионов Арктики – архипелага Шпицберген – имеет сравнительно высокое видовое и экотопическое разнообразие (Svoboda, Henry, 1987; Chernov, Matveeva, 1997). Особенности климата Шпицбергена (наличие теплых морских течений) позволяют наряду с холодоустойчивыми и широко распространенными видами произрастать термофильным, редким растениям, занимающим локальные экотопы, жизнеспособность которых ограничивает биоклиматическая зона (Alsos et al., 2007).
Одним из показателей, позволяющим оценить жизнеспособность вида в разных экологических условиях, может быть “активность вида” (Юрцев, 1968). По представлениям автора термин “активность” включает широту экологической амплитуды вида, частоту его встречаемости в сообществах какой-либо ассоциации и его участие (“обилие”).
Цель исследования – выявить связь между содержанием липидов, ЖК и экологической активностью разных по термоустойчивости видов, произрастающих в арктических тундровых сообществах Западного Шпицбергена.
МАТЕРИАЛЫ И МЕТОДЫ
Западный Шпицберген – крупный остров архипелага Шпицберген, расположенный между северной частью Атлантического океана и Северным Ледовитым океаном. Рельеф острова горный, ледники занимают больше половины площади, берега изрезаны фьордами, породы многолетнемерзлые (мощность слоя до 200 м), естественное оттаивание грунтов в летний период колеблется от 0.5 до 2.6 м, климат океанический, на западе значительно смягчен теплым Шпицбергенским течением (часть Гольфстрима) (Мавлюдов, 2006). Вследствие высокой влажности воздуха даже зимние осадки могут выпадать дождем или туманом. Среднегодовая температура воздуха составляет –5.8°С. Средняя температура самого теплого месяца (июля) +8.0°С, самого холодного (февраля) –18°С (Семенов и др., 2002). В среднем за год выпадает 563 мм осадков. В течение всего года наблюдается высокая относительная влажность воздуха, в среднем 78%. На широте Баренцбурга с 19 апреля по 24 августа (127 дней) длится полярный день. Климатические особенности обусловливают короткий вегетационный период (40−70 дней).
Работа выполнена в окрестностях п. Баренцбург на приморских и предгорных террасах и склонах горной цепи Гренфьордфьеллет, в арктических тундрах в окрестностях п. Колсбей в июле 2018 г. В качестве объектов исследования выбраны 11 видов растений из 8 семейств арктических тундр о. Западный Шпицберген. Из них 7 травянистых многолетников: сем. Caryophyllaceae – звездчатка приземистая (Stellaria humifusa Rottb.), ясколка альпийская (Cerastium alpinum L.), смолевка бесстебельная (Silene acaulis L.); сем. Polygonaceae – кисличник двупестичный (Oxyria digyna (L.) Hill); сем. Ranunculaceae – лютик серно-желтый (Ranunculus sulphureus Soland.); сем. Saxifragaceae – камнеломка дернистая (Saxifraga cespitosa L.), камнеломка поникающая (S. cernua L.); 4 вида кустарничков: сем. Salicaceae – ива полярная (Salix polaris Walenb.); сем. Rosaceae – дриада восьмилепестная (Dryas octopetala L.); сем. Ericaceae – голубика обыкновенная, мелколистная (Vaccinium uliginosum subsp. microphyllum (Lange) Hulten.) и cем. Betulaceae – береза карликовая (Betula nana L.) (Rǿnning, 1996).
Материал собран в середине июля, в фазу цветения. Для биохимических анализов отбирали хорошо развитые листья 5–10 растений одного вида, которые лиофинизировали в аналитической лаборатории Института Арктики и Антарктики в п. Баренцбург. Исследование фракционного и жирнокислотного состава липидов были выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук” (лаборатория аналитическая ИЛ КарНЦ РАН). Суммарные липиды экстрагировали смесью хлороформа и метанола в соотношении 2 : 1. Жирные кислоты анализировали в виде метиловых эфиров, которые получали реакцией с ацетилхлоридом в метаноле. Анализ проводили на газожидкостном хроматографе “Хроматэк-Кристалл-5000.1” (Россия) при следующих условиях: капиллярная колонка HP INNOWAX (30 м, 0.32 мм); температура колонки, испарителя, пламенно-ионизационного детектора – 205, 240 и 260°С соответственно; газ-носитель – азот; скорость пропускания через колонку азота, водорода, воздуха – 50, 40, 400 мл/мин соответственно. Идентификацию ЖК проводили по временам удерживания стандартных образцов (Supelko, 37 компонентов, США). Определение количественного содержания ЖК проводили методом внутреннего стандарта (в качестве стандарта – маргариновая кислота) (Шуляковская и др., 2014). Расчет делали в мг/г сухой массы и далее рассчитывали в весовых процентах от суммы.
Содержание пигментов пластид в ассимилирующих органах определяли в спиртовых вытяжках (96%) спектрофотометрическим методом (UV-1800, “Shimadzu”, Япония) по оптической плотности в максимумах поглощения хлорофиллов (a и b) и каротиноидов (Lichtenthaler, Wellburn, 1983). Пробы листьев каждого вида растений отбирали в 5-кратной биологической повторности, а затем анализировали в 3-кратной аналитической повторности.
Описательная статистика, сравнительный и корреляционный анализ проведены по стандартной методике (Коросов, 2007). Анализ сходства исследованных сосудистых растений проведен на основе количественных данных (мг/г сухой массы) по ЖК суммарных липидов методом кластерного анализа, для подтверждения результатов которого число итераций бутстрепинга составило 10 000 (Шитиков, Розенберг, 2013). Оценку соотношения НЖК и ННЖК для выделенных групп растений, сформированных на основе применения кластеризации, проводили с использованием нормированного отклонения – универсального способа унификации данных в вариационной статистике (Коросов, 2007). Сначала проводили нормирование каждого признака (количество конкретной ЖК – j = 1, 2, …, m) определенного вида (i = 1, 2, …, n): tij = (x − M)/S, где x – количество ЖК на единицу массы (мг/г), M – среднее арифметическое и S – стандартное отклонение по всем ЖК отдельного вида растений. Далее безразмерные признаки усредняли по группе ЖК суммарных липидов (СЛ) (диеновые, моноеновые, триеновые, тетраеновые, насыщенные): ti = 1/m∑(1 →m)tij. Данные по видам одного кластера усредняли, а для более наглядного представления результатов соотношения НЖК и ННЖК использованы абсолютные значения индекса, рассчитанного на основе нормированного отклонения |t| =|1/n∑(1→ n)ti|.
Статистическая обработка выполнена в программах Microsoft Excel 2010, STATGRAPHICS Plus 5.0 и бесплатном пакете PAST v3.17.
РЕЗУЛЬТАТЫ
В исследуемой группе сосудистых растений о. Западный Шпицберген доминируют представители арктической фракции флоры с циркум- и амфиареалами (более 70%), представлены гипоаркты (Vaccinium uliginosum subsp. microphyllum) и представители бореальной фракции флоры (Betula nana). Экологическая группа представлена в основном мезофитами и гигрофитом (Stellaria humifusa), но также присутствуют эвритопные виды (Betula nana, Saxifraga cespitosa, S. cernua) (Секретарева, 2004).
Количество СЛ в ассимилирующих органах исследованных видов варьирует в широком диапазоне от 75.8 до 401.5 мг/г сухого веса (табл. 1). Для травянистых растений показатель сдвинут в сторону более высоких значений (85.8–401.5), а для одревесневающих – более низких (75.8–125.4). Среди трав максимальное значение отмечено у широко распространенного вида Oxyria digyna, а минимальное – у представителя приморских экотопов Stellaria humifusa. В группе “кустарнички” максимум наблюдается у распространенного вида Salix polaris, а минимум у термофильного вида локальных экотопов Dryas octopetala (табл. 1). К растительным липидам относят многие изопреноидные соединения, в число которых входят и хлорофиллы. Суммарное содержание хлорофиллов (a + b) изменяется в широких пределах от 2.4 до 8.1 мг/г сухого веса (табл. 1). Между содержанием СЛ и пигментов установлена высокая значимая корреляция (r = 0.72, р < 0.05), что может свидетельствовать о большом значении липидов в фотосинтетической функции у растений Арктики (Schmid, Ohlrogge, 2002; Марковская, Шмакова, 2017).
Таблица 1.
Содержание суммарных липидов и хлорофиллов в растениях арктических тундр Западного Шпицбергена, средние значения ±SE (n = 5)
| Вид | Суммарные липиды, мг/г с. в. | Хлорофиллы (a + b), мг/г с. в. |
|---|---|---|
| Травы | ||
| Oxyria digyna | 401.5 ± 36.2 | 8.1 ± 0.07 |
| Ranunculus sulphureus | 178.8 ± 10.7 | 5.5 ± 0.08 |
| Cerastium alpinum | 126.8 ± 8.9 | 4.5 ± 0.07 |
| Saxifraga cernua | 124.7 ± 6.2 | 3.6 ± 0.03 |
| Silene acaulis | 118.6 ± 8.4 | 2.6 ± 0.02 |
| Saxifraga cespitosa | 101.9 ± 8.1 | 2.4 ± 0.01 |
| Stellaria humifusa | 85.8 ± 2.6 | 3.8 ± 0.06 |
| Кустарнички | ||
| Salix polaris | 125.4 ± 7.8 | 5.0 ± 0.09 |
| Betula nana | 108.6 ± 4.9 | 6.4 ± 0.11 |
| Vaccinium uliginosum | 86.5 ± 5.2 | 5.2 ± 0.07 |
| Dryas octopetala | 75.8 ± 4.3 | 3.8 ± 0.09 |
В составе СЛ ассимилирующих органов всех исследованных растений идентифицирована 21 ЖК, которые различаются по длине углеродных цепей (от 16 до 24 атомов углерода) и числу двойных связей (табл. 2). Доминирующими ЖК у всех видов (65–91% от СЛ) являются пальмитиновая (С16:0), линолевая (С18:2(n-6)) и α-линоленовая (С18:3(n-3)), что соответствует данным по растениям более низких широт (Zhivet’ev et al., 2010).
Таблица 2.
Групповой состав жирных кислот суммарных липидов (% от суммы) высших сосудистых растений Западного Шпицбергена
| ЖК | Виды растений | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Oxyria digyna | Cerastium alpinum | Silene acaulis | Stellaria humifusa | Ranunculus sulphureus | Saxifraga cernua | Saxifraga cespitosa | Salix polaris | Betula nana | Dryas octopetala | Vaccinium uliginosum | |
| 16:0 | 14.21 ± 1.13 | 22.10 ± 1.98 | 21.52 ± 1.87 | 22.79 ± 2.03 | 16.43 ± 0.79 | 18.57 ± 0.85 | 23.40 ± 1.06 | 22.64 ± 1.98 | 34.81 ± 3.83 | 31.28 ± 2.76 | 32.0 ± 2.96 |
| 18:0 | 0.94 ± 0.03 | 1.32 ± 0.15 | 4.40 ± 0.21 | 2.57 ± 0.08 | 1.24 ± 0.06 | 1.97 ± 0.09 | 1.25 ± 0.11 | 1.51 ± 0.06 | 3.11 ± 0.12 | 6.24 ± 0.35 | 5.05 ± 0.45 |
| 20:0 | – | 1.11 ± 0.05 | 12.62 ± 1.05 | 1.08 ± 0.08 | 1.12 ± 0.04 | – | – | 0.54 ± 0.03 | 2.07 ± 0.13 | 11.25 ± 0.86 | 6.90 ± 0.41 |
| 22:0 | 0.63 ± 0.02 | – | 5.45 ± 0.32 | – | 1.36 ± 0.06 | – | – | – | 2.17 ± 0.15 | 7.31 ± 0.48 | 1.46 ± 0.04 |
| 16:1(n-5) | 3.21 ± 0.14 | 1.81 ± 0.16 | 0.68 ± 0.03 | – | 3.01 ± 0.13 | 1.85 ± 0.06 | 1.50 ± 0.07 | 2.48 ± 0.14 | 2.69 ± 0.18 | 2.11 ± 0.18 | 2.37 ± 0.08 |
| 16:1(n-7) | – | – | 0.62 ± 0.05 | 1.68 ± 0.09 | – | – | – | – | 0.98 ± 0.05 | 1.0 ± 0.07 | 0.97 ± 0.06 |
| 18:1(n-9) | 3.06 ± 0.28 | 2.84 ± 0.18 | 3.82 ± 0.27 | 7.94 ± 0.63 | 1.88 ± 0.03 | 2.77 ± 0.17 | 4.72 ± 0.23 | 1.96 ± 0.85 | 6.42 ± 0.35 | 5.10 ± 0.23 | 5.88 ± 0.25 |
| 20:1(n-9) | 0.77 ± 0.05 | – | – | – | – | – | 0.97 ± 0.08 | – | 0.57 ± 0.03 | – | 4.15 ± 0.34 |
| 16:2(n-6) | – | – | – | – | – | – | 1.0 ± 0.07 | – | – | – | – |
| 16:2(n-9) | – | 0.81 ± 0.08 | – | 0.90 ± 0.07 | – | – | – | – | 2.63 ± 0.11 | – | – |
| 18:2(n-6) | 23.61 ± 1.63 | 28.55 ± 1.83 | 27.50 ± 1.21 | 29.87 ± 1.52 | 10.02 ± 0.88 | 10.72 ± 0.76 | 20.76 ± 1.05 | 11.56 ± 0.98 | 13.26 ± 0.87 | 9.62 ± 0.43 | 10.61 ± 0.87 |
| 20:2(n-6) | 0.60 ± 0.03 | 1.30 ± 0.08 | 2.13 ± 0.08 | 1.41 ± 0.12 | 0.56 ± 0.03 | – | – | 0.61 ± 0.04 | 1.78 ± 0.17 | – | – |
| 20:2(n-9) | – | – | – | – | – | – | 2.41 ± 0.08 | – | – | – | – |
| 20:2(n-4) | – | – | – | – | 0.59 ± 0.05 | – | – | – | – | – | – |
| 16:3(n-4) | – | – | – | 0.64 ± 0.01 | – | – | – | – | – | – | – |
| 16:3(n-6) | – | – | – | – | 10.73 ± 0.79 | 0.96 ± 0.10 | – | – | 1.64 ± 0.12 | – | 0.73 ± 0.03 |
| 18:3(n-3) | 52.04 ± 3.64 | 30.02 ± 2.57 | 19.43 ± 0.98 | 19.90 ± 0.83 | 51.87 ± 2.47 | 60.79 ± 6.58 | 43.05 ± 1.97 | 57.12 ± 3.53 | 27.27 ± 1.85 | 23.71 ± 1.07 | 28.83 ± 1.43 |
| 18:3(n-4) | – | – | – | – | – | – | – | – | 0.60 ± 0.01 | – | – |
| 18:3(n-6) | – | 3.11 ± 0.22 | 0.66 ± 0.02 | 4.20 ± 0.16 | – | – | – | – | – | – | – |
| 18:4(n-4) | – | 5.43 ± 0.14 | – | 5.15 ± 0.19 | – | – | – | – | – | – | – |
| 20:4(n-3) | – | – | 1.17 ± 0.10 | 0.92 ± 0.07 | 0.68 ± 0.02 | – | – | – | – | 2.23 ± 0.08 | – |
Оценка варьирования содержания жирных кислот показала, что межвидовая изменчивость достоверно выше внутривидовой для всех рассмотренных типов жирных кислот (критерий Бартлетта, р < 0.08). Содержание НЖК в СЛ исследованных растений варьирует от 16 до 56% от суммы ЖК: у травянистых многолетников этот диапазон составляет 16–44%, а у одревесневающих видов – 25–56%. Из травянистых растений наибольшее значение (44%), сходное с одревесневающими видами, обнаружено у Silene acaulis, у остальных трав доля не превышает 27%. Самое низкое количество НЖК из группы одревесневающих растений зарегистрировано у кустарничка Salix polaris (25%), что сближает его с травянистыми растениями. Высокие значения наблюдаются у Dryas octopetala, где в составе СЛ доминируют НЖК (56%). Основной вклад в состав НЖК вносит пальмитиновая кислота С16:0. У одревесневающих растений ее значение выше и составляет 23–35%, у трав не превышает 23% от суммы ЖК. У кустарничков Dryas octopetala, Vaccinium uliginosum и травянистого вида Silene acaulis выявлены редкие длинноцепочечные ЖК: арахиновая (С20:0) и бегеновая (С22:0) с содержанием выше 5%.
Содержание ННЖК варьирует в диапазоне от 44 до 84% от суммы СЛ: у травянистых растений 56–84%, у одревесневающих 44–75%. При этом содержание моноеновых ЖК в целом у растений невысокое (5–13%), основной вклад в их состав у большинства видов вносит олеиновая кислота С18:1(n-9). Например, ее содержание у Stellaria humifusa составляет 80% от суммы моноеновых кислот. В составе липидов Ranunculus sulphureus, Oxyria digyna, Salix polaris отмечено более высокое содержание С16-моноеновых кислот с разным положением двойных связей: С16:1(n-7) и С16:1(n-5) по сравнению с содержанием олеиновой кислоты С18:1(n-9). У нескольких видов (Silene acaulis, Vaccinium uliginosum, Dryas octopetala) присутствует гондоиновая кислота С20:1(n-9), которая у Vaccinium uliginosum занимает второе место после С18:1(n-9).
Количество диеновых ЖК у большинства видов увеличивается, как правило, в 2–6 раз по сравнению с моноеновыми ЖК. Однако для кустарничков Dryas octopetala и Vaccinium uliginosum их количество остается на уровне моноеновых. Группа диеновых кислот представлена двумя семействами: с двойными связями в положении (n-6) и (n-9). Главной из них является линолевая кислота С18:2(n-6), содержание которой составляет более 90% среди диеновых ЖК у большинства видов, а для Dryas octopetala и Vaccinium uliginosum является единственной (табл. 2).
Содержание триеновых кислот у многих видов значительно увеличивается по сравнению с диеновыми кислотами. Главной триеновой ЖК является α-линоленовая С18:3(n-3), как основной компонент липидов листьев, ее содержание достигает наибольших значений у Saxifraga cernua (61%), Salix polaris (57%), Ranunculus sulphureus (52%), Oxyria digyna (52%). Однако у видов Silene acaulis, Stellaria humifusa содержание триеновых оказалось ниже, чем диеновых ЖК. Низкое содержание α-линоленовой кислоты (20–29%) отмечено и у одревесневающих растений: Betula nana, Vaccinium uliginosum, Dryas octopetala. У некоторых видов обнаружена γ-линоленовая кислота С18:3(n-6) с максимальным количеством (4.2%) в листьях Stellaria humifusa. В минорных количествах идентифицированы кислоты других биосинтетических семейств, например, 16:3(n-4), 16:3(n-6) и 18:4(n-4). Содержание ЖК 16:3(n-6) у Ranunculus sulphureus составило около 11% от общей суммы и около 20% от суммы триеновых кислот. Тетраеновые кислоты появляются у 5 видов в количестве от 0.7 до 6.1% от суммы ЖК (табл. 2).
Для установления сходства растений арктической тундры Шпицбергена по количественному составу ЖК проведен кластерный анализ (рис. 1). В результате было выделено 7 кластеров растений, которые отличаются с доверительной вероятностью >95% (рис. 1). Для трактовки дифференциации растений в зависимости от состава ЖК липидов был использован метод обработки данных на основе нормированного отклонения и проведена оценка соотношения НЖК и ННЖК в выделенных кластерах растений (рис. 1, 2).
Рис. 1.
Дендрограмма сходства видов по количественному составу жирных кислот, полученная методом ближайшего соседа по матрице нормированных евклидовых дистанций с нанесенными оценками бутстреп-вероятностей ветвей; пунктиром разделены кластеры растений с доверительной вероятностью >95%: Saxifraga cespitosa (S_ces), Oxyria digyna (Ox_dig), Dryas octopetala (Dr_oct), Salix polaris (S_pol), Silene acaulis (S_ac), Stellaria humifusa (St_hum), Saxifraga cernua (S_cern), Vaccinium uliginosum microphyllum (V_ul_m), Ranunculus sulphureus (R_sul), Cerastium alpinum (C_alp), Betula nana (B_nana).

Рис. 2.
Соотношение насыщенных и ненасыщенных жирных кислот (ЖК) суммарных липидов (СЛ) у семи выделенных кластеров растений арктической тундры Шпицбергена, рассчитанное на основе нормированного отклонения (использованы абсолютные значения для более наглядного представления данных – |t|).
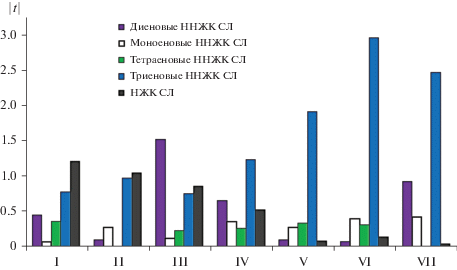
Для видов первой группы или кластера (Dryas octopetala и Vaccinium uliginosum subsp. microphyllum) характерно высокое содержание НЖК, более низкое – триеновых и присутствие тетраеновых ННЖК, которые повышают величину ненасыщенности липидов. Во втором кластере (Betula nana) также наблюдается высокое содержание НЖК, увеличивается роль триеновых ННЖК и отсутствуют тетраеновые ННЖК. У видов третьей группы (Silene acaulis и Stellaria humifusa) отмечается максимальное значение диеновых ННЖК и остаются высокими значения НЖК; в небольшом количестве, но имеются тетраеновые ННЖК. У видов четвертого кластера (Cerastium alpinum и Saxifraga cespitosa) содержание НЖК снижается, но увеличивается количество триеновых ННЖК, сохраняется значимость диеновых ННЖК и присутствуют тетраеновые ННЖК. В пятой (Salix polaris и Saxifraga cernua) и шестой (Ranunculus sulphureus) группах резко доминируют триеновые ННЖК, а в седьмом кластере (Oxyria digyna), наряду с доминированием триеновых ННЖК увеличивается значимость диеновых (рис. 2).
Таким образом, существует большое разнообразие в соотношении компонентов НЖК и ННЖК. Это определяет реакцию растений на стресс и связано со способностью регуляции текучести и проницаемости мембран разных видов растений (Tsydendambaev et al., 2013). Следовательно, в адаптивных процессах у растений высокой Арктики принимают участие как НЖК, так и ННЖК (избирательно диеновые, моноеновые и более значимо триеновые) суммарных липидов.
ОБСУЖДЕНИЕ
Полученные результаты показали, что имеется зависимость между биологическими особенностями видов (жизненная форма, степень устойчивости, географический ареал) и составом жирных кислот в суммарных липидах. Для оценки предполагаемой зависимости был выбран интегральный эколого-биологический показатель, учитывающий биологические особенности видов – “активность вида” (Юрцев, 1968). Согласно понятию термина “активность”, выделяется пять категорий активности (I–V), с буквенным обозначением степени обилия: a – высокое и b – низкое обилие. В работе Н.Е. Королевой с соавторами (2008) было проведено исследование активности видов высших сосудистых растений флоры Западного Шпицбергена, что позволило проанализировать и рассмотреть выявленные нами закономерности кластеризации группы видов по липидной фракции метаболитов. Использование геоботанической характеристики (активность вида) показало, что в первый и второй кластеры вошли растения с низкой и средней активностью (категория I и III), в третий кластер вошли виды со средней и высокой активностью категорией IIIа и IVа, в четвертый–седьмой кластеры вошли виды активные и высокоактивные (категории IV и V). Выявленная связь между биохимической и геоботанической характеристиками исследованных растений позволяет подойти к рассмотрению участия отдельных ЖК в адаптации видов к условиям Арктики.
Так, в первые два кластера объединены виды (Betula nana I, Vaccinium uliginosum subsp. microphyllum I, Dryas octopetala IIIa), у которых в составе СЛ доминируют НЖК (42–55% от суммы), что и определяет их низкую функциональную активность (категория I и III) и ограничения в освоении широкого спектра экотопов (Rǿnning, 1996). Это теплолюбивые растения (Alsos et al., 2007), которые либо спорадически заходят в высокую Арктику, либо находятся на периферии ареала своего распространения (Betula nana). Они занимают более благоприятные локальные местообитания (Dryas octopetala) или встречаются только в единичных местообитаниях (Betula nana, Vaccinium uliginosum subsp. microphyllum).
К третьему кластеру относятся виды (Silene acaulis IIIa и Stellaria humifusa IVa), у которых значимо присутствуют НЖК. У Silene acaulis отмечены длинноцепочные НЖК (22:0) и тетраеновая ЖК (20:4). У Stellaria humifusa присутствуют длинноцепочные тетраеновые ЖК (20:4), доминируют диеновые ННЖК, что отличает их от других видов. Silene acaulis является подушковидным растением, но в условиях Шпицбергена ее произрастание ограничено прогреваемыми, малоснежными местообитаниями, в отличие от более южных высокогорий (Körner, 2003; Волков, 2006). Stellaria humifusa – арктическое растение приморских экотопов, высокая активность связана с широким распространением данных экотопов во внутренних фьордах, где и проводились исследования (Rǿnning, 1996).
Четвертый кластер включает два активных вида (Cerastium alpinum Vb и Saxifraga cespitosa IVb), которые широко представлены в экотопах исследуемой территории (Rǿnning, 1996). В липидном спектре у них доминируют диеновые и триеновые ННЖК. У Cerastium alpinum уровень ненасыщенности поддерживается еще и группой тетраеновых ННЖК.
Пятый кластер представлен высокоактивными видами (Salix polaris Va и Saxifraga cernua IVa), которые занимают широкий спектр экотопов (Rǿnning, 1996). Для них отмечено высокое содержание триеновых ННЖК (57–61% от суммы ЖК). Высокая активность Salix polaris подтверждена литературными данными (Słupianek et al., 2019). Этот вид является коллективным доминантом в большинстве растительных сообществ арктических тундр Шпицбергена, отмечен почти во всех типах местообитаний (за исключением приморских маршей и пляжей), где встречается с высоким постоянством (Королева и др., 2008).
Шестой кластер содержит Ranunculus sulphureus – активный арктический вид, но не имеющий высокого участия в сообществах (категория IVb). R. sulphureus занимает различные местообитания, но никогда не входит в состав доминантов в сообществах исследованного района (Королева и др., 2008). У него доминируют триеновые ННЖК и присутствуют длинноцепочные тетраеновые ЖК (20:4(n-3)).
Седьмой кластер представлен одним видом – Oxyria digyna (категория IVа). Это категория довольно обычных видов, которые встречаются несколько реже и с меньшим постоянством, чем высокоактивные виды, но в некоторых местообитаниях входят в состав доминантов сообществ (Королева и др., 2008). У этого вида отмечено максимальное содержание СЛ и низкое разнообразие индивидуальных ЖК, число которых не превышает шести, если не учитывать ЖК с низким содержанием (меньше 1%). O. digyna – арктоальпийский вид, широко представлен на антропогенно трансформированных экотопах, где может иметь высокую биомассу, в десятки раз превышающую биомассу растений в естественных экотопах.
ЗАКЛЮЧЕНИЕ
Исследованная группа видов сосудистых растений Западного Шпицбергена, контрастных по своей систематической, географической и экологической принадлежности, объединена в семь кластеров на основе количественного состава суммарных липидов и соотношения насыщенных и ненасыщенных жирных кислот. Нормирование количественных данных по ЖК предоставило возможность оценить их соотношение в разных по термоустойчивости растениях. В группе СЛ доминирование НЖК или ННЖК зависит от холодоустойчивости видов растений, что определяет их степень распространения на экотопах исследованной территории.
Два первых кластера объединили термофильные кустарнички. Для данных видов установлены минимальные температуры жизнедеятельности по июлю: Vaccinium uliginosum subsp. microphyllum (5−6°С), Betula nana (6−7°С), Dryas octopetala (3−4°С) (Alsos et al., 2007). Эти растения имеют высокие значения НЖК, что ограничивает их функциональную активность и широкое распространение. Для видов остальных кластеров характерно доминирование содержания ННЖК. Это обеспечивает поддержание текучести мембран и является ведущим показателем в адаптации растений к более широкому диапазону условий и, соответственно, расширяет возможности в освоении арктических экотопов.
Следует отметить, что для растений Арктики характерно большое разнообразие минорных ННЖК, которые значительно увеличивают разнообразие путей синтеза ЖК и, соответственно, число участвующих в адаптации индивидуальных липидов (Betula nana, Stellaria humifusa, Silene acaulis и др.). Однако особенностью некоторых хорошо адаптированных к условиям Арктики видов является резкое ограничение числа индивидуальных липидов, например, Oxyria digyna, Salix polaris, Saxifraga cernua.
Таким образом, к особенностям липидной фракции видов высших сосудистых растений Арктики можно отнести: активное участие НЖК и/или ННЖК в жизнедеятельности растений в период активной вегетации, большое количество минорных ЖК, присутствие у большинства видов длинноцепочных как НЖК, так и ННЖК. У большинства исследованных видов отмечено доминирование триеновой – линоленовой ЖК, увеличение содержания которой связывается с высоким уровнем функциональной активности мембранных систем, что подтверждается и данными других авторов (Слепцов и др., 2017).
Работа выполнена в рамках проекта ПАБСИ КНЦ РАН “Растительно-почвенные ресурсы, совершенствование методов управления охраняемыми природными территориями в условиях климатических изменений и антропогенного воздействия и оптимизации среды обитания человека на архипелаге Шпицберген” (№ гос. регистрации АААА-А17-117121120045-5).
Список литературы
Василевская Н.В., 2007. Поливариантность онтогенетических процессов растений в условиях высоких широт. Мурманск: МГПУ. 231 с.
Волков И.В., 2006. Введение в экологию высокогорных растений. Томск: ТГПУ. 416 с.
Герман А.Г., 2009. “Вымерший климат” Арктики // Наука в России. № 1. С. 36–44.
Королева Н.Е., Константинова Н.А., Белкина О.А., Давыдов Д.А., Лихачев А.Ю. и др., 2008. Флора и растительность побережья залива Грен-фьорд (архипелаг Шпицберген). Апатиты: К&М. 132 с.
Коросов А.В., 2007. Специальные методы биометрии. Петрозаводск: ПетрГУ. 364 с.
Лось Д.А., 2014. Десатуразы жирных кислот. М.: Научный мир. 372 с.
Мавлюдов Б.Р., 2006. Состояние оледенения Шпицбергена в конце XX века // Мат-лы гляциол. исследований. Вып. 101. С. 146–152.
Марковская Е.Ф., Шмакова Н.Ю., 2017. Растения и лишайники Западного Шпицбергена: экология, физиология. Петрозаводск: ПетрГУ. 270 с.
Марковская Е.Ф., Галибина Н.А., Ильинова М.К., Никерова К.М., Шмакова Н.Ю., 2017. Состав липидов и функциональное состояние мембранных систем Stellaria humifusa // Тр. КарНЦ РАН. № 5. С. 99–110.
Нохсоров В.В., Дударева Л.В., Чепалов В.А., Софронова В.Е., Верхотуров В.В. и др., 2015. Свободные жирные кислоты и адаптация организмов к холодному климату Якутии // Вестн. БГСХА им. В.Р. Филиппова. Т. 38. № 1. С. 127–134.
Петров К.А., Перк А.А., Осипова В.В., 2011. Криорезистентность и формирование кормовой ценности растений Якутии. Якутск: Бичик. 197 с.
Розенцвет О.А., 2006. Липидный состав растений как показатель их адаптивных возможностей к различным экологическим условиям. Дисс. … докт. биол. наук. Тольятти: Ин-т экологии Волжского бассейна РАН. 436 с.
Розенцвет О.А., Нестеров В.Н., Богданова Е.С., 2016. Физиолого-биохимические аспекты экологии галофитов // Поволжский экол. журн. № 4. С. 434–444.
Секретарева Н.А., 2004. Сосудистые растения Российской Арктики и сопредельных территорий. М.: Т-во науч. изд. КМК. 131 с.
Семенов А.В., Анциферова А.Р., Давыдов А.А., 2002. Климат Баренцбурга. Изменения основных характеристик за последние 40 лет (по данным наблюдений зональной гидрометобсерватории “Баренцбург”) // Мат-лы II Междунар. конф. “Комплексные исследования природы Шпицбергена”. Вып. 2. Апатиты: Изд-во КНЦ РАН. С. 139–145.
Слепцов И.В., Хлебный Е.С., Журавская А.Н., 2017. Липиды, жирные кислоты и флавоноиды в листьях Amaranthus retroflexus произрастаюешлго в условиях центральной Якутии // Химия растит. сырья. № 3. С. 77–84.
Сысоева М.И., Марковская Е.Ф., 2008. Влияние круглосуточного освещения на процессы жизнедеятельности растений // Успехи соврем. биологии. Т. 128. № 6. С. 580–591.
Шитиков В.К., Розенберг Г.С., 2013. Рандомизация и бутстреп: статистический анализ в биологии и экологии с использованием R. Тольятти: Кассандра. 314 с.
Шуляковская Т.А., Ильинова М.К., Карелина Т.В., 2014. Липидный состав тканей ствола Betula pendula и B. pendula var. carelica (Betulaceae) // Растит. ресурсы. Т. 50. № 1. С. 94–104.
Юрцев Б.А., 1968. Флора Сунтар-Хаята: Проблемы истории высокогорных ландшафтов Северо-Востока Сибири. Л.: Наука. 235 с.
Alsos I.G., Eidesen P.B., Ehrich D., Skrede I., Westergaard K., et al., 2007. Frequent long-distance plant colonization in the changing Arctic // Science. V. 316. P. 1606–1609.
Bakht J., Bano A., Dominy P., 2006. The role of abscisic acid and low temperature in chickpea (Cicer arietinum) cold tolerance. II. Effect on plasma membrane structure and function // J. Exp. Bot. V. 57. P. 3707–3715.
Chernov Yu.I., Matveeva N.V., 1997. Arctic ecosystems in Russia // Ecosystems of the World 3: Polar and Alpine Tundra / Ed. Wielgolaski F.E. Amsterdam; N.-Y.: Elsevier. P. 361–507.
Demmig-Adams B., Adams W.W. III, 2006. Photoprotection in an ecological context: The remarkable complexity of thermal energy dissipation // New Phytol. V. 172. P. 11–21.
Furt F., Simon-Plas F., Mongrand S., 2011. Lipids of the plant plasma membrane // The Plant Plasma Membrane / Eds Murphy A.S., Peer W., Schulz B. Berlin; Heidelberg: Springer. P. 3–30.
Hashem H.A., Mohamed A.H., 2020. Strategies for drought tolerance in xerophytes // Plant Ecophysiology and Adaptation under Climate Change: Mechanisms and Perspectives I / Ed. Hasanuzzaman M. Singapore: Springer. P. 269–293.
Körner Ch., 2003. Alpine Plant Life: Functional Plant Ecology of High Mountain Ecosystems. Berlin; Heidelberg: Springer-Verlag. 360 p.
Levitt J., 1980. Responses of Plants to Environmental Stresses: Chilling, Freezing, and High Temperature Stresses. N.-Y.: Academic Press. 497 p.
Lichtenthaler H.K., Wellburn A.R., 1983. Determination of total carotenoids and chlorophylls a and b of leaf extracts in different solvents // Biochim. Soc. Trans. V. 11. P. 591−592.
Lütz C., 2010. Cell physiology of plants growing in cold environments // Protoplasma. V. 244. № 1–4. P. 53–73.
Markovskaya E.F., Novichonok E.V., Shmakova N.Y., 2019. Eco-physiological peculiarities of Stellaria humifusa in West Spitsbergen // Czech Polar Rep. V. 9. № 2. P. 152–159.
Murakami Y., Tsuyama M., Kobayashi Y., Kodama H., Iba K., 2000. Trienoic fatty acids and plant tolerance of high temperature // Science. V. 287. P. 476–479.
Murphy D.J., 2005. Plant Lipids: Biology, Utilization and Manipulation. Oxford: Blackwell Publishing. 403 p.
Narayanan S., Tamura P.J., Roth M.R., Prasad P.V.V., Welti R., 2016. Wheat leaf lipids during heat stress: I. High day and night temperatures result in major lipid alterations // Plant Cell Environ. V. 39. № 4. P. 787–803.
Nievola C.C., Carvalho C.P., Carvalho V., Rodrigues E., 2017. Rapid responses of plants to temperature changes // Temperature (Austin). V. 4. P. 371–405.
Nilsen J., 1983. Light climate in northern areas // Plant production in the North. Proceeding from Plant adaptation Workshop. Tromso: Norwegian Univ. Press. P. 62–72.
Parnikoza I., Kozeretska I., Kunakh V., 2011. Vascular plants of the maritime Antarctic: origin and adaptation // Am. J. Plant Sci. V. 2. P. 381–395.
Penfield S., 2008. Temperature perception and signal transduction in plant // New Phytol. V. 179. P. 615–628.
Petrov K.A., Sofronova V.E., Chepalov V.A., Perk A.A., Maksimov T.K., 2010. Seasonal changes in the content of photosynthetic pigments in perennial grasses of cryolithic zone // Russ. J. Plant Physiol. V. 57. № 2. P. 181–188.
R$\mathop {slasho}\limits^\prime $nning O.I., 1996. The Flora of Svalbard. Oslo: Norsk Polarinstitutt. 184 p.
Rozentsvet O.A., Nesterov V.N., Bogdanova E.S., 2014. Membrane-forming lipids of wild halophytes growing under the conditions of Prieltonie of South Russia // Phytochemistry. V. 105. P. 37–42.
Ruelland E., Zachowski A., 2010. How plants sense temperature // Environ. Exp. Bot. V. 69. P. 225–232.
Sakai A., Larcher W., 1987. Frost Survival of Plants: Responses and Adaptation to Freezing Stress. Berlin: Springer-Verlag. 321 p.
Schmid K.M., Ohlrogge J.B., 2002. Lipid metabolism in plants // Biochemistry of Lipids, Lipoproteins and Membranes / Eds Vance D.E., Vance J.E. Amsterdam: Elsevier. P. 93–126.
Słupianek A., Wojtuń B., Myśkow E., 2019. Origin, activity and environmental acclimation of stem secondary tissues of the polar willow (Salix polaris) in high-Arctic Spitsbergen // Polar Biol. V. 42. P. 759–770.
Svoboda J., 2009. Evolution of plant cold hardiness and its manifestation along the latitudinal gradient in the Canadian Arctic // Plant Cold Hardiness. From the Laboratory to the Field / Eds Gusta L.W., Wisniewski M.E., Tanino K.K. Cambridge: CABI. P. 140–162.
Svoboda J., Henry H.G.R., 1987. Succession in marginal arctic environments // Arc. Alp. Res. V. 4. P. 373–384.
Tsydendambaev V.D., Ivanova T.V., Khalilova L.A., Kurkova E.B., Myasoedov M.A., Balnokin Yu.V., 2013. Fatty acid composition of lipids in vegetative organs of the halophyte Suaeda altissima under different levels of salinity // Russ. J. Plant Physiol. V. 60. № 5. P. 661–671.
Wallis J.G., Browse J., 2002. Mutants of Arabidopsis reveal many roles for membrane lipids // Prog. Lipid Res. V. 41. P. 54–278.
Welti R., Li W., Li M., Sang Y., Biesiada H. et al., 2002. Profiling membrane lipids in plant stress responses. Role of phospholipase D alpha in freezing-induced lipid changes in Arabidopsis // J. Biol. Chem. V. 277. № 35. P. 31994–32002.
Zheng G., Tian B., Zhang F., Tao F., Li W., 2011. Plant adaptation to frequent alterations between high and low temperatures: remodeling of membrane lipids and maintenance of unsaturation levels // Plant Cell Environ. V. 34. № 9. P. 1431–1442.
Zhivet’ev M.A., Graskova I.A., Dudareva L.V., Stolbikova A.V., Voinikov V.K., 2010. Change of fatty-acid composition in plants during adaptation to hypothermia // J. Stress Physiol. Biochem. V. 6. P. 51–65.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


