Журнал общей биологии, 2022, T. 83, № 5, стр. 323-335
Фитопланктонные сообщества юго-восточной части Баренцева моря и юго-западной части Карского моря как индикаторы фитогеографического статуса регионов
П. Р. Макаревич 1, В. В. Ларионов 1, *, В. В. Водопьянова 1, Т. Г. Ишкулова 1
1 Мурманский морской биологический институт РАН
183010 Мурманск, Владимирская, 17, Россия
* E-mail: larionov@mmbi.info
Поступила в редакцию 24.05.2022
После доработки 20.07.2022
Принята к публикации 30.08.2022
- EDN: VINGAF
- DOI: 10.31857/S0044459622050050
Аннотация
В конце августа–первой половине сентября 2020 г. в юго-восточной части Баренцева моря и юго-западной части Карского моря проведены комплексные исследования фитопланктона одновременно с определением гидролого-гидрохимических характеристик. Таксономический список микроводорослей, обнаруженных на изученной акватории, включал 35 представителей, идентифицированных до вида. Из них 14 (40%) были встречены в обоих водоемах. В Печорском море средняя численность фитопланктона в столбе воды варьировала от 10.65 до 41.84 тыс. кл./л, биомасса – от 71.04 до 300.55 мкг/л; в юго-западной части Карского моря значения этих показателей составляли 3.51–28.42 тыс. кл./л и 16.31–66.96 мкг/л соответственно. При этом оба сообщества находились на осенней стадии сезонной сукцессии, по биомассе в них преобладали формы аркто-бореального происхождения, преимущественно океанические, а в списке доминантов равные доли составляли крупноклеточные центрические диатомовые и динофлагелляты. Виды, не достигавшие высоких величин обилия, отличались значительной мозаичностью пространственного распределения: они присутствовали на небольшом числе станций и не на всех горизонтах. Таким образом, результаты сравнительного анализа позволяют утверждать, что пелагические альгоценозы сравниваемых районов, несмотря на различие гидрологических параметров, характеризовались значительной степенью сходства. Описанная ситуация в целом подтверждает гипотезу о флористическом единстве юго-восточной части Баренцева моря и юго-западной части карскоморской пелагиали.
Биогеографические исследования морского фитопланктона имеют более чем вековую историю, однако до настоящего времени в данном направлении гидробиологии отсутствует единая методологическая концепция. И хотя очевидным признается утверждение, что водные массы Мирового океана представляют собой единство среды и обитающей в ней биоты, зачастую каждая область в пределах границ морских водоемов рассматривается как отдельная структура с присущей только ей пелагической альгофлорой. Данный подход, именуемый “биотопическим” (Моисеев, 1986), предполагает выделение по сходству каких-либо абиотических характеристик относительно однородных участков акватории, считающихся на этом основании фитогеографическими районами.
Существует и прямо противоположный взгляд на проведение флористических исследований: аналогичные районы выявляются путем сопоставления всех имеющихся в литературе таксономических списков микроводорослей (Околодков, 2000; Ильяш, Житина, 2009). Он выглядит более адекватным поставленной задаче, но на самом деле имеет тот же главный недостаток, что и вышеописанный биотопический – искусственное разделение среды и биоты. В итоге общее высокое видовое разнообразие и обширные ареалы большинства организмов приводят к не вполне корректным результатам. Это ярко проявляется в попытках выделения биогеографических районов в Арктическом бассейне. Практически все сообщества фитопланктона, населяющие круговороты Гренландского, Норвежского, Баренцева морей и юго-западной части Карского моря, в значительной степени происходят от одного источника, а именно от крупномасштабной Субарктической циркуляции, расположенной в Северной Атлантике к югу от Гренландии (Виноградова, Грузов, 1990). Принос богатой космополитной флоры из Северной Атлантики в Арктику создает высокий уровень таксономического сходства. И тогда, основываясь только на видовом составе, можно сделать парадоксальный вывод о том, что на всех перечисленных акваториях мы имеем дело с одним и тем же альгоценозом. Подобная точка зрения встречается в литературе (Guillard, Kilham, 1977; Heimdal, 1989); более того, существует даже концепция, рассматривающая весь Мировой океан как биотоп, а весь фитопланктон как сообщество (Williams et al., 1981) – правда, последний термин сами авторы отвергают, но суть от этого не меняется.
В сложившейся ситуации наиболее перспективным представляется сравнение альгофлоры близлежащих областей, географически принадлежащих к различным водоемам. Удачным примером таковых являются юго-восточная часть Баренцева моря (ЮВБМ) и юго-западная часть Карского моря (ЮЗКМ). Вопрос о единстве их биогеографического статуса уже рассматривался ранее (Druzhkov, Makarevich, 1999). Основания для такого предположения давали оба вышеописанных подхода: данные районы характеризуются высоким сходством гидрологического и ледового режимов, а также видовых списков микроводорослей (Grönlund et al., 1994, 1995, 1997; Матишов и др., 1996; Druzhkov et al., 1997). Важное значение имеет и низкая степень межгодовой изменчивости как абиотических параметров среды, так и биологических показателей (Loeng, 1989; Изменчивость …, 2004; Ларионов, 2016; Суханова и др., 2017).
Однако, чтобы избежать указанных выше недостатков, при проведении такого сравнения должны быть соблюдены по крайней мере два условия. Во-первых, использование методических приемов наземной фитоценологии. В исследованиях материковых природных сообществ выделение таковых производится на основе сравнения не всего видового состава организмов, а групп доминантов, в первую очередь видов-эдификаторов, которыми практически всегда являются цветковые растения. В пелагических же экосистемах в роли таковых выступают именно представители доминирующих групп фитопланктона. Являясь основными первичными продуцентами органического вещества, они определяют общую продуктивность акватории, вызывают “цветение” морской воды, а также вследствие различного метаболизма оказывают влияние на большинство гидрохимических параметров. В конечном счете они оказываются средообразующим фактором для остальных компонентов биоценоза, формируя систему консортивных связей и в значительной мере всю структуру экосистемы (Хайлов и др., 2005).
Во-вторых, необходим правильный выбор сезона проведения исследований. Описанное таксономическое сходство арктических альгоценозов является характерной особенностью зимней стадии развития с преобладанием представителей криофлоры и весенней стадии, когда максимум биомассы создается фактически одним набором видов диатомовых ледово-неритического комплекса (Макаревич, Дружкова, 2007). Поэтому для достоверного сравнения состава микроводорослей наблюдения должны выполняться в завершающую фазу годового сукцессионного цикла – в позднелетний и осенний сезоны (Wang et al., 2018).
Целью нашей работы являлась проверка возможного единства фитогеографического статуса двух географически разных акваторий (юго-восточная часть Баренцева моря и юго-западная часть Карского моря) на основе сравнительного анализа фитопланктонных сообществ данных районов в конце вегетационного периода.
МАТЕРИАЛЫ И МЕТОДЫ
Наблюдения проводились в юго-восточной части Баренцева моря и юго-западной части Карского моря (рис. 1) в конце августа–первой половине сентября 2020 г. в ходе рейса НИС “Дальние Зеленцы” (Рейсовый отчет…, 2021).
Температуру и соленость водных масс устанавливали с помощью СТД-зонда SBE 19plus. Пробы воды на фитопланктон, а также содержание хлорофилла a и биогенных элементов отбирали из одних и тех же 10-литровых батометров Нискина комплекса ROSETTE HydroBios MWS-12 сразу после проведения гидрологического зондирования. Отбор был выполнен на шести станциях в Печорском море и восьми станциях в Карском море с поверхностного, промежуточного и придонного горизонтов.
Обработку полученного материала осуществляли по стандартным гидробиологическим методикам: пробы фитопланктона объемом 1–2 л концентрировали с помощью метода обратной фильтрации до конечного объема 4–5 мл и фиксировали 40%-ным раствором формальдегида (конечная концентрация составляла 2–4%) для последующего микроскопирования (Суханова, 1983). Таксономическую идентификацию организмов и подсчет клеток производили под световым микроскопом “Ампливаль” (при увеличении ×400) в счетной камере Нажотта объемом 0.05 мл по стандартной методической схеме (Федоров, 1979). Названия видов и систематических групп приведены согласно номенклатуре, принятой в электронных источниках: AlgaeBase (https://www.algaebase.org/), WoRMS (http://www.marinespecies.org). Биомассу вычисляли с помощью таблиц средних клеточных объемов микроводорослей (Makarevich et al., 1993).
Фильтрацию проб морской воды на содержание пигментов (объем 3–5 л) осуществляли в судовой лаборатории на вакуумной фильтровальной установке (насос производства фирмы GAST, США). Использовали мембранные фильтры с диаметром рабочей поверхности 47 мм и размером пор 0.6 мкм. Концентрацию хлорофилла а определяли спектрофотометрическим методом (Вода, 2001). Изучение экстракта осуществляли на UV-Visible спектрофотометре Nicolett Evolution 500 (“Spectronic Unicam”, Великобритания).
Параллельно проводили гидрохимические исследования: осуществляли оценку содержания в воде растворенного кислорода и минеральных форм основных биогенных элементов. Концентрацию кислорода определяли методом Винклера, измерение нитритов, нитратов, фосфатов и силикатов выполняли на фотоколориметре ПЭ-5300ВИ. Неорганический растворенный фосфор (Р-${\text{PO}}_{4}^{{3 - }}$) определяли по методу Морфи-Райли, растворенный кремний (Si-${\text{SiO}}_{3}^{{2 - }}$) – методом Королева, нитритный (N-${\text{NO}}_{2}^{ - }$) и нитратный азот (N-${\text{NO}}_{3}^{ - }$) – методом Бендшнайдера и Робинсона (Руководство…, 1993).
РЕЗУЛЬТАТЫ
Гидролого-гидрохимические параметры
Распределение основных гидрологических показателей в плоскости разрезов исследованных районов изображено на рис. 2 и 3. Юго-западная часть Карского моря характеризовалась четко выраженным пикноклином, располагавшимся на глубине 10–15 м в устьевой области Байдарацкой губы (станции 4 и 6) и на глубине 25–30 м на остальной акватории водоема. Общий размах колебаний температуры составлял от –1.51 до +11.39°C, солености – 29.08–34.38 psu; в верхнем перемешанном слое минимальные значения достигали +8.85°C, солености – 32.87 psu. На всех станциях, кроме 4-й и 6-й, обнаруживался слой воды с отрицательной температурой и несколько пониженной соленостью в интервале глубин от 35 до 60 м. Он образован собственно карскоморской водной массой, формирующейся в зимний период в результате конвективного перемешивания (Фомин, Петров, 1985; Зацепин и др., 2010). Ниже располагаются более теплые и соленые воды, скорее всего, баренцевоморского происхождения (Зацепин и др., 2010).
Рис. 2.
Распределение температуры (°C) в плоскостях условных разрезов в исследованных районах Печорского моря (а) и юго-западной части Карского моря (б).
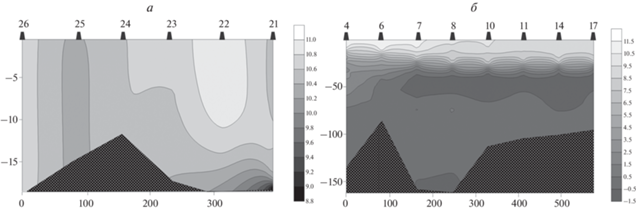
Рис. 3.
Распределение солености (psu) в плоскостях условных разрезов в исследованных районах Печорского моря (а) и юго-западной части Карского моря (б).
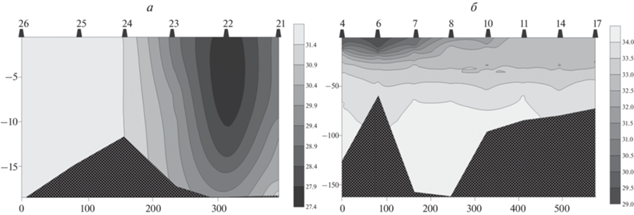
В Печорском море вследствие малых глубин распределение температуры и солености было практически однородным, а диапазон изменчивости их величин составлял 8.81–10.94°C и 27.52–31.56 psu соответственно. При этом минимальные значения температуры и максимальные – солености были зарегистрированы только в придонном горизонте на станции 21, расположенной на восточном краю разреза, где проявляется очень слабое влияние трансформированных атлантических вод (Бышев и др., 2003).
Характерной чертой распределения гидрохимических показателей в водах юго-западной части Карского моря было наличие значительного вертикального градиента величин с промежуточным минимумом в слое пикноклина и максимумом у дна (табл. 1). Концентрация кремния в поверхностном слое варьировала от 0.70 до 1.91 мкг-ат/л, его наибольшее содержание отмечалось на станции 8, самой глубоководной на данном участке. Остальные изученные биогенные элементы отличались низкими значениями в нулевом горизонте и падением их в слое скачка плотности до аналитического нуля, что может быть следствием только фотосинтетической активности автотрофной биоты. Нитратный азот был лимитирующим фактором для фитопланктона – при нулевом уровне нитратов имелся некоторый избыток фосфатов и силикатов, а соотношение N/Si в среднем не превышало 1.0. Минимальная величина последней характеристики (0.04) была зарегистрирована в поверхностном слое на станции 10 (при невысоком уровне силикатов: 0.89 мкг-ат/л).
Таблица 1.
Величины концентраций биогенных элементов (мкг-ат/л) на исследованной акватории
| Горизонт | P-PO4 | N-NO2 | N-NO3 | Si-SiO2 |
|---|---|---|---|---|
| Юго-западная часть Карского моря | ||||
| Поверхность | $\frac{{0.09 \pm 0.03}}{{0.02{\kern 1pt} --{\kern 1pt} 0.30}}$ | $\frac{{0.014 \pm 0.008}}{{0{\kern 1pt} --{\kern 1pt} 0.062}}$ | $\frac{{0.17 \pm 0.09}}{{0{\kern 1pt} --{\kern 1pt} 0.72}}$ | $\frac{{1.62 \pm 0.34}}{{0.70{\kern 1pt} --{\kern 1pt} 1.91}}$ |
| Дно | $\frac{{0.70 \pm 0.14}}{{0.20{\kern 1pt} --{\kern 1pt} 1.29}}$ | $\frac{{0.055 \pm 0.022}}{{0{\kern 1pt} --{\kern 1pt} 0.157}}$ | $\frac{{6.23{\text{ }} \pm {\text{ }}1.66}}{{0.85--15.45}}$ | $\frac{{7.64 \pm 2.25}}{{1.75{\kern 1pt} --{\kern 1pt} 19.04}}$ |
| Печорское море | ||||
| Поверхность | $\frac{{0.15 \pm 0.04}}{{0.02{\kern 1pt} --{\kern 1pt} 0.25}}$ | $\frac{{0.015 \pm 0.007}}{{0{\kern 1pt} --{\kern 1pt} 0.040}}$ | $\frac{{0.11 \pm 0.07}}{{0{\kern 1pt} --{\kern 1pt} 0.42}}$ | $\frac{{3.84 \pm 1.03}}{{0.65{\kern 1pt} --{\kern 1pt} 6.85}}$ |
| Дно | $\frac{{0.14 \pm 0.02}}{{0.07{\kern 1pt} --{\kern 1pt} 0.18}}$ | $\frac{{0.005 \pm 0.003}}{{0{\kern 1pt} --{\kern 1pt} 0.013}}$ | $\frac{{0.11 \pm 0.04}}{{0{\kern 1pt} --{\kern 1pt} 0.18}}$ | $\frac{{3.76 \pm 0.85}}{{1.73{\kern 1pt} --{\kern 1pt} 6.41}}$ |
Также в распределении биогенов на данном участке акватории выявлялась некоторая мозаичность: в нулевом горизонте на станциях 7 и 8 выделялась область низких концентраций одновременно и фосфатов, и нитратов, а на станции 6, напротив, их содержание было наибольшим. При этом соотношение Si/P на первых двух станциях в среднем составляло 51.8, а на последней – 9.5: такая ситуация четко свидетельствует о локализации на этих участках различных водных масс (Хмельницкая, 2011).
В Печорском море гидрохимические показатели характеризовались невысокими значениями и однородностью пространственного распределения (табл. 1).
Максимальные концентрации были выявлены на востоке района (станции 22, 23), в зоне распространения пресного стока. Наиболее значимые корреляционные зависимости обнаруживались в парах “соленость–фосфаты” (r = –0.79, R2 = 0.62) и “соленость–силикаты” (r = –0.71, R2 = 0.52). Соотношение N/P в среднем невысокое (0.6), что указывает на дефицит по биогенным элементам (Ильин и др., 1985). На станциях 25 и 26 на поверхности и у дна были выявлены нулевые значения нитритов и нитратов при наиболее низком для горизонта содержании кремния (1.73 мкг-ат/л – дно, 0.65 мкг-ат/л – 0 м).
Концентрация хлорофилла а в поверхностном слое карскоморской акватории не превышала 0.45 мг/м3 (среднее 0.22 ± 0.15 мг/м3), в зоне пикноклина диапазон значений данного показателя составил от 0.15 до 0.41 мг/м3, при этом на некоторых станциях они оказались ниже чувствительности применяемого метода; в придонном горизонте аналогичная ситуация наблюдалась на большинстве станций (табл. 2). В Печорском море, в связи с малыми глубинами, наблюдалась почти полная однородность в распределении пигмента по всей водной толще. В поверхностном слое содержание хлорофилла а в среднем составляло 0.92 ± 0.29 мг/м3, в слое скачка плотности – 1.15 ± 0.46 мг/м3, в придонном горизонте – 0.99 ± 0.22 мг/м3. Невысокое среднее содержание пигмента в фотическом слое (в ЮЗКМ – 0.24 ± ± 0.13 мг/м3; в ЮВБМ – 1.02 ± 0.33 мг/м3) и доля феофитина > 50% в обоих водоемах характеризуют позднелетнюю и осеннюю стадии сезонной сукцессии пелагических альгоценозов.
Таблица 2.
Значения концентраций хлорофилла а (мг/м3) на исследованной акватории
| Номер станции | Поверхностный горизонт | Слой скачка | Придонный горизонт |
|---|---|---|---|
| Юго-западная часть Карского моря | |||
| 4 | 0.45 | 0.20 | 0.07 |
| 6 | 0.09 | 0.40 | –* |
| 7 | 0.08 | –* | –* |
| 8 | 0.28 | 0.21 | –* |
| 10 | 0.11 | 0.15 | –* |
| 11 | 0.11 | –* | –* |
| 14 | –* | 0.20 | 0.09 |
| 17 | 0.41 | 0.41 | 0.12 |
| Печорское море | |||
| 21 | 1.48 | 0.99 | 1.04 |
| 22 | 0.66 | 0.64 | 0.58 |
| 23 | 0.79 | 1.10 | 1.01 |
| 24 | 1.33 | 0.95 | 1.03 |
| 25 | 0.60 | 2.02 | 1.05 |
| 26 | 0.81 | 1.22 | 0.68 |
Качественные и количественные показатели развития фитопланктона
Полный таксономический список микроводорослей, обнаруженных на изученной акватории, приведен в табл. 3. В него включены 35 организмов, определенных до вида, а также не идентифицированные представители нескольких родов и крупных таксонов различного ранга. По систематическому положению 15 видов относятся к классу Bacillariophyceae, 16 – к классу Dinophyceae; остальные 4 – к классам Ebriophyceae (Ebria tripartita), Dictyochophyceae (Octactis speculum), Prasinophyceae (Polyasterias problematica), Pyramimonadophyceae (Halosphaera viridis). По фитогеографической принадлежности 10 видов имеют аркто-бореальное происхождение, 9 – бореальное, 16 – космополиты. В экологическом плане 21 вид характеризовался как неритический, 7 – океанические, 7 – панталассные.
Таблица 3.
Общий таксономический список представителей фитопланктонных сообществ на исследованной акватории: на светло-сером фоне – виды, обнаруженные только в ЮЗКМ; на темно-сером – только в ЮВБМ
| Таксон | |
|---|---|
| Класс Bacillariophyceae | Класс Dinophyceae |
| Asteroplanus karianus (Grun.) C. Gardner et R.M. Crawford, 1997 | Dinophysis arctica Mereschk., 1879 |
| D. norvegica Clap. et Lachm., 1859 | |
| Cerataulina pelagica (Cl.) Hendey, 1937 | Gonyaulax sp. |
| Chaetoceros borealis Bailey, 1854 | Gyrodinium fusiforme Kof. et Sw., 1921 |
| C. curvisetus Cl., 1889 | G. lachryma (Meunier) Kof. et Sw., 1921 |
| C. decipiens Cl., 1873 | Heterocapsa triquetra (Ehr.) Stein, 1883 |
| C. laciniosus F. Schütt, 1895 | Phalacroma rotundatum (Clap. et Lachm.) Kof. et Michener, 1911 |
| Chaetoceros sp. | |
| Ceratoneis closterium Ehr., 1839 | Protoperidinium brevipes (Pauls.) Balech, 1974 |
| Leptocylindrus danicus Cl., 1889 | P. cerasus (Pauls.) Balech, 1973 |
| L. minimus Gran, 1915 | P. pallidum (Ostf.) Balech, 1973 |
| Melosira sp. | P. pellucidum Bergh, 1881 |
| Odontella granulata (Roper) R. Ross, 1986 | Scrippsiella trochoidea (Stein) Loeblich III, 1976 |
| Paralia sulcata (Ehr.) Cl., 1873 | Tripos arcticus (Vanh.) F. Gómez, 2013 |
| Rhizosolenia hebetata Bailey, 1856 | T. fusus (Ehr.) F. Gómez, 2013 |
| Skeletonema costatum (Grev.) Cl., 1873 | T. horridus (Cl.) F. Gómez, 2013 |
| Thalassionema nitzschioides (Grun.) Mereschk., 1902 | T. lineatus (Ehr.) F. Gómez, 2013 |
| T. longipes (J.W. Bailey) F. Gómez, 2013 | |
| Thalassiosira decipiens (Grun.) Jørg, 1905 | Не идентифицированные флагелляты |
| Не идентифицированные диатомовые | Класс Dictyochophyceae |
| Класс Pyramimonadophyceae | Octactis speculum (Ehr.) F.H. Chang, J.M. Grieve & J.E. Sutherland, 2017 |
| Halosphaera viridis F. Schmitz, 1878 | |
| Класс Ebriophyceae | Класс Prasinophyceae |
| Ebria tripartita (J. Schumann) Lemm., 1899 | Polyasterias problematica (Cl.) Meunier, 1910 |
| Класс Euglenoidea | Класс Cyanophyceae |
| Не идентифицированные формы | Не идентифицированные формы |
Закономерный вопрос может вызвать отсутствие в данном списке кокколитофорид (мелких жгутиковых из класса Prymnesiophyceae). Эта группа в течение последних двадцати лет особенно привлекает внимание исследователей, поскольку регулярно образует мощные цветения в баренцевоморском бассейне в летний период, что обычно объясняется усилением притока атлантических вод (Сергеева и др., 2020; Паутова, 2021). Нами эти организмы обнаружены не были, скорее всего, по методическим причинам. При фиксации формалином кокколитофориды очень быстро теряют известковые пластинки, и их достоверная идентификация становится невозможной. Однако сами клетки не разрушаются, и потому учитываются с прочими жгутиковыми как “не идентифицированные флагелляты”. И здесь необходимо отметить, что данная группа ни в одном из водоемов ни на одной станции не составляла значимой доли в общей численности микроводорослей, а следовательно, кокколитофориды, по крайней мере в осенний сезон, не играют существенной роли в альгоценозах изучаемых районов. Этот факт вполне объясняется тем, что и в ЮЗКМ, и в ЮБВМ влияние атлантических вод крайне слабое (Никифоров и др., 2003; Зацепин и др., 2010), и даже за последние десятилетия не наблюдается ощутимых изменений ни в ледовом режиме, ни в гидрологической обстановке, ни в таксономическом составе фитопланктона (Паутова, 2003, 2021; Изменчивость …, 2004; Суханова и др., 2011; Ларионов, 2016).
При этом сравнение двух участков района исследований выявило следующие особенности. Среди микроводорослей, встреченных на всей акватории (практически у каждого из них количественные показатели были очень близки в обеих рассматриваемых областях), обнаружено 5 видов диатомовых, 8 динофитовых и один представитель класса Ebriophyceae (Ebria tripartita). Аркто-бореальное происхождение имели 5 форм, бореальное – 1, космополитическое – 8. По экологической характеристике отмечено 9 неритических видов, 3 океанических, 2 панталассных.
В числе организмов, зарегистрированных только в юго-западной части Карского моря, равные доли (по 6 видов) составляли диатомеи и динофлагелляты, а также присутствовали представители остальных систематических групп: Octactis speculum, Polyasterias problematica, Halosphaera viridis. Фитогеографическая структура данного альгоценоза включала 4 аркто-бореальных вида, 3 бореальных и 8 космополитов; экологическая – 7 неритических форм и по 4 – океанических и панталассных. В Печорском море среди видов, обнаруженных только в этом водоеме, было 4 представителя диатомовых и 2 – динофитовых; 5 форм имели бореальное происхождение, 1 – аркто-бореальное; 5 видов относились к неритическим, 1 – к панталассным.
Описанные показатели свидетельствуют, что в целом сообщества пелагических микроводорослей изученной части арктического бассейна характеризовались полным преобладанием представителей двух классов – Bacillariophyceae и Dinophyceae – примерно в равном соотношении. При этом были зарегистрированы организмы всех трех свойственных данному региону фитогеографических и трех основных экологических групп, за исключением пресноводных и достоверно идентифицированных форм микрофитобентоса. Наибольшую долю в альгоценозах составляли космополиты, которые, однако, отсутствовали среди видов, встреченных только в Печорском море. На всей исследованной акватории преобладали представители неритической альгофлоры, значительно меньшую роль играли панталассные и океанические формы (на печороморском участке организмы последней группы вообще не отмечены). Все перечисленные особенности в целом можно считать типичными для арктических пелагических экосистем северных морей. Ни в таксономической, ни в фитогеографической, ни в экологической структурах не выявлено значимых различий между альгоценозами баренцевоморской и карскоморской пелагиали. Список видов, обнаруженных только в Печорском море, более беден, но это может быть обусловлено тем, что наблюдения проводились лишь в одном, довольно узком, прибрежном районе водоема (Ларионов, 2016).
Несколько иную картину мы видим при рассмотрении пространственного распределения доминирующих форм микроводорослей. Среди таковых по численности выделяются в первую очередь мелкие не идентифицированные представители диатомовых, динофитовых и эвгленовых водорослей, достигающие высоких концентраций на всей исследованной акватории. Кроме них, на баренцевоморском участке значительную долю составляют диатомеи Thalassiosira decipiens, Thalassionema nitzschioides и Paralia sulcata. В карскоморских водах уровень их обилия намного ниже, а первый вид вообще отсутствует. По биомассе лидирующее положение занимают следующие организмы: на всей исследованной акватории – Chaetoceros borealis, Tripos longipes; встречающиеся в обеих областях, но преобладающие по данному показателю лишь в Карском море – Dinophysis norvegica, Scrippsiella trochoidea; только в Печорском море – Paralia sulcata, Thalassionema nitzschioides, Tripos fusus. Также в число доминантов входят зарегистрированные лишь в карскоморских водах Leptocylindrus danicus, Tripos arcticus, Gonyaulax sp., Gyrodinium lachryma, Protoperidinium brevipes, Halosphaera viridis; только в баренцевоморских водах – Thalassiosira decipiens, Tripos horridus. Таким образом, прослеживаются достаточно выраженные различия между рассматриваемыми альгоценозами: основная часть биомассы микроводорослей образована разными их представителями, в том числе развивающимися в каком-либо одном из водоемов. Кроме того, если в сообществе Карского моря нет форм, заметно преобладающих по численности, а среди видов, обнаруженных только на данном участке, наблюдается большое количество лидеров по биомассе, то в Печорском море имеет место обратная ситуация.
В то же время обращает на себя внимание ярко проявляющаяся черта пространственного распределения, характерная для всех без исключения идентифицированных организмов фитопланктона: ни один из них не был отмечен на всех станциях исследованного бассейна. Даже формы, безусловно доминирующие по численности или биомассе, достигали значительных средних значений этих показателей за счет очень высоких концентраций лишь на небольших участках водоемов, часто на двух–трех станциях, тогда как на остальной акватории их уровни обилия были минимальными или нулевыми. Однако комплексы видов, встречающихся только в одной из двух сравниваемых областей, в данном отношении отличаются. В юго-западной части Карского моря также нет представителей альгоценоза, которые бы присутствовали на каждой станции, тогда как в Печорском море эта особенность не носит абсолютного характера: все доминанты регистрировались на всей исследованной акватории водоема.
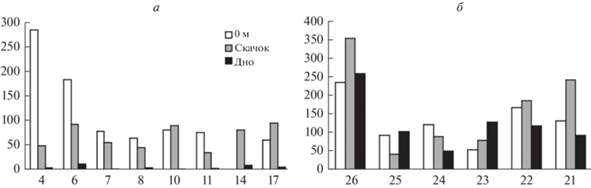
Что касается общих количественных показателей развития фитопланктона, в них также обнаруживаются отличия между сообществами изученных участков Печорского и Карского морей (табл. 4, рис. 4, 5). В целом по акватории размах колебаний величин обеих характеристик был невелик, за исключением альгоценозов на станциях 4 и 6, расположенных в устьевой области Байдарацкой губы. При этом если по численности там полностью преобладают диатомеи Skeletonema costatum и в меньшей степени Leptocylindrus danicus и L. minimus (только на станции 4, на станции 6 оба вида отсутствуют), то по биомассе лидирует динофлагеллята Tripos longipes, а второстепенную роль играют динофитовые Gonyaulax sp. и Dinophysis norvegica и диатомовые Chaetoceros borealis, L. danicus (на станции 4) и Rhizosolenia hebetata (встреченная лишь на этих двух станциях и только в нулевом горизонте). Таким образом, имеет место еще одно проявление мозаичности пространственного распределения микроводорослей.
Таблица 4.
Значения общей численности (тыс. кл./л, числа над чертой) и биомассы (мкг/л, числа под чертой) фитопланктона на исследованной акватории
| Станция | Горизонт | Среднее в столбе воды | ||
|---|---|---|---|---|
| поверхность | пикноклин | придонный | ||
| Юго-западная часть Карского моря | ||||
| 4 | $\frac{{117.80}}{{285.44}}$ | $\frac{{18.90}}{{48.23}}$ | $\frac{{4.17}}{{4.06}}$ | $\frac{{28.42}}{{66.96}}$ |
| 6 | $\frac{{34.80}}{{184.12}}$ | $\frac{{33.17}}{{92.95}}$ | $\frac{{5.47}}{{11.71}}$ | $\frac{{16.39}}{{51.95}}$ |
| 7 | $\frac{{9.98}}{{77.90}}$ | $\frac{{6.92}}{{54.88}}$ | $\frac{{0.84}}{{1.20}}$ | $\frac{{8.24}}{{60.49}}$ |
| 8 | $\frac{{8.37}}{{64.16}}$ | $\frac{{3.96}}{{44.24}}$ | $\frac{{2.45}}{{3.32}}$ | $\frac{{5.44}}{{41.27}}$ |
| 10 | $\frac{{9.04}}{{81.34}}$ | $\frac{{11.20}}{{89.71}}$ | $\frac{{0.94}}{{1.36}}$ | $\frac{{4.18}}{{32.19}}$ |
| 11 | $\frac{{9.25}}{{76.13}}$ | $\frac{{9.24}}{{34.35}}$ | $\frac{{1.56}}{{2.58}}$ | $\frac{{3.51}}{{16.31}}$ |
| 14 | $\frac{{0.00}}{{0.00}}$ | $\frac{{5.36}}{{80.91}}$ | $\frac{{2.32}}{{8.88}}$ | $\frac{{4.85}}{{60.24}}$ |
| 17 | $\frac{{10.75}}{{60.60}}$ | $\frac{{8.51}}{{95.58}}$ | $\frac{{2.18}}{{4.24}}$ | $\frac{{4.79}}{{41.96}}$ |
| Печорское море | ||||
| 26 | $\frac{{28.73}}{{235.77}}$ | $\frac{{40.15}}{{353.27}}$ | $\frac{{28.05}}{{259.91}}$ | $\frac{{34.27}}{{300.55}}$ |
| 25 | $\frac{{12.41}}{{93.94}}$ | $\frac{{7.96}}{{43.20}}$ | $\frac{{14.27}}{{103.80}}$ | $\frac{{10.65}}{{71.04}}$ |
| 24 | $\frac{{14.03}}{{122.97}}$ | $\frac{{12.67}}{{90.75}}$ | $\frac{{7.92}}{{51.11}}$ | $\frac{{12.09}}{{92.07}}$ |
| 23 | $\frac{{46.40}}{{54.91}}$ | $\frac{{40.05}}{{79.85}}$ | $\frac{{40.84}}{{128.65}}$ | $\frac{{41.84}}{{85.81}}$ |
| 22 | $\frac{{27.22}}{{168.65}}$ | $\frac{{25.86}}{{186.39}}$ | $\frac{{18.89}}{{118.56}}$ | $\frac{{24.87}}{{167.50}}$ |
| 21 | $\frac{{27.37}}{{133.24}}$ | $\frac{{33.77}}{{242.54}}$ | $\frac{{11.69}}{{93.03}}$ | $\frac{{27.43}}{{179.85}}$ |
Рис. 4.
Численность фитопланктона (тыс. кл./л) на исследованных горизонтах станций, расположенных в юго-западной части Карского моря (а) и в Печорском море (б).
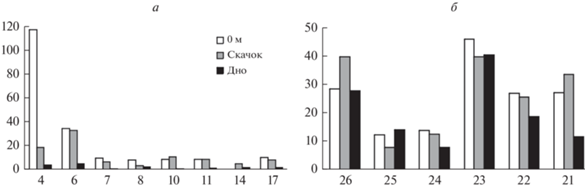
Рис. 5.
Биомасса фитопланктона (мкг/л) на исследованных горизонтах станций, расположенных в юго-западной части Карского моря (а) и в Печорском море (б).
Сравнение общих значений количественных показателей развития фитопланктона двух рассматриваемых участков выявило (без учета сообщества на станции 4) более высокий уровень обоих в Печорском море – в среднем примерно в 2 раза. Для этого же района был отмечен и больший их разброс между точками наблюдений.
В вертикальной структуре пелагических альгоценозов заметных различий между станциями и водоемами не обнаруживается (опять-таки за исключением станции 4). В баренцевоморской области ее можно считать однородной во всем столбе воды. Карскоморский участок характеризовался очень сходными величинами обилия организмов в поверхностном слое и на глубине скачка плотности и значительно более низкими в придонном горизонте. Последний факт вполне объясним различиями рельефа: исследованный район юго-западной части Карского моря характеризовался глубинами порядка 100 м и более, тогда как в мелководном Печорском море их значения находились в диапазоне 12–22 м.
ОБСУЖДЕНИЕ
Известно, что приток атлантических вод оказывает значительное влияние на гидрометеорологические режимы юго-восточной части Баренцева моря (Grönlund et al., 1995, 1997; Матишов и др., 1996) и юго-западного участка акватории Карского моря (Степанов, 1979). Рассматриваемый регион характеризуется сложной динамикой течений, образованной тремя основными циркуляциями. Первая – циклонический (против часовой стрелки) круговорот Печорского моря, особенно явно проявляющийся в весенне-летний период (Grönlund et al., 1995, 1997; Архипов, Попов, 1996; Матишов и др., 1996); вторая – циркуляция по часовой стрелке, огибающая побережье арх. Новая Земля (Бацких, Денисов, 1995); третья – циклонический круговорот, занимающий всю юго-западную часть Карского моря (Степанов, 1985). Итогом становится стабильная разнообразная сеть водообмена между Печорским и Карским морями, осуществляющегося через проливы Карские ворота и Югорский Шар. Между этими двумя бассейнами существует и интенсивный обмен льдом, но он носит сезонный характер (Loeng, 1991). Есть все основания предполагать, что имеет место и дрейф организмов, вследствие которого (учитывая, что перенос воды с запада на восток оказывается преобладающим) именно фитопланктон Печорского моря играет решающую роль в формировании пелагической альгофлоры всей новоземельской фитогеографической провинции (Druzhkov, Makarevich, 1999).
Анализ результатов исследований прошлых лет, проводившихся в указанных районах, в целом подтверждает данную гипотезу. Он показывает, что сообщества планктонных микроводорослей юго-восточной части Баренцева моря и юго-западной части Карского моря сформированы в основном аркто-бореальными неритическими видами с высокой долей космополитов. При этом преобладание аркто-бореальных форм в пелагиали – характерная черта не только Баренцева и Карского морей, но и других окраинных бассейнов Арктики. Более того, на всех этих акваториях наблюдается большое сходство в составе доминирующего комплекса организмов (Guillard, Kilham, 1977; Heimdal, 1989; Дружков, Макаревич, 1996). Остальные экологические и фитогеографические группы не занимают в экосистемах данных областей лидирующего положения. Присутствие в них бореальных (тепловодных) элементов можно объяснить влиянием трансформированных атлантических вод. Вклад криофильной флоры – преимущественно пеннатных диатомей – в сообщества ЮВБМ и ЮЗКМ незначителен, а в летний период с открытой водой минимален, так как ледяной покров здесь носит сезонный характер (Степанов, 1985). Основные различия таксономического состава пелагических альгоценозов этих районов обнаруживаются среди микрофитобентосных и пресноводных форм, но таковые являются аллохтонными и нехарактерными для них компонентами, а потому их учетом можно пренебречь.
Наши наблюдения, охватывающие зимний и весенний периоды, начиная с 80-ых годов 20-го столетия (Макаревич, 1998; Макаревич, Дружкова, 2010), также свидетельствуют о сходстве сообществ в данных водоемах. Сроки начала вегетации и набор доминирующих форм в Печорском море и юго-западной части Карского морей очень близки, отличия состоят лишь в наличии единичных специфических таксонов для отдельных участков и в небольших отклонениях календарных дат наступления максимума цветения фитопланктона.
Однако все рассмотренные материалы имеют один существенный недостаток: они практически не затрагивают летнюю и осеннюю фазы годового сукцессионного цикла развития альгоценозов. По сути, заключение об однотипности их состава в данных областях базируется главным образом на сравнении комплексов видов, формирующих пик весеннего цветения. Такой подход может быть оправдан тем, что именно эти представители абсолютно преобладают в пелагиали по численности и/или по биомассе. И он в конечном итоге приводит к закономерному выводу о единообразии одноклеточной альгофлоры всех северных морей, называемой панарктической (Guillard, Kilham, 1977) или ледово-неритической (Виноградова, Грузов, 1990). Более того, даже в тех исследованиях, в которых фигурирует полный список организмов, используется тот же самый прием: формы, свойственные летне-осеннему периоду, игнорируются, поскольку не образуют уровней обилия, сравнимых с весенними, и характеризуются мозаичностью пространственного распределения, встречаясь не на всей площади водоема и лишь на отдельных участках достигая высоких концентраций. Но не следует забывать, что подобная картина вообще является типичной для морских фитопланктонных сообществ, находящихся в фазе смешанного синтеза годового продукционного цикла (Makarevich et al., 2012). Виды, лидирующие по количественным показателям на данной стадии, пусть даже в течение короткого времени и на ограниченной акватории, тем не менее должны быть признаны доминантами и в этом качестве включены в сравнительный флористический анализ.
В этом плане результаты работ, изложенные в настоящей статье, представляют особую ценность, поскольку дают возможность заполнить указанный пробел и внести необходимые коррективы в определение биогеографического статуса изучаемых районов. В предыдущем разделе четко показаны значительные отличия вод ЮВБМ и ЮЗКМ по гидролого-гидрохимическим параметрам. Причины этого очевидны: разница глубин и динамики течений. Следствием же, в свою очередь, оказываются различия абсолютных величин численности и биомассы микроводорослей. На таком фоне выявленные черты сходства сравниваемых сообществ, несомненно, будут свидетельствовать об их близости.
Одной из таковых, безусловно, должна считаться характеристика сезонного состояния фитопланктона. Пелагические альгоценозы обоих водоемов по всем признакам находились в конце летней–начале осенней стадии сукцессии. Термохалинная структура водной толщи полностью соответствовала данной фазе годового гидрологического цикла, достаточно хорошо изученной и в Печорском море (Никифоров и др., 2003), и на рассматриваемом участке карскоморской акватории (Зацепин и др., 2010). Средние и предельные значения концентраций биогенных элементов были типичными для указанного сезона и не обнаруживали заметных отличий от описанных в данный период времени в различные годы исследований как для баренцевоморского бассейна (Позднякова, Виноградов, 1966; Маккавеев и др., 2003; Сергеева и др., 2018), так и для карскоморского (Широколобов, 1982; Маккавеев, Стунжас, 1994; Маккавеев и др., 2010; Морозова и др., 2013). Уровни содержания хлорофилла а и структура его пространственного распределения также практически совпадают с таковыми, опубликованными в литературных источниках по материалам наблюдений разных лет, проводившихся в сентябре в ЮВБМ (Ведерников и др., 2001, 2003) и ЮЗКМ (Ведерников и др., 1994; Мошаров, 2010).
К аналогичному результату приводит и сравнение качественных и количественных характеристик фитопланктона с таковыми, приведенными ранее для того же сезона в Печорском море (Макаревич, 1996; Паутова, 2003; Ларионов, 2016) и юго-западной части Карского (Дружков, Макаревич, 1996; Суханова и др., 2017). Согласуются и общие таксономические списки, и наборы доминирующих видов, и средние абсолютные величины численности и биомассы. Из этого, кстати, можно сделать вывод о слабой межгодовой изменчивости данных показателей. Причиной этому служит давно установленный факт: размах многолетних колебаний климатических факторов, в первую очередь сроков образования и таяния ледяного покрова, в данных областях бассейна крайне невелик (Loeng, 1989; Зубакин, 1987; Изменчивость природных условий…, 2004).
Исходя из вышеизложенного, по итогам сравнения двух рассматриваемых сообществ, представляется необходимым выделить следующие важные особенности.
1. В обоих исследованных альгоценозах полностью отсутствуют, даже в единичных количествах, микроводоросли, принадлежащие к весеннему видовому комплексу.
2. Из общего числа идентифицированных организмов 40% зарегистрированы в пелагиали обоих рассматриваемых районов.
3. Среди фитопланктеров, отмеченных и в ЮЗКМ, и в ЮВБМ, лидировали по биомассе исключительно формы аркто-бореального происхождения, преимущественно океанические. Среди обнаруженных только в Печорском море – бореальные неритические; только в Карском море – космополиты и аркто-бореальные виды из различных экологических групп.
4. В списке доминантов, как общих для обоих водоемов, так и встреченных лишь в одном из них, практически равные доли составляли крупноклеточные центрические диатомовые и динофлагелляты.
5. Микроводоросли, не достигавшие высоких величин обилия, отличались большей “степенью мозаичности” пространственного распределения: они присутствуют на меньшем числе станций и не на всех горизонтах.
Таким образом, проведенный анализ позволяет утверждать, что пелагические альгоценозы сравниваемых районов, несмотря на различие гидрологических параметров, находились на одной стадии сезонной сукцессии и характеризовались значительным сходством качественного состава, в том числе и по экологической и фитогеографической принадлежности. Важной чертой летней, а тем более осенней фаз их годового сукцессионного цикла является отсутствие видов, намного превосходящих остальные по количественным показателям на обширной площади акватории. Именно такую картину мы наблюдаем в представленном материале: на фоне общего таксономического разнообразия относительно большое число форм доминирует на небольших участках акватории. При этом отличия по составу микроводорослей в пределах одного водоема не меньше, а то и больше таковых между ними.
ЗАКЛЮЧЕНИЕ
Описанная ситуация в целом подтверждает гипотезу о флористическом единстве Печорского моря и юго-западной части карскоморской пелагиали. При этом особенно нужно подчеркнуть, что такое подтверждение получено на материале, практически исключающем альтернативные объяснения. Гидролого-гидрохимические параметры рассматриваемых водоемов осенью 2020 г. характеризовались значительными отличиями, которые обуславливали разные уровни обилия организмов, но при этом никак не отражались на качественном составе альгофлоры. Выбранный сезон проведения наблюдений определял нахождение сообществ на стадии сукцессии с максимальным видовым разнообразием и высокой мозаичностью распределения большинства видов; несмотря на это, в них четко проявлялись черты сходства по набору доминантов и соотношению форм различного происхождения.
В итоге мы вправе сделать вывод, что основным механизмом флористической интеграции юго-восточной части Баренцева моря и юго-западной части Карского моря служит стабильный интенсивный водообмен между этими акваториями. Тем не менее для окончательной проверки обсуждаемой гипотезы необходимы дальнейшие исследования и сравнение с описанием летне-осеннего состояния пелагических альгоценозов других водоемов Арктического бассейна: на настоящий момент эти данные малочисленны либо вообще отсутствуют.
Список литературы
Архипов Б.В., Попов С.К., 1996. Моделирование плотностных и ветровых течений в юго-восточной части Баренцева моря // Океанология. Т. 36. С. 805–813.
Бацких Ю.М., Денисов В.В., 1995. Льды и айсберги // Среда обитания и экосистемы Новой Земли: Архипелаг и шельф. Апатиты: Изд. КНЦ РАН. С. 29–35.
Бышев В.И., Галеркин Л.И., Галеркина Н.Л., Щербинин А.Д., 2003. Динамика и структура вод // Печорское море: Системные исследования. М.: “МОРЕ”. С. 93–116.
Ведерников В.И., Демидов А.Б., Судьбин А.И., 1994. Первичная продукция и хлорофилл в Карском море в сентябре 1993 г. // Океанология. Т. 34. С. 693–703.
Ведерников В.И., Гагарин В.И., Буренков В.И., 2001. Особенности распределения первичной продукции и хлорофилла в Печорском море в августе–сентябре 1998 г. // Океанология. Т. 41. С. 69–79.
Ведерников В.И., Гагарин В.И., Ветров А.А., 2003. Первичная продукция и хлорофилл // Печорское море: Системные исследования. М.: “МОРЕ”. С. 195–206.
Виноградова Л.А., Грузов Л.Н., 1990. О биоценологическом районировании эпипелагиали Северной Атлантики и сопредельных районов // Тр. ГОИН. Т. 182. С. 112–133.
Вода, 2001. Спектрофотометрическое определение хлорофилла a (ГОСТ 17.1.4.02-90). М.: Стандарты. 688 с.
Дружков Н.В., Макаревич П.Р., 1996. Пространственно-временная организация пелагического фитоценоза в открытых шельфовых водах Западной Арктики (Карское море) // Экосистемы пелагиали морей Западной Арктики. Апатиты: Изд. КНЦ РАН. С. 37–72.
Зацепин А.Г., Завьялов П.О., Кременецкий В.В., Поярков С.Г., Соловьев Д.М., 2010. Поверхностный опресненный слой в Карском море // Океанология. Т. 50. № 5. С. 698–708.
Зубакин Г.К., 1987. Крупномасштабная изменчивость состояния ледяного покрова Северо-Европейского бассейна. Л.: Гидрометеоиздат. 160 с.
Изменчивость природных условий в шельфовой зоне Баренцева и Карского морей, 2004 / Ред. Данилов А.И. и др. СПб.: Изд. ААНИИ. 432 с.
Ильин Г.В., Несветова Г.И., Петров В.С., Цехоцкая Л.К., 1985. Биогенные элементы и режим кислорода // Жизнь и условия ее существования в пелагиали Баренцева моря. Апатиты: Изд. КФ АН СССР. С. 46–63.
Ильяш Л.В., Житина Л.С., 2009. Сравнительный анализ видового состава диатомовых водорослей льдов морей российской Арктики // Журн. общ. биологии. Т. 70. С. 143–154.
Ларионов В.В., 2016. Особенности годового цикла развития фитопланктонных сообществ в различных районах Печорского моря // Современные экологические, биологические и химические исследования, технологии и продукционные технологии. Мат-лы Междунар. науч.-практ. конф. Мурманск: Изд. МГТУ. С. 196–202.
Макаревич П.Р., 1996. Фитопланктонные сообщества // Экосистемы, биоресурсы и антропогенное загрязнение Печорского моря. Апатиты: Изд. КНЦ РАН. С. 50–54.
Макаревич П.Р., 1998. Весеннее состояние микрофитопланктонного сообщества юго-восточной части Баренцева и юго-западной части Карского морей на акваториях, покрытых льдами // Биология и океанография Карского и Баренцева морей (по трассе Севморпути). Апатиты: Изд. КНЦ РАН. С. 138–150.
Макаревич П.Р., Дружкова Е.И., 2007. Функционирование пелагических и криопелагических экосистем в покрытых льдом участках Баренцева и Карского морей // Биология и океанография Северного морского пути: Баренцево и Карское моря. М.: Наука. С. 50–63.
Макаревич П.Р., Дружкова Е.И., 2010. Сезонные циклические процессы в прибрежных планктонных альгоценозах северных морей. Ростов-на-Дону: Изд. ЮНЦ РАН. 280 с.
Маккавеев П.Н., Стунжас П.А., 1994. Гидрохимическая характеристика вод Карского моря // Океанология. Т. 34. С. 662–667.
Маккавеев П.Н., Стунжас П.А., Маккавеев А.П., 2003. Гидрохимия // Печорское море: Системные исследования. М.: “МОРЕ”. С. 134–170.
Маккавеев П.Н., Стунжас П.А., Мельникова З.Г., Хлебопашев П.В., Якубов Ш.Х., 2010. Гидрохимическая характеристика вод западной части Карского моря // Океанология. Т. 50. С. 730–739.
Матишов Г.Г., Ильин Г.В., Матишов Д.Г., 1996. Общие закономерности океанологического режима и океанологические условия безледного периода // Экосистемы, биоресурсы и антропогенное загрязнение Печорского моря. Апатиты: Изд. КНЦ РАН. С. 25–39.
Моисеев П.А., 1986. Биотопический подход к изучению биологических ресурсов Мирового океана // Биотопическая основа распределения морских организмов. М.: Наука. С. 3–6.
Морозова О.А., Весман А.В., Добротина Е.Д., Тарасенко А.Д., Шумская Н.К. и др., 2013. Особенности гидрохимической структуры вод Карского моря в летний период 2012 г. // Проблемы Арктики и Антарктики. № 1 (95). С. 61–71.
Мошаров С.А., 2010. Распределение первичной продукции и хлорофилла “а” в Карском море в сентябре 2007 г. // Океанология. Т. 50. С. 933–941.
Никифоров С.Л., Дунаев Н.Н., Огородов С.А., Артемьев А.В., 2003. Физико-географическая характеристика // Печорское море: Системные исследования. М.: “МОРЕ”. С. 27–92.
Околодков Ю.Б., 2000. Динофлагеллаты (Dinophyceae) морей Евразийской Арктики. Дисс. … д-ра биол. наук. СПб.: БИН РАН. 363 с.
Паутова Л.А., 2003. Фитопланктон Печорского моря // Печорское море: Системные исследования. М.: “МОРЕ”. С. 171–194.
Паутова Л.А., 2021. Фитопланктон Баренцева моря // Система Баренцева моря. М.: ГЕОС. С. 217–230.
Позднякова Л.Е., Виноградов В.И., 1966. Некоторые особенности распределения гидрохимических элементов в юго-восточной части Баренцева моря в августе–сентябре 1959 г. // Состав и распределение планктона и бентоса в южной части Баренцева моря. М.; Л.: Изд. АН СССР. С. 140–156.
Рейсовый отчет комплексной экспедиции на НИС “Дальние Зеленцы” в Баренцево море (10.03–14.04.2021), 2021 / Ред. Макаревич П.Р. Мурманск: ММБИ. 99 с.
Руководство по химическому анализу морских вод, 1993. Л.: Гидрометеоиздат. 265 с.
Сергеева В.М., Житина Л.С., Мошаров С.А., Недоспасов А.А., Полухин А.А., 2018. Структура фитопланктонного сообщества в области Полярного фронта восточной части Баренцева моря в конце вегетационного сезона // Океанология. Т. 58. № 5. С. 763–773.
Сергеева В.М., Суханова И.Н., Флинт М.В., Полухин А.А., Кременецкий В.В. и др., 2020. Фитопланктон желоба Св. Анны: влияние абиотических факторов // Океанология. Т. 60. № 4. С. 528–544.
Степанов С.И., 1979. Пространственно-временная изменчивость полей солености в Карском море в навигационный период // Тр. ААНИИ. Т. 361. С. 59–62.
Степанов С.И., 1985. Особенности циркуляции вод Карского моря в навигационный период // Тр. ААНИИ. Т. 389. С. 43–45.
Суханова И.Н., 1983. Концентрирование фитопланктона в пробе // Современные методы количественной оценки распределения морского планктона. М.: Наука. С. 97–105.
Суханова И.Н., Флинт М.В., Сергеева В.М., Кременецкий В.В., 2011. Фитопланктон юго-западной части Карского моря // Океанология. Т. 51. С. 1039–1053.
Суханова И.Н., Флинт М.В., Георгиева Е.Ю., Ланге Е.К., Кравчишина М.Д. и др., 2017. Структура сообществ фитопланктона в восточной части моря Лаптевых // Океанология. Т. 57. С. 86–102.
Федоров В.Д., 1979. О методах изучения фитопланктона и его активности. М.: Изд. МГУ. 167 с.
Фомин О.К., Петров В.С., 1985. Роль природных факторов в распределении биомассы планктона в Карском море // Природа и хозяйство Севера. Т. 13. С. 34–45.
Хайлов К.М., Юрченко Ю.Ю., Снегирев С.М., 2005. От растения к ноосфере: Антиучебник. Одесса: Друк. 272 с.
Хмельницкая О.К., 2011. Основные гидрохимические характеристики промежуточных и глубинных водных масс Северной Атлантики // Вестн. Моск. ун-та. Сер. 5. Геогр. № 6. С. 60–66.
Широколобов В.Н., 1982. Гидролого-гидрохимические условия юго-западной части Карского моря // Комплексные исследования природы северных морей. Апатиты: Изд. КФ АН СССР. С. 7–17.
Druzhkov N.V., Makarevich P.R., 1999. Comparison of the phytoplankton assemblages of the southeastern Barents Sea and southwestern Kara Sea: Phytogeographic status of the regions // Botanica Marina. V. 42. P. 103–115.
Druzhkov N.V., Grönlund L., Kuznetsov L.L., 1997. The phytoplankton of the Pechora Sea, the Pechora Bay and the Cheshskaya Bay // Pechora Sea Ecological Studies in 1992–1995: Final Report. Helsinki: Finnish-Russian Offshore Technology Working Group. Rep. B13. P. 41–52.
Grönlund L., Kuznetsov L.L., Druzhkov N.V., 1997. Hydrology of the Pechora Sea, the Pechora Bay and the Cheshskaya Bay // Pechora Sea Ecological Studies in 1992–1995: Final Report. Helsinki: Finnish-Russian Offshore Technology Working Group. Rep. B13. P. 15–28.
Grönlund L., Kuznetsov L.L., Fomin O.K., Leppanen J.-M., Makarevich P.R., 1994. Hydrography, chemistry, chlorophyll-a, phytoplankton and zooplankton species composition and biomass in the Pechora Sea in 1993 // Pechora Sea Ecological Studies in 1993. Helsinki: Finnish-Russian Offshore Technology Working Group. Rep. B5. P. 3–34.
Grönlund L., Kuznetsov L.L., Fomin O.K., Leppanen J.-M., Larionov V.V., 1995. Plankton production, nutrient concentration and hydrography at the Pechora Sea, in 1994 // Pechora Sea Ecological Studies in 1993. Helsinki: Finnish-Russian Offshore Technology Working Group. Rep. B6. P. 3–30.
Guillard R.R.L., Kilham P., 1977. The ecology of marine planktonic diatoms // The Biology of Diatoms. Oxford: Blackwell Sci. Publ. P. 372–469.
Heimdal B.R., 1989. Arctic Ocean phytoplankton // The Arctic Seas: Climatology, Oceanography, Geology and Biology. N.-Y.: Van Nostrand Reinhold. P. 123–146.
Loeng H., 1989. Ecological features of the Barents Sea // Proc. 6th Conf. Com. Arctique Int., 13–15 May 1985. Leiden: E.J. Brill. P. 327–365.
Loeng H., 1991. Features of the physical oceanographic conditions of the Barents Sea // Polar Res. V. 10. № 1. P. 5–18.
Makarevich P.R., Larionov V.V., Druzhkov N.V., 1993. Mean weights of dominant phytoplankton of the Barents Sea // Algology. V. 13. P. 103–106.
Makarevich P.R., Druzhkova E.I., Larionov V.V., 2012. Primary producers of the Barents Sea // Diversity of Ecosystems. Rijeka: InTech. P. 367–393. http://www.intechopen.com/books/diversity-of-ecosystems/primary-producers-of-the-barents-sea
Wang Y., Xiang P., Kang J., Ye Y., Lin G., et al., 2018. Microphytoplankton community structure in the western Arctic Ocean: Surface layer variability of geographic and temporal considerations in summer // Hydrobiologia. V. 811. P. 295–312.
Williams W.T., Bunt J.S., John R.D., Abel D.J., 1981. The community concept and the phytoplankton // Mar. Ecol. Progr. Ser. V. 6. P. 115–121.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии



