Океанология, 2020, T. 60, № 5, стр. 729-739
Влияние абиотических факторов среды на численность икры и личинок трески в юго-Восточной Балтике в 2016 г.
Е. М. Карасева 1, *, Е. Е. Ежова 2, В. А. Кречик 2
1 Атлантический филиал Всероссийского научно-исследовательского института
рыбного хозяйства и океанографии
Калининград, Россия
2 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: karasiova@rambler.ru
Поступила в редакцию 05.03.2020
После доработки 05.03.2020
Принята к публикации 08.04.2020
Аннотация
По материалам экспедиционных работ в Балтийском море в 2016 г. представлена характеристика параметров среды обитания, значимых для выживания икры и личинок трески: соленость, температура, содержание кислорода. Установлено, что икра трески присутствовала в ихтиопланктоне в ходе всего нерестового сезона: с конца марта по начало августа. Личинки трески встречались в июле и августе в количестве, превысившем среднемноголетнее значение для Гданьской впадины. Показано, что рассчитанная по вертикальной локализации изогалины 11‰ и изооксигены 2 мл/л толщина репродуктивного слоя, пригодного для размножения трески, была достаточной для выживания икры трески. Отмечено существование слоев с обостренными вертикальными градиентами плотности: в верхней части галоклина в марте–августе, летом также в поверхностном слое. Предполагается, что нижняя граница скачка плотности в поверхностном слое могла служить зоной концентрации личинок трески и их кормовых объектов.
На протяжении нескольких декад (конец 1940-х–начало 1980-х гг.) восточно-балтийская треска Gadus morhua callarias размножалась в глубоководных районах – Борнхольмском и так называемых восточных впадинах: Гданьской и Готландской. Однако после режимного сдвига конца 1980-х–начала 1990-х гг. [12] массовый нерест трески стал ежегодно проходить только в ближайшей к Датским проливам Борнхольмской впадине. Главной причиной этих изменений было резкое сокращение частоты и интенсивности так называемых больших балтийских затоков соленых и насыщенных кислородом североморских вод, после 1983 г. [26]. За период с 1987 по 2014 гг. относительно высокая численность икры трески в Гданьской впадине наблюдалась только в 1994 и 2003 гг. [7]. Еще более низкой была численность личинок трески в Гданьской и Готландской впадинах. Это позволило считать вклад этих районов моря в формирование численности пополнения в указанный период весьма незначительным [31]. В настоящее время можно считать хорошо изученными основные факторы, определяющие успех выживания икры балтийской трески: соленость и содержание кислорода в придонном слое, репродуктивный объем вод, пригодных для размножения трески, хищничество сельдевых на икре трески в Борнхольмской впадине [21–23]. Успешное выживание личинок трески в целом связывают с высокой численностью их кормовых объектов и возникновением пространственно-временны́х “окон выживания” [23]. В связи с постепенным перемещением личинок в вышележащие слои с низкой соленостью [18, 19], их выживание могло зависеть от факторов, обеспечивающих их удержание (ретенцию) в поверхностном биотопе и совпадения их распределения с высокой концентрацией кормовых организмов.
Цель этой статьи: 1) оценка сезонных изменений численности икры и личинок трески в юго-восточном районе Балтийского моря в 2016 г., 2) характеристика абиотических параметров среды, значимых для выживания ранних онтогенетических стадий трески (соленость, содержание кислорода, величина репродуктивного слоя, вертикальная локализация максимальных градиентов плотности).
МАТЕРИАЛ И МЕТОДИКА
Пробы ихтиопланктона в пределах исключительной экономической зоны РФ собирались в Гданьской впадине и на юге Готландской впадины на судах Института океанологии им. П.П. Ширшова РАН в 131-м и 133-м рейсах НИС “Профессор Штокман” и 32-м рейсе НИС “Академик Николай Страхов”. Сборы в этом районе проводились весной (март–апрель) и летом (июль и август) 2016 г.
Кроме того, в сентябре 2016 г. ихтиопланктонные сборы охватили также центральную часть Готландской впадины (глубины от 100 до 220 м). Карта с местоположением глубоководных впадин и станций представлена на рис. 1.
Рис. 1.
Положение станций в Гданьской и Готландской впадинах Балтийского моря в марте–сентябре 2016 г.
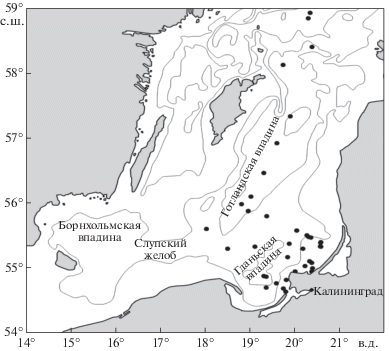
Общее количество проб ихтиопланктона составило 43 шт., из которых 20 проб было собрано в глубоководных восточных впадинах. Орудием лова служила ихтиопланктонная сеть ИКС-80 с фильтрующим конусом из капронового сита с размером ячеи 335 мкм. На каждой станции производился вертикальный облов слоя дно – поверхность. Пробы фиксировали 4%-ным раствором формальдегида. Определение видовой принадлежности икры и личинок рыб проводилось согласно определителю И.И. Казановой [4]. Численность икры и личинок рассчитывалась в экз/м2. Длина личинок измерялась под бинокуляром МБС-10 с точностью до 0.1 мм.
В ходе экспедиций были получены вертикальные профили значений температуры, солености и плотности воды посредством использования мультипараметрических зондов Idronaut Ocean seven 316 Plus и Sea & Sun Tech CTD90M. Также были измерены значения растворенного кислорода, которые определялись классическим объемным методом по Винклеру.
Учитывалось, что для оплодотворения икры трески и поддержания ее нейтральной плавучести необходима соленость не менее 11‰ [37], для ее развития – содержание кислорода не менее 2 мл/л [38]. Общепринятым показателем среды, формирующим благоприятные условия для успешного размножения трески, является репродуктивный объем RV (RL × S, где RL – толщина слоя с соленостью не менее 11‰ и содержанием кислорода более 2 мл/л, S – площадь распределения этого слоя) [31]. В связи с этим, в данной работе для характеристики условий размножения была использована величина RL, м, рассчитанная по разности между глубинами локализации изооксигены 2 мл/л и изогалины 11‰.
Для выявления параметров среды, потенциально обеспечивающих ретенцию (удержание) личинок трески в толще воды в условиях низкой солености, были рассчитаны градиенты плотности Δσθ через 5-метровые промежутки от поверхности до дна по гидрографическим данным за весну–лето 2016 г.
РЕЗУЛЬТАТЫ
Абиотические условия среды в зоне галоклина. На основе вертикального распределения параметров в табл. 1–3 представлена характеристика значимых для размножения трески абиотических условий в слое галоклина, верхней границей которого принято считать изогалину 8‰ [1].
Таблица 1.
Условия среды (температура, соленость, содержание кислорода у дна, локализация и толщина репродуктивного слоя RL), 30.03–02.04.2016 г.
| Станция | Дата | Координаты | Н, м | T°C, дно | S ‰, дно | О2, мл/л | H, м cлоя RL | Слой RL, м |
|---|---|---|---|---|---|---|---|---|
| 131 001 | 30.03.2016 | 54°52′ с.ш.–19°21′ в.д. | 109 | 7.46 | 14.40 | 2.83 | 71.12–85.26 | 14.14 |
| 91.58–109 м | 17.42 | |||||||
| Σ = 31.56 | ||||||||
| 131 010 | 01.04.2016 | 55°35′ с.ш.–20°02′ в.д. | 81 | 6.24 | 11.66 | 2.60 | 68.52–81.0 | 12.48 |
| 131 011 | 02.04.2016 | 55°56′ с.ш.–18°57′ в.д. | 107 | 6.46 | 12.42 | 1.97 | – | 0.0 |
В конце марта–начале апреля высокая придонная соленость (>14‰) и содержание кислорода > 2 мл/л на юге впадины свидетельствовали о недавнем (февраль 2016 г.) проникновении туда нового североморского затока. Однако его воды еще не достигли северной части района, где соленость и содержание кислорода были ниже (ст. 131 011).
В южной части Гданьской впадины на стандартной глубоководной ст. 233 (№ 131 001) верхняя граница слоя с соленостью 11‰ находилась на глубине 71.1 м, являвшейся верхней границей репродуктивного слоя (табл. 1). Содержание кислорода снижалось ниже лимитирующего минимума в 2 мл/л на глубине 92.1–92.5 м (до 1.56 мл/л), но затем снова возрастало до 2 мл/л на 91.6 м, достигая 2.83 мл/л у дна. Таким образом, на этой станции могли быть выделены два слоя RL с наиболее благоприятными для выживания икры трески условиями: на глубинах 71.1–85.3 м и 91.6–109 м. В сумме толщина репродуктивного слоя, доступного для размножения трески, составила 31.6 м.
На расположенной севернее ст. 131 011 в результате заглублении изогалины 11‰ до 83.5 м репродуктивный слой отсутствовал.
В июле на всех станциях разреза придонная соленость в Гданьской впадине понизилась (табл. 2). Следствием было небольшое заглубление изогалины 11‰ по сравнению с мартом–апрелем. Однако благодаря росту содержания кислорода в придонных слоях до величин, заметно превышающих лимитирующий уровень 2 мл/л, на каждой из станций на глубинах более 100 м присутствовал репродуктивный слой вод, обеспечивающий успешный нерест трески. На глубинах около 80–82 м (станции 133 022, 133 043) придонная соленость была ниже критического уровня 11‰. Поэтому, несмотря на рост содержания кислорода, репродуктивный слой там отсутствовал.
Таблица 2.
Условия среды (температура, соленость, содержание кислорода у дна, локализация и толщина репродуктивного слоя RL), 18–22.07.2016 г.
| Станция | Дата | Координаты | Н, м | T°C, дно | S ‰, дно | О2, мл/л дно | HcлояRL, м | Слой RL, м |
|---|---|---|---|---|---|---|---|---|
| 133 022 | 18.07.2016 | 55°35′ с.ш.–20°02′ в.д. | 80.5 | 5.53 | 10.44 | 5.92 | ||
| 133 025 | 18.07.2016 | 55°52′5 с.ш.–18°57′ в.д. | 108 | 5.74 | 11.70 | 3.29 | 87.8–108.0 | 20.2 |
| 133 043 | 22.07.2016 | 55°20′ с.ш.–19°06′ в.д. | 82 | 5.29 | 10.58 | 6.40 | ||
| 133 044 | 22.07.2016 | 54°50′ с.ш.–19°21′ в.д. | 105 | 6.91 | 13.32 | 3.08 | 76.1–105.0 | 28.9 |
В начале августа в придонном слое Гданьской впадины соленость немного повысилась. Это привело к незначительному уменьшению глубины локализации изогалины 11‰ по сравнению с июлем. Впервые за весенне-летний сезон в придонном слое наблюдалось истощение кислорода. Его содержание у дна на ст. 32 012 составило только 0.2 мл/л. Однако репродуктивный слой, хотя и уменьшившийся по толщине, присутствовал в начале августа на глубинах более 86 м.
В Гданьской впадине сезонная динамика критических для формирования репродуктивного слоя параметров – глубин локализации изогалины 11‰ и изооксигены 2 мл/л – была заметно выражена только для последнего показателя (рис. 2). Опускание изогалины 11‰ было незначительным, но по мере истощения придонного кислорода наблюдался подъем изооксигены 2 мл/л. Это приводило к уменьшению репродуктивного слоя с марта по август. Тем не менее, на протяжении всех рассмотренных месяцев условия для размножения трески в Гданьской впадине сохранялись. В северной части российской зоны (ст. 133 025) такие условия появились только в июле благодаря росту содержания кислорода в придонном слое.
Рис. 2.
Глубина залегания, м, изогалины 11‰, изооксигены 2 мл/л и толщина репродуктивного слоя RL, м, в Гданьской впадине в марте, июле и августе 2016 г.
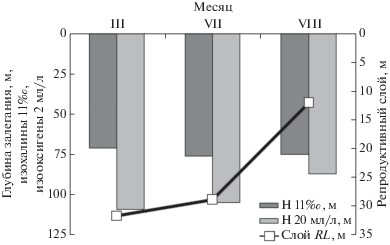
Таблица 3.
Условия среды (температура, соленость, содержание кислорода у дна, локализация и толщина репродуктивного слоя RL), 02–03.08.2016 г.
| Станция | Дата | Координаты | Н, м | T °C, дно | S ‰, дно | О2, мл/л дно | HcлояRL, м | Слой RL, м |
|---|---|---|---|---|---|---|---|---|
| 32 001 | 02.08.2016 | 54°46′ с.ш.–19°35′ в.д. | 86.2 | 6.08 | 11.82 | 1.93 | 76.48–85.3 | 9.15 |
| 32 012 | 03.08.2016 | 54°53′ с.ш.–19°18′ в.д. | 105 | 7.10 | 13.80 | 0.22 | 75.17–87.22 | 12.05 |
Вертикальное распределение градиентов плотности воды Δσθ в Юго-Восточной Балтике. Вертикальная локализация максимальных градиентов плотности характеризовалась значительной сезонной изменчивостью. В Гданьской впадине в конце марта–начале апреля вертикальное распределение Δσθ было мономодальным (рис. 3). От поверхности до глубин 50 м градиенты плотности были очень низкими (0.02–0.06). Они заметно возрастали на глубинах более 50 м. Максимальные приращения плотности были отмечены на горизонтах 60–65 м. На глубоководной станции (H > 100 м) Δσθ достигала величины 1.05, над глубинами от 80 до 90 м – 1.85 (рис. 3; табл. 4). На нижележащих горизонтах (от 70 до 100 м) этот параметр уменьшался до величин 0.23–0.63. Таким образом, в начале весны максимальные градиенты плотности наблюдались только в верхней части галоклина.
Рис. 3.
Вертикальное распределение градиентов плотности и линейная фильтрация: (а) – 30.03–01.04.2016 г., (б) – 18.07.2016 г., (в) – 22.07. 2016 г., (г) – 02.08.2016 г.
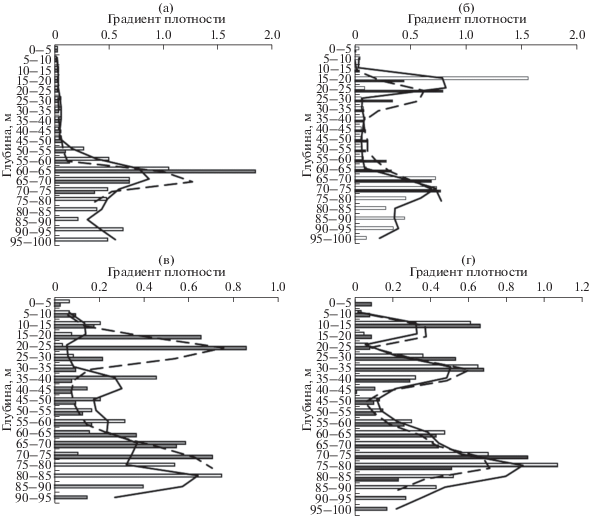
Таблица 4.
Вертикальная локализация максимальных градиентов плотности Δσθ и условия абиотической среды в Юго-Восточной Балтике в марте–августе 2016 г.
| Дата | Станция | Глубина, м | Горизонты, м | Параметры среды | |||
|---|---|---|---|---|---|---|---|
| Δσθ | T °C | S ‰ | O2, мл/л | ||||
| 30.03.16 | 131 001 | 109 | 60–65 | 1.05 | 4.62–5.64 | 8.53–9.96 | 7.27–6.39 |
| 02.04.16 | 131 010 | 81 | 60–65 | 1.85 | 4.19–5.46 | 7.93–10.32 | 7.58–7.28 |
| 18.07.16 | 133 022 | 80.5 | 20–25 | 0.80 | 14.75–8.79 | 7.30–7.31 | 6.65–6.48 |
| 70–75 | 0.78 | 5.06–5.50 | 9.42–10.42 | 6.61–6.21 | |||
| 18.07.16 | 133 025 | 108 | 15–20 | 1.56 | 17.20–5.40 | 7.06–7.19 | 6.65–10.30 |
| 70–75 | 0.74 | 4.86–5.31 | 8.71–9.63 | 6.59–5.55 | |||
| 22.07.16 | 133 043 | 82 | 20–25 | 0.86 | 13.70–8.76 | 7.20–7.50 | 7.28–7.58 |
| 70–75 | 0.71 | 4.98–5.29 | 9.19–10.09 | 7.34–6.76 | |||
| 22.07.16 | 133 044 | 105 | 10–15 | 0.21 | 18.17–16.98 | 7.36–7.36 | 6.61–6.88 |
| 35–40 | 0.46 | 9.77–6.36 | 7.49–7.69 | 7.56–7.35 | |||
| 80–85 | 0.75 | 5.61–6.40 | 11.6–12.57 | 5.48–5.05 | |||
| 02.08.16 | 32 001 | 85 | 10–15 | 0.60 | 20.01–17.30 | 7.7–7.38 | 6.91–6.77 |
| 30–35 | 0.68 | 13.84–9.10 | 7.42–7.49 | 5.56–6.16 | |||
| 70–75 | 0.91 | 5.21–5.52 | 9.74–10.89 | 5.46–6.59 | |||
| 02.08.16 | 32 012 | 103 | 10–15 | 0.61 | 20.03–17.30 | 7.28–7.27 | 6.54–5.96 |
| 30–35 | 0.65 | 6.91–6.05 | 7.43–7.52 | 5.78–6.04 | |||
| 75–80 | 1.01 | 5.22–5.78 | 9.89–11.32 | 4.16–3.28 | |||
Пики в этом слое присутствовали также в летние месяцы, но были менее выражены, чем в весенний сезон, и более заглублены, возможно, в связи с понижением придонной солености (рис. 3). Глубина локализации этих пиков летом колебалась от 70–75 до 80–85 м (табл. 4). В марте–апреле при локализации максимальных градиентов плотности на глубине 60–65 м соленость была менее 11‰. Только при заглублении нижнего градиента плотности до горизонтов 75–80 и 80–85 м соленость превышала критический для выживания икры трески уровень 11‰ (станции 133 044 и 32 012, июль, август). Содержание кислорода во всех случаях превышало критический уровень 2 мл/л. Температура воды находилась в диапазоне от 4.2 до 6.4°С.
После начала летнего прогрева пики Δσθ появились также в поверхностном слое. В июле на станциях над глубинами более 100 м небольшие максимумы Δσθ присутствовали или только на горизонте 10–15 м, или на горизонтах 10–15 и 35–40 м (рис. 3; табл. 4). На станциях над глубинами менее 100 м в июле был отмечен один, но более выраженный пик в поверхностном слое на горизонте 20–25 м (рис. 3б). В августе в поверхностном слое наблюдались два пика Δσθ, между 10–15 и 30–35 м, вне зависимости от глубины места.
Летом в поверхностном (сезонном) термоклине соленость на глубинах формирования максимальных градиентов плотности Δσθ была на уровне ее минимальных значений: от 7.06 до 7.69‰. Содержание кислорода колебалось в диапазоне от 5.56 до 7.35 мл/л. Если в поверхностном слое наблюдался только один максимум Δσθ, перепад температуры воды мог быть очень значительным: от 17.2°С на верхней границе 5-метрового слоя до 5.40°С на нижней границе (ст. 133 025). При наличии двух максимумов Δσθ в поверхностном слое температурный режим в них заметно различался: от 20.0 до 17.3°С между горизонтами 10–15 м и от 13.8 до 6.1°С между горизонтами 30–35 м.
Численность и распределение икры и личинок трески. Икра трески в основном районе исследований в Юго-Восточной Балтике присутствовала с конца марта по август (табл. 5). В марте и июле ее средняя численность составляла 4.5 экз/м2, при максимуме 18 экз/м2. В августе средняя численность икры трески увеличилась, составив в среднем 14.7 экз/м2. Сходный сезонный тренд к увеличению средней численности в августе прослеживался также и для личинок трески: от 1.5 экз/м2 в июле до 3.8 экз/м2 при максимуме 10 экз/м2.
Таблица 5.
Численность (экз/м2) икры и личинок трески в восточной Балтике в 2016 г.
| Координаты | Месяц | Икра | Личинки | ||
|---|---|---|---|---|---|
| максимум | средняя | максимум | средняя | ||
| 54°46′–55°53′ с.ш. 18°30′–19°34′ в.д. |
III–V | 18 | 4.5 | 0 | 0.0 |
| VII | 18 | 4.5 | 4 | 1.5 | |
| VIII | 34 | 14.7 | 10 | 3.8 | |
| 56°30′–58’50′ с.ш. | IX | 4 | 1.0 | 0 | 0.0 |
| 19°35′–20°22′ в.д. | |||||
В сентябре, в сезон завершения нереста трески, в южной части Готландской впадины (56°00′–56°30′ c.ш.) икра трески отсутствовала. Однако, в небольшом количестве (от 2 до 4 экз/м2) она обнаружена в центральной части Готландской впадины (56°55′–57°20′ с.ш.). Диаметр икринок трески в марте был в диапазоне 1.65–1.80 мм, в июле–августе – в диапазоне 1.60–1.75 мм, что было выше документированных минимальных, но меньше максимальных размеров (соответственно 1.46–1.99 мм) [3].
В марте–апреле и июле икра трески встречалась только в пределах акватории, очерченной изобатой 100 м. В августе зона распределения икры трески расширилась до изобаты 80 м, при сохранении основных скоплений на глубинах более 100 м. Напротив, личинки трески встречались либо только на станциях с глубинами от 80 до 100 м, как в июле, либо в этом диапазоне глубин находилось их основное скопление, как в августе. Таким образом, распределение икры трески было приурочено к зоне максимальных для этого района глубин, где, по-видимому, и проходил нерест трески. Личинки трески постепенно смещались на периферию основной нерестовой зоны с меньшими глубинами. Такой характер распределения свидетельствовал, что присутствие ранних стадий развития было результатом массовой репродукции трески в рассматриваемом районе, а не следствием выноса из западных районов моря. В центральной части Готландской впадины икринки трески были обнаружены на станциях с глубинами 146 и 220 м.
В июле длина личинок трески находилась в диапазоне 4.5–8.1 мм, при среднем значении 6.06 мм. В августе средняя длина личинок трески уменьшилась: от 3.6 до 5.1 мм, при среднем значении 4.21 мм. Все личинки не имели желточного мешка. Соответственно, они уже прошли стадию предличинки и должны были частично или полностью перейти на внешнее питание [4]. Согласно современным литературным данным [18] личинки балтийской трески длиной более 4.5 мм рассматривались как начавшие питаться. В среднем за июль и август 2016 г. доля личинок длиной более 4.5 мм в Гданьской впадине составила 63.3%.
Сопоставление распределения икры и личинок трески с условиями среды. Сезонная динамика численности икры трески и толщины репродуктивного слоя характеризовалась разнонаправленными трендами (рис. 4).
Рис. 4.
Репродуктивный слой RL, м, относительно численности: (a) – икры, (б) – личинок трески, экз/м2.
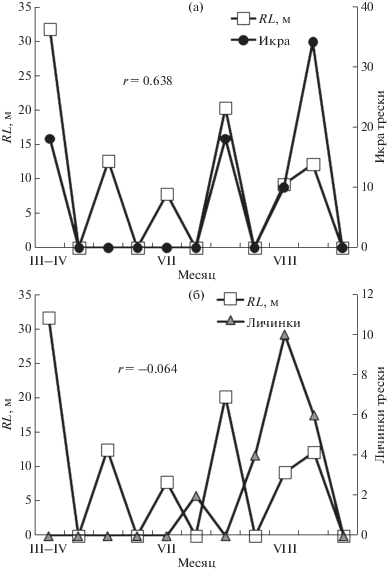
В то время как численность икры трески увеличивалась к августу, репродуктивный слой уменьшался. Это уменьшение было связано с постепенным снижением содержания кислорода в придонном слое и развитием гипоксии в наиболее глубоководных участках рассматриваемого района. Таким образом, интенсивность нереста трески возрастала к августу, что типично для современного состояния этой популяции. В течение длительного сезона размножения (весна–лето) прослеживалась положительная связь (r = 0.638, p < 0.05) между численностью икры трески в ихтиопланктоне и толщиной репродуктивного слоя RL (рис. 4). Отсутствие икры трески в начале апреля на станции № 131 010 с толщиной RL 12.5 м определялось, по-видимому, тем, что большое количество половозрелых особей еще не достигло нерестового состояния. Связь между численностью личинок трески и толщиной RL не прослеживалась (рис. 4). Отсутствие связи определялось тем, что они после рассасывания желточного мешка начинали перемещаться в слои воды с высокой концентрацией кормовых объектов [14].
В летний сезон нижний слой с высоким значением градиента плотности Δσθ мог частично совпадать с локализацией RL или находиться несколько выше его: на глубине 70–75 м, при температуре от 5.5 до 6.8°С (табл. 2–4). Этот слой стабильно присутствовал на всех станциях, где были обнаружены икра и личинки трески. Однако, учитывая, что вскоре после выклева личинки трески начинали онтогенетическую миграцию в поверхностные слои воды, их наличие в пробах следует рассматривать относительно условий среды в зоне сезонного (поверхностного) термоклина. В табл. 6 представлены данные по величине и локализации максимумов Δσθ на станциях, где были обнаружены личинки трески.
Таблица 6.
Численность личинок трески, глубина локализации максимальных градиентов плотности Δσθ в поверхностном слое и температура воды Т °С
| Дата | Глубина, м | Численность, экз/м2 | Локализация максимумов Δσθ | ||
|---|---|---|---|---|---|
| максимум Δσθ | глубина, м | Т °С | |||
| 18.07.16 | 80.5 | 2 | 0.80 | 20–25 | 14.75–8.79 |
| 22.07.16 | 82 | 4 | 0.86 | 20–25 | 13.70–8.76 |
| 02.08.16 | 85 | 10 | 0.61 | 10–15 | 20.01–17.30 |
| 0.65 | 30–35 | 13.84–9.10 | |||
| 02.08.16 | 103 | 6 | 0.66 | 10–15 | 20.03–17.30 |
| 0.68 | 30–35 | 6.91–6.05 | |||
По наблюдениям in situ [19], личинки трески в августе 2007 г. были многочисленными на глубинах от 25 до 40 м (T °C от 11 до 6°С). Они отсутствовали в слое 0–10 м и единично встречались на горизонтах 10–15 и 15–20 м. В эксперименте успешное выращивание способных экзогенно питаться личинок трески было проведено при 8°С, что может быть принято как оптимум [13]. Близкие температурные условия наблюдались в июле 2016 г. на нижних границах слоя 20–25 м и в августе – слоя 30–35 м (табл. 4). Биотоп личинок трески, возможно, мог находиться вблизи нижних границ этих слоев. Учитывая, что в июле и августе температура воды на горизонтах выше 15 м была в диапазоне от 17 до 20°С, поверхностный слой 10–15 м с максимальными значениями Δσθ, был, по-видимому, неблагоприятен для роста и развития личинок трески.
ОБСУЖДЕНИЕ
Балтийское море является одним из крупнейших солоноватоводных водоемов планеты, глубоководная часть которого характеризуется наличием галоклина, разделяющим море на два слоя – распресненный и осолоненный. В межгодовом аспекте соленость придонных вод определяется частотой и интенсивностью затоков соленых и обогащенных кислородом североморских вод [26]. В период между 1983 и 2014 гг. частота поступления и объем адвективных североморских вод значительно уменьшились, в том числе и в Юго-Восточную Балтику, а вентиляция придонных вод ухудшилась [3, 27]. В течение этих 30 лет были отмечены только два так называемых больших балтийских затока (MBI) – в 1993 и 2003 гг. Но начиная с декабря 2014 г., частота адвекций значительно увеличилась. Вслед за мощным, так называемым рождественским затоком в декабре [28], вторжения североморских вод уровня MBI наблюдались в середине ноября 2015 г. и конце января–начале февраля 2016 г. [9, 25]. Это привело к росту солености у дна Гданьской впадины в 2016 г. Уровень конца марта 2016 г. (14.4‰) не наблюдался в этом районе моря более 60 лет. Предшествующий максимум (15.4‰ в апреле, в среднем 14.5‰ за 1952 г.) был отмечен в период векового пика солености в глубоководных впадинах; средняя соленость за 1946–2010 гг. в этом районе составляла 12.03‰ [5].
Хотя содержание кислорода на глубине 105 м значительно уменьшилось в августе по сравнению с мартом и июлем, величина репродуктивного слоя, определявшаяся положением изогалины 11‰ и изоксигены 2 мл/л, вполне обеспечивала успешные нерест, плавучесть и эмбриональное развитие икры трески, вплоть до выклева личинок. В лабораторных экспериментах соленость, сохранявшая плавучесть крупных икринки балтийской трески, составляла 12‰; мелких икринок – 14‰ [30].
Из многолетних наблюдений за 1992–2014 гг. в Гданьской впадине следует, что после вторжения больших балтийских затоков происходили интенсификация нереста трески и значительный рост численности выметанной икры, как это было в 1994 и 2003 гг. [7, 22, 23]. В годы с неблагоприятными условиями среды личинки трески, как правило, отсутствовали в ихтиопланктоне Юго-Восточной Балтики. Но даже появление большого количества икры в годы адвекций не приводило к аналогичному увеличению численности личинок этом районе. За 1992–2014 гг. их максимальная численность никогда не превышала 2 экз/м2, а преобладающей размерной группой были мелкие экземпляры (<4.5 мм), составлявшие в среднем около 75% [6]. Впервые за много лет наблюдений в июле–августе 2016 г. особи длиной от 4.5 мм и более преобладали в уловах.
Вертикальное распределение личинок балтийской трески на различных стадиях их развития хорошо изучено in situ. Детальные исследования вертикальной локализации личинок трески в Борнхольмской впадине Балтийского моря в мае, июне, июле 1994 г. [18] и августе 2007 г. [19] показали, что их распределение в слое глубин от 5 до 80 м не являлось равномерным, демонстрируя от 1 до 3 пиков численности в некоторых глубинных диапазонах. Характерной чертой были сезонные отличия в вертикальном распределении различных размерных групп: а) менее 4.5 мм (эндогенное питание за счет желточного мешка); б) 4.5–5.5 мм (начало перехода на экзогенное питание); в) более 5.5 мм (полный переход на экзогенное питание) в естественных условиях среды. Как средний размер, так и количество выловленных личинок были выше в поверхностных слоях, чем в зоне ниже галоклина [19]. Состав питания личинок трески по мере их роста изменялся от доминирования науплиев у мелких особей до преобладания копеподитных стадий каляноид у среднеразмерных личинок и, наконец, до появления значительной доли половозрелых каляноид у крупных личинок трески [35]. Обеспеченность пищей личинок трески считается важным фактором их успешного выживания после уменьшения в современный период численности их основного объекта питания Pseudocalanus acuspes [36]. Сопоставление данных этих исследований, проведенных по сходной методике в рамках международных проектов CORE и STORE [14, 35], показало, что для мелких и средне-размерных личинок трески прослеживалась тенденция сезонного уменьшения глубины их основных скоплений: 1) в мае и начале июня слой ниже галоклина Борнхольмской впадины (60–75 м); 2) в июле – бимодальное распределение: как в зоне поверхностного термоклина (15–35 м), так и в глубинном слое ниже галоклина (65–75 м); 3) в августе – преобладающее распределение в поверхностном слое выше 35 м. Преимущественное распределение в мае-июне мелких личинок трески в глубоководных слоях с высокой соленостью, то есть, в зоне икрометания, объяснялось низкой плавательной активностью. Высокая соленость обеспечивала плавучесть личинок. Учитывая, что размер личинок трески уменьшался с мая по июль, требуется дополнительный анализ объяснения возможностей мелких личинок удерживаться в поверхностном слое при солености 7–8‰.
Известно, что пространственно-временнáя изменчивость в распределении зоо- и ихтиопланктона во многом зависит от локальных океанографических факторов [24, 33]. Среди них – процессы апвеллинга и даунвеллинга, турбулентность [35], а также фронтальные структуры, включая вертикальную стратификацию водного столба [17]. В случае относительной стабильности фронтальных структур они оказывают значительное влияние на численность, распределение и видовой состав ихтиопланктонных и зоопланктонных комплексов [15, 16, 29]. Установлено, что во фронтальных зонах Белого моря основные концентрации личинок сельди были сосредоточены под зоной максимальных вертикальных градиентов солености и температуры [8]. Микроструктура вод и гидродинамические процессы на поверхностях раздела еще недостаточно изучены. Известно, что галоклин и термоклин являются зонами распространения внутренних волн, что является типичной чертой мезомасштабной структуры термохалинных полей в юго-восточной части Балтийского моря [2]. Вертикальная динамика вод, создаваемая распространением внутренних волн вдоль термоклина, влияет на вертикальную изменчивость распределения фито- и зоопланктона [11, 32]. Тонкая плотностная стратификация морей, обеспечивая концентрирование планктона в градиентных прослойках, позволяет хищникам питаться с минимальной потерей энергии [10].
Можно предположить, что границы биотопа, в пределах которого личинки трески совершали вертикальные миграции, во многом определялась сезонными изменениями в вертикальной стратификации водного столба. Эти изменения в первую очередь выражались в появлении обостренного градиента плотности в поверхностном слое по мере усиления летнего прогрева.
Существование личинок трески в природных условиях зависело от миграции в вышележащие водные слои, способности удерживаться в них, находить скопления кормовых организмов и, таким образом, от их локомоторной функции. В целом, выживание личинок трески определялось совокупностью многих факторов, и в том числе, опосредованно зависело также от вертикальной стратификации вод, благодаря которой, по-видимому, во многом и формировались слои с высокой численностью зоопланктона.
Способность балтийской трески быстро реагировать на улучшение условий среды, возможно, связано с наличием в ее популяции мигрирующего компонента, что позволяет рыбе, зимующей в Слупском желобе, перемещаться в Гданьскую впадину при проникновении туда вод больших североморских затоков, что типично для этого района моря [39]. Балтийская треска способна уходить из неблагоприятных для нереста зон, предпочитая местообитания с высокими соленостью и содержанием кислорода [34].
После режимного сдвига конца 1980-х–начала 1990-х гг. нерестовый запас восточно-балтийской трески значительно сократился [20]. Ихтиопланктонные исследования 2016 г. показали, что впервые с 1987 г. в Юго-Восточной Балтике на протяжении нескольких месяцев имело место как интенсивное размножение трески, так и успешное выживание ее потомства на ранних стадиях развития. Это свидетельствовало об увеличении роли Гданьской впадины в репродукции балтийской трески.
Благодарности. Авторы благодарят д.ф-м.н., г.н.с. АО ИО РАН В.Т. Паку за предоставленные данные, многочисленные консультации и критические замечания, которые помогли существенно улучшить работу, сотрудников лаборатории геоэкологии А.А. Кондрашова и А.О. Коржа за помощь в работе с данными мультипараметрических зондов.
Источник финансирования. Сбор полевого биологического материала выполнялся в рамках темы Государственного задания ИО РАН на 2016 г. и плановый период 2016–2017 гг. № 0149-2014-0055 (рук. Е.Е. Ежова). Анализ гидролого-гидрофизических данных выполнен в рамках темы Государственного задания ИО РАН № 0149-2019-0013 (рук. В.В. Сивков). Анализ данных поддержан темой Государственного задания АО ИО РАН № 0149-2019-0008 (рук. М.В. Флинт) и темой Госзадания Атлантического филиала ВНИРО (АтлантНИРО) № 076-00005-19-00 (рук. К.В. Бандурин).
Список литературы
Гидрометеорология и гидрохимия морей СССР. Т. III. Балтийское море. Вып. 1 Гидрометеорологические условия. СПб.: Гидрометеоиздат. 1992. 451 c.
Голенко Н.Н., Щука С.А. Особенности сезонной изменчивости мезомасштабной структуры термохалинных полей в Юго-Восточной Балтике // Комплексные исследования процессов, характеристик и ресурсов российских морей Северо-Европейского бассейна. Вып. 2. Апатиты: Изд-во КНЦ РАН, 2007. С. 201–209.
Зезера А.С. Многолетние изменения абиотических условий в Балтийском море (1975–2007 гг.) // Промыслово-биологические исследования АтлантНИРО в 2006–2007 годах. Труды АтлантНИРО. Т. 1. Балтийское море и заливы. 2009. С. 6–17.
Казанова И.И. Материалы по размножению рыб Балтийского моря //Докл. ВНИРО. 1954. № 1. С. 55–70.
Карасева Е.М., Карпушевский И.В. Многолетняя (1946–2010) динамика условий гидрографической среды в придонном слое Гданьской впадины Балтийского моря // Пром.-биол. исслед. АтлантНИРО в 2010–2013 годах. Тр. АтлантНИРО. Т. 1. 2014. С. 122–129.
Карасева Е.М. Межгодовые колебания численности икры и личинок трески в Гданьской впадине Балтийского моря в современный период в связи с изменениями условий среды и динамики индекса выживания // Тр. АтлантНИРО, 2017.Т. 1. № 2. С. 146–153.
Карасева Е.М. Численность икры восточнобалтийской трески Gadus morhua callarias в XX веке как показатель изменений состояния популяции // Вопросы ихтиологии. 2018. Т. 58. № 6. С. 699–709.
Кобылянский С.Г., Дриц А.В., Мишин А.В. и др. Мелкомасштабное распределение личинок сельди (Сlupea pallasii marisalbi) и структура вод в районах нереста в Белом море // Океанология. 2014. Т. 54. № 6. С. 805–815.
Кречик В.А., Капустина М.В., Дубравин В.Ф. и др. Изменчивость термохалинных и гидрохимических, седиментационных и биологических показателей придонных вод Гданьской и Готландской впадин в 2015–2016 гг. //Система Балтийского моря. М.: Научный мир, 2017. С. 109–121.
Монин А.С., Каменкович В.М., Корт В.Г. Изменчивость Мирового океана. Л.: Гидрометеоиздат, 1974. 262 с.
Пионтковский С.А. Многомасштабная изменчивость мезопланктонных полей океана. Севастополь: ЭКОСИ-Гидрофизика, 2005. 194 с.
Alheit J., Möllmann C., Dutz J., Kornilovs G. et al. Synchronous ecological regime shifts in the central Baltic and the North Sea in the late 1980s // Canadian J. Fish Aquat. Sci. 2005. V. 59. P. 1858–1873.
Biernaczyk M., Neja Z., Oranowski A., Stepanowska K. et al. Reproduction of cod, Gadus morhua (Actinopterygii: Gadiformes: Gadidae), from the Gdansk Deep (Baltic Sea) under controlled conditions // Acta Ichthyologica et Piscatoria. 2016. V.46 (3). P. 239–246.
CORE. Mechanisms influencing long term trends in reproductive success and recruitment of Baltic cod: Implications for fisheries management. AIR 94-1226. Brussels: Eur. Comm., 1998. Parts 1–2.
Espinosa-Fuentes M.L., Flores-Coto C. Cross-shelf and vertical structure of ichthyoplankton assemblages in continental shelf waters off the Southern Gulf of Mexico // Estuarine, Coastal and Shelf Science. 2004. V. 59. P. 333–352.
Flint M. V., Sukhanova I.N., Kopylov A.I. et al. Plankton distribution associated with frontal zones in the vicinity of the Pribilof Islands // Deep - Sea Res. 2010. 49 (Suppl. 2): P. 6069–6093.
Gallagher S. M., Yamazaki H., Davis C.S. Contribution of fine-scale vertical structure and swimming behaviour to formation of plankton layers on Georges Bank // Marine Ecology Progress Series. 2004. V. 267. P. 27–43.
Gr
 nkjær P., Wieland K. Ontogenetic and environmental effects on vertical distribution of cod larvae in the
Bornholm Basin, Baltic Sea // Marine Ecology Progress Series. 1997. V. 154. P. 91–105.
nkjær P., Wieland K. Ontogenetic and environmental effects on vertical distribution of cod larvae in the
Bornholm Basin, Baltic Sea // Marine Ecology Progress Series. 1997. V. 154. P. 91–105.
Huwer B., Clemmesen C., Gr
 nkjær P., Köster F.W. Vertical distribution and growth performance of Baltic cod larvae – Field evidence
for starvation – induced recruitment regulation during the larval stage? // Progress
in Oceanography. 2011. V. 91. P. 382–396.
nkjær P., Köster F.W. Vertical distribution and growth performance of Baltic cod larvae – Field evidence
for starvation – induced recruitment regulation during the larval stage? // Progress
in Oceanography. 2011. V. 91. P. 382–396.
ICES.2014. Report of the Baltic fisheries assessment working Group (WGBFAS) // ICES CM 2014/ACOM: 10. 919 p.
Köster F.W., Möllmann C., Hinrichsen H.-H. et al. Baltic cod recruitment – the impact of climate and species interaction // ICES J. Mar. Sci. 2005.V. 62. P. 1408–1425.
Köster F.W., Vinther M., MacKenzie B.R. et al. Environmental effect on recruitment and implications for biological reference points of eastern Baltic cod (Gadus morhua) // J. Northwest Atl. Fish. Sci. 2009. V. 41. P. 205–220.
Köster F.W., Huver B., Hinrichsen H.-H., et al. Eastern Baltic cod recruitment revisited – dynamics and impacting factors // ICES J. Mar. Sci. 2017.V.74 (1). P. 3–19.
Lee O., Nash D.M., Danilowicz B.S. Small-scale spatio-temporal variability in ichthyoplankton and zooplankton distribution in relation to a tidal-mixing front in the Irish Sea// ICES J. Marine Science. 2005. № 6. P. 1021–1036.
Liblik T., Naumann M., Alenius P. et al. Propagation of impact of the recent Major Baltic Inflows from the Eastern Gotland Basin to the Gulf of Finland //Frontier Marine Science. https//doi.org/https://doi.org/10.3389/fmars.2018.00222
Matthäus W. The history of investigations of salt water inflows into the Baltic Sea – from the early beginning to recent results // Meereswissenschaft. Bericht. 2006. № 65. P. 1–73.
Meier H.E.M., Feistel R., Piechura J. et al. Ventilation of the Baltic Sea deep water: A brief review of present knowledge from observations and models // Oceanologia. 2006. V. 48 (S). P. 133–164.
Mohrholz V., Naumann M., Nausch G. et al. Fresh oxygen for the Baltic Sea – An exceptional saline inflow after a decade of stagnation //J. Marine System. 2015. V. 148. P. 152–166.
Munk P., Larsson P. O., Danielsen D., Moksness E. Variability in frontal zone formation and distribution of gadoid fish larvae at the shelf break in the northeastern North Sea // Marine Ecology Progress Series. 1999. V. 177. P. 221–233.
Nissling A., Vallin L. The ability of Baltic cod (Gadus morhua) eggs to maintain neutral buoyancy and opportunity for survival in prevailing conditions in the Baltic Sea // J. Fish. Biol. 1996. V. 48. P. 217–227.
Plikshs M., Hinrichsen H.-H.,Elferts D. et al. Reproduction of Baltic cod, Gadus morhua (Actinopterygii: Gadiformes: Gadidae), in the Gotland Basin: Causes of annual variability // Acta Ichthyologica et Piscatoria. 2015. V. 45. P. 247–258.
Pugh P.R., Boxshall G.A. The small scale distribution of plankton at a shelf station off the northwest African coast // Continent. Shelf Res. 1984. V. 3. № 4. P. 399–423.
Rodriges J.M., Hernandez-Leon S., Barton E.D. Mesoscale distribution of fish larvae in relation to an upwelling filament off northwest Africa // Deep-Sea Res. 1999. V. 1. № 46. P. 1969–1984.
Schaber M., Hinrichsen H.-H., Neuenfeldt S., Voss R. Hydroacoustic resolution of small-scale vertical distribution in Baltic cod Gadus morhua – habitat choice and limits during spawning // Marine Ecology Progress Series. 2009. V. 377. P. 239–253.
STORE. Baltic Project. Environmental and fisheries influences on fish stock recruitment in the Baltic Sea. Part 1–2. 2003.
Voss R., Köster F.W., Dieckmann M. Comparing the feeding habits of co-occurring sprat (Sprattus sprattus) and cod (Gadus morhua) larvae in the Bornholm Basin, Baltic Sea // Fisheries Res. 2003. V. 63. P. 97–111.
Wieland K., Waller U., Schnack D. Development of Baltic cod eggs at different levels of temperature and oxygen content // Dana. 1994. V. 10. P. 163–177.
Westin L., Nissling A. Effects of salinity on spermatozoa motility, percentage of fertilized eggs and egg development of Baltic cod (Gadus morhua), and implications for cod stock fluctuations in the Baltic // Mar. Biol. 1991. V. 108. P. 5–9.
Zhurbas V., Elken V., Paka V., Piechura J. et al. Structure of unsteady overflow in the Slupsk Furrow of the Baltic Sea // J. of Geophys. Res. 2012 – Oceans 117, C04027 https://doi.org/10.1029/2011JC007284
Дополнительные материалы отсутствуют.


