Океанология, 2021, T. 61, № 1, стр. 21-31
Гидрохимический состав стока рек Абхазии и особенности его трансформации в прибрежной зоне
А. А. Полухин 1, *, А. Д. Заговенкова 1, 2, П. В. Хлебопашев 1, В. М. Сергеева 1, А. А. Осадчиев 1, Р. С. Дбар 3
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Институт экологии АНА
Сухум, Абхазия
* E-mail: polukhin@ocean.ru
Поступила в редакцию 16.03.2020
После доработки 03.07.2020
Принята к публикации 15.08.2020
Аннотация
В статье приведены результаты гидрохимических исследований рек абхазского побережья Черного моря в апреле 2019 г. Основным объектом изучения стала р. Кодор и ее плюм, кроме того, были отобраны пробы в небольших реках Келасур, Моква и Гализга. Найдено, что вода р. Кодор на момент проведения измерений содержит высокие концентрации биогенных элементов (1.35 µМ фосфатов, 128.5 µМ силикатов и 16 µМ нитратов), что дает возможность для активного развития фитопланктонного сообщества в море. Процесс интенсивного продуцирования органического вещества подтверждается высокими значениями рН и низким содержанием аммонийного азота. Также внутри плюма р. Кодор удалось выявить фронтальные зоны по общей щелочности, содержанию кремния и минерального азота. Важным результатом является обнаружение различий исследованных рек по химическому составу, несмотря на относительную их близость друг к другу и общий источник питания (ледники Кавказских гор). Так, вода рек Кодор и Келасур отличается от воды рек Моква и Гализга, находящихся южнее Кодора, по карбонатным параметрам и более чем в 2 раза по содержанию нитратного азота. Различия могут быть вызваны разной степенью промывания почв и пород бассейнов рек.
1. ВВЕДЕНИЕ
Реки дренируют огромные пространства суши, поэтому величина речного стока, а также и его химический состав, служат интегральным показателем биогеохимического состояния бассейна водосбора. По химическому составу вод, динамике его параметров и изменениям объема речного стока можно уверенно судить об изменениях гидрометеорологических условий и интенсивности антропогенной (техногенной и бытовой) нагрузки в бассейне водосбора реки.
Общий объем пресноводного стока в Черное море составляет, по разным оценкам, порядка 350 км3/год [2]. На долю абхазского сектора Черного моря приходится 30 км3/год речной воды, что составляет менее 10% от общего стока. Тем не менее, эта цифра достаточно велика, так как протяженность береговой линии в Абхазии составляет всего 205 км [2]. На многочисленных спутниковых снимках Черного моря видно, особенно в период половодья, что пресный сток может распространяться практически на все его побережье из-за многочисленных рек и малых водотоков [26–28], которые несут со своими водами взвесь, биогенные элементы, а также загрязняющие вещества [5, 9]. Таким образом, и на прибрежную зону Абхазии оказывается заметное воздействие материкового стока.
Для черноморского региона изучение химии речного стока, а также его влияния на прибрежную зону, носит не только фундаментальный, но и прикладной характер, так как Черное море, и в частности побережье Абхазии – важный объект природного и рекреационного значения. В связи со сложной политической ситуацией в республике Абхазия, научные исследования в прибрежной зоне были практически прекращены. Тем не менее, в последние годы появляются публикации, отражающие современное состояние изученности рек Республики Абхазия, а также устьевых областей и прибрежной зоны. Так, в работах [1, 24] сообщается о состоянии устьевых участков рек Абхазии и влиянии стока на побережье. Измерены расходы рек (наибольший, как и ожидалось, у р. Кодор), мутность вод (в среднем, 0.007 г/м3, самая высокая – в р. Келасур, 0.28 г/м3), по составу фитопланктона речные воды относятся к олиготрофным. В прибрежной зоне г. Сухум отмечаются высокие значения нитратного азота в мае–июне (до 3 мг/л, что равносильно 214 µМ), минимальные (0.92 мг/л или 65 µМ) – в октябре [1]. Такое содержание нитратного азота вызывает серьезные сомнения, возможно, это методические погрешности или в работе идет речь о загрязнениях с суши. Хотя, в целом, в литературе отмечается, что содержание загрязняющих веществ, нефтеуглеводородов, и биогенных элементов не превышает ПДК для акватории г. Сухум или для устьевых областей рек Абхазии [1]. Тем не менее, имеющихся данных недостаточно для оценки влияния речного стока на экосистему прибрежных вод Абхазии, поэтому данная работа вносит определенный вклад в изучение этого процесса.
2. МАТЕРИАЛЫ И МЕТОДЫ
В основу данного исследования легли материалы, полученные в ходе экспедиции на побережье Абхазии с 1 по 4 апреля 2019 г. Экспедиция решала широкий спектр задач, связанных с изучением влияния стока р. Кодор на прибрежную зону [11]. Основная цель группы гидрохимии в составе экспедиции состояла в изучении химического состава (биогенные элементы, параметры карбонатной системы) рек абхазского побережья Черного моря, а также вод в зоне смешения морских вод с водами р. Кодор.
Температура и соленость на станциях были получены с помощью CTD-зонда (Sea-Bird Electronics 19plus), опускаемого вручную до дна. Отбор проб для определения гидрохимических параметров проводился на 19 станциях в зоне смешения морских вод с водами р. Кодор в выходах на судне 2 и 3 апреля. Пробы речной воды были отобраны в нижнем течении рек Кодор, Келасур (Кяласур), Моква и Гализга (Галидзга) 1 и 2 апреля (рис. 1). В р. Келасур отбор проводился в двух местах: недалеко от устья и выше по течению, для остальных рек – на расстоянии порядка 2 км от устья. Пробы из рек брались непосредственно в пластиковую посуду для отбора, в море – с поверхности пластиковым ведром, и сразу переливались в посуду для хранения проб по ГОСТ 17.1.5.04-81, в зависимости от определяемого компонента. Определения в пробах гидрохимических параметров проводились не позднее, чем через 24 ч после отбора.
Рис. 1.
а – Район работ и реки где отбирались пробы (показано точками), б – схема станций и отборов гидрохимических проб 2 апреля 2019 г., в – схема станций и отборов гидрохимических проб 3 апреля 2019 г. Пунктиром показана граница плюма р. Кодор.

Минерализация для вод р. Кодор была вычислена через соотношение с общей щелочностью в соответствии с [17, 18]. Величина рН определялась потенциометрическим методом с использованием четырехканального рН-метра “Эконикс-Эксперт” с комбинированным электродом фирмы “Аквилон”. Определение общей щелочности (Ta) проводилось методом прямого титрования (метод Бруевича) с цветовым окончанием. Определение содержания растворенного неорганического фосфора (${\text{PO}}_{4}^{ - }$) проводилось колориметрически по модифицированному методу Морфи и Райли. Определение растворенного неорганического кремния (Si) проводилось колориметрически по голубому кремнево-молибденовому комплексу (метод Королева). Определение нитритного азота (N-NO2) проводилось колориметрически с использованием единого цветного реактива. Определение нитратного азота (N-NO3) также проводилось колориметрически, после его восстановления на кадмиевых колонках до нитритного азота. Аммонийный азот (N-NH4) определялся фенолят-гипохлоритной реакцией по методике Сэджи-Солорзано. Подробно методики определений гидрохимических параметров описаны в [12, 14].
Кроме измеренных параметров, с помощью программы CO2SYS [22] были рассчитаны такие параметры карбонатной системы, как содержание в воде карбонат (CO3) и гидрокарбонат-иона (${\text{HCO}}_{3}^{ - }$), количество общего неорганического углерода (DIC), а также парциальное давление углекислого газа (pCO2).
3. РЕЗУЛЬТАТЫ
Гидрофизические аспекты изучения плюма р. Кодор приводятся в сопутствующей статье [11]. В данной работе приведем результаты гидрохимических исследований рек Абхазии и их влияния на особенности распределения гидрохимических параметров в прибрежной зоне.
Исследование химического состава речных вод. Реки Абхазии характеризуются карбонатно-кальциевым типом вод со средней минерализацией [24]. Проведенные исследования химического состава речных вод выявили существенные различия. По содержанию растворенных силикатов реки Келасур, Кодор и Моква почти не отличаются (129–132 µМ), а в р. Гализга было меньше – 114 µМ. Вода р. Кодор выделяется высокой концентрацией фосфатов (1.35 µМ), в остальных реках этот параметр на низком уровне (0.1–0.3 µM). По содержанию нитратов вода рек Келасур и Кодор также сильно отличаются от воды рек Моква и Гализга. В первых двух содержание нитратов находится на уровне 16 µМ, в то время как в воде р. Гализга – 31 µМ, а в р. Моква – 45 µМ (рис. 2а). рН рек Келасур и Кодор сильно отличается (на ~0.15 ед.) от рН вод рек Моква и Гализга (рис. 3a). Также они отличаются и по параметру общей щелочности, которая характеризует количество карбонатных солей. В водах рек Келасур и Кодор щелочность не превышает 1300 µмоль/кг, тогда как в двух других реках она составляет порядка 1700 µмоль/кг (рис. 3a). Как следствие, воды рек Келасур и Кодор отличаются по содержанию ${\text{HCO}}_{3}^{ - }$ и общему неорганическому углероду от воды рек Моква и Гализга (рис. 3б).
Рис. 3.
(а) рН и общая щелочность (Ta), (б) содержание карбонат-иона (HCO3) и растворенного неорганического углерода (DIC) в воде устьев рек Келасур, Кодор, Моква, Гализга.
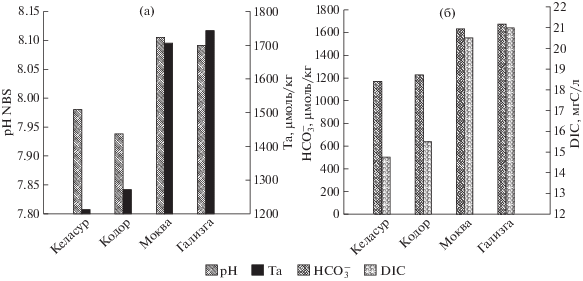
Столь существенные отличия в химическом составе рек связаны с ландшафтно-геохимическими особенностями бассейна водосбора, а также с особенностями в типе питания. Преобладание метеорных или подземных вод в питании рек при выщелачивании пород влияет на рН и щелочность поверхностных вод. Важную роль играет и интенсивность промывного режима в разных районах карстовых массивов низкогорий и среднегорий абхазского побережья Западного Кавказа [7]. По-видимому, почвы и породы бассейна водосбора рек Келасур и Кодор промываются менее интенсивно, чем водосборы рек Моква и Гализга, что приводит к различиям в составе общей щелочности и рН. Различия в содержании биогенных элементов в водах исследованных рек могут быть вызваны сельскохозяйственной деятельностью в разных районах Абхазии [24]. Влияние сельскохозяйственной деятельности может проявляться достаточно отчетливо. В [18] на примере рек Дальнего Востока показано, что смыв минеральных удобрений с полей в бассейнах р. Раздольная и Туманная существенно увеличил в них концентрацию нитратного азота (43 µМ в весенний сезон).
Распределение химических параметров в плюме р. Кодор
Для изучения процесса смешения вод р. Кодор с морскими водами и особенностей распределения биогенных элементов, влияющих на продуктивность вод и состав фитопланктонного сообщества в прибрежной зоне, 2 апреля 2019 г. был выполнен отбор проб в плюме реки с отбором проб из поверхностного слоя (рис. 1). Также изучалась изменчивость параметров карбонатной системы в приустьевом районе, так как речные и морские воды обладают принципиально разным содержанием карбонатных солей. Исследованная акватория покрывала площадь от одного из рукавов дельты вдоль побережья на северо-запад на 4 км, и в сторону моря на 2 км. Температура в поверхностном слое изменялась от 9°С в устье р. Кодор до 10.2°С в центральной части плюма и затем падала до 9.8°С в его мористой части (рис. 4a). Соленость варьировала от 122 мг/кг (устье р. Кодор) до 18 епс в свободной от речной воды части моря. Распределение рН (рис. 4Б): в устье р. Кодор 7.94 ед. NBS, максимум (8.55) на станции 2–13 в мористой части. В плюме этот параметр варьирует от 8.35 до 8.49 ед. NBS, скорее всего, эти изменения связаны с развитием в поверхностном слое фитопланктона. Щелочность находится в прямой корреляции с соленостью (рис. 4Б), изменяясь от 1273 µмоль/кг в речной воде до 3179 µмоль/кг в морской. Фронтальный раздел с резким градиентом увеличения щелочности (как и солености) проходит между станциями 2–3 и 2–8. Именно здесь можно локализовать первую фронтальную зону плюма р. Кодор, на которой должно происходить массовое выпадение взвеси, а также другие геохимические и биологические процессы, характерные для устьевых областей рек [8].
Рис. 4.
Распределение (а) температуры и солености, (б) рН и общей щелочности Ta, (в) фосфатов и силикатов, (г) аммонийного и нитратного азота (N), (д) парциального давления CO2 и неорганического углерода (DIC) на выполненных 2 апреля станциях.

Содержание минерального фосфора в поверхностном слое изменялось от аналитического нуля до 1.35 µМ (рис. 4в). Максимум фосфатов отмечается в воде р. Кодор, в плюме содержание фосфатов близко к нулю, локальный максимум (1 µМ) отмечен на внешней границе исследованного плюма, на станции 2–13. После границы плюма, выраженной по солености и щелочности, на станции 2–4 отмечен локальный пик содержания фосфатов, но весьма незначительный (0.1 µМ), он повторяется на станции 2–9. В целом такое распределение показывает вовлеченность фосфатов в активный процесс фотосинтеза как в плюме, так и в мористой части разреза. Сток р. Кодор является источником фосфатов в прибрежную область моря, а быстрое (по сравнению с нитратами и кремнием) убывание фосфатов показывает, что в данном случае оно лимитирует развитие фитопланктонных сообществ.
Содержание силикатов в поверхностном слое изменяется от 130 µМ в речной воде до 8 µМ в мористой части на последней станции разреза (рис. 4в). Между станциями 2–3 и 2–8, так же, как и в случае со щелочностью, наблюдается фронтальная зона, где происходит резкое уменьшение содержания силикатов (в 2 раза, с 60 до 30 µМ). После этой зоны содержание силикатов падает до 20 µМ и уменьшается в сторону открытого моря до 8 µМ.
Нитратный азот является одним из основных элементов, которые фитопланктонные сообщества используют для питания. Вариация нитратов в плюме составляет от 16 µМ в воде р. Кодор до 0.57 µМ на станции 2–12 с наивысшей соленостью (рис. 4г). По нитратам также хорошо видна граница речного плюма: между станциями 2–3 и 2–8 наблюдается резкий градиент (содержание нитратов падает с 10 до 4 µМ). Как в плюме, так и за его выраженными границами (станция 2–11), содержание нитратов достаточно высокое и не могло являться лимитирующим фактором в развитии фитопланктонного сообщества.
Содержание аммонийного азота показывает степень окисления органического вещества, так как первым в ряду разложения органического азота стоит именно аммонийный азот. На исследованной акватории он изменяется от 0 до 0.6 µМ (рис. 4г). Максимум отмечается на станции 2–8, которая находится за границей фронтального раздела. Других закономерностей в распределении аммонийного азота по поверхности не наблюдается.
Парциальное давление углекислого газа в поверхностном слое изменялось от 650 µатм в речной воде до 250 µатм в мористой его части на станции 2–12 (рис. 4д). То, что парциальное давление CO2 ниже равновесного с атмосферой значения (400 µатм), также указывает на протекающий процесс продуцирования органического вещества. В плюме р. Кодор содержание общего растворенного неорганического углерода (DIC) варьирует от 26.6 до 36.5 мгС/л, минимальное его содержании в речной воде (15.5 мгС/л). Результаты химических анализов и сопутствующих расчетов приведены в таблице 1.
Таблица 1.
Результаты определения гидрохимических параметров в пробах, отобранных во время выходов в море 2 и 3 апреля 2019 г.
| Станция | С.ш.° | В.д.° | Т, °С | S, епс | pH, NBS | Ta, µмоль/кг | PO4, µM | Si, µM | NH4, µM | NO2, µM | NO3, µM | DIC, мгС/л | HCO3, µM | CO3, µM | CO2, µM | pCO2, µатм |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2–2 | 42.814 | 41.132 | 10.20 | 16.730 | 8.26 | 3150.1 | 0.02 | 14.05 | 0.28 | 0.11 | 2.73 | 36.1 | 2838.7 | 140.8 | 26.4 | 546 |
| 2–3 | 42.813 | 41.134 | 9.49 | 10.800 | 8.35 | 2421.4 | 0.00 | 54.46 | 0.21 | 0.09 | 9.67 | 27.8 | 2189.1 | 105.6 | 18.9 | 370 |
| 2–4 | 42.812 | 41.133 | 10.00 | 15.130 | 8.38 | 2973.4 | 0.11 | 23.85 | 0.21 | 0.08 | 3.58 | 33.6 | 2614.1 | 162.81 | 18.8 | 384 |
| 2–5 | 42.819 | 41.127 | 10.18 | 17.220 | 8.37 | 3245.8 | 0.00 | 12.05 | 0.14 | 0.09 | 2.16 | 36.5 | 2836.8 | 185.2 | 20.2 | 419 |
| 2–6 | 42.811 | 41.135 | 9.46 | 8.890 | 8.45 | 2340.5 | 0.00 | 59.66 | 0.31 | 0.09 | 9.92 | 26.6 | 2084.0 | 117.8 | 14.9 | 288 |
| 2–7 | 42.812 | 41.136 | 9.57 | 9.790 | 8.49 | 2399.4 | 0.01 | 57.21 | 0.35 | 0.09 | 9.35 | 27.0 | 2104.4 | 134.9 | 13.5 | 263 |
| 2–8 | 42.812 | 41.117 | 10.16 | 14.980 | 8.45 | 2921.9 | 0.01 | 25.46 | 0.59 | 0.10 | 4.74 | 32.6 | 2517.1 | 183.4 | 15.5 | 317 |
| 2–9 | 42.826 | 41.119 | 10.17 | 17.310 | 8.44 | 3179.5 | 0.09 | 11.55 | 0.28 | 0.11 | 1.97 | 35.3 | 2715.6 | 209.8 | 16.3 | 339 |
| 2–10 | 42.829 | 41.090 | 10.22 | 16.020 | 8.46 | 3076.5 | 0.02 | 19.35 | 0.31 | 0.08 | 3.62 | 34.1 | 2623.9 | 205.1 | 15.3 | 316 |
| 2–11 | 42.844 | 41.103 | 9.95 | 17.370 | 8.46 | 3209.0 | 0.00 | 8.55 | 0.31 | 0.10 | 1.20 | 35.5 | 2721.5 | 220.7 | 15.6 | 321 |
| 2–12 | 42.850 | 41.098 | 9.77 | 17.780 | 8.49 | 3238.4 | 0.52 | 7.60 | 0.42 | 0.09 | 0.57 | 35.6 | 2716.9 | 235.7 | 14.6 | 299 |
| 2–13 | 42.850 | 41.096 | 10.01 | 17.510 | 8.55 | 3150.1 | 1.01 | 14.70 | 0.31 | 0.08 | 2.07 | 34.2 | 2581.7 | 256.3 | 12.1 | 250 |
| 3–1 | 42.795 | 41.149 | 10.11 | 16.296 | 2995.5 | 0.06 | 16.20 | 0.09 | 3.50 | |||||||
| 3–8 | 42.812 | 41.135 | 10.65 | 12.779 | 1670.7 | 0.04 | 99.12 | 0.08 | 16.13 | |||||||
| 3–9 | 42.810 | 41.138 | 10.32 | 15.554 | 2995.5 | 0.08 | 25.96 | 0.08 | 4.43 | |||||||
| 3–10 | 42.816 | 41.130 | 10.56 | 16.013 | 3113.3 | 0.02 | 20.40 | 0.10 | 2.79 | |||||||
| 3–11 | 42.805 | 41.141 | 10.51 | 13.727 | 2782.1 | 0.03 | 41.81 | 0.13 | 9.33 | |||||||
| 3–12 | 42.804 | 41.141 | 10.62 | 14.610 | 2384.6 | 0.03 | 62.06 | 0.08 | 10.59 | |||||||
| 3–13 | 42.795 | 41.147 | 10.13 | 16.035 | 3260.5 | 0.02 | 11.35 | 0.07 | 1.13 |
Во время работ 3 апреля в том же районе был выполнен отбор проб с поверхности на семи станциях. В пробах определены общая щелочность и биогенные элементы (фосфаты, силикаты, нитратный и нитритный азот). Из рис. 5a виден плавный рост солености от 12.8 до 16.0 епс на первых пяти станциях в такой последовательности: 3–8, 3–11, 3–12, 3–9, 3–10. Однако ход изменения химических параметров, в отличие от данных предыдущего дня, не так хорошо коррелировал с соленостью. Так, на ст. 3–8 содержание силикатов, общей щелочности и нитратов было 99 µМ, 1671 µмоль/кг и 16 µМ соответственно. Это характеризует поверхностную воду на ст. 8 как близкую к речной, несмотря на соленость 12.8 епс. Также видно, что на ст. 3–12 происходит понижение щелочности до 2384 µмоль/кг (по сравнению с предыдущей ст. 11), при этом возрастает и содержание силикатов (60 µМ) и нитратов (10.5 µМ). Т.е. опять происходят изменения не коррелирующие с изменением солености. Можно предположить две причины таких расхождений. Первая – разная глубина отбора проб (ведром с поверхности) и измерений солености зондом. Если 2 апреля, как показывает рис. 7, толщина плюма была примерно 3 м, тогда разница глубин измерения была несущественна. 3 апреля такие измерения не проводились, толщина плюма могла быть меньше, и измерения солености происходили на нижней границе плюма, показывая соленость большую, чем следовало из химических параметров. Другая причина – это может быть связано с динамикой внутри плюма и отдельными струями пресной воды, так как р. Кодор имеет устье дельтового типа с несколькими рукавами, из которых может поступать вода с несколько отличающимися характеристиками. Особенно хорошо это было заметно при выполнении дрифтерного эксперимента [11].
Рис. 5.
Распределение (а) температуры, солености и общей щелочности (Ta), (б) фосфатов и силикатов, (в) нитритного и нитратного азота (N) на выполненных 3 апреля станциях.
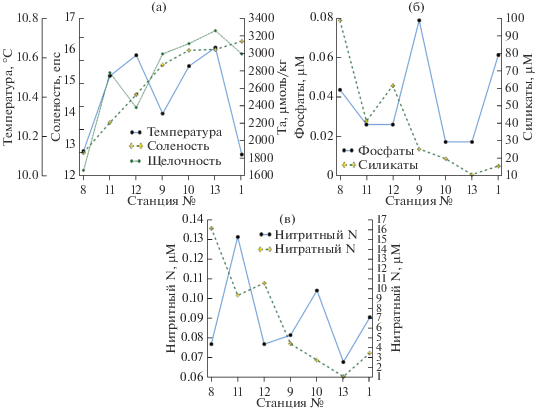
Рис. 6.
Выделение фронтальных зон (ФЗ) в плюме р. Кодор по соотношениям щелочность (Ta)-соленость и кремний (Si)-соленость.

Концентрация фосфатов в плюме, как и во время работ 2 апреля, была низкой, от 0.02 до 0.08 µМ (рис. 5б), что означает почти полное потребление их фитопланктоном. Соотношение N : P равно 12 в речной воде, 2 и 1 на самых мористых станциях 3–13 и 3–12 соответственно. В целом на станциях в плюме соотношение Редфилда показывает сильное преобладание нитратов. Таким образом, фосфаты, в отличие от нитратов, лимитируют активность фитопланктона и продуцирование органического вещества. Содержание нитритов в плюме (рис. 5в) также весьма невысокое, от 0.08 до 0.13 µМ, что говорит о низкой вовлеченности минерального азота в процесс окисления органического вещества. Результаты химических анализов и сопутствующих расчетов приведены в таблице 1.
4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В связи с тем, что в последние несколько десятилетий научные исследования, в том числе в области гидрологии и океанологии, в Абхазии свелись к минимуму, существует крайне мало информации о химии речных вод этого региона. Поэтому, для сравнения и объяснения различий в химическом составе стока исследованных рек Келасур, Кодор, Гализга и Моква, мы будем использовать данные экспедиций ИОРАН, полученные в ходе проекта “Малые реки Черного моря” [5, 21]. Крупнейшая из малых рек черноморского побережья России, Мзымта, по бассейну водосбора, а также основным гидрологическим характеристикам, сильно уступает р. Кодор, но превосходит р. Келасур, Гализга и Моква (табл. 2). Из гидрохимических различий рек стоит, в первую очередь, выделить значения рН (для р. Мзымта выше) и общей щелочности (для р. Мзымта ниже). Отличаются абхазские реки от р. Мзымта и по гидрохимическим показателям. Так, в ее водах содержится больше фосфатов (0.4–0.8 µМ), чем во всех реках, кроме р. Кодор (1.35 µМ), в то время как силикатов, наоборот, меньше (92 µМ в Мзымте против 114 µМ и более в абхазских реках). Концентрация аммония в водах Мзымты также выше, содержание нитритов – на одном уровне, нитратов в водах Мзымты сравнимое с реками Кодор и Келасур количество, а в водах рек Моква и Гализга – в 2–2.5 раза выше. Такие различия можно объяснить сезонностью режимов этих рек. Наблюдения на р. Мзымта проводились ежегодно во второй половине мая, сразу после пика половодья. А на абхазских реках в начале апреля половодье еще не прошло, их состояние и состав вод был скорее ближе к зимней межени. Поэтому после половодья на абхазских реках их химический состав скорее всего станет схожим с р. Мзымта. Также заметно различие в карбонатных параметрах пар рек Келасур–Кодор (рН 7.98 и 7.94, Ta 1214 и 1273 µмоль/кг соответственно) и Гализга-Моква (рН 8.09 и 8.11, Ta 1744 и 1707 µмоль/кг соответственно). Такая ситуация наблюдалась и для пары рек Кудепста-Мзымта, например, в 2014 г. (рН 8.26 и 8.62, Ta 3216 и 1013 µмоль/кг соответственно) и в другие годы. Несмотря на соседство их бассейнов водосбора, они тоже имели различия как по рН, так и по значению общей щелочности. Это объясняется более высоким содержанием карбонатов в породах бассейна р. Кудепста [5]. В работе [7] показано, что различия в гидрохимическом составе горных водотоков Абхазии могут проявляться ввиду разной степени интенсивности промывания одних и тех же карбонатно-кальциевых пород, а также из-за различного типа питания. По-видимому, это является причиной различий параметров карбонатной системы для вод исследованных абхазских рек.
Таблица 2.
Гидрохимические характеристики реки Мзымта в сравнении с реками Абхазии (отбор проб проводился в устье рек)
| Река | S, км2 |
V, км3/год |
pH, NBS |
Ta, µмоль/кг | PO4, µM | Si, µM |
NH4, µM | NO2, µM | NO3, µM | DIC, мгC/л | pCO2, µатм |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Мзымта* | 885 | 1.56 | 8.4–8.7 | 1013–1141 | 0.39–0.78 | 92 | 2.9 | 0.22–0.25 | 12–22 | ||
| Келасури | 220 | 0.42 | 7.98 | 1214 | 0.28 | 129 | 0.07 | 16.33 | 14.7 | 572 | |
| Кодор | 2030 | 4.2 | 7.94 | 1273 | 1.35 | 128 | 0.09 | 16.26 | 15.5 | 663 | |
| Галидзга | 483 | 0.93 | 8.09 | 1744 | 0.13 | 114 | 1.99 | 0.15 | 30.68 | 21 | 632 |
| Моква | 336 | 0.57 | 8.11 | 1707 | 0.11 | 132 | 0.70 | 0.13 | 44.58 | 20.5 | 598 |
Устьевые области рек и приэстуарные районы моря – одни из самых сложных для изучения географических объектов из-за сильно выраженной пространственной изменчивости [21, 29]. Особенно ярко это проявляется для крупных рек [4, 10, 15]. Но и малые реки, такие, как на черноморском побережье, способны генерировать плюмы, в которых происходят сложные динамические процессы [25], а также идет активное перераспределение растворенных и взвешенных веществ [3, 6, 9]. Так, по полученным в ходе работ 2 апреля гидрохимическим данным, в плюме р. Кодор выделяются 2 фронтальные зоны по соотношению щелочность–соленость и кремний–соленость (рис. 6). Эти соотношения являются четкими маркерами при разделении морских и речных вод [13, 16]. На рисунке показано, что на внешней границе плюма, определяемой по солености 16–16.5 епс, располагаются станции 2–8, 2–4, 2–10 и 2–2, которые также выделяются по величине общей щелочности (2900–3150 µмоль/кг) и концентрации кремния (14–25 µМ). Кроме этого, ярко выражена фронтальная зона внутри плюма. Она определяется по резкому градиенту солености (с 9.46 до 10.16 епс) на станциях 2–6, 2–7, 2–3, 2–8. Кроме того, она выделяется в поведении щелочности (рост с 2340 до 2921 µмоль/кг) и силикатов (уменьшение с 60 до 25 µМ). Вода р. Кодор выступает в качестве начальной точки смешения, а конечной точкой смешения – чистыми морскими водами, являются станции 2–5, 2–9, 2–11, 2–13 и 2–12 с соленостью выше 17 епс, щелочностью 3200 µмоль/кг и концентрацией силикатов 7–14 µМ. Наличие двух выраженных фронтальных зон подтверждается и по вертикальному распределению мутности на станциях (рис. 7). В верхнем метровом слое вод на первой фронтальной зоне высокие значения мутности (4–5 NTU) на станциях 2–6 и 2–7 сменяются мутностью 2 NTU на станции 2–3. Вторая фронтальная зона, находящаяся дальше от устья р. Кодор, определяется значениями мутности в верхнем метровом слое 2–2.5 NTU, а на самой мористой станции 2–12 мутность во всем слое ниже 1.5 NTU.
Как показывают гидрофизические исследования плюма р. Кодор, есть несколько существенных факторов, влияющих на его сильную пространственную неоднородность. Во-первых, особенности строения дельты р. Кодор, в результате чего сток из разных рукавов формирует несколько разные по термохалинным характеристикам воды. Во-вторых, особенности батиметрии в прибрежной зоне, которая создает условия для определенных динамических эффектов, влияющих на скорости течений в плюме. В-третьих, гидрометеорологическое воздействие на бассейн водосбора, например, кратковременные дождевые паводки, в результате которых в плюме формируется сложная система фронтов [11].
Выделенные в плюме по соотношению щелочность–соленость и кремний–соленость фронтальные зоны находят свое подтверждение и по биологичесиким данным. Анализ видового разнообразия активных автотрофных планктонных микроводорослей показал, что максимальное количество видов находится на станциях 2–3 и 2–5, как раз на границе выделенных по гидрохимии зон. Максимумы численности и биомассы фитопланктона также расположены на станциях 2–5 и 2–9, уже в мористой части исследованной акватории, на границе со второй фронтальной зоной. По-видимому, там создаются оптимальные для фитопланктона условия освещенности, температуры и питательной базы.
5. ВЫВОДЫ
В данной статье приведены результаты исследований гидрохимического состава некоторых рек Абхазии в нижнем течении, а также плюма р. Кодор и прибрежной акватории. Выявлены различия в гидрохимическом составе рек Келасур, Кодор, Моква и Гализга. Различия по параметрам карбонатной системы вызваны типом питания каждой из исследованных рек, а также интенсивностью промывания пород в бассейне их водосбора. Различия в содержании биогенных элементов, в частности, минеральных форм фосфора и азота (нитратов) объясняются антропогенной нагрузкой на реки. В приустьевой акватории р. Кодор формируется плюм, граница которого выделяется не только визуально и по гидрофизическим параметрам [11], но и по соотношению щелочность–соленость и кремний–соленость. Также внутри плюма, по тем же соотношениям, выделяется фронтальная зона, на границе которой происходят продукционно-деструкционные процессы, а также активное осаждение аллохтонной взвеси.
Результаты проведенных исследований представляются весьма важными ввиду двух фактов. Во-первых, в отличие от крупных рек, устьевым областям малых рек к настоящему времени уделено недостаточно внимания, тогда как известно, что доля жидкого и твердого стока малых рек в планетарном масштабе составляет 25 и 45% соответственно [23]. Во-вторых, непосредственно для побережья Абхазии и его устьевых областей имеется очень мало современных гидрохимических данных [19, 20]. Кроме того, чаще всего морские и прибрежные экспедиции в Абхазии проводятся в летний сезон, тогда как данная работа отражает состояние рек и прибрежной акватории в период ранней весны. Поэтому данные исследования могут найти применение для моделирования и прогнозирования внутригодовых процессов трансформации химических веществ и развития прибрежных экосистем абхазского сектора Черного моря.
Благодарности. Авторы благодарят анонимных рецензентов за конструктивную критику, а также с.н.с. ИОРАН П.А. Стунжаса за ценные советы при подготовке публикации.
Источники финансирования. Работа выполнена в рамках Госзадания ИОРАН (тема 0149-2019-0008, подготовка публикации), при поддержке Российского Научного Фонда (проект 18-17-00156, получение натурных данных; проект 19-17-00196, обработка архивных данных).
Список литературы
Гицба Я.В., Экба Я.А. Влияние речного стока на загрязнение биогенными элементами и нефтепродуктами морской акватории Абхазии // Изв. Южного федерального университета. Технические науки. 2017. № 8 (193). С. 27–37.
Джаошвили Ш. Реки Черного моря // Европейское агентство по охране окружающей среды. Технический отчет № 71. 2002. 58 с. http://www.eea.europa.eu/ru/publications/technical_report_2002_71/at_ download/file.
Завьялов П.О., Барбанова Е.С., Пелевин В.В., Осадчиев А.А. Метод расчета осаждения и перемешивания аллохтонной взвеси на основе совместного анализа данных по концентрации взвеси и солености // Океанология. 2015. Т. 55. № 6. С. 922.
Завьялов П.О., Ижицкий А.С., Осадчиев А.А. и др. Структура термохалинных и био-оптических полей на поверхности Карского моря в сентябре 2011 г. // Океанология. 2015. Т. 55. № 4. С. 514–525.
Завьялов П.О., Маккавеев П.Н., Коновалов Б.В. и др. Гидрофизические и гидрохимические характеристики морских акваторий у устьев малых рек российского побережья Черного моря // Океанология. 2014. Т. 54. № 3. С. 293–308.
Костылева А.В. Распределение растворенного органического углерода в приустьевых районах Большого Сочи (северо-восточная часть Черного моря) // Океанология. 2015. Т. 55. № 2. С. 224–230.
Кудерина Т.М., Мавлюдов Б.Р., Грабенко Е.А., Дбар Р.С. Геохимический состав природных вод карстовых систем Западного Кавказа // Вопросы географии. 2018. № 147. С. 134–142.
Лисицын А.П. Маргинальный фильтр океанов // Океанология. 1994. Т. 34. № 5. С. 765–747.
Маккавеев П.Н., Завьялов П.О. Сток малых и средних рек российского побережья Черного моря и его влияние на характеристики вод / В сборнике: Система Черного моря. Монография. Москва, 2018. С. 287–322.
Маккавеев П. Н., Мельникова З.Г., Полухин А.А. и др. Гидрохимическая характеристика вод западной части Карского моря (по материалам 59-го рейса НИС “Академик Мстислав Келдыш”) // Океанология. 2015. Т. 55. № 4. С. 540–551.
Осадчиев А.А., Барымова А.А., Седаков Р.О. и др. Гидрофизическая структура и динамика течения плюма реки Кодор // Океанология. 2020. (в печати).
Руководство по химическому анализу морских и пресных вод при экологическом мониторинге рыбохозяйственных водоемов и перспективных для промысла районов Мирового океана / ред. В.В. Сапожников. М.: Изд-во ВНИРО. 2003. 202 с.
Полухин А.А., Маккавеев П.Н. Особенности распространения материкового стока по акватории Карского моря // Океанология. 2017. Т. 57. № 1. С. 25–37.
Современные методы гидрохимических исследований океана / Ред. О.К. Бордовский, В.Н. Иваненков. М.: АН СССР. Ин-т Океанологии. 1992. 200 с.
Степанова С.В., Полухин А.А., Костылева А.В. Гидрохимическая структура вод в восточной части моря Лаптевых осенью 2015 г. // Океанология. 2017. Т. 57. № 1. С. 57–66.
Стунжас П.А. Разделение вод Енисея и Оби в Карском море по щелочности и кремнию // Океанология. 1995. Т. 35. № 2. С. 215–219.
Тищенко П.Я., Семкин П.Ю., Павлова Г.Ю. и др. Гидрохимия эстуария реки Туманной (Японское море) // Океанология. 2018. Т. 58. № 2. С. 192–204.
Тищенко П.Я., Стунжас П.А., Павлова Г.Ю. и др. Алгоритм расчета минерализации речных и солености эстуарных вод из данных электропроводности // Океанология. 2019. Т. 59. № 4. С. 591–599.
Химченко Е.Е., Серебряный А.Н. Внутренние волны на кавказском и крымском шельфах Черного моря (по летне-осенним наблюдениям 2011–2016 гг.) // Океанологические исследования. 2018. Т. 46. № 2. С. 69–87. https://doi.org/10.29006/1564-2291.JOR-2018.46(2).7
Якубенко В.Г., Востоков С.В., Силкин В.А. и др. Гидрофизические факторы формирования интенсивного “цветения” кокколитофориды Emiliania huxleyi в Абхазском секторе Черного моря в конце мая 2013 г. // Экология гидросферы. 2019. № 1 (3). С. 52–67. https://doi.org/10.33624/2587-9367-2019-1(3)-52-67
Kostyleva A.V., Podymov O.I., Makkaveev P.N., Polukhin A.A. Influence of small rivers runoff on the Hydrochemical structure of coastal waters of the north-eastern Black Sea // Coastal Engineering 2011: Conference proceedings, August 21–24, 2011, San-Diego, California. P. 286–297 / ISBN: 978-0-7844-1190-2.
Lewis E., Wallace D.W.R. 1998. Program Developed for CO2 System Calculations. ORNL/CDIAC-105. Carbon Dioxide Information Analysis Center, Oak Ridge National Laboratory, U.S. Department of Energy, Oak Ridge, Tennessee.
Milliman J.D., Farnsworth K.L., Albertin C.S. Flux and fate of fluvial sediments leaving large islands in the East Indies // J. Sea Res. 1999. V. 41. P. 97–107.
Mingazova N.M., Dbar R.S., Ivanova V.M. et al. Conditions of estuarine rivers of the Abkhazia Republic and their impact on the Black Sea coast // Marine Biological Journal. 2016. V. 1. № 4. P. 30–39. https://doi.org/10.21072/mbj.2016.01.4.04
Osadchiev A.A. Small mountainous rivers generate high-frequency internal waves in coastal ocean // Sci. Rep. 2018. V. 8. P. 1–8. 16 609.
Osadchiev A.A., Korshenko E.A. Small river plumes off the north-eastern coast of the Black Sea under average climatic and flooding discharge conditions // Ocean Sci. 2017. V. 13. P. 465–482.
Osadchiev A.A., Sedakov R.O. Spreading dynamics of small river plumes off the northeastern coast of the Black Sea observed by Landsat 8 and Sentinel-2 // Rem. Sens. Environ. 2019. V. 221. P. 522–533.
Osadchiev A.A., Zavialov P.O. Lagrangian model of a surface-advected river plume // Cont. Shelf. Res. 2013. V. 58. P. 96–106.
Zavialov P.O., Pelevin V.V., Belyaev N.A. et al. High resolution LiDAR measurements reveal fine internal structure and variability of sediment-carrying coastal plume // Estuar. Coast. Shelf Sci. 2018. V. 205. P. 40–45.
Дополнительные материалы отсутствуют.




