Океанология, 2021, T. 61, № 4, стр. 560-571
Встречаемость и распределение китообразных в северо-восточной части Черного моря
А. Д. Чернецкий 1, *, В. В. Краснова 1, А. Н. Болтунов 2, Е. М. Панова 1, А. В. Агафонов 1, Р. А. Беликов 1, Е. А. Беликова 1
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Научно-экспедиционный центр “Морские млекопитающие”
Москва, Россия
* E-mail: adcher@ocean.ru
Поступила в редакцию 14.11.2020
После доработки 27.11.2020
Принята к публикации 17.03.2021
Аннотация
Исследования черноморских китообразных были проведены в сентябре 2018 г. (11 сут, 799 км учетного маршрута) и июне 2019 г. (12 сут, 1174 км учетного маршрута). Судно следовало по учетному маршруту, расположенному у кавказского побережья Черного моря от г. Анапа до г. Адлер с удалением от берега до 165 км. Зарегистрировано 103 встречи китообразных (548 особей) в 2018 г. и 347 встреч (1280 особей) в 2019 г. Отмечены три вида: дельфин-белобочка, афалина и морская свинья, процентное соотношение которых составило 78.1 : 20.8 : 1.1 в 2018 г. и 90.1 : 7.1 : 2.8 в 2019 г. Белобочки встречались повсеместно, в июне чаще в прибрежной акватории, а сентябре – в открытом море, что, вероятно, определялось доступностью кормовых объектов. Для афалин и морских свиней, наряду с небольшими сезонными кочевками, отмечается привязанность к локальным прибрежным участкам обитания.
ВВЕДЕНИЕ
В Черном море обитает три вида китообразных: дельфин-белобочка (Delphinus delphis), афалина (Tursiops truncatus) и обыкновенная морская свинья, или азовка, (Phocoena phocoena), которые рассматриваются как эндемичные подвиды, обособленные от соседних средиземноморских популяций [1, 16, 25, 49]. В настоящее время все три вида черноморских китообразных включены в Красный список Международного союза охраны природы (МСОП). Кроме того, два из них занесены в Красную книгу РФ: афалина со статусом “сокращающиеся в численности и/или распространении” (2-И-II); азовка – “находящиеся под угрозой исчезновения” (1-КР-I).
Долгое время черноморские китообразные служили объектом масштабного промысла. Он предоставил обширный биологический материал, благодаря которому были получены данные по морфологии, анатомии и физиологии дельфинов [16]. Интенсификация промысла в 1930–1940-е гг. сопровождалась развитием авиаразведки состояния запасов черноморских китообразных, в результате чего появились первые сведения об их численности и распределении [10, 24]. Чрезмерный практически нерегулируемый промысел белобочки, афалины и азовки привел к критическому снижению их численности к середине XX века. Стала очевидной необходимость принятия мер по их изучению и сохранению, в результате чего в 1966 г. в СССР был введен мораторий на их добычу. С целью оценки численности китообразных, изучения особенностей их распределения и миграций в Черном море с 1976 по 1987 г. в СССР Югрыбпромразведкой и Одесским отделением АзЧерНИРО осуществлялись систематические ежегодные авианаблюдения за дельфинами и судовые учеты [14, 15, 18, 28]. Однако в 1990-е гг. эти исследования были прекращены.
С 2000-х гг. и по настоящее время исследования морских млекопитающих Черного моря, по сути, представлены разрозненными локальными работами отдельных научных коллективов. Судовые и авиационные учеты, береговые наблюдения черноморских китообразных были проведены преимущественно у побережья Крыма, в Керченском проливе и Азовском море, и в меньшей степени – в северо-восточной и северо-западной частях Черного моря [4, 5, 8, 11, 12, 27, 29].
После многолетнего перерыва Институт океанологии им. П.П. Ширшова РАН по инициативе и при поддержке ПАО “НК “Роснефть” в 2018 г. начал комплексные исследования китообразных в северо-восточной части Черного моря. Цель этого проекта – получение современных данных о состоянии популяций афалины, дельфина-белобочки и азовки, что имеет особую актуальность с учетом произошедших за последние десятилетия катастрофических изменений в экосистеме Черного моря [23, 35, 38, 45]. В этой статье представлены результаты двух морских экспедиций по изучению встречаемости и особенностей распределения китообразных в северо-восточной части Черного моря в осеннем и летнем сезонах 2018–2019 гг.
МАТЕРИАЛ И МЕТОДЫ
Судовые исследования проходили в северо-восточной части Черного моря в районе, ограниченном c севера 45°00′ с.ш., с юга 43°06′ с.ш. и с запада 36°30′ в.д., с 1 по 13 сентября 2018 г. и с 15 по 26 июня 2019 г. Работы были проведены с использованием парусно-моторной яхты типа Bavaria 42 длиной 13.4 м, оснащенной дизельным двигателем мощностью 55 л.с. Весь обследованный район был разделен на два неравных сектора: морской и прибрежный. Морской сектор располагался в исключительной экономической зоне РФ с максимальным удалением учетных маршрутов от берега до 165 км в 2018 г. и до 150 км в 2019 г. Прибрежный сектор располагался в пределах территориального моря РФ (12-мильная зона) от порта г. Анапа до Имеретинской бухты (г. Адлер). За два полевых сезона общая длина учетного маршрута составила 1973 км, всего было проведено 250 ч наблюдений (табл. 1).
Таблица 1.
Протяженность учетного маршрута и продолжительность визуальных наблюдений за черноморскими китообразными в 2018 и 2019 гг.
| Сектор | Дата | Длина учетного маршрута (км) | Продолжительность наблюдений |
|---|---|---|---|
| Сентябрь 2018 г. | |||
| Прибрежный | 1.09–4.09 | 308 | 45 ч 18 мин |
| Морской | 5.09–3.09* | 491 | 57 ч 42 мин |
| ИТОГО | 1.09–13.09 | 799 | 103 ч |
| Июнь 2019 г. | |||
| Прибрежный | 15.06–17.06; 21.06–26.06 | 220; 493 | 22 ч 50 мин; 65 ч 30 мин |
| Морской | 17.06–21.06 | 461 | 59 ч 10 мин |
| ИТОГО | 15.06–26.06 | 1174 | 147 ч 30 мин |
Наблюдения и регистрация встреч китообразных проводились только в светлое время суток. В морском секторе исследований в темное время суток яхта продолжала следовать по заданному маршруту, а в прибрежном секторе на ночь базировалась у причала или на якорной стоянке. Наблюдения проводились вахтовым методом. Каждая вахта продолжалась 2 ч с участием двух специалистов – наблюдателей правого и левого борта. Наблюдатели заносили в протокол сведения о дате и времени наблюдений, метеоусловиях (видимость, волнение, скорость и направление ветра), скорости, курсе и координатах яхты, видовом составе и количестве встреченных животных, направлении их перемещения и поведении. Каждая встреча соответствовала отдельному животному либо группе особей. Китообразных относили к одной группе, если расстояние между ними не превышало 100 м и животные имели сходное поведение [47, 50]. При описании поведения животных придерживались общепринятой классификации [40, 44, 48] с некоторыми дополнениями из-за специфики работ (яхта как фактор воздействия на дельфинов) и ограниченности обзора наблюдений (табл. 2).
Таблица 2.
Характеристика форм поведения черноморских китообразных
| Форма поведения | Описание |
|---|---|
| Перемещение | Размеренное движение в одном направлении с кратковременными погружениями под воду (≤30 с) |
| Подход к судну (исследовательское) | Подход животных к судну без последующего сопровождения |
| Сопровождение судна | Подход животных к судну и следование за ним в течение 3–5 мин и дольше |
| Социо-половое | Движение как при перемещении (размеренно в одном направлении со средней скоростью и интервалами нахождения под водой ≤30 с), но с элементами социо-полового поведения: параллельное и перекрестное плавание двух особей, контакты брюшными частями тела, садки, прикусывания друг друга |
| Охотничье (кормовое) | Движение животных хаотично с непостоянными интервалами погружения. У афалины и дельфина-белобочки наблюдаются прыжки с обилием брызг. Также возможно присутствие скопления птиц или выпрыгивающей рыбы |
Распределение китообразных в районе исследования оценивалось по их встречаемости в зависимости от (1) удаления от берега и (2) фактического местоположения в пределах всей обследованной акватории.
Для оценки распределения китообразных в зависимости от удаления от берега акватория моря была разбита на полосы шириной 5 км, расположенные параллельно береговой линии. В пределах каждой пятикилометровой полосы была определена длина пройденного судном учетного маршрута и рассчитано количество встреченных китообразных на 1 км этого пути. Учетный маршрут включал путь судна только в светлое время суток, когда велись визуальные наблюдения.
Для оценки встречаемости животных в пределах всей обследованной акватории район работ был разделен на квадраты 20 × 20 км. В каждом квадрате рассчитывалась встречаемость каждого вида китообразных на 1 км пути исходя из протяженности учетного маршрута судна и количества животных, встреченных на этом маршруте. Значения встречаемости, полученные для квадратов, в которых проходил учетный маршрут, были использованы для оценки встречаемости каждого вида китообразных на всей обследованной акватории с применением метода пространственной интерполяции ArcGIS.
Количество особей в группах оценивалось для прибрежной полосы (от 0 до 5 км от берега) и открытого моря (дальше 5 км от берега). Для каждого вида китообразных в разные сезоны наблюдений представлены медиана, минимальные и максимальные значения количества особей в группах, среднее значение и стандартное отклонение.
РЕЗУЛЬТАТЫ
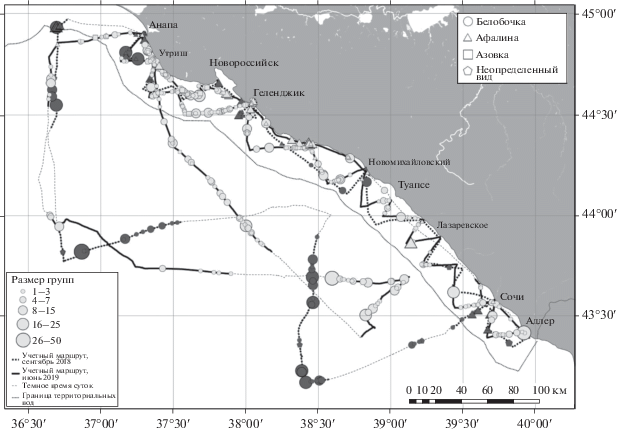
Общее количество китообразных, встреченных в ходе судовых наблюдений, составило 548 особей в сентябре 2018 г. и 1280 особей в июне 2019 г. (табл. 3). В оба сезона преобладали встречи белобочек, реже всего наблюдались азовки. Процентное соотношение учтенных белобочек, афалин и азовок составило 78.1 : 20.8 : 1.1 в сентябре 2018 г. и 90.1 : 7.1 : 2.8 в июне 2019 г. Сводные данные о встречах черноморских китообразных в период судовых наблюдений в 2018 и 2019 гг. приведены на рис. 1.
Таблица 3.
Число встреч и количество китообразных в период судовых наблюдений в июне и сентябре (2018–2019 гг.)
| Этапы наблюдений | Дельфин- белобочка | Афалина | Азовка | Вид не определен | Всего | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| встреч | особей | встреч | особей | встреч | особей | встреч | особей | встреч | особей | |
| Сентябрь 2018 г. | ||||||||||
| Морской | 43 | 353 | 7 | 35 | 0 | 0 | 6 | 10 | 56 | 398 |
| Прибрежный | 5 | 60 | 35 | 75 | 4 | 6 | 3 | 9 | 47 | 150 |
| Всего | 48 | 413 | 42 | 110 | 4 | 6 | 9 | 19 | 103 | 548 |
| Июнь 2019 г. | ||||||||||
| Прибрежный | 198 | 732 | 28 | 83 | 18 | 26 | 9 | 11 | 253 | 852 |
| Морской | 82 | 409 | 2 | 7 | 8 | 9 | 2 | 3 | 94 | 428 |
| Всего | 280 | 1141 | 30 | 90 | 26 | 35 | 11 | 14 | 347 | 1280 |
Рис. 1.
Распределение китообразных по маршруту следования судна в северо-восточной части Черного моря в сентябре (черные метки) и июне (серые метки) 2018–2019 гг.
Особенности распределения черноморских китообразных в районе исследований
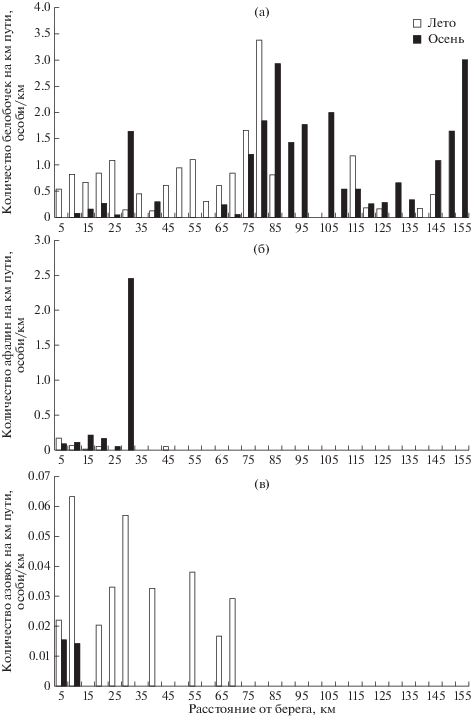
Дельфин-белобочка. В районе исследований дельфины-белобочки встречались практически по всей исследуемой акватории, с некоторыми отличиями в зависимости от сезона наблюдений. В июне дельфины наблюдались ближе к берегу: большая часть животных была зарегистрирована на удалении до 80 км от берега с максимальным показателем встречаемости 3.4 особи/км в полосе 75–80 км, за пределами которой количество встреч резко падает (рис. 2а). Встречаемость в прибрежной пятикилометровой полосе составила 0.54 особи/км. Напротив, в сентябре наблюдается некоторое перемещение дельфинов в открытое море: в прибрежной полосе животные вообще не наблюдались, а большая часть встреч была отмечена на удалении от 75 до 155 км от берега с максимальной встречаемостью в полосе 150–155 км (3 особи/км).
Рис. 2.
Встречаемость черноморских китообразных (особь/км) в зависимости от удаления от берега в сентябре 2018 г. и июне 2019 г.: (а) – дельфин-белобочка, (б) – афалина, (в) – азовка.
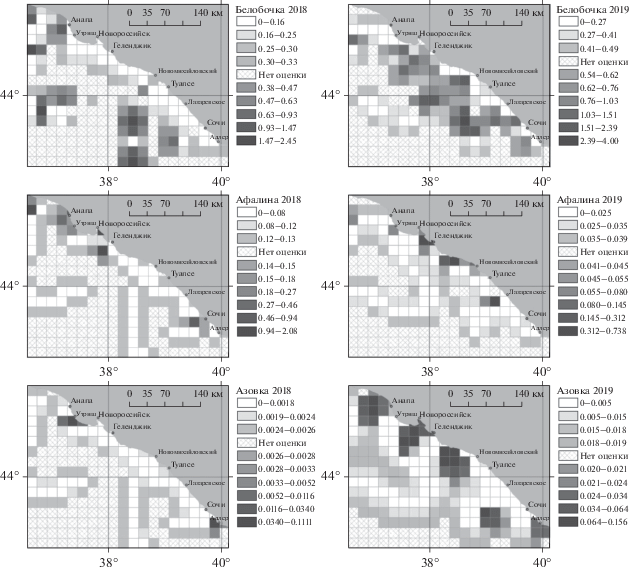
Максимальные значения встречаемости белобочек по пути следования судна в июне были выше, чем в сентябре, практически в два раза. Распределение дельфинов на маршруте было неравномерным и мозаичным (рис. 3). В июне большая встречаемость выявлена на широте г. Новороссийск (1.03–1.51 особей/км маршрута) и п. Новомихайловский (1.51–2.39 особей/км маршрута), а самая высокая встречаемость показана в южной части исследуемой акватории севернее г. Сочи (4 особи/км маршрута) (рис. 3). В сентябре наибольшая встречаемость (до 2.45 особей/км маршрута) белобочек была не только в южной части маршрута на широте г. Адлер–г. Сочи, но и в северной части исследуемой акватории – от г. Анапа до широты п. Б. Утриш и на широте г. Геленджик и г. Туапсе (рис. 3).
Рис. 3.
Распределение интерполированной встречаемости (особей на 1 км маршрута) афалины, белобочки и азовки в сентябре 2018 г. и июне 2019 г. по результатам судовых наблюдений.
Афалина. В июне район распределения афалины охватывал акваторию до 45 км от берега, при этом самая высокая встречаемость отмечалась в прибрежной пятикилометровой полосе (0.17 особей/км). Напротив, в сентябре на фоне общего сужения района их встречаемости (до 30 км от берега) отмечается незначительное смещение дельфинов дальше в море (рис. 2б). Встречаемость в пятикилометровой прибрежной полосе составила 0.09 особей/км, в полосе 10–15 км – 0.21 особей/км, а самая высокая встречаемость афалины (2.46 особей/км) была отмечена в полосе 25–30 км в шельфовой зоне в предпроливье Керченского пролива (рис. 2б).
Максимальные значения встречаемости афалин по маршруту следования судна были выше в сентябре, чем июне (рис. 3). Однако в целом, независимо от сезона наблюдений, распределение афалины вдоль берега было связано с относительно регулярными участками обитания. Так, в оба сезона исследований дельфины встречались на акватории в районе г. Геленджик–Геленджикская бухта (рис. 3). В целом же распределение афалин в сентябре было смещено от г. Геленджик на север в сторону г. Анапа и предпроливья Керченского пролива, а в июне – от г. Геленджик на юг в сторону п. Новомихайловский. Самая высокая встречаемость афалин составила 0.74 особей/км маршрута в июне и 2.08 особей/км маршрута – в сентябре (рис. 3).
Морская свинья, или азовка. Наибольшие значения встречаемости морских свиней как в июне, так и в сентябре были отмечены не далее 10 км от берега: 0.06 и 0.015 особей/км соответственно. Однако если в сентябре на большем удалении азовки вообще не встречались, то в июне несколько встреч было отмечено в полосе от 35 до 70 км от берега (рис. 2в).
На маршруте следования судна в июне максимальные значения встречаемости азовок была несколько выше, чем в сентябре (рис. 3). В июне на маршруте выявлены четыре района с высокой встречаемостью животных (от 0.2 до 0.16 особей/км): на северном участке маршрута в предпроливье Керченского пролива, вдоль побережья на широте г. Анапа и п. Новомихайловский и на южном участке маршрута на широте севернее г. Сочи. В сентябре единичные встречи морских свиней были приурочены к акваториям в районе г. Адлер и п. Большой Утриш (0.6 особи/км) (рис. 3).
Размер групп черноморских китообразных и их поведенческая активность
У белобочек количество особей в группах менялось в зависимости от сезона наблюдений и удаления от берега (табл. 4 ). Если в сентябре белобочки в прибрежной полосе (от 0 до 5 км) совсем не наблюдались, то в июне они встречались здесь группами до 12 особей (в среднем 4.23 ± ± 3.08 особей). Самые большие группы, насчитывавшие до нескольких десятков дельфинов, наблюдались в открытом море (от 5 км и дальше), причем в июне они были меньше по численности (3.97 ± 4.08 особей), чем в сентябре (8.60 ± ± 9.49 особей).
Таблица 4.
Размер групп китообразных, встреченных в прибрежной полосе и открытом море в сентябре 2018 г. и июне 2019 г. Представлены медиана (Me), минимальные (Min) и максимальные (Max) значения количества особей в группах, среднее значение и стандартное отклонение (M ± SD)
| Удаленность от берега | Дельфин-белобочка | Афалина | Азовка | |
|---|---|---|---|---|
| Сентябрь 2018 г. | ||||
| Прибрежная полоса (<5 км) | Me (Min–Max) | – | 2 (1–5) | 1 (1–2) |
| M ± SD | 2.3 ± 1.15 | 1.33 ± 0.58 | ||
| n = 10 | n = 3 | |||
| Открытое море (>5 км) | Me (Min–Max) | 4 (1–50) | 2 (1–10) | 2 |
| M ± SD | 8.60 ± 9.49 | 2.71 ± 1.81 | ||
| n = 48 | n = 32 | n = 1 | ||
| Июнь 2019 г. | ||||
| Прибрежная полоса (<5 км) | Me (Min–Max) | 3 (1–12) | 2.5 (1–10) | 1 (1–3) |
| M ± SD | 4.23 ± 3.08 | 3.13 ± 2.27 | 1.5 ± 0.84 | |
| n = 52 | n = 22 | n = 6 | ||
| Открытое море (>5 км) | Me (Min–Max) | 3 (1–30) | 1.5 (1–7) | 1 (1–3) |
| M ± SD | 3.97 ± 4.08 | 2.75 ± 2.3 | 1.3 ± 0.57 | |
| n = 232 | n = 8 | n = 20 | ||
У афалин размер групп мало варьировал (табл. 4 ). Чаще всего встречались группы из двух животных, наиболее крупные насчитывали 5–10 особей.
Встречи морских свиней, независимо от сезона наблюдений и расстояния от берега, чаще всего были представлены одиночными животными (табл. 4 ). В июне наблюдались группы до 3 особей (1.5 ± 0.84 особей в прибрежной полосе и 1.3 ± ± 0.57 особей в открытом море). В сентябре в прибрежной полосе размер группы не превышал двух особей (1.33 ± 0.58 особей), а в открытом море была зарегистрирована единственная встреча группы из двух животных.
Поведенческая активность у белобочек и афалин менялась в зависимости от сезона наблюдений (табл. 5). В сентябре у белобочек преобладало поведение, “сфокусированное” на экспедиционном судне: подходы к яхте и ее сопровождение наблюдалось в 63% случаев. Самое длительное сопровождение яхты у белобочек наблюдалось 2 и 3 сентября 2018 г., когда большие группы (порядка 50 животных) преследовали судно в течение 45 мин. Напротив, в июне самой распространенной формой активности у этого вида дельфинов было перемещение по акватории и охота.
Таблица 5.
Встречаемость различных форм поведения у черноморских китообразных в осенний и летний сезоны наблюдений
| Форма поведения | Сентябрь 2018 г. | Июнь 2019 г. | ||||
|---|---|---|---|---|---|---|
| Дельфин-белобочка | Афалина | Азовка | Дельфин-белобочка | Афалина | Азовка | |
| Перемещение | 16% (n = 8) | 60% (n = 24) | 100% (n = 4) | 45% (n = 126) | 41% (n = 12) | 96% (n = 24) |
| Подход к яхте (исследовательское) |
24% (n = 12) | 20% (n = 8) | – | 17% (n = 48) | 21% (n = 6) | 4% (n = 1) |
| Сопровождение яхты | 39% (n = 19) | 5% (n = 2) | – | 17% (n = 49) | 14% (n = 4) | – |
| Охотничье | 16% (n = 8) | 15% (n = 6) | – | 20% (n = 55) | 24% (n = 7) | – |
| Социо-половое | 4% (n = 2) | – | – | 1% (n = 2) | – | – |
Афалины независимо от сезона наблюдений большую часть своего времени тратили на перемещения по акватории (табл. 5). Однако в июне у них чаще отмечалось охотничье поведение, и в то же время они чаще стали сопровождать яхту.
Самое однообразное поведение наблюдалось у азовок. Как правило, животные проплывали мимо яхты с очень короткими вынырами (несколько секунд) и только однажды подошли близко к борту яхты (табл. 5).
ОБСУЖДЕНИЕ
Известно, что на распределение и перемещение китообразных, в том числе и дельфинов, влияет большое количество факторов. К ним относятся наличие и доступность кормовых объектов [16, 33], температура поверхности моря [36, 44], строение морского дна [41], время года и суток [21, 31, 44], а также гидрологические условия, например, приливно-отливное состояние воды [40].
Несмотря на сравнительно небольшой объем материала, полученный в ходе двух экспедиций, были выявлены сезонные особенности пространственного распределения, структуры групп и поведенческой активности черноморских китообразных.
Дельфин-белобочка
В районе исследований по результатам наблюдений чаще всего и практически повсеместно встречались белобочки, которые действительно являются самым распространенным и многочисленным видом морских млекопитающих Черного моря [7, 14, 16, 21].
В целом, полученные современные данные о структуре групп и перемещениях белобочек в северо-восточной части Черного моря в июне и сентябре подтверждают выявленные ранее закономерности сезонного распределения этих дельфинов по результатам судовых и авиационных учетов 1970–80-х гг. [21].
В июне белобочки наблюдались по всему морю, наиболее часто встречаясь в полосе от 0 до 80 км от берега. Дельфины формировали небольшие группы, размер которых существенно не менялся с расстоянием от берега (среднее количество особей в группе в прибрежной пятикилометровой полосе составляло 4.0; в открытом море – 4.2). В бюджете времени у наблюдаемых белобочек преобладали охотничье поведение и перемещения, которые могли быть вызваны активным поиском добычи. Известно, что кормовые ресурсы редко распределяются равномерно в окружающей среде, что требует от дельфинов постоянных перемещений между возможными местами нагула [44]. В то же время было показано, что чем равномернее распределяются кормовые объекты в пространстве, тем мельче размеры групп у охотящихся дельфинов [32].
К сентябрю отмечается некоторое смещение белобочек в открытое море (рис. 2а): наибольшее количество животных наблюдалось за пределами 80-километровой полосы. По сравнению с июнем, на фоне общего понижения встречаемости белобочек в районе исследования у них отмечается укрупнение групп (среднее количество особей в группе – 8.6) или “скосячивание” [6, 21]. По визуальным наблюдениям, самая большая группа насчитывала порядка 50 особей, скопления численностью от 100 и более особей, характерные для этих дельфинов [16, 21, 30], не наблюдались. Несмотря на то, что в сентябре активность встреченных животных преимущественно была сфокусирована на экспедиционном судне, что проявлялось в регулярных подходах к яхте и продолжительном ее сопровождении, доля охотничьего поведения у белобочек была сопоставима с таковой в июне (16 и 20% соответственно). Вероятно, наблюдаемое пространственное перераспределение белобочек и увеличение размеров их групп было вызвано смещением кормовых объектов с прибрежной акватории и их концентрацией в открытом море. Действительно, было показано, что обитающие вдали от берега дельфины при неравномерном распределении ресурсов в присутствии крупных рыбных косяков обычно охотятся большими группами [32, 50]. Сопровождение дельфинами яхты, возможно, также являлось следствием увеличения размеров их групп: считается, что в больших группах белобочки более стрессоустойчивы, благодаря чему начинают подходить к судам и реже их избегают [44].
Похожая схема сезонного распределения белобочек наблюдается и в других районах их обитания, например, в заливе Меркурия о. Северный Новой Зеландии [44] и в Ирландском море [39]. Авторы этих исследований связывают местные сезонные колебания численности белобочек с наличием пищи, обилие которой, в свою очередь, зависит от температуры поверхностной воды. Напротив, распределение белобочек в заливе Айлендс (о. Северный, Новая Зеландия) имело противоположный характер: зимой (июнь–август) с понижением температуры воды животные перемещались ближе к берегу, а летом (декабрь–февраль) чаще встречались на глубоководье вдали от залива. Предположительно, в этом районе распределение питательных веществ и добычи главным образом зависит от гидрологических условий в заливе, а не от температуры поверхностной воды [34].
Таким образом, дельфины-белобочки, традиционно рассматриваемые как пелагический вид [7], встречались не только в открытых, но и в прибрежных водах северо-восточной части Черного моря, что было показано и в более ранних исследованиях [21]. Несмотря на то, что состав и обилие кормовых объектов черноморских китообразных не являлись предметом исследования данной работы, в результате анализа поведенческой активности белобочек прослеживается связь их сезонного распределения с доступностью пищевых ресурсов [7, 16]. Спектр питания белобочек в Черном море широк и может варьировать в течение года, определяясь текущим обилием, распределением и стадией жизненного цикла конкретных видов рыб [16, 17, 22]. Обнаруженная повышенная встречаемость дельфинов на акваториях вблизи портовых городов, вероятно, также вызвана наличием кормовых объектов в этих районах. Действительно, нетипичное для белобочек обитание в урбанизированных районах с высоким риском антропогенного воздействия связывают с предсказуемостью распределения пищевых ресурсов в прибрежных водах, что повышает у дельфинов эффективность нагула [42, 43]. В свою очередь, увеличение количества учтенных белобочек в июне по сравнению с сентябрем, вероятно, главным образом было вызвано перемещением дельфинов в прибрежную акваторию моря, где проходил основной маршрут исследовательского судна.
Афалина
В районе исследований афалины наблюдались чаще всего парами или небольшими группами до 10 особей, средний размер которых практически не зависел от места и времени наблюдений. Небольшой размер групп характерен не только для черноморских афалин, но и вида в целом [19, 28, 46].
Результаты регулярных авиаучетов, проведенных в 1970–80-е гг., показали, что черноморские афалины обитают на всей акватории моря, совершая в течение года сезонные кочевки [19]. Отмечается, что ранней весной дельфины чаще встречаются у побережья, к середине лета распространяются по всему морю, предпочитая открытые воды, а к осени вновь смещаются ближе к берегу. Согласно этим данным, в общей сложности встречаемость афалин в открытом море была лишь на 28% ниже, чем в прибрежной акватории, ширина которой была принята равной 50 км в районе кавказского берега и 75 км – в предпроливье Керченского пролива со стороны моря. Напротив, в наших исследованиях независимо от сезона наблюдений район распространения афалин не превышал 50-километровую зону моря, которая по Ю.А. Михалеву [19] соответствует “прибрежной акватории”. Кроме того, в более мелком масштабе анализа показана привязанность дельфинов в июне к пятикилометровой прибрежной полосе, а сентябре на фоне некоторого сужения общего района встречаемости отмечается заметное смещение животных дальше в открытое море. Наибольшее количество афалин наблюдали на акватории предпроливья Керченского пролива в полосе 25–30 км от берега. Вероятно, это было связано с тем, что акватория предпроливья, в отличие от кавказского берега, представлена обширной шельфовой зоной (до 50 км), которая является предпочтительным местом обитания афалин [16, 22, 28]. С другой стороны, такой выброс данных по встречаемости дельфинов на этом участке акватории может иметь методологическое объяснение: путь, пройденный исследовательским судном в пределах 25–30-километровой полосы, был самым коротким на учетном маршруте, что повлияло на расчеты встречаемости афалин. Следует добавить, что похожая схема сезонных перемещений отмечалась у афалин в районе западного побережья п-ова Крым: в июле дельфины наблюдались у берега, а в конце лета откочевывали дальше в море [13].
В отличие от белобочек, по результатам этого исследования показана некоторая привязанность черноморских афалин к прибрежным локальным участкам акватории, что соответствует общим представлениям о распределении этого вида [2, 3, 9, 16, 37]. Вероятно, одним из таких мест является акватория Геленджикской бухты. Таким образом, мнение о широком распространении афалин в пелагических водах Черного моря [19] до сих пор остается дискуссионным.
Количество учтенных афалин в районе исследования было значительно ниже, чем белобочек (в июне – на порядок), но больше, чем азовок, что в целом соответствует долевому соотношению этих видов в Черном море, представленному по результатам авиаучетов 1970–80-х гг.: 24.3% : 68.1% : 7.6% [19].
Морская свинья, или азовка
Самыми редкими китообразными на исследуемой акватории были морские свиньи. Однако такое соотношение численности трех видов в Черном море было не всегда. Так, в период промысла количество добытых азовок было меньше белобочек, но значительно превышало число отловленных афалин, и их количественное соотношение составляло 10 : 200 : 1 [26]. Позднее, после объявленного моратория на промысел, по результатам авианаблюдений начала 1970-х гг., численность азовок уже была представлена практически в равных долях с афалинами (азовка 12 : белобочка 77 : афалина 11) [14]. Наконец, по данным последних регулярных авиаучетов [19, 20], количество азовок в Черном море значительно сократилось. Вероятно, промысел, а также истощение кормовой базы нанесли ущерб популяции черноморских морских свиней, после чего их численность так и не восстановилась.
В то же время низкое число учтенных азовок отчасти могло быть связано с особенностями внешнего вида и поведения этих животных [20]. Действительно, небольшие размеры тела с невысоким спинным плавником и кратковременное появление на поверхности воды для вдоха между погружениями усложняли визуальный учет морских свиней с борта яхты.
По результатам проведенных исследований, морские свиньи наблюдались как в прибрежной акватории, так и на значительном удалении от берега. Таким образом, полученные данные согласуются с общими закономерностями распределения азовок в черноморском регионе, выявленными на основе анализа авиаучетных карт 1970–1980-х гг.: преимущественно обитая в прибрежных мелководных районах, морские свиньи также регулярно наблюдались в открытом море [20]. Причем при обоих видах учета в летний и осенний сезоны наибольшая их встречаемость была приурочена к шельфовой зоне между Керченским проливом и г. Новороссийском [20; собственные наблюдения]. Считается, что для морских свиней в летне-осеннее время характерна привязанность к одним и тем же районам Черного моря на период размножения, где они образуют предположительно обособленные скопления [20]. По всей видимости, обнаруженные морские свиньи могут принадлежать к “крымско-кавказскому” скоплению, основная часть которого весной совершает миграции в Азовское море вслед за азовской хамсой (Engraulis encrasicolus maeoticus), осенью возвращаясь обратно, а некоторая часть из них постоянно обитает в черноморских водах, в том числе у кавказского побережья.
По сравнению с сентябрем, рост встречаемости азовок, наблюдаемый в июне, вероятно, во многом был обусловлен особенностями учетного маршрута, прибрежная часть которого в летнем сезоне была значительно длиннее (см. табл. 1).
ЗАКЛЮЧЕНИЕ
Впервые после многолетнего перерыва представлены результаты морских наблюдений за китообразными в северо-восточной части Черного моря. Показаны некоторые особенности распределения дельфинов-белобочек, афалин и морских свиней в летнем и осеннем сезонах наблюдений. Наиболее выраженные сезонные перемещения, которые, вероятно, определялись главным образом доступностью и обилием кормовых объектов, были характерны для белобочек. В отличие от белобочек, у афалин и морских свиней, наряду с небольшими сезонными кочевками, отмечается привязанность к локальным прибрежным участкам обитания. Численное соотношение трех видов черноморских китообразных изменилось со времен окончания промысла, но, вероятно, осталось без изменений с периода регулярных авиаучетов конца XX столетия. Получение актуальных оценок состояния популяции черноморских китообразных требует продолжения начатых работ и расширения района исследований.
Благодарности. Авторы выражают благодарность экипажу яхты “Arial” за помощь проведения морских исследований.
Источники финансирования. Работа была выполнена в рамках совместного договора ИО РАН и ПАО “НК “Роснефть” “Изучение и мониторинг морских млекопитающих как индикаторов устойчивого состояния экосистем Черного моря” и Госзадания 0149-2019-0009.
Список литературы
Барабаш-Никифоров И.И. Фауна китообразных Черного моря, ее состав и происхождение. Воронеж: Изд-во Воронеж. гос. ун-та., 1940. С. 1070–1074.
Белькович В.М. Поведение и биоакустика дельфинов // Сборник статей под ред. Бельковича В.М. М.: ИО АН СССР. 1978. 199 с.
Белькович В.М. Поведение и биоакустика китообразных // Сборник статей под ред. Бельковича В.М. М.: ИО АН СССР. 1987. 218 с.
Биркун А.А., Кривохижин С.В. Распределение и тенденции в динамике численности китообразных у берегов Крыма // Морские млекопитающие Голарктики. Тез. докл. межд. конф. Архангельск, 2000. С. 23–27.
Биркун А.А. мл., Кривохижин С.В., Глазов Д.М. и др. Оценка численности китообразных в прибрежных водах северной части Черного моря: результаты судовых учетов в августе–октябре 2003 г. // Морские млекопитающие Голарктики. Тез. докл. III межд. конф. Коктебель, Крым, Украина, 2004. С. 64–67.
Бушуев С.Г. Основные результаты авианаблюдений черноморских дельфинов в 1970–80-х гг. // Морские млекопитающие Голарктики. Тез. докл. II межд. конф. Байкал, Россия, 2002. С. 60–61.
Гептнер В.Г., Чапский К.К., Арсеньев В.А., Соколов В.Е. Млекопитающие Советского Союза. Под ред. В. Г. Гептнера и Н. П. Наумова. Том II. Часть 3. Ластоногие и зубатые киты / Под ред. Гептнера В.Г. М.: Высшая школа, 1976. 718 с.
Гладилина Е.В., Гольдин Е.Б., Гольдин П.Е. Наблюдения китообразных в прибрежных водах юго-восточного Крыма в 2006–2008 гг. // Морские млекопитающие Голарктики. Тез. докл. V межд. конф. Одесса, Украина, 2008. С. 198–201.
Гладилина Е.В. Структура локальных популяций и биология афалины (Tursiops truncatus) в прибрежных водах северо-восточной части Черного моря // Диссертация на соискание ученой степени кандидата биол. наук. Киев, 2017. 167 с.
Голенченко А.П. Наставление по авиационной разведке рыбы и дельфина в Азово-Черноморском бассейне. М.: Вып. Пищепромиз, 1955. 44 с.
Гольдин Е.Б. Китообразные в Керченском проливе и эколого-географический метод в их изучении // Морские млекопитающие Голарктики. Тез. докл. V межд. конф. Одесса, Украина, 2008. С. 208–214.
Гольдин Е.Б. Китообразные прибрежной зоны южного Крыма: современная ситуация // Морские млекопитающие Голарктики. Тез. докл. VIII межд. конф. Санкт-Петербург, 2014. Т. I. С. 148–157.
Затевахин И.И. Особенности распределения и ритмики активности афалины у западного побережья Крыма // Изучение, охрана и рациональное использование морских млекопитающих. Тез. докл. Восьмого всесоюз. совещ. Астрахань, 1982. С. 134–136.
Земский В.А. Сколько дельфинов в Черном море? // Природа. 1975. № 6. С. 97–98.
Земский В.А., Михалев Ю.А., Минеев В.Н., Боровской В.С. Опыт наблюдения за черноморскими дельфинами с судна и самолета // Морские млекопитающие. Тез. докл. IX Всесоюз. совещ. 1986. С. 152–154.
Клейненберг С.Е. Млекопитающие Черного и Азовского морей. Опыт биолого-промыслового исследования. М.: Издательство Академии наук СССР, 1956. 288 с.
Кривохижин С.В., Биркун, А.А. мл. Спектр питания китообразных в Черном море // Морской экологический журн. 2009. Т. 8. № 4. С. 67–78.
Михалев Ю.А., Савусин В.П., Зеленая Ф.Е. О численности черноморских дельфинов // Морские млекопитающие. Тез. докл. VII всесоюз. совещ. М.: ВНИРО, 1978. С. 226–227.
Михалев Ю.А. Особенности распределения афалины, Tursiops truncatus (Cetacea), в Черном море // Вестник зоологии. 2005. Т. 39(3). С. 29–42.
Михалев Ю.А. Особенности распределения морской свиньи, Phocoena phocoena relicta (Cetacea), в Черном море // Вестник зоологии. 2005. Т. 39(6). С. 25–35.
Михалев Ю.А. Особенности распределения белобочки, Delphinus delphis (Cetacea), в Черном море // Вестник зоологии. 2008. Т. 42(4). С. 325–337.
Томилин А.Г. Звери СССР и прилежащих стран. Том IX. Китообразные. М.: Издательство Академии наук СССР, 1957. 756 с.
Хорошилов В.С., Лукашева Т.А. Изменения зоопланктонного сообщества Голубой бухты после вселения в Черное море гребневика мнемиопсиса // Океанология. 1999. Т. 33. № 4. С. 558–562.
Цалкин В.И. Научно-промысловая разведка на Черном море в 1936 г. // Рыбное хозяйство СССР. 1937. № 5. С. 16–17.
Цалкин В.И. Морфологическая характеристика, систематическое положение и зоографическое значение морской свиньи Азовского и Черного морей // Зоол. журн. 1938. Т. 17. Вып. 4. С. 705–732.
Цалкин В.И. Материалы к биологии морской свиньи (Phocoena phocoena relicta Abel) Азовского и Черного морей // Зоол. журн. 1940. Т. 19. Вып. 1. С. 160–171.
Шпак О.В., Глазов Д.М., Крюкова А.А., Мухаметов Л.М. Применение метода фотоидентификации с целью изучения сезонного распределения черноморских дельфинов вдоль курортного побережья Большого Сочи // Морские млекопитающие Голарктики. Тез. докл. IV межд. конф. Санкт-Петербург, 2006. С. 561–563.
Яскин В.А., Юхов В.Л. Численность и распределение черноморских афалин // Черноморская афалина Tursiops truncatus ponticus: Морфология, физиология, акустика, гидродинамика / Ред. Соколов В.Е., Романенко Е.В. М.: Наука. 1997. С. 19–26.
Birkun A., Glazov D., Krivokhizin S., Mukhametov L. First aerial surveys of cetaceans in the Azov Sea and Kerch Strait // Bul. ACCOBAMS. 2002. № 4. P. 25–27.
Birkun A. Jr., Northridge S.P., Willsteed E.A., James F.A., Kilgour C., Lander M., Fitzgerald G.D. Studies for Carrying Out the Common Fisheries Policy: Adverse Fisheries Impacts on Cetacean Populations in the Black Sea // Final report to the European Commission. Brussels. 2014. 347 p.
Bräger S. Diurnal and seasonal behavior patterns of bottlenose dolphins (Tursiops truncatus) // Mar. Mammal. Sci. 1993. V. 9. P. 434–438.
Burgess E.A. Foraging ecology of common dolphins (Delphinus sp.) in the Hauraki Gulf, New Zealand // Master of Science (Zoology). Massey University Albany, New Zealand, 2006. 143 p.
Cockcroft V.G., Peddemors V.M. Seasonal distribution and density of common dolphins, Delphinus delphis, off the south-east coast of Southern Africa // South African J. of Marine Science. 1990. V. 9. P. 371–377.
Constantine R., Baker C.S. Monitoring the commercial swim-with-dolphins operations in the Bay of Islands // Wellington, New Zealand: Department of Conservation, 1997. 59 p.
Daskalov G.M. Overfishing drives a trophic cascade in the Black Sea // Marine Ecology Progress Series. 2002. V. 225. P. 53–63.
Gaskin D.E. 1968. Distribution of Delphinidae (Cetacea) in relation to sea surface temperatures off eastern and southern New Zealand // N. Z. J. Mar. Freshwater Res. 1968. V. 2. P. 527–534.
Genov T., Kotnijek P., Lesjak J., Hace A., Fortuna C.M. Bottlenose dolphins (Tursiops truncatus) in Slovenian and adjacent waters (Northern Adriatic Sea) // ANNALES. Ser. hist. nat. 2008. V. 18.2. P. 227–244.
Gomoiu M.T. Scapharca inaequivalvis (Bruguière), a new species in the Black Sea // Cercetãri marine / IRCM. 1984. V. 17. P. 131–141.
Goold J.C. Acoustic assessment of populations of common dolphin off the West Wales coast, with perspectives from satellite infra-red imagery // J. Mar. Biol. Assoc. U. K. 1998. V. 78. P. 1353–1364.
Hanson M.T., Defran R.H. The behaviour and feeding ecology of the Pacific coast bottlenose dolphin, Tursiops truncates // Aquatic Mammals. 1993. V. 19. P. 127–142.
Hui C.A. Undersea topography and distribution of the genus Delphinus in the Southern California Bight // J. Mammal. 1979. V. 60. P. 521–527.
Mason S., Salgado K.C., Donnelly D., Weir J., Bilgmann K. Atypical residency of short-beaked common dolphins (Delphinus delphis) to a shallow, urbanized embayment in south-eastern Australia // R. Soc. Open Sci. 2016. Sep 28; 3(9):160478. https://doi.org/10.1098/rsos.160478
Meynier L., Pusineri C., Spitz J., Santos M.B., Pierce G.J., Ridoux V. Intraspecific dietary variation in the short-beaked common dolphin Delphinus delphis in the Bay of Biscay: importance of fat fish // Mar. Ecol. Progr. Ser. 2008. V. 354. P. 277–288. https://doi.org/10.3354/meps 07246
Neumann D.R., Orams M.D. Behaviour and ecology of common dolphins (Delphinus delphis) and the impact of tourism in Mercury Bay, North Island, New Zealand // Science for conservation 254. Wellington: Department of Conservation, 2005. 40 p.
Purcell J.E., Shiganova T.A., Decker M.B., Houde E.D. The ctenophore Mnemiopsis in native and exotic habitats: U.S. estuaries versus the Black Sea basin // Hydrobiologia. 2001. V. 451. P. 145–176.
Scott M.D., Wells R.S., Irvine A.B. A long-term study of bottlenose dolphins on the West coast of Florida // In: The Bottlenose Dolphin / Leatherwood S., Reeves R.R. (eds.). San Diego: Academic Press, 1990. P. 235–244.
Shane S.H., Wells R.S., Würsig B. Ecology, behavior and social organization of the bottlenose dolphin: a review // Mar. Mamm. Sci. 1986. V. 2(1). P. 34–63.
Shane S.H. Behaviour and ecology of the bottlenose dolphin at Sanibel Island, Florida // In: The bottlenose dolphin / Leatherwood S., Reeves R.R. (eds.). San Diego: Academic Press, 1990. P. 245–265.
Viaud-Martinez K.A., Vergara M.M., Gol’din P.E. et al. Morphological and genetic differentiation of the Black Sea harbor porpoise Phocoena phocoena // Mar. Ecol. Progr. Ser. 2007. V. 338. P. 281–294.
Wells R.S., Scott M.D. Bottlenose dolphin Tursiops truncatus (Montagu, 1821) // In: Handbook of marine mammals / Ridgway S.H., Harrison R. (eds.). V. 6: The second book of dolphins and the porpoises. San Diego, CA, USA: Academic Press, 1999. P. 137–182.
Дополнительные материалы отсутствуют.


