Океанология, 2022, T. 62, № 2, стр. 315-323
О методике подготовки образцов для анализа водных палиноморф
Т. С. Клювиткина 1, *, Е. А. Новичкова 2, **
1 Московский государственный университет имени М.В. Ломоносова,
географический факультет
Москва, Россия
2 Институт океанологии имени П.П. Ширшова РАН
Москва, Россия
* E-mail: t.klyuvitkina@mail.ru
** E-mail: enovichkova@mail.ru
Поступила в редакцию 05.10.2021
После доработки 19.11.2021
Принята к публикации 16.12.2021
- EDN: NPGXUJ
- DOI: 10.31857/S0030157422020095
Аннотация
Анализ водных палиноморф широко используется для палеоокеанологических реконструкций. Для извлечения этих микроорганизмов из осадка применяется методика, включающая в себя обработку осадка соляной (HCl) и фтористоводородной (HF) кислотами и последующую фильтрацию. Конечная цель такой обработки — удаление из образца минеральной составляющей и получение на выходе исключительно органики. Однако в готовом препарате нередко сохраняются нерастворимые минеральные кристаллы, осложняющие проведение микроскопного анализа. С помощью электронной микроскопии определено происхождение таких кристаллов. Стандартная методика обработки проб скорректирована с целью исключения или минимизации их появления. Предложены решения для предотвращения образования фторидов кальция, калия и алюминия, а также для удаления остатков разложения кварца и алюмосиликатных минералов.
ВВЕДЕНИЕ
Для палеоокеанологических реконструкций основных параметров поверхностных и придонных вод Мирового океана широко применяются различные микропалеонтологические методы. Среди них важную роль играет анализ непыльцевых палиноморф и, в частности, водных палиноморф. Он очень востребован благодаря современным данным по систематике и распространению этой группы микроорганизмов в осадках Мирового океана.
Видовое и количественное распределение водных палиноморф в поверхностных морских осадках зависит от современных гидрологических параметров, что позволяет успешно использовать эти микроорганизмы в палеореконструкциях [14, 16, 18, 20, 25 и др.]. Среди водных палиноморф самыми информативными считаются органостенные цисты динофлагеллят (диноцисты), с их помощью можно восстанавливать температуру и соленость морских поверхностных вод, распространение различных водных масс, ледовые условия и т.п. В настоящее время существует и постоянно пополняется обширная международная база данных по диноцистам из поверхностных осадков практически всех морей земного шара [6, 8, 20, 25 и др.]. В качестве индикаторов речного стока и изменений его интенсивности используются пресноводные зеленые водоросли, а также их количественное соотношение с цистами динофлагеллят [13 и др.]. В составе водных палиноморф встречаются также акритархи, органические части фораминифер и других водных микроорганизмов.
Для извлечения водных палиноморф из осадка применяется методика, имеющая различные вариации, но в целом включающая в себя три основных этапа: обработку осадка соляной (HCl) и фтористоводородной (HF) кислотами и последующее вымывание лишних фракций путем фильтрации через сита с диаметром пор 10 мкм и 120 мкм (именно в этом интервале находятся размеры изучаемых нами микроскопических объектов) [7, 15, 19 и др.]. Конечная цель такой пробоподготовки – как можно более полное удаление минеральной составляющей и получение на выходе образца, обогащенного органическим веществом и содержащего непыльцевые палиноморфы. Вместе с тем иногда приходится сталкиваться с технической проблемой, осложняющей проведение микроскопного анализа. Так, в готовых препаратах из проб разного географического и геологического происхождения, обработанных в разных лабораториях, нередко в большом количестве встречаются нерастворимые прозрачные кристаллы разнообразной формы. Их размер составляет примерно 10–100 мкм, следовательно, они не могут быть удалены механическим путем при фильтрации. Наличие этих зерен существенно затрудняет, а иногда делает невозможным просмотр препаратов и подсчет палиноморф. Очевидно, что методика обработки проб на анализ водных палиноморф должна быть скорректирована таким образом, чтобы исключить либо свести к минимуму присутствие в препарате нерастворимых минеральных остатков.
Целью данного исследования стал выбор наилучшей техники обработки проблемных образцов с кристаллами различной формы и происхождения, оставшимися после лабораторного приготовления препаратов.
ВОЗМОЖНОСТИ И ОГРАНИЧЕНИЯ РАЗНЫХ МЕТОДИК ИЗВЛЕЧЕНИЯ ИЗ ОСАДКА ОРГАНИЧЕСКИХ МИКРООРГАНИЗМОВ
Группу водных палиноморф объединяет одно важное свойство: их оболочки представляют собой органические соединения. Оболочка цист динофлагеллят состоит из устойчивого биополимера, называемого диноспорином. По составу он близок к спорополленину (материалу оболочек пыльцы и спор наземных растений), поэтому считается, что водные палиноморфы могут быть определены в палинологических препаратах [9]. Это действительно так, и палинологи нередко обнаруживают, идентифицируют и подсчитывают диноцист в своих пробах. Однако методики приготовления препаратов для этих двух видов анализа во многом отличаются. Для извлечения пыльцы и спор из осадочных пород традиционно применяется сепарационный метод В.П. Гричука, известный еще с начала прошлого века [1, 4] и не потерявший своей актуальности и сегодня. Его суть заключается в разделении пробы на две фракции при помощи тяжелой жидкости (например, йодистого кадмия, жидкости Туле, бромоформа, поливольфрамата натрия и др.). При смешивании осадка с жидкостью с удельным весом, большим, чем у пыльцы и спор, органические частицы всплывают, а минеральные тонут. Кроме этого метода, в спорово-пыльцевом анализе допускается кипячение породы в 10% растворе едкой щелочи (КОН или NaOH) и в 10% соляной кислоте для диспергирования и удаления карбонатов соответственно. Для проб, богатых органикой, используется ацетолиз — обработка уксусным ангидридом и серной кислотой. Все эти методические подходы, используемые в разных сочетаниях, позволяют получить практически безупречного качества препарат, пригодный и удобный для микроскопного исследования, а благодаря использованию тяжелой жидкости проблемы наличия в препарате большого количества крупных нерастворимых минеральных зерен в спорово-пыльцевом анализе не существует.
Методика, принятая для анализа четвертичных водных палиноморф, отличается от палинологической и, к сожалению, имеет ряд ограничений. Одно из самых существенных заключается в том, что тяжелая жидкость для разделения проб по фракциям может использоваться лишь в исключительных случаях. Дело в том, что многие цисты динофлагеллят относятся к так называемому хоратному типу — имеют сильно развитые выросты, шипы или иную орнаментацию разной формы и размеров. Выросты часто сложно ветвятся, срастаются основаниями или вершинами, образуют гребни или сетчатую внешнюю оболочку. Такие выросты, густо покрывающие поверхность цисты, могут собирать на себя минеральные частицы и вместе с ними опускаться в тяжелой жидкости на дно [7, 20, 21, 24 и др.]. Следовательно, использование тяжелой жидкости может приводить к потерям диноцист и ошибкам в статистических подсчетах [7, 21, 24].
Кроме того, из-за риска разрушения или повреждения цист динофлагеллят невозможно использование ацетолиза, KOH и кипячения в кислотах [15, 17]. Например, обработка колонок донных осадков из моря Лаптевых (PS51/080-13 и PM9482-2) с использованием стандартной методики для анализа водных палиноморф [3] и методики с применением KOH и тяжелой жидкости [22] показала очевидную разницу в итоговом количестве диноцист. В первом случае они стабильно присутствовали во всех образцах в статистически достаточном количестве, а во втором в большинстве проб обнаружены не были. Вероятно, диноцисты растворились в щелочи и/или были потеряны при разделении с тяжелой жидкостью.
Тем не менее, тяжелая жидкость в некоторых случаях все же используется. Ее можно применять при необходимости отделить минеральную часть пробы и оценить наличие любых палиноморф в полевых условиях (например, на борту судна), когда работы с фтористоводородной кислотой невозможны по соображениям безопасности. Кроме того, использование тяжелой жидкости допускается при подготовке препаратов для таксономических наблюдений, фотографирования видов и систематических описаний. Однако важно понимать, что при такой обработке в образце не сохраняются все диноцисты: некоторые из них, содержащие минеральные частицы в полости или на выростах, могут осесть. Таким образом, при палеоэкологических исследованиях, предполагающих подсчет разных видов палиноморф, определение концентраций и состава ассоциаций, использования тяжелой жидкости принято избегать [7, 17].
Общепринятая стандартная методика приготовления препаратов для анализа водных палиноморф выглядит следующим образом [7, 15, 19 и др.]. Вначале образцы высушиваются в лиофильной сушилке. Навеска массой около 5 г помещается в центрифужную пробирку объемом 50 мл. С целью последующего определения концентраций палиноморф в образец добавляются таблетки со спорами плаунов Lycopodium clavatum [23]. Для удаления карбонатов проба на время от часа до суток заливается соляной кислотой (10%), затем центрифугируется и промывается дважды дистиллированной водой. Далее для растворения кремнесодержащих частиц используется фтористоводородная кислота (40%). Обычно проба находится в этой кислоте в среднем около суток, после чего также дважды промывается дистиллированной водой. Далее образец фильтруется через сито с диаметром пор 7–10 мкм. Делается это с помощью специальной воронки и вакуумной помпы либо путем кратковременного погружения фильтра в ультразвуковую ванну. При необходимости проба фильтруется и через сито 120 мкм. Отфильтрованный осадок, содержащий палиноморфы, помещается в пробирку объемом 10–15 мл, заливается глицерином и в дальнейшем может неоднократно использоваться для приготовления временных препаратов (существует также методика изготовления постоянных препаратов при помощи глицеринового желе и парафина).
Описанный метод представляет собой установленный протокол для обработки образцов, богатых неорганическими частицами (силикатами и карбонатами). Но допускаются различные варианты этой методики [7, 19]. Разные лаборатории обычно адаптируют ее под свои задачи и возможности. Могут меняться размер исходной навески, число циклов отмывания, продолжительность обработки ультразвуком, количество этапов фильтрации. Используются сита из разных материалов, и в известных пределах варьирует размер ячеек. Можно нагревать пробу в кислоте для ускорения реакции или же оставлять ее холодной, применять центрифугу либо декантацию для отмывания осадка, менять время, последовательность и число повторов кислотной обработки [15].
Наличие в некоторых из наших препаратов минеральных зерен, затрудняющих микроскопный анализ, говорит о том, что используемая нами стандартная методика также нуждается в коррекции в рамках допустимых вариаций. Эта проблема весьма актуальна, так как минеральные зерна могут встречаться в образцах разного возраста и литологического состава. В случае высоких концентраций микроводорослей проблема может быть частично решена путем дополнительного разбавления препарата. Но если концентрации невысоки, то присутствие минеральных остатков значительно усложняет методику, многократно увеличивает время, затрачиваемое на анализ проб, а иногда делает его полностью невыполнимым.
МАТЕРИАЛ ИССЛЕДОВАНИЯ, ТЕСТИРОВАНИЕ МЕТОДИКИ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Минеральные кристаллы встречены в разных образцах, в числе которых, например, пробы верхнеплейстоценовых и голоценовых осадков с континентального склона моря Лаптевых, образцы из голоценовых колонок и поверхностных донных осадков Белого, Баренцева и Карского морей, поверхностных осадков Восточно-Сибирского моря, а также из верхнеплейстоценовых осадков Кумо-Манычской впадины и Среднего Поволжья и другие. Кристаллы могут обнаруживаться на отдельных интервалах глубин колонок и скважин в образцах различного гранулометрического состава.
Готовые для анализа водных палиноморф образцы представляют собой пробирки объемом 10–15 мл, содержащие органическую часть пробы, заполненную сверху глицерином. В такой пробирке после центрифугирования минеральный осадок остается на дне, а верхний слой представляет собой нужную нам для анализа органику. Количество минеральной части может быть незначительным, но нередко занимает до 90% объема препарата (рис. 1а, 1б). Размер всех кристаллов одинаков и составляет примерно 10–100 мкм, что соответствует средним размерам изучаемых нами органических объектов. Все частицы большего либо меньшего размера заведомо удалены из пробы при финальной фильтрации.
Рис. 1.
Пробирки с готовыми препаратами из осадков колонок и скважин Белого моря (а) и Кумо-Манычской впадины (б). Белыми стрелками показана минеральная часть пробы, черными – органическая.

Для коррекции лабораторной методики необходимо установить происхождение и состав минеральных зерен. Для этой цели были повторно изучены препараты, подготовленные для анализа водных палиноморф и содержащие минеральные кристаллы, из коллекций лаборатории новейших отложений и палеогеографии плейстоцена географического факультета МГУ имени М.В. Ломоносова и лаборатории физико-геологических исследований имени А.П. Лисицына Института океанологии имени П.П. Ширшова РАН.
Мы предполагали единый облик и происхождение минеральных частиц во всех пробах, однако предварительный анализ с помощью светового микроскопа Axio Imager.A2 Zeiss с цифровой камерой AxioCam (305 color) при увеличении Х400 показал, что кристаллы представлены двумя типами. Кристаллы первого типа (рис. 2а, 2в) встречены в пробах, например, из Белого и Баренцева морей и имеют правильную прямоугольную или кубическую форму со скругленными углами. Кристаллы второго типа (рис. 2б, 2г) представляют собой исключительно остроугольные обломки произвольной формы и обнаружены в пробах из Карского моря, Кумо-Манычской впадины и Среднего Поволжья. В некоторых образцах (например, из моря Лаптевых) встречены кристаллы обоих типов.
Рис. 2.
Минеральные зерна в поле зрения светового (а, б) и сканирующего электронного (в, г) микроскопа: а, в – кристаллы первого типа (Белое море, колонка ПШ6066, глубина 111–112 см), б, г – кристаллы второго типа (Кумо-Манычская впадина, скважина OL-1, глубина 440–450 см).

Для отработки методики была отобрана новая, тестовая партия из 12 образцов морских осадков из разных регионов. Ранее в этих образцах уже были обнаружены минеральные кристаллы. В тестовую партию вошли три пробы из колонок донных осадков Белого моря, три пробы из поверхностных осадков Карского моря и шесть проб из скважины, пробуренной в центральной части Кумо-Манычской впадины. Химическая обработка и изготовление препаратов выполнены по стандартной методике в ИО РАН. Во всех готовых препаратах, как и ожидалось, обнаружены минеральные зерна. В беломорских пробах встречены кристаллы первого типа, а в осадках Карского моря и Кумо-Манычской впадины – второго.
Из трех разных препаратов минеральные зерна были отобраны, отмыты от органической части и проанализированы на сканирующем электронном микроскопе VEGA-3 TESCAN (Чехия) с системой рентгеноспектрального микроанализа Oxford INCA Energy 350 (Великобритания).
В результате установлено, что кристаллы первого типа (Белое море) представляют собой соли – новообразованные малорастворимые соединения металлов с кислотными остатками. По литературным данным известно, что в пробе после обработки ее соляной кислотой остаются свободные катионы, которые впоследствии вступают в реакцию с фтористоводородной кислотой, в результате чего и появляются кристаллы солей. Например, наличие в осадке иона Ca2+ может привести к осаждению фторида кальция (CaF2) [15]. Однако, для Белого моря характерно практически полное отсутствие карбонатов в осадках. Установлено, что обнаруженные в беломорских пробах кристаллы состоят из фторидов алюминия и калия (рис. 3а). В данном случае высвобождение ионов Al3+ и K+, вероятно, произошло вследствие воздействия фтористоводородной кислоты на глинистую составляющую осадка [2].
Рис. 3.
Секторные диаграммы элементного состава (в %) кристаллов первого (а) и второго (б) типов по данным сканирующей электронной микроскопии.
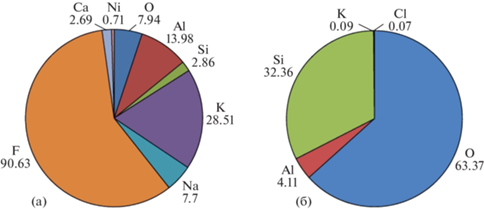
Кристаллы второго типа (Карское море и Кумо-Манычская впадина) представлены остатками разложения кварца и алюмосиликатных минералов, богатых кремнеземом, близких по составу к полевым шпатам и амфиболам (рис. 3б), т.е. частицами кремнезема, не растворившимися в кислоте. Тем не менее, сравнение кварцевых зерен из исходного осадка с кристаллами после химической обработки показало, что во втором случае они оказались более потравленными. По-видимому, в этом случае сократить их количество поможет увеличение времени обработки пробы фтористоводородной кислотой. Для проверки этой гипотезы часть пробы, содержащей кварц, отделили, залили кислотой и оставили на длительный срок. В общей сложности проба простояла во фтористоводородной кислоте 48 суток. По прошествии этого времени оказалось, что количество кристаллов в пробирке значительно сократилось. Однако такой срок нахождения пробы в кислоте выходит за рамки всех возможных вариаций лабораторной методики [15] и применен, на наш взгляд, быть не может.
Таким образом, в новую лабораторную методику предлагается внести следующие изменения (рис. 4а, 4б). Для предотвращения образования кристаллов первого типа, т.е. любых солей и, главным образом, солей кальция (при обработке высококарбонатных осадков), необходимо более тщательно отмывать пробу дистиллированной водой после обработки соляной кислотой, чтобы исключить сохранение катионов, способных вступить в реакцию с фтористоводородной кислотой. Проба должна промываться не два раза, а до тех пор, пока значение pH не станет нейтральным (проверяется индикаторной бумагой). Установлено, что в пробирке объемом 50 мл такой результат достигается после четырехкратного промывания. При работе с низкокарбонатными осадками (например, из арктических морей) для избавления от солей алюминия и калия следует дополнительно промывать осадок через сито 10 мкм с целью удаления пелита перед использованием фтористоводородной кислоты.
Рис. 4.
Схематическое изображение стандартной методики обработки проб на анализ водных палиноморф (а) и методики с учетом предлагаемых изменений (б).
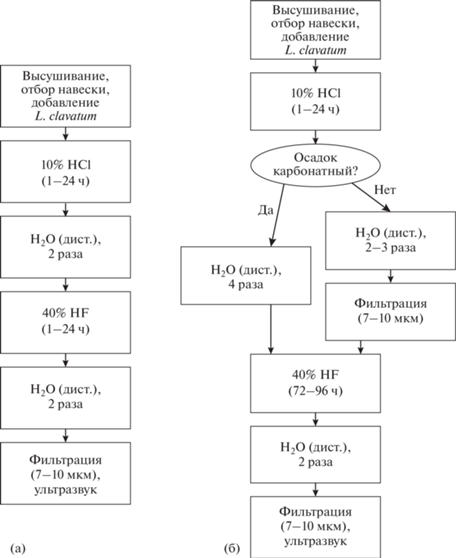
Для того чтобы ускорить и упростить удаление из пробы кристаллов второго типа, т.е. остатков разложения кварца и алюмосиликатов, предлагаются два решения. Во-первых, нужно сократить объем материала, заливаемого фтористоводородной кислотой. Сделать это можно, так же как и в случае с солями алюминия и калия, путем добавления дополнительного этапа фильтрации пробы через 10 мкм после отмывания от соляной кислоты. При фильтрации объем осадка в пробирке в среднем сокращается более чем в два раза (рис. 5а, 5б), и последующая реакция с кислотой проходит быстрее и эффективнее. Кроме того, этот подход имеет еще одно преимущество: удаление пелитовой фракции позволяет минимизировать такое неприятное явление, как интенсивное кипение образца во фтористоводородной кислоте. Во-вторых, время нахождения в кислоте пробы, содержащей большое количество кварцевых кристаллов, предлагается увеличить до 3–4 суток.
Рис. 5.
Среднее количество осадка в пробирке до (а) и после (б) дополнительного этапа фильтрации через 10 мкм.

Тестовая партия образцов была обработана повторно с учетом предложенных изменений в методике. Последующий микроскопный анализ показал, что проблема образования солей в препарате успешно решена (рис. 6а, 6б). Количество кварца в большинстве проб сократилось до незначительного количества, либо до значений, позволяющих вести определение и подсчет палиноморф. Тем не менее, в некоторых пробах, изначально содержавших большое количество песчаной фракции, минеральные кристаллы в препарате сохранились. В таких случаях, если просмотр и подсчет по-прежнему невозможны, для отдельных проб допускается применение тяжелой жидкости. Использоваться может, например, поливольфрамат натрия с удельным весом 2.4 [5, 12]. В некоторых лабораториях тяжелую жидкость применяют для песчаных осадков [10–12], однако обработанные таким образом пробы должны быть специально помечены, а к полученным результатам нужно относиться с осторожностью.
ЗАКЛЮЧЕНИЕ
Проведен анализ методических подходов, используемых для извлечения из осадка органических микроводорослей. Существующая стандартная методика обработки проб для анализа водных палиноморф была скорректирована с целью исключения или минимизации появления в препарате нерастворимых минеральных зерен. Предложены следующие решения:
Для того чтобы избежать образования кристаллов фторида кальция, необходимо более тщательное отмывание (не менее чем четырехкратное) пробы от соляной кислоты дистиллированной водой перед добавлением в нее фтористоводородной кислоты.
Количество кристаллов фторида калия и алюминия, а также остатков разложения кварца и алюмосиликатов возможно сократить, добавив дополнительный этап фильтрации пробы через сито с диаметром пор 10 мкм после обработки соляной кислотой и увеличив время нахождения пробы во фтористоводородной кислоте до 3–4 суток. В исключительных случаях, при большом количестве песка и невозможности выполнения микроскопного анализа, допустимо использование тяжелой жидкости.
Таким образом, очевидно, что универсальной методики подготовки проб для анализа водных палиноморф не существует. Тем не менее, многие возникающие технические трудности возможно преодолеть, корректируя лабораторные процедуры и меняя их последовательность.
Благодарности. Авторы выражают глубокую благодарность сотрудникам лаборатории физико-геологических исследований им. А.П. Лисицына ИО РАН Н.В. Политовой, А.А. Клювиткину, Д.П. Стародымовой за помощь и ценные замечания в процессе подготовки статьи и А.Г. Боеву за проведение электронно-микроскопических исследований.
Источник финансирования. Работа выполнена при поддержке Российского фонда фундаментальных исследований: исследования образцов из Карского и Белого морей и анализ проб на сканирующем электронном микроскопе проводились в рамках проекта № 19-05-50 090, изучение проб из южных регионов России — по проекту № 20-05-00608.
Список литературы
Гричук В.П. Новый метод обработки осадочных пород для целей пыльцевого анализа // Тр. Совещания секции Международной ассоциации по изучению четвертичного периода. 1937. Вып. 3. 78 с.
Добровольский В.В. Гипергенез и коры выветривания. Избранные труды. Т. 1. М.: Научный мир, 2007. 512 с.
Полякова Е.И., Клювиткина Т.С., Новичкова Е.А. и др. Изменения стока реки Лены в голоцене // Водные ресурсы. 2009. Т. 36. № 3. С. 289–299.
Пыльцевой анализ / Под общ. ред. А.Н. Криштофовича. М.: Госгеолиздат, 1950. 572 с.
Bolch C.J.S. The use of sodium polytungstate for the separation and concentration of living dinoflagellate cysts from marine sediments // Phycologia. 1997. V. 36(6). P. 472–478.
de Vernal A., Eynaud F., Henry M. et al. Reconstruction of sea-surface conditions at middle to high latitudes of the Northern Hemisphere during the Last Glacial Maximum (LGM) based on dinoflagellate cyst assemblages // Quaternary Science Reviews. 2005. V. 24. P. 897–924. https://doi.org/10.1016/j.quascirev.2004.06.014
de Vernal A., Henry M., Bilodeau G. Micropaleontological preparation techniques and analyses. Notes prepared for students of course SCT 8245. Montréal: Département des Sciences de la Terre, UQAM, 2010. 32 p.
de Vernal A., Radi T., Zaragosi S. et al. Distribution of common modern dinoflagellate cyst taxa in surface sediments of the Northern Hemisphere in relation to environmental parameters: The new n=1968 database // Marine Micropaleontology. 2020. V. 159. Article 101 796. https://doi.org/10.1016/j.marmicro.2019.101796
Fensome R.A. Taylor F.J.R., Norris G. et al. A classification of living and fossil dinoflagellates // Micropaleontology. 1993. V. 7. P. 1–351.
Hoyle T.M., Leroy S.A.G., López-Merino L., Richards K. Using fluorescence microscopy to discern in situ from reworked palynomorphs in dynamic depositional environments — An example from sediments of the late Miocene to early Pleistocene Caspian Sea // Review of Palaeobotany and Palynology. 2018. V. 256. P. 32–49. https://doi.org/10.1016/j.revpalbo.2018.05.005
Marret F., Eiriksson J., Knudsen K.L. et al. Distribution of dinoflagellate cyst assemblages in surface sediments from the northern and western shelf of Iceland // Review of Palaeobotany and Palynology. 2004. V. 128. P. 35–53. https://doi.org/10.1016/S0034-6667(03)00111-8
Marret F., Scourse J. Control of modern dinoflagellate cyst distribution in the Irish and Celtic seas by seasonal stratification dynamics // Marine Micropaleontology. 2002. V. 47. P. 101–116.
Matthiessen J., Künz-Pirrung M., Mudie P.J. Freshwater chlorophycean algae in recent marine sediments of the Beaufort, Laptev and Kara Seas (Arctic Ocean) as indicators of river runoff // International Journal of Earth Sciences. 2000. V. 89(3). P. 470–485. https://doi.org/10.1007/s005310000127
Mertens K.N., Gu H., Gurdebeke P.R. et al. A review of rare, poorly known, and morphologically problematic extant marine organic-walled dinoflagellate cyst taxa of the orders Gymnodiniales and Peridiniales from the Northern Hemisphere // Marine Micropaleontology. 2020. V. 159. Article 101773. https://doi.org/10.1016/j.marmicro.2019.101773
Mertens K.N., Verhoeven K., Verleye T. et al. Determining the absolute abundance of dinoflagellate cysts in recent marine sediments: The Lycopodium marker-grain method put to the test // Review of Palaeobotany and Palynology. 2009. V. 157. P. 238–252. https://doi.org/10.1016/j.revpalbo.2009.05.004
Mudie P.J., Harland R., Matthiessen J. et al. Marine dinoflagellate cysts and high latitude Quaternary paleoenvironmental reconstructions: an introduction // Journal of Quaternary Science. 2001. V. 16 (7). P. 595–602. https://doi.org/10.1002/jqs.660
Mudie P.J., Leroy S.A.G., Marret F. et al. Nonpollen palynomorphs: Indicators of salinity and environmental change in the Caspian–Black Sea–Mediterranean corridor // Geology and Geoarchaeology of the Black Sea Region: Beyond the Flood Hypothesis / Eds.: Buynevich I.V., Yanko-Hombach V., Gilbert A.S., Martin R.E.). Geological Society of America Special Paper. 2011. V. 473. P. 89–115. https://doi.org/10.1130/2011.2473(07)
Nieuwenhove Van N., Head M.J., Limoges A. et al. An overview and brief description of common marine organic-walled dinoflagellate cyst taxa occurring in surface sediments of the Northern Hemisphere // Marine Micropaleontology. 2020. V. 159. Article 101 814. https://doi.org/10.1016/j.marmicro.2019.101814
Pound M.J., O’Keefe J.M.K., Marret F. An overview of techniques applied to the extraction of non-pollen palynomorphs, their known taphonomic issues and recommendations to maximize recovery // Geological Society, London, Special Publications. 2021. V. 511. P. 63–76. https://doi.org/10.1144/SP511-2020-40
Rochon A., de Vernal A., Turon J.-L. et al. Recent dinoflagellate cysts of the North Atlantic Ocean and adjacent seas in relation to sea-surface parameters // American Association of Stratigraphic Palynologists Contribution Series. 1999. V. 35. P. 1–146.
Roncaglia L., Kuijpers A. Palynofacies analysis and organic-walled dinoflagellate cysts in Late-Holocene sediments from Igaliku Fjord, South Greenland // The Holocene. 2004. V. 14 (2). P. 172–184. https://doi.org/10.1191/0959683604hl700rp
Rudenko O., Taldenkova E., Ovsepyan Y. et al. A multiproxy-based reconstruction of the mid- to late Holocene paleoenvironment in the Laptev Sea off the Lena River Delta (Siberian Arctic) // Palaeogeography, Palaeoclimatology, Palaeoecology. 2020. V. 540. Article 109 502. https://doi.org/10.1016/j.palaeo.2019.109502
Stockmarr J. Tablets with spores used in absolute pollen analysis // Pollen and Spores. 1971. V. 13. P. 616–621.
Warny S.A., Wrenn J.H. New species of dinoflagellate cysts from the Bou Regreg Core: a Miocene-Pliocene boundary section on the Atlantic Coast of Morocco // Review of Palaeobotany and Palynology. 1997. V. 96. P. 281–304.
Zonneveld K.A.F., Marret F., Versteegh G.J.M. et al. Atlas of modern dinoflagellate cyst distribution based on 2405 data points // Review of Palaeobotany and Palynology. 2013. V. 191. P. 1–197. https://doi.org/10.1016/j.revpalbo.2012.08.003
Дополнительные материалы отсутствуют.



