Онтогенез, 2019, T. 50, № 2, стр. 141-146
Формирование и преобразования желез простаты человека в пренатальном и неонатальном периодах
И. А. Петько a, А. К. Усович a, *
a Учреждение образования “Витебский государственный ордена Дружбы народов медицинский университет”
210009 г. Витебск, пр-т Фрунзе, 27, Республика Беларусь
* E-mail: usovicha@mail.ru
Поступила в редакцию 27.09.2018
После доработки 26.11.2018
Принята к публикации 22.11.2018
Аннотация
Цель настоящего исследования – определение морфометрических параметров эпителиальных тяжей, простатических проточков, концевых отделов желез простаты человека, выстилающего их эпителия, формы желез на протяжении пренатального и неонатального периодов. Исследование выполнено на серийных гистологических срезах тазовой области 47 предплодов и плодов человека, 10 простат мальчиков раннего и позднего неонатальных периодов. Изучены форма и размеры концевых отделов желез и их просветов, эпителиоцитов эпителиальных тяжей, концевых отделов желез и простатических проточков. Результаты показали, что образование и канализация эпителиальных тяжей простаты определялись уже в раннем фетальном периоде. Образование простатических проточков не сопровождалось увеличением их общей площади, а было результатом дифференцировки эпителиальных клеток и апоптоза. Установлены изменения размера и формы концевых отделов желез простаты у новорожденных по сравнению с фетальными периодами. Вывод. Формирование концевых отделов желез простаты происходит не непосредственно из эпителиальных тяжей, а последовательно: эпителиальные тяжи преобразуются в простатические проточки, из которых формируются концевые отделы желез.
ВВЕДЕНИЕ
Данные о формировании и преобразованиях желез простаты человека из эпителиальных тяжей в сложные альвеолярно-трубчатые железы, особенностях их роста и динамики развития в течение пренатального онтогенеза и у новорожденных многочисленны, но фрагментарны и не систематизированы (Лугин, 2009; Троценко, 2009; Лысяков, 2010; Евтушенко, 2011). Уточнение сроков появления и формирования тех или иных структур является важным для наблюдения за правильным развитием мочеполового аппарата плода (Ахтемиiчук, 2012). Развитие патологических изменений, в том числе и в простате, может быть следствием нарушенного процесса развития органа (Shapiro, 1990). Наряду с иммуногистохимическими методами в биомедицинские исследования по определению степени развития патологических изменений желез внедряются методы определения факторов формы (Sparks et al., 2013). Данных о таких показателях в неизмененных патологией железах, в том числе и в простате, не опубликовано. Целью данной работы явилось определение морфометрических параметров эпителиальных тяжей, простатических проточков, концевых отделов желез простаты человека, выстилающего их эпителия, формы желез на протяжении пренатального и неонатального периодов.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на серийных гистологических сагиттальных, фронтальных и горизонтальных срезах предплодов и плодов человека 14.0–108.0 мм теменно-копчиковой длины (ТКД) из эмбриологической коллекции кафедры нормальной анатомии учреждения образования “Белорусский государственный медицинский университет”, а также на простатах плодов человека и мальчиков раннего и позднего неонатальных периодов (табл. 1, 2), полученных в соответствии с Законом Республики Беларусь № 55-3 “О погребении и похоронном деле” в редакции закона № 2/2235 от 09.01.15 и разрешено независимым этическим комитетом УО ВГМУ (протокол № 2 от 07.05.2018). Сведения о причине смерти и наличии патологических изменений новорожденных взяты из протоколов патологоанатомического исследования. Определение возраста эмбрионов и плодов осуществляли по их теменно-копчиковой длине в соответствии с таблицами Хватова (Хватов и др., 1969). Материал сгруппирован в возрастные группы согласно международной эмбриологической терминологии (Колесников и др., 2014).
Таблица 1.
Распределение материала исследования по возрастным группам
| Возрастной период | Предплоды | Ранний фетальный период | Средний фетальный период | Поздний фетальный период | Ранний неонатальный период | Поздний неонатальный период |
|---|---|---|---|---|---|---|
| Количество изученных случаев | 15 | 16 | 12 | 7 | 7 | 3 |
Серийные гистологические срезы эмбриологической коллекции академика Д.М. Голуба (УО БГМУ) импрегнированы азотнокислым серебром по методу Бильшовского–Буке, окрашены гематоксилином и эозином. Полученные авторами статьи простаты после фиксации разрезали в сагиттальной, фронтальной, горизонтальной плоскостях и заливали в парафин по общепринятой методике. Гистологические срезы толщиной 5 мкм, изготовленные на ротационном микротоме Leica RM 2125 RT (Германия), окрашивали гематоксилином – эозином и фукселином по Hart.
Таблица 2.
Размеры желез простаты в промежуточном и позднем фетальном, раннем и позднем неонатальном периодах M (1st Qu; 3rd Qu, мкм)
| Возрастные периоды | Промежуточный фетальный период | Поздний фетальный период | Ранний неонатальный период | Поздний неонатальный период |
|---|---|---|---|---|
| Высота эпителия, мкм | 12.74 (10.1; 15.7) |
15.5* (12.2; 18.97) |
12.5* (9.4; 16.4) |
14.8* (11.9; 18.1) |
| Площадь эпителиальных тяжей, мкм2 | 4244 (2981; 6758) |
4516 (3100; 7244) |
4466 (3027; 6682) |
4427 (2372; 8682) |
| Площадь концевого отдела железы, мкм2 | 4769 (3247; 7535) |
5967* (4092; 9562) |
5002* (3390; 7484) |
5136* (2751; 10 072) |
| Площадь просвета концевого отдела железы, мкм2 | 149 (95; 289) |
565* (301; 987) |
241* (150; 551) |
852* (465; 1425) |
Окрашенные препараты исследованы под микроскопом Leica DM 2000 (Германия) с фотонасадкой при суммарном увеличении 100, 200, 400. С помощью цифровой камеры “Leica D-LUX 3” (Германия) изготовлены микрофотографии исследованных областей. Обработку полученных микрофотографий желез простаты выполнили в программе Image Fiji, используя набор стандартных инструментов и плагинов, позволяющих изменять резкость, контрастность изображений, сглаживание, устранение “шумов” и разделение цветного изображения по цветовым каналам. Затем при помощи плагина Trianable Weka Segmentation изображения были сегментированы, получены их двоичные маски. Все обработанные изображения были откалиброваны с использованием стандартного объект-микрометра.
Применяли морфологический способ верификации апоптоза клеток на окрашенных гистологических препаратах с использованием критериев апоптоза, согласно рекомендациям Скибо (Скибо, 2011).
Проводили морфометрическое исследование, включающее измерение концевых отделов желез, площади их просветов, высоты эпителия. Оценку факторов формы концевых отделов желез и их просветов определяли, используя показатели округлости (Худоерков, 2013) и диаметр Фере (Мыцик, 2011).
Проверка статистических гипотез выполнена в программах “Statistica 10.0” и “Microsoft Excel 2007”. Проверку статистической однородности выборок проводили с использованием непараметрических процедур однофакторного дисперсионного анализа (критерий Крускала-Уоллиса для множественного сравнения). При обнаружении статистической неоднородности нескольких выборок для последующего выявления неоднородных групп использовали U критерий Манна–Уитни, post hoc тест данна с поправкой Бонферрони. Критическим уровнем значимости считали p < 0.05.
РЕЗУЛЬТАТЫ
У плодов 7–10 нед. (21–57 мм ТКД) в области закладки будущей простаты ниже шейки формирующегося мочевого пузыря на уровне впадения в урогенитальный синус мезонефральных протоков эпителиальных зачатков простаты не было обнаружено.
На 11 нед. развития плодов по бокам от урогенитального синуса ниже закладки шейки мочевого пузыря в сгущении мезенхимы выявлялись эпителиальные тяжи, которые раньше всего располагались в области задней и заднелатеральной стенок закладки урогенитального синуса. В раннем фетальном периоде во всех областях простаты наряду с эпителиальными тяжами, представляющими собой многоклеточные конструкции, образованные плотно прилегающими друг к другу эпителиальными клетками, ограниченными базальной мембраной, обнаруживались тяжи с щелевидными просветами, эпителиальные трубочки с просветами различного размера, формы и простатические проточки (рис. 1). В тяжах эпителиальные клетки содержали большие ядра и не имели признаков полярности по отношению к базальной мембране. Как правило, ближе к центру в некоторых эпителиальных тяжах и эпителиальных трубочках обнаруживались эпителиоциты с характерными для апоптоза изменениями в морфологии ядер и цитоплазмы: маргинация хроматина, пикноз в ядрах, изменения окрашивания цитоплазмы, просветы между отдельными эпителиальными клетками вследствие потери межклеточного контакта (рис. 2).
Рис. 1.
Препарат простаты плода (17 нед.). Окраска гематоксилином и эозином. 1. Эпителиальный тяж с плотно прилегающими друг к другу эпителиальными клетками. Эпителиоциты содержат большие ядра без признаков поляризации. 2. Эпителиоциты простатического проточка с базально-расположенными ядрами. 3. Базальные эпителиоциты простатического проточка.
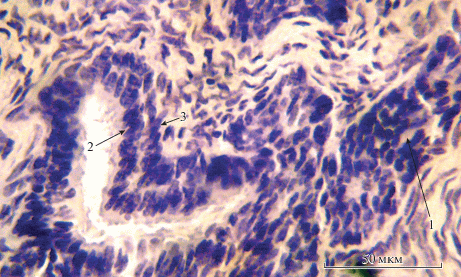
Рис. 2.
Препарат простаты плода (38 нед.). Окраска гематоксилином и эозином. 1. Клетка с признаками кариопикноза ядра и просветленной цитоплазмой (апоптозная клетка). 2. Кубические эпителиоциты простатического проточка. 3. Базальные эпителиоциты.

В эпителиальных образованиях с просветом наблюдалась слабо окрашенная апикальная часть клетки и поляризация ядер по отношению к базальной мембране. Признаки канализации эпителиальных тяжей и типичные простатические проточки в простате обнаруживались на разных расстояниях от формирующейся уретры на протяжении всех фетальных и неонатальных периодов. Простатические проточки, в отличие от эпителиальных тяжей с признаками канализации, были выстланы двухрядным эпителием с базально расположенными ядрами. Внутренний слой клеток, как правило, был образован кубическими или плоскими эпителиоцитами. В простатических проточках простаты в позднем фетальном и неонатальном периодах внутри просвета простатических проточков, расположенных ближе к уретре, наблюдали конгломераты апоптозных клеток (рис. 3).
Рис. 3.
Препарат простаты новорожденного мальчика (2 сут). Окраска гематоксилином и эозином. А – конгломераты апоптозных клеток в просветах простатических проточков.

В простате плодов промежуточного фетального периода выявляли сформированные концевые отделы желез первого и второго порядков. Образовавшиеся железы имели типичное альвеолярно-трубчатое строение, их концевые отделы были выстланы двухрядным эпителием. Высота эпителия, выстилающего концевые отделы желез, достоверно увеличивалась в позднем фетальном периоде по сравнению с промежуточным фетальным и уменьшалась в раннем неонатальном периоде (табл. 3). Площадь сечения эпителиальных тяжей не изменялась на протяжении фетальных и неонатальных периодов (р > 0.05). Площадь концевых отделов и их просветов увеличивалась в позднем фетальном периоде по сравнению с промежуточным периодом (р < 0.05), и уменьшалась в раннем неонатальном периоде (р < 0.05). В фетальные и неонатальные периоды наблюдалось изменение формы просветов концевых отделов желез (р < 0.05). Форма желез статистически достоверно изменялась только у новорожденных по сравнению с фетальными периодами (р < 0.05).
Таблица 3.
Факторы формы желез простаты и их просветов M (1st Qu; 3rd Qu)
| Возрастные периоды | Промежуточный фетальный период | Поздний фетальный период | Ранний неонатальный период | Поздний неонатальный период |
|---|---|---|---|---|
| Округлость концевых отделов желез | 0.74 (0.66; 0.80) |
0.79 (0.65; 0.82) |
0.82* (0.69; 0.89) |
0.69* (0.46; 0.71) |
| Округлость просветов концевых отделов желез | 0.70 (0.57; 0.78) |
0.64 (0.49; 0.76) |
0.77* (0.4; 0.7) |
0.59* (0.54; 0.80) |
| Диаметр Фере концевых отделов желез | 105 (86; 124) |
112 (84; 148) |
102 (75; 125) |
110 (80; 171) |
| Диаметр Фере просветов концевых отделов желез | 20 (14; 34) |
72* (42; 11) |
22* (17; 36) |
47* (34; 68) |
ОБСУЖДЕНИЕ
Проведенное исследование показало, что образование простатических проточков начинается уже в раннем неонатальном периоде. Их формирование не сопровождается увеличением площади и является результатом дифференцировки эпителиальных клеток и апоптоза. Дифференцировка эпителиальных клеток выражается в смещении ядер к базальной поверхности клетки.
В отличие от предыдущих предположений о том, что канализация эпителиальных тяжей является результатом сегрегации базальных и секреторных эпителиальных клеток (Hayward et al., 1996), мы считаем, что канализация протоков простаты имеет сходство с канализацией других желез, например, молочных (Mailleux et al., 2008). Наши наблюдения согласуются с исследованиями развития простаты крыс, в которых также показано, что при канализации проточковой системы простаты апоптоз клеток встречается в центре эпителиальных тяжей простаты (Bruni-Cardoso et al., 2007; Лугин, 2012). В нашем исследовании признаки канализации эпителиальных тяжей в простатические проточки, обнаружены в разных участках простаты плодов и новорожденных мальчиков, что согласуется с данными Бруни-Кардозо, полученными на простатах новорожденных мышей (Bruni-Cardoso, 2007). Это не соответствует предположению Маркер о том, что процесс канализации должен происходить в проксимально-дистальном направлении (Маркеr et al., 2003). В сформированных простатических проточках конгломераты апоптозных клеток наблюдались ближе к уретре. Это позволило нам предположить, что их удаление из протоковой системы простаты происходит путем экструзии.
Выявленное в простате новорожденных по сравнению с поздним фетальным периодом уменьшение площади концевых отделов желез и их просветов, уменьшение высоты выстилающего их эпителия согласуются с данными Евтушенко (Евтушенко и др., 2013) об уменьшении железистой паренхимы у новорожденных. Вероятно, это связано с уменьшением концентрации мужских половых гормонов после рождения мальчиков (Скородок и др., 1984).
Таким образом, формирование концевых отделов желез простаты происходит не непосредственно из эпителиальных тяжей, а последовательно: эпителиальные тяжи преобразуются в простатические проточки, из которых формируются концевые отделы желез.
Список литературы
Ахтемиiчук Ю.Т. Актуальность навуковых дослiджень у галузi перинатальной анатомii // Неонатологiя, хiрургiя та перинат. мед. 2012. Т. II. № 1(3). С. 15–21.
Евтушенко В.М., Сырцов В.К., Зидрашко Г.А. и др. Особенности структурно-функциональной организации стромальных и железистых элементов предстательной железы человека в пренатальном и постнатальном онтогенезе // Український морфологічний альманах. 2011. Т. 3. № 9. С. 106–108.
Лугин И.А. Особенности межтканевых взаимодействий в процессах морфогенеза органов с гетерогенным происхождением тканевых компонентов // Свiт медицини та бiологii. 2012. Т. 8. № 4. С. 77–79.
Лысяков С.Н. Характеристика простаты плодов человека 20–21 нед. внутриутробного развития // Современные наукоемкие технологии. 2010. № 12. С. 41–42.
Международные термины по эмбриологии человека с официальным списком русских эквивалентов / Под ред. Колесникова Л.Л., Шевлюка Н.Н., Ерофеевой Л.М. М.: ГЭОТАР-МЕДИА, 2014. 417 с.
Мыцик А.В. Использование программы ImageJ для автоматической морфометрии в гистологических исследованиях // Омский научный вестник. 2011. Т. 100. № 2. С. 187–189.
Скибо Ю.В., Абрамова З.И. Методы исследования программируемой клеточной гибели: Учебно-методическое пособие для магистров по курсу “Теория апоптоза”. Казань: ФГАОУ ВПО КФУ, 2011. 61 с.
Скородок Л.М., Савченко О.Н. Нарушения полового развития у мальчиков. М.: Медицина, 1984. 238 с.
Троценко Б.В., Лугин И.А. Региональная гетерогенность мезенхимы в процессах морфогенеза предстательной железы у плодов человека и крысы // Морфологiя. 2009. Т. 3. № 3. С. 126–130.
Хватов Б.П., Шаповалов Ю.Н. Ранний эмбриогенез человека и млекопитающих: пособие. Симферополь, 1968. 183 с.
Худоерков Р.М. Методы компьютерной морфометрии в нейроморфологии. М.: ФГБУ “НЦН” РАМН, 2014. 53 с.
Bruni-Cardoso A., Carvalho H.F. Dynamics of the epithelium during canalization of the rat ventral prostate // Anat Rec. 2007. V. 290. P. 1223–1232.
Hayward S.W., Baskin L.S., Haughney P.C. Epithelial development in the rat ventral prostate, anterior prostate and seminal vesicle // Acta Anat. 1996. V. 155. P. 81–93.
Mailleux A.A., Overholtzer M., Schmelzle T. et al. BIM regulates apoptosis during mammary ductal morphogenesis, and its absence reveals alternative cell death mechanisms // Dev. Cell. 2007. № 12. P. 221–234.
Marker P.C., Donjacour A.A., Dahiya R. et al. Hormonal, cellular, and molecular control of prostatic development // Dev. Biol. 2003. V. 253. P. 165–174.
Shapiro E. Embriologic development of the prostate. Insights into the etiology and treatment of benign prostatic hyperplasia // Urol. Clin. North. Am. 1990. V. 1. № 17, № 3. P. 487–493.
Sparks R., Madabhushi A. Explicit shape descriptors: Novel morphologic features for histopathology classification // Medical Image Analysis. 2013. V. 17. № 8. P. 997–1009.
Дополнительные материалы отсутствуют.


