Онтогенез, 2019, T. 50, № 3, стр. 149-156
Механизмы эмбрионального скейлинга
А. М. Нестеренко a, b, *, А. Г. Зарайский a, **
a Федеральное государственное учреждение науки Институт биоорганической химии им. акад. М.М. Шемякина
и Ю.А. Овчинникова РАН
117997 г. Москва, ул. Миклухо-Маклая, д. 16/10, Россия
b Научно-исследовательский институт физико-химической биологии имени А.Н. Белозерского
Московского государственного университета имени М.В. Ломоносова
119992 г. Москва, Ленинские горы, д. 1, стр. 40, Россия
* E-mail: comcon1@protonmail.com
** E-mail: azaraisky@yahoo.com
Поступила в редакцию 02.12.2018
После доработки 24.01.2019
Принята к публикации 26.01.2019
Аннотация
Явление скейлинга, т.е. сохранение пропорций пространственной разметки эмбриона при изменении его размеров – наиболее характерная особенность эмбриональных морфогенетических полей. Вплоть до настоящего времени попытки понять механизмы скейлинга сводились к созданию и анализу поведения теоретических моделей, в той или иной мере воспроизводящих это явление in silico. Лишь сравнительно недавно при создании таких моделей авторы стали использовать экспериментальные данные о конкретных генах и их продуктах – секретируемых белках – идентифицированных в ходе изучения различных молекулярных механизмов в эмбриогенезе. Однако до сих пор в литературе не были описаны подходы для целенаправленного выявления генов и белков, непосредственно ответственных за эмбриональный скейлинг. Разработка таких подходов и применение их на практике – важная задача будущих исследований. В настоящем обзоре рассматриваются основные современные публикации, посвященные проблеме эмбрионального скейлинга и возможным подходам к изучению механизмов этого явления.
ВВЕДЕНИЕ
Вопрос о механизмах регуляции правильной общей структуры эмбриона в зависимости от его размеров является одним из наиболее важных вопросов биологии, поскольку именно способность к такой регуляции наиболее отчетливо демонстрирует отличие живых организмов от обычных объектов неживой природы и свидетельствует об особых механизмах, управляющих эмбриональным развитием. Особенно необычно выглядят такие эмбриональные регуляции, при которых пропорционально сложенный, но маленький эмбрион развивается из полученного в результате операции фрагмента исходного зародыша нормальных размеров. Такие регуляции иногда называют – дришевскими, в честь немецкого ученого, работавшего в России на рубеже XIX и XX веков, Ганса Дриша, который впервые подробно описал данный тип регуляций у морского ежа (Driesch, 1891). Также в последнее время подобный тип эмбриональных регуляций часто называют скейлингом (от англ. “scale” – масштаб), имея ввиду сохранение правильных пропорций образующихся структур при изменении масштаба всей пространственной разметки эмбриона.
Современное концептуальное описание механизмов скейлинга опирается на то, что в контроле целостности эмбрионального развития большое значение должны играть механизмы т.н. неравновесной (диссипативной) самоорганизации (Белинцев, 1983; Meinhardt, 2008; Dawes, 2010). В результате в развивающемся эмбрионе формируются крупномасштабные динамические структуры различной природы, т.н. морфогенетические поля, обеспечивающие согласованную дифференцировку составляющих его клеток и способные к скейлингу при изменении размеров эмбриона (Levin, 2012). Однако до сих пор конкретная природа подобных динамических структур в применении к живым объектам остается слабо изученной. Наиболее распространенным является представление о том, что такие структуры формируются в результате нелинейных взаимодействий специфических белков – морфогенов – диффундирующих внутри зародыша и взаимодействующих, как друг с другом, так и влияющих на экспрессию своих собственных генов. Такие системы нелинейно взаимодействующих морфогенов относятся к классу т.н. реакционно-диффузионных систем (РД систем) – разновидность нелинейных дифференциальных уравнений в частных производных (УрЧП). Считается, что диффузионные градиенты морфогенов, формирующиеся в результате самоорганизации РД систем, организуют пространственную разметку эмбриона так, что разные пороговые концентрации вдоль градиента данного морфогена включают разные генные ансамбли (Wolpert, 1969; Meinhardt, 2009; Wartlick et al., 2009). В результате вдоль этого градиента формируется упорядоченное пространственное распределение различных типов клеточных дифференцировок (Wartlick et al., 2009). Предполагается, что структура эмбриона может регулироваться именно потому, что особенностью определяющих ее самоорганизующихся градиентов морфогенов является способность к регуляции в зависимости от общих размеров эмбриона – т.е. способность к скейлингу. Очевидно, что подобный скейлинг должен осуществляться таким образом, чтобы градиент одного и того же морфогена в большом и маленьком эмбрионе имел бы одинаковый набор пороговых концентраций, расположенных друг от друга на расстояниях пропорциональных общим размерам эмбриона (т.н. свойство масштабной инвариантности или скейлинга) (Shingleton et al., 2007; Umulis, Othmer, 2013).
ВИДЫ МОДЕЛЕЙ МОРФОГЕНЕЗА
Работы А.Тьюринга (Turing, 1952) с первыми абстрактными математическими моделями морфогенеза и работы Л. Вольперта (Wolpert, 1969), оформившие понятие “морфогена” как носителя позиционной информации, стали отправной точкой для моделирования биологического морфогенеза и, в том числе, явления эмбрионального скейлинга. Причем Тьюринг, будучи математиком, не слишком представлял, как реализуется введенное им абстрактное понятие “морфоген” и фокусировался на принципиальной возможности создания пространственной неоднородности. В то же время Вольперт, будучи биологом, не слишком задавался вопросом о происхождении пространственной неоднородности, а фокусировался на том, как имплементировать градиент морфогена в дифференцированную структуру. Некоторые зарубежные авторы до сих пор разделяют эти подходы на “reaction-diffusion” и “position-information” (Green, Sharpe, 2015), тогда как в действительности эти взгляды на морфогенез никогда друг другу не противоречили.
Работа Тьюринга долгое время доминировала в моделировании морфогенеза, хотя отвечала на довольно локальный вопрос о формировании первичной неоднородности в исходно гомогенной системе. Она предполагала наличие как минимум двух морфогенов, нелинейно взаимодействующих между собой и при этом значительно различающихся по подвижностям. Первые серьезные модели, реализующие идеи Тьюринга в виде нескольких систем УрЧП, появляются в работе Гирера–Мейнхарта (Gierer, Meinhardt, 1972; Meinhardt, 2009). Пространственно неоднородные стационарные решения этих УрЧП связывают с градиентом некоторого фактора дифференцировки. Конкретно Гирер и Мейнхардт в своей работе попытались моделировать формирование градиента морфогена, определящиего дифференцировку головы гидры при регенерации. Однако математическая форма предложенных ими уравнений оказалась чрезвычайно удачной и используется до сих пор в моделировании формирования градиента самых разнообразных морфогенов. Очень популярными во второй половине двадцатого века были модели формирования окраски, опятнения шкур, крыльев бабочек, чешуи рыб (Murray, 1993). Это было связано с тем, что пространственно неоднородные структуры, которые образуются в моделях типа Гирера–Мейнхардта, зачастую очень напоминают раскраску животных визуально.
В тех случаях, когда градиент морфогена формируется за счет исходной “материнской” неоднородности, принципы Тьюринга оказываются избыточными и построенные модели опираются на более широкий класс УрЧП. Самым известным примером является градиент Bicoid, формирующийся в ранней синцитиальной бластуле Drosophila (см. подробнее ниже). Формирование градиентов более поздних морфогенов, как предполагается, происходит за счет интерпретации исходно сформированного градиента Bicoid некоторой динамической системой, которая также моделируется системой УрЧП.
К сожалению, вплоть до недавнего времени подобные работы носили сугубо теоретический характер и не могли быть проверены экспериментально. Однако в последние годы благодаря бурному прогрессу в молекулярной и клеточной биологии и, в частности, в разработке методов мечения белков с помощью генетически кодируемых флуоресцентных меток на основе GFP и его гомологов, стало возможным визуализировать и количественно изучать диффузию реальных морфогенов непосредственно в живых эмбрионах. В результате появилась возможность прямой проверки теоретических предсказаний ранее разработанных моделей, что крайне важно как для понимания фундаментальных механизмов эмбрионального развития, так и в перспективе для возможных биомедицинских приложений. В связи с этим, в последнем десятилетии наблюдается быстрое развитие исследований в данном важном направлении синтетической биологии, что находит отражение в публикациях в таких ведущих научных журналах, как Cell, Nature и Science (см., например, Ben-Zvi, 2008; Müller, 2012; Inomata, 2013).
Наиболее полно реальные самоорганизующиеся системы изучены в настоящее время на модели уже упомянутого выше раннего эмбриона дрозофилы (см., например, Houchmandzadeh et al., 2002; Eldar et al., 2002; Wartlick et al., 2011). В частности, в этих работах авторами был подробно исследован и численно моделирован механизм образования специфического продольного паттерна концентраций транскрипционных факторов сегментации, возникающий на основе продольного материнского градиента мРНК и белка bicoid (см., например, Gregor et al., 2007; Okabe-Oho et al., 2009; Porcher et al., 2010). Особенностью данной экспериментальной модели, облегчающей подобные исследования, является хорошая изученность молекулярно-генетических основ развития дрозофилы, а также то, что формирование исследуемых паттернов происходит у этого объекта на синцитиальной стадии эмбриогенеза, когда весь эмбрион представляет собой, по сути, не разделенную клеточными стенками систему, удобную для теоретического моделирования.
Реальные самоорганизующиеся системы описаны и среди позвоночных. Есть ряд примеров, где формирование неоднородности в распределении морфогена описывается моделями Тьюринговского типа и используются уравнения, аналогичные уравнениям Гирера-Мейнхарта: право-левый градиент Nodal у Danio rerio (Muller, 2012), формирование и регенерация пигментных полос у него же (Yamaguchi, 2007; Eom, 2015), разметка волосяных фолликулов на коже мыши (Sick, 2006). Среди современных моделей намного более распространены нетьюринговские модели, где неоднородность формируется на фоне постоянного градиента материнского морфогена или на фоне постоянного потока морфогена из локализованной области эмбриона. Наиболее известные из таких моделей посвящены изучению самоорганизации градиента BMP4 в раннем эмбрионе шпорцевой лягушки, а также самоорганизации градиента его аналога Dpp в имагинальных дисках Drosophila. Эти модели стали первыми моделями, описавшими достаточно убедительно механизмы скейлинга, поэтому мы рассмотрим их ниже чуть подробнее.
МОДЕЛИ МОРФОГЕНЕЗА, ДЕМОНСТРИРУЮЩИЕ СКЕЙЛИНГ
Было известно, что градиент фактора BMP, с минимумом на спинной и максимумом на брюшной стороне эмбриона, образуется на стадии гаструляции. Ранее другими авторами было установлено, что разные пороговые значения концентрации BMP4 включают те или иные типы клеточной дифференцировки, размечая эмбрион вдоль его спинно-брюшной оси (Schmierer et al., 2008). Было также известно, что белок Chordin синтезируется в области организатора и именно он является причиной установления градиента BMP. Более того в зародышах с удаленной вентральной половиной, где организатор занимал больше места, градиент BMP восстанавливал правильную форму, иными словами – наблюдался скейлинг этого градиента. Авторы работ (Ben-Zvi et al., 2008; Inomata et al., 2013) построили модели, которые учитывали диффузию обоих факторов, диффузию комплекса Chordin-BMP, а также распад белка Chordin под действием протеазы Holloid. В основу одной модели легли уравнения для BMP, Сhordin, ADMP (аналога BMP, синтезируемого на дорсальной стороне) (Ben-Zvi et al., 2008), в основу другой BMP, Сhordin и Sizzled (ингибитора Holloid) (Inomata et al., 2013). В обоих случаях авторам удалось построить модели, описывающие восстановление корректного градиента после удаления вентральной половины. При этом в одной работе предполагали, что BMP4, образуя комплекс с белком Chordin, приобретает в составе этого комплекса повышенную способность к диффузии. И именно это, в конечном итоге, приводило динамическую систему к возможности скейлинга (Ben-Zvi et al., 2008). Авторы другой модели объясняли скейлинг наличием Sizzled, ингибитора протеазы Holloid, который синтезируется под воздействием морфогена BMP4. Данный ингибитор, по мнению авторов, способствует “растяжению” градиента белка Chordin из-за снижения его деградации, что в свою очередь объясняет и эффект скейлинга. Таким образом, на сегодняшний день имеется два различных объяснения эффекта скейлинга градиента BMP и совершенно не обязательно, что правильным является только один из них – эти механизмы могут действовать в тандеме и сопровождаться другими, не изученными пока, дополнительными механизмами.
Сходный механизм был установлен в имагинальных дисках Drosophila, где градиент активации сигнальной системы MAD демонстрировал реакцию на размер диска (Teleman, Cohen, 2000). В динамическую систему включались белок Dpp, его рецептор Thickveins (активатор MAD), корецептор Dally и белок Pentagone, который связывался с Dally и ускорял таким образом диффузию Dpp. Сам белок Dpp продуцировался клетками на границе диска. Модель включала шесть РД уравнений и хорошо описывала явление скейлинга в имагинальных дисках.
Во всех трех перечисленных выше примерах скейлинг объясняли в терминах феноменологической модели “expanison-repression” (ингибирования растяжения), математические основы для которой описаны в ключевой работе PNAS (Barkai, Ben-Zvi, 2010). Эта работа одна из первых формализовала проблему скейлинга в исключительно математических терминах и предложила ее решение в виде системы РД уравнений для двух агентов, один из которых авторы назвали “морфогеном”, а другой – “экспандером”. Суть модели достаточно проста:
морфоген продуцируется на одном краю и деградирует во всем объеме;
морфоген ингибирует производство экспандера;
экспандер расширяет распределение морфогена, например, за счет ингибирования деградации последнего.
Система уравнений, реализующая данную схему взаимодействий, приводит к стационарному градиенту морфогена, который не зависит от размеров области в широком диапазоне. То есть данная модель в полной мере реализует скейлинг формирующегося градиента морфогена. Взаимодействия между факторами Chordin, BMP4 и Sizzled в рамках модели ингибирования растяжения отражены на рис. 1а–1в. Chordin здесь выступает в роли агента “морфоген”, а Sizzled – в роли агента “экспандер”.
Рис. 1.
Схемы взаимодействия факторов при установлении дорсо-вентрального градиента pSmad1 у X. laevis (а), а также разметки пресомитной мезодермы у D. rerio (г). Стрелка (→), указывающая на фактор означает активацию его продукции, стрелка; указывающая на крест (→X), означает деградацию фактора; синяя стрелка с треугольным наконечником означает базальную продукцию; стрелка с тупым концом (⊣) означает ингибирование. Справа от каждой из схем даны приблизительные распределения морфогенов в пространстве интактного (б, д) и уменьшенного (в, е) эмбрионов. Изогнутая стрелка на (б) демонструрует “растягивающее” действие фактора Sizzled на градиент Chordin; изогнутая стрелка на (е) демонстрирует “сжимающее” действие фактора Lefty на градиент Nodal. Схемы (а) и (г) восстановлены по уравнениям, приведенным в работах (Inomata, 2013, 2017) и (Almuedo-Castillo, 2018) соответственно.
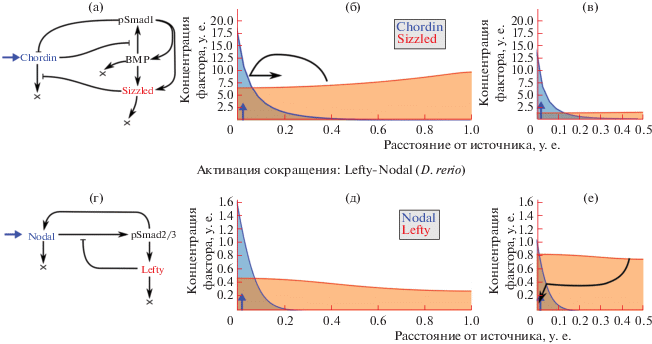
В противовес “ингибированию растяжения” авторы предположили и другой возможный механизм: “активация сокращения” (Contraction-Induction). В этом случае в модели рассматриваются два агента “морфоген” и “контрактор”. Первый активирует продукцию второго, а второй – “сжимает” распределение морфогена. Можно видеть, что все взаимодействия в этой модели организованны как бы обратно по отношению к модели ингибирования растяжения.
В 2018 году вышла первая экспериментальная работа, наглядно иллюстрирующая скейлинг у данио по механизму типа “активация сокращения” (Almuedo-Castillo, 2018). Исследователи удаляли часть клеток бластодиска данио на стадии средней бластулы и наблюдали закономерное изменение размера пресомитной мезодермы. Ответственными за эту разметку называются хорошо известная пара морфогена Nodal и его ингибитора Lefty. Известно, что активация Nodal-каскада вызывает дополнительную продукцию Nodal, а также продукцию Lefty, который, в свою очередь, ингибирует Nodal. Эти взаимодействия, а также разница в подвижности Nodal и Lefty, ранее позволили исследователям из той же группы рассматривать эти факторы как “активатор” и “ингибитор” в модели Тьюринговского типа (Müller, 2012), правда на другой стадии развития данио. Скейлинг области с активированным Smad2/3 (трансдуктором Nodal-каскада) по мнению авторов происходит по следующему механизму. При удалении части клеток на стадии бластодиска из той области, где Nodal не экспрессируется, исследователи не влияли на начальное количество вырабатываемого Nodal и, как следствие, количество Lefty. Однако концентрация Lefty в уменьшенных эмбрионах оказывалась выше из-за уменьшения объема бластодиска, а значит увеличивалась локальная концентрация Lefty, и на Nodal-активированную ткань оказывалось большее “давление” (рис. 1г–1е).
Скейлинг может реализовываться и многими другими способами. Например, скейлинг градиента bicoid у Drosophila связывают с видо-специфической адаптацией времени жизни РНК bicoid (Gregor, 2005). С систематическим описанием видов скейлинга можно ознакомиться в работе (Umilis, 2009), составленной на основе анализа модельных работ по Drosophila. В более современной работе (Rasolonjanahary, Vasiev, 2016) рассматривается еще больший спектр вариантов простейших систем, обладающих свойством скейлинга, включая и системы Тьюринговского типа. Что немаловажно, само понятие скейлинг на сегодняшний день получило более строгое определение, введены специальные величины для его измерения (“scaling measures”). Стоит отметить, что сегодня все еще достаточно трудно выделить единый общий формализм из всего пула работ по скейлингу из-за их некоторой разрозненности.
СКЕЙЛЕРЫ – РАЗМЕРО-ЧУВСТВИТЕЛЬНЫЕ МОРФОГЕНЫ
В недавней работе мы постулировали и подтвердили с помощью математического моделирования обоснованность гипотезы о том, что при основных описанных в литературе модельных вариантах скейлинга всегда есть некий белковый фактор(ы), концентрация которого зависит от размера эмбриона (Orlov et al., неопубл.). Подобные факторы были названы нами скейлерами. Именно изменение концентраций скейлеров в ответ на изменение размера эмбриона обеспечивает скейлинг формирующегося в РД системе градиента морфогена. В отличие от скейлеров, при условии успешного скейлинга концентрации большинства белков в эмбрионах разного размера не должны меняться. Указания на существование скейлеров приводились и ранее. Так, в работе (Inomata, 2013) при моделировании оказывалось, что количество Sizzled в более крупных зародышах увеличивалось непропорционально, что позволяло “растянуть” градиент Chordin до нужных пропорций (рис. 1б). Напротив, в работе (Almuedo-Castillo, 2018) количество Lefty увеличивалось в уменьшенных эмбрионах, что позволяло “сжать” градиент Nodal до нужных пропорций (рис. 1е).
Очевидно, что идентификация скейлеров, с последующим изучением механизмов их регуляции и молекулярных функций, могла бы стать эффективным подходом для выяснения механизмов скейлинга. Основываясь на выводе наших теоретических исследований о зависимости концентраций скейлеров от размера эмбриона мы разработали экспериментальный подход, позволяющий прицельно идентифицировать такие факторы путем сравнения транскриптомов эмбрионов нормального размера и искусственно уменьшенных. Этот подход базируется на предположении о том, что изменение концентраций, по-крайней мере части скейлеров, является следствием изменения уровней экспрессии кодирующих их генов. Используя данный подход, мы смогли выявить по-крайней мере один подобный ген и, соответственно, кодируемый им белок (матриксную металлопротеиназу-3 – MMP3), регулирующий скейлинг дорсо-вентральной разметки у эмбрионов шпорцевой лягушки. Секретируемая матриксная металлопротеиназа MMP3, также известная как стромелизин-1, участвует в расщеплении белков внеклеточного матрикса в нормальных физиологических процессах, таких как эмбриональное развитие и размножение, а также при многих патологиях, таких, как артрит, метастазы опухолей и т.п. (см. например: Lee et al., 2014; Cui et al., 2017). В связи с этим, изучение этого фермента, помимо фундаментальной науки, представляют большой интерес для биомедицины.
Кроме того, в этом исследовании нами был идентифицирован ряд других генов, резко меняющих в ту или иную сторону интенсивность своей экспрессии в искусственно уменьшенных эмбрионах и, возможно, кодирующих потенциальные скейлеры. Среди этих генов особенно выделяется ген SLC16A6 из суперсемейства solute carrier, т.к. концентрация его транскриптов в уменьшенных эмбрионах увеличивается до семи раз по сравнению с нормой. При этом в литературе практически отсутствуют данные о функции SLC16A6, хотя была показана активация этого гена в некоторых типах человеческих опухолей (https://www.proteinatlas.org/ ENSG00000108932-SLC16A6/pathology). Последнее обстоятельство делает актуальными исследования SLC16A6 для биомедицины.
Таким образом, очевидно, что предложенный нами подход, позволяющий проводить прицельный поиск вовлеченных в скейлинг генов, открывает широкие перспективы для изучения механизмов скейлинга в развитии самых разных организмов.
ПЕРСПЕКТИВНЫЕ ОРГАНИЗМЫ ДЛЯ ПОИСКА СКЕЙЛЕРОВ
Организмами, эмбрионы которых демонстрируют наиболее яркую способность к скейлингу, а значит являются перспективными объектами для поиска генов с экспрессией, зависимой от размеров эмбриона, т.е. потенциальных регуляторов скейлинга, традиционно являются беспозвоночные. В частности, морские ежи и гидроидные полипы.
Впервые способность к скейлингу у эмбрионов морского ежа была продемонстрирована Дришем конце в конце XIX века (Driesch, 1891). Дриш показал, что при разделении бластомеров морского ежа на стадии 2-х клеток, каждый из них дает маленькую гармонично сложенную личинку. Затем, в первой половине XX века аналогичные опыты, демонстрирующие скейлинг меридионально разделенных эмбрионов морского ежа на более поздних стадиях развития, были проведены Герстадиусом (Horstadius, 1939). Наконец, сравнительно недавно Л.В. Белоусовым и С.Б. Богдановским было установлено, что даже меридионально разделенные половинки бластулы морского ежа способны к правильному скейлингу (Белоусов, Богдановский, 1980). Важно, что уже 12 лет назад был секвенирован геном одного из видов морских ежей – Strongilocentrotus purpuratus (Sodergren et al., 2006). Также существуют транскриптомные он-лайн базы для некоторых других видов (http://www.echinobase.org/Echinobase/). Имеются многочисленные исследования раннего паттернинга зародышей морских ежей на стадии бластулы-гаструлы методом гибридизации in situ с зондами к транскриптам различных регуляторов развития (см. обзор Angerer et al., 2011). Эти исследования подтверждают активное формирование пространственной разметки зародыша на этих стадиях. Все это создает хорошую основу для проведения различных исследований, связанных с транскриптомным анализом и последующим исследованием роли найденных генов в процессе раннего паттернинга. Так же существенно и то, что для морских ежей разработана эффективная методика массового разделения бластомеров, что, учитывая малые размеры их эмбрионов, очень важно для сбора необходимых количеств материала для транскриптомного анализа (Vacquier, Mazia, 1968; Satoh, Kominami, 2008).
В отличие от морских ежей, способность к скейлингу разделенных бластомеров была продемонстрирована у популярного модельного гидроида Nematostella vectensis только в XXI веке (Fritzenwanker et al., 2007). У этого вида также недавно был секвенирован геном и имеются транскриптомные базы данных (Putnam et al., 2007; Warner et al., 2018). Как и у морского ежа, для Nematostella vectensis есть уже довольно много исследований раннего паттернинга эмбрионов, которые показывают, что глобальная пространственная разметка зародыша происходит уже в период бластуляции и в общих чертах заканчивается к началу гаструляции (Magie et al., 2007; Leclère et al., 2016; DuBuc et al., 2018). Существует работа, с предложенной системой уравнений, описывающих установление градиента BMP и формирование вторичной оси у этого кишечнополостного (Genikhovich, 2015). Таким образом, данный объект, как и морской еж, представляется весьма перспективным для исследований скейлинга.
Работа выполнена за счет гранта Российского научного фонда (проект № 14-14-00557П).
Список литературы
Белинцев Б.Н. Диссипативные структуры и проблема биологического формообразования // Успехи физических наук. 1983. Т. 141. № 1. С. 55–101.
Белоусов Л.В., Богдановский С.Б. Клеточные механизмы эмбриональных регуляций у морских ежей // Онтогенез. 1980. T. 11. С. 467–475.
Almuedo-Castillo M., Bläßle A., Mörsdorf D. et al. Scale-invariant patterning by size-dependent inhibition of Nodal signalling // Nature Cell Biology. 2018. V. 20. № 9. P. 1032–1042.
Angerer L.M., Yaguchi R., Angerer R., Burke R.D. The evolution of nervous system patterning: insights from sea urchin development // Development. 2011. V. 138. № 17. P. 3613–3623.
Ben-Zvi D., Shilo B.-Z., Fainsod A., Barkai N. Scaling of the BMP morphogen activation gradient in Xenopus embryos // Nature. 2008. V. 453. № 7199. P. 1205–1211.
Ben-Zvi D., Pyrowolakis G., Barkai N., Shilo B.-Z. Expansion-repression mechanism for scaling the Dpp activation gradient in Drosophila wing imaginal discs // Current Biology. 2011. V. 21. № 16. P. 1391–1396.
Cui N., Hu M., Khalil R.A. Biochemical and biological attributes of matrix metalloproteinases // Prog. Mol. Biol. Transl. Sci. 2017. V. 147. P. 1–73.
Dawes J.H. The emergence of a coherent structure for coherent structures: localized states in nonlinear systems // Philos. Trans. A. 2010. V. 368. № 1924. P. 3519–3354.
Driesch H. Der Werth der beiden ersten Furchungszellen in der Echinodermentwicklung. Experimentelle Erzeugung von Theil und Doppelbildungen // Z. Wiss. Zool. 1891. V. 53. P. 160–178.
DuBuc T.Q., Stephenson T.B., Rock A.Q., Martindale M.Q. Hox and Wnt pattern the primary body axis of an anthozoan cnidarian before gastrulation // Nat. Com. 2018. V. 9. № 1. P. 2007.
Eldar A., Dorfman R., Weiss D. et al. Robustness of the BMP morphogen gradient in Drosophila embryonic patterning // Nature. 2002. V. 419. P. 304–308.
Eom D.S., Bain E.J., Patterson L.B. et al. Long-distance communication by specialized cellular projections during pigment pattern development and evolution // Elife. 2015. V. 4. P. 2686–2695.
Fritzenwanker J.H., Genikhovich G., Kraus Y., Technau U. Early development and axis specification in the sea anemone Nematostella vectensis // Dev. Biol. 2007. V. 310. № 2. 264–279.
Genikhovich G., Fried P., Prünster M.M. et al. Axis patterning by BMPs: cnidarian network reveals evolutionary constraints // Cell. Rep. 2015. V. 10. № 10. P. 1646–1654.
Gierer A., Meinhardt H. A theory of biological pattern formation // Kybernetik. 1972. V. 12. № 1. P. 30–39.
Green J.B.A., Sharpe J. Positional information and reaction-diffusion: two big ideas in developmental biology combine // Development. 2015. V. 142. № 7. P. 1203–1211.
Gregor T., Tank D.W., Wieschaus E.F., Bialek W. Probing the limits to positional information // Cell. 2007. V. 130. № 1. P. 153–164.
Horstadius S. The mechanisms of sea urchin development, studied by operative methods // Biol. Rev. 1939. V. 14. № 2. P. 132–179.
Houchmandzadeh B., Wieschaus E., Leibler S. Establishment of developmental precision and proportions in the early Drosophila embryo // Nature. 2002. V. 415. № 6873. P. 798–802.
Inomata H. Scaling of pattern formations and morphogen gradients // Devel. Growth Diff. 2017. V. 59. № 1. P. 41–51.
Inomata H., Shibata T., Haraguchi N., Sasai Y. Scaling of dorsal-ventral patterning by embryo size-dependent degradation of spemann’s organizer signals // Cell. 2013. V. 153. № 6. P. 1296–1311.
Leclère L., Bause M., Sinigaglia C. et al. Development of the aboral domain in Nematostella requires β-catenin and the opposing activities of Six3/6 and Frizzled5/8 // Development. 2016. V. 143. № 10. P. 1766–1777.
Lee J.Y., Choi H.Y., Ahn H.J. et al. Matrix metalloproteinase-3 promotes early blood-spinal cord barrier disruption and hemorrhage and impairs long-term neurological recovery after spinal cord injury // Am. J. Pathol. 2014. V. 184. № 11. P. 2985–3000.
Levin M. Morphogenetic fields in embryogenesis, regeneration, and cancer: non-local control of complex patterning // BioSystems. 2012. V. 109. № 3. P. 243–261.
Magie C.R., Daly M., Martindale M.Q. Gastrulation in the cnidarian Nematostella vectensis occurs via invagination not ingression // Dev. Biol. 2007. V. 305. № 2. P. 483–497.
Meinhardt H. Models of biological pattern formation: from elementary steps to the organization of embryonic axes // Current Topics in Developmental Biology. 2008. V. 81. № 7. C. 1–63.
Meinhardt H. Models for the generation and interpretation of gradients // Cold Spring Harb. Perspect. Biol. 2009. V. 1. № 4. P. a001362.
Müller P., Rogers K.W., Jordan B.M. et al. Differential diffusivity of Nodal and Lefty underlies a reaction-diffusion patterning system // Science. 2012. V. 336. № 6082. P. 721–724.
Mathematical Biology II: Spatial Models and Biomedical Applications / Ed. Murray J.D. New York: Springer-Verlag, 1993. 811 p.
Okabe-Oho Y., Murakami H., Oho S., Sasai M. Stable, precise, and reproducible patterning of bicoid and hunchback molecules in the early Drosophila embryo // PLoS Comput. Biol. 2009. V. 5. № 8. P. e1000486.
Porcher A., Dostatni N. The Bicoid Morphogen System // Curr. Biol. 2010. V. 20. № 5. P. R249–R254.
Putnam N.H., Srivastava M., Hellsten U. et al. Sea anemone genome reveals ancestral eumetazoan gene repertoire and genomic organization // Science. 2007. V. 317. № 5834. P. 86–94.
Rasolonjanahary M., Vasiev B. Scaling of morphogenetic patterns in reaction-diffusion systems // J. Theor. Biol. 2016. V. 404. P. 109–119.
Satoh K., Kominami T. Initial observation of potential factors involved in the specification process of oral-aboral axis in the sand dollar Scaphechinus mirabilis // Develop. Growth Differ. 2008. V. 50. № 8. P. 675–687.
Schmierer B., Tournier A.L., Bates P.A., Hill C.S. Mathematical modeling identifies Smad nucleocytoplasmic shuttling as a dynamic signalinterpreting system // Proc. Natl. Acad. Sci. USA. 2008. V. 105. № 18. P. 6608–6613.
Shingleton A.W., Frankino W.A., Flatt T. et al. Size and shape: the developmental regulation of static allometry in insects // Bioessays. 2007. V. 29. № 6. P. 536–548.
Sick S., Reinker S., Timmer J., Schlake T. WNT and DKK determine hair follicle spacing through a reaction-diffusion mechanism // Science. 2006. V. 314. № 5804. P. 1447–1450.
Sodergren E., Weinstock G.M., Davidson E.H. et al. The Genome of the Sea Urchin Strongylocentrotus purpuratus // Science. 2006. V. 314. № 5801. P. 941–952.
Teleman A.A., Cohen S.M. Dpp gradient formation in the Drosophila wing imaginal disc // Cell. 2000. V. 103. № 6. P. 10.
Turing A. The chemical basis of morphogenesis // Philos. Trans. R. Soc. Lond. B. 1952. V. 237. № 641. P. 37–72.
Vacquier V.D., Mazia D. Twinning of sea urchin embryos by treatment with dithiothreitol. Roles of cell surface interactions and of the hyaline layer // Exp. Cell Res. 1968. V. 52. № 2–3. P. 459–468.
Umulis D.M. Analysis of dynamic morphogen scale invariance // J. R. Soc. Interface. 2009. V. 6. № 41. P. 1179–1191.
Umulis D.M., Othmer H.G. Mechanisms of scaling in pattern formation // Development. 2013. V. 140. № 24. P. 4830–4843.
Warner J.F., Guerlais V., Amiel A.R. et al. NvERTx: a gene expression database to compare embryogenesis and regeneration in the sea anemone Nematostella vectensis // Development. 2018. V. 145. № 10. P. dev162867.
Wartlick O., Kicheva A., González-Gaitán M. Morphogen gradient formation // Cold Spring Harb. Perspect. Biol. 2009. V. 1. № 3. P. a001255.
Wartlick O., Mumcu P., Kicheva A. et al. Dynamics of Dpp signaling and proliferation control // Science. 2011. V. 331. № 6021. P. 1154–1159.
Wolpert L. Positional information and the spatial pattern of cellular differentiation // J. Theor. Biol. 1969. V. 25. № 1. P. 1–47.
Yamaguchi M., Yoshimoto E., Kondo S. Pattern regulation in the stripe of zebrafish suggests an underlying dynamic and autonomous mechanism // Proc. Natl. Acad. Sci. USA. 2007. V. 104. № 12. P. 4790–4793.
Дополнительные материалы отсутствуют.
Инструменты
Онтогенез


