Онтогенез, 2020, T. 51, № 1, стр. 64-72
Дофамин-продуцирующие нейроны в онтогенезе у крыс: фенотипические особенности, характеризующие молекулярные механизмы секреции и регуляции
А. И. Куртова a, Л. К. Дильмухаметова a, Т. С. Пронина a, Э. Р. Мингазов a, Ю. О. Никишина a, К. К. Сухинич a, М. В. Угрюмов a, b, *
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
b Национальный исследовательский университет “Высшая школа экономики”
101000 Москва, ул. Мясницкая, 20, Россия
* E-mail: mugrumov@mail.ru
Поступила в редакцию 30.07.2018
После доработки 22.05.2019
Принята к публикации 20.06.2019
Аннотация
Дофамин (ДА), синтезируемый ДА-ергическими нейронами и так называемыми моноферментными нейронами, участвует в регуляции дифференцировки нейронов мозга в критический период морфогенеза. Целью данной работы явилось изучение фенотипических особенностей ДА-продуцирующих нейронов в ряде отделов мозга (стриатум, супрахиазматическое ядро и аркуатное ядра) у крыс в онтогенезе – с 18-го эмбрионального дня (Э18) до 60-го постнатального дня (П60). В качестве маркеров функциональной активности этих нейронов использованы ферменты синтеза ДА – тирозингидроксилаза (ТГ) и декарбоксилаза ароматических аминокислот (ДАА), везикулярные транспортеры моноаминов (ВМАТ) и рецепторы к дофамину Д1 и Д2. Экспрессия данных маркеров была исследована с помощью двойного иммуногистохимического мечения на ТГ и ДАА, а также с помощью ПЦР генов ТГ, ДАА, ВМАТ1, ВМАТ2 и рецепторов к ДА – Д1 и Д2. В стриатуме, несмотря на то, что мРНК всех перечисленных маркеров выявляется на протяжении всего исследуемого периода онтогенеза, иммунопозитивные на ТГ и ДАА биферментные нейроны обнаружены только на Э18, а моноферментные ТГ или ДАА-содержащие нейроны – только на П60. В супрахиазматическом ядре в раннем постнатальном периоде (П10), наряду с моноферментными ДАА-нейронами, присутствует моноферментные ТГ-иммунореактивные волокна, иннервирующие вентральную область ядра. В супрахиазматическом ядре на П10 отсутствует экспрессия генов ТГ, ВМАТ1 и ВМАТ2, однако обнаружены транскрипты генов Д1 и Д2. В аркуатном ядре у плодов крыс в конце пренатального периода (Э21) содержатся только моноферментные нейроны: ТГ-нейроны – в вентролатеральной области ядра, и ДАА-нейроны – в дорсомедиальной области. При этом было показано, что мРНК ТГ, ДАА, ВМАТ2, Д1 и Д2 экспрессируется в обеих областях аркуатного ядра. Таким образом, в стриатуме, супрахиазматическом и аркутном ядрах у крыс в онтогенезе присутствуют недофаминергические нейроны, содержащие по одному из ферментов – ТГ или ДАА, что позволяет предположить наличие в этих отделах мозга кооперативного синтеза дофамина.
ВВЕДЕНИЕ
Биогенные моноамины, в частности дофамин (ДА), в развивающемся мозге играют роль морфогенетических факторов, обеспечивающих аутокринную и паракринную регуляцию дифференцировки нейронов-мишеней (Gaspar et al., 2003; Pronina et al., 2003; Izvolskaya et al., 2005). В наших предыдущих исследованиях показано, что ДА синтезируется не только в дофаминергических нейронах, экспрессирующих оба фермента синтеза ДА – тирозингидроксилазу (ТГ) и декарбоксилазу ароматических L‑аминокислот (ДАА), но и в недофаминергических, так называемых моноферментных нейронах, содержащих по одному из указанных ферментов (Ugrumov et al., 2004, 2013; Kozina et al., 2017). В отличие от ДА-ергических нейронов, в которых реализуются все этапы синтеза ДА из L-тирозина – аминокислоты-предшественницы, моноферментные нейроны производят этот нейротрансмиттер в тандеме по конвейерному принципу. При этом в нейронах, экспрессирующих только ТГ, L‑тирозин превращается в L-диоксифенилаланин (L-ДОФА), который выделяется из этих нейронов и захватывается близлежащими нейронами, содержащими ДАА, где и происходит синтез ДА (Ugrumov, 2013). Несмотря на то, что кооперативный синтез ДА моноферментными нейронами доказан, особенности фенотипа, отражающие молекулярные механизмы функционирования этих нейронов мало изучены. Так, остается невыясненным экспрессируют ли моноферментные нейроны гены “везикулярных моноаминовых транспортеров 1 и 2” (ВМАТ1 и ВМАТ2), обеспечивающих захват ДА из цитозоля в везикулы (Hoffman et al., 1998).
Особый интерес представляет судьба моноферментных нейронов в онтогенезе. Так, предполагается, что ТГ-иммунореактивные нейроны, иннервирующие супрахиазматическое ядро (СХЯ) в раннем постнатальном периоде, позднее либо перестают экспрессировать ТГ, либо погибают (Beltramo et al., 1994; Ugrumov, 2009). В отличие от СХЯ, в аркуатном ядре (АЯ) моноферментные нейроны сохраняются в течение всей жизни, причем в постнатальном периоде в части этих нейронов ко-экспрессируется по второму комплементарному ферменту синтеза ДА. Эти биферментые нейроны можно считать дофаминергическими, хотя в них низкий уровень экспрессии мембранного переносчика ДА, третьего обязательного атрибута дофаминергических нейрнов (Ershov et al., 2002).
Целью данной работы явилось изучение фенотипических особенностей ДА-продуцирующих нейронов, характеризующих молекулярные механизмы секреции и регуляции, в мозге у крыс в онтогенезе. В качестве объектов исследования были выбраны АЯ, СХЯ и стриатум – те отделы мозга, в которых, по нашим предыдущим данным и данным литературы, на определенных этапах онтогенеза доминируют моноферментные нейроны (Beltramo et al., 1994; Ershov et al., 2002, Buscetti et al., 2012).
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена на самцах крыс линии Wistar на 18-й день эмбрионального периода (Э18), Э21, 5-й день постнатального периода (П5), П10 и П60. День обнаружения сперматозоидов в вагинальном мазке считали первым эмбриональным днем, а день рождения крысят – первым постнатальным днем. Все манипуляции с животными были проведены согласно протоколу, утвержденным комиссией по биоэтике Института биологии развития им. Н.К. Кольцова РАН, и находящемуся в соответствии с национальными и международными требованиями.
Иммуногистохимия. Животных (беременных самок и самцов) предварительно анестезировали хлоралгидратом (Sigma, USA) в дозе 400 мг/кг, а затем перфузировали через сердце сначала 0.02 М фосфатно-солевым буфером (ФСБ) (рН 7.2–7.4) в течение 10–15 мин при 37°С, а затем охлажденным (4°С) 4% параформальдегидом на 0.2 М ФСБ (рН 7.2–7.4) в течение 15 мин. После декапитации выделяли мозг и проводили постфиксацию в 4% параформальдегиде в течение 12 часов при 4°C. Затем мозг промывали в 0.02 М ФСБ 3 раза по 15 мин, инкубировали в 20% сахарозе в течение 24 ч при 4°С, замораживали в гексане при –40°С и хранили при –70°С. Мозг был получен от четырех животных каждого возраста – Э18, Э21, П5, П10 и П60.
На криостате LeicaCM1950 (“Leica”, Германия) приготавливали серийные фронтальные срезы мозга крыс толщиной 10 мкм на уровне стриатума на Э18, Э21, П5, П10 и П60, АЯ на Э21 и СХЯ на П10. Для двойного иммуномечения ТГ и ДАА срезы на стеклах последовательно инкубировали в растворах на основе ФСБ: а) с 3% бычьим сывороточным альбумином (Sigma, США) и 0.3% Triton Х-100 (Sigma, США) в течение 30 мин при 20°С; б) с 1% лаурилсульфатом натрия (SDS, Sigma, США) в течение 3-х мин при 20°С; в) с поликлональными антителами овцы к ТГ (1 : 700) (Chemicon, США) и поликлональными антителами кролика к ДАА (1 : 300) (Abcam, США), 1% бычьим сывороточным альбумином и 0.1% Triton Х-100 в течение 24 ч при 20°С; г) с FITC-конъюгированными антителами осла против гамма-глобулинов овцы (1 : 40) (FITC antisheep, Sigma, США) и Су3-конъюгированными антителами козы против гамма-глобулинов кролика (1 : 500) (CY3 antirabbit, Sigma, США) в течение 2-х ч при 20°С. После каждой инкубации, кроме последней, срезы промывали в 0.02 М ФСБ 3 раза в течение 15 мин. После последней инкубации срезы промывали в 0.02 М ФСБ в течение часа и заключали в гидрофильную среду Mowiol (Calbiochem, Germany). Срезы стриатума, АЯ и СХЯ изучали в конфокальном микроскопе Leica TC SP5.
Полимеразно-цепная реакция (ПЦР). Крыс под наркозом декапитировали и извлекали мозг. Затем приготавливали фронтальные срезы стриатума, АЯ и СХЯ толщиной 300 мкм на вибратоме Vibratome Series 1000 (“Intracel LTD”, Великобритания) в растворе Кребса–Рингера, содержащем 120 мМ NaCl, 4.8 мМ KCl, 2 мМ CaCl2, 1.3 мМ MgSO4, 25 мМ NaHCO3, 10 мМ D-глюкозы, 20 мМ HEPES, 0.1 мМ аскорбиновой кислоты (pH 7.2–7.4; 4°С). Из полученных срезов на охлажденной пластине под контролем бинокуляра выделяли стриатум (на Э18, Э21, П5, П10, П60), АЯ (на Э21) и СХЯ (на П10). При этом АЯ разделяли на дорсомедиальную и вентролатеральную области, которые собирали в отдельные пробирки. В одной пробе пулировали АЯ от четырех животных, а СХЯ от шести животных. В случае стриатума одна проба включала материал от одного животного. Всего было собрано по 4 пробы из каждой области мозга. Полученные образцы ткани замораживали в жидком азоте и хранили при –70°С.
Из описанных выше проб выделяли тотальную РНК с помощью TRI Reagent (Sigma, США) согласно протоколу производителя. Для удаления примеси геномной ДНК выделенную РНК обрабатывали ДНКазой (Fermentas, США). РНК переосаждали в 4 М растворе хлорида лития, концентрацию обработанной РНК измеряли на спектрофотометре Nanodrop 8000 (Thermo Scientific, США). Синтез кДНК проводили с использованием обратной транскриптазы M-MLV и рандомных гексануклеотидов (Fermentas, США).
В СХЯ и АЯ с помощью ПЦР определяли экспрессию генов ТГ, ДАА, ВМАТ1, ВМАТ2, а также генов рецепторов к ДА – Д1 и Д2. В стриатуме с помощью ПЦР определяли мРНК ВМАТ1 и ВМАТ2. ПЦР проводили на амплификаторе IQ5 Cycler (Biorad, США) c использованием смеси ScreenMix-HS (“Евроген”, Россия) и специфических праймеров для генов ТГ, ДАА, ВМАТ1, ВМАТ2, Д1, Д2 и “гена домашнего хозяйства” GAPDH (“Евроген”, Россия) (табл. 1). Электрофоретическое разделение ПЦР-продуктов проводили в 1% агарозном геле, интенсивность свечения полос детектировали в системе визуализации гелей и мембран Chemi Docтм Touch Imaging System (BioRad Laborarories, США).
Таблица 1.
Специфические гексоолигонуклеотиды
| Ген | 5'-3' смысловой | 5'-3' антисмысловой |
|---|---|---|
| TH | CTGTCCGCCCGTGATTTT | GAGGCCCCCAGAGATG |
| AADC | CCCCAGGAGCCAGAAACA | AGCCCAGGAGAAGCCAATG |
| VMAT1 | CATCTACTGGGGGTGTTATCGT | TGTGGGCTTCTGGACTGTGT |
| VMAT2 | TATAACCGCGCAGTCACAGG | AGCAGCAGCGCAAGGAAC |
| D1R | CAACTGGGGCTGAACAAGAAG | GGAAACAGGCCGTGAGGAT |
| D2R | CAGACAGGCCCCACTACAACTA | ACAACCCACGGCATTACCA |
| 18S rRNA2 | ACGGACCAGAGCGAAAGCAT | TGTCAATCCTGTCCGTGTCC |
| GAPDH | CTGACATGCCGCCTGGAGAAA | TGGAAGAATGGGAGTTGCTGTTGA |
В стриатуме на Э18, Э21, П5, П10 и П60 также определяли содержание мРНК ТГ и ДАА с помощью ПЦР в реальном времени. Реакцию проводили с помощью автоматического амплификатора 7500 Real-Time PCR System (Applied Biosystems, США) с использованием смеси qPCRmix-HS SYBR + ROX (Fermentas, США) и специфических праймеров для генов ТГ и ДАА (“Евроген”) (табл. 1). Значения, полученные для каждого образца, нормировали на экспрессию “гена домашнего хозяйства” 18S рРНК и выражали в условных единицах. Расчет относительной экспрессии гена проводили методом ΔΔCt с учетом эффективности ПЦР. За единицу брали экспрессию гена на П60, как наиболее стабильную. Эффективность ПЦР определяли методом построения стандартных кривых (Bookout et al., 2006). Полученные данные обрабатывали в программе GraphPad Prism6.
РЕЗУЛЬТАТЫ
Стриатум. При использовании двойного иммуномечения нейроны, иммунореактивные на ТГ и ДАА (биферментные), были обнаружены в стриатуме у крыс только на Э18 (рис. 1а–1в). На Э21, П5 и П10 нейроны, иммунореактивные на ТГ и/или ДАА, не были обнаружены. На П60 в стриатуме были выявлены моноферментные нейроны, иммунореактивные на ДАА или ТГ (рис. 1).
Рис. 1.
Двойное иммуномечение нейронов, экспрессирующих ферменты синтеза дофамина в стриатуме у крыс в онтогенезе. Масштаб – 30 мкм, ТГ – тирозингидроксилаза, ДАА – декарбоксилаза ароматических аминокислот, Э18 – 18-ый эмбриональный день, П60 – 60-ый постнатальный день; стрелки – иммунореактивные нейроны.

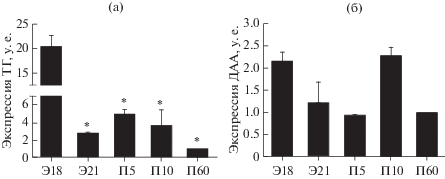
С помощью ПЦР в стриатуме у крыс всех изученных возрастов (Э18, Э21, П5, П10, П60) выявлена мРНК ТГ и ДАА. При использовании ПЦР в реальном времени показано, что уровень мРНК ТГ максимален на Э18, затем многократно снижается к Э21 и после этого не изменяется до П60 (рис. 2а). Уровень мРНК ДАА не изменяется в течение всего изученного периода онтогенеза – с Э18 до П60 (рис. 2б).
Рис. 2.
ПЦР в реальном времени мРНК тирозингидроксилазы (ТГ) (а) и декарбоксилазы ароматических L-аминокислот (ДАА) (б) в стриатуме у крыс на 18-й эмбриональный день (Э18), Э21, 5-й постнатальный день (П5), П10 и П60. M ± m, n = 4 (в каждой возрастной группе), * p < 0.05, сравнение с Э18.
С помощью ПЦР в стриатуме у крыс были выявлена мРНК ВМАТ1 на всех исследованных сроках развития – Э18, Э21, П5, П10, П60, тогда как мРНК ВМАТ2 была обнаружена только в пренатальном периоде – на Э18 и Э21 (рис. 3).
Рис. 3.
Экспрессия генов ВМАТ1 и ВМАТ2 в стриатуме у крыс на 18-й эмбриональный день (Э18), Э21, 5-й постнатальный день (П5), П10 и П60. Данные нормированы на “ген домашнего хозяйства” (GAPDH). ВМАТ1 и ВМАТ2 – везикулярный транспортер моноаминов первого и второго типов.

Супрахиазматическое ядро. С помощью двойного иммуномечения ТГ и ДАА у крыс на П10 в вентральной области СХЯ выявлены многочисленные моноферментные ТГ-иммунореактивные нервные волокна, образующие сплетение (рис. 4а). В дорсальной части ядра присутствуют моноферментные ДАА-иммунореактивные нейроны (рис. 4а).
Рис. 4.
Нейроны, экспрессирующие маркеры дофаминергического фенотипа в супрахиазматическом ядре (пунктирная линия) у крыс на 10-й постнатальный день: сплетение моноферментных ТГ-иммунореактивных нервных волокон (головки стрелок), моноферментные ДАА-иммунореактивные нейроны (тонкие стрелки) (двойное иммуномечение), мРНК ТГ, ДАА, ВМАТ2, Д1 и Д2 рецепторов (ПЦР, нормирование по “гену домашнего хозяйства” – GAPDH) (б). Масштаб рис. а – 40 мкм. OX – оптическая хиазма, III – 3-й желудочек мозга, ТГ – тирозингидроксилаза, ДАА – декарбоксилаза ароматических аминокислот, ВМАТ2 – везикулярный транспортер моноаминов второго типа, Д1 и Д2 – рецепторы к дофамину 1 и 2-ого типов.

Анализ экспрессии генов с помощью ПЦР показал, что в СХЯ на П10 присутствует мРНК ДАА, Д1 и Д2 рецепторов. При этом не была обнаружена мРНК ТГ и ВМАТ2 (рис. 4б).
Аркуатное ядро. Двойное иммуномечение ТГ и ДАА показало, что в АЯ на Э21 практически все нейроны, иммунореактивные на ТГ и ДАА, являются моноферментными (рис. 5а). Действительно, при анализе серийных срезов АЯ пяти плодов крыс был обнаружен только один биферментный нейрон (рис. 5а). Моноферментные ТГ-иммунореактивные нейроны локализованы в вентролатеральной области ядра, а моноферментные ДАА-иммунореактивные нейроны – в дорсомедиальной области ядра (рис. 5а).
Рис. 5.
Нейроны, экспрессирующие маркеры дофаминергического фенотипа в аркуатном ядре (пунктирная линия) у крыс на 21-й эмбриональный день: моноферментные ТГ-иммунореактивные нейроны в вентролатеральной области (ВЛ) ядра (широкая стрелка) и моноферментные нейроны, иммунореактивные на ДАА в дорсомедиальной области (ДМ) ядра (тонкая стрелка) (а, двойное иммуномечение), мРНК ТГ, ДАА, ВМАТ1, ВМАТ2, Д1 и Д2 рецепторов (б, ПЦР, нормирование по “гену домашнего хозяйства” – GAPDH). Масштаб рис. а – 40 мкм. III – 3-й желудочек мозга, СВ – срединное возвышение, головка стрелки – биферментный нейрон, ТГ – тирозингидроксилаза, ДАА – декарбоксилаза ароматических аминокислот, ВМАТ1 и ВМАТ2 – везикулярный транспортер моноаминов первого и второго типов, Д1 и Д2 – рецепторы к дофамину 1 и 2-ого типов.
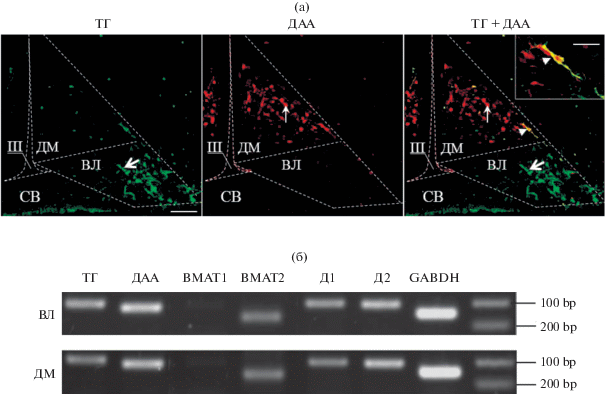
Анализ экспрессии генов ферментов синтеза ДА на Э21 показал, что мРНК ТГ и ДАА присутствует как в вентролатеральной, так и в дорсомедиальной областях АЯ (рис. 5б). Также в обеих областях АЯ на Э21 обнаружена мРНК ВМАТ2, Д1 и Д2 рецепторов (рис. 5б).
ОБСУЖДЕНИЕ
В данном исследовании показано, что нейроны, содержащие ферменты синтеза ДА, в исследованных отделах мозга – в стриатуме, в СХЯ и в АЯ, различаются как по протеомному фенотипу, так и по экспрессии специфических генов. Так, в стриатуме у крыс на разных стадиях онтогенеза выявлены два типа нейронов, характеризующиеся различными признаками ДА-ергического фенотипа. Нейроны первого типа, выявленные на Э18, содержат оба фермента синтеза ДА. В этих же нейронах вероятно экспрессируется ген белка ВМАТ2, обеспечивающего запасание моноаминов в центральных моноаминергических нейронах, включая ДА-ергические нейроны черной субстанции. Захват моноаминов в гранулы из места их синтеза в цитозоле защищает их от ферментов деградации и предотвращает токсическое действие моноаминов при их избыточном накоплении в цитозоле (Schafer et al., 2013). В совокупности приведенные данные позволяют предположить, что в стриатуме у крыс на Э18 содержатся ДА-ергические нейроны, хотя для утверждения этого в дальнейших исследованиях следует убедиться в экспрессии в них гена мембранного транспортера ДА.
Нейроны второго типа, содержащиеся в стриатуме, причем только у взрослых крыс (П60), но отсутствующие в перинатальном периоде (Э21–П10), являются моноферментными, содержащими либо ТГ, либо ДАА. Полученные нами данные согласуются с результатами, полученными в работе Mura с коллегами (Mura et al., 1995), в которой показаны моноферментные нейроны, содержащие либо ТГ, либо ДАА в стриатуме у взрослых крыс после 6-гидроксидофамин-индуцированной односторонней дофаминергической денервации стриатума. Более того, по данным Ibáñez-Sandoval с коллегами и Xenias с коллегами в стриатуме у взрослых мышей коэкспрессия ТГ выявляется в ГАМК-ергических нейронах (Ibáñez-Sandoval et al., 2010; Xenias et al., 2015).
В отличие от типичных центральных моноаминергических нейронов, нейроны стриатума во все изученные сроки постнатального периода от П5 до П60, вместо гена ВМАТ2 экспрессируют ген ВМАТ1. Считается, что для ЦНС характерна экспрессия гена ВМАТ2, а ВМАТ1 экспрессируется в основном на периферии. Тем не менее, Hansson с коллегами (Hansson et al., 1998) показывает, что мРНК ВМАТ1 обнаруживается в мозге у крыс в различные периоды онтогенеза, что подтверждает полученные нами результаты. Однако работы, в которых, помимо экспрессии гена ВМАТ1, был бы обнаружен соответствующий белок, отсутствуют, поэтому данный вопрос требует дальнейшего изучения. Учитывая то, что, в отличие от стриатума, куда проецируются ДА-ергические аксоны, в черной субстанции, содержащей тела этих нейронов, экспрессируется ген ВМАТ2, можно предположить наличие различных механизмов запасания моноаминов в указанных отделах нигростриатной системы мозга.
Несмотря на то, что в перинатальном периоде (Э21–П10) в стриатуме у крыс иммуногистохимически не были обнаружены нейроны, содержащие ферменты синтеза ДА, в нейронах стриатума экспрессируются гены ТГ и ДАА. Это означает, что в перинатальном периоде либо не происходит трансляции ферментов синтеза дофамина, либо трансляция идет, но на таком низком уровне, что не выявляется иммуногистохимически. В литературе в раннем постнатальном периоде моноферментные ТГ-нейроны описаны в стриатуме только у мышей (Buscetti et al., 2012; Bupesh et al., 2014). По-видимому, у мышей и крыс существуют различия в экспрессии ТГ в стриатуме. Уровень мРНК ДАА в стриатуме сохранялся постоянным на всех исследованных сроках, хотя нейроны, содержащие ДАА, выявлялись только на Э18. По представлениям Mura и коллег, ДАА-нейроны в интактном стриатуме могут маскироваться плотной сетью ДАА-волокон, что не позволяет визуализировать нейроны (Mura et al., 1995). С другой стороны, очень часто отсутствует корреляция между транскрипцией и трансляцией (Kozina et al., 2014), что объясняется различными механизмами регуляции этих процессов.
В отличие от стриатума, в СХЯ отсутствует экспрессия гена ТГ, однако вентральная область этого ядра, причем только в раннем постнатальном периоде, заполнена сетью моноферментных ТГ-иммунореактивных нервных волокон (см. Результаты). Наличие такой транзиторной сети ТГ-иммунореактивных волокон в СХЯ было показано в нашем предыдущем исследовании (Beltramo et al., 1994) и подтверждено в данной работе. Более того, нами было ранее показано, эти волокна принадлежат моноферментным нейронам, расположенным за пределами СХЯ, хотя и недалеко от него (Mirochnik et al., 2002).
Обнаружение у взрослых грызунов в СХЯ вазопрессинергических нейронов, ко-экспрессирущих ДАА (Jaeger et al., 1983), позволило нам предположить, что ТГ-содержащие волокна и вазопрессинергические нейроны, ко-экспрессирующие ДАА, могут участвовать в кооперативном синтезе ДА. Выявленная в данном исследовании экспрессия гена ДАА в СХЯ у крыс на П10 является важным аргументом в пользу этого предположения. Дополнительный анализ показал, что в этих нейронах СХЯ в этот период развития отсутствует экспрессия мРНК ВМАТ2, что указывает на неспособность моноферментных вазопрессинергических нейронов депонировать синтезированный из L‑ДОФА ДА в секреторных гранулах, как это происходит в моноаминергических нейронах.
Крайне интересно и важно то, что в СХЯ совпадают по времени (ранний постнатальный период) два транзиторных события. С одной стороны, это – высокое содержание ТГ в нервных волокнах, что при наличии в СХЯ ДАА в вазопрессинергических нейронах предполагает наличие кооперативного синтеза ДА. С другой стороны, это – экспрессия рецепторов к ДА – Д1 и Д2, при отсутствии дофаминергических нейронов в СХЯ и его ближайшем окружении. В этом отношении наши данные хорошо согласуются с предыдущими исследованиями, в которых показано, что рецепторы к ДА экспрессируются в СХЯ у крыс в перинатальном периоде и отсутствуют у взрослых животных (Duffield et al., 1999). Учитывая то, что ранний постнатальный период является критическим периодом морфогенеза, нами предполагается, что транзиторный кооперативный синтез ДА недофаминергическими нейронами и экспрессия рецепторов к ДА в СХЯ именно в этот период онтогенеза обеспечивают дофаминовую регуляцию развития этого ядра как “биологических часов” (Ugrumov, 2009). Предположение о том, что ДА через Д1 рецепторы обеспечивает созревание механизма регуляции циркадных ритмов также было высказано Gallardo с коллегами (Gallardo et al., 2014). Однако, эти исследователи считают, что ДА диффундирует в СХЯ из стриатума по градиенту концентрации, что маловероятно ввиду большого расстояния между ними.
Особое внимание в данной работе было уделено оценке экспрессии маркеров ДА-ергических нейронов в АЯ гипоталамуса – важнейшем центре нейроэндокринной регуляции. По данным ранее проведенного исследования в АЯ в конце пренатального периода более 99% нейронов, экспрессирующих ферменты синтеза ДА, представлены моноферментными нейронами, причем ТГ-нейроны в основном локализованы в вентролатеральной области ядра, а ДАА-нейроны – в дорсомедиальной области (Ershov et al., 2002). Эти данные полностью подтвердились в нашем иммуногистохимическом исследовании: на серийных срезах АЯ четырех плодов крыс на Э21 на фоне многочисленных моноферментных ТГ-иммунореактивных и ДАА-иммунореактивных нейронов был выявлен только один биферментный нейрон в пограничной зоне между вентролатеральной и дорсомедиальной областями АЯ.
В данной работе впервые с помощью ПЦР продемонстрирована экспрессия генов ТГ и ДАА в АЯ, причем как в дорсомедиальной области, так и вентролатеральной области, что противоречит иммуноцитохимическим данным о зональности в распределении моноферментных нейронов. Топографическое несоответствие в экспрессии генов и локализации моноферментных нейронов, содержащих ТГ или ДАА, можно объяснить наличием нейронов, в которых экспрессируются гены обоих ферментов синтеза ДА, но только один из ферментов синтезируется на уровне, достаточно высоком для иммуноцитохимического выявления. Аналогичная ситуация была описана выше для стриатума неонатальных крыс, когда экспрессируются гены ТГ и ДАА, однако сами ферменты в телах нейронов иммуногистохимически не выявляются. Нельзя также исключить, что ген ДАА в вентролатеральной области АЯ экспрессируется не столько в нейронах, сколько в эндотелиальных клетках портальных сосудов, что характерно вообще для сосудов мозга (Berry et al., 1996).
Особый интерес представляет обнаруженная нами экспрессия гена ВМАТ2 как в вентролатеральной, так и в дорсомедиальной областях АЯ у плодов крыс на Э21. Если экспрессию гена ВМАТ2 в моноферментных ДАА-нейронах дорсомедиальной области АЯ можно легко объяснить участием этого транспортера в захвате ДА из цитозоля в секреторные гранулы, то экспрессию гена ВМАТ2 в вентролатеральной области АЯ объяснить гораздо труднее. Действительно, в вентролатеральной области АЯ локализованы преимущественно моноферментные ТГ-нейроны, в которых осуществляется синтез L-ДОФА из L-тирозина. До сих пор отсутствуют какие-либо сведения о механизме внутринейронального запасания L‑ДОФА, если оно вообще существует. Не исключено, что в отличие от ДА-ергических нейронов, в которых L-ДОФА содержится только в цитозоле, в моноферментных нейронах он депонируется в секреторных гранулах, что следует проверить в будущем с помощью электронномикроскопической иммуноцитохимии. Приведенные выше данные в совокупности позволяют предположить, что в моноферментных нейронах разных областей АЯ экспрессируется одинаковый набор генов, а особенности их химического фенотипа определяются на трансляционном уровне специфических синтезов.
Таким образом, в исследованных отделах мозга у крыс в онтогенезе обнаружено несколько типов нейронов, обладающих теми или иными характеристиками фенотипа ДА-ергических нейронов, что, вероятно, позволяет им синтезировать ДА, оказывающий аутокринное или паракринное морфогенетическое действие на нейроны-мишени.
Работа поддержана грантом РНФ 17-14-01422.
Список литературы
Beltramo M., Calas M., Chernigovskaya E. et al. Postnatal development of the suprachiasmatic nucleus in the rat. Morpho-functional characteristics and time course of tyrosine hydroxylase immunopositive fibers // Neuroscience. 1994. V. 63. № 2. P. 603–610.
Berry M.D., Juorio A.V., Li X.-M. et al. Aromatic L-amino acid decarboxylase: A neglected and misunderstood enzyme // Neurochem. Res. 1996. V. 21. № 9. P. 1075–1087.
Bookout A., Cummins C., Mangelsdorf D. et al. High-throughput real-time quantitative reverse transcription PCR // Curr. Protoc. Mol. Biol. 2006. P. 15.8.1–15.8.28.
Bupesh M., Vicario A., Abellan A. et al. Dynamic expression of tyrosine hydroxylase mRNA and proteinin neurons of the striatum and amygdala of mice, and experimental evidence of their multiple embryonic origin // Brain Struct. Funct. 2014. V. 219. № 3. P. 751–776.
Buscetti C.L., Bucci D., Molinaro G. et al. Lack or inhibition of dopaminergic stimulation induces a development increase of striatal tyrosine hydroxylase-positive interneurons // PLoS One. 2012. V. 7. № 9. e44025.
Duffield G.E., McNulty S., Ebling F.J.P. Anatomical and functional characterisation of a dopaminergic system in the suprachiasmatic nucleus of the neonatal siberian hamster // J. Comp. Neurol. 1999. V. 408. P. 73–96.
Ershov P., Ugrumov M.V., Calas A. et al. Neurons possessing enzymes of dopamine synthesis in the mediobasal hypothalamus of rats: topographic relations and axonal projections to the median eminence in ontogenesis // J. Chem. Neuroanat. 2002. V. 24. № 2. P. 95–107.
Gallardo C.M., Darvas M., Oviatt M. et al. Dopamine receptor 1 neurons in the dorsal striatum regulate food anticipatory circadian activity rhythms in mice // Elife. 2014. V. 3. e03781.
Gaspar P. Cases O., Maroteaux L. The developmental role of serotonin: news from mouse molecular genetics // Nat. Rev. Neurosci. 2003. V. 4. P. 1002–1102.
Hansson S.R., Hoffman B.J., Mezey E. Ontogeny of vesicular monoamine transporter mRNAs VMAT1 and VMAT2: I. The developing rat central nervous system // Brain Res. Dev. Brain. Res. 1998. V. 110. № 1. P. 135–158.
Hoffman B.J., Hansson S.R., Mezey E., Palkovits M. Localization and dynamic regulation of biogenic amine transporters in the mammalian central nervous system // Front. Neuroendocrinol. 1998. V. 19. P. 187–231.
Ibáñez-Sandoval O., Tecuapetla F., Unal B. et al. Electrophysiological and morphological characteristics and synaptic connectivity of tyrosine hydroxylase-expressing neurons in adult mouse striatum. J. Neurosci. 2010. V. 30. P. 6999–7016.
Izvolskaya M.S., Adamskaya E.I., Voronova S.N. et al. Catecholamines in regulation of development of GnRH neurons of rat fetuses // Russian J. Developmental Biology. 2005. V. 36. № 6. P. 369–376.
Jaeger C.B., Albert V.R., Joh T.H. et al. Aromatic l-amino acid decarboxylase in the rat brain: coexistence with vasopressin in small neurons of the suprachiasmatic nucleus // Brain Res. 1983. V. 276. № 2. P. 362–366.
Kozina E.A., Kim A.R., Kurina A.Y., Ugrumov M.V. Cooperative synthesis of dopamine by non-dopaminergic neurons as a compensatory mechanism in the striatum of mice with MPTP-induced Parkinsonism // Neurobiology of Disease. 2017. V. 98. P. 108–121.
Kozina E.A., Khakimova G.R., Khaindrava V.G. et al. Tyrosine hydroxylase expression and activity in the nigrostriatal dopaminergic neurons of MPTP-treated mice at the presymptomatic and symptomatic stages of parkinsonism // J. Neurol. Sci. 2014. V. 340. P. 198–207.
Mirochnik V.V., Makarenko I.G., Ugryumov M.V. The Source of transitory innervation of suprachiasmatic nucleus by tyrosine hydroxylase-immunoreactive fibers during postnatal period in rats // Russian J. Developmental Biology. 2002. V. 33. № 3. P. 147–150.
Mura A., Jackson D., Manley M.S. et al. Aromatic L-amino acid decarboxylase immunoreactive cells in the ratstriatum: a possible site for the conversion of exogenous L-DOPA to dopamine // Brain Research. 1995. V. 704. P. 51–60.
Pronina T., Ugrumov M., Calas A. et al. Influence of monoamine on differentiating gonadotropin-releasing hormone neurones in foetal mice // J. Neuroendocrinol. 2003. V. 15. P. 925–932.
Schafer M.K.-H., Weihe E., Eiden L.E. Localization and expression of VMAT2 across mammalian species: A translational guide for its visualization and targeting in health and disease // Adv. Pharmacol. 2013. V. 68. P. 319–334.
Ugrumov M.V. Developing brain as an endocrine organ: Paradoxical reality // Neurochem. Res. 2010. V. 35. P. 837–850.
Ugrumov M.V. Brain neurons partly expressing dopaminergic phenotype: location, development, functional significance, and regulation // Adv. Pharmacol. 2013. V. 68. P. 37–91.
Ugrumov M.V. Non-dopaminergic neurons partly expressing dopaminergic phenotype: Distribution in the brain, development and functional significance // J. Chem. Neuroanat. 2009. V. 38. P. 241–256.
Ugrumov M.V., Melnikova V.I., Lavrentyeva A.V. et al. Dopamine synthesis by non-dopaminergic neurons expressing individual complementary enzymes of the dopamine synthetic pathway in the arcuate nucleus of fetal rats // Neuroscience. 2004. V. 124. № 3. P. 629–635.
Xenias H.S., Ibáñez-Sandoval O., Koós T., Tepper J.M. Are striatal tyrosine hydroxylase interneurons dopaminergic? // J. Neurosci. 2015. V. 35. P. 6584–6599.
Дополнительные материалы отсутствуют.


