Онтогенез, 2020, T. 51, № 2, стр. 81-95
Фитогормональная регуляция роста и развития гаметофитов папоротников в культуре in vitro
Е. А. Романенко a, *, Л. М. Бабенко a, Е. В. Вашека b, П. А. Романенко c, И. В. Косаковская a
a Институт ботаники им. Н.Г. Холодного НАН Украины
01004 Киев, ул. Терещенковская, 2, Украина
b Учебно-научный центр “Институт биологии и медицины” Киевского национального университета
имени Тараса Шевченко
03127 Киев, пр-т Академика Глушкова, 2, Украина
c ООО “Научно-производственное предприятие “5 Element””
73025 Херсон, ул. Михайловская, 37, Украина
* E-mail: katerynaromanenko4@gmail.com
Поступила в редакцию 16.07.2019
После доработки 24.11.2019
Принята к публикации 30.11.2019
Аннотация
Интерес к папоротникам как объектам биотехнологических исследований определяется особенностями их развития и репродукции, знание которых важно для понимания путей эволюции наземных растений. В обзоре проанализированы и обобщены данные литературы об участии фитогормонов в регуляции онтогенеза гаметофитов папоротников при культивировании in vitro. Рассмотрен вопрос о возможности размножения папоротников путем использования спор в качестве эксплантов методами in vitro. Проанализированы эффекты экзогенной обработки цитокининами, ауксинами, гиббереллинами, этиленом, жасмоновой кислотой и брассиностероидами на прорастание спор, морфологию и развитие гаметофита. Обсуждается роль гиббереллинов и антеридиогена в формировании полового диморфизма гаметофитов папоротников. Обобщены данные о нарушениях полового процесса у папоротников, участии фитогормонов в образовании апогамных спорофитов на талломах гаметофитов.
ВВЕДЕНИЕ
Папоротники – сосудистые споровые растения – вместе с хвощами и псилотовыми образуют класс Polypodiopsida (PPG І, 2016). По разным оценкам насчитывают от 9000 до 10600 видов (Smith et al., 2008; Christenhusz, Chase, 2014; PPG І, 2016), представленных наземными, эпифитными и водными формами. Характерной особенностью папоротников является чередование поколений, которое обеспечивает независимое развитие бесполого поколения – спорофита и полового поколения – гаметофита. Спорофиты, как правило, многолетние растения с различной продолжительностью жизни, тогда как рост и развитие гаметофитов протекает быстрее.
Гаметофит папоротников развивается из споры и является свободноживущим фотосинтезирующим организмом (Sharpe et al., 2010). Развитие таллома гаметофита начинается с прорастания споры и формирования проталлиальной нити, которая дифференцируется в лопатовидный проталлий, а затем в однослойный таллом, форма которого может изменяться (Арнаутова, 2008). На талломе гаметофита формируются женские (архегонии) и мужские (антеридии) репродуктивные органы, образующие гаметы. После оплодотворения из зиготы на гаметофите развивается спорофит. В дальнейшем гаметофит отмирает, а спорофит переходит к самостоятельному существованию. Во время роста и развития спорофита образуются спорангии, содержащие спорогенную ткань, из которой, в результате мейоза, формируются споры (Banks, 1999; Арнаутова, 2008). Различают равноспоровые (гомоспоровые) и разноспоровые (гетероспоровые) папоротники. Равноспоровые папоротники продуцируют один тип спор, тогда как разноспоровые размножаются посредством мегаспор и микроспор, из которых образуются гаметофиты, производящие только женские или мужские гаметы (Johari, Singh, 2018). Подавляющее большинство современных папоротников являются равноспоровыми.
В онтогенезе гаметофитов равноспоровых папоротников выделяют четыре периода развития: первичный покой, виргинильный, дефинитивный, сенильный и восемь онтогенетических состояний: спора, проросток, ювенильное, имматурное, виргинильное, дефинитивное, субсенильное и сенильное (Шорина, 1987; Барабанщикова, 2009). Тип развития таллома определяет в дальнейшем форму зрелого проталлия. В работе Н.М. Державиной (2017) обобщены данные касательно классификаций форм развития талломов гаметофитов. Автором отмечено, что существует масса исключений из рассмотренных в работе классификаций. Одной из причин вариабельности форм талломов может быть гормональная регуляция морфогенеза, которая контролируется не только собственным гормоном антеридиогеном, но и антеридиогенами других видов папоротников (Schneller, 2008).
Гаметофиты папоротников являются идеальными модельными объектами для наблюдения за процессами роста и развития (Hickok et al., 1987; Banks, 1999), их легко культивировать in vitro до состояния полной зрелости (Raghavan, 1989; Menéndez et al., 2010). Кроме того, они могут размножаться вегетативно с образованием клонов гаметофитов (Johari, Singh, 2018). Исследование гаметофитов в лабораторных условиях позволяет выявить особенности влияния различных экзогенных факторов на прорастание спор, рост и морфогенез таллома, половой диморфизм, образование зиготы и формирование зародыша спорофита. Изолированные в культуре in vitro гаметофиты успешно используются для изучения генетических и физиологических механизмов регуляции роста и развития, что способствует получению новых данных об эволюции наземных растений (Banks, 1999).
Процессы роста и развития гаметофита и спорофита папоротников, как и представителей других таксонов, контролируются многокомпонентной гормональной системой (Haufler et al., 2016). Определяющим в характере действия фитогормонов является их концентрация и локализация в отдельных органах и тканях растений (Davies, 2010). Благодаря гормональной регуляции и влиянию экзогенных факторов этапы реализации генетической программы растительного организма могут ускоряться либо замедляться (Bradford, Trewavas, 1994). Так, ауксины влияют на митотический цикл, переход клеток из состояния покоя к активной пролиферации, задействованы в эмбрио-, органо- и морфогенезе, развитии корневой системы, формировании цветков, семян, плодов (Del Pozo et al., 2005; Ludwig-Muller, 2011). Гиббереллины (ГК) координируют процессы деления и растяжения клеток, индуцируют цветение, регулируют пол, активируют завязывание и развитие плодов, а также прорастание семян, клубней и луковиц (Peng, Harberd, 2002; Chandler, 2011; Davière, Achard, 2013). В формировании антеридиев на поверхности гаметофита задействованы антеридиогены (АГ) – специфические ГК-подобные гормоны (Atallah, Banks, 2015). Образование мужского гаметофита происходит при высокой концентрации эндогенного АГ, в случае же его отсутствия формируется женский гаметофит. Низкая концентрация АГ обусловливает развитие двуполого заростка (Haufler et al., 2016). АГ может проникать в почву на глубину от одного до пятнадцати сантиметров (Schneller, 1988). Выделенный в почву на стадии развития проталия АГ активирует прорастание других спор (Chiou, Farrar, 1997), а также индуцирует развитие антеридиев на более поздних стадиях развития гаметофита (Tanaka et al., 2014). АГ играет важную роль в видообразовании и эволюции папоротников, поскольку он способствует перекрестному межгаметофитному оплодотворению и формированию генетической гетерозиготности (Chiou, Farrar, 1997; Korpelainen, 1998; Tanaka et al., 2014).
Цитокинины (ЦК) стимулируют процессы деления и роста клеток, образование побегов из каллусов в культуре in vitro, активируют биогенез и дифференциацию хлоропластов, ингибируют рост апикальной меристемы корня, тормозят процесс старения листьев, регулируют покой и прорастание семян (Романов, 2009). ЦК также влияют на устойчивость растений к неблагоприятным воздействиям окружающей среды (Ha et al., 2012). Абсцизовая кислота (АБК), этилен, вместе с жасмоновой кислотой (ЖК) и брассиностероидами (БС) относятся к фитогормонам, которые задействованы в реакциях растений на абиотические и биотические стрессы (Bartoli et al., 2013; Babenko et al., 2015). АБК, помимо регуляции защитных механизмов (Vishwakarma et al., 2017), управляет процессами покоя, прорастания семян, вегетативного роста (Finkelstein et al., 2008). Прорастание семян, развитие, созревание плодов и старение растений находится под контролем этилена (Pierik et al., 2006). ЖК регулирует процессы созревания семян и плодов, рост корней, способствует выходу из состояния покоя, индуцирует защитные реакции (Hyun, Lee, 2008; Babenko et al., 2015). БС – растительные фитостероиды (Arora et al., 2008) – влияют на процессы роста, формирования сосудистой системы, репродукцию, развитие цветков и плодов (Khripach et al., 2000). Контролируя ингибиторные эффекты АБК, брассиностероиды положительно влияют на прорастание семян (Hu, Yu, 2014).
Споры и гаметофиты папоротников активно используют при проведении физиологических (Ballesteros et al., 2012; Zhang et al., 2016), генетических (Rutherford et al., 2004; Plackett et al., 2015), цитологических (Rodríguez-Romero et al., 2018), биохимических (Nekrasov et al., 2019) и экотоксикологических исследований (García-Cortés et al., 2018). Это обусловлено продуцированием папоротниками больших количеств спор, простотой их сбора и хранения, достаточно несложными методами проращивания и последующего культивированием гаметофитов. Изучение влияния экзогенных фитогормонов на рост и развитие гаметофитов открывает возможности для поиска путей управления этими процессами. Целью нашего обзора был анализ и обобщение результатов научных исследований, посвященных изучению влияния экзогенных фитогормонов на прорастание спор, регуляцию морфогенеза, реализацию полового диморфизма гаметофитов, оптимизацию развития спорофитов на поверхности талломов гаметофитов.
ВЛИЯНИЕ ЭКЗОГЕННЫХ ФИТОГОРМОНОВ НА ПРОРОСТАНИЕ СПОР
На прорастание спор папоротников влияют различные внешние факторы. Среди них: освещение, температура, элементы питания (Du et al., 2009; Wu et al., 2010; Ballesteros et al., 2012; Juárez-Orozco et al., 2013; Suo et al., 2015), гравитация (Edwards, Roux, 1998), тяжелые металлы и пестициды (Drăghiceanu, Soare, 2016; Soare et al., 2019), почвенные микроорганизмы (Ganger et al., 2019). В условиях in vitro споры, как правило, проращивают без добавления регуляторов роста, что косвенно указывает на достаточное количество эндогенных гормонов для запуска и регуляции процесса (Pinto et al., 2013). Тем не менее, экзогенная обработка, в зависимости от концентрации гормонов, способна ускорять либо замедлять прорастание спор (рис. 1). Положительное влияние на прорастание спор оказывают гиббереллины. Так, пятиминутная обработка спор Athyrium multidentatum (Doll.) Ching 20 мг/л гибберелловой кислотой (ГК3), а также внесение 10 мг/л гормона в питательную среду улучшало прорастание (Guo et al., 2007; Zhang, Yang, 2011). ГК3 в концентрации 0.15 × × 10–7 г/л ускоряла прорастание спор Pteridium aquilinum (L.) Kuhn (Zhang, Niu, 1999). Значительно более высокие концентрации гормона (0.5, 5 и 50 µМ) активировали прорастание спор Blechnum spicant L. (Fernandez et al., 1997). Нами было показано, что высокие концентрации ГК3 (10–5 и 10–6 М) существенно тормозили прорастание спор Polystichum aculeatum (L.) Roth., тогда как более низкие концентрации (10–7 и 10–8 М) ускоряли этот процесс (Babenko et al., 2018). В то же время известно, что споры некоторых видов папоротников нечувствительны к гиббереллинам. В частности, ГК3 не влияла на прорастание спор Pteridium aquilinum var. latiusculum (Desvaux) L. Underwood ex A. Heller (Zhai et al., 2007) и Sphenomeris chinensis (L.) Maxon (Ren et al., 2008). Показано, что ГК3 улучшала прорастание спор Pteridium aquilinum, Polystichum munitum (Kaulf.) Presl. и Polypodium feei (Bory) Mett. в темноте (Weinberg, Voeller, 1969). Гиббереллины ГК3, ГК4, ГК7 и ГК13 индуцировали прорастание спор Anemia mexicana Klotzsch и Anemia phyllitidis (L.) Sw. в темноте, причем более чувствительными оказались споры A. phyllitidis (Nester, Coolbaugh, 1986). Наибольший эффект проявляли ГК4 и ГК7, тогда как ГК13 была менее эффективной (Nester, Coolbaugh, 1986). Положительное влияние ГК3, ГК4, ГК9 на прорастание спор в темноте показано также для Lygodium japonicum (Thunb.) Sw. (Sugai et al., 1987). Гиббереллины не влияли на прорастание спор Schizaea pusilla Pursh в темноте (Guiragossian, Koning, 1986), однако при использовании красного света стимулировали процесс, причем эффект ГК3 оказался более выраженным, чем ГК4 + 7. Особенности влияния ГК3 на прорастание спор L. japonicum в темноте и при освещении позволили авторам исследования (Kagawa, Sugai, 1991) предположить, что красный свет активирует биосинтез гиббереллинов, что приводит к улучшению прорастания спор.
Рис. 1.
Фитогормональная регуляция прорастания спор. Обозначения: сплошная линия – позитивное действие; линейный пунктир – негативное, точечный пунктир – нейтральное; ГК – гиббереллины, АГ – антеридиоген, ЦК – цитокинины, Асинт – ауксины синтетические; Эт – этилен, ЖК – жасмоновая кислота, АБК – абсцизовая кислота, БС – брассиностероиды (приведенные сведения адаптированы из Suo et al., 2015 и дополнены).
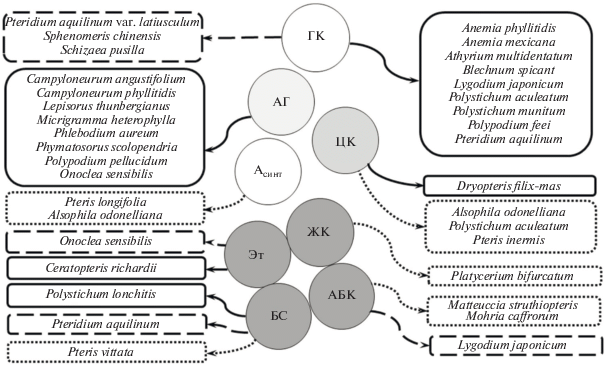
Споры Campyloneurum angustifolium (Sw.) Fée, C. phyllitidis (L.) C. Presl., Lepisorus thunbergianus (Kaulfuss) Ching, Microgramma heterophylla (L.) Wherry, Phymatosorus scolopendria (Burm. f.) Pic. Serm. и Polypodium pellucidum Kaulf. прорастали в присутствии собственного антеридиогена, который также индуцировал развитие антеридиев на проталлии (Chiou, Farrar, 1997). Напротив, споры Phlebodium aureum (L.) J. Sm. на собственный АГ не реагировали, а прорастали в присутствии антеридиогена вида Pteridium aquilinum (AГPt), при этом AГPt не проявлял видовой специфичности и положительно влиял на прорастание спор и развитие антеридиев всех перечисленных выше видов папоротников. С другой стороны, антеридиоген Ph. aureum стимулировал прорастание спор Onoclea sensibilis L. (Chiou, Farrar, 1997).
Исследования эффектов цитокининов и ауксинов на прорастание спор папоротников немногочисленны. Синтетический ауксин 2,4-Д (2,4-дихлорфеноксиуксусная кислота) не влиял на прорастание спор Pteris longifolia L. (Strickler, 1946) и Alsophila odonelliana (Alston) Lehnert (Bonomo, 2013). Нами было установлено, что экзогенная обработка 6-бензиламиномурином (БАП) в концентрации 10–5 М существенно тормозила прорастание спор Polystichum aculeatum, а при концентрации гормона 10–6, 10–7, 10–8 М стимулирующий эффект отсутствовал (Babenko et al., 2018). В другом исследовании (Bonomo et al., 2013) сообщалось, что влияние БАП в концентрациях 0.01, 0.1, 1.0 мг/л на прорастание спор Alsophila odonelliana было слабо выраженно. Добавление в среду БАП и ГК3 ускоряло прорастания спор Pteris inermis (Rosenst.) Sota, тогда как отдельно БАП на прорастание спор существенно не влиял (Tanco et al., 2009). Нами (Romanenko et al., 2019) было показано, что экзогенные ЦК кинетин, БАП, N6-2-изопентениладенин (ИПА) ингибировали прорастание спор Dryopteris filix-mas (L.) Schott, при этом эффект был прямо пропорционален концентрации гормона. Оказалось, что наибольший ингибирующий эффект проявлял ИПА. Положительно влиял на прорастание спор зеатин, концентрация гормона 10–7 М была самой эффективной (Romanenko et al., 2019).
В работах других авторов (Jarvis, Wklkins, 1973; Chia, Raghavan, 1982) сообщалось, что экзогенная АБК в концентрации 10 мг/л не влияла на прорастание спор Mohria caffrorum Sw. и Matteuccia struthiopteris (L.) Tod. В то же время было показано, что АБК в концентрации 5 мг/л полностью блокировала прорастание спор Lygodium japonicum (Swami, Raghavan, 1980).
Этилен в темноте ингибировал прорастание спор Onoclea sensibilis, однако при нормальном освещении до 50% спор прорастало (Edwards, Miller, 1972; Fisher, Miller, 1975). Фотоиндуцированное прорастание спор O. sensibilis регулировалось на уровне антагонистического взаимодействия между CO2 и этиленом. Если этилен полностью угнетал прорастание спор в темноте, то в дальнейшем такое ингибирование частично устранялось при освещении и обработке CO2 (Edwards 1977). Обработка спор этиленпродуцентом 2-хлорэтилфосфорной кислоты ускоряла всхожесть свежесобранных и незрелых спор Ceratopteris richardii Brongn., однако ингибировала прорастание зрелых и длительно хранившихся спор (Warne, Hicko, 1987). Полученные результаты позволили авторам предположить, что 2-хлорэтилфосфорная кислота ускоряет процессы созревания незрелых спор и старения зрелых, а объясняется это высвобождением этилена при гидролизе 2-хлорэтилфосфорной кислоты и последующей активацией гормоном вышеупомянутых процессов (Warne, Hickok, 1987).
ЖК не влияла на прорастание спор Platycerium bifurcatum (Cav.) C. Chr., однако, активировала раннее развитие и рост ризоидов (Camloh et al., 1996). Следует отметить, что подобные эффекты ЖК и АБК наблюдались при прорастании семян высших растений (Wasternack, 2007).
Брассиностероиды улучшали прорастание спор Polystichum lonchitis (L.) Roth. Гормон в концентрации 10–7 М был наиболее эффективным. В то же время БС угнетали прорастание Pteridium aquilinum и не влияли на споры Pteris vittata L. (Gómez-Garay et al., 2018). По мнению авторов исследования (Gómez-Garay et al., 2018), влияние БС связано с образованием антеридиогена. Споры P. aquilinum и P. vittata были достаточно чувствительны к АГ (Gómez-Garay et al., 2018), тогда как в спорах P. lonchitis количество синтезируемого гормона оказалось низким (Pangua et al. 2003). Недавние исследования показали, что экзогенные БС подавляют биосинтез эндогенных БС, а также активируют гены, отвечающие за активность ГК3-оксидазы, энзима участвующего, в инактивации гиббереллинов (Tong et al., 2014).
ВЛИЯНИЕ ЭКЗОГЕННЫХ ФИТОГОРМОНОВ НА МОРФОГЕНЕЗ ГАМЕТОФИОВ В КУЛЬТУРЕ IN VITRO
Гаметофитам папоротников свойственен талломный тип морфологической организации (Арнаутова, 2008). Особенности развития гаметофитов в культуре in vitro проанализированы в работах (Шелихан, Некрасов, 2018; Rivera et al., 2018). В табл. 1 мы представили имеющиеся в научной литературе данные о влиянии экзогенных фитогормонов на морфогенез гаметофитов папоротников.
Таблица 1.
Влияние экзогенных фитогормонов на морфогенез гаметофитов в культуре in vitro
| Вид | Фитогормон | Концентрация фитогормона | Эффект фитогормона | Источник |
|---|---|---|---|---|
| АУКСИНЫ | ||||
| Onoclea sensibilis | ИУК | 10–5 М | Укороченные протонемы, уменьшение количества клеток в проталлии | Miller, 1961 |
| 10–6, 10–7, 10–8 М | Вытягивание протонемы, активация деления клеток | |||
| Pteridium aquilinum | ИУК | 10–5 М | Ингибирование клеточного деления, компактная форма проталлия | Sobota, Partanen, 1967 |
| Lygodium japonicum | ИУК | 2 мг/л | Нитчатая форма таллома, активация клеточного деления | Swami, Raghavan, 1980 |
| 2,4-Д | 0.01–5.0 мг/л | |||
| ИАН | 5 мг/л | |||
| Ceratopteris thalictroides | 2,4-Д | 10–4 М | Летальное действие | Hickok, Kiriluk, 1984 |
| 10–5, 10–6 М | Увеличение размеров клеток, образование удлиненных талломов | |||
| НУК | 10–4 М | Летальное действие | ||
| 10–6, 10–7 М | Развитие краевых ризоидов | |||
| ИУК, ИАН | 10–5, 10–6, 10–7 М | Нейтральное действие | ||
| Platycerium coronarium | ИУК | 80–100 µМ | Активация роста ризоидов | Kwa, 1995 |
| Blechnum spicant | ИМК | 5, 50 µМ | Ингибирование формирования меристемы | Fernandez et al., 1997 |
| Ceratopteris richardii | НУК | 10–5 М | Ингибирование активности боковой меристемы, формирование талломов округлой формы небольшого размера | Gregoric, Fisher, 2006 |
| 2,4,5-Т | 10–4 М | |||
| Alsophila odonelliana | 2,4-Д | 0.1 мг/л | Образование удлиненных нитевидных проталлиев с разветвлениями | Bonomo et al., 2013 |
| 2 мг/л | Образование укороченных нитевидных проталлиев | |||
| Anemia tomentosa | ИУК | 2.8; 5.4; 11.4 µМ | Нейтральное действие | Castilho et al., 2018 |
| ГИББЕРЕЛЛИНЫ | ||||
| Lygodium japonicum | ГК3 | 10–4, 10–5 М | Торможение роста проталлия | Takeno, Furuya, 1977 |
| 10–6, 10–7 М | Растяжение клеток проталлия | Swami, Raghavan, 1980 | ||
| Blechnum spicant | ГК3 | 0.5, 5 и 50 µМ | Ингибирование роста гаметофитов | Fernandez et al., 1997 |
| Anemia phyllitidis | ГК3 | 10–5 М, 30 µМ | Растяжение клеток, снижение клеточного деления в вегетативных клетках, образование талломов небольшого размера | Kaźmierczak, 1998; Kaźmierczak, 2003 |
| Osmundastrum cinnamomeum | ГК3 | 10–4 М | Увеличение размеров проталлия | Hollingsworth et al., 2012 |
| 10–3 М | Образование талломов небольшого размера | |||
| Polystichumaculeatum | ГК3 | 10–5, 10–6 М | Образование талломов небольшого размера вытянутой формы | Babenko et al., 2018 |
| 10–7, 10–8 М | Образование несимметричных сердцевидных талломов с деформированной выемкой | |||
| ЦИТОКИНИНЫ | ||||
| Ceratopterisrichardii (без освещения) | БАП, ИПА, кинетин | 10–9, 10–8, 10–7 М | Активация образования меристемы и выемки, индукция фотоморфогенеза | Spiro et al., 2004 |
| 10–12 М | Снижение растяжения клеток, индукция фотоморфогенеза, активация клеточного деления и образования ризоидов | |||
| Ceratopterisrichardii (с освещением) | БАП | 10–7 М | Уменьшение размеров проталлия | |
| 10–9 М | Нейтральное действие | |||
| Blechnum spicant | БАП | 0.5; 5; 50 µМ | Ингибирование формирования меристемы | Fernandez et al., 1997 |
| 4.44 μM | Деформация таллома, отсутствие сердцевидной формы | Menéndez et al., 2009 | ||
| Osmunda regalis | Кинетин | 0, 1 nM | Увеличение размеров таллома, стимулирование развития апикальной меристемы | Greer et al., 2012 |
| 10–3, 10–4 М | Уменьшение размеров таллома, деформация выемки | |||
| Alsophila odonelliana | БАП | 0.01, 0.1, 1 мг/л | Образование нитчатых и разветвленных проталлиев | Bonomo et al., 2013 |
| Polystichumaculeatum | БАП | 10–5, 10–6, 10–7 М | Блокирование развития нормальной протонемы, появление нескольких инициальных клеток | Babenko et al., 2018 |
| 10–8 М | Образование проталлиев с разветвлениями и неровным краем | |||
| Dryopteris filix-mas | ИПА | 10–5, 10–6 М | Блокирование развития нормальной протонемы, уменьшение размеров проталлия, ингибирование развития ризоидов | Romanenko et al., 2019 |
| ИПА | 10–7, 10–8 М | Образование вытянутых талломов | ||
| БАП, кинетин, зеатин | 10–5 М | Активация развития ризоидов, образование талломов с деформациями | ||
| БАП, кинетин, зеатин | 10–7, 10–8 М | Активация клеточного деления, увеличение размеров таллома | ||
| Lygodium japonicum | Абсцизовая кислота | 0.5, 1 мг/л | Ингибирование клеточного деления, формирование укороченных проталлиев | Swami, Raghavan, 1980 |
| Ceratopteris richardii | 10–4 М | Ингибирование роста ризоидов, активности меристемы | Hickok, 1983 | |
| 10–6 М | Активирование роста ризоидов, развитие талломов меньшего размера | |||
| Onoclea sensibilis | Этилен | 0.01–1000 ppm | Ингибирование клеточного деления, растяжение клеток, удлинение нити протонемы, торможение роста ризоидов | Miller et al., 1970 |
| Anemia tomentosa | Жасмоновая кислота | 0.01; 1; 10 µМ | Активный рост таллома и развитие спорофитов на его поверхности | Castilho et al., 2018 |
| Platycerium bifurcalum | 0.01, 1 µМ | Активация деления клеток, переход от нитчатой к лопатовидной форме, увеличение количества и длины ризоидов | Camloh et al., 1996 | |
| 10, 100 µМ | Ингибирование всех ростовых процессов | |||
Индолил-3-уксусная кислота (ИУК) способствовала удлинению протонемы Onoclea sensibilis в культуре in vitro в темноте (Miller, 1961). Низкие концентрации гормона вызывали увеличение числа клеток и значительное вытягивание протонемы, тогда как при высокой концентрации ИУК протонемы состояли из меньшего количества клеток и приобретали компактную форму (Miller, 1961). В высокой концентрации ИУК угнетала деление клеток в протонемах Pteridium aquilinum (Sobota, Partanen, 1967). В то же время ауксин не влиял на развитие гаметофита Anemia tomentosa (Savigny) Swartz var. anthriscifolia (Schrader) Mickel (Castilho et al., 2018). ИУК, индолил-3-ацетонитрил (ИАН) и синтетический ауксин 2,4-Д также активировали деление клеток и индуцировали развитие нитчатых талломов у Lygodium japonicum (Swami, Raghavan, 1980), олнако, в комбинации с АБК это влияние нивелировалось, вследствие чего развивались менее длинные, расширенные талломы. ИУК контролировала образование ризоидов у Platycerium coronarium (Koenig) Desv. (Kwa, 1995). Синтетические ауксины нафтилуксусная (НУК) и 2,4,5-трихлорфеноксиуксусная (2,4,5-Т) кислоты подавляли активацию боковой меристемы у Ceratopteris richardii, в результате чего изменялась форма таллома (Gregoric, Fisher, 2006). НУК способствовала развитию краевых ризоидов у Ceratopteris thalictroides (L.) Brongn., тогда как в контроле они формировались в базальной части таллома (Hickok, Kiriluk, 1984). Обработка 2,4-Д увеличивала размеры клеток проталлия C. thalictroides, а также инициировала развитие удлиненных талломов. Высокие концентрации эти двух синтетических ауксинов оказывали летальное действие на развитие гаметофитов C. thalictroides: после прорастания споры дальнейший рост протонемы прекращался. ИУК и индолил-3-масляная кислота (ИМК) не оказывали существенного влияния на форму талломов и рост ризоидов C. thalictroides (Hickok, Kiriluk, 1984). Применение как низких, так и высоких концентраций ИМК у Blechnum spicant отрицательно сказывалось на росте гаметофитов на всех этапах онтогенеза, способствовало появлению большого количества заростков без развитой меристемы (Fernandez et al., 1997). При низкой концентрации 2,4-Д образовывались сильно вытянутые проталлии у Alsophila odonelliana, а с увеличением концентрации ауксина рост гаметофитов замедлялся, талломы были вытянутой формы со слабо выраженной выемкой (Bonomo et al., 2013).
ГК3 в высокой концентрации подавляла рост проталлия Lygodium japonicum, тогда как в низкой – не влияла на его развитие (Takeno, Furuya, 1977), или способствовала растяжению клеток (Swami, Raghavan, 1980). У Blechnum spicant добавление в среду ГК3 в концентрациях 0.5, 5 и 50 µМ существенно ингибировало рост гаметофитов на всех этапах онтогенеза и препятствовало развитию спорофитов (Fernandez et al., 1997). ГК3 влияла на клеточное деление в проталлиях Anemia phyllitidis, что приводило к уменьшению скорости деления клеток и образованию талломов меньших размеров, а рост проталлия осуществлялся за счет растяжения отдельных клеток (Kaźmierczak, 1998, 2003). Подобные эффекты отмечены и для Osmundastrum cinnamomeum (L.) C. Presl, у которого гормон в низкой концентрации значительно увеличивал размеры проталлия, тогда как при увеличении концентрации размер таллома был меньше контроля (Hollingsworth et al., 2012). Наши исследования (Babenko et al., 2018) показали, что высокие концентрации ГК3 угнетали формирование меристемы и способствовали появлению небольших вытянутых талломов без характерной сердцевидной формы у Polystichum aculeatum. С увеличением концентрации ГК3 наблюдались аномалии в развитии меристемы, сердцевидная форма таллома присутствовала, однако имела неровный край и деформированную выемку (Babenko et al., 2018).
Цитокинины БАП, ИПА и кинетин индуцировали морфогенез у гаметофитов Ceratopteris richardii, выращенных в темноте, влияли на скорость роста, деление и дифференциацию клеток (Spiro et al., 2004). Обработка этими ЦК в концентрации 10–12 М способствовала уменьшению длины клеток, ускоряла их деление в апикальной зоне проталлия, индуцировала образование ризоидов. С повышением концентрации гормонов активировалось формирование меристемы и апикальной выемки, при этом наиболее активным был БАП (Spiro et al., 2004). После обработки БАП высокой концентрации размер проталлия выращенных на свету гаметофитов C. richardii значительно уменьшался. Снижение концентрации гормона существенных изменений в развитии гаметофита не вызывало (Spiro et al., 2004).
Добавление микромолярных концентраций БАП в среду выращивания Blechnum spicant вызывало задержку развития проталлия (Menéndez et al., 2009), подавление формирование меристемы, ингибировало развитие спорофитов (Fernandez et al., 1997). Внесение кинетина в культуральную среду гаметофитов Osmunda regalis L. показало, что с увеличением концентрации гормона размер сердцевидного таллома уменьшился, деформировалась выемка между лопастями, ингибировалось развитие апикальной меристемы (Greer et al., 2012). При выращивании гаметофита Alsophila odonelliana в культуре in vitro добавление БАП различной концентрации инициировало образование вытянутых нитчатых или разветвленных проталлиев и многочисленных пролифераций таллома (Bonomo et al., 2013). Наши исследования (Babenko et al., 2018) показали, что БАП блокировал развитие протонемы Polystichum aculeatum в культуре in vitro, а степень влияния гормона зависела от его концентрации в питательной среде. Так, в высоких концентрациях БАП вызывал появление укороченных протонем с одиночными боковыми ветвлениями. По мере снижения концентрации в среде, происходило образование лопатовидного проталлия, часто с разветвлениями и неровными краями (Babenko et al., 2018). Последующие наши эксперименты (Romanenko et al., 2019) показали, что высокие концентрации ИПА, БАП, кинетина и зеатина тормозили развитие протонемы Dryopteris filix-mas, инициировали образование сердцевидных талломов деформированной формы. Низкие концентрации этих гормонов активировали клеточное деление, в результате чего количество клеток в проталлиях увеличивалось. Однако под влиянием низкой концентрации ИПА, БАП, кинетина и зеатина продолжали развиваться аномальные сердцевидные талломы. В то же время эти ЦК активировали рост и развитие ризоидов у D. filix-mas. Эффект возрастал с повышением концентрации гормонов в питательной среде. Действие ИПА было самым выраженным. Гормон в наивысшей концентрации блокировал развитие протонемы, а в наиболее низкой – сердцевидного таллома. Зеатин в малых концентрациях стимулировал развитие гаметофита, минимизировал появление деформаций таллома, активировал рост и развитие многочисленных ризоидов (Romanenko et al., 2019).
Абсцизовая кислота подавляла деление и удлинение клеток гаметофитов Lygodium japonicum, выращенных в режиме красного и синего света, в следствии чего формировались укороченные плоские проталлии (Swami, Raghavan, 1980). При совместном применении АБК и 2,4-Д, в отличие от раздельного действия гормонов, образовывались вытянутые талломы, состоящие из большего количества клеток (Swami, Raghavan, 1980). Ингибирующее действие высокой концентрации АБК на рост меристемы проталлия и ризоидов показано для Ceratopteris richardii. В низкой концентрации гормон стимулировал рост ризоидов и индуцировал развитие талломов меньшего размера (Hickok, 1983).
На этапе развития протонемы Onoclea sensibilis этилен ингибировал деление клеток, индуцировал их растяжение и удлинение проталлиальной нити, замедлял рост ризоидов (Miller et al., 1970). Гормон ускорял реорганизацию ядерного хроматина и индуцировал синтез ДНК в ядре антеридиальной части клеток мужского гаметофита (Kaźmierczak, 2010).
Жасмоновая кислота активировала клеточные процессы на ранних фазах онтогенеза гаметофита Platycerium bifurcalum (Cav.) C. Chr. (Camloh et al., 1996). В низких концентрациях ЖК стимулировала деление клеток и раннее развитие протонемы, ускоряла переход гаметофита от нитчатой к лопатковидной форме, способствовала удлинению и увеличению количества ризоидов (Camloh et al., 1996). Противоположный эффект наблюдали при применении гормона в высоких концентрациях. Авторы исследования (Castilho et al., 2018) объясняют ростстимулирующее действие ЖК активацией синтеза мРНК, вызванное гормоном. Экзогенная ЖК способствовала активному росту гаметофитов и дальнейшему развитию спорофита на поверхности таллома у Anemia tomentosa var. anthriscifolia (Castilho et al., 2018).
ВЛИЯНИЕ ЭКЗОГЕННЫХ ФИТОГОРМОНОВ НА ПОЛОВОЙ ДИМОРФИЗМ И АПОГАМИЮ ГАМЕТОФИТОВ В КУЛЬТУРЕ IN VITRO
Половому поколению многих видов папоротников свойственен половой диморфизм, при котором формируются мужские, женские и двуполые (бисексуальные/гермафродитные) фенотипы (Banks, 1999). Индуктором полового фенотипа у равноспоровых папоротников является антеридиоген, секретируемый гаметофитом первоначально на стадии проталлия (Tanaka et al., 2014). Наиболее активно гормон синтезируется на стадии сердцевидного таллома (Atallah, Banks, 2015). После выделения АГ во внешнюю среду происходит индукция развития мужских гаметангиев в соседних бесполых гаметофитах (Strain et al., 2001).
Исследования (Fernandez et al., 1997; Kaźmierczak, 1998, 2003; Menéndez et al., 2006а) показали, что экзогенные гиббереллины наиболее активно инициируют образование антеридиев у гаметофитов многих видов папоротников. Установлено, что на ранних этапах онтогенеза гаметофита ГК индуцируют активное образование мужских талломов небольшого размера. Наиболее активными ГК, стимулирующими раннее образование антеридиев на проталлиях Anemia phyllitidis, оказались ГК5 и ГК8, наименее – ГК7, ГК4, ГК1, тогда как и ГК9 заняли промежуточное положение (Schraudolf, 1964). Позднее (Kaźmierczak, 1998, 2003) было установлено, что ГК3 ингибирует митотическую активность вегетативных клеток проталлия A. phyllitidis, при этом активируя ее в клетках, отвечающих за антеридиогенез. Такие клетки под действием ГК3 становились шире апикальных, отличались поперечным ростом, тогда как в апикальной зоне проталлия клетки росли как в поперечном, так и продольном направлении.
Различные формы ГК по-разному влияли на формирование гаметангиев на различных этапах морфогенеза L. japonicum (Takeno, Furuya, 1975, 1977). Наиболее активными стимуляторами образования антеридиев на протонеме оказались ГК7, ГК4, ГК9 и ГК3, наименее – ГК8 (Takeno, Furuya, 1975). ГК3 в концентрации 10–4 и 10–5 М полностью подавляли развитие архегониев на этапе сердцевидного таллома. При уменьшении концентрации гормона угнетение образования женских гаметангиев нивелировалось (Takeno, Furuya, 1977). Сообщалось, ГК4 и ГК9 в концентрации 10–9 М подавляли развитие женских половых органов на сердцевидном талломе, тогда как ГК1, ГК5 и ГК8 не тормозили их развитие (Takeno, Furuya, 1977).
ГК3 в концентрации 50 µM ингибировала формирование антеридиев у Blechnum spicant (Fernandez et al., 1997), тогда как в более низких концентрациях (0.28 и 2.8 µM) не влияла на их развитие (Menéndez et al., 2006а). ГК4 + 7 в концентрации 1 мг/л инициировала развитие женских гаметофитов, снижение же концентрации гормона до 0.1 мг/л способствовало значительному увеличению доли мужских гаметофитов (Menéndez et al., 2006а). Показано (Hollingsworth et al., 2012), что ГК3 во концентрации 10–3 и 10–4 М тормозила развитие антеридиев Osmundastrum cinnamomeum, что, по мнению авторов, связано с ингибированием формирования апикальной меристемы.
Влияние других фитогормонов на регуляцию и реализацию полового диморфизма гаметофитов папоротников исследовано частично. Синтетические ауксины НУК и 2,4-Д в концентрации 10–6 и 10–5 М ингибировали развитие антеридиев и образование мужских талломов, однако способствовали развитию архегониев и женских гаметофитов у Ceratopteris thalictroides (Hickok, Kiriluk, 1984). Действие ИУК в таких же концентрациях на развитие мужских гаметангиев было менее выраженным, однако в концентрации 10–4 М гормон существенно ограничивал их образование и способствовал развитию мужских талломов. ИМК в концентрации 10–4–10–7 М стимулировала развитие мужских талломов с небольшим количеством антеридиев (Hickok, Kiriluk, 1984), однако, в концентрации 5 и 50 µМ ингибировала действие собственного антеридиогена у Blechnum spicant (Fernandez et al., 1997), в результате чего мужские гаметангии не развивались.
Экзогенные цитокинины по-разному влияли на образование гаметангиев. БАП как в низкой (0.3; 3 µМ), так и в высокой (30 µМ) концентрациях ингибировал формирование антеридиев у Blechnum spicant (Fernandez et al., 1997). Кинетин в концентрации 10–3 и 10–6 М способствовал развитию бесполых и мужских талломов и уменьшал долю женских талломов в популяции гаметофитов Osmunda regalis (Greer et al., 2012). В более низкой концентрации (10–10 М) кинетин стимулировал развитие архегониев и большего количества женских талломов в популяции O. regalis (Greer et al., 2012). Наши исследования (Romanemko et al., 2019) показали, что зеатин и кинетин в концентрациях 10–7 и 10–8 М активировали раннее развитие архегониев у Dryopteris filix-mas, тогда как ИПА и БАП в тех же концентрациях оказались стимуляторами развития антеридиев.
АБК является антагонистом антеридиогена (Banks, 1999). В концентрации 10–4 М гормон полностью блокировал образование антеридиев у Ceratopteris richardii, даже в присутствии собственного антиридиогена AГCe (Hickok, 1983). АБК в концентрации 10–6 и 10–7 М частично подавляла развитие мужских гаметангиев C. richardii, и не блокировала развитие меристемы и последующее формирование архегониев (Hickok, 1983). В то же время экзогенная АБК в концентрации 0.035, 0.35 и 3.5 μM не ингибировала развитие антеридиев у Blechnum spicant (Menéndez et al., 2006а).
Для некоторых видов папоротников характерно нарушение полового процесса. Апогамия – частый случай апомиксиса у папоротников, характеризуется образованием спорофита из соматических клеток гаметофита (Liu et al., 2012). У папоротников различают облигатную и факультативную апогамию (Sheffield, Bell, 1987; Raghavan, 1989). Облигатная апогамия характерна для видов, спорофиты которых развиваются без слияния половых клеток. Сообщалось, что для 10% известных на сегодня видов папоротников свойственен такой способ развития спорофита, способных к спорогенезу (Liu et al., 2012). Однако факторы, препятствующие половой функции гаметофитов, остаются мало исследованными. На гаметофитах классических апогамных видов часто развиваются антеридии, сперматозоиды которых могут оплодотворять яйцеклетки других родственных видов. Формирующиеся в таких случаях архегонии не функционируют, что объясняется их “недоразвитием” или “некрозом” яйцеклеток (Gastony, Haufler, 1976). Спорофиты апогамных папоротников образуются, как правило, из соматических клеток, расположенных за апикальной меристемой в области развития архегониев, или в других местах гаметофита (Sheffield, Bell, 1987). Факультативная апогамия чаще всего возникает при изменении условий культивирования in vitro (Cordle et al., 2007), в частности, при дефиците воды (Whittier, 1975), повышении уровня освещенности (Sheffield, Bell, 1987), высоких концентрациях углеводов (Whittier, Steeves, 1960; Whittier, Steeves, 1962; Cordle et al., 2007). Применение экзогенных фитогормонов может активировать случайное развитие апогамных спорофитов на талломах гаметофитов (Whittier 1966; Kwa, 1995; Menéndez et al., 2006b).
ИУК индуцировала апогамное развитие спорофита на стерильных гаметофитах Platycerium coronarium. Максимальный стимулирующий эффект наблюдался при концентрации гормона 40 µМ (Kwa, 1995). Эндогенный этилен при добавлении ИУК угнетал апогамное развитие спорофитов на гаметофитах P. coronarium, что могло быть обусловлено ухудшением транспорта ИУК в клетках гаметофита (Kwa, 1995). Ранее сообщалось (Elmore, Whittier, 1973), что этилен активировал развитие апогамных заростков на гаметофитах Pteridium aquilinum. Увеличение концентрации гормона снижало эффективность его действия (Elmore, Whittier, 1973). Формирование апогамных спорофитов на гаметофитах P. aquilinum инициировали экзогенные НУК и ГК3 в концентрации 2 и 15 мг/л (Whittier, 1966). Гормоны НУК и ГК3 в концентрации 0.53, 5.37 и 2.8 µМ стимулировали развитие соматических спорофитов Dryopteris affinis, для которых характерна облигатная апогамия. Добавление БАП в низких и высоких концентрациях (0.44, 4.44, 22 μM) полностью угнетало формирование спорофита и активировало каллусогенез (Menéndez et al., 2006b).
ЗАКЛЮЧЕНИЕ
Проведенный нами анализ и обобщение литературных данных свидетельствует о значительном экспериментальном материале, посвященном изучению гормональной регуляции роста и развития гаметофитов папоротников в условиях in vitro. Влияние экзогенных фитогормонов на прорастание спор, морфогенез, половой диморфизм, возникновение апомиксиса в ходе онтогенеза гаметофитов исследовано более чем у тридцати видов. Гаметофиты Ceratopteris richardii, Blechnum spicant, Lygodium japonicum, Osmunda regalis, Pteridium aquilinum, Anemia phyllitidis в большинстве случаев привлекались для анализа. Экзогенные фитогормоны по-разному действуют на прорастание спор и развитие гаметофитов. Направленность и интенсивность оказываемого эффекта определяются концентрацией гормона и зависят от вида папоротника. Фитогормоны гаметофитов папоротников, также как гормоны высших растений, играют ключевую роль в регуляции метаболизма, ростовых и морфогенетических процессов, формировании адаптивных реакций. Для фитогормональной системы гаметофитов характерно наличие антеридиогена, специфического гормона, отсутствующего у высших растений. АГ отвечает за формирование антеридиев, которые могут развиваться на любом этапе онтогенеза гаметофита, а также индуцирует прорастание спор в неблагоприятных условиях, в том числе и спор других видов, выполняя при этом роль аллелопатически активного соединения. Выраженным позитивным эффектом на прорастание спор отличаются гиббереллины, действие которых усиливается в темноте. Гиббереллины, как и АГ, влияют на половую дифференциацию гаметофитов, способствуют развитию мужских талломов небольшого размера, подавляют образование архегониев. В высокой концентрации гиббереллины угнетают деление проталлиальных клеток, в низкой – способствуют растяжению вегетативных клеток и образованию деформированных талломов.
Ауксины в низкой концентрации активируют линейный рост и стимулируют формирование талломов вытянутой формы, в высокой – ингибируют клеточное деление, а в отдельных случаях вызывают гибель гаметофита. ИУК и НУК в низкой концентрации активируют рост ризоидов. Цитокинины задействованы в регуляции виргинильной и дифинитивной стадий онтогенеза гаметофитов папоротников, во время которых происходит активный рост проталлия, многоклеточной меристемы и ризоидов, формируется выемка и архегониальная подушка. Цитокинины регулируют образование мужских и женских гаметангиев. Участие АБК, ЖК и БС в регуляции онтогенеза гаметофита исследовано фрагментарно. Эффекты этих гормонов видоспецифичны. АБК и этилен угнетают клеточное деление, тогда как ЖК в отдельных случаях его стимулировала и способствовала развитию ризоидов. Вероятно, АБК, как антагонист антеридиогена, причастна к формированию антеридиев, однако имеющиеся литературные данные не дают окончательного ответа на этот вопрос.
Публикация содержит результаты исследований, проведенных в рамках научного проекта Национальной Академии наук Украины № III-71-14.431 “Гормональный контроль роста и развития споровых растений (различной таксономической принадлежности)”.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Настоящая статья не содержит описания выполненных авторами исследований с участием людей или использованием животных в качестве объектов.
Список литературы
Арнаутова Е.М. Гаметофиты равноспоровых папоротников. СПб: Изд-во СПб ун-та, 2008. 454 с.
Барабанщикова Н.С. Формирование меристемы в ходе онтогенеза у гаметофитов кочедыжника женского (Athyrium filix-femina (L.) Roth.) в природных условиях // Вестн. Удм. ун-та. Сер. Биология. Науки о земле. 2009. Вып. 1. С. 87–100.
Державина Н.М. Классификация гаметофитов равноспоровых папоротников в связи с морфогенезом // Бюлл. Ботан. сада-института ДВО РАН. 2017. Вып. 18. С. 45–50.
Романов Г.А. Как цитокинины действуют на клетку // Физиология растений. 2009. Т. 56. № 2. С. 295–319.
Шелихан Л.А., Некрасов Э.В. Размножение папоротников посредством спор в культуре in vitro (обзор литературы) // Бюлл. Ботан. сада-института ДВО РАН. 2018. Вып. 20. С. 23–42.
Шорина Н.И. Возрастные состояния гаметофитов папоротников и возрастнополовая структура их популяций // Популяционная экология растений. М.: Наука, 1987. С. 43–48.
Arora N., Bhardwaj R., Sharma P. et al. Effects of 28-homobrassinolideon growth, lipid peroxidation and antioxidative enzyme activities in seedlings of Zea mays L. under salinity stress. // Acta Physiol. Plant. 2008. V. 30. P. 833–839.
Atallah N.M., Banks J.A. Reproduction and the pheromonal regulation of sex type in fern gametophytes // Front. Plant Sci. 2015. V. 6. P. 100–107.
Babenko L.M., Kosakivska I.V., Skaterna T.D. Jasmonic acid: role in biotechnology and the regulation of plants biochemical processes // Biotechnol. Acta. 2015. V. 8. № 2. P. 35–51.
Babenko L.M., Romanenko K.O., Shcherbatiuk M.M. et al. Effects of exogenous phytohormones on spore germination and morphogenesis of Polystichum aculeatum (L.) Roth gametophyte in vitro culture // Cytol. Genet. 2018. V. 52. № 2. P. 117–126.
Ballesteros D., Estrelles E., Walters C. et al. Effects of temperature and desiccation on ex situ conservation of nongreen fern spores // Amer. J. Bot. 2012. V. 9. № 4. P.721–729.
Banks J.A. Gametophyte development in ferns // Annu. Rev. Plant Physiol. Plant Mol. Biol. 1999. V. 50.P. 163–186.
Bartoli C.G., Casalongueb C.A., Simontacchia M. et al. Interactions between hormone and redox signalling pathways in the control of growth and cross tolerance to stress // Environ. Exp. Bot. 2013. V. 94. P. 73–88.
Bonomo M.C., Martínez O.G., Tanco M.E. et al. Spores germination and gametophytes of Alsophila odonelliana (Cyatheaceae) in different sterile media // Phyton (Buenos Aires). 2013. V. 82. P. 119–126.
Bradford K.J., Trewavas A.J. Sensitivity thresholds and variable time scales in plant hormone action // Plant Physiol. 1994. V. 4. P. 1029–1036.
Camloh M., Ravnikar M., Zel J. Jasmonic acid promotes division of fern protoplasts, elongation of rhizoids and early development of gametophytes // Physiol. Plant. 1996. V. 97. P. 659–664.
Castilho C.V.V., Neto J.F.F., Leitão S.G. et al. Anemia tomentosa var. anthriscifolia in vitro culture: sporophyte development and volatile compound profile of an aromatic fern // Plant Cell Tiss. Organ Cult. 2018. V. 133. P. 1–13.
Chandler J.W. The hormonal regulation of flower development // J. Plant Growth Regul. 2011. V. 30. P. 242–254.
Chia S.-G. E., Raghavan V. Abscisic acid effects on spore germination and protonemal growth in the fern, Mohria caffrorum // New Phytol. 1982. V. 92. P. 31–37.
Chiou W.L., Farrar D.R. Antheridiogen production and response in Polypodiaceae species // Amer. J. Bot. 1997. V. 84. № 5. P. 633–640.
Christenhusz M.J.M., Chase M.W. Trends and concepts in fern classification // Ann. Bot. 2014. V. 113. № 4. P. 571–594.
Cordle A.R., Irish E.E., Cheng C.-L. Apogamy induction in Ceratopteris richardii // Int. J. Plant Sci. 2007. V. 168. №. 4. P. 361–369.
Davière J.M., Achard P. Gibberellin signaling in plants // Development. 2013. V. 140. № 6. P. 1147–1151.
Davies P.J. Plant Hormones: Biosynthesis, Signal Transduction, Action! 3rd ed. N.Y.: Springer, 2010. 750 p.
Del Pozo J.C., Lopez-Mataz M.A., Ramirez-Parra E. et al. Hormonal control of the plant cell cycle // Physiol. Plant. 2005. V. 123. P. 173–183.
Drăghiceanu O.-A., Soare L.C. Effects of chronic toxicity induced by cadmium on the gametophyte of two fern species // Sci. Papers. Series B. Hort. 2016. V. 60. P. 279–284.
Du H., Li Y., Li D. et al. Effects of light, temperature and pH on spore germination and early gametophytic development of Alsophila metteniana // Biodiv. Sci. 2009. V. 17. P. 182–187.
Edwards M.E. Carbon dioxide and ethylene control of spore germination in Onoclea sensibilis L. // Plant Physiol. 1977. V. 59. P. 756–758.
Edwards M.E., Miller J.H. Growth regulation by ethylene in fern gametophytes. III. Inhibition of spore germination // Amer. J. Bot. 1972. V. 59. P. 458–465.
Edwards E. S., Roux S.J. Influence of gravity and light on the developmental polarity of Ceratopteris richardii fern spores // Planta. 1998. V. 205. P. 553–560.
Elmore H.W., Whittier D.P. The role of ethylene in the induction of apogamous buds in Pteridium gametophytes // Planta. 1973. V. 111. № 1. P. 85–90.
Fernandez H., Bertrand A.M., Feito I. et al. Gametophyte culture in vitro and antheridiogen activity in Blechnum spicant // Plant Cell Tissue Organ Cult. 1997. V. 50. P. 71–74.
Finkelstein R.R., Reeves W., Ariizumi T. et al. Molecular aspects of seed dormancy // Ann. Rev. Plant Biol. 2008. V. 59. P. 387–415.
Fisher R.W., Miller J.H. Growth regulation by ethylene in fern gametophytes. IV. Involvement of photosynthesis in overcoming ethylene inhibition of spore germination // Amer. J. Bot. 1975. V. 62. P. 1104–1111.
Ganger M.T., Hiles R., Hallowell H. et al. A soil bacterium alters sex determination and rhizoid development in gametophytes of the fern Ceratopteris richardii // AoB Plants. 2019. V. 11. № 2. P. 1–12.
García-Cortés H., Catalá M., Rodríguez-Gil J.L. Update on the assessment of chronic phytotoxicity using fern spore biomarkers // Current Advances in Fern Research / Ed. Fernándes H. Cham: Springer International Publishing, 2018. P. 499–515.
Gastony G.J. Haufler C.H. Chromosome numbers and apomixis in the fern genus Bommeria // Biotropica. 1976. V. 8. P. 1–11.
Gómez-Garay A., Galán J.M.G., Cabezuelo A. et al. Ecological significance of brassinosteroids in three temperate ferns // Current Advances in Fern Research / Ed. Fernándes H. Cham: Springer International Publishing, 2018. P. 453–466.
Greer G.K., Dietrich M.A., DeVol J.A. et al. The effects of exogenous cytokinin on the morphology and gender expression of Osmunda regalis gametophytes // Amer. Fern J. 2012. V. 102. P. 32–46.
Gregoric M. Fisher R. Auxin regulates lateral meristem activation in developing gametophytes of Ceratopteris richardii // Can. J. Bot. 2006. V. 84. № 10. P. 1520–1530.
Guiragossian H.A., Koning R.E. Induction of spore germination in Schizaea pusilla (Schizaeaceae) // Amer. J. Bot. 1986. V. 73. № 11. P. 1588–1594.
Guo Q.X., Shen Y.X., Song X.H. et al. The effects of spores germination and planting rate of Athyrium multidentatum // Chin. Agric. Sci. Bull. 2007. V. 23. P. 343–345.
Ha S., Vankova R., Yamaguchi-Shinozaki K. et al. Cytokinins: metabolism and function in plant adaptation to environmental stresses // Trends Plant Sci. 2012. V. 17. P. 172–179.
Haufler Ch.H., Pryer K.M., Schuettpelz E. et al. Sex and the single gametophyte: revising the homosporous vascular plant life cycle in light of contemporary research // BioScience. 2016. V. 66. № 11. P. 928–937.
Hickok L. Abscisic acid blocks antheridiogen-induced antheridium formation in gametophytes of the fern Ceratopteris // Can. J. Bot. 1983. V. 61. № 3. P. 888–892.
Hickok L.G., Kiriluk R.M. Effects of auxins on gametophyte development and sexual differentiation in the fern Ceratopteris thalictroides (L.) Brongn. // Bot. Gaz. 1984. V. 145. № 1. P. 37–42.
Hickok L.G., Warne T.R., Slocum M.K. Ceratopteris richardii: Applications for experimental plant biology // Amer. J. Bot. 1987. V. 74. P. 1304–1316.
Hollingsworth S., Andres E., Greery G. Pheromonal interactions among gametophytes of Osmundastrum cinnamomeum and the origins of antheridiogen systems in leptosporangiate ferns // Int. J. Plant Sci. 2012. V. 173. P. 382–390.
Hu Y., Yu D. BRASSINOSTEROID INSENSITIVE2 interacts with ABSCISIC ACID INSENSITIVE5 to mediate the antagonism of brassinosteroids to abscisic acid during seed germination in Arabidopsis // Plant Cell. 2014. V. 26. P. 4394–4408.
Hyun Y., Lee I. Generating and maintaining jasmonic acid in Arabidopsis // Plant Signal. Behav. 2008. V. 3. P. 798–800.
Jarvis S.J., Wklkins M.B. Photoresponses of Matteuccia struihiopteris (L.) Todaro. I. Germination // J. Exp. Bot. 1973. V. 24. P. 1149–1157.
Johari D., Singh A.P. Biotechnology in clone gametophytes: future perspectives in homosporous ferns // Current Advances in Fern Research / Ed. Fernándes H. Cham: Springer International Publishing, 2018. P. 75–98.
Juárez-Orozco S., Orozco-Segovia A., Mendoza-Ruiz A. et al. Spore germination of eight homosporous ferns in a temperature gradient // S. Afr. J. Bot. 2013. V. 87. P. 112–117.
Kagawa T., Sugai M. Involvement of gibberellic acid in phytochrome-mediated spore germination of the fern Lygodium japonicum // J. Plant Physiol. 1991. V. 138. № 3. P. 299–303.
Kaźmierczak A. Gibberellic acid and ethylene control male sex determinationand development of Anemia phyllitidis gametophytes // Working with Ferns.: Issues and Applications / Eds. Kumar A., Fernández H., Revilla M.A. N.Y.: Springer, 2010. P. 49–65.
Kaźmierczak A. Studies on morphology and metabolism of prothalli during GA3-induced formation of antheridia in Anemia phyllitidis // Acta Physiol. Plant. 1998. V. 20. № 3. P. 277–283.
Kaźmierczak A. Induction of cell division and cell expansion at the beginning of gibberellin A3-induced precocious antheridia formation in Anemia phyllitidis gametophytes // Plant Sci. 2003. V. 165. P. 933–939.
Khripach V., Zhabinskii V., Groot A.D. Twenty years of brassinosteroids: steroidal plant hormones warrant better crops for XXI century // Ann. Bot. 2000. V. 86. P. 441–447.
Korpelainen H. Labile sex expression in plants // Biol. Rev. 1998. V. 73. P. 157–180.
Kwa S.H., Wee Y.C., Lim T.M. et al. IAA-induced apogamy in Platycerium coronarium (Koenig) Desv. gametophytes cultured in vitro // Plant Cell Rep. 1995. V. 14. P. 598–602.
Liu H.-M., Dyer R.J., Guo Z.-Y. et al. The evolutionary dynamics of apomixis in ferns: a case study from Polystichoid ferns // J. Bot. 2012. Art. 510478. P. 1–11.
Ludwig-Muller J. Auxin conjugates: their role for plant development and in the evolution of land plants // J. Exp. Bot. 2011. V. 62. № 6. P. 1757–1773.
Menéndez V., Arbesú R., Somer M. et al. From spore to sporophyte: How to proceed in vitro // In: Working with Ferns: Issues and Applications / Eds. Kumar A., Fernández H., Revilla M.A. N.Y.: Springer, 2010. P. 97–110.
Menéndez V., Revilla M.A., Bernard P. et al. Gibberellins and antheridiogen on sex in Blechnum spicant L. // Plant Cell Rep. 2006a. V. 25. № 10. P. 1104–1110.
Menéndez V., Villacorta N.F., Revilla M.A. et al. Exdogenous and endogenous growth regulators on apogamy in Dryopteria affinis (Lowe) Frasser-Jenkins // Plant Cell Rep. 2006b. V. 25. № 2. P. 85–91.
Menéndez V., Revilla M.A., Fal M.A. et al. The effect of cytokinins on growth and sexual organ development in the gametophyte of Blechnum spicant L. // Plant Cell Tiss. Organ Cult. 2009. V. 96. P. 245–250.
Miller J.H. The effect of auxin and guanine on cell expansion and cell division in the garnetophyte of the fern, Onoclea sensibilis // Amer. J. Bot. 1961. V. 48. P. 816–819.
Miller P.M., Sweet H.C., Miller J.H. Growth regulation by ethylene in fern gametophytes. I. Effects on protonemal and rhizoidal growth and interaction with auxin // Amer. J. Bot. 1970. V. 57. P. 212–217.
Nekrasov E.V., Shelikhan L.A., Svetashev V.I. Fatty acid composition of gametophytes of Matteuccia struthiopteris (L.) Tod. (Onocleaceae, Polypodiophyta) // Botanica Pacifica. 2019. V. 8. № 1. P. 1–4.
Nester J.E., Coolbaugh R.C. Factors influencing spore germination and early gametophyte development in Anemia mexicana and Anemia phyllitidis // Plant Physiol. 1986. V. 82. № 1. P. 230–235.
Pangua E., Quintanilla L.G., Sancho A. et al. A comparative study of the gametophytic generation in the Polystichum aculeatum group Pteridophyta // Int. J. Plant Sci. 2003. V. 164. P. 295–303.
Peng J., Harberd N.P. The role of GA-mediated signalling in the control of seed germination // Curr. Opin. Plant Biol. 2002. V. 5. P. 376–381.
Pierik R., Tholen D., Poorter H. et al. The Janus face of ethylene: growth inhibition and stimulation // Trends Plant Sci. 2006. V. 11. № 4. P. 178–182.
Pinto S.C., Leitao G.G., Castellar A. et al. Chemical composition of the volatile fractions from wild and in vitro plants of Anemia tomentosa var. anthriscifolia (Pteridophyta) // J. Essent. Oil Res. 2013. V. 25. № 3. P. 198–202.
Plackett A.R.G., Rabbinowitsch E.H., Langdale J.A. Protocol: genetic transformation of the fern Ceratopteris richardii through microparticle bombardment // Plant Methods. 2015. V. 11. P. 1–10.
PPG I. A community-derived classification for extant lycophytes and ferns // J. Syst. Evol. 2016. V. 54. № 6. P. 563–603.
Raghavan V. Developmental Biology of Fern gametophytes. Cambridge: Cambridge University Press, 1989. 376 p.
Ren B.R., Xia B., Li W.L. et al. Investigation on spore germination of Sphenomeris chinensis (Lindsaeaceae) // Acta Bot. Yunnanica. 2008. V. 30. № 6. P. 713–717.
Rivera A., Cañal M.J., Grossniklaus U. et al. The gametophyte of fern: born to reproduce // Current Advances in Fern Research / Ed. Fernándes H. Cham: Springer International Publishing, 2018. P. 3–20.
Rodríguez-Romero A.J., Sedeño-Díaz J.E., López-López E. et al. Recentadvances in the use of mitochondrial activity of fern spores for the evaluation of acute toxicity // Current Advances in Fern Research / Ed. Fernándes H. Cham: Springer International Publishing, 2018. P. 481–498.
Romanenko K.O., Kosakivska I.V., Babenko L.M. et al. Effects of exogenous cytokinins on spore germination and gametophyte morphogenesis of Dryopteris filix-mas (L.) Schott in vitro culture // Cytol. Genet. 2019. V. 53. № 3. P. 192–201.
Rutherford G., Tanurdzic M., Hasebe M. et al. A systemic gene silencing method suitable for high throughput, reverse genetic analyses of gene function in fern gametophytes // BMC Plant Biol. 2004. V. 16. P. 4–6.
Schneller J.J. Antheridiogens // Biology and Evolution of Ferns and Lycophytes / Eds. Ranker T.A., Haufler C.H. Cambridge: Cambridge University Press, 2008. P. 134–158.
Schneller J.J. Spore bank, dark germination and gender determination in Athyrium and Dryopteris: results and implications for population biology of Pteridophyta // Bot. Helv. 1988. V. 98. P. 77–86.
Schraudolf H. Relative activity of gibberellins in antheridium induction in Anemia phyllitidis // Nature. 1964. V. 201. P. 98–99.
Sharpe J.M., Mehltretter K., Walker L.R. Ecological importance of ferns // Fern Ecology / Eds. Mehltretter K., Walker L.R., Sharpe J.M. Cambridge: Cambridge University Press, 2010. P. 1–21.
Sheffield E., Bell P.R. Current studies of the pteridophyte life cycle // Bot. Rev. 1987. V. 53. P. 442–490.
Smith A.R., Pryer K.M., Schuettpelz E. et al. Fern classification // Biology and Evolution of Ferns and Lycophytes / Eds. Ranker T.A., Haufler C.H. Cambridge: Cambridge University Press, 2008. P. 417–467.
Soare L.C., Păunescu A., Ponepal C.M. The morphophysiological, histological, and biochemical response of some nontarget organisms to the stress induced by the pesticides in the environment // Pesticides, Anthropogenic Activities and the Health of Our Environment / Eds. Larramendy M.L., Soloneski S. London: IntechOpen Limited, 2019. P. 1–25.
Sobota A.E., Partanen C.R. The growth and division of cells in relation to morphogenesis in fern garnetophytes: II. The effect of biochemical agents on the growth and development of Pteridium aquilinum // Can. J. Bot. 1967. V. 45. № 5. P. 595–603.
Spiro M.D., Torabi B., Cornell C.N. Cytokinins induce photomorphogenic development in dark-grown gametophytes of Ceratopteris richardii // Plant Cell Physiol. 2004. V. 45. P. 1252–1260.
Strain E., Hass B. Banks J. Characterization of mutations that feminize gametophytes of the fern Ceratopteris // Genetics. 2001. V. 159. P. 1271–1281.
Strickler B. Responses of Pteris longifolia to applications of ammonium 2,4-dichlorophenoxyacetate // Bot. Gaz. 1946. V. 108. P. 101–114.
Sugai M., Nakamura K., Yamane H. et al. Effects of gibberellins and their methyl esters on dark germination and antheridium formation in Lygodium japonicum and Anemia phyllitidis // Plant Cell Physiol. 1987. V. 28. № 1. P. 199–202.
Suo J., Chen S., Zhao Q. et al. Fern spore germination in response to environmental factors // Front. Biol. 2015. V. 10. P. 358–376.
Swami P., Raghavan V. Control of morphogenesis in the gametophyte of a fern by light and growth hormones // Can. J. Bot. 1980. V. 58. P. 1464–1473.
Takeno K., Furuya M. Bioassay of antheridiogen in Lygodium japonicum // Dev. Growth Differ. 1975. V. 17. № 1. P. 9–18.
Takeno K., Furuya M. Inhibitory effect of gibberellins on archegonial differentiation in Lygodium japonicum // Physiol. Plant. 1977. V. 39. P. 135–138.
Tanaka J., Yano K., Aya K. et al. Antheridiogen determines sex in ferns via a spatiotemporally split gibberellin synthesis pathway // Science. 2014. V. 346. № 6208. P. 469–473.
Tanco M.E., Martinez O.G., Bonomo M.L.C. Germination and gametofitic morphogenesis of Pteris inermis (rosenst.) de la sota // Gayana Bot. 2009. V. 66. № 1. P. 10–17.
Tong H., Xiao Y., Liu D., et al. Brassinosteroid regulates cell elongation by modulating gibberellin metabolism in rice // Plant Cell. 2014. V. 26. № 11. P. 4376–4393.
Vishwakarma K., Upadhyay N., Kumar N. et al. Abscisic acid signaling and abiotic stress tolerance in plants: a review on current knowledge and future prospects // Front. Plant Sci. 2017. V. 8. P. 161–173.
Warne T.R., Hickok L.G. (2-Chloroethyl)phosphonic acid promotes germination of immature spores of Ceratopteris richardii Brongn // Plant Physiol. 1987. V. 83. № 4. P. 723–725.
Wasternack C. Jasmonates: an update on biosynthesis, signal transduction and action in plant stress response, growth and development // Ann. Bot. 2007. V. 100. P. 681–669.
Weinberg E.S., Voeller B.R. External factors inducing germination of fern spores // Amer. Fern J. 1969. V. 59. № 4. P. 153–167.
Whittier D.P. The influence of growth substances on the induction of apogamy in Pteridium gametophytes // Amer. J. Bot. 1966. V. 53. P. 882–886.
Whittier D.P. The influence of osmotic conditions on induced apogamy in Pteridium gametophytes // Phytomorphology. 1975. V. 25. P. 246–249.
Whittier D.P., Steeves T.A. The induction of apogamy in the bracken fern // Can. J. Bot. 1960. V. 38. P. 925–930.
Whittier D.P., Steeves T.A. Further studies on induced apogamy in ferns // Can. J. Bot. 1962. V. 40. P. 1525–1531.
Wu H., Liu X.-Q., Ji H. et al. Effects of light, macronutrients, and sucrose on germination and development of the endangered fern Adiantum reniforme var. sinense (Adiantaceae) // Sci. Hortic. 2010. V. 125. P. 417–421.
Zhai G.Y., Bian K., Jia K.G. et al. Effect of GA3 and MS medium ratio treatments on spore germination of wild Brake // China Veget. 2007. V. 8. P. 21–23.
Zhang J.W., Niu J.Y. The effects of culture ground substances, GA3 and B, on spores germination and planting rate of Pteridium aquilinum // Acta Pratac Sin. 1999. V. 8. № 1. P. 62–68.
Zhang K.M., Shen Y., Fang Y.M. et al. Changes in gametophyte physiology of Pteris multifidainduced by the leaf leachate treatment of the invasive Bidens pilosa // Environ. Sci. Pollut. Res. 2016. V. 23. P. 3578–3585.
Zhang Y., Yang L. Effects of GA3 and culture media on the development of Athyrium multidentatum (Dol.) // J. Jilin Agric. Univ. 2011. V. 33. № 4. P. 355–359.
Дополнительные материалы отсутствуют.
Инструменты
Онтогенез


