Онтогенез, 2021, T. 52, № 2, стр. 83-93
Формирование биомолекулярных конденсатов: регуляция эмбриогенеза на клеточном уровне
М. А. Тихомирова a, b, c, *, Е. В. Шеваль c, d
a Московский государственный университет им. М.В. Ломоносова, факультет биоинженерии
и биоинформатики
119991 Москва, Ленинские горы, 1, стр. 73, Россия
b Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
c НИИ физико-химической биологии им. А.Н. Белозерского Московского государственного университета
им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 40, Россия
d Московский государственный университет им. М.В. Ломоносова, биологический факультет
119991 Москва, Ленинские горы, 1, стр. 12, Россия
* E-mail: mariiatikh@gmail.com
Поступила в редакцию 07.09.2020
После доработки 19.10.2020
Принята к публикации 25.10.2020
Аннотация
Многие морфогенетические процессы в ходе онтогенеза определяются изменениями в структуре и функциях клеток эмбрионов. Наибольшую пластичность клеточной организации придают безмембранные органеллы или биомолекулярные конденсаты, которые могут формироваться в ядре или цитоплазме по механизму разделения фаз на границе жидкость-жидкость (liquid-liquid phase separation). Гибкость биогенеза биомолекулярных конденсатов и высокая динамика их компонентов позволяют быстро менять клеточную организацию, что влечет за собой изменения в судьбе клеток, и, как следствие, в ходе эмбриогенеза. В обзоре на примере одного из типов безмембранных структур – половых гранул, обсуждается связь пластичности клеточной организации с реализацией процессов раннего эмбриогенеза.
ВВЕДЕНИЕ
Органеллы в клетке можно подразделить на те, которые окружены мембранами, и те, у которых мембрана отсутствует. Хотя среди безмембранных органелл есть относительно стабильные образования с высоко упорядоченной организацией (микротрубочки, центриоли, рибосомы), большинство таких органелл представляет собой высоко лабильные ассоциаты различных макромолекул (прежде всего, РНК и белков). Такие структуры могут локализоваться как в ядре (ядрышки, тельца Кахаля, тельца гистонового локуса и т.д.), так и в цитоплазме (стресс-гранулы, Р-гранулы и т.д.). Все эти структуры представляют собой результат конденсации специфического набора молекул в локальной, не ограниченной мембранами области клетки. Для обозначения таких структур удобно использовать чисто описательный термин безмембранные органеллы (Боголюбов, 2019). Но в последние годы чаще используются термины конденсаты (Shin, Brangwynne, 2017) или биомолекулярные конденсаты (Sabari et al., 2020), отражающие ключевой принцип формирования этих структур.
Процессы эмбриогенеза сопровождаются формированием специфических биомолекулярных конденсатов. Наиболее известным примером клеточной дифференцировки такого типа является формирование половых гранул, присутствие которых определяет особенности последующей судьбы клеток, в которые эти гранулы попадают (Voronina et al., 2011). Биомолекулярные конденсаты формируются в результате процессов самоорганизации, что позволяет легко изменять их организацию, гибко реагируя на потребности клетки и условия окружающей среды (Misteli, 2001). По-видимому, именно эта гибкость и делает биомолекулярные конденсаты удобным инструментом для регуляции стремительных изменений в ходе эмбриогенеза.
МЕХАНИЗМЫ БИОГЕНЕЗА БИОМОЛЕКУЛЯРНЫХ КОНДЕНСАТОВ
Биомолекулярные конденсаты не окружены мембранами, что делает возможным постоянный обмен образующих их макромолекул с окружающим пространством клетки (с нуклеоплазмой или цитозолем). Такие структуры образуются посредством процесса, известного как разделение фаз на границе жидкость-жидкость (liquid-liquid phase separation) (Banani et al., 2017; Sabari et al., 2020; Shin, Brangwynne, 2017). Чтобы разделение фаз происходило в клетках, концентрации макромолекул, которые составляют биомолекулярные конденсаты, должны превышать их концентрации насыщения или “предел растворимости” в цитоплазме или нуклеоплазме (Courchaine et al., 2016). Ниже этого уровня молекулы растворяются в окружающем клеточном растворе и формирование структур не происходит. Если концентрация насыщения превышена, дополнительные полимерные цепи конденсируются в своеобразные жидкие капли, что ведет к увеличению размера органелл. При этом, макромолекулы внутри и вне органелл постоянно обмениваются и находятся в равновесии (рис. 1).
Рис. 1.
Формирование безмембранных органелл. Основным физическим процессом, приводящим к формированию биомолекулярных конденсатов, является разделение фаз на границе жидкость-жидкость. В результате такого разделения, происходящего за счет слабых, но многочисленных взаимодействий между биологическими макромолекулами (РНК и белки), достигается высокая концентрация необходимых компонентов в составе структур, не окруженных мембранами. При этом структуры сохраняют высокую динамику, что выражается как в способности структур быстро собираться и разбираться, так и в постоянном обмене молекул между структурой и окружающим пространством (нуклеоплазма или цитозоль).
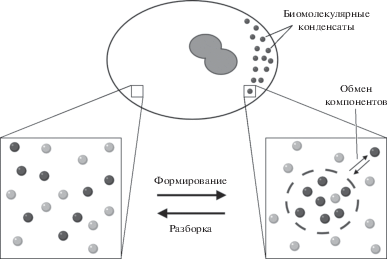
Биомолекулярные конденсаты могут образовывать гомогенные по внутренней структуре образования, но часто они представляют собой сложные по архитектуре гетерогенные структуры, имеющие несколько обособленных частей, образованных несмешивающимися между собой фазами (Shin, Brangwynne, 2017). В частности, представлены данные в пользу того, что белки ядрышка способны формировать обособленные фазы, что лежит в основе формирования сложной структуры ядрышка (Feric et al., 2016).
Биомолекулярные конденсаты могут гибко реагировать на колебания температуры, рН и осмолярности, поэтому некоторые из гранул образуются в условиях стресса (Palangi et al., 2017). Например, изменение тоничности окружающей клетки среды может приводить к изменению объема клетки, т.е. влиять на концентрацию макромолекул. Так, перевод клеток в гипотонические условия приводит к разборке ядрышек (Zatsepina et al., 1997a), а последующий возврат в изотонические условия приводит к формированию из компонентов разобранных ядрышек многочисленных телец, которые были названы интерфазными проядрышками (Zatsepina et al., 1997b). Аналогичным образом, перевод в гипертонические условия индуцирует формирование биомолекулярных конденсатов в цитоплазме (Bounedjah et al., 2012; Aulas et al., 2017; Jalihal et al., 2020). По-видимому, сходные механизмы реализуются и в половых клетках. Так, при задержке овуляции у Caenorhabditis elegans в ооцитах формируются крупные РНП-гранулы, которые содержат РНК-связывающие белки и материнские мРНК, подвергающиеся трансляционной репрессии (Jud et al., 2008). Формирование сходных РНП-гранул может быть индуцировано и в нормальных ооцитах под действием теплового шока, осмотического стресса или аноксии (Schisa et al., 2001; Jud et al., 2008; Noble et al., 2008; Patterson et al., 2011), что очень сходно с индукцией стресс-гранул в клетках млекопитающих (Corbet, Parker, 2019), а также стресс-гранул и P-телец у дрожжей (Buchan et al., 2011; Shah et al., 2013).
Формирование безмембранных структур зависит в наибольшей степени от двух типов взаимодействий между биологическими макромолекулами. Большую роль в формировании конденсатов играют мультивалентные белок-белок и/или белок-РНК взаимодействия (Li et al., 2012; Banani et al., 2016). Также биомолекулярные конденсаты содержат большое количество белков, в составе которых присутствуют участки с низкой сложностью (low sequence complexity domains), в которых содержатся многочисленные повторы как отдельных аминокислот, так и аминокислотных мотивов. Эти белки относят к группе внутренне неупорядоченных белков (intrinsically disordered proteins), которые содержат протяженные участки, не имеющие четко выраженной конформации (Tompa, 2012). Неупорядоченные участки могут слабо взаимодействовать друг с другом, и такие слабые мультивалентные взаимодействия являются одной из движущих сил разделения фаз (Kato et al., 2012; Lin et al., 2015; Molliex et al., 2015; Nott et al., 2015).
В формировании многих биомолекулярных конденсатов ведущую роль играют молекулы РНК (Mao et al., 2011; Shevtsov, Dundr, 2011; Kato et al., 2012), а выход молекул РНК из структуры может вести к ее разборке (Carron et al., 2012; Musinova et al., 2016). Молекулы РНК достаточно велики, что позволяет им выступать субстратом для мультивалентных взаимодействий (Falkenberg et al., 2017). Центром нуклеации биомолекулярных конденсатов могут выступать кодирующие РНК, как это происходит в случае телец гистонового локуса, формирование которых зависит от транскрипции мРНК коровых гистонов (Shevtsov, Dundr, 2011). Биогенез некоторых биомолекулярных конденсатов зависит от присутствия специальных некодирующих РНК, которые играют структурную роль. Такие РНК иногда называют архитектурными (architectural RNA, arcRNA) (Chujo et al., 2016).
ПОЛОВЫЕ ГРАНУЛЫ
Половые гранулы представляют собой цитоплазматические биомолекулярные конденсаты, необходимые для дифференцировки клеток половой линии. Эти органеллы были обнаружены в цитоплазме многих животных, и хотя состав половых гранул варьирует в зависимости от вида, белки Vasa, Tudor и Argonaut обнаруживаются в составе гранул от C. elegans до человека (Gao, Arkov, 2013).
У разных организмов половые гранулы могут носить разные названия, но во всех случаях они содержат материнские мРНК, необходимые для спецификации половых клеток, и определяют время трансляции мРНК, чтобы способствовать установлению линии половых клеток у ранних эмбрионов (Marnik, Updike, 2019; Trcek, Lehmann, 2019; Lasko, 2020).
ПОЛОВЫЕ ГРАНУЛЫ У Drosophila melanogaster
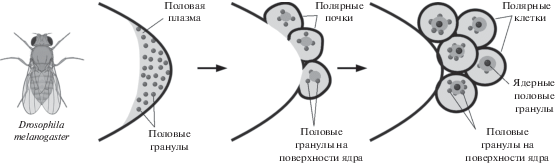
Образование половых клеток у насекомых детерминируется расположенной на заднем полюсе ядра половой плазмой (рис. 2). Уже ранние электронно-микроскопические работы Мэховалда показали, что половая плазма содержит многочисленные гранулы, которые у насекомых называют половыми гранулами (Mahowald, 1962). Формирование гранул и специфическое накопление в них макромолекул имеет решающее значение для формирования половых клеток у дрозофилы. Например, эмбрионы, в которых не формируются гранулы или формируются маленькие гранулы, не образуют половых клеток (Arkov et al., 2006).
Рис. 2.
Организация половых гранул в раннем развитии D. melanogaster. В только что оплодотворенном яйце гранулы равномерно распределены по половой плазме, через 1.5–3 ч на заднем конце эмбриона формируются полярные почки, которые потом становятся полярными клетками. В полярных почках половые гранулы располагаются около ядер, во время образования полярных клеток дополнительно формируются ядерные половые гранулы.
Формирование половых гранул у Drosophila melanogaster зависит от мРНК osk, которая накапливается в задней области ооцитов и ранних эмбрионов (Lehmann, Nüsslein-Volhard, 1986; Ephrussi, Lehmann, 1992). Развивающийся ооцит дрозофилы окружен питающими клетками, которые связаны между собой и с ооцитом каналами. Функция питающих клеток состоит в том, чтобы синтезировать мРНК, белки и другие материалы, необходимые для раннего развития, и депонировать их в растущем ооците. мРНК osk синтезируется питающими клетками, а затем поступает в ооцит. Транспорт в ооцит транскриптов osk и некоторых других мРНК зависит от кортикальных микротрубочек и активности динеинов и кинезинов (Glotzer et al., 1997; Bullock, Ish-Horowicz, 2001; Sinsimer et al., 2013), а накопление транскриптов osk зависит от F-актина (Sinsimer et al., 2013).
Однако, если транспорт зависит от элементов цитоскелета, формирование гранул зависит от взаимодействия транскриптов osk друг с другом. Интересно, что в эти взаимодействия вовлечены компоненты комплекса сращивания экзонов (exon-exon junction complex), благодаря чему в половых гранулах накапливаются только сплайсированные транскрипты (Hachet, Ephrussi, 2004). Кроме того, с osk связываются факторы, регулирующие трансляцию, например, РНК-связывающий белок Bruno, который репрессирует трансляцию в ходе транспорта (Castagnetti et al., 2000; Chekulaeva et al., 2006; Kim et al., 2015) и одновременно способствует олигомеризации транскриптов мРНК (Chekulaeva et al., 2006).
На заднем полюсе ооцита мРНК osk транслируется в две изоформы белка: длинную изоформу, называемую Long Oskar, и короткую изоформу, называемую Short Oskar. В формировании половых гранул ключевую роль играет короткая изоформа белка Oskar (Markussen et al., 1995). Oskar взаимодействует с еще одним белком половых гранул – Vasa, что является, по-видимому, ключевым событием в формировании половых гранул (Breitwieser et al., 1996). Показано, что короткая изоформа белка Oskar способна формировать гранулы в отсутствие других компонентов половых гранул в культивируемых клетках дрозофилы и клетках человека (Kistler et al., 2018). Эта способность зависит от присутствия в белке внутренне неупорядоченных участков (Krishnakumar et al., 2018).
Важную роль в формировании половых гранул также играет белок Tudor (Thomson, Lasko, 2004; Arkov et al., 2006), который содержит 11 доменов Tudor, способных связывать симметрично диметилированные аргинины. Tudor связывает белки, в составе которых есть метилированные аргинины, например, белок Aubergine (Kirino et al., 2010b; Liu et al., 2010), который связывает piRNA. Метилированые аргинины есть также в составе белка Vasa (Kirino et al., 2010a).
Уже в ранних электронно-микроскопических работах было показано, что половые гранулы у D. melanogaster имеют неоднородную структуру, во время оогенеза они состоят из гранул размером 150–200 нм и содержат более мелкий гранулярный или фибриллярный компонент, а также часто имеют полость в центре (Mahowald, 1962). Показано, что белки Aubergine и Tudor формируют в половых гранулах частично перекрывающиеся фазы, а после формирования половых клеток в гранулах белок Aubergine располагается вокруг кластера белка Tudor (Vo et al., 2019). Т.е. половые гранулы D. melanogaster могут представлять собой гетерогенные конденсаты с сосуществующими двумя фазами.
Функция половых гранул осуществляется за счет накапливающихся в их составе инактивированных транскриптов различных мРНК. В половых гранулах специфически накапливается приблизительно 200 типов молекул мРНК (Frise et al., 2010). Некоторые из этих мРНК кодируют белки, которые играют важную роль в процессах развития. Так, белок Nanos участвует в формировании передне-заднего градиента, который необходим для закладки передне-задней оси эмбриона (Gavis, Lehmann, 1992). Накопление мРНК связано с диффузией молекул и последующим их заякориванием (entrapment) внутри гранул (Forrest, Gavis, 2003). Интересно, что различные мРНК образуют так называемые гомотипические кластеры, т.е. скопления молекул мРНК одного типа (Trcek et al., 2015). По-видимому, сначала в гранулы включаются единичные молекулы мРНК, которые затем рекрутируют дополнительные транскрипты тех же генов, что ведет к формированию кластеров молекул мРНК (Niepielko et al., 2018). Механизмы формирования гомотипических кластеров малопонятны. С одной стороны, некоторые данные говорят о том, что формирование таких кластеров зависит от присутствия особых последовательностей в 3' некодирующих регионах транскриптов (Eagle et al., 2018), другие данные свидетельствуют в пользу того, что формирование кластеров не зависит от присутствия в молекулах мРНК каких-либо специальных последовательностей, а представляет собой обособление обогащенных различными мРНК фаз внутри зародышевых гранул (Trcek et al., 2020).
Также необходимо отметить, что в эмбрионе могут формироваться два типа половых гранул: цитоплазматические гранулы, также называемые “полярными гранулами”, которые связываются с молекулами материнской мРНК и способствуют образованию первичных половых клеток, и внутриядерные половые гранулы, которые способствуют митотическому делению первичных половых клеток (Kistler et al., 2018) (рис. 2). Формирование обоих типов гранул зависит от короткой изоформы белка Oskar.
Р-ГРАНУЛЫ Caenorhabditis elegans
Половые гранулы C. elegans называют Р-гранулами, так как эти гранулы накапливаются в бластомерах, из которых формируются половые клетки (Р-линия). P-гранулы присутствуют в линии половых клеток на протяжении всего цикла жизни червя (рис. 3). Они располагаются на поверхности ядер предшественников ооцитов, которые формируют синцитий, но после целлюляризации постепенно распределяются по цитоплазме. После оплодотворения Р-гранулы сосредотачиваются на заднем конце клетки, ассиметричное распределение Р-гранул повторяется в течении последующих четырех клеточных делений, что в итоге приводит к формированию Р-бластомера, клетки, ответственной за развитие половой линии (Seydoux, 2018). Между 2 и 8 клеточной стадии гранулы опять начинают локализоваться на поверхности ядер, причем имеются данные, что на этой стадии формируется три типа гранул – Р-гранулы, Z-гранулы и Mutator foci (Wan et al., 2018).
Рис. 3.
Формирование Р-гранул у C. elegans. P-гранулы располагаются на поверхности ядер в клетках-предшественниках ооцитов, ко времени созревания ооцитов Р-гранулы отделяются от ядер и распределяются по цитоплазме. У одноклеточного эмбриона Р-гранулы располагаются в задней части, такая неравномерная локализация сохраняется в последующие деления клеток. Между 2 и 8 клеточной стадии, на момент образования примерно 100 клеток, гранулы опять начинаю локализоваться на поверхности ядер и на этой стадии формируется три типа гранулы – Р-гранулы, Z‑гранулы и Mutator foci.

После оплодотворения в зиготе Р-гранулы демонстрируют динамичное поведение, они постоянно перемещаются с током цитоплазмы (Hird et al., 1996). Причем, потоки гранул от переднего конца к заднему и обратно уравновешены: по ходу движения от заднего конца к переднему Р-гранулы постепенно разбираются, и наоборот по мере движения материала Р-гранул к заднему концу конденсируются (Brangwynne et al., 2009).
Р-гранулы гетерогенны по локализации и, вероятно, функциям. Это гетерогенность связана с присутствием белков с внутренне неупорядоченными доменами разных типов, которые отвечают за особенности формирования и функционирования Р-гранул. Так, белки GLH-1, GLH-2, GLH-4, RDE-12 и DDX-19 содержат FG-повторы, которые сходны с FG-повторами нуклеопоринов (Sheth et al., 2010). В синцитии, сформированном половыми клетками, Р-гранулы связаны с ядром, непосредственно контактируя при этом с ядерными порами (Pitt et al., 2000). FG-нуклеопорины образуют барьер в центральном канале ядерной поры, через который проникают белки и РНК в ходе ядерного экспорта и импорта (Hayama et al., 2017; Zilman, 2018). P-гранулы контролируют проникновение в цитоплазму половых клеток транскриптов некоторых генов, которые вовлечены в процессы функционирования соматических клеток, т.е. выступают в качестве регулятора транкриптома половых клеток (Knutson et al., 2017). Кроме того, у С. elegans нуклеопорины необходимы для обеспечения ассоциации Р-гранул с ядерными порами (Updike, Strome, 2009), а гомолог нуклеопорина позвоночных Nup98 (CeNup98) локализуется также и в перинуклеарных Р-гранулах синцития линии половых клеток, в которых CeNup98 связан с транскрипционно репрессированной мРНК nos-2 (Voronina, Seydoux, 2010). По-видимому, экспортируемая мРНК попадает из поры сразу в Р-гранулы, которые накапливают большие количества мРНК в еще неактивных половых клетках, и предположительно репрессируют трансляцию этих РНК (Sheth et al., 2010).
Некоторые белки Р-гранул содержат более или менее протяженные участки, обогащенные потворами аргининов и глицинов (RG- или RGG-мотивы). Аргинины в составе как RG так и RGG повторов метилируются (Thandapani et al., 2013), также для них характерна неспецифическая РНК-связывающая активность (Chong et al., 2018). Такие повторы есть в белках PGL-1 и PGL-3, а также в белке LAF-1. Для этих белков показана способность формировать конденсаты in vitro (Elbaum-Garfinkle et al., 2015; Saha et al., 2016). PGL-1 и PGL-3 способны формировать конденсаты благодаря присутствию димеризационного домена, а RG-повторы необходимы для связывания РНК и привлечения других белков (Hanazawa et al., 2011). По-видимому, участки белков, содержащие RG- и RGG-мотивы, часто вовлечены в формирование различных биомолекулярных конденсатов. Так, недавно было показано, что формирование одного из доменов ядрышка – плотного фибриллярного компонента, зависит от взаимодействий между собой обогащенных RGG-мотивами N-терминальных участков фибрилларина (FBL) (Yao et al., 2019).
Наконец, белки MEG-1, MEG-2, MEG-3 и MEG-4 содержат длинные неупорядоченные N-концевые участки, обогащенные серинами (Wang et al., 2014). MEG-3 способен образовывать конденсаты in vitro (Lee et al., 2020), и, по-видимому, формирует относительно стабильную часть Р-гранул, с которой взаимодействуют более динамичные компоненты (Putnam et al., 2019). Благодаря наличию неупорядоченных белковых доменов, белок MEG-3 конденсирует мРНК (Lee et al., 2020). P-гранулы эмбриона удерживают мРНК, не связанные с рибосомами до момента их деградации или трансляции в бластомере половой линии P4.
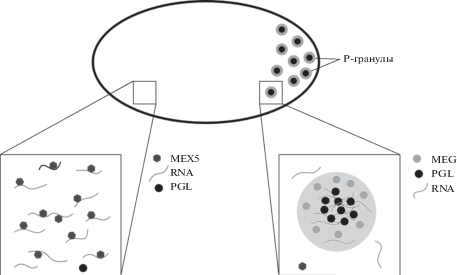
Закладка передне-задней оси в зиготе C. elegans определяется токами в цитоплазме, индуцируемыми сперматозоидом при оплодотворении (Kimura, Kimura, 2020). Р-гранулы формируются только в задней части одноклеточного эмбриона благодаря градиенту белка MEX-5 (Brangwynne et al., 2009). По-видимому, этот градиент регулирует фазовый переход, ведущий к формированию Р-гранул, через регулирование пула доступных РНК. В системе in vitro показано, что добавление РНК к очищенным PGL-3 и MEG-3 снижает концентрацию белка, необходимую для индукции фазового перехода (Saha et al., 2016; Smith et al., 2016). MEX-5 связывается с молекулами РНК на переднем конце зиготы, таким образом уменьшая пул молекул РНК, который используется для формирования Р-гранул. На заднем конце клетки отсутствие MEX-5 позволяет MEG-3 и PGL-3 связывать РНК, что облегчает формирование Р-гранул (рис. 3).
БИОМОЛЕКУЛЯРНЫЕ КОНДЕНСАТЫ, УЧАСТВУЮЩИЕ В ЗАЩИТЕ КЛЕТОК ПОЛОВОЙ ЛИНИИ ОТ СТРЕССА
Клетки половой линии потенциально бессмертны, поэтому защита этих клеток от стресса имеет особое значение. В ооцитах накапливаются значительные количества материнских мРНК, многие из которых остаются нетранслируемыми в течение длительного времени. Повреждение этих мРНК может представлять особую опасность для последующего развития зародыша. Одним из распространенных вариантов ответа на клеточный стресс с целью защиты гамет, является сборка гранул, состоящих из белков и РНК (Schisa, 2019). Индуцированные стрессом гранулы были описаны у позвоночных и беспозвоночных, однако их функция остается в значительной степени неизвестной.
Среди гранул, которые образуются в соматических клетках в условиях стресса, выделяют стресс-гранулы и тельца процессинга (P-тельца) (Kedersha et al., 2005). Одной из ключевых реакций на стресс является ингибирование трансляции и формирование стресс-гранул, содержащих консервативные РНК-связывающие белки TIA-1 и TIAR. Стресс-гранулы содержат нетранслируемые мРНК (Khong et al., 2017), и принято считать, что формирование стресс-гранул позволяет быстро восстановить трансляцию после завершения стресса (Buchan, Parker, 2009). Р-тельца, по-видимому, представляют собой сайты деградации мРНК (Decker, Parker, 2012), но они также способны накапливать в себе трансляционно неактивную мРНК (Hubstenberger et al., 2017), защищая ее от деградации с возможностью быстро активировать трансляцию. Р-тельца и стресс-гранулы хотя и отличаются по составу и свойствам, но имеют отдельные общие компоненты (Ivanov et al., 2019).
Несколько компонентов P-телец участвуют в локализации мРНК osk и трансляционной репрессии (Fan et al., 2011). Белок Cup трансляционно репрессирует мРНК osk у D. melanogaster и играет важную роль в поддержании ее стабильности. В отсутствии Сup компоненты комплекса Oskar не локализуются в развивающемся ооците (Broyer et al., 2017). Локализация мРНК osk на заднем полюсе ооцита дрозофилы особенно важна для эмбрионального развития, поскольку она играет важную роль для формирования будущей половой линии.
Белок DAZL является важным регулятором развития половых клеток (Rosario et al., 2019), он вовлечен в активацию трансляции мРНК при созревании ооцитов и раннем эмбриональном развитии (Chen et al., 2011). В отсутствии белка DAZL мыши стерильны и не формируют половые клетки (Lin, Page, 2005). В половых клетках самцов мышей DAZL необходим для формирования стресс-гранул, влияющих на выживание половых клеток при тепловом стрессе (Kim et al., 2012).
Белок стресс-гранул TIAR-1 изучался в ооцитах С. elegans при различных стрессовых условиях и, по-видимому, защищает зародышевую линию от неблагоприятного действия теплового шока. У червей с мутациями в белке TIAR-1 было значительное снижение фертильности (Huelgas-Morales et al., 2016). У эмбрионов С. elegans окислительный стресс, голодание и солевой стресс вызывают перемещение убиквитина, протеасом и белка TIAR-2 в отдельные области, называемые ядерными гранулами, вызванными стрессом (stress induced nuclear granules, SING) (Sampuda et al., 2017). У эмбрионов, содержащих SING прекращается деление клеток.
Рис. 4.
Регуляция формирования Р-гранул у C. elegans путем конкурентного связывания с РНК белков Р-гранул и белка MEX5. Разделение фаз в передней части эмбриона C. elegans подавляется за счет присутствия там белка MEX5, взаимодействующего с молекулами РНК. В задней части эмбриона белок MEG связывается с РНК в результате чего, по-видимому, происходит сборка P-гранул за счет разделения фаз. Белки PGL формируют жидкую фазу вокруг которой конденсируются белки MEG, имеющие более плотную структуру, похожую на гель.
Интересно, но формирование телец, содержащих мРНК может происходить не только как результат реакции клетки на стресс, но и в нормальных условиях. Недавно были обнаружены новые рибонуклеопротеиновые гранулы в цитоплазме ооцитов Xenopus laevis, которые были названы L‑тельцами (Neil et al., 2020). L-тельца содержат мРНК, которые накапливаются в цитоплазме ооцитов в ходе созревания. Протеом L-телец более чем на две трети состоит из белков, которые являются компонентами ранее описанных цитоплазматических гранул, в том числе стресс-гранулы, P‑телец, половых гранул, но остальная часть белков является уникальной для этих органелл. По-видимому, молекулы мРНК в L-тельцах выполняют структурную (архитектурную) функцию. В ооцитах упаковка материнских мРНК в стабильные гранулы, такие как L-тельца, может быть важным механизмом для подавления трансляции в течение длительных периодов времени (Neil et al., 2020). Также важно отметить, что формирование описанных выше органелл, содержащих мРНК, может являться крайней формой обособления молекул в цитоплазме. Накопление отдельных мРНК может происходить и отдельно от каких-либо органелл, причем этот процесс сопряжен с трансляцией (Samacoits et al., 2020).
ЗАКЛЮЧЕНИЕ
В этом обзоре мы сосредоточились на наиболее изученном случае регуляции эмбриогенеза с помощью безмембранных структур (половых гранул), однако приведенный материал не исчерпывает случаи регуляции эмбриогенеза и дифференцировок биомолекулярных конденсатов. Так, например, ядерные тельца вовлечены в процесс перехода от материнского к зиготическому типу экспрессии генов (материнско-зиготический переход) (Arias Escayola, Neugebauer, 2018). Скорее всего, мы находимся в самом начале изучения роли биомолекулярных конденсатов в регуляции процессов эмбриогенеза и дифференцировки. С чем же связана столь важная роль именно этого типа органелл?
Как уже упоминалось выше, формирование биомолекулярных конденсатов происходит путем самоорганизации. Еще в ранних работах по изучению механизмов самоорганизации было отмечено, что такой способ позволяет добиваться большой гибкости в структуре и составе (а значит и функции) органелл, позволяет гибко реагировать на изменения в составе клетки и вокруг нее (Misteli, 2001). Это особенность ярко проявляется, например, в изменениях структуры Р-гранул в ходе гаметогенеза и раннего развития C. elegans (рис. 3). Однако не менее важным является и то, что формирование крупных конденсатов позволяет регулировать целые комплексы макромолекул. Причем, эти комплексы могут быть легко перемещены в определенные части клетки, что особенно важно для процессов раннего эмбриогенеза, когда происходит пространственная дифференцировка зародыша. Также обращает внимание, что высокая пластичность биомолекулярных конденсатов приводит к возможности формировать на единой основе очень разные структуры. Половые гранулы имеют много общего с образующимися при стрессе стресс-гранулами и Р-тельцами. Обе группы структур накапливают мРНК, однако это преследует принципиально разные цели – адаптация клетки к стрессу и обеспечения раннего эмбриогенеза. Т.е. на одной основе могут формироваться разные типы структур, которые могут выполнять функции специфические для определенных этапов развития.
Таким образом, изучение механизмов биогенеза биомолекулярных конденсатов уже сейчас позволяет на новом уровне взглянуть на роль клеточных механизмов в регуляции онтогенетических процессов. Невероятная гибкость, обеспечиваемая основным механизмом формирования – разделением фаз на границе жидкость-жидкость – играет важную роль в обеспечение гибкости процессов эмбриогенеза.
Список литературы
Боголюбов Д.С. Безмембранные органеллы эукариотической клетки: основные понятия и принципы формирования // Цитология. 2019. Т. 61. С. 683–703.
Arias Escayola D, Neugebauer K.M. Dynamics and function of nuclear bodies during embryogenesis // Biochemistry. 2018. V. 57. P. 2462–2469.
Arkov A.L., Wang J-Y.S., Ramos A. et al. The role of Tudor domains in germline development and polar granule architecture // Development. 2006. V. 133. P. 4053–4062.
Aulas A, Fay M.M., Lyons S.M. et al. Stress-specific differences in assembly and composition of stress granules and related foci // J. Cell. Sci. 2017. V. 130. P. 927–937.
Banani S.F., Lee H.O., Hyman A.A. et al. Biomolecular condensates: organizers of cellular biochemistry // Nat. Rev. Mol. Cell Biol. 2017. V. 18. P. 285–298.
Banani S.F., Rice A.M., Peeples W.B. et al. Compositional control of phase-separated cellular bodies // Cell. 2016. V. 166. P. 651–663.
Bounedjah O., Hamon L., Savarin P. et al. Macromolecular crowding regulates assembly of mRNA stress granules after osmotic stress: new role for compatible osmolytes // J. Biol. Chem. 2012. V. 287. P. 2446–2458.
Brangwynne C.P., Eckmann C.R., Courson D.S. et al. Germline P granules are liquid droplets that localize by controlled dissolution/condensation // Science. 2009 V. 324. P. 1729–1732.
Breitwieser W., Markussen F.H., Horstmann H. et al. Oskar protein interaction with Vasa represents an essential step in polar granule assembly // Genes Dev. 1996. V. 10. P. 2179–2188.
Broyer R.M., Monfort E., Wilhelm J.E. Cup regulates oskar mRNA stability during oogenesis // Dev. Biol. 2017. V. 421. P. 77–85.
Buchan J.R., Parker R. Eukaryotic stress granules: the ins and outs of translation // Mol. Cell. 2009. V. 36. P. 932–941.
Buchan J.R., Yoon J.-H., Parker R. Stress-specific composition, assembly and kinetics of stress granules in Saccharomyces cerevisiae // J. Cell Sci. 2011. V. 124. P. 228–239.
Bullock S.L., Ish-Horowicz D. Conserved signals and machinery for RNA transport in Drosophila oogenesis and embryogenesis // Nature. 2001. V. 414. P. 611–616.
Carron C., Balor S., Delavoie F. et al. Post-mitotic dynamics of pre-nucleolar bodies is driven by pre-rRNA processing // J. Cell Sci. 2012. V. 125. P. 4532–4542.
Castagnetti S., Hentze M.W., Ephrussi A. Control of oskar mRNA translation by Bruno in a novel cell-free system from Drosophila ovaries // Development. 2000. V. 127. P. 1063–1068.
Chekulaeva M., Hentze M.W., Ephrussi A. Bruno acts as a dual repressor of oskar translation, promoting mRNA oligomerization and formation of silencing particles // Cell. 2006. V. 124. P. 521–533.
Chen J., Melton C., Suh N. et al. Genome-wide analysis of translation reveals a critical role for deleted in azoospermia-like (Dazl) at the oocyte-to-zygote transition // Genes Dev. 2011. V. 25. P. 755–766.
Chong P.A., Vernon R.M., Forman-Kay J.D. RGG/RG motif regions in RNA binding and phase separation // J. Mol. Biol. 2018. V. 430. P. 4650–4665.
Chujo T., Yamazaki T., Hirose T. Architectural RNAs (arcRNAs): a class of long noncoding RNAs that function as the scaffold of nuclear bodies // Biochim. Biophys. Acta. 2016. V. 1859. P. 139–146.
Corbet G.A., Parker R. RNP granule formation: lessons from p-bodies and stress granules // Cold Spring Harb. Symp. Quant. Biol. 2019. V. 84. P. 203–215.
Courchaine E.M., Lu A., Neugebauer K.M. Droplet organelles? // EMBO J. 2016. V. 35. P. 1603–1612.
Decker C.J., Parker R. P-bodies and stress granules: possible roles in the control of translation and mRNA degradation // Cold Spring Harb. Perspect. Biol. 2012. V. 4. № 9:a012286.
Eagle W.V.I., Yeboah-Kordieh D.K., Niepielko M.G. et al. Distinct cis-acting elements mediate targeting and clustering of Drosophila polar granule mRNAs // Development. 2018. V. 145. P. dev.164657.
Elbaum-Garfinkle S., Kim Y., Szczepaniak K. et al. The disordered P granule protein LAF-1 drives phase separation into droplets with tunable viscosity and dynamics // Proc. Natl. Acad. Sci. U. S. A. 2015. V. 112. P. 7189–7194.
Ephrussi A., Lehmann R. Induction of germ cell formation by oskar // Nature. 1992. V. 358. P. 387–392.
Falkenberg C.V., Carson J.H., Blinov M.L. Multivalent molecules as modulators of RNA granule size and composition // Biophys. J. 2017. V. 113. P. 235–245.
Fan S.-J., Marchand V., Ephrussi A. Drosophila Ge-1 promotes P body formation and oskar mRNA localization // PLoS One. 2011. V. 6. P. e20612.
Feric M., Vaidya N., Harmon T.S. et al. Coexisting liquid phases underlie nucleolar subcompartments. // Cell. 2016 V. 165. P. 1686–1697.
Forrest K.M., Gavis E.R. Live imaging of endogenous RNA reveals a diffusion and entrapment mechanism for nanos mRNA localization in Drosophila // Curr. Biol. 2003. V. 13. P. 1159–1168.
Frise E., Hammonds A.S., Celniker S.E. Systematic image-driven analysis of the spatial Drosophila embryonic expression landscape // Mol. Syst. Biol. 2010. V. 6. P. 345.
Gao M., Arkov A.L. Next generation organelles: structure and role of germ granules in the germline // Mol. Reprod. Dev. 2013. V. 80. P. 610–623.
Gavis E.R., Lehmann R. Localization of nanos RNA controls embryonic polarity // Cell. 1992. V. 71. P. 301–313.
Glotzer J.B., Saffrich R., Glotzer M. et al. Cytoplasmic flows localize injected oskar RNA in Drosophila oocytes // Curr. Biol. 1997. V. 7. P. 326–337.
Hachet O., Ephrussi A. Splicing of oskar RNA in the nucleus is coupled to its cytoplasmic localization // Nature. 2004. V. 428. P. 959–963.
Hanazawa M., Yonetani M., Sugimoto A. PGL proteins self associate and bind RNPs to mediate germ granule assembly in C. elegans // J. Cell. Biol. 2011. V. 192. P. 929–937.
Hayama R., Rout M.P., Fernandez-Martinez J. The nuclear pore complex core scaffold and permeability barrier: variations of a common theme // Curr. Opin. Cell. Biol. 2017. V. 46. P. 110–118.
Hird S.N., Paulsen J.E., Strome S. Segregation of germ granules in living Caenorhabditis elegans embryos: cell-type-specific mechanisms for cytoplasmic localisation // Development. 1996. V. 122. P. 1303–1312.
Hubstenberger A., Courel M., Bénard M. et al. P-body purification reveals the condensation of repressed mRNA regulons // Mol. Cell. 2017. V. 68. P. 144–157.e5.
Huelgas-Morales G., Silva-García C.G., Salinas L.S. et al. The stress granule RNA-binding protein TIAR-1 protects female germ cells from heat shock in Caenorhabditis elegans // G3. 2016. V. 6. P. 1031–1047.
Ivanov P., Kedersha N., Anderson P. Stress granules and processing bodies in translational control // Cold Spring Harb. Perspect. Biol. 2019. V. 11. P. a032813.
Jalihal A.P., Pitchiaya S., Xiao L.et al. Multivalent proteins rapidly and reversibly phase-separate upon osmotic cell volume change // Mol Cell. 2020. https://doi.org/10.1016/j.molcel.2020.08.004
Jud M.C., Czerwinski M.J., Wood M.P. et al. Large P body-like RNPs form in C. elegans oocytes in response to arrested ovulation, heat shock, osmotic stress, and anoxia and are regulated by the major sperm protein pathway // Dev. Biol. 2008. V. 318. P. 38–51.
Kato M., Han T.W., Xie S. et al. Cell-free formation of RNA granules: low complexity sequence domains form dynamic fibers within hydrogels // Cell. 2012. V. 149. P. 753–767.
Kedersha N., Stoecklin G., Ayodele M. et al. Stress granules and processing bodies are dynamically linked sites of mRNP remodeling // J. Cell. Biol. 2005. V. 169. P. 871–884.
Khong A., Matheny T., Jain S. et al. The stress granule transcriptome reveals principles of mRNA accumulation in stress granules // Mol. Cell. 2017. V. 68. P. 808–820.e5.
Kim B., Cooke H.J., Rhee K. DAZL is essential for stress granule formation implicated in germ cell survival upon heat stress // Development. 2012. V. 139. P. 568–578.
Kim G., Pai C.-I., Sato K. et al. Region-specific activation of oskar mRNA translation by inhibition of Bruno-mediated repression // PLoS Genet. 2015. V. 11. P. e1004992.
Kimura K, Kimura A. Cytoplasmic streaming drifts the polarity cue and enables posteriorization of the Caenorhabditis elegans zygote at the side opposite of sperm entry // Mol. Biol. Cell. 2020. V. 31. P. 1765–1773.
Kirino Y., Vourekas A., Kim N. et al. Arginine methylation of vasa protein is conserved across phyla // J. Biol. Chem. 2010a. V. 285. P. 8148–8154.
Kirino Y., Vourekas A., Sayed N. et al. Arginine methylation of Aubergine mediates Tudor binding and germ plasm localization // RNA. 2010b. V. 16. P. 70–78.
Kistler K.E., Trcek T., Hurd T.R. et al. Phase transitioned nuclear Oskar promotes cell division of Drosophila primordial germ cells // Elife. 2018. V. 7. P. e37949.
Knutson A.K, Egelhofer T., Rechtsteiner A. et al. Germ granules prevent accumulation of somatic transcripts in the adult Caenorhabditis elegans germline // Genetics. 2017. V. 206. P. 163–178.
Krishnakumar P., Riemer S., Perera R. et al. Functional equivalence of germ plasm organizers // PLoS Genet. 2018. V. 14. P. e1007696.
Lasko P. Patterning the Drosophila embryo: A paradigm for RNA-based developmental genetic regulation // Wiley Interdiscip. Rev. RNA. 2020. https://doi.org/10.1002/wrna.1610
Lee C.-Y.S., Putnam A., Lu T. et al. Recruitment of mRNAs to P granules by condensation with intrinsically-disordered proteins // Elife. 2020. V. 9. P. e52896.
Lehmann R., Nüsslein-Volhard C. Abdominal segmentation, pole cell formation, and embryonic polarity require the localized activity of oskar, a maternal gene in Drosophila // Cell. 1986. V. 47. P. 141–152.
Lin Y., Page D.C. Dazl deficiency leads to embryonic arrest of germ cell development in XY C57BL/6 mice // Dev. Biol. 2005. V. 288. P. 309–316.
Lin Y., Protter D.S.W., Rosen M.K. et al. Formation and maturation of phase-separated liquid droplets by RNA-binding proteins // Mol Cell. 2015. V. 60. P. 208–219.
Li P., Banjade S., Cheng H-C. et al. Phase transitions in the assembly of multivalent signalling proteins // Nature. 2012. V. 483. P. 336–340.
Liu H., Wang J.-Y.S., Huang Y. et al. Structural basis for methylarginine-dependent recognition of Aubergine by Tudor // Genes Dev. 2010. V. 24. P. 1876–1881.
Mahowald A.P. Fine structure of pole cells and polar granules in Drosophila melanogaster // J. Exp. Zool. 1962. V. 151. P. 201–215.
Mao Y.S., Sunwoo H., Zhang B. et al. Direct visualization of the co-transcriptional assembly of a nuclear body by noncoding RNAs // Nat. Cell Biol. 2011. V. 13. P. 95–101.
Markussen F.H., Michon A.M., Breitwieser W. et al. Translational control of oskar generates short OSK, the isoform that induces pole plasma assembly // Development. 1995. V. 121. P. 3723–3732.
Marnik E.A., Updike D.L. Membraneless organelles: P granules in Caenorhabditis elegans // Traffic. 2019. V. 20. P. 373–379.
Misteli T. The concept of self-organization in cellular architecture // J. Cell Biol. 2001. V. 155. P. 181–185.
Molliex A., Temirov J., Lee J et al. Phase separation by low complexity domains promotes stress granule assembly and drives pathological fibrillization // Cell. 2015. V. 163. P. 123–133.
Musinova Y.R., Lisitsyna O.M., Sorokin D.V. et al. RNA-dependent disassembly of nuclear bodies // J. Cell Sci. 2016. V. 129. P. 4509–4520.
Neil C.R., Jeschonek S.P., Cabral S.E. et al. L-bodies are novel RNA-protein condensates driving RNA transport in Xenopus oocytes // BioRxiv preprint 2020. https://doi.org/10.1101/2020.05.08.084814
Niepielko M.G., Eagle W.V.I., Gavis E.R. Stochastic seeding coupled with mRNA self-recruitment generates heterogeneous drosophila germ granules // Curr. Biol. 2018. V. 28. P. 1872–1881.e3.
Noble S.L., Allen B.L., Goh L.K. et al. Maternal mRNAs are regulated by diverse P body–related mRNP granules during early Caenorhabditis elegans development // J. Cell Biol. 2008. V. 182. P. 559–572.
Nott T.J., Petsalaki E., Farber P. et al. Phase transition of a disordered nuage protein generates environmentally responsive membraneless organelles // Mol. Cell. 2015. V. 57. P. 936–947.
Palangi F., Samuel S.M., Thompson I.R. et al. Effects of oxidative and thermal stresses on stress granule formation in human induced pluripotent stem cells // PLoS One. 2017. V. 12. P. e0182059.
Patterson J.R., Wood M.P., Schisa J.A. Assembly of RNP granules in stressed and aging oocytes requires nucleoporins and is coordinated with nuclear membrane blebbing // Dev. Biol. 2011. V. 353. P. 173–185.
Pitt J.N., Schisa J.A., Priess J.R. P granules in the germ cells of Caenorhabditis elegans adults are associated with clusters of nuclear pores and contain RNA // Dev. Biol. 2000. V. 219. P. 315–333.
Putnam A., Cassani M., Smith J. et al. A gel phase promotes condensation of liquid P granules in Caenorhabditis elegans embryos // Nat. Struct. Mol. Biol. 2019. V. 26. P. 220–226.
Rosario R., Crichton J.H., Stewart H.L. et al. Dazl determines primordial follicle formation through the translational regulation of Tex14 // FASEB J. 2019. V. 33. P. 14221–14233.
Sabari B.R, Dall’Agnese A., Young R.A. Biomolecular condensates in the nucleus // Trends Biochem. Sci. 2020. https://doi.org/10.1016/j.tibs.2020.06.007
Saha S., Weber C.A., Nousch M. et al. Polar positioning of phase-separated liquid compartments in cells regulated by an mRNA competition mechanism // Cell. 2016. V. 166. P. 1572–1584.e16.
Chouaib R., Safieddine A., Pichon X. et al. A dual protein-mRNA localization screen reveals compartmentalized translation and widespread co-translational RNA targeting // Dev. Cell. 2020. https://doi.org/10.1016/j.devcel.2020.07.010
Sampuda K.M., Riley M., Boyd L. Stress induced nuclear granules form in response to accumulation of misfolded proteins in Caenorhabditis elegans // BMC Cell Biol. 2017. V. 18. P. 18.
Schisa J.A. Germ cell responses to stress: the role of RNP granules // Front. Cell Dev. Biol. 2019. V. 7. P. 220.
Schisa J.A., Pitt J.N., Priess J.R. Analysis of RNA associated with P granules in germ cells of C. elegans adults // Development. 2001. V. 128. P. 1287–1298.
Seydoux G. The P granules of C. elegans: a genetic model for the study of RNA-protein condensates // J. Mol. Biol. 2018. V. 430. P. 4702–4710.
Shah K.H., Zhang B., Ramachandran V. et al. Processing body and stress granule assembly occur by independent and differentially regulated pathways in Saccharomyces cerevisiae // Genetics. 2013. V. 193. P. 109–123.
Sheth U., Pitt J., Dennis S. et al. Perinuclear P granules are the principal sites of mRNA export in adult C. elegans germ cells // Development. 2010. V. 137. P. 1305–1314.
Shevtsov S.P., Dundr M. Nucleation of nuclear bodies by RNA // Nat. Cell Biol. 2011. V. 13. P. 167–173.
Shin Y., Brangwynne C.P. Liquid phase condensation in cell physiology and disease // Science. 2017. V. 357. P. aaf4382.
Sinsimer K.S., Lee J.J., Thiberge S.Y. et al. Germ plasm anchoring is a dynamic state that requires persistent trafficking // Cell Rep. 2013 V. 5. P. 1169–1177.
Smith J., Calidas D., Schmidt H. et al. Spatial patterning of P granules by RNA-induced phase separation of the intrinsically-disordered protein MEG-3 // Elife. 2016. V. 5. P. e21337.
Thandapani P., O’Connor T.R., Bailey T.L. et al. Defining the RGG/RG motif // Mol. Cell. 2013. V. 50. P. 613–623.
Thomson T., Lasko P. Drosophila tudor is essential for polar granule assembly and pole cell specification, but not for posterior patterning // Genesis. 2004. V. 40. P. 164–170.
Tompa P. Intrinsically disordered proteins: a 10-year recap // Trends Biochem. Sci. 2012. V. 37. P. 509–516.
Trcek T., Douglas T.E., Grosch M. et al. Sequence-independent self-assembly of germ granule mRNAs into homotypic clusters // Mol. Cell 2020. V. 78. P. 941–950.e12.
Trcek T., Grosch M., York A. et al. Drosophila germ granules are structured and contain homotypic mRNA clusters // Nat. Commun. 2015. V. 6. P. 7962.
Trcek T., Lehmann R. Germ granules in Drosophila // Traffic. 2019. V. 20. P. 650–660.
Updike D.L., Strome S. A genomewide RNAi screen for genes that affect the stability, distribution and function of P granules in Caenorhabditis elegans // Genetics 2009 V. 183. P. 1397–419.
Vo H.D.L., Wahiduzzaman, Tindell S.J. et al. Protein components of ribonucleoprotein granules from Drosophila germ cells oligomerize and show distinct spatial organization during germline development // Sci. Rep. 2019. V. 9. P. 19190.
Voronina E., Seydoux G. The C. elegans homolog of nucleoporin Nup98 is required for the integrity and function of germline P granules // Development. 2010. V. 137. P. 1441–1450.
Voronina E., Seydoux G., Sassone-Corsi P. et al. RNA granules in germ cells // Cold Spring Harb. Perspect. Biol. 2011. V. 3. P. a002774.
Wan G., Fields B.D., Spracklin G. et al. Spatiotemporal regulation of liquid-like condensates in epigenetic inheritance // Nature. 2018. V. 557. P. 679–683.
Wang J.T., Smith J., Chen B.-C. et al. Regulation of RNA granule dynamics by phosphorylation of serine-rich, intrinsically disordered proteins in C. elegans // Elife. 2014. V. 3. P. e04591.
Yao R.-W., Xu G., Wang Y. et al. Nascent pre-rRNA sorting via phase separation drives the assembly of dense fibrillar components in the human nucleolus // Mol. Cell. 2019. V. 76. P. 767–783.e11.
Zatsepina O.V., Dudnic O.A., Chentsov Y.S. et al. Reassembly of functional nucleoli following in situ unraveling by low-ionic-strength treatment of cultured mammalian cells // Exp. Cell Res. 1997a. V. 233. P. 155–168.
Zatsepina O.V., Dudnic O.A., Todorov I.T. et al. Experimental induction of prenucleolar bodies (PNBs) in interphase cells: interphase PNBs show similar characteristics as those typically observed at telophase of mitosis in untreated cells // Chromosoma. 1997b. V. 105. P. 418–430.
Zilman A. Aggregation, phase separation and spatial morphologies of the assemblies of FG nucleoporins // J. Mol. Biol. 2018. V. 430. P. 4730–4740.
Дополнительные материалы отсутствуют.
Инструменты
Онтогенез


