Онтогенез, 2021, T. 52, № 6, стр. 485-504
Роль пуринергической сигнальной системы в контроле гистогенеза, гомеостаза и патогенеза сетчатки глаза позвоночных
Ю. В. Маркитантова a, *, В. Н. Симирский a, **
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: yuliya.mark@gmail.com
** E-mail: simir@mail.ru
Поступила в редакцию 27.06.2021
После доработки 26.07.2021
Принята к публикации 30.07.2021
Аннотация
Пуринергическая сигнальная система (ПСС) занимает особое место в регуляции клеточных процессов, поддержании гомеостаза сетчатки глаза позвоночных. В функционировании ПСС в сетчатке, помимо общих закономерностей, проявляются таксоноспецифические различия, генетически и метаболически обусловленные. Сигнальные каскады с участием компонентов ПСС могут выполнять в сетчатке двойственную роль: оказывая как повреждающее, так и защитное действие, что во многом определяется условиями клеточного микроокружения и молекулярного контекста. Выявление ключевых звеньев в работе ПСС, связывающих ее с другими эндогенными регуляторными системами, создает предпосылки для выбора клеточных и молекулярных мишеней для нейропротекции при патологиях сетчатки глаза у человека.
ВВЕДЕНИЕ
Пуринергическая сигнальная система (ПСС) вовлечена в регуляцию основных физиологических и патологических процессов в организме и находится в ряду приоритетных тематик биомедицины. Пурины являются триггерами и модуляторами клеточных процессов (пролиферации, дифференцировки, миграции, гибели клеток) и вовлечены в сигнальные пути нейротрансмиссии, поддержание гомеостаза нейральных тканей в эмбриогенезе и постнатальном периоде развития (Burnstock, Knight, 2004; Lin et al., 2006; Burnstock, Ulrich, 2011). За длительную историю исследований накоплен большой объем данных о разных аспектах участия компонентов ПСС в сетчатке глаза позвоночных (Sholl-Franco etal., 2010; Kur, Newman, 2013). В сетчатке ПСС играет важную роль в обеспечении взаимодействий между клетками пограничных тканей: фоторецепторами, ретинальным пигментным эпителием (РПЭ), клетками сосудов и глии, что является условием их функционирования (Mitchell, Reigada, 2008; Ventura et al., 2019). Взаимодействия перицитов эндотелия капилляров сетчатки и клеток РПЭ, мембраны Бруха, хориокапилляров, а также глии, обеспечивают целостность гематоретинального барьера и поддержание микросреды клеток сетчатки (Cunha-Vaz et al., 2011). ПСС играет существенную роль в этих процессах (Nagase et al., 2006). Взаимодействия между нейронами и клетками глии сетчатки, в контексте ПСС, при метаболических нарушениях, сопровождающихся нейродегенеративными процессами, отражены в ряде обзоров (Ward et al., 2010; Guzman-Aranguez et al., 2014; Sanderson et al., 2014; Reichenbach, Bringmann, 2016; Sinha et al., 2020a).
Ключевая роль в работе ПСС принадлежит аденозинтрифосфату (АТФ) и метаболитам, которые высвобождаются во внеклеточное пространство практически всеми клетками. РПЭ (Pearson et al., 2005), глия Мюллера, астроциты, амакриновые и ганглиозные нейроны (Vecino et al., 2016) служат источником АТФ, высвобождаемого под действием разных стимулов (свет, KCl-агонисты деполяризации клеток, глутамат, кальций) (Cunha-Vaz et al., 2011). Одна из основных функций АТФ сводится к пространственно-временной организации процессов эмбрионального развития (Dale, 2008; Burnstock, Ulrich, 2011). С помощью биосенсоров, высвобождение АТФ было зарегистрировано в клетках передней части нервной пластинки задолго до начала регионализации области формирования глаза в ходе эмбрионального развития шпорцевой лягушки. Выявлено участие компонентов ПСС – эктонуклеозидтрифосфат-дифосфогидролаз (ENTPD) – в конвертации АТФ в АДФ и АМФ, создании морфогенетических концентрационных градиентов, которые могут оказывать влияние на экспрессию регуляторных генов “глазного поля”. Это влияние осуществляется посредством специфического набора пуринорецепторов (Masse, Dale, 2012), которые, как известно, принадлежат к числу одних из первых мембранных рецепторов функционально активных в раннем эмбриогенезе (Schacher et al., 1997; Burnstock, 2007; Verkhratsky, Burnstock, 2014).
Представления о тканеспецифическом распределении и роли компонентов ПСС, их связи с другими сигнальными путями и генами-мишенями в нейральных тканях глаза в ходе онтогенеза позвоночных постоянно обогащаются. В настоящем обзоре обсуждается роль ПСС в регуляции пролиферации и дифференцировки клеток сетчатки глаза позвоночных, на базе анализа данных, полученных с использованием современных подходов, на модельных объектах in vivo и in vitro. Рассмотрены современные стратегии фармакологической нейропротекции, основанные на использовании компонентов ПСС, которые нашли применение при лечении патологий глаза, сопровождающихся нейродегенеративными процессами.
КРАТКИЕ СВЕДЕНИЯ О КЛЮЧЕВЫХ КОМПОНЕНТАХ ПУРИНЕРГИЧЕСКОЙ СИГНАЛЬНОЙ СИСТЕМЫ В СЕТЧАТКЕ
ПСС является частью более обширной системы, называемой пуриномом, которая объединяет множество белков, утилизирующих, связывающих и транспортирующих пурины (пуринорецепторы, G-белки, АТФазы, протеинкиназы, дегидрогеназы, эктонуклеотидазы, транспортеры), и кофакторы (Yegutkin, 2008; Sanderson et al., 2014; Giuliani et al., 2019). Пуриновые агонисты активируют трансмембранные пуринорецепторы, участвуя как в обеспечении быстрых реакций (нейротрансмиссия, нейромодуляция, секреция), так и длительных (трофических) клеточных процессов (пролиферация, дифференцировка, миграция, гибель клеток) в развитии и регенерации тканей (Abbracchio et al., 2009). В клетках большинства эукариот АТФ синтезируется в цитозоле посредством гликолиза, и в митохондриях путем окислительного фосфорилирования. В условиях in vivo АТФ быстро распадается в несколько этапов до аденозина и фосфатов, для которых существует механизм обратного захвата в нервную клетку (Zimmermann et al., 2012). АТФ и метаболиты (АДФ, АМФ, аденозин) высвобождаются во внеклеточное пространство с помощью АТФ-связывающих кассетных транспортеров (Quazi, Molday, 2014; Locher, 2016), через хемиканалы (коннексины, паннексины) (Baroja-Mazo et al., 2013), через хлоридные каналы чувствительные к изменениям объема клеток, посредством экзоцитоза лизосом, через пуринорецепторы (P2XR) (Lazarowski et al., 2011; Jung et al., 2014).
Пуриновые рецепторы. Известны два основных класса пуриновых рецепторов: аденозиновые Р1-рецепторы, универсальным агонистом которых является аденозин, и Р2-рецепторы, универсальным агонистом которых служит АТФ (для некоторых рецепторов – АДФ). Идентифицированы четыре подтипа P1-рецепторов к аденозину: A1R, A2AR, A2BR и A3R. A1R и A3R образуют комплексы с Gαi семейством G-белков, а A2AR и A2BR – с Gαs-белками, которые обеспечивают сопряжение этих рецепторов с аденилатциклазой. Р2-рецепторы включают два больших подсемейства: лиганд-оперирующие ионотропные рецепторы P2XR и метаботропные рецепторы P2YR, связанные с G-белком. Известны семь подтипов Р2Х-рецепторов (P2X1–7) и восемь подтипов P2Y-рецепторов (P2Y1, 2, 4, 6, 11–14). АТФ может действовать как через рецепторы P2XR, так и через рецепторы P2YR, в то время как аденозин проявляет селективность к метаботропным аденозиновым (АR) рецепторам (Jacobson, Muller, 2016).
Эктонуклеотидазы. Внеклеточные уровни АТФ и продуктов его гидролиза регулируются эктонуклеотидазами, которые являются важным звеном в пуринергических сигнальных каскадах (Zimmermann et al., 2012). Высвобождаемый из клеток АТФ последовательно дефосфорилируется в АДФ, АМФ и аденозин с помощью эктонуклеотидаз и экто-АТФаз, которые связаны с плазматической мембраной и характеризуются тканеспецифичностью экспрессии. Эктоэнзимы участвуют в создании градиента продуктов метаболизма АТФ, от их активности зависит метаболизм АТФ, регуляция пространственного распределения и связывание лигандов (АДФ, АМФ, аденозина) с соответствующими пуриновыми рецепторами (Burnstock, Knight, 2004; Alvarado-Castillo et al., 2005). В тканях глаза позвоночных идентифицированы четыре основных семейства эктонуклеотидаз: эктонуклеозидтрифосфатдифосфогидролазы (ENTPD, также известные как CD39), экто-5'-нуклеотидаза (eN или CD73), эктонуклеотидпирофосфатазы/фосфодиэстеразы (ENPPs) и щелочные фосфатазы (ALPs). Эктоэнзимы ENTPD 1, 2, 3 и пуринорецепторы P2XR, P2YR выявлены на самых ранних стадиях эмбриогенеза практически у всех позвоночных и вовлечены в формирование тканей-производных зародышевых листков (эктодермы, мезодермы, эндодермы) (Dale, 2008; Burnstock, Ulrich, 2011). Функции ENTPD 2 в тканях заднего сектора глаза связаны с поддержанием баланса аденозина, регуляцией гематоретинального барьера, пролиферацией клеток, обеспечением нормального функционирования глаза (Lu et al., 2015).
Нуклеотидные и нуклеозидные транспортеры. Адениновые нуклеотиды транспортируются в другие клеточные компартменты носителями митохондриальных АДФ/АТФ и АМФ/АТФ (Traba et al., 2011). Идентифицированы два типа транспортеров, которые переносят нуклеозиды через плазматическую мембрану клетки и мембраны клеточных органелл: концентрационные нуклеозидные транспортеры (CNT) (Na+-зависимые симпортеры) и равновесные нуклеозидные транспортеры (ENT) (Na+-независимые пассивные носители) (King et al., 2006; Akanuma et al., 2013).
Транспортеры ABC. АТФ-связывающие кассетные транспортеры (ABC) включают в себя суперсемейство белков, обнаруженных практически во всех живых организмах. Они состоят из четырех основных доменов: двух трансмембранных доменов (ТМД) и двух доменов, связывающих нуклеотиды (НСД) (Ahn, Molday, 2000). Эти транспортеры переносят, как правило, широкий спектр соединений через клеточные мембраны, используя гидролиз АТФ в качестве источника энергии. Субстраты, о которых известно, что они транспортируются различными транспортерами ABC, включают фосфолипиды, жирные кислоты, стероиды, органические анионы, ионы металлов, лекарственные препараты, аминокислоты, пептиды, витамины и другие соединения (Kim et al., 2008). ABC-транспортеры эукариот являются однонаправленными экспортерами, переносящими субстраты со стороны цитоплазмы на внеклеточную сторону плазматической мембраны или в просвет внутриклеточных мембран (Tsybovsky et al., 2010). ABC-транспортеры ответственны за обеспечивание гематоэнцефалического барьера, участвуя в механизме межклеточного транспорта субстратов, лекарственных препаратов, и способствуют поддержанию гомеостаза в нейральных тканях. В сетчатке млекопитающих в гиалоидных сосудах выявлены транспортеры P-gp/ABCB1, Mrp4/ABCC4 и Bcrp/ABCG2, участвующие в создании гематоретинального барьера, осуществляя перенос веществ из клеток эндотелия кровеносных сосудов и капилляров в клетки сетчатки (Tomi, Hosoya, 2010; Kubo et al., 2018). Экспериментальное моделирование гипоксической ретинопатии у мышей вызывает преретинальную неоваскуляризацию вокруг центральной, в норме бессосудистой, сетчатки, что связано с нарушением экспрессии ABCA транспортеров (Tagami et al., 2009). В другой работе выявлена роль ABCA4 в защите фоторецепторных клеток сетчатки от избыточного накопления и токсического влияния продукта метаболизма реакций зрительного цикла – 11-цис-ретиналя (Quazi, Molday, 2014).
Общий план строения сетчатки схож у всех позвоночных (рис. 1). В сетчатке позвоночных выделяют основные типы нейронов (фоторецепторы, биполярные, горизонтальные, амакриновые и гаглиозные клетки), формирующие ее радиальные слои, и четыре типа клеток глии: макроглия (глия Мюллера и астроциты), микроглия, а также олигодендроциты (локализованы преимущественно вдоль зрительного нерва). Тела нейронов формируют три ядерных слоя, которые разделены двумя сетчатыми (синаптическими) слоями волокон (аксоны и дендриты нейронов) (рис. 1). Наружный ядерный слой сетчатки представлен ядрами светочувствительных фоторецепторов – палочек и колбочек, наружные сегменты которых находятся в тесном контакте с клетками РПЭ, формирующими однорядный слой (Hoon et al., 2014; Tsukamoto, 2018).
Рис. 1.
Распределение основных подтипов пуринергических рецепторов в клетках сетчатки и РПЭ позвоночных. (Модифицировано по: Li F., et al., 2019; Markitantova, Simirskii, 2020.). Общий план организации сетчатки позвоночных: РПЭ – ретинальный пигментный эпителий; НЯС – наружный ядерный слой; ВЯС – внутренний ядерный слой; НСС – наружный сетчатый слой; ВСС – внутренний сетчатый слой; Гкл – слой ганглиозных клеток. 1 – фоторецепторы палочки (Фп), 2 – фоторецепторы колбочки (Фк), 3 – горизонтальные клетки (Г), 4 – палочковые биполяры (Бп), 5 – колбочковые биполяры (Бк), 6 – глия Мюллера (Мг), 7 – амакриновые клетки (А), 8 – микроглия (Мкг), 9 – ганглиозные клетки (Гкл), 10 – астроциты.
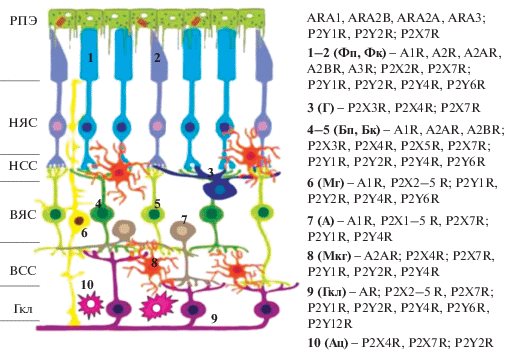
Мы проанализировали имеющиеся в литературе сведения по экспрессии ключевых компонентов ПСС – пуринорецепторов, выявленных на уровне мРНК и/или белка в клеточных типах сетчатки позвоночных с использованием различных методов (нозерн-блот; ОТ-ПЦР; гибридизация in situ, иммуногистохимия, вестерн-блот гибридизация, авторадиография/связывание лигандов, исследования физиологической и фармакологической активности). Пуринорецепторы в сетчатке позвоночных представлены семью подтипами трансмембранных лиганд-управляемых ионных каналов (P2XR), восемью подтипами G‑связанных рецепторов (P2YR), и характеризуются специфичным для клеток паттерном экспрессии (Jabs et al., 2000; Fries et al., 2004a, 2004b) (рис. 1). Ганглиозные клетки сетчатки экспрессируют все подтипы аденозиновых рецепторов AR, все подтипы рецепторов P2XR (за исключением P2X6R) (Puthussery, Fletcher, 2006; Guzman-Aranguez et al., 2014), большинство P2Y-рецепторов P2YR (P2Y1R, P2Y2R, P2Y4R, P2Y6R, P2Y12R) (deAlmeida-Pereira et al., 2018). В горизонтальных клетках выявлена экспрессия пуринорецепторов P2X3R, P2X4R, P2X7R (Ward et al., 2010); в амакриновых клетках – A1R; P2X1R, P2X2R, P2X3R, P2X4R, P2X5R, P2X7R; P2Y1R, P2Y4R (Puthussery, Fletcher, 2006; Ward et al., 2010; Pannicke et al., 2014). Биполяры экспрессируют: A1R; P2X3R, P2X4R, P2X5R, P2X7R; P2Y1R, P2Y2R, P2Y4R, P2Y6R (Wheeler-Schilling et al., 2001; Vessey, Fletcher, 2012). В биполярных нейронах всех 3 подтипов выявлена также экспрессия P2X2R, P2X3R и P2X7R, которые колокализуются с ГАМК (Puthussery, Fletcher, 2006; Jacobson, Muller, 2016). В фоторецепторах (палочки, колбочки) выявлена экспрессия A1R, A2R, A2AR, A2BR, A3R; P2X2R (Greenwood et al., 1997), P2X7R (Puthussery, Fletcher, 2006; Puthussery et al., 2006; Notomi et al., 2013), P2Y1R, P2Y2R, P2Y4R, P2Y6R (Pannicke et al., 2014). В сетчатых слоях сетчатки (наружный и внутренний) идентифицированы P2X7R (Puthussery, Fletcher, 2004); P2X1R, P2X2, P2X4R и P2X7R (Kaneda et al., 2004), P2Y2, P2Y4 (Sugioka et al., 1999). В клетках глии Мюллера обнаружена экспрессия пуринорецепторов A1R, A2AR, A2BR; P2X3R, P2X4R, P2X5R, P2X7R; P2Y1R, P2Y4R, P2Y6R (Bringmann et al., 2009; Brass et al., 2012). В микроглии экспрессируются A2AR; P2X4R, P2X7R; P2Y1R, P2Y2R, P2Y4R (Gu et al., 2012; Santiago et al., 2014; Ho et al., 2016); астроцитах – P2X4R, P2X7R; P2Y2R (Ho et al., 2016); олигодендроцитах – A3R (González-Fernández et al., 2014), P2X7 (Domercq et al., 2010), P2Y1 (Moran-Jimenez, Matute, 2000). В РПЭ выявлено большинство пуринорецепторов, принадлежащих всем трем подтипам: P1 – ARA1, ARA2B, ARA2A, ARA3 (Wan et al., 2011), P2: P2Y1, P2Y2 (Maminishkis et al., 2002; Pintor et al., 2004); P2X7 (Guha et al., 2013; Yang et al., 2014; Sanderson et al., 2016).
Следует отметить, что для идентификации мРНК пуринорецепторов и кодируемых ими белков, а также активности рецепторов использовались различные методы, что объясняет некоторые противоречия в данных. В частности, рецепторы P2X7R были обнаружены в биполярных клетках у крыс с помощью иммунофлуоресценции (Vessey, Fletcher, 2012), и не были обнаружены методом полимеразной цепной реакции (ПЦР) (Wheeler-Schilling et al., 2001). Напротив, рецепторы P2Y6R были обнаружены в этих клетках с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) (Fries et al., 2004b), но не детектировались с помощью иммунофлуоресценции. Иммунохимически рецепторы P2X7R выявлены в микроглии сетчатки обезьян (Gu et al., 2012), но не обнаружены в клетках микроглии у мышей (Franke et al., 2005). Рецепторы P2X2R не детектировались в фоторецепторных нейронах сетчатки крысы (Greenwood et al., 1997), а – P2Y1R, P2Y2R, P2Y4R, P2Y6R – в фоторецепторах кролика, крысы и макаки (Cowlen et al., 2003; Fries et al., 2004a; Pintor et al., 2004). Эти различия могут объясняться специфичностью использованных антител и праймеров для ПЦР, и/или различной чувствительностью методов. Другим объяснением может быть то, что, спектр пуринорецепторов и их изоформ, характер экспрессии в одноименном типе клеток может варьировать у разных видов животных.
РОЛЬ ПСС В ДИФФЕРЕНЦИРОВКЕ КЛЕТОК СЕТЧАТКИ И НЕЙРОТРАНСМИССИИ
В сетчатке позвоночных в процессе эмбриогенеза возникают многочисленные типы нейронов и глии, которые формируют упорядоченные слои сетчатки в строго координируемой последовательности. Порядок созревания основных клеточных типов сетчатки перекрывается на отдельных этапах гистогенеза и различается во времени у разных видов. Первыми из нейробластов появляются клетки ганглиозного слоя, затем колбочки фоторецепторов (их наружные сегменты появляются позже). За ними возникают амакриновые и горизонтальные клетки внутреннего ядерного слоя. Глия Мюллера и биполяры завершают дифференцировку позже, вслед за ними, как правило, завершают дифференцировку палочки фоторецепторов, ядра которых, вместе с ядрами колбочек фоторецепторов, образуют наружный ядерный слой сетчатки (Heavner, Pevny, 2012). Видовые различия гистогенеза сетчатки у разных позвоночных проявляются в специфичности подтипов клеток сетчатки, гетерохронности клеточных процессов гистогенеза, связанных с различной продолжительностью эмбрионального и постнатального развития (Schacher et al., 1997; Stacy, Wong, 2003), особенностями генетической и эпигенетической регуляции дифференцировки клеток сетчатки (Cvekl, Mitton, 2010). Так, у млекопитающих созревание нейронов сетчатки продолжается и в постнатальный период (Alvarez-Hernan et al., 2021).
Решающая роль в развитии РПЭ и сетчатки, уже со стадии разделения нейроэпителия глазного пузыря на проспективные РПЭ и нейральную часть сетчатки, принадлежит процессу запрограммированной клеточной гибели. Продуцируемые клетками сетчатки нейротрансмиттеры и нейромодуляторы разных классов вносят вклад в афферентный контроль апоптоза нейронов (Marc, 2003). Нарушения апоптоза на ранних стадиях формирования глаза мыши (стадия глазного бокала, Е10.5) коррелируют с нарушениями дифференцировки клеток сетчатки и процесса пигментации РПЭ (Pequignot et al., 2011). Для сетчатки позвоночных характерны три пика апоптоза: первый возникает до начала нейрогенеза, второй совпадает с пиком нейрогенеза, а третий – с периодом формирования синаптических связей и уточнения проекционных связей между нейронами. Нейротрансмиттеры, в том числе принадлежащие ПСС, в сетчатке выявляются уже во время первой волны апоптоза, затрагивающей ганглиозные клетки, задолго до экспрессии нейротрофинов. Вторая волна апоптоза затрагивает, в первую очередь, клетки внутреннего ядерного слоя сетчатки. Клетки сетчатки, подвергающиеся апоптозу в ранний период развития, оказывают влияние на постмитотические незрелые нейроны, которые мигрируют к месту окончательной локализации, где достигают терминальной дифференцировки. В развивающейся сетчатке нейротрансмиттеры разных классов, в кооперации с трофическими факторами, продуцируемыми клеточным микроокружением, участвуют в регуляции чувствительности клеток к гибели (Linden et al., 2005). Реакция клеток сетчатки на действие пуриновых нейротрансмиттеров, в частности, АТФ, была выявлена в раннем эмбриональном развитии. Доказано участие АТФ в регуляции числа нейронов сетчатки, экспрессирующих рецепторы к АТФ P2X-типа (Resta et al., 2007). Важным фактором в контроле гибели дифференцирующихся клеток РПЭ и сетчатки, в процессе ее формирования, служит не только концентрация нейротрансмиттеров, но и концентрация кислорода (Geiger et al., 2002). Жизнеспособность и гибель клеток сетчатки зависит от уровня экспрессии и активности белков, регулируемых редокс-системой, которая обеспечивает поддержание в клетке окислительно-восстановительного баланса в определенном физиологическом диапазоне (Markitantova, Simirskii, 2020а). Функциональные связи между формирующимися нейронами сетчатки складываются в ходе синаптогенеза, где определяющими становятся эндогенные факторы, и нейромедиаторы играют в этом процессе ведущую роль (Linden et al., 2005; Xu, Tian, 2008). В совокупности, весь набор нейромедиаторов, присущий определенному типу клеток, определяет характер взаимодействий между нейронами и их морфологические особенности. В клетках сетчатки существует несколько механизмов, которые обеспечивают формирование нейромедиаторной связи (Pearson et al., 2002). Сигнальные системы нейротрансмиттеров и нейромедиаторов, включающие АТФ, ацетилхолин, ГАМК (гамма-аминомасляную кислоту) и глутамат, начинают участвовать в контроле процессов пролиферации, дифференцировки и поддержания жизнеспособности клеток задолго до формирования синаптических связей, используя разнообразные механизмы высвобождения из клеток, путем как везикулярного, так и невезикулярного транспорта (Attwell et al., 1993; Voigt et al., 2015). В сетчатке позвоночных в эмбриогенезе отмечено высвобождение АТФ из клеток РПЭ (Pearson et al., 2005), глии Мюллера (Vecino et al., 2016). Действие пуриновых нейротрансмиттеров, главным образом, реализуется за счет активации одного из двух семейств мембраносвязанных рецепторов: ионотропных и метаботропных связанных с G-белком. АТФ, продуцируемый клетками РПЭ, способен паракринным образом активировать рецепторы P2-типа, локализованные на клеточной мембране нейронов сетчатки: фоторецепторов, амакриновых и ганглиозных клеток (Puthussery, Fletcher, 2006; Kaneda et al., 2008), клеток микроглии (Potucek et al., 2006).
В клетках-предшественниках формирующейся сетчатки высвобождение нейротрансмиттеров было отмечено до начала синаптогенеза, по механизму везикулярного транспорта, диффузии через плазматическую мембрану клетки, с использованием невезикулярных белков-транспортеров, а также обратного захвата, например, аденозина, фосфатов, ГАМК, глутамата (Zimmermann et al., 2012; Nascimento et al., 2013). Еще одним способом высвобождения нейротрансмиттеров, преобладающим в раннем эмбриогенезе, служит временное открытие механочувствительных хемиканалов коннексина, формирующих плотные щелевые межклеточные контакты и обеспечивающих транспорт биологически активных молекул и лигандов, в том числе АТФ, между цитоплазмой клетки и внеклеточным пространством (Bennett et al., 2012). Этот механизм используется для высвобождения АТФ в субретинальное пространство в дифференцирующихся клетках РПЭ, контактирующих с клетками-предшественниками сетчатки, что стимулирует их пролиферацию (Massey et al., 2003), а также в астроцитах сетчатки мыши, in vivo (Xia et al., 2012; Beckel et al., 2016).
Ионотропные пуринорецепторы и рецепторы к глутамату в клетках сетчатки преимущественно вовлечены в механизмы быстрой синаптической передачи межклеточных сигналов. В основе функционирования сетчатки лежат процессы метаболизма НАДН, необходимого для производства АТФ и синтеза нейромедиаторов – глутамата и ГАМК, тогда как метаболизм РПЭ и сосудистой оболочки базируется на использовании НАДФН и ацетил-КоА (Sinha et al., 2020a). Клетки нейральной сетчатки потребляют глюкозу, никотинамид, аспартат, глутамат, цитрат и другие компоненты для поддержания активного гликолиза, митохондриального окислительного метаболизма и синтеза нейротрансмиттеров. РПЭ является основным источником аспартата и глутамата для нейральной сетчатки. Различия в потреблении продуктов метаболизма нейральной сетчаткой и РПЭ/сосудистой оболочкой подчеркивают важность поддержания метаболического обмена между этими пограничными тканями (Swarup et al., 2019).
Один из известных механизмов действия нейротрансмиттеров на ранних этапах эмбриогенеза позвоночных в модуляции процессов миграции, пролиферации, дифференцировки клеток, реализуется за счет использования вторичных мессенджеров. В формирующейся, как и зрелой сетчатке, нейротрансмиттеры могут действовать как по Ca2+-независимому механизму, так и по Ca2+-зависимому механизму, вызывая изменения уровня внутриклеточного Ca2+ и модулируя активность ферментных систем (Xia et al., 2012; Beckel et al., 2016). Следует отметить, что ATФ участвует в кооперации с ацетилхолином в регуляции потока ионов Ca2+ в дифференцированных клетках взрослой ткани сетчатки, что необходимо для обеспечения ее физиологических функций (Wu et al., 2003; Wehrwein et al., 2004). В работе Канеды (Kaneda et al., 2004) было показано, что внеклеточный АТФ ингибирует высвобождение ацетилхолина холинергическими нейронами сетчатки. C использованием методов иммунохимии, было изучено распределение пуриноцепторов P2X1R, P2X2R, P2X4R и P2X7R, по отношению к холинацетилтрансферазе в сетчатке у мышей дикого типа и трансгенных мышей, экспрессирующих зеленый флуоресцентный белок-репортер (GFP). Оказалось, что селективное удаление холинергических амакриновых клеток внутреннего ядерного слоя сетчатки у трансгенных мышей приводило к возрастанию иммунореактивности P2X2R в наружном сетчатом слое, на фоне понижения таковой во внутреннем сетчатом слое сетчатки. Поскольку распределение белков P2X1R, P2X4R и P2X7R в синаптических слоях сетчатки отличалось от распределения холинацетилтрансферазы, было высказано предположение о том, что избирательная экспрессия пуриноцепторов P2X2 может быть ответственна за селективное высвобождение ацетилхолина (Kaneda et al., 2004).
Различия функционально-морфологической организации сетчатки позвоночных, при сходстве основных компонентов ПСС, нейромедиаторов и консервативного регуляторного генного каскада, тесно связаны с физиологическими адаптационными особенностями путей передачи зрительного сигнала между нейронами. К примеру, в сетчатке низших позвоночных (амфибии, рептилии, рыбы) в отличие от млекопитающих, палочковые биполяры связаны напрямую с ганглиозными клетками (Schacher et al., 1997; Voelgyi et al., 2004).
УЧАСТИЕ ПСС В КОНТРОЛЕ ПРОЛИФЕРАЦИИ КЛЕТОК-ПРЕДШЕСТВЕННИКОВ СЕТЧАТКИ
Ранний период нейрогенеза в сетчатке позвоночных характеризуется усиленной пролиферацией клеток-предшественников, продуцирующих все типы нейронов и глии сетчатки, и осуществляется под контролем индуктивных или ингибирующих сигнальных путей, в которых задействованы нейромедиаторы разных классов (Prada et al., 1991; Ohnuma, Harris, 2003; Martins, Pearson, 2008). Популяция незрелых нейронов эмбриональной сетчатки является одним из основных источников пуринергических нейромедиаторов и нейротрансмиттеров (Wheeler-Schilling et al., 2001; Pearson et al., 2005). Известна функция АТФ как митогена в формирующейся сетчатке (Sholl-Franco et al., 2010), которая реализуется благодаря присущей всем нейротрансмиттерам способности модулировать потоки ионов Ca2+ через мембраны клеток. Изменения внутриклеточной концентрации ионов Ca2+регулируют успешное прохождение пролиферирующими клетками через все этапы клеточного цикла, включая переход из G1 в S-фазу, все ключевые фазы митоза, переход из метафазы в анафазу и индукцию цитокинеза (Arredouani et al., 2010). Волнообразное возрастание транспорта ионов Ca2+ наблюдается во время пика нейрогенеза, и, главным образом, приурочено к процессу формирования межклеточных синаптических связей между дифференцирующимися клетками сетчатки (Pearson et al., 2002). Процессы транспорта ионов Ca2+, характеризуемые определенной частотой, амплитудой и продолжительностью, также оказывают влияние на синтез нейротрансмиттеров, экспрессию специфических рецепторов в созревающих нейронах, скорость роста их нейритов (Rosenberg, Spitzer, 2011).
Разнообразие эффектов действия пуринергических нейротрансмиттеров во многом объясняется активацией тканеспецифического набора рецепторов из семейств мембрано-связанных ионотропных и метаботропных пуринорецепторов P2-типа. С использованием методов радиоавтографии и иммунохимии были получены данные об участии Р2-пуринорецепторов в регуляции синтеза ДНК в сетчатке позвоночных в эмбриогенезе (Sugioka et al., 1999). Связывание АТФ с метаботропными рецепторами приводит к активации G-белка, который в зависимости от его типа запускает работу одной из нескольких эффекторных систем: фосфолипазы C, инозитол-1,4,5-трифосфата (IP3), аденилатциклазы или цАМФ. Активация рецепторов P2YR и P2XR, в ответ на действие нуклеотидов, приводит к мобилизации из внутриклеточных депо ионов Ca2+, продукции инозитол-1,4,5-трифосфата, фосфолипазы А2, возрастанию активности аденилатциклазы и киназ PLC, PKC, MAPK (Potucek et al., 2006; Nunes et al., 2007). АТФ-индуцируемая пролиферация в клетках-предшественниках нейронов сетчатки связана с активацией вторичного мессенджера IP3 и MAPK каскада. Активация P2YR агонистами АТФ и УТФ вызывает образование фосфоинозитидов (Sanches et al., 2002) и мобилизацию внутриклеточного кальция в клетках сетчатки эмбрионов кур (Sugioka et al., 1996). На этом же объекте показано, что ингибирование сигнального пути PI3K/Akt приводит к нарушению продвижения клеток-предшественников сетчатки через G2/M фазы клеточного цикла (Ornelas et al., 2013).
В отличие от связанных с G-белком рецепторов P2YR, лиганд-активируемые ионотропные рецепторы P2XR стимулируют быстрый приток ионов Ca2+ и Na+ и отток ионов K+. Это приводит к деполяризации плазматической мембраны и значительному увеличению концентрации ионов Ca2+ в цитозоле. Очевидно, что резкое изменение внутриклеточного гомеостаза ионов служит причиной активации нескольких вторичных мессенджеров и ферментативных каскадов, которые задействованы в стимуляции MAPK (Potucek et al., 2006). Сигнальные пути, с участием нуклеотидов, контролируют продвижение клеток по клеточному циклу и ассоциированы с интеркинетической ядерной миграцией в слое нейробластов сетчатки (Lin et al., 2006). В сетчатке деление клетки происходит во внешней апикальной области нейробласта, в то время как синтез ДНК – в его внутренней, базальной области (Dyer, Cepko, 2001). Ранее было высказано предположение о том, что нейротрансмиттеры могут модулировать пространственно-временные процессы внутриклеточного транспорта ионов Ca2+ в ходе интеркинетической ядерной миграции в нейробластах, что нашло подтверждение на модели эмбриональной сетчатки кур. Действие экзогенного АТФ или агониста УТФ, посредством рецепторов P2Y2R, оказалось достаточным для инициации входа ранних клеток-предшественников сетчатки (ганглиозных, амакриновых, горизонтальных, фоторецепторов) в S-фазу клеточного цикла (Pearson et al., 2005). На более поздней стадии развития сетчатки активация P2Y1R, под воздействием АТФ, способствовала инициации пролиферации биполяров и глии Мюллера. Регуляторные факторы, продуцируемые ранними постмитотическими нейронами, вызывали остановку поздних нейронов сетчатки в фазе митоза, чему сопутствовала агонист-зависимая десенсибилизация рецепторов P2R (Franca et al., 2007). В сетчатке цыпленка, на 7–8-е сут эмбрионального развития, более 75% клеток представлены популяцией вышедших из митоза клеток-предшественников ганглиозных, горизонтальных, амакриновых клеток и фоторецепторов. На 10–11-е сут эмбриогенеза большинство клеток-предшественников глии Мюллера и биполяров выходят из митоза (Prada et al., 1991). В другой работе показано, что снижение ответа клеток сетчатки на действие АТФ корреллировало с падением их пролиферативной активности, на завершающих стадиях ретиногенеза (Franca et al., 2007).
В сетчатке мыши действие эндогенного АТФ, через рецепторы P2Y1R, стимулирует вход клеток-предшественников в цикл пролиферации, в результате увеличения уровня экспрессии циклина D1 и снижения экспрессии p27kip1. В пролиферирующих нейробластах сетчатки, после действия АТФ, была выявлена корреляция между увеличением числа BrdU-позитивных клеток и возрастанием интенсивности включения другого маркера синтеза ДНК – H3-тимидина. Влияние экзогенного АТФ проявлялось в увеличении числа PCNA- и BrdU-позитивных клеток, возрастании уровня экспрессии циклина D1 и фосфорилированного гистона Н3 и снижении уровня экспрессии p27kip1, в нейробластах через 24 и 48 ч культивирования эксплантатов. АДФ, как и АТФ, также способен индуцировать синтез ДНК, через сигнальный путь, опосредованный рецепторами P2Y1R (Sholl-Franco et al., 2010). Выявлена роль АДФ как паракринного сигнала в индукции входа клеток цилиарно-маргинальной зоны (ЦМЗ) в S‑фазу клеточного цикла в сетчатке низших позвоночных (Pearson et al., 2005; Ricatti et al., 2011). Пролиферативная активность клеток ЦМЗ у представителей низших позвоночных (амфибий и некоторых видов рыб) поддерживает постоянный рост сетчатки в течение всего онтогенеза (Миташов, 1969; Perron et al., 1998; Raymond et al., 2006). Снижение уровня внеклеточного АДФ, а также блокирование рецепторов P2Y1R приводило к уменьшению числа клеток ЦМЗ сетчатки, проходящих S-фазу клеточного цикла (Franca et al., 2007). Поддержание определенной концентрации внеклеточных нуклеотидов в ростовой ЦМЗ сетчатки рыб происходит за счет гидролиза АТФ эктонуклеотидазами, что является условием успешной пролиферации клеток в этой зоне (Ricatti et al., 2011).
РОЛЬ ПСС В ГОМЕОСТАЗЕ И РАЗВИТИИ ПАТОЛОГИИ В СЕТЧАТКЕ
Стабильное функционирование зрелой сетчатки взрослых животных достигается за счет сложной сети взаимодействий эндогенных регуляторных систем, что обеспечивает клеточный и метаболический гомеостаз в сетчатке (Sinha et al., 2020a, 2020b; Ramachandra, Fliesler, 2021). В норме баланс метаболитов и сигнальных молекул (в частности, компонентов ПСС), постоянно поддерживается и восстанавливается в результате взаимодействия клеток нейральной сетчатки с пограничными тканями (Sinha et al., 2020b). ПСС вовлечена в диалог между нейронами и глией сетчатки в онтогенезе позвоночных. Передача пуринергических сигналов через рецепторы P2Y1R-типа, которые экспрессируются в глии и нейронах сетчатки, обеспечивает поддержание жизнеспособности фоторецепторов, а при ишемии сетчатки вовлечена в процесс гибели холинергических амакриновых клеток, в результате увеличения цитотоксического влияния кальция (Ward et al., 2010). Делеция генов пуринорецепторов P2Y1R приводит к повышенной выживаемости амакриновых клеток, и, в то же время, выраженной гибели фоторецепторов у мышей и крыс (Wurm et al., 2009; Pannicke et al., 2014). В сетчатке рыбок Danio rerio, у которых клетки глии являются источником для восстановления нейронов (Raymond et al., 2006), активация пуринорецепторов P2Y1R под действием АТФ играет защитную роль для внутренних нейронов сетчатки после цитотоксического повреждения (Battista et al., 2009).
В нейронах сетчатки пурины вносят вклад в сигнальную передачу быстрых возбуждающих нейронально-глиальных импульсов, осуществляют нейромодулирующий эффект, посредством рецепторов: P2X7R – в палочках фоторецепторов (Puthussery et al., 2006), P2X2R – колбочках, амакриновых и ганглиозных клетках (Puthussery, Fletcher, 2006; Kaneda et al., 2008). Благодаря активации рецепторов P2Y1R и P2Y2R нейроны сетчатки реагируют на действие внеклеточного АТФ повышением содержания внутриклеточного кальция (Newman, 2006), осуществляется абсорбция избытка жидкости во внеклеточном пространстве, необходимая для поддержания гомеостаза РПЭ и пограничных с ним тканей – фоторецепторов сетчатки и сосудистой оболочки (Maminishkis et al., 2002). Специфический набор пуринорецепторов на поверхности глии Мюллера взаимодействует с АТФ и продуктами его метаболизма АДФ и АМФ, высвобождаемыми его нейронами сетчатки. Пуринорецепторы P2Y1R и AR являются основными в обеспечивании поддержания объема клеток глии Мюллера (Metea, Newman, 2006).
Длительное нарушение гомеостаза, вызванное наследственными факторами, повреждением РПЭ и сетчатки, факторами стресса, в большинстве случаев необратимо и приводит к патологическим процессам (апоптоз, воспаление) а, в конечном итоге, к гибели тех или иных клеток сетчатки и потере зрения (Markitantova, Simirskii, 2020b; Pîrvu et al., 2021; Zhang et al., 2021).
Дегенеративные заболевания сетчатки характеризуются избыточным уровнем внеклеточного АТФ, что способствует инициации апоптоза клеток РПЭ, фоторецепторов, ганглиозных клеток (Notomi et al., 2013). При гибели фоторецепторов наружного ядерного слоя у млекопитающих в сетчатке происходят негативные изменения, связанные с отмиранием нейронов в других слоях сетчатки, гипертрофией глии Мюллера, нарушением послойной организации выживших нейронов. Процессы массовой гибели нейронов сетчатки сопровождаются формированием новых хаотических синаптических связей, так называемых микронейром, неспособных поддерживать нормальный процесс передачи зрительных сигналов, что приводит к ухудшению зрения (Marc, 2003). Если на ранней стадии удается затормозить процесс гибели нейронов сетчатки, то на поздних стадиях эти процессы приобретают необратимый характер.
В условиях патологии клетки глии сетчатки млекопитающих продуцируют избыточное количество АТФ во внеклеточное пространство, с помощью экзоцитоза, в ответ на осмотическую или механическую стимуляцию, например, при отслойке сетчатки, локальной травме или повреждении светом (Uckermann et al., 2006; Vecino et al., 2016). Избыточная продукция клетками АТФ во внеклеточное пространство служит эндогенным “сигналом опасности” при окислительном и осмотическом стрессе, воспалении, нарушениях метаболизма, гипоксии, ишемии, повреждении зрительного нерва (Uckermann et al., 2006; Notomi et al., 2013). В зоне повреждения ткани сетчатки запускается каскад защитных реакций, медиаторами которых выступают ионы Ca2+, АТФ и активные формы кислорода (АФК), высвобождающиеся из гибнущих клеток в межклеточное пространство. Пуринергические сигналы, под действием избытка АТФ, в которых задействованы рецепторы P2X7R, являются центральным звеном в индукции гибели РПЭ, нейронов сетчатки, клеток сосудов при возрастной макулярной дегенерации сетчатки (ВМД), диабетической ретинопатии, пигментном ретините, глаукоме (Puthussery, Fletcher, 2006; Fowler et al., 2014). Ранние молекулярные события глиоза, связанные с выбросом АТФ, стимулируют возрастание уровня перекиси водорода, оксида азота (NO), возрастанию концентрации Р2-опосредованного внутриклеточного Ca2+ и гиперактивации P2X7R. Описанные реакции служат сигналом, инициирующим процессы эндогенной защиты и репарации сетчатки. Общим для всех этих моделей является метаболический стресс, при котором происходит выброс АТФ, стимулирующий клеточную нейротоксичность, опосредованную рецепторами Р2Х7R (Mitchell, 2001; Reichenbach, Bringmann, 2016). Рецепторы P2X7R представляют собой катионные каналы, активируемые высокими концентрациями АТФ. При длительной активации эти каналы объединяются с мембранными белками, образуя широкие поры, что и приводит к увеличению высвобождения АТФ во внеклеточную среду и гибели клеток (Andrejew et al., 2020). Высокая концентрация внеклеточного АТФ является пусковым звеном в механизмах гибели перицитов микроциркуляторного русла и снижению кровотока в сосудах сетчатки, опосредованных активацией P2X7R. Развивающийся при ВМД (возрастная макулярная дистрофия сетчатки) метаболический стресс, связанный со снижением продукции NO клетками эндотелия сосудов сетчатки, вызывает деполяризацию клеток, летальный для клеток приток кальция через потенциал-управляемые кальциевые каналы, дегенерацию клеток микроциркуляторного русла. Показано, что NO в микрососудах сетчатки участвует в подавлении избыточной патологической активности кальциевых каналов в результате активации рецепторов P2Y4R, что предотвращает образование пор рецепторами P2X7R и усиленное высвобождение АТФ во внеклеточную среду (Bhutto et al., 2010; Sugiyama et al., 2010).
Критическим событием в инициации гибели клеток РПЭ и клеток сетчатки является длительная перегрузка цитозоля и митохондрий ионами Ca2+, вследствие избыточной активности ионотропных рецепторов к глутамату и пуринам, потенциал-управляемых кальциевых каналов (Bringmann et al., 2009). В развитие цитотоксической перегрузки кальцием в клетках РПЭ, как и в нейральной сетчатке, вносит вклад гиперстимуляция рецепторов P2XR, которые служат непосредственными проводниками кальция, и вызывая деполяризацию клеточных мембран, стимулируют активность потенциал-управляемых кальциевых каналов. Так, активация P2X7R в клетках РПЭ при ВМД вызывает подщелачивание лизосом и нарушает их функции, что приводит к повышенному окислению липидов, накоплению избыточного количества липофусцина в наружных сегментах фоторецепторов, подвергающихся фагоцитозу, возникновению акумулирующих липопротеины друз, характерных для РПЭ при патологиях (Guha et al., 2013). Важным звеном в механизмах гибели клеток РПЭ, при хориоидальной форме ВМД, географической атрофии (возрастной дегенерации желтого пятна) является P2X7R-опосредованная активация инфламмасом NLRP3 и каспаз, на фоне возрастания продукции АФК (Tarallo et al., 2012; Fowler et al., 2014).
Данные, полученные на моделях метаболического стресса, при повреждении зрительного нерва in vivo и моделировании экспериментальной ишемии сетчатки человека в эксплантатах ткани в системе in vitro, показали, что рецепторы P2X7R вовлечены в механизмы гибели ганглиозных клеток (Zhang et al., 2006; Niyadurupola et al., 2013; Sugiyama, 2014). Кратковременная стимуляция P2X7R вызывает повышение уровня кальция, а их длительная стимуляция приводит к гибели ганглиозных клеток через активацию потенциал-управляемых кальциевых каналов, поддерживающих повышенный уровень свободного кальция в цитозоле, что инициирует активность каспаз (Hu et al., 2010; Pannicke et al., 2014). Гибель микроглии, вызванная длительной стимуляцией P2X7R, также опосредована активностью каспаз 1, 3 и 8 (Ferrari et al., 2006; DiVirgilio et al., 2017). Высвобождаемые из микроглии мыши АТФ и метаболиты индуцируют фосфорилирование CREB, экспрессию цАМФ (Ghosh et al., 2015). Активация рецепторов P2Y1R и P2X7R в микроглии ведет к повышению экспрессии фосфолипаз A2 и D, усилению фосфорилирования тирозина, запуску MAPK-каскада, синтезу провоспалительных цитокинов, факторов регуляции транскрипции NF-kB, CREB и AP-1 (Potucek et al., 2006; Ventura et al., 2019). Перечисленные факторы транскрипции запускают экспрессию генов воспалительного ответа – индуцибельной синтазы NO iNOS и COX-2 (Ghosh et al., 2015). В частности, индуцибельная синтаза iNOS, продуцируемая в ганглиозных клетках и клетках внутреннего ядерного слоя сетчатки (амакриновые и горизонтальные клетки), с участием цГМФ, задействована в сигнальных путях, которые запускают гибель ганглиозных и фоторецепторных клеток сетчатки. Эти же компоненты сигнальных путей задействованы в механизмах защиты от гибели недифференцированных постмитотических нейронов сетчатки (Sinha et al., 2020a). Модели in vivo ишемической пролиферативной ретинопатии мыши, после нокаута iNOS или после действия ингибитора 1400W, показали, что роль iNOS состоит в локальной индукции апоптоза в бессосудистом внутреннем ядерном слое сетчатки. Возрастание уровня экспрессии iNOS в бессосудистой части сетчатки при пролиферативной ретинопатии in vivo является пусковым механизмом в развитии неоваскулярных и дегенеративных заболеваний сетчатки человека при гипоксии, поэтому iNOS рассматривается в качестве фармакологической мишени для улучшения кровоснабжения сетчатки и ее защиты от дегенерации (Sennlaub et al., 2002).
Показано, что активация рецепторов P2YR и факторов роста, в ответ на действие АТФ, вовлечены в патогенез ВМД и диабетической ретинопатии (Mishra et al., 2006; Yang, Chen, 2014). Возрастание активности пуринорецепторов типа P2YR вызывает быстрый выброс кальция из внутренних депо клеток, за которым следует более устойчивый длительный приток кальция, высокие концентрации которого токсичны для клетки (Hu et al., 2010; Pannicke et al., 2014). Отмечена вовлеченность рецепторов образующегося при гидролизе АТФ аденозина – A2AR, A2BR, A3R в передачу сигналов, провоцирующих развитие неоваскуляризации сетчатки человека при ВМД (Liu et al., 2010; Zhang et al., 2015). При этом, действие аденозина на AR3 рецепторы обладает противоположным эффектом, останавливая возрастание внутриклеточной концентрации кальция (Zhang et al., 2006).
Общим свойством в дегенерации сетчатки при патологиях глаза, таких как ВМД, диабетическая ретинопатия, пролиферативная витреоретинопатия, глаукома, является активация микроглии (Vecino et al., 2015), в регуляции которой участвуют нейроны, астроциты, макроглия Мюллера, а также Т-клетки (Sanderson et al., 2014; Madelung et al., 2015). Глия сетчатки первой реагирует на повышение внутриглазного давления при глаукоме, характеризующейся прогрессирующей дегенерацией сетчатки (Seitz et al., 2013). Переход глии Мюллера и микроглии к реактивному фенотипу, при гипоксии сетчатки, инициирует сигнальные каскады, которые не только участвуют в контроле гибели нейронов сетчатки, но также выполняют функцию нейропротекции (Ghosh et al., 2015). При этом активация пуринорецепторов P2Y1R также может проявлять двойственный эффект: c одной стороны – усиливать пролиферацию и гипертрофию клеток Мюллера и астроцитов, а с другой – снижать апоптотическую гибель клеток сетчатки, индуцируемую гипоксией (Wang, Harris, 2005; Pannicke et al., 2014). Нейропротекторная роль глии Мюллера связана с гомеостатической сигнальной сетью, в которую встроены разные типы глии сетчатки, обеспечивающие поддержание или восстановление функции фоторецепторов и ганглиозных нейронов сетчатки в норме и при нарушениях гомеостаза (Vecino et al., 2016). При глаукоме нейропротекторный эффект глии Мюллера на ганглиозные клетки сетчатки состоит в их защите от дальнейшего повреждения за счет продукции нейротрофических факторов, антиоксидантов и нейротрансмиттеров, а микроглии – в макрофагальной активности и секреции факторов роста (Seitz et al., 2013; Liu et al., 2019). Кроме того, глия Мюллера является латентным прогенитором для восстановления утраченных нейронов сетчатки, а клетки микроглии и астроциты предположительно участвуют в упрощении (редуцировании) межклеточных синаптических связей (Vecino et al., 2016).
Очевидно, что физиологически защитная роль пуринергической стимуляции в клетках сетчатки зависит от баланса между компонентами про-дегенеративных и анти-дегенеративных путей передачи сигнала. Для поддержания необходимого количества дифференцирующихся клеток сетчатки в развитии и для обеспечения физиологических функций клеток в зрелой сетчатке важен баланс между уровнем нейротрансмиттеров и продуктов их метаболизма, а также трофических (BDNF, FGF, NO и др.) и апоптотических факторов (NGF, TGF и др.) (Kimura et al., 2016). Патологические изменения, затрагивающие сетчатку, прогрессируют достаточно быстро. Ввиду неоднозначного ответа глии на стресс, исследование механизмов участия ПСС в активации клеток Мюллера и астроцитов приобретает первостепенное значение для разработки стратегий, направленных на “спасение” нейронов сетчатки (Ventura et al., 2019). С одной стороны, эти исследования тесно связаны с изучением клеточных источников – резервов для восстановления и поддержания гомеостаза сетчатки (Ricatti et al., 2011; Illes, Rubini, 2017; Singh et al., 2018), с другой – c поиском эффективных молекулярных мишеней в терапии нейродегенеративных заболеваний (Burnstock, Ulrich, 2011; Illes, Rubini, 2017).
ПРИМЕНЕНИЕ КОМПОНЕНТОВ ПСС В НЕЙРОПРОТЕКЦИИ
Наиболее эффективными в терапии патологий, затрагивающих сетчатку и РПЭ, и функционирование глаза в целом, являются стратегии нейропротекции, направленные на восстановление гомеостаза сетчатки, как клеточного, так и метаболического (рис. 2). Фармакологические методы предусматривают уменьшение степени воспаления в сетчатке глаза за счет блокирования избыточной активности микроглии и снижения реактивного глиоза (Bringmann et al., 2009). В основе развития биомедицинских подходов к сетчатке лежат достижения клеточных и геномных технологий, разрабатываемых на животных моделях in vivo, культурах и системах in vitro-like-in vivo (Grigoryan et al., 2012; Capowski et al., 2019; Dopper et al., 2020). Ряд методов терапии нейродегенеративных заболеваний сетчатки глаза человека основан на использовании молекулярных компонентов ПСС и подконтрольных сигнальных каскадов, в качестве мишеней действия фармакологических препаратов (Fowler et al., 2014). При этом большая часть исследований сосредоточена вокруг выяснения роли пуринорецепторов в механизмах нейродегенерации, поиска селективных агонистов и блокаторов, клеточных и молекулярных мишеней (Eltzschig et al., 2012; MacNair et al., 2016; Boia et al., 2020). Для изучения роли регуляторных сигнальных путей в клетках сетчатки, тестирования лекарственных препаратов, используются имитирующие ткань in vivo системы – органоиды, в которых обнаружены метаболические характеристики клеток сетчатки: экспрессия компонентов ППС, нейротрансмиттеров, транспортеров, ферментов, ответственных за метаболизм аспартата и глутамата (Browne et al., 2017). Однако, ограничения данного подхода, связанные с нарушениями взаимодействий между пограничными тканями, проявляются в неполной клеточной организации сетчатки (отсутствие ганглиозного слоя, нарушения синаптогенеза и васкулогенеза), что затрудняет моделирование молекулярных и метаболических процессов, свойственных этой ткани in vivo (McMurtrey, 2016).
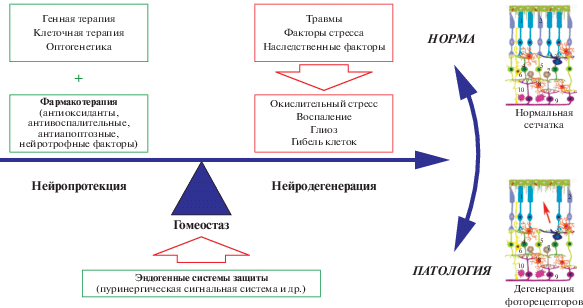
Рис. 2.
Стратегии нейропротекции при дегенеративных заболеваниях сетчатки (модифицировано по Markitantova, Simirskii, 2020 и Maneu et al., 2022). Эндогенные системы защиты (пуринергическая и др.) обеспечивают поддержание гомеостаза и функционирование сетчатки. Экстремальные воздействия, сопровождающиеся нарушениями и гибелью клеток сетчатки, перечислены в красных квадратах справа, а стратегии, применяемые для восстановления гомеостаза сетчатки и предотвращения дегенерации ее клеток – в зеленых квадратах слева. Красная стрелка на схеме сетчатки указывает на участок, в котором отсутствуют фоторецепторы и клетки пигментного эпителия. 1 – фоторецепторы палочки, 2 – фоторецепторы колбочки, 3 – горизонтальные клетки, 4 – палочковые биполяры, 5 – колбочковые биполяры, 6 – глия Мюллера, 7 – амакриновые клетки, 8 – микроглия, 9 – ганглиозные клетки, 10 – астроциты.
Лечению глазных заболеваний пуринергическими препаратами посвящен ряд обзоров, поскольку пуринорецепторы остаются в ряду перспективного фармакологического потенциала в терапии заболеваний сетчатки и стимуляции заживления ткани при ее повреждении (Guzman-Aranguez et al., 2014; Sanderson et al., 2014; Beckel et al., 2016; Reichenbach, Bringmann, 2016). Идея о том, что антагонисты P2X7R могут найти применение в предотвращении в сетчатке апоптоза нейронов, при действии высоких доз АТФ, гипоксии, была высказана ранее и нашла подтверждение в нескольких работах (Hu et al., 2010; Sugiyama et al., 2010; Sakamoto et al., 2015). В одной из этих работ была обнаружена перспективность использования антагонистов P2X7R для терапии глаукомы, сопровождаемой прогрессирующей гибелью ганглиозных клеток и атрофией зрительного нерва (Sakamoto et al., 2015). Стратегия деактивации P2X7R может быть использована для лечения хориоидальной формы ВМД, а также возрастной дегенерации желтого пятна (географической атрофии) сетчатки (Olivier et al., 2016). Для лечения этих патологий, также была предложена стратегия, основанная на использовании ингибиторов обратной транскриптазы нуклеозидов, которая направлена на блокирование активности каспазы-1, ключевого эффектора инфламмасом NLRP3, индуцированной Alu РНК (Fowler et al., 2014). Полиморфизмы одиночных нуклеотидов в генах, кодирующих пуринергические рецепторы, также служат основой для разработки диагностических биомаркеров патологий сетчатки глаза (Caseley et al., 2014). Все больший интерес в качестве потенциальных исходных терапевтических мишеней и биомаркеров заболеваний приобретают микроРНК, модулирующие работу ППС (Ferrari et al., 2016). В настоящее время в клинической практике известно несколько примеров применения фармакологических препаратов на основе пуринов и их производных, агонистов и антагонистов для лечения патологий глаза, затрагивающих сетчатку и РПЭ. Представлены доказательства эффективности антагонистов аденозиновых рецепторов для лечения глаукомы (Zhong et al., 2013). Диаденозин тетрафосфат (Ap4A), являющийся ингибитором пуринорецепторов P2Y1 и P2Y12, был заявлен в качестве эффективного химического соединения для лечения этой патологии (Fonseca et al., 2017). Агонист рецепторов P2Y2R – INS37217, усиливает реабсорбцию субретинальной жидкости, и стоит в ряду перспективных фармакологических средств, которые могут быть направлены на терапию отслоения сетчатки (Maminishkis et al., 2002; Meyer et al., 2002). Антагонист P2X7R и агонисты рецепторов A3R применяются в лечении диабетической ретинопатии (Sugiyama, 2014; Reichenbach, Bringmann, 2016), дегенерации фоторецепторов сетчатки (Hu et al., 2015; Ho et al., 2016), антагонист P2Y12R клопидогрел – в терапии развития тромбоза сосудов сетчатки (Oh et al., 2011). Агонисты A2AR используются для лечения нейродегенеративных патологий, и, возможно, вскоре найдут более широкое применение (Andrejew et al., 2020).
Несмотря на длительную историю исследований пуринов, клинические вмешательства с использованием компонентов ПСС для лечения широкого спектра заболеваний сетчатки сопряжены с рядом трудностей. Ввиду широкой представленности пуринорецепторов и их изоформ в разных тканях организма проблема избирательного фармакологического воздействия на определенные типы клеток остается нерешенной. Многообещающим в офтальмологии является поиск новых блокаторов P2X7R для лечения воспалительных заболеваний, однако, наличие полиморфных вариантов этих рецепторов затрудняет разработку селективных антагонистов для конкретной патологии. Отсутствие устоявшихся пуринергических методов лечения связано с относительно небольшим количеством агонистов и антагонистов, характеризующихся избирательностью к подтипам пуринорецепторов, и которые были бы не только эффективными, но и стабильными in vivo (Jacobson, Muller, 2016). Так, продолжают разрабатываться терапевтические подходы, предусматривающие применение новых компонентов ППС, стабильных in vivo: эктонуклеотидаз для нормализации баланса АТФ и аденозина, а также ингибиторов избыточного высвобождения из клеток АТФ (Traba et al., 2011; Andrejew et al., 2020). Накопление сведений о роли АТФ-связывающих кассетных транспортеров ABC в нормальном метаболизме и при его нарушениях способствует развитию стратегий безопасного и эффективного введения фармакологических препаратов (в частности, новорожденным и взрослым пациентам с сосудистыми заболеваниями глаз), поскольку системное введение некоторых лекарств остается малоэффективным (Liu, Liu, 2019).
Работа ПСС тесно связана с другими эндогенными системами, и, следовательно, предоставляет множество потенциальных клеточных и молекулярных мишеней. Большинство пуриноцепторов широко экспрессируются в эндокринных органах (Burnstock, Knight, 2004), однако сведения о механизмах взаимодействия ПСС с эндокринной системой остаются далеко неполными (Burnstock, 2014; Bjelobaba et al., 2015), а в отношении РПЭ и сетчатки отсутствуют. С использованием современных методов транскриптомики и протеомики единичных клеток, продолжается поиск регуляторов экспрессии компонентов пуринергического каскада: пуринорецепторов, ингибиторов и активаторов метаболизма и транспорта АТФ. Выявление взаимодействий ПСС с другими регуляторными системами межклеточной передачи сигналов сохраняет свою актуальность.
ЗАКЛЮЧЕНИЕ
Клеточные процессы в развитии и функционировании сетчатки позвоночных динамичны, осуществляются за счет согласованной работы специализированных нейронов и глии и взаимодействия с пограничными тканями – РПЭ и сосудистой оболочкой. ПСС вовлечена в регуляцию пролиферации клеток-предшественников, гибели, дифференцировки и поддержания жизнеспособности клеток сетчатки (Burnstock, Ulrich, 2011; Ventura et al., 2019). Ключевые компоненты пуринома: нуклеотиды, нуклеозиды, пуринорецепторы, традиционно стоят в ряду основных мишеней для генотерапевтического воздействия и разработки способов доставки фармакологических препаратов в клетки (King et al., 2006; Abbracchio et al., 2009; Singh et al., 2018; Spinozzi et al., 2021), особенно в отношении тканей заднего сектора глаза, характеризующихся низкой биологической доступностью.
В соответствии с накопленными к настоящему времени многочисленными экспериментальными и клиническими данными, сигнальные каскады, опосредованные рецепторами P2Y-типа, могут оказывать как нейротоксическое, так и нейропротекторное действие в сетчатке в онтогенезе, при патологиях и повреждении ткани. Один и тот же подтип пуринергических рецепторов P2Y1R в разных сигнальных каскадах может участвовать в процессах дегенерации в одних нейронах сетчатки (ганглиозные, фоторецепторы) (Ward et al., 2010), и выполнять функцию нейропротекции в других (амакриновые, горизонтальные) (Battista et al., 2009; Pannicke et al., 2014). ПСС оказывает модулирующее влияние на характер экспрессии в РПЭ и сетчатке генов, принадлежащих к разным функциональным группам, индуцируя или репрессируя их работу (Dale, 2008; Ricatti et al., 2011; Gampe et al., 2015). При общности некоторых важных звеньев клеточных и молекулярных процессов, существуют эволюционно закрепленные функциональные различия клеточного ответа в сетчатке (Casco-Robles et al., 2016). В ответ на действие пуринов в сетчатке возможны проявления вариабельности клеточного ответа (скорость и степень пролиферации и гибели клеток, функциональная состоятельность ткани, полнота восстановительных процессов). Один и тот же общий стимул может приводить к активации пуринергических рецепторов разного типа (изоформ), что может находить отражение в разнообразии используемых сигнальных путей, механизмов и проявляемых эффектов их воздействия на клетки сетчатки (Ward et al., 2010; Glaser et al., 2012). С одной стороны, внеклеточный АТФ и его метаболиты (аденозин) стимулируют секрецию факторов стресса, а с другой – принимают участие в индукции эндогенных систем, работа которых направлена на защиту клеток сетчатки от гибели и поддержание их жизнеспособности (Sanderson et al., 2014).
Стоит подчеркнуть существование различий в генных сетях, контролирующих клеточные процессы и гомеостаз тканей глаза у позвоночных в онтогенезе и в ответ на разные виды стресса. В клетках РПЭ взрослых млекопитающих (человека, мыши) при моделировании ВМД сетчатки обнаружены отличия профиля экспрессии генов (качественные и количественные) от профиля, характерного для эмбриональных тканей. Различия также носят таксоноспецифичный характер и связаны со спецификой работы сигнальных путей в норме и при развитии патологических процессов в сетчатке (Erb, Weisman, 2012; Bennis et al., 2015; Mellough et al., 2019). Ввиду того, что работа ПСС связана с другими эндогенными системами, проявляемые в сетчатке эффекты не всегда равнозначны. С одной стороны, избыточная активация пуриновых сигналов сопровождает хроническое воспаление при патологиях сетчатки. С другой, нуклеотиды, будучи вовлеченными в механизмы инициации апоптоза, могут предотвращать вторичное развитие воспалительных реакций и некроза в поврежденной ткани сетчатки. Двойственная роль пуринов в клетках сетчатки млекопитающих, направленная на защиту или повреждение, зависит от физиологического состояния ткани и ее ответа на действие экстремальных факторов (окислительный стресс, воспаление, механическое повреждение) (Burnstock, 2016). Эффекты нуклеотидов в сетчатке во многом определяются их концентрацией, продолжительностью стимуляции пуринорецепторов и их изоформ, а также молекулярным контекстом (Ferrari et al., 2006; Hu et al., 2010; Pannicke et al., 2014). Отличия находят отражение во взаимодействиях компонентов ПСС и гомео-бокссодержащих генов у низших и высших позвоночных (Dale, 2008; Masse, Dale, 2012; Gampe et al., 2015). В связи с этими фактами, изучение роли компонентов ПСС в клеточных процессах сетчатки и РПЭ тесно связано с характеристикой молекулярно-генетического портрета клеток и сигнальных путей, поиском факторов ниш, обеспечивающих специализацию и поддержание гомеостаза этих тканей глаза (Tian et al., 2015; Swarup et al., 2019).
Разнообразие проявлений действия пуринов в одноименной ткани обусловливает необходимость сравнительного анализа моделей сетчатки in vivo и in vitro, выявления таксоноспецифичных особенностей, мишеней, вовлеченных в пуринергические регуляторные каскады. Очевидно, что сложность работы ПСС в сетчатке во многом обусловлена тем, что ее ключевые компоненты, а также ряд эффекторных молекул, являются общими звеньями, которые связывают работу многочисленных сигнальных путей (Weick et al., 2005; Ventura et al., 2019). Понимание того, как работа ПСС в сетчатке интегрирована с другими эндогенными системами (иммунной, эндокринной, редокс-системой), способствует развитию экспериментально обоснованной базы для разработки способов поддержания жизнеспособности клеток нейральной сетчатки и РПЭ. Рассмотрение вопросов взаимодействия этих регуляторных систем в сетчатке глаза позвоночных выходит за рамки настоящего обзора.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена в рамках раздела Государственного задания ИБР РАН 2021 года № 0088-2021-0017.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Все применимые международные, национальные и/или институциональные принципы использования животных в экспериментах и условия ухода за ними были соблюдены.
ИНФОРМАЦИЯ О ВКЛАДЕ АВТОРОВ
Авторы внесли одинаковый вклад в подготовку материалов и написание обзора.
СПИСОК СОКРАЩЕНИЙ
| АТФ | аденозинтрифосфат |
| АДФ | аденозинтдифосфат |
| АМФ | аденозинмонофосфат |
| АТФаза | аденозинтрифосфатаза |
| ацетил-КоА | ацетилкофермент А |
| ВМД | возрастная макулярная дистрофия сетчатки |
| ГАМК | гамма-аминомасляная кислота |
| ДНК | дезоксирибонуклеиновая кислота |
| НАДФН | никотинамид-β-аденин динуклеотид фосфат |
| ПСС | пуринергическая сигнальная система |
| РПЭ | ретинальный пигментный эпителий |
| Транспортеры ABC | транспортные белки, содержащие АТФ-связывающий домен |
| УТФ | уридинтрифосфат |
| цАМФ | циклический аденозинмонофосфат |
| цГМФ | циклический гуанозинмонофосфат |
| ALP (alkaline phosphatase) | щелочная фосфатаза |
| AR | метаботропные рецепторы к аденозину |
| BDNF (brain-derived neurotrophic factor) | нейротрофический фактор мозга |
| BrdU (Bromodeoxyuridine/5-bromo-2'-deoxyuridine) | бромдезоксиуридин |
| CNT (concentrative nucleoside transporter) | концентрационные нуклеозидные транспортеры |
| eN (ecto-5'-nucleotidase) | экто-5'-нуклеотидаза |
| ENT | равновесные нуклеозидные транспортеры |
| ENTPD | эктонуклеозидтрифосфатдифосфогидролаза |
| ENPP | эктонуклеотидпирофосфатазы/фосфодиэстераза |
| FGF (fibroblast growth factor) | фактор роста фибробластов |
| G2 (period of rapid cell growth and protein synthesis in cell cycle preceding mitosis) | постсинтетическая или премитотическая фаза клеточного цикла |
| NO (nitric oxide) | оксид азота |
| iNOS (inducible nitric oxide synthase) | индуцибельная синтаза оксида азота |
| IP3 (inositol trisphosphate) | инозитол-1,4,5-трифосфат |
| M | фаза митоза |
| MAPK (mitogen-activated protein kinase) | митоген-активируемая протеин киназа |
| NGF (nerve growth factor) | фактор роста нервов |
| P2XR (ATP-gated P2X receptor cation channel family) | семейство АТФ-управляемых катионных каналов рецептора P2X |
| P2YR | метаботропные связанные с G-белком рецепторы |
| PCNA (proliferating cell nuclear antigen) | ядерный антиген пролиферирующих клеток |
| PI3K/Akt | сигнальный путь |
| PKC (protein kinase C) | протеин киназа С |
| PLC (phospholipase C) | фосфолипаза-C |
| S-фаза | фаза репликации ДНК |
| TGF (transforming growth factor) | трансформирующий фактор роста |
Список литературы
Миташов В.И. Характеристика митотических циклов клеток пигментного эпителия и зачатка сетчатки у взрослых тритонов (Triturus cristatus, Triturus taeniatus) // Докл. АН СССР. 1969. Т. 189. № 3. С. 666–669.
Abbracchio M.P., Burnstock G., Verkhratsky A. et al. Purinergic signaling in the nervous system: a noverview // Trends Neurosci. 2009. V. 32. № 1. P. 19–29.
Ahn J., Molday R.S. Purification and characterization of ABCR from bovine rod outer segments // Methods Enzymol. 2000. V. 315. P. 864–879.
Akanuma S., Soutome T., Hisada E. et al. Na+-independent nucleoside transporters regulate adenosine and hypoxanthine levels in Müller cells and the inner blood-retinal barrier // Invest. Ophthalmol. Vis. Sci. 2013. V. 54. № 2. P. 1469–1477.
Alvarado-Castillo C., Harden T.K., Boyer J.L. Regulation of P2Y1 receptor-mediated signaling by the ectonucleosidetriphosphate diphosphohydrolase isozymes NTPDase1 and NTPDase2 // Mol. Pharmacol. 2005. V. 67. № 1. P. 114–122.
Alvarez-Hernan G., de Mera-Rodríguez J.A., Ganan Y. et al. Development and postnatal neurogenesis in the retina: a comparison between altricial and precocial bird species // Neural Regen. Res. 2021. V. 16. № 1. P. 16–20. https://doi.org/10.4103/1673-5374.286947
Andrejew R., Oliveira-Giacomelli A., Ribeiro D.E. et al. The P2X7 receptor: Central hub of brain diseases // Front. Mol. Neurosci. 2020. V. 13. Article № 124.
Arredouani A., Yu F., Sun L. et al. Regulation of store-operated Ca2+ entry during the cell cycle // J. Cell Sci. 2010. V. 123. № 13. P. 2155–2162.
Attwell D., Barbour B., Szatkowski M. Nonvesicular release of neurotransmitter // Neuron. 1993. V. 11. № 3. P. 401–407.
Battista A.G., Ricatti M.J., Pafundo D.E. et al. Extracellular ADP regulates lesion-induced in vivo cell proliferation and death in the zebrafish retina // J. Neurochem. 2009. V. 111. № 2. P. 600–613.
Beckel J.M., Lu W., Civan M.M. et al. Treatment of retinal disorders with purinergic drugs: beyond receptors // J. Ocul. Pharmacol. Ther. 2016. V. 32. P. 488–489.
Bjelobaba I., Janjic M.M., Stojilkovic S.S. Purinergic signaling pathways in endocrine system // Auton Neurosci. 2015. V. 191. P. 102–116.
Bennett M.V., Garre J.M., Orellana J.A. et al. Connexin and pannexin hemichannels in inflammatory responses of glia and neurons // Brain Res. 2012. V. 1487. P. 3–15.
Bennis A., Gorgels T.G.M.F., ten Brink J.B. et al. Comparison of mouse and human retinal pigment epithelium gene expression profiles: potential implications for age-related macular degeneration // PLoS One. 2015. V. 10(10):e0141597.
Bhutto I.A., Baba T., Merges C. et al. Low nitric oxide synthases (NOS) in eyes with age-related macular degeneration (AMD) // Exp. Eye Res. 2010. V. 90. № 1. P. 155–167.
Boia R., Ruzafa N., Aires I.D. et al. Neuroprotective strategies for retinal ganglion cell degeneration: Current status and challenges ahead // Int. J. Mol. Sci. 2020. V. 21. № 7. Article № 2262.
Brass D., Grably M.R., Bronstein-Sitton N. et al. Using antibodies against P2Y and P2X receptors in purinergic signaling research // Purinergic Signal. 2012. V. 8. Suppl. 1. P. 61–79.
Bringmann A., Iandiev I., Pannicke T. et al. Cellular signaling and factors involved in Muller cell gliosis: neuroprotective and detrimental effects // Prog. Ret. Eye Res. 2009. V. 28. № 6. P. 423–451.
Browne A.W., Arnesano C., Harutyunyan N. et al. Structural and functional characterization of human stem-cell-derived retinal organoids by live imaging // Invest. Ophthalmol. Vis. Sci. 2017. V. 58. № 9. P. 3311–3318.
Burnstock G. Shortand long-term (trophic) purinergic signaling // Phil. Trans. R. Soc. B. 2016. V. 371. Article № 20150422.
Burnstock G. Purinergic signalling in endocrine organs // Purinergic Signal. 2014. V. 10. P. 189–231.
Burnstock G., Knight G.E. Cellular distribution and functions of P2 receptor subtypes in different systems // Int. Rev. Cytol. 2004. V. 240. P. 31–304.
Burnstock G., Ulrich H. Purinergic signalling in embryonic and stem cell development // Cell Mol. Life Sci. 2011. V. 68. № 8. P. 1369–1394.
Carneiro A.C.D., Fragel-Madeira L., Silva-Neto M.A. et al. A role for CK2 upon interkinetic nuclear migration in the cell cycle of retinal progenitor cells // Dev. Neurobiol. 2008. V. 68. № 5. P. 620–631.
Casco-Robles M.M., Islam M.R., Inami W. et al. Turning the fate of reprogramming cells from retinal disorder to regeneration by Pax6 in newts // Sci. Rep. 2016. V. 6. Article № 33761.
Caseley E.A., Muench S.P., Roger S. et al. Non-synonymous single nucleotide polymorphisms in the P2X receptor genes: association with diseases, impact on receptor functions and potential use as diagnosis biomarkers // Int. J. Mol. Sci. 2014. V. 15. P. 13344–13371.
Capowski E.E., Samimi K., Mayer S.J. et al. Reproducibility and staging of 3D human retinal organoids across multiple pluripotent stem cell lines // Development. 2019. V. 146. № 1. Article № dev171686.
Cowlen M.S., Zhang V.Z., Warnock L. et al. Localization of ocular P2Y2 receptor gene expression by in situ hybridization // Exp. Eye Res. 2003. V. 77. P. 77–84.
Cunha-Vaz J., Bernardes R., Lobo C. Blood-retinal barrier // Eur. J. Ophthalmol. 2011. V. 21. Suppl. 6. P. 3–9.
Cvekl A., Mitton K.P. Epigenetic regulatory mechanisms in vertebrate eye development and disease // Heredity (Edinb.). 2010. V. 105. № 1. P. 135–151.
Dale N. Dynamic ATP signalling and neural development // J. Physiol. 2008. V. 586. № 10. P. 2429–2436.
De Almeida-Pereira L., Repossi M.G., Magalhaes C.F et al. P2Y12 but not P2Y13 purinergic receptor controls postnatal rat retinogenesis in vivo // Mol. Neurobiol. 2018. V. 55. № 11. P. 8612–8624.
Di Virgilio F., Ben D.D., Sarti A.C. et al. The P2X7 receptor in infection and inflammation // Immunity. 2017. V. 47. № 1. P. 15–31.
Domercq M., Perez-Samartin A., Aparicio D. et al. P2X7 receptors mediate ischemic damage to oligodendrocytes // Glia. 2010. V. 58. № 6. P. 730–740.
Dyer M.A., Cepko C.L. p27Kip1 and p57Kip2 regulate proliferation in distinct retinal progenitor cell populations // J. Neurosci. 2001. V. 21. № 12. P. 4259–4271.
Dopper H., Menges J., Bozet M. et al. Differentiation protocol for 3D retinal organoids, immunostaining and signal quantitation // Curr. Protocols. 2020. V. 55. № 1. Article № e120.
Eltzschig H.K., Sitkovsky M.V., Robson S.C. Purinergic signaling during inflammation // N. Engl. J. Med. 2012. V. 367. № 24. P. 2322–2333.
Erb L., Weisman G.A. Coupling of P2Y receptors to G proteins and other signaling pathways // Wiley Interdiscip. Rev. Membr. Transp. Signal. 2012. V.1. № 6. P. 789–803.
Ferrari D., Pizzirani C., Adinolfi E.et al. The P2X7 receptor: A key player in IL-1 processing and release // J. Immunol. 2006. V. 176. № 7. P. 3877–3883.
Ferrari D., Bianchi N., Eltzschig H.K. et al. MicroRNAs modulate the purinergic signaling network // Trends Mol. Med. 2016. V. 22. P. 905–918.
Fonseca B., Martinez-Aguila A., De Lara M.J.P. et al. Diadenosine tetraphosphate as a potential therapeutic nucleotide to treat glaucoma // Purinergic Signal. 2017. V. 13. P. 171–177.
Fowler B.J., Gelfand B.D., Kim Y. et al. Nucleoside reverse transcriptase inhibitors possess intrinsic anti-inflammatory activity // Science. 2014. V. 346. P. 1000–1003.
Franca G.R., Freitas R.C., Ventura A.L. ATP-induced proliferation of developing retinal cells: regulation by factors released from postmitotic cells in culture // Int. J. Dev. Neurosci. 2007. V. 25. № 5. P. 283–291.
Franke H., Klimke K., Brinckmann U. et al. P2X(7) receptor-mRNA and -protein in the mouse retina; changes during retinal degeneration in BALBCrds mice // Neurochem. Int. 2005.V. 47. № 4. P. 235–242.
Fries J.E., Wheeler-Schilling T.H., Guenther E. et al. Expression of P2Y1, P2Y2, P2Y4, and P2Y6 receptor subtypes in the rat retina // Invest. Ophthalmol. Vis. Sci. 2004a. V. 45. № 10. P. 3410–3417.
Fries J.E., Wheeler-Schilling T.H., Kohler K. et al. Distribution of metabotropic P2Y receptors in the rat retina: a single-cell RT-PCR study // Brain Res. Mol. Brain Res. 2004b. V. 130 P. 1–6.
Gampe K., Haverkamp S., Robson S.C. et al. NTPDase2 and the P2Y1 receptor are not required for mammalian eye formation // Purinergic Signal. 2015. V. 11. № 1. P. 155–160.
Geiger L.K., Kortuem K.R., Alexejun C. et al. Reduced redox state allows prolonged survival of axotomized neonatal retinal ganglion cells // Neuroscience. 2002. V. 109. P. 635–642.
Ghosh M., Aguirre V., Wai K. et al. The interplay between cyclic AMP, MAPK, and NF-κBP at hways in response to proinflammatory signalsin microglia // Biomed. Res. Int. 2015. V. 2015. Article № 308461.
Giuliani A.L., Sarti A.C., Di Virgilio F. Extracellular nucleotides and nucleosides as signalling molecules // Immunol. Lett. 2019. V. 205. P. 16–24.
Glaser T., Cappellari A.R., Pillat M.M. et al. Perspectives of purinergic signaling in stem cell differentiation and tissue regeneration // Purinergic Signal. 2012. V. 8. P. 523–553.
Gonzalez-Fernandez E., Sanchez-Gomez M.V., Perez-Samartin A. et al. A3 adenosine receptors mediate oligodendrocyte death and ischemic damage to optic nerve // Glia. 2014. V. 62. № 2. P. 199–216.
Greenwood D., Yao W.P., Housley G.D. Expression of the P2X2 receptor subunit of the ATP-gated ion channel in the retina // NeuroReport. 1997. V. 8. P. 1083–1088.
Grigoryan E.N., Novikova Y.P., Gancharova O.S. et al. New antioxidant SkQ1 is an effective protector of rat eye retinal pigment epithelium and choroid under conditions of long term organotypic cultivation // Adv. Aging Res. 2012. V. 1. P. 31–37.
Gu X., Neric N.J., Crabb J.S. et al. Age-related changes in the retinal pigment epithelium (RPE) // PLoS One. 2012. V. 7. № 6. Article № e38673.
Guha S., Baltazar G.C., Coffey E.E. et al. Lysosomal alkalinization, lipidoxidation, and reduced phagosome clearance triggered by activation of the P2X7 receptor // FASEB J. 2013. V. 27. P. 4500–4509.
Guzman-Aranguez A., Gasull X., Diebold Y. et al. Purinergic receptors in ocular inflammation // Mediators Inflamm. 2014. V. 2014. Article № 320906.
Heavner W., Pevny L. Eye development and retinogenesis // Cold Spring Harb. Perspect. Biol. 2012. V. 4. Article № a008391.
Ho T., Aplin F.P., Jobling A.I. et al. Localization and possible function of P2X receptors in normal and diseased retinae // J. Ocul. Pharmacol. Ther. 2016. V. 32. P. 509–517.
Hoon M., Okawa H., Santina L.D. et al. Functional architecture of the retina: development and disease // Prog. Retin. Eye Res. 2014. V. 42. P. 44–84.
Hu H., Lu W., Zhang M. et al. Stimulation of the P2X7 receptor kills rat retinal ganglion cells in vivo // Exp. Eye Res. 2010. V. 91. P. 425–432.
Hu S.J., Calippe B., Lavalette S. et al. Upregulation of P2RX7 in Cx3cr1-deficient mononuclear phagocytes leads to increased interleukin-1β secretion and photoreceptor neurodegeneration // J. Neurosci. 2015. V. 35. P. 6987–6996.
Illes P., Rubini P. Regulation of neural stem/progenitor cell functions by P2X and P2Y receptors // Neural Regen. Res. 2017. V. 12. P. 395–396.
Jabs R., Guentherb E., Marquordt K. et al. Evidence for P2X3, P2X4, P2X5 but not for P2X7 containing purinergic receptors in Müller cells of the rat retina // Mol. Brain Res. 2000. V. 76. P. 205–210.
Jacobson K.A., Muller C.E. Medicinal chemistry of adenosine, P2Y and P2X receptors // Neuropharmacology. 2016. V. 104. P. 31–49.
Jung J., JoH. W., Kwon H., Jeong N.Y. ATP release through lysosomal exocytosis from peripheral nerves: the effect of lysosomal exocytosis on peripheral nerve degeneration and regeneration after nerve injury // Biomed. Res. Int. 2014. V. 2014. Article № 936891.
Kaneda M., Ishii K., Morishima Y. et al. OFF-cholinergic-pathway-selective localization of P2X2 purinoceptors in the mouse retina // J. Comp. Neurol. 2004. V. 476. № 1. P. 103–111.
Kaneda M., Ishii T., Hosoya T. Pathway-dependent modulation by P2-purinoceptors in the mouse retina // Eur. J. Neurosci. 2008. V. 28. P. 128–136.
Kim W.S., Weickert C.S., Garner B. Role of ATP-binding cassette transporters in brain lipid transport and neurological disease // J. Neurochem. 2008. V. 104. P. 1145–1166.
Kimura A., Namekata K., Guo X. et al. Neuroprotection, growth factors and BDNF-TrkB signalling in retinal degeneration // Int. J. Mol. Sci. 2016. V. 17. № 9. Article № 1584.
King A.E., Ackley M.A., Cass C.E. et al. Nucleoside transporters: from scavengers to novel therapeutic targets // Trends Pharm. Sci. 2006. V. 27. P. 416–425.
Kubo Y., Akanuma S., Hosoya K. Recent advances in drug and nutrient transport across the blood-retinal barrier // Expert. Opin. Drug Metab. Toxicol. 2018. V. 14. № 5. P. 513–531.
Kur J., Newman E.A. Purinergic control of vascular tone in the retina // J. Physiol. 2013. V. 592. № 3. P. 491–504.
Lazarowski E.R., Sesma J.I., Seminario-Vidal L. et al. Molecular mechanisms of purine and pyrimidine nucleotide release // Adv. Pharmacol. 2011. V. 61. P. 221–261.
Li F., Jiang D., Samuel M.A. Microglia in the developing retina // Neural Dev. V. 2019. № 14. P. 12.
Lin J.H., Takano T., Arcuino G. et al. Purinergic signaling regulates neural progenitor cell expansion and neurogenesis // Develop. Biol. 2006. V. 302. № 1. P. 356–366.
Linden R., Martins R., Silveira M.S. Control of programmed cell death by neurotransmitters and neuropeptides in the developing mammalian retina // Prog. Ret. Eye Res. 2005. V. 24. № 4. P. 457–491.
Liu X.L., Zhou R., Pan Q.-Q. et al. Genetic inactivation of the adenosine A2A receptor attenuates pathologic but not developmental angiogenesis in the mouse retina // Invest. Ophthalmol. Vis. Sci. 2010. V. 51. № 12. P. 6625–6632.
Liu L., Liu X. Roles of drug transporters in blood-retinal barrier // Adv. Exp. Med. Biol. 2019. V. 1141. P. 467–504.
Liu Y., Wang C., Su G. Cellular signaling in müller glia: Progenitor cells for regenerative and neuroprotective responses in pharmacological models of retinal degeneration // J. Ophthalmol. 2019. V. 2019. Article № 5743109.
Locher K.P. Mechanistic diversity in ATP-binding cassette (ABC) transporters // Nat. Struct. Mol. Biol. 2016. V. 23. № 6. P. 487–493.
Lu W., Hu H., Sévigny J. et al. Rat, mouse, and primate models of chronic glaucoma show sustained elevation of extracellular ATP and altered purinergic signaling in the posterior eye // Invest. Ophthalmol. Vis. Sci. 2015. V. 56. P. 3075–3083.
Mac Nair C.E., Schlamp C.L., Montgomery A.D. et al. Retinal glial responses to optic nerve crush are attenuated in Bax-deficient mice and modulated by purinergic signaling pathways // J. Neuroinflammation. 2016. V. 13. Article № 93.
Madelung C.F., Falk M.K., Sorensen T.L. The association between neovascular age-related macular degeneration and regulatory T cells in peripheral blood // Ophthalmol. 2015. V. 9. P. 1147–1154.
Maminishkis A., Jalickee S., Blaug S.A. et al. The P2Y2 receptor agonist INS37217 stimulates RPE fluid transport in vitro and retinal reattachment in rat // Invest. Ophthalmol. Vis. Sci. 2002. V. 43. P. 3555–3566.
Maneu V., Lax P., Cuenca N. Current and future therapeutic strategies for the treatment of retinal neurodegenerative diseases // Neural Regen. Res. 2022. V. 17. № 1. P. 103–104.
Marc R.E. Retinal neurotransmitters // Vis. Neurosci. 2003. V. 85. P. 6187–6191.
Markitantova Y.V., Simirskii V.N. The role of the redox system in initiation of neural eye tissues regenerative response in vertebrates // Rus. J. Dev. Biol. 2020a. V. 51. P. 16–30.
Markitantova Y.V., Simirskii V.N. Inherited eye diseases with retinal manifestations through the eyes of homeobox genes // Int. J. Mol. Sci. 2020b. V. 21. № 5. Article № 1602.
Martins R.A.P., Pearson R.A. Control of cell proliferation by neurotransmitters in the developing vertebrate retina // Brain Res. 2008. V. 1192. P. 37–60.
Massé K., Dale N. Purines as potential morphogens during embryonic development // Purinergic Signal. 2012. V. 8. P. 503–521.
Massey S.C., O’Brien J.J, Trexler E.B. et al. Multiple neuronal connexins in the mammalian retina // Cell Commun. Adhesion. 2003. V. 10. № 4–6. P. 425–430.
McMurtrey R.J. Multi-compartmental biomaterial scaffolds for patterning neural tissue organoids in models of neurodevelopment and tissue regeneration // J. Tissue Engineering. 2016. V. 7. P. 1–8.
Medrano M.P., Bejarano C.A., Battista A.G. et al. Injury-induced purinergic signalling molecules upregulate pluripotency gene expression and mitotic activity of progenitor cells in the zebrafish retina // Purinergic Signal. 2017. V. 4. P. 443–465.
Mellough C.B., Bauer R., Collin J. et al. An integrated transcriptional analysis of the developing human retina // Development. 2019. V. 146. № 2. Article № dev169474.
Metea M.R., Newman E.A. Glial cells dilate and constrict blood vessels: a mechanism of neurovascular coupling // J. Neurosci. 2006. V. 26. P. 2862–2870.
Meyer C.H., Hotta K., Peterson W.M. et al. Effect of INS37217, a P2Y2 receptor agonist, on experimental retinal detachment and electroretinogram in adult rabbits // Invest. Ophthalmol. Vis. Sci. 2002. V. 43. P. 3567–3574.
Mitchell C.H. Release of ATP by a human retinal pigment epithelial cell line: potential for autocrine stimulation through subretinal space // J. Physiol. 2001. V. 534. P. 193–202.
Mitchell C.H., Reigada D. Purinergic signalling in the subretinal space: a role in the communication between the retina and the RPE // Purinergic Signal. 2008. V. 4. P. 101–107.
Mishra S.K., Braun N., Shukla V. et al. Extracellular nucleotide signaling in adult neural stem cells: synergism with growth factor-mediated cellular proliferation // Development. 2006. V. 133. P. 675–684.
Moran-Jimenez M.J., Matute C. Immunohistochemical localization of the P2Y(1) purinergic receptor in neurons and glial cells of the central nervous system // Brain Res. Mol. Brain Res. 2000. V. 78. P. 50–58.
Nagase K., Tomi M., Tachikawa M. et al. Functional and molecular characterization of adenosine transport at the rat inner blood-retinal barrier // Biochim. Biophys. Acta. 2006. V. 1758. № 1. P. 13–19.
Nascimento J.L., Sawada L.A., Oliveira K.R.M. et al. GABA and glutamate transporters: new events and function in the vertebrate retina // Psychol. Neurosci. 2013. V. 6. № 2. P. 145–150.
Niyadurupola N., Sidaway P., Ma N. P2X7 receptor activation mediates retinal ganglion cell death in a human retina model of ischemic neurodegeneration // Invest. Ophthalmol. Vis. Sci. 2013. V. 54. P. 2163–2170.
Notomi S., Hisatomi T., Murakami Y. et al. Dynamic increase in extracellular ATP accelerates photoreceptor cell apoptosis via ligation of P2RX7 in subretinal hemorrhage // PLoS One. 2013. V. 8. Article № e53338.
Nunes P.H., Calaza K.C., Albuquerque L.M. et al. Signal transduction pathways associated with ATP-induced proliferation of cell progenitors in the intact embryonic retina // Int. J. Dev. Neurosci. 2007. V. 25. № 8. P. 499–508.
Olivier E., Dutot M., Regazzetti A. et al. P2X7-pannexin-1 and amyloidβ-induced oxysterol input in human retinal cell: role in age-related macular degeneration? // Biochimie. 2016. V. 127. P. 70–78.
Oh J., Smiddy W.E., Kim S.S. Antiplatelet and anticoagulation therapy in vitreoretinal surgery // Am. J. Ophthalmol. 2011. V. 151. № 6. P. 934–939.
Ohnuma S., Harris W.A. Neurogenesis and the cell cycle // Neuron. 2003. V. 40. № 2. P. 199–208.
Ornelas I.M., Silva T.M., Fragel-Madeira L. et al. Inhibition of PI3K/Akt pathway impairs G2/M transition of cell cycle in late developing progenitors of the avian embryo retina // PLoS One. 2013. V. 8. № 1. Article № e53517.
Pannicke T., Frommherz I., Biedermann B. et al. Differential effects of P2Y1 deletion on glial activation and survival of photoreceptors and amacrine cells in the ischemic mouse retina // Cell Death Dis. 2014. V. 5. № 7. Article № e1353.
Pearson R., Catsicas M., Becker D. et al. Purinergic and muscarinic modulation of the cell cycle and calcium signaling in the chick retinal ventricular zone // J. Neurosci. 2002. V. 22. P. 7569–7579.
Pearson R.A., Dale N., Llaudet E. et al. ATP released via gap junction hemichannels from the pigment epithelium regulates neural retinal progenitor proliferation // Neuron. 2005. V. 46. № 5. P. 731–744.
Pequignot M.O., Provost C., Salle S. et al. The retinal pigment epithelium undergoes massive apoptosis during early differentiation and pigmentation of the optic cup // Mol. Vis. 2011. V. 17. P. 989–996.
Perron M., Kanekar S., Vetter M.L. et al. The genetic sequence of retinal development in the ciliary margin of the Xenopus eye // Dev. Biol. 1998. V. 199. P. 185–200.
Pintor P., Sánchez-Nogueiro J., Irazu M. et al. Immunolocalisation of P2Y receptors in the rat eye // Purinergic Signal. 2004. V. 1. P. 83–90.
Pirvu A.S., Andrei A.M., Stanciulescu A.C. NAD+ metabolism and retinal degeneration // Exp. Ther. Med. 2021. V. 22. № 1. Article № 670.
Potucek Y.D., Crain J.M., Watters J.J. Purinergic receptors modulate MAP kinases and transcription factors that control microglial inflammatory gene expression // Neurochem. Int. 2006. V. 49. № 2. P. 204–214.
Prada C., Puga J., Pérez-Méndez L. et al. Spatial and temporal patterns of neurogenesis in the chick retina // Eur. J. Neurosci. 1991. V. 3. P. 559–569.
Puthussery T., Fletcher E.L. Synaptic localization of P2X7 receptors in the rat retina // J. Comp. Neurol. 2004. V. 472. № 1. P. 13–23.
Puthussery T., Fletcher E.L. P2X2 receptors on ganglion and amacrine cells in cone pathways of the rat retina // J. Comp. Neurol. 2006. V. 496. P. 595–609.
Puthussery T., Yee P., Vingrys A.J. et al. Evidence for the involvement of purinergic P2X7 receptors in outer retinal processing // Eur. J. Neurosci. 2006. V. 24. P. 7–19.
Quazi F., Molday R.S. ATP-binding cassette transporter ABCA4 and chemical isomerization protect photoreceptor cells from the toxic accumulation of excess 11-cis-retinal // Proc. Natl. Acad. Sci. USA. 2014. V. 111. № 13. P. 5024–5029.
Ramachandra R.S., Fliesler S.J. Cholesterol homeostasis in the vertebrate retina: biology and pathobiology // J. Lipid Res. 2021. V. 62. Article № 100057.
Raymond P.A., Barthel L.K., Bernardos R.L. et al. Molecular characterization of retinal stem cells and their niches in adult zebrafish // BMC Dev. Biol. 2006. V. 6. Article № 36.
Reichenbach A., Bringmann A. Purinergic signaling in retinal degeneration and regeneration // Neuropharmacology. 2016. V. 104. P. 194–211.
Resta V., Novelli E., Vozzi G. et al. Acute retinal ganglion cell injury caused by intraocular pressure spikes is mediated by endogenous extracellular ATP // Eur. J. Neurosci. 2007. V. 25. № 9. P. 2741–2754.
Ricatti M.J., Battista A.G., Zorrilla Z.M. et al. Purinergic signals regulate daily S-phase cell activity in the ciliary marginal zone of the zebrafish retina // J. Biol. Rhythms. 2011. № 2. P. 107–117.
Rosenberg S.S., Spitzer N.C. Calcium signaling in neuronal development // Cold Spring Harb. Perspect. Biol. 2011. V. 3. № 10. Article № a004259.
Sakamoto K., Endo K., Suzuki T. et al. P2X7 receptor antagonists protect against N-methyl-D-aspartic acid-induced neuronal injury in the rat retina // Eur. J. Pharmacol. 2015. V. 756. P. 52–58.
Sanches G., de Alencar L.S., Ventura A.L. ATP induces proliferation of retinal cells in culture via activation of PKC and extracellular signal-regulated kinase cascade // Int. J. Dev. Neurosci. 2002. V. 20. P. 21–27.
Sanderson J., Dartt D.A., Trinkaus-Randall V. et al. Purines in the eye: recent evidence for the physiological and pathological role of purines in the RPE, retinal neurons, astrocytes, Müller cells, lens, trabecular meshwork, cornea and lacrimal gland // Exp. Eye Res. 2014. V. 127. P. 270–279.
Santiago A.R., Baptista F.I., Santos P.F. et al. Role of Microglia adenosine A2A receptors in retinal and brain neurodegenerative diseases // Mediators Inflamm. 2014. V. 2014. Article № 465694.
Schacher S., Wu F., Sun Z.Y. Pathway-specific synaptic plasticity: activity-dependent enhancement and suppression of long-term heterosynaptic facilitation at converging inputs on a single target // J. Neurosci. 1997. V. 17. № 2. P. 597–606.
Seitz R., Ohlmann A., Tamm E. The role of Müller glia and microglia in glaucoma // Cell Tissue Res. 2013. V. 353. № 2. P. 339–345.
Sennlaub F., Courtois Y., Goureau O. Inducible nitric oxide synthase mediates retinal apoptosis in ischemic proliferative retinopathy // J. Neurosci. 2002. V. 22. № 10. P. 3987–3993.
Sinha T., Naash M.I., Al-Ubaidi M.R. The symbiotic relationship between the neural retina and retinal pigment epithelium is supported by utilizing differential metabolic pathways // iScience. 2020a. V. 23. № 4. Article № 101004.
Sinha T., Naash M.I., Al-Ubaidi M.R. Flavins act as a critical liaison between metabolic homeostasis and oxidative stress in the retina // Front. Cell Dev. Biol. 2020b. V. 27. № 8. Article № 861.
Sholl-Franco A., Fragel-Madeira L., Macama A.C. et al. ATP controls cell cycle and induces proliferation in the mouse developing retina // Int. J. Dev. Neurosci. 2010. V. 28. № 1. P. 63–73.
Spinozzi E., Baldassarri C., Acquaticci L. et al. Adenosine receptors as promising targets for the management of ocular diseases // Med. Chem. Res. 2021.V. 30. P. 353–370.
Stacy R.C., Wong R.O.L. Developmental relationship between cholinergic amacrine cell processes and ganglion cell dendrites of the mouse retina // J. Comparative Neurol. 2003. V. 456. P. 154–166.
Sugioka M., Fukuda Y., Yamashita M. Ca2+ responses to ATP via purinoceptors in the early embryonic chick retina // J. Physiol. 1996. V. 493. P. 855–863.
Sugioka M., Zhou W.L., Hofmann H.D. et al. Involvement of P2 purinoceptors in the regulation of DNA synthesis in the neural retina of chick embryo // Int. J. Dev. Neurosci. 1999. V. 17. P. 135–144.
Sugiyama T., Oku H., Shibata M. et al. Involvement of P2X7 receptors in the hypoxia-induced death of rat retinal neurons // Invest. Ophthalmol. Vis. Sci. 2010. V. 51. № 6. P. 3236–3243.
Sugiyama T. Role of P2X7 receptors in the development of diabetic retinopathy // World J. Diabetes. 2014. V. 5. P. 141–145.
Swarup A., Samuels I.S., Bell B.A. et al. Modulating GLUT1 expression in retinal pigment epithelium decreases glucose levels in the retina: impact on photoreceptors and Muller glial cells // Am. J. Physiol. Cell Physiol. 2019. V. 316. P. 121–133.
Tagami M., Kusuhara S., Honda S. et al. Expression of ATP-binding cassette transporters at the inner blood-retinal barrier in a neonatal mouse model of oxygen-induced retinopathy // Brain Res. 2009. V. 1283. P. 186–193.
Tarallo V., Hirano Y., Gelfand B.D. et al. DICER1 loss and Alu RNA induce age-related macular degeneration via the NLRP3 inflammasome and MyD88 // Cell. 2012. V. 149. P. 847–859.
Tian L., Kazmierkiewicz K.L., Bowman A.S. Transcriptome of the human retina, retinal pigmented epithelium and choroid // Genomics. 2015. V. 105. P. 253–264.
Tomi M., Hosoya K. The role of blood-ocular barrier transporters in retinal drug disposition: an overview // Expert. Opin. Drug Metab. Toxicol. 2010. V. 6. № 9. P. 1111–1124.
Traba J., Satrustegui J., del Arco A. Adenine nucleotide transporters in organelles: novel genes and functions // Cell. Mol. Life Sci. 2011. V. 68. P. 1183–1206.
Tsukamoto Y. Morphological survey from neurons to circuits of the mouse retina // Meth. Mol. Biol. 2018. V. 1753. P. 3–25.
Tsybovsky Y., Molday R.S., Palczewski K. The ATP-binding cassette transporter ABCA4: Structural and functional properties and role in retinal disease // Adv. Exp. Med. Biol. 2010. V. 703. P. 105–125.
Uckermann O., Wolf A., Kutzera F. et al. Glutamate release by neurons evokes a purinergic inhibitory mechanism of osmotic glial cell swelling in the rat retina: activation by neuropeptide // J. Neurosci. Res. 2006. V. 83. P. 538–550.
Vecino E., Rodriguez F.D., Ruzafa N. et al. Glia–neuron interactions in the mammalian retina // Prog. Ret. Eye Res. 2016. V. 51. P. 1–40.
Ventura A.L.M., Santos-Rodrigues A.D., Mitchell C.H. et al. Purinergic signaling in the retina: From development to disease // Brain Res. Bull. 2019. V. 151. P. 92–108.
Verkhratsky A., Burnstock G. Biology of purinergic signalling: Its ancient evolutionary roots, its omnipresence and its multiple functional significance // Bio Essays. 2014. V. 36. № 7. P. 697–705.
Vessey K.A., Fletcher E.L. Rod and cone pathway signalling is altered in the P2X7 receptor knock out mouse // PLoS One. 2012. V. 7. № 1. Article № e29990.
Voelgyi B., Deans M.R., Paul D.L. et al. Convergence and segregation of the multiple rod pathways in mammalian retina // J. Neurosci. 2004. V. 24. № 49. P. 11182–11192.
Voigt J., Grosche A., Vogler S. et al. Nonvesicular release of ATP from rat retinal glial (Müller) cells is differentially mediated in response to osmotic stress and glutamate // Neurochem. Res. 2015. V. 40. № 4. P. 651–660.
Wan W., Cui D., Yang X. et al. Expression of adenosine receptors in human retinal pigment epithelium cells in vitro // Chin. Med. J. (Engl.). 2011. V. 124. № 8. P. 1139–1144.
Wang J.C.-C., Harris W.A. The role of combinational coding by homeodomain and bHLH transcription factors in retinal cell fate specification // Dev. Biol. 2005. V. 285. P. 101–115.
Ward M.M., Puthussery T., Vessey K.A. et al. The role of purinergic receptors in retinal function and disease // Adv. Exp. Med. Biol. 2010. V. 664. P. 385–391.
Wehrwein E., Thompson S.A., Coulibaly S.F. et al. Acetylcholine protection of adult pig retinal ganglion cells from glutamate-induced excitotoxicity // Invest. Ophthalmol. Vis. Sci. 2004. V. 45. № 5. P. 1531–1543.
Weick M., Wiedemann P., Reichenbach A. et al. Resensitization of P2Y receptors by growth factor–mediated activation of the phosphatidylinositol-3 kinase in retinal glial cells // Invest. Ophthalmol. Vis. Sci. 2005. V. 46. P. 1525–1532.
Wheeler-Schilling T.H., Marquordt K., Kohler K. et al. Identification of purinergic receptors in retinal ganglion cells // Brain Res. Mol. Brain Res. 2001. V. 92. P. 177–180.
Wu D.M., Kawamura H., Sakagami K. et al. Cholinergic regulation of pericyte-containing retinal microvessels // Am. J. Physiol. Heart Circ. Physiol. 2003. V. 284. № 6. P. 2083–2090.
Wurm A., Erdmann I., Bringmann A. et al. Expression and function of P2Y receptors on Muller cells of the postnatal rat retina // Glia. 2009. V. 57. P. 1680–1690.
Xia J., Lim J.C., Lu W. et al. Neurons respond directly to mechanical deformation with pannexin-mediated ATP release and autostimulation of P2X7 receptors // J. Physiol. 2012. V. 590. № 10. P. 2285–2304.
Xu H., Tian N. Glycine receptor-mediated synaptic transmission regulates the maturation of ganglion cell synaptic connectivity // J. Comp. Neurol. 2008. V. 509. № 1. P. 53–71.
Yang D., Chen J. The P2X7 receptor in AMD // Austin. J. Clin. Ophthalmol. 2014. V. 1. № 3. 1012.
Yegutkin G.G. Nucleotide- and nucleoside-converting ectoenzymes: Important modulators of purinergic signalling cascade // Biochim. Biophys. Acta. 2008. V. 1783. № 5. P. 673–694.
Zhang X., Zhang M., Laties A.M. et al. Balance of purines may determine life or death of retinal ganglion cells as A3 adenosine receptors prevent loss following P2X7 receptor stimulation // J. Neurochem. 2006. V. 98. № 2. P. 566–575.
Zhang S., Li H., Li B. et al. Adenosine A1 receptors selectively modulate oxygen-induced retinopathy at the hyperoxic and hypoxic phases by distinct cellular mechanisms // Invest. Ophthalmol. Vis. Sci. 2015. V. 56. № 13. P. 8108–8119.
Zhang X., Alhasani R.H., Zhou X. et al. Oxysterols and retinal degeneration // Br. J. Pharmacol. 2021. Jan 27. [Online ahead of print].https://doi.org/10.1111/bph.15391
Zhong Y., Yang Z., Huang W. C. et al. Adenosine, adenosine receptors and glaucoma: an updated overview // Biochim. Biophys. Acta. 2013. V. 1830. P. 2882–2890.
Zimmermann H., Zebisch M., Sträter N. Cellular function and molecular structure of ectonucleotidases // Purinergic Signal. 2012. V. 8. № 3. P. 437–502.
Дополнительные материалы отсутствуют.


