Онтогенез, 2022, T. 53, № 4, стр. 265-286
Астроциты мозга – свита делает короля
М. А. Александрова a, *, К. К. Сухинич a, **
a ФГБУН Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: mariaaleks@inbox.ru
** E-mail: transpl@hotmail.com
Поступила в редакцию 20.03.2022
После доработки 27.04.2022
Принята к публикации 30.04.2022
- EDN: WVYVNP
- DOI: 10.31857/S0475145022040024
Аннотация
В ткани мозга, помимо нейронов, есть множество других клеток, объединенных под названием глия. По современным данным у человека насчитывается примерно одинаковое число нейронов и глиальных клеток. Среди клеток глии, астроциты занимают особое место благодаря своей фантастической многофункциональности, которая все еще продолжает открываться с новых сторон. История изучения астроцитов насчитывает более сотни лет. За это время за ними прочно закрепилась роль опорных и обслуживающих клеток, и поэтому они всегда находились в “тени” нейронов. Новые молекулярно-генетические инструменты, позволяющие маркировать клетки, манипулировать ими in vitro и in vivo, контролируемо удалять гены и регулировать их экспрессию, а также новые методы визуализации клеток открыли широкие возможность для решения многих фундаментальных проблем. Благодаря им были сделаны два важных открытия: астроциты близки в функциональном отношении к нейронам, а также играют важную роль в восстановлении и регенерации мозга. В направлениях, связанных с каждым из этих открытий, активные исследования ведутся с 90-х годов прошлого века. Однако в каждом из них исследования шли самостоятельным путем, и они практически не пересекались. В этом нет ничего удивительного, так как современные исследования зачастую узко специализированы и погружаются в такую глубину, где теряется ощущение целостности объекта и проблемы. В случае с астроцитами примерно так и получилось. В одном направлении исследования, чрезвычайно важные для понимания функций мозга, были сфокусированы на физиологии астроцитов и их участия в регуляции синаптической активности нейронов. Исследования в рамках другого направления были связаны с изучением нейральных стволовых клеток. Благодаря им у астроцитов были обнаружены свойства стволовых клеток, а также способность репрограммироваться в нейроны. Массивы данных, полученных в ходе изучения астроцитов, огромны. Поэтому каждый из посвященных этим клеткам обзоров охватывает, как правило, лишь одну узкую тему. В связи с этим цель нашего обзора – объединение информации, полученной в рамках двух упомянутых направлений исследований. Благодаря этому будет сформировано наиболее полное представление о современном уровне знаний в области биологии астроцитов; будут намечены новые пути изучения нормального функционирования мозга и его реконструкции.
ВВЕДЕНИЕ. ОБЩАЯ ХАРАКТЕРИСТИКА АСТРОЦИТОВ
Во всех обзорах, посвященных глиальным клеткам, непременно указывается, что глия, впервые описанная Рудольфом Вирховым в 1846 г., изначально представлялась как однородная соединительная ткань, поддерживающая нервные клетки. Однако позже С. Рамон и Кахаль и другие исследователи описали в мозге морфологически разные типы и нервных и глиальных клеток. По современным данным у человека насчитывается примерно одинаковое число нейронов (86.1 млрд) и глиальных клеток (84.6 млрд), но их соотношение меняется в зависимости от области мозга (von Bartheld et al., 2016). В ЦНС к глии относится две категории клеток: макроглия (астроциты и олигодендроциты), клетки нейрального происхождения, и микроглия, клетки мезенхимного ряда. В неокортексе мозга человека отношение глия/нейрон 3.72 (60.8 млрд глии и 16.3 млрд нейронов), а в мозжечке 0.23 (16.1 млрд глии и 69.1 млрд нейронов). В отношении коры мозга известно, что соотношение глиальных клеток в ней следующее: олигодендроцитов 75.6%, астроцитов 17.3%, микроглии 6.5% (Pelvig et al., 2008).
Астроциты имеют множество разных, важных функций для поддержания жизнедеятельности нейронов и всей ткани мозга как в развитии, так во взрослой нервной системе, при старении и болезнях (Zhou et al., 2019; Ишунина и др., 2020). Традиционное представление об астроцитах сводилось к тому, что они выполняют опорную функцию, поддерживают ионный гомеостаз, обеспечивают структурную и защитную функции в ЦНС, участвуют в формировании гематоэнцефалического барьера. Эти характеристики дополнили новые удивительные открытия последних десятилетий (Verkhratsky, Nedergaard, 2018). Теперь очевидно, что дифференцированные астроциты через свои экстраординарные отростки взаимодействуют со многими тысячами синапсов и регулируют их функциональную активность. Астроциты занимают и обслуживают определенные пространственные домены в мозге, они экспрессируют глиотрансмиттеры, множество рецепторов, канальные белки и транспортеры, метаболически поддерживают нервные клетки, контролируют дыхание, участвуют в образовании синапсов и регуляции синаптической передачи вплоть до поддержания когнитивных процессов. Во многих работах поднимается вопрос о том, что в функциональном отношении астроциты становятся равными партнерами нервных клеток (Гомазков, 2019; Farhy-Tselnicker, Allen, 2018; Forsberg, Herlenius, 2019; Akdemir et al., 2020).
В дополнение к информационным функциям астроцитов, в последние годы раскрылась их регенеративная роль в мозге (Gotz, Bocchi, 2021). Благодаря открытию нейральных стволовых клеток (НСК) и детальному их изучению в развитии и во взрослом мозге сложилось понимание того, что НСК являются не чем иным как специализированными типами астроцитов (Kriegstein, Alvarez-Buylla, 2009). Более того, стволовые свойства обнаружились и в паренхимных астроцитах взрослого мозга, за что они получили название “латентных предшественников” (Alunni, Bally-Cuif, 2016). Несмотря на то, что нейроны и астроциты происходят от единого базального стволового предшественника, дифференцированные астроциты много пластичнее нейронов, они проявляют реактивность при повреждении, сохраняют эпигенетическую память и способность к пролиферации (Barker et al., 2018). Эти свойства в определенных условиях in vitro и in vivo позволяют астроцитам репрограммироваться в нервные клетки, что делает их чрезвычайно значимыми с точки зрения регенерации (Wang et al., 2021).
Формирование этих уникальных физиологических и регенераторных свойств непосредственно связано с развитием астроцитов, их морфофункциональной и молекулярной дифференцировкой. Поэтому в обзоре будут рассмотрены современные данные о генезе нервной ткани, молекулярные механизмы переключения с нейро- на глиогенез, развитие и дифференцировка астроцитов, участие в контроле синаптической активности и их пластические свойства, способность к репрограммированию в нейроны и способы ее регуляции.
РАЗВИТИЕ И СПЕЦИАЛИЗАЦИЯ АСТРОЦИТОВ
В мозге млекопитающих известно несколько путей возникновения астроцитов, и все они реализуются только после генерации нервных клеток. Нейроны возникают первыми, вслед за закрытием нервной трубки со стадии эмбриогенеза Э10–11 у мышей. По завершении нейроногенеза на Э17–18 начинает образовываться глия, и в первую очередь астроциты, что наиболее детально изучено в коре мозга у грызунов (McConnell, 1992; Noctor et al., 2004). У мышей в коре генерация нейронов завершается до рождения, и их число сохраняется вплоть до периода старения. По окончании генерации нейронов начинается астрогенез на Э17–18, а олигодендроциты обнаруживаются около момента рождения. Однако основная масса клеток обоих типов макроглии (астроциты и олигодендроциты) образуется в течение первого месяца постнатального развития, когда их число увеличивается в шесть–восемь раз. Считается, что механизм последовательной во времени генерации разных типов нейронов и глии жестко запрограммирован и опирается на эндогенные факторы (Qian et al., 2000). Подтверждается это тем, что такая же последовательность генерации клеток реализуется in vitro при культивировании ранних кортикальных клеток, выделенных из мозга эмбриона (Qian et al., 2000; Shen et al., 2006).
Все типы нейронов и макроглиальных клеток возникают из нейральных стволовых клеток (НСК), которые в онтогенезе меняют морфологию и молекулярные свойства, сохраняя стволовость. Изначально стволовыми свойствами обладают нейроэпителиальные клетки. Они генерируют первые нейроны и одновременно морфологически и молекулярно дифференцируются в клетки радиальной глии (РГ). Клетка РГ, собственно, и является базальным предшественником, нейральной стволовой клеткой, которая генерирует основные типы нейронов и глии в эмбриогенезе и в постнатальный период, когда она становится нейральной стволовой клеткой взрослого мозга (Kriegstein, Alvarez-Buylla, 2009).
За время эмбрионального развития клетки РГ изменяют свои генеративные свойства, морфологию и поведение. В период производства нейронов клетки РГ имеют биполярную форму, тело расположено в вентрикулярной зоне (ВЗ), базальный отросток прикрепляется к верхней пиальной поверхности, а апикальный к стенке желудочка эмбрионального мозга (Schmechel, Rakic, 1979; de Azevedo et al., 2003; Noctor et al., 2004). Путем симметричных и ассиметричных делений РГ поддерживает себя и продуцирует нейроны, затем она переходит к генерации глии, и первые астроциты появляются в коре мозга при асимметричном делении между поздней эмбриональной (Э17–Э18) и перинатальной стадией (Magavi et al., 2012) (рис. 1). Подобно нейронам, астробласты мигрируют вдоль радиального отростка материнской клетки РГ из вентрикулярной зоны в толщу коры (Rakic, 1972; Kriegstein, Alvarez-Buylla, 2009; Burns et al., 2009). По ходу миграции они претерпевают несколько циклов деления, в результате которых возникают множественные скопления астроцитов в одной и той же кортикальной колонке. В отличие от нейронов, тела которых уже находятся в дефинитивной позиции при терминальном делении, астроциты продолжают делиться по ходу миграции, в результате их дочерние клетки образуют популяцию астроцитов верхнего слоя в коре мозга (Ge, Jia, 2016).
Рис. 1.
Схема основных этапов нейрогенеза. Нейроны возникают из клеток нейроэпителия (NEP) и радиальной глии (R). Затем клетки радиальной глии переключаются на астрогенез (A). 1 – первая волна астрогенеза идет при ассиметричном делении R. 2 – при второй волне астрогенеза клетки радиальной глии напрямую, без деления, трансформируются в астроциты, которые активно пролиферируют и образуют популяции протоплазматических и фиброзных астроцитов соответственно. Подробное объяснение в тексте.
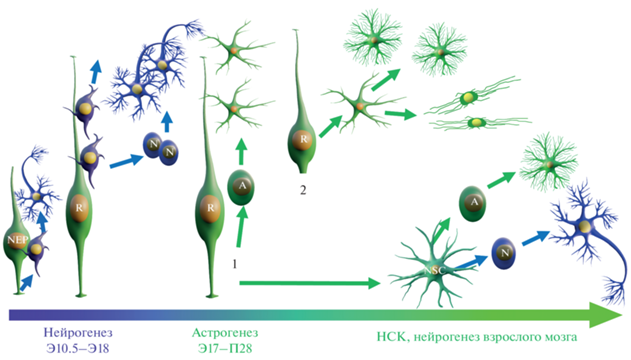
После окончания первого этапа генерации астроцитов при ассиметричном делении РГ, начинается вторая волна глиогенеза, когда клетки возникают иным путем, за счет прямой трансформации радиальной глии в астроциты уже без деления (рис. 1). При этом клетки радиальной глии втягивают апикальный отросток и открепляются от желудочка, подтягивают тело к верхней пиальной поверхности мозга, где превращаются в клетки переходной формы, которые дифференцируется в протоплазматические или фиброзные астроциты, распределяющиеся по серому (слои нейронов) и белому веществу (слои волокон) коры, соответственно (Noctor et al., 2004; Tabata, 2015; Ge, Jia, 2016). Прямая трансформация радиальной глии в астроциты считается эволюционно консервативным механизмом, она была детально документирована при картировании клеточной судьбы у Nestin-CreER мышей и прослежена у других видов млекопитающих (Voigt, 1989; Burns et al., 2009).
Возникшие из РГ астроциты симметрично делятся, и скорость их пролиферации усиливается вплоть до 10 постнатального дня у мышей, и общее их количество увеличивается вплоть до конца первого месяца жизни. В этот период делятся уже дифференцированные клетки, за счет чего возникает около половины всей популяции астроцитов в ЦНС (Bandeira et al., 2009; Ge, Jia, 2016). Так как астроциты образуются и развиваются в окружении нервных клеток, интересен тот факт, что число астроцитов коррелирует с уровнем сенсорной активности нейронов в данной области мозга. В экспериментах со зрительной депривацией показано, что выращенные в темноте мыши имеют низкую в сравнении с контрольными животными плотность астроцитов в зрительной коре и повышенную в слуховой коре (Stogsdill et al., 2017). Эти тонкие сенсорные взаимодействия нейронов и астроцитов поднимают вопрос о том, что нарушения развития и дисфункция астроцитов могут лежать в основе ряда психических расстройств, например, таких как шизофрения и заболевания аутистического спектра (Sloan, Barres, 2014).
Основную популяцию астроцитов мозга составляют протоплазматические и фиброзные клетки. К ним еще добавляется несколько типов специализированных астроцитов: клетки РГ, клетки Мюллера в сетчатке и клетки Бергмана в мозжечке, поверхностные астроциты, астроциты гипоталамуса, астроциты у мозговой оболочки (glia limitans), на границе в третьем желудочке, питуициты нейрогипофиза и взрослые нейральные стволовые клетки (Verkhratsky, Nedergaard, 2018).
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ, ЛЕЖАЩИЕ В ОСНОВЕ ГЕНЕРАЦИИ АСТРОЦИТОВ
Астроциты появляются вслед за нейронами из тех же предшественников, поэтому главным для определения их судьбы является подавление нейрогенной программы в стволовых клетках РГ и активация астроцитарных генов. Здесь требуется четкое переключение между нейро- и астрогенезом от которого зависит образование определенного числа клеток обоих типов и формирование нейронных сетей. Определением судьбы материнской РГ управляют многие внешние сигналы и внутренние механизмы, приводящие к понижению нейрогенных и усилению астрогенных компетенций РГ со временем развития. Для выяснения конкретных механизмов были использованы многие методы: оригинальные системы культивирования клеток, нокаутные и трансгенные мыши, электропорация плазмид in vivo, иммуногистохимия и т.д., что детально описано в обзоре (Miller, Gauthier, 2007). В период нейроногенеза канонический путь экспрессии астроцитарных генов ингибирован сигнальными путями JAK/STAT, что предотвращает преждевременную дифференцировку астроцитов (Kanski et al., 2014). Механизмы, регулирующие подавление пронейральных генов Ngn1, Ngn 2, NeuroD1, Mash1 и др., в достаточной степени изучены (Miller, Gauthier, 2007; Kriegstein, Alvarez-Buylla, 2009; Verkhratsky, Nedergaard, 2018). Роль основных регуляторов выполняют сигнальные пути JAK-STAT, Notch и BMP-SMAD (Namihira et al., 2009) (рис. 2). В начальный период сигнальный путь Notch индуцирует ремоделирование астроцитарных генов, что изменяет компетентность материнской РГ. Notch подавляет нейроногенез связываясь с промотором астроцитарного гена GFAP, это защищает его от DNMT1-зависимого метилирования (Deneen et al., 2006; Namihira et al., 2009). Цитокины LIF, CNTF и CN-1 активируют сигнальный путь JAK/STAT (Bonni et al., 1997; He et al., 2005; Duong et al., 2019). В дополнение активируются транскрипционные факторы sox9 и NF1A (Kang et al., 2012). Модуляторное влияние оказывают сигнальные молекулы WNT, BMP и SHH, которые подавляют пронейральные гены Ngn1 и Ngn 2 в клетках радиальной глии (Freeman, 2010). Ядерный фактор NF1A индуцирует GLAST в прогениторах глиальных клеток (Namihira et al., 2009). Регуляторная активность всех этих факторов приводит к деметилированию и экспрессии специфических генов астроцитов, таких как GFAP, GLAST и S100 β (Kanski et al., 2014; Molofsky, Deneen, 2015). В развивающейся коре мозга грызунов астроцит-специфические гены в норме начинают деметилироваться на Э14.5, однако астроциты удается выявить по морфологическим и молекулярным признакам начиная с Э17–18 (Natada et al., 2008) и только с использованием определенных маркеров.
Рис. 2.
Три сигнальных пути JAK-STAT, Notch и BMP-SMAD определяют эмбриональное развитие астроцитов. Факторы CNTF, LIF, CT-1 отвечают за инициацию глиогенеза, они активируют канонический сигнальный путь JAK/STAT, что стимулирует транскрипцию астроглиальных генов. Сигнальные пути JAK/STAT и Notch действуют синергетически. Notch также участвует в деметилировании и, следовательно, в эпигенетической регуляции астроцитарных генов во время дифференцировки. Сигнальный путь Notch способствует астрогенезу путем прямой активации промотора GFAP. Лиганды BMP связываются с соответствующими рецепторами и индуцируют фосфорилирование SMAD и его димеризацию с SMAD4, которые в комплексе являются активатором транскрипции астроцитарных генов GFAP и S100β.

МАРКЕРЫ АСТРОЦИТОВ
Идентификация астроцитов является не самой простой задачей. Это связано с тем, что на разных этапах дифференциации и функционального состояния уровень экспрессии маркерных белков меняется и, кроме того, маркеры могут быть общими с другими типами клеток мозга. Отсутствие четких маркеров, как для предшественников, так и для промежуточных стадий дифференциации осложняет анализ развития астроцитов и природы их гетерогенности (Holst et al., 2019). Еще более усложняет характеристику то, что астроциты очень пластичны и размножаются после спецификации (Ge, Jia, 2016).
Одним из наиболее важных и часто используемых маркеров, является глиальный фибриллярный кислый белок (GFAP), который обеспечивает структурную стабильность и подвижность астроцитов. В мозге грызунов в норме высокий уровень экспрессии GFAP характерен для фиброзных астроцитов и очень низкий для протоплазматических, поэтому GFAP не годится для обнаружения всей популяции астроцитов. Интересно, что когда для прослеживания дифференцировочной судьбы астроцитов были созданы трансгенные линии мышей GFAP-Cre, то оказалось, что у них одновременно с астроцитами маркируются и нейральные стволовые клетки (Zhuo et al., 2001; Garcia et al., 2004). Экспрессия GFAP традиционно используется как индикатор созревания астроцитов. Именно на основе анализа GFAP получены данные о механизмах дифференцировки астроцитов и идентифицированы сигнальные пути JAK-STAT, BMP и Notch в качестве центральных регуляторов их дифференцировки из клеток-предшественников (Bonni et al., 1997; Barnabé-Heider et al., 2005). Несмотря на это, все еще остаются вопросы относительно маркирования GFAP в процессе развития. Например, нет понимания того, почему у приматов, включая человека, в коре мозга клетки РГ экспрессируют GFAP уже в самом начале нейрогенеза, тогда как у грызунов он начинает экспрессироваться, когда нейрогенез практически завершен (Holst et al., 2019; Allerano et al., 2021).
Среди генов-маркеров, которые экспрессируются в ходе дифференцировки астроцитов выделяют белки, связанные с мембраной GLT1, Cx43, Cx30, Kir4.1 и Aqp4; цитоплазматические белки GFAP, S100b, AldoC и GS, и секреторные белки Thbs1, Gpc4, Gpc6, Hevin и SPARC (Raponi et al., 2007; Allen, Eroglu, 2017; Farhy-Tselnicker, Allen, 2018; Akdemir et al., 2020). Аквапорин 4 (AQP4) и коннексины (Cx43, 30) используются для выявления контактов отростков-ножек астроцитов, однако они также экспрессируются в нейронах, олигодендроцитах и эпендимных клетках. Хотя транспортеры глутамата GLT-1, GLAST экспрессируются в астроцитах и нейронах, считается, что все же 80% общего белка GLT-1 определяется в астроцитах гиппокампа (Furness et al., 2008). Большей специфичности маркирования удалось достичь на трансгенных мышах. Миллер использовал специфическую область промотора GLT-1 для создания трансгенных мышей, на которых обнаружил новые типы астроцитов в сером веществе в коре мозга (Miller et al., 2019). На мышах, полученных при скрещивании линий Aldh1L1-GFP с EAAT2-tdtomato удалось выявить селективную популяцию астроцитов, локализованных в слоях I и II в коре (Morel et al., 2019).
Интересно, что астроциты мозга человека хорошо распознаются антителами к мембраносвязанному белку CD44, которые выявляют детали их морфологии до такой степени, которая невозможна для антител к GFAP (Sosunov et al., 2014). Недавно представлен новый поверхностный маркер астроцитов человека CD49f, не связанный с их реактивностью, который можно применять для выявления фетальных и iPSC астроцитов человека (Barbar et al., 2020). Транскрипционный фактор Sox9 определен как специфичный маркер астроцитов взрослого мозга, в отличие от фактора NFIA, который обнаруживается в некоторых классах нейронов и клетках-предшественниках олигодендроцитов (Sun et al., 2017).
ДИФФЕРЕНЦИРОВКА АСТРОЦИТОВ
По окончании фазы пролиферации астроциты проходят поэтапное созревание, когда транзиторные популяции приобретают уникальные морфологические и молекулярные свойства. Исследования генетических траекторий клонов предшественников астроцитов в спинном мозге мышей in vivo и на клетках человека in vitro с применением молекулярного профилирования выявили двухфазную модель индукции генов. На ранней фазе экспрессируются гены клеточного цикла и цитоскелета, а в более поздней, канальные и метаболические гены. Интересен тот факт, что в дифференцированных астроцитах обнаружена экспрессия многих генов активных в раннем развитии, это предполагает сохранение ими ювенильных черт и пластичности (Zhang et al., 2016).
За время развития нейроморфологии были охарактеризованы сотни типов нервных клеток, в то время как паренхимные астроциты, несмотря на морфологическую и функциональную неоднородность, продолжают классифицировать на два типа: протоплазматические и фиброзные в зависимости от структуры и расположения (Sofroniew, Vinters, 2010). Протоплазматические астроциты занимают пространство среди нервных клеток. Те из них, которые располагаются между нейронами и эндотелиальными клетками сосудов являются частью, так называемой нейро-васкулярной единицы (Iadecola, 2017; Stackhouse, Mishra, 2021).
В настоящее время стало ясно, что протоплазматические астроциты развивают намного более сложную сеть отростков, чем полагали ранее. Через неделю после появления клетки имеют мало отростков, через две недели число ветвлений и объем занимаемых ими территорий значительно увеличивается, а к концу третьей недели на отростках образуется множество новых точек роста, от которых вырастают крошечные дистальные выросты, перисинаптические астроцитарные отростки (ПАО). Эти отростки размером менее 50 нм придают клетке “губчатую” морфологию и не выявляются GFAP (Bushong et al., 2004; Freeman, 2010). В это же время наложение друг на друга основных отростков у соседних астроцитов становится минимальным, и клетки распределяются по четким территориям (Bushong et al., 2002; Halassa et al., 2007; Farhy-Tselnicker, Allen, 2018). При этом посредством щелевых контактов между отростками, астроциты объединяются в мелкие и крупные сети. Например, в сером веществе коры мозга сети образуются из 50–100 астроцитов, объединенных вместе (Houades et al., 2008).
Перисинаптические астроцитарные отростки подрастают к синапсам и образуют с ними тесный контакт (Farhy-Tselnicker, Allen, 2018). В сером веществе коры мозга ПАО имеют разветвления, которые охватывают пре- и постсинапсы, а кроме того, образуют прямые контакты с капиллярами, так называемыми перикапиллярными отростками или ножками астроцитов (endfeet). ПАО одного астроцита контактируют со многими тысячами синапсов, активность которых они модулируют посредством двунаправленной сигнализации. ПАО охватывают синапсы в различной степени в зависимости от области мозга и нервной сети. Например, в коре мозжечка ПАО клеток Бергмановской глии (специализированные астроциты мозжечка) полностью покрывают большинство синапсов, тогда как в области CA1 гиппокампа ПАО проникают лишь в половину синапсов и только частично (Santello et al., 2019). Несмотря на развитие современных высокоточных методов, детальная морфологическая классификация подтипов протоплазматических астроцитов затруднена. Сложные структуры ПАО плохо поддаются микроскопическому анализу, однако, прогресс в развитии методов визуализации позволит решить эту проблему (Носова и др., 2021; Minge et al., 2021).
ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ АСТРОЦИТОВ
Астроциты – электрически не возбудимые клетки, которые используют специфические механизмы влияния на формирование и функционирование синапсов, как во время развития, так и у взрослых млекопитающих. Одним из основных мессенджеров являются Ca2+ волны, которые играют роль посредника в коммуникации между астроцитами, астроцитами и нейронами и, между астроцитами и другими глиальными клетками (Torres, 2012; Швалев и др., 2018). Нарушение нормального баланса кальциевых ионов в астроцитах сопровождает многие патологические проявления в ЦНС, в частности, такие как эпилепсия и болезнь Паркинсона (Гомазков, 2019; Walrave et al., 2020; Bantle et al., 2021). Перисинаптические отростки астроцитов несут многие метаботропные и ионотропные рецепторы к нейромедиаторам, благодаря которым способны отслеживать текущее функциональное состояние синапса. Активация этих рецепторов генерирует динамические Ca2+ волны, которые наблюдаются как в клеточных телах, так и в дистальных отростках астроцитов (Allen, Eroglu, 2017; Браже и др., 2019). Скорости распространения кальциевых волн различаются в ПАО и в соме с крупными ветвями. Астроциты дифференциально реагируют на активность синапсов, с которыми связаны тонкими отростками, и других, где, они взаимодействуют с глобальными популяциями клеток через крупные отростки (Khakh, Sofroniew, 2015; Farhy-Tselnicker, Allen, 2018).
Важнейшей формой ответа астроцита на нейротрансмиттеры является повышение уровня внутриклеточного кальция, что, в свою очередь, может приводить к высвобождению из астроцитов молекул-передатчиков, таких как глутамат, D-серин, АТФ/аденозин или ГАМК, называемых глиотрансмиттерами (Araque et al., 2014). Для функции мозга чрезвычайно важно, что глиотрансмиттеры могут модулировать активность не только самих астроцитов, но и окружающих их нейронов (Papouin et al., 2017). Здесь нужно подчеркнуть, что кальциевые волны, которые генерируют астроциты, медленнее, чем нейротрансмиссия в нервных клетках, поэтому возникает немало вопросов об особенностях их регуляторной функции. Улучшенные методы кальциевой визуализации обнаружили пространственно-временное разнообразие астроцитарных Ca2+ сигналов, которые могут лежать в основе способности астроцитов кодировать и обрабатывать различные паттерны синаптической активности (Bindocci et al., 2017).
Астроциты, располагающиеся во всех слоях и всех областях коры мозга взрослых млекопитающих, функционально различаются, это связывают как с их происхождением, так и расположением в мозге (Lozzi et al., 2020). Гетерогенность может закладываться в раннем развитии и быть связанной с тем, что клетки нейроэпителия представляют смесь предшественников, возникших в разное время в разных областях нервной трубки (Bayraktar et al., 2014). Кроме того, сами астроциты возникают разными путями и в разное время, что так же предопределяет их гетерогенность. Протоплазматические и фиброзные астроциты образуются из различных линий предшественников, что показано с использованием ретровирусных векторов для прослеживания судьбы клеток и иммуногистохимии (Parnavelas, 1999; Garcia-Marques, Lopez-Mascaraque, 2013). Кроме того, различия в фенотипах протоплазматических астроцитов связывают не только с пространственным локусом их происхождения, но и с типом клетки материнской РГ. Распределение астроцитов по регионам мозга идет вслед за нейронами, в результате чего формируются структуры, содержащие оба типа клеток. Ранее считалось, что в коре мозга астроглиальные клоны мигрируют радиально по отростку РГ вслед за нейронами и остаются в пределах той же самой колонки (Magavi et al., 2012). Однако сейчас методом секвенирования РНК единичных клеток (scRNA-seq) с пространственной реконструкцией в коре головного мозга взрослых мышей и человека обнаружено наличие слоев астроцитов, не совпадающих со слоями нейронов (Bayraktar et al., 2020). Очевидно, что гетерогенность астроцитов намного шире, и она только начинает открываться благодаря современным методам молекулярно-генетического анализа.
Если кортикальные астроциты быстро размножаются в течение первой постнатальной недели, то динамика пролиферации астроцитов в подкорковых областях мозга мышей иная. В гипоталамусе обнаружено меньшее число пролиферирующих астроцитов по сравнению с корой в течение первой постнатальной недели, однако с П15 по П30 она становится более активной, чем в коре и по проценту пролиферирующих астроцитов, и по плотности их расположения (Shoneye et al., 2020). В спинном мозге клетки РГ переключаются на генерацию глии (примерно на Э12.5 у мыши), что регулируется фактором Scl (также известным как Tal1) из семейства bHLH и гомеодоменными белками Pax6 и Nkx6.1. Экспрессия Scl, ограниченная вентральным p2-доменом, способствует генерации астроцитов и, одновременно, подавляет продукцию транскрипционного фактора Olig2 и олигодендроцитов (Muroyama et al., 2005). Экспрессия Pax6 и Nkx6.1 разграничивает домены p1, p2 и p3, что приводит к выделению трех молекулярно различных субпопуляций астроцитов в белом веществе спинного мозга (Hochstim et al., 2008). Молекулярное и функциональное разнообразие астроцитов регулируют паттерны сигналов, распределенные в пространстве и времени, которые к настоящему не совсем определены и требуют тонкого методологического решения (Lozzi et al., 2020).
АСТРОЦИТЫ – УНИКАЛЬНЫЕ РЕГУЛЯТОРЫ АКТИВНОСТИ СИНАПТИЧЕСКОЙ ПЕРЕДАЧИ
Среди многочисленных детально охарактеризованных функций астроцитов, их взаимодействие с нейронами посредством регуляции активности синапсов с предполагаемым вкладом в обработку информации и когнитивные процессы, сегодня активно изучается и остро дискутируется (Santello et al., 2019). К настоящему времени многими исследованиями доказано, что протоплазматические астроциты с их тончайшими перисинаптическими отростками, которые несут множество рецепторов, являются неотъемлемыми функциональными элементами синапсов (Шушарина и др., 2018; Khakh, Deneen, 2019). Тесно контактируя с пре- и постсинапсами нейронов через ПАО, астроциты активно участвуют в утилизации, рециркуляции и синтезе нейротрансмиттеров. Их способность быстро удалять избыток нейротрансмиттеров из синаптической щели гарантирует эффективность синаптической передачи и поддержание возбудимости нейронов.
В мозге глутамат является одним из важнейших возбуждающих нейротрансмиттеров, однако его избыток чрезвычайно токсичен для нейронов. Число глутаматергических синапсов, контактирующих с астроцитами, различается в разных отделах мозга: от 60–90% в мозжечке, 90% в области поля баррелов в коре, 50–90% в гиппокампе и 80% в стриатуме (Farhy-Tselnicker, Allen, 2018). Астроциты захватывают глутамат из синаптической щели используя транспортер GLT-1 и EAAT и перерабатывают в глутамат-глутаминовом цикле (Bak et al., 2006; Allen, Eroglu, 2014).
Астроциты очень чувствительны к активности глутаматергических нейронов и в норме постоянно регулируют синаптическую передачу и пластичность в этих синапсах (Angulo et al., 2004). Однако если, например, при патологии нарушается обратный захват глутамата астроцитами, то из-за его переизбытка в межклеточном пространстве может активироваться токсическое повреждение нейронов (Коломеец, 2015; Limbad et al., 2020). Имеется достаточно доказательств того, что астроциты способны регулировать синаптическую активность, вызванную и другими нейротрансмиттерами, такими как, ГАМК, ацетилхолин, АТФ и норадреналин во многих отделах мозга (Zorec et al., 2012).
После поглощения астроцитами глутамат метаболизируется с участием фермента глутаматдегидрогеназы (GDH), у большинства млекопитающих он присутствует в форме GDH1, тогда как у человека обнаружены две изоформы GDH1 и 2 (Zhang et al., 2016). Исключительная экспрессия двух изоформ фермента в мозге человека означает усиленное окисление глутамата и эффективный глутамат-глутаминовый цикл, свидетельствующий о более устойчивой глутаматергической активности.
Интересно, что астроциты выступают не только в роли регуляторов глутаматергических синапсов во взрослом мозге, но и непосредственно участвуют в их формировании при развитии (Shan et al., 2021). Как уже было сказано, астроциты массово возникают в коре мозга в период постнатального развития, когда идет активное развитие аксонов и дендритов нервных клеток. Именно в это время незрелые астроциты экспрессируют нейротрофические и синаптогенные факторы. Среди них NGF, BDNF, GDNF и тромбоспондин, хевин, глипикан, TNFa, WNT, TGFb, SPARC, холестерин, хондроитинсульфат протеогликан, которые поддерживают рост аксонов и дендритов (Allen, Eroglu, 2017), и стимулируют формирование и функционирование глутаматергических синапсов, доминирующих в коре мозга (Verkhratsky, Nedergaard, 2018).
Чрезвычайно важно, что отростки астроцитов одновременно с формированием контактов с синапсами, подрастают к кровеносным сосудам и капиллярам, полностью покрывая их к 20 дню после рождения, что завершает построение гематоэнцефалического барьера и образование нейро-васкулярных единиц (Blanchette, Daneman, 2015; Kugler et al., 2021). Благодаря этим контактам формируются тонкие взаимоотношения астроцитов с эндотелием сосудов, посредством которых они регулируют энергетический обмен и кровоток, используя кальциевые волны и другие механизмы.
По результатам вышеприведенных работ сложилась новая концепция о “трехчастном синапсе” (Tripartite synapses) (Araque et al., 1999; Perea et al., 2009; Гомазков, 2019), в основе которой лежит представление о том, что астроциты не просто изолируют синапсы своими отростками, а воспринимают и активно регулируют синаптическую активность. В соответствие с этой концепцией, астроциты становятся участниками передачи информации в нейронных сетях, так как в ответ на активность нейронов в синапсах, они регулируют синаптическую передачу. В их функцию входит: удаление из синаптической щели глутамата (или другого трансмиттера), его транспортировка и переработка; регуляция кровотока и захват глюкозы из капилляров с переносом полученных продуктов (глютамина и лактата) обратно в пресинапс (рис. 3). Все это обеспечивает длительность синаптической передачи и поддержание долговременной потенциации (Tang et al., 2014; Farhy-Tselnicker, Allen, 2018; Perez-Catalan et al., 2021). Эти взаимодействия дополняются еще и нейротрофической поддержкой, например, BDNF, созревание которого регулируется астроцитами, что необходимо для стабилизации синаптической передачи (Vignoli et al., 2021). В настоящее время концепция “трехчастного синапса” находит множество экспериментальных подтверждений. Есть данные о том, что долговременная потенциация (LTP) в гиппокампе связана с изменением пространственных отношений между ПАО и синапсами, показано, что бóльшее количество ПАО тесно контактируют с активированными синапсами во время индукции LTP (Bernardinelli et al., 2014; Santello et al., 2019). Известно, что передача сигналов норадреналина через β-рецепторы, которая способствует консолидации памяти, происходит при высвобождении лактата из астроцитов. Гликоген, запасенный в астроцитах и переработанный в лактат, энергетически обеспечивает молекулярные изменения в нейроне, необходимые для формирования долговременной памяти (Tang et al., 2014; Gao et al., 2016). Активность астроцитов в синаптических контактах влияет на стабилизацию синаптической передачи и долговременную потенциацию, и соответственно на процессы обучения и памяти (Wade et al., 2011; Loprinzi, 2019; Vignoli et al., 2021; Zhang et al., 2021). Важно, что в дополнение к стабилизации синапсов, астроциты играют важную роль в их элиминации, так же зависящей от активности нейронов (Lee et al., 2021). Эта фагоцитарная функция расширяет возможности астроцитов в регуляции синаптических взаимодействий между нейронами.
Рис. 3.
Трехчастный синапс. Участие астроцита в регуляции активности синапса. Перисинаптические отростки астроцита окружают синапсы и захватывают глютамат (красные кружки) из синаптической щели, который, в свою очередь, активирует в астроците повышение внутриклеточного Са2+ и выброс глиотрансмиттеров (малиновые звездочки). Другими отростками астроцит захватывает глюкозу из капилляра. В результате астроцит осуществляет метаболическую и глиотрансмиттерную регуляцию активности синапса.

В недавно вышедшем обзоре, где обсуждается функция астроцитов в переработке информации и когнитивных нарушениях, авторы выделяют несколько уровней синаптической сигнализации астроцитов (Santello et al., 2019). Во-первых, нано уровень, где сигнал от ПАО влияет на синаптическую активность и пластичность на уровне точечных локальных взаимодействий. Во-вторых, микро уровень, когда один астроцит координирует синаптические ансамбли, находящиеся на его территории. В-третьих, уровень синцития, когда пространственно разные группы астроцитов (объединенные щелевыми контактами) формируют функциональные домены соответственно нескольким нейрональным сетям, и совместно координируют их возбудимость и энергетические потребности. И, наконец, четвертый мезо уровень, когда астроциты из нескольких областей мозга согласованно реагируют на активность дистантных нервных волокон и тем самым оказывают генерализованное влияние на состояние мозга (Santello et al., 2019). Хотя астроциты не могут модулировать синапсы в масштабе времени синаптических событий, считается, что их более медленные Ca2+ волны регулируют базовые свойства синапса, высвобождение медиатора и постсинаптическую возбудимость. Накопленные за последние десятилетия данные указывают на то, что механизмы и функциональные последствия передачи сигналов в системах астроцит-нейрон много сложнее, чем думали изначально (Perez-Catalan et al., 2021). Острые дискуссии возникают в связи с тем, что новые данные ставят под сомнение традиционную парадигму, согласно которой функция мозга является исключительно результатом деятельности нейронных сетей. Новая концепция постулирует, что функция нервной системы фактически возникает в результате совместной активности нейро-глиальных сетей (Adamsky et al., 2018; Farhy-Tselnicker, Allen, 2018; Santello et al., 2019). Конечно, есть много веских причин полагать, что у астроцитов и так достаточно важных функций, чтобы не претендовать на когнитивную деятельность (Verkhratsky, Nedergaard, 2018). Тем не менее, уже сейчас очевидно, что астроциты выходят из “тени” нервных клеток и становятся их равными партнерами. Межклеточная коммуникация нейронов и глии и их сетевые взаимодействия широко исследуются, поскольку они могут открыть новые пути к познанию функции мозга.
УЧАСТИЕ АСТРОЦИТОВ В ПОВРЕЖДЕНИИ МОЗГА И РЕГЕНЕРАЦИИ
Совершенно иная, но не менее интригующая функция астроцитов связана с их способностью к пластическим перестройкам и участию в регенерации нервной системы. Хорошо известно, что в мозге постмитотические клетки, такие как нейроны и олигодендроциты, не могут возобновить деление даже после травмы, и подвергаются полиплоидии или гибели при активации генов клеточного цикла (Arendt, 2012). В нормально функционирующем мозге астроциты так же находятся в стабильном состоянии, но в ответ на травму они резко повышают уровень экспрессии GFAP в отростках, изменяют молекулярные свойства и пролиферируют, активируя каскад внутриклеточных изменений, который получил название реактивный глиоз (Sofroniew, Vinters, 2010). Глиоз модулируется цитокинами, среди них наиболее детально изучены роли интерлейкина-1бета (IL-1β), интерферона (IFNγ) и трансформирующего фактора роста бета 1 (TGF-β1) (John et al., 2003). Традиционно реактивный астроглиоз рассматривается как процесс, приводящий к патологическим изменениям в ЦНС (Sofroniew, Vinters, 2010; Robel et al., 2015). На границе зоны повреждения астроциты образуют барьер из своих клеточных тел и отростков, который блокирует рост аксонов и нормальное проведение импульсов, и может служить причиной развития ряда заболеваний мозга, например, эпилепсии (Robel et al., 2015). При незначительных повреждениях астроциты увеличивают отростки и активируют в них экспрессию GFAP, образуя узкие плотные волоконные рубцы, а при обширных травмах клетки начинают пролиферировать через 3–5 сут после травмы, и многие повторно входят в клеточный цикл через неделю (Susarla et al., 2014). Например, в зонах мозга, окружающих очаг поражения после инсульта, идет пролиферация астроцитов и обширное разрастание их отростков далеко за пределы их собственной стабильной территории. Новые границы отделяют и изолируют поврежденную ткань от соседней жизнеспособной нервной ткани, что может приводить к изменению архитектуры ткани и функции мозга (Sofroniew, Vinters, 2010; Sofroniew, 2020). При тяжелых поражениях мозга в астроцитах повышается экспрессии не только генов, кодирующих GFAP, но и S100ƅ, Aldh1l1 генов, происходит гипертрофия клеточных тел и отростков. Более того, часто наблюдается взаимодействие реактивных астроцитов с другими типами клеток (например, фибробластами), совместно образующими сложный глио-мезодермальный рубец (Sofroniew, Vinters, 2010).
Молекулярные исследования реактивных астроцитов при различных повреждения мозга показывают изменения транскриптомов, которые существенно различаются как по числу, так и по типам генов, экспрессия которых меняется (Zamanian et al., 2012). Основные изменения обнаружены в генах, кодирующих белки внеклеточного матрикса, что показывает способность реактивных астроцитов модифицировать микроокружение в процессе формирования глиального рубца. В реактивных астроцитах высоко экспрессируются гены не только GFAP, но и гены виментина и нестина, что свидетельствует о понижении уровня их дифференцировки вследствие травмы (Цыба и др., 2020). Другие группы генов, экспрессия которых повышена в реактивных астроцитах, кодируют цитокины, белки презентации антигена и пути комплемента, указывая на роль астроцитов в иммунной реакции при повреждении. В то же время считается, что однозначно интерпретировать эти результаты затруднительно, поскольку транскриптомы могут меняться и на разных стадиях развития патологического процесса, например, в разное время после инсульта (Zamanian et al., 2012). Хотя представления о механизмах этих процессов далеко не полны, а порой противоречивы, доминирующая точка зрения сводится к тому, что реактивные астроциты провоцируют нейротоксичность, воспаление, увеличение уровней провоспалительных факторов (таких как интерлейкины, IFN-γ, TGFβ, ROS, NO), глутамата, S100b, а глиальные рубцы рассматриваются как блокаторы регенерации аксонов (Becerra-Calixto, Cardona-Gómez, 2017).
Однако из каждого правила есть исключения, и в ряде случаев реакция глии может быть позитивной, активирующей восстановление и регенерацию нервной ткани (Li et al., 2008; Sofroniew, Vinters, 2010; Sofroniew, 2020). Предполагается, что реактивные астроциты способны приобретать свойства малодифференцированных клеток, и благодаря высвобождению нейротрофических (NGF, BDNF, CNTF), ангиогенных факторов (VEGF), и модуляции иммунного ответа способствуют выживанию нейронов и ангиогенезу (Goss et al., 1998; Burns et al., 2009; Zamanian et al., 2012). Помимо того, они экспрессируют аполипротеин-Е (АПОЕ), тромбоспондин, SPARK и хевин, которые совместно с нейротропными факторами активируют синаптогенез и развитие новых синаптических контактов на нейронах в области повреждения (Chiareli et al., 2021).
Таким образом, реактивные астроциты, помимо негативного влияния, при определенных обстоятельствах оказывают нейропротекторное и противовоспалительное действие. В этих случаях они проявляют пластичность и демонстрируют свойства постнатальных астроцитов, которые обеспечивают появление новых синапсов и их поддержание, рост нейронов и реорганизацию нейронных сетей (Becerra-Calixto, Cardona-Gómez, 2017).
ПЛАСТИЧНОСТЬ АСТРОЦИТОВ ВЗРОСЛОГО МОЗГА
Базой для раскрытия пластических свойств астроцитов послужили исследования в области нейральных стволовых клеток. Фундаментальный вклад в изучение астроцитов в онтогенезе внесли Магдалена Гётц и ее сотрудники. Прослеживая изменения реактивных астроцитов in vivo, они установили, что именно дифференцированные астроциты, а не циркулирующие глиальные предшественники (NG2), отвечают на повреждение мозга гипертрофией, повышением уровня GFAP и пролиферацией (Mori et al., 2005). Более того, когда эти реактивные астроциты помещали в культуру in vitro на среды для стволовых клеток, они образовывали нейросферы и вели себя как нейральные стволовые клетки (Buffo et al., 2008). Продолжая исследование уже с генетическим картированием клонов реактивных астроцитов в коре мозга взрослых мышей при травме in vivo, было обнаружено, что, хотя большинство пролиферирующих клеток вновь возвращается к судьбе астроцитов, некоторые приобретают свойства стволовых клеток (Buffo et al., 2008). Вслед за этой пионерской работой, многими было показано, что астроциты в реактивном состоянии дедифференцируются и проявляют свойства нейральных стволовых клеток (Robel et al., 2011; Shimada et al., 2012; Sirko et al., 2013; Dimou, Gotz, 2014; Magnusson et al., 2014).
Естественно, возник вопрос, какова природа пластичности и нейрогенных потенций взрослых астроцитов? Ответ на него находится в хорошо документированных исследованиях стволовых клеток при развитии нервной ткани. Из них становится ясно, что клетки нейроэпителия, стволовые клетки радиальной глии, астроциты и НСК взрослого мозга являются единой линией клеток, сочетающих глиальные и стволовые свойства (Doetsch, 2003; Mori et al., 2005; Kriegstein, Alvarez-Buylla, 2009). Сегодня доказано, что клетки нейроэпителия переходят в стволовые клетки радиальной глии, которые генерируют нейроны и затем глию, после чего РГ сама трансформируется в астроциты, расселяющиеся по всему мозгу. Небольшая часть клеток РГ сохраняется в специализированных нишах, где они функционируют уже как стволовые клетки взрослого мозга (Doetsch et al., 1999; Merkle et al., 2004). НСК взрослого мозга являются специализированными астроцитами, несущими ключевые морфологические и молекулярные характеристики нейроэпителия, включая экспрессию маркеров nestin, BLBP и Sox2 (Shen et al., 2008; Tavazoie et al., 2008). Они обеспечивают постоянное восстановление нейронов и глии в нейрогенных областях взрослого мозга (Bayraktar et al., 2014). Помимо НСК, оказалось, что и паренхимные астроциты, находящиеся вне нейрогенных ниш, при повреждении могут проявлять повышенную пластичность, подобную НСК, и продуцировать нейроны (Buffo et al., 2006; Sirko et al., 2013; Sofroniew et al., 2015). Было проведено сравнение НСК субвентрикулярной зоны с паренхимными астроцитами стриатума и коры мозга мышей путем секвенирования РНК единичных клеток (scRNA-seq). Исследование показало значимую общность в генах НСК и астроцитов, в которых прослеживается континуум от астроцитов к покоящимся стволовым клеткам и далее к активированным стволовым клеткам (Llorens-Bobadilla et al., 2015). Активацию транскрипционной программы стволовых клеток в паренхимных астроцитах связывают с тем, что они обладают многими общими свойствами и имеют схожие транскрипционные сети с НСК взрослого мозга (Magnusson et al., 2020). Астроциты со свойствами покоящихся нейральных стволовых клеток, получили название “латентные прогениторы” (Alunni, Bally-Cuif, 2016; Frisén, 2016; Zamboni et al., 2020), к ним еще относятся клетки Мюллеровой глии в сетчатке, которые способны пролиферировать в ответ на факторы повреждения и активировать нейрогенную программу (Gao et al., 2021). В настоящее время накапливается все больше данных в пользу высокой пластичности паренхимных астроцитов, в регуляции которой участвуют эпигенетические механизмы и внутренние программы транскрипции, определяющие функции астроцитов и контроль над их регенеративным и дегенеративным потенциалом (Pavlou et al., 2019).
РЕГУЛЯЦИЯ НЕЙРОГЕННОЙ ПРОГРАММЫ В ПАРЕНХИМНЫХ АСТРОЦИТАХ
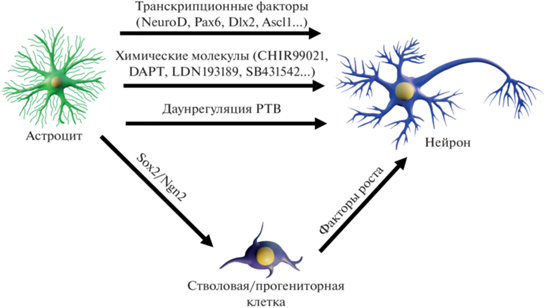
Усиление скрытой нейрогенной способности и репрограммирование астроцитов на нейрогенную программу может происходить в естественных условиях при некоторых травмах мозга, а в эксперименте оно осуществляется посредством повышения эктопической экспрессии паннейральных и ряда других факторов (Ofenbauer, Tursun, 2019). Разработанные на сегодняшний день молекулярно-генетические алгоритмы включают нейрогенные транскрипционные факторы (ТФ), факторы плюрипотентности, сигнальные молекулы и факторы роста, малые молекулы, системы CRISPR-Cas и др. Разные сочетания факторов репрограммируют астроциты сразу в нейроны или через дедифференцировку в нейральные прогениторы или НСК, включающие пролиферативную стадию (Magnusson et al., 2020; Wang et al., 2021) (рис. 4). Хотя термин “прямое нейрональное репрограммирование” был предложен Фербухеном в 2010 г. (Verbuchen et al., 2010), впервые обратила внимание на регуляторное влияние уровня экспрессии нейрогенных транскрипционных факторов М. Гётц и сотр. Они обнаружили, что повышенная экспрессия паннейронального Pax6 в культивируемых постнатальных астроцитах подавляла активность GFAP и репрограммировала клетки в сторону нейронной дифференцировки с активацией β-тубулин-III (Heins et al., 2002). В дальнейшем транскрипционные факторы для репрограммирования выбирали согласно их роли в дифференцировке нейронов во время развития мозга. Было установлено, что повышение экспрессии ТФ Ngn2 и Ascl1 (последний представляет пионерный фактор, делающий хроматин более доступным для факторов транскрипции (Raposo et al., 2015)), совместно или по отдельности репрограммируют астроциты в нейроны in vitro (Berninger et al., 2007). Используя ретровирусный вектор (VSV-G) с генами Pax6, Ngn2, Mash1, и репортерным GFP, методами видеомикроскопии и иммуногистохимией авторы (Berninger et al., 2007) показали изменение морфологии астроцитов в сторону нейроноподобной. Индуцированные клетки сначала экспрессировали маркер незрелых нейронов Tuj1, а затем MAP2 и NeuN, нейроны приобретали глутаматергическую или гамкергическую идентичность, демонстрировали спонтанную активность и генерировали потенциалы действия (Berninger et al., 2007). По данным японских исследователей, понижение дифференцировки мышиных астроцитов в культуре происходит на фоне усиления ацетилирования H3K9K14 вблизи NeuroG1 и NeuroG2 (Hirabayashi et al., 2009). Предполагается, что многие нижестоящие мишени у этих ТФ не блокируются, поэтому повышение их экспрессии может напрямую привести к репрограммированию астроцитов (Robel et al., 2011).
В настоящее время большое число пронейральных ТФ используется для конверсии астроцитов: Ascl1, Ngn2, NeuroD1, Pax6 и Dlx2, Brn2, Myt1l, Zfp238 и др. Регион специфичные астроциты коры головного мозга, мозжечка и спинного мозга репрограммируются с помощью ТФ с разной эффективностью. Ряд авторов связывает это с различиями в уровне экспрессии сигнального пути Notch, который играет важную роль в поддержании стволовых клеток и репрограммировании (Hu et al., 2019).
Как уже было сказано, репрограммирование астроцитов в нейроны может проходить без пролиферации или через последовательные деления с переходными состояниями предшественника. Енс Магнуссон полагает, что прямое превращение мало перспективно из-за того, что один астроцит дает один нейрон, в то время как дедифференцированный пролиферирующий астроцит образует 30–40 нейробластов (Magnusson et al., 2020). В процессе дедифференцировки в менее специализированную стадию астроциты приобретают сходный с НСК транскрипционный профиль и пролиферативную активность, которая находится под контролем сигнальной системы Notch (Magnusson et al., 2014). Поэтому у мутантных мышей с подавленной сигнальной системой Notch астроциты способны пролиферировать и генерировать новые нейроны в ответ на повреждение мозга. Недавно, методом секвенирования РНК единичных клеток (scRNA-seq) были получены молекулярные портреты астроцитов в состоянии репрограммирования, когда сигнальная система Notch заблокирована фактором Rbpj. В этой экспериментальной ситуации кортикальные астроциты понижали дифференцировку, разворачивали нейрогенную программу и на молекулярном уровне с удивительной точностью воспроизводили кортикальный нейрогенез (Zamboni et al., 2020).
Кроме нейрогенных ТФ, влиять на судьбу астроцитов можно путем регуляции экспрессии других ТФ и мишеней. Факторы плюрипотентности Nanog, OCT4, FOXG1, SOX2, Klf-4, c-MYC и CEND1 могут по отдельности или в сочетании друг с другом дедифференцировать постмитотические астроциты (Corti et al., 2012; Niu et al., 2013; Bulstrode et al., 2017). При анализе клеточных клонов в процессе репрограммирования астроцитов человека оказалось, что большинство клеток со сверхэкспрессией CEND1 проходит от одного до двух асимметричных делений до дифференцирования в нейроны (Aravantinou-Fatorou et al., 2021).
Отработанные в культуре клеток методы прямого репрограммирования были воспроизведены in situ посредством эктопической экспрессии нейрональных ТФ в резидентных глиальных клетках мозга (Li., Chen, 2016; Gascon et al., 2016). Первые эксперименты выполнены на трансгенных GFAP-Cre мышах, которым в стриатум инъецировали лентивирусную конструкцию c тремя репрограммирующими генами Ascl1, Brn2, Myt11 и GFP. Через 6 недель астроциты (примерно 120 клеток на животное) превращались в NeuN дифференцированные нейроны (Torper et al., 2013; Flitsch, Brüstle, 2019). В дальнейшем оказалось, что астроциты в коре, стриатуме и спинном мозге мышей могут репрограммироваться в глутаматергические и гамкергических нейроны с использованием или одного из факторов NeuroD1, Ascl1, Sox2, либо в их сочетаниях (Liu et al., 2015; Torper et al., 2015; Gascon et al., 2016; Sharif et al., 2021). Интересный факт обнаружен недавно в ходе транскриптомного анализа при конверсии астроцитов спинного мозга пронейральными факторами Ascl1 и Neurog2 in vitro. Оказалось, что каждый фактор сначала активирует свою нейрогенную программу, хотя позже они обе приводят к общему состоянию дифференцировки, характеризующей специфический интернейрон V2 (Kempf et al., 2021). В переднем мозге NeuroD1 может эффективно перепрограммировать астроциты в сером веществе коры в функциональные нейроны, в то время как астроциты в белом веществе мало подвержены репрограммированию (Liu et al., 2020). И хотя механизмы этого пока не ясны, очевидно, что разные способности к репрограммированию могут определяться эндогенными особенностями клеток, и возможностью участия микроокружения в этих процессах.
Среди нейрогенных ТФ NeuroD1 по эффективности занимает высокое место, преобразуя около ~90% астроцитов в мозге взрослых мышей в глутаматергические нейроны, включая мышей 14-месячного возраста с моделью болезни Альцгеймера (Guo et al., 2014). В недавних исследованиях было подтверждено, что репрограммирование на основе аденоассоциированного вируса (AAV) с NeuroD1 дает много новых нейронов, возникающих из астроцитов, и одновременно защищает поврежденные нейроны после ишемии мозга у мышей. Морфологические, молекулярные, электрофизиологические исследования продемонстрировали функциональность вновь образованных нервных клеток, а анализ поведения животных показал значительное улучшение как двигательных, так и когнитивных функций после преобразования астроцитов (Chen et al., 2019; Ge et al., 2020). Несмотря на эти оптимистические результаты, нужно отдавать себе отчет в том, что доказательная база репрограммирования астроцитов в нейроны в живом мозге чрезвычайно сложна и требует работы с линиями Cre-loxP и CreER мышей, тонких молекулярно-генетических методов и специфических маркеров. В настоящее время для доставки рекомбинантных ДНК-векторов ТФ используются ленти, ретро- и аденоассоциированные вирусы (AAV), каждый из которых имеет свои преимущества и недостатки. Сейчас возникла острая дискуссия об эффективности ТФ NeuroD1 в репрограммировании астроцитов в нейроны in vivo с доставкой AAV (Chen, 2021). Есть веские причины полагать, что не исключены методические ошибки, связанные с особенностями линий репортерных мышей, токсичностью AVV и возможностью попадания генов-мишеней в нервные клетки, что может приводить к ложным результатам (Xiang et al., 2021). Конечно, потребуется время на разрешение этих проблем, но в результате будут скорректированы методические неточности и установлена реальная эффективность репрограммирования, что очень важно для оценки перспективы регенерации в мозге.
В поисках путей для повышения репрограммирования астроцитов с помощью ТФ пришли к пониманию того, что одним из них может стать модуляция экспрессии сигнальных путей и микроРНК, участвующих в развитии мозга и функционировании взрослых НСК. Еще в работах Сирко с коллегами было установлено, что при острой травме мозга у мышей в реактивных астроцитах, приобретающих свойства НСК, активируется сигнальный путь Shh (Sirko et al., 2013). Далее экспериментально было показано (Yang et al., 2019), что репрограммирование астроцитов с помощью OCT4 значительно повышается при одновременной активации экспрессии Shh. В отношении астроцитов человека известно, что NEUROD1, ASCL1, LMX1A в комплексе с miR-218 и при одновременной активации сигнальных путей Shh и Wnt преобразуют их в дофаминергические нейроны в клеточной культуре и в мозге грызунов (Rivetti di Val Cervo et al., 2017). В модели болезни Паркинсона у мышей астроциты стриатума, трансфецированные лентивирусами с вышеуказанными факторами, превращались в дофаминергические нейроны, которые улучшали двигательное поведение, и именно miR-128 усиливал дедифференцировку астроцитов (Rivetti di Val Cervo et al., 2017). Повышение активности микроРНК, таких как miR-302, miR‑367, miR-181a и др., или блокирование (например, miR-124) в сочетании с ТФ существенно влияет на конверсию астроцитов в нейроны (Griffiths et al., 2020).
Другая стратегия направлена на разработку комплексов малых молекул для регуляции экспрессии пронейральных генов с целью замены факторов транскрипции химическим репрограммированием (Das et al., 2019). В ряде работ показано, что малые молекулы, среди которых CHIR99021 (ингибитор GSK3); DAPT (ингибитор γ-секретазы, подавляет сигнальный путь Notch), LDN193189 (ингибитор сигнального пути BMP) и SB431542 (ингибитор TGF-β/Activin/NODAL через подавление ALK5, ALK4), способны конвертировать астроциты мышей и эмбриональные астроциты человека в функциональные нейроны in vitro (Ma et al., 2019; Yin et al., 2019). Нейроны, химически конвертированные из астроцитов человека, переживают более 7 месяцев в культуре, демонстрируя потенциалы действия и синаптическую активность (Yin et al., 2019). Секвенирование РНК (scRNA-seq) выявило изменения транскриптомов астроцитов в процессе преобразования в нейроны, показавшее, что химическое репрограммирование может активировать сигнальный путь SHH в течение 24 часов после воздействия, в результате подавляются многие глиальные гены и гены клеточного цикла. После снижения астроцитарной идентичности возрастает экспрессия пронейральных генов, участвующих в росте аксона и синаптогенезе. Комплекс малых молекул включает несколько этапов дифференциальной экспрессии генов в астроцитах: активацию сигнальных путей Shh, Wnt/β-catenin и Notch и подавление TGF-β и JAK/STAT (Ma et al., 2019). Эти работы дают важное представление о молекулярных каскадах, запускаемых комплексом малых молекул, которые приводят к репрограммированию астроцитов в нейроны (Ma et al., 2019; Yin et al., 2019). Несмотря на то, что исследования по химической конверсии in vivo находятся на начальной стадии (Ma et al., 2021), они интересны для предполагаемой клинической трансляции, поскольку малые молекулы экономически целесообразны, не иммуногенны, могут нарабатываться в большом количестве и эффективно доставляться через мембрану в клетки.
Иная стратегия репрограммирования астроцитов в дофаминергические нейроны in vivo основана на подавлении РНК-связывающего белка PTB (белок, связывающий полипиримидиновый тракт), который кодируется геном Ptbp1b (Qian et al., 2020). Авторы трансдуцировали кортикальные астроциты мышей лентивирусом с РНК против PTB (shPTB) и через четыре недели обнаружили от 50 до 80% клеток с морфологией нейронов экспрессирующих shPTB, окрашенных на Tuj1 и MAP2 и включенных в эндогенные нейронные сети. По всей видимости, астроциты из разных областей мозга могут быть преобразованы в разные подтипы нейронов с использованием этого метода. Аналогичное изменение фенотипа также достигается путем преобразования Мюллеровой глии и астроцитов в нейроны с использованием CRISPR-CasRx для подавления PTB (Zhou et al., 2020; Russo et al., 2021).
Нет сомнения в необходимости разработки новых эффективных протоколов, однако многие исследователи обращают внимание на то, что не менее важно искать пути поддержания жизнеспособности индуцированных нейронов, защищать их от гибели и обеспечивать дифференцировку. Известно, что многие вновь образованные нейроны гибнут от ферроптоза в результате генерации избыточных активных форм кислорода (АФК) (Gascon et al., 2017), поэтому пути, направленные на снижение и подавление АФК могут значительно повысить эффективность репрограммирования за счет сохранения образованных нейронов (Barker et al., 2018).
Очевидно, что быстро развившееся направление in vivo преобразования астроцитов в нейроны путем прямой конверсии чрезвычайно важно для фундаментальной биологии и регенеративной медицины (Rahman et al., 2021). Одновременно нужно отдавать себе отчет в том, что существует еще множество нерешенных проблем. Среди них, возможность истощения эндогенных клеток; риски возникновения глиальных опухолей; совершенствование систем доставки генов; оценка аутентичности перепрограммированных нейронов на уровне транскриптомов отдельных клеток; анализ репрограммирования астроцитов человека (критически отличных от грызунов) и т.д.
АСТРОЦИТЫ В МОЗГЕ ЧЕЛОВЕКА
Фундаментальные знания по биологии астроцитов главным образом получены в исследованиях на лабораторных животных, и немногие работы подчеркивают различия между астроцитами человека и грызунов (Eilam et al., 2016; Zhang et al., 2016; VigHodge et al., 2019; Li et al., 2021). Если многие типы клеток человека и других видов млекопитающих имеют значительное сходство, то к астроцитам это не относится. Эволюционный процесс удивительным образом отразился в астроцитах гоминид. У человекообразных обезьян и человека астроциты по морфологическим и функциональным свойствам значительно отличаются от других видов млекопитающих. Об астроцитах человека известно, что они начинают возникать со второго триместра развития плода (deAzevedo et al., 2003; Holst et al., 2019), клетки намного крупнее, морфологически сложнее, проявляют большой полиморфизм, и имеют более быструю и обширную синцитиальную кальциевую сигнализацию в сравнении с астроцитами у не приматов (Oberheim et al., 2006, 2009; Goldman, 2020). Исследование астроцитов человека в развитии по понятным причинам затруднены, но данные по зрелому мозгу показывают, что один кортикальный астроцит может охватывать отростками более двух миллионов индивидуальных синапсов (Oberheim et al., 2006). В коре мозга человека описано 4 класса GFAP позитивных клеток, которые относят к типу протоплазматических астроцитов. По данным физиологических исследований, проведенных на переживающих срезах (приготовленных из быстро выделенной ткани неокортекса человека), протоплазматические астроциты распространяют волны Ca2+ со скоростью 36 м/с, что примерно в четыре раза быстрее, чем у мышей. В слое 1 располагаются тела так называемых межслойных астроцитов, чьи отростки характеризуются извилистой морфологией и простираются на миллиметры в глубину коры через слои 2–4. Наибольшую длину имеют отростки астроцитов находящихся в слоях 2–6. Эти клетки в 2.6 раза больше в диаметре и имеют в 10 раз более длинные GFAP первичные отростки, чем их аналоги у грызунов. Более того, астроциты человека вытягивают от клеточного тела в 10 раз больше отростков GFAP, чем у грызунов. Только в мозге людей обнаружены уникальные поляризованные астроциты в слоях 5–6 коры, отростки которых протягиваются на миллиметры и характеризуются варикозными расширениями с пока еще неизвестными функциями (Falcone et al., 2019; Verkharatsky et al., 2019). В эволюционном отношении важно, что у нечеловеческих приматов протоплазматические астроциты проявляют промежуточный фенотип между грызунами и людьми: они меньше и не так сложны, как у человека, но больше, чем у грызунов. Нельзя исключить, что уникальные свойства морфологии и физиологии астроцитов могут быть как-то связаны с увеличением общего числа глутаматергических нейронов до 80% в мозге человека (Дьяконова, 2022), с регуляцией огромного числа их синапсов и защитой от эксайтотоксического повреждения.
Фиброзные астроциты в белом веществе мозга человека имеют многочисленные перекрывающиеся отростки. Если в мозге грызунов тела астроцитов лежат на поверхности сосуда, где их отростки-ножки образуют розетки, то в мозге человека тела астроцитов лежат вне сосуда, а к его поверхности тянутся их ножки-отростки и сплошь покрывают сосуд (Oberheim et al., 2006, 2009). Как и у грызунов, отростки астроцитов человека образуют щелевые проницаемые контакты с клетками эндотелия, через которые локально регулируют ток крови, транспорт метаболитов и водный обмен посредством кальциевых волн (Iadecola, 2017).
Данные о морфологических отличиях астроцитов в мозге человека и грызунов логично дополняют результаты транскриптомного анализа, из которого следует, что имеются значительные различия в экспрессии генов между человеком и мышами. По мере созревания, астроциты человека демонстрируют повышенную экспрессию генов, участвующих в передаче нервных импульсов, межклеточной сигнализации, метаболизме жирных кислот, клеточной адгезии и в ионном гомеостазе. Гены, кодирующие белки для регуляции передачи сигналов Ca2+, оказались более обогащенными в астроцитах человека по сравнению с мышами (Goldman, 2020). Набор генов, участвующих в метаболизме, в большей степени экспрессируется в астроцитах человека по сравнению с мышами. Более того, на основе сравнения данных о скорости метаболизма в астроцитах людей и у макак предполагается, что метаболизм в человеческом мозге может быть необычно высоким (Sim et al., 2009; Zhang et al., 2016).
Неожиданно ярко различия астроцитов человека и грызунов проявились при их трансплантации в мозг неонатальных иммунодефицитных мышей (Han et al., 2013). После пересадки большое число глиальных предшественников и астроцитов крупного размера с морфологией астроглии человека было выявлено в мозге у мышей. Астроциты человека формировали щелевые контакты с астроглией хозяина и распространяли Ca2+ волны в 3 раза быстрее, чем астроциты мыши. Электрофизиологические и поведенческие исследования показали, что у химер резко усилилась долговременная потенциация (LTP), возможности к обучению и когнитивные способности, в то время как мыши с трансплантатами астроцитов мышей не обнаружили функциональных изменений (Han et al., 2013; Goldman, 2020). Эти результаты, в совокупности с данными морфологии, молекулярных и физиологических исследований показывают, что в процессе эволюции астроциты человека не только изменились морфологически и увеличились в размерах, но и значимо усилили свое участие в кооперации с нейронами для обработки сигнала. В отношении репрограммирования астроцитов человека данных пока немного. Тем не менее, известно, что они могут быть разными способами конвертированы в нейроны in vitro (Yin et al., 2019; Aravantinou-Fatorou et al., 2021) и даже после трансплантации в мозг мышей (Rivetti di Val Cervo et al., 2017).
Итак, эволюция привела к очень заметным морфологическим и функциональным изменениям в астроцитах человека, что, безусловно, должно иметь определенное значение для функции мозга, которое еще предстоит понять и оценить. Однако уже сейчас ясно, что новые знания по физиологии и репрограммированию, полученные на астроцитах грызунов, следует переносить на мозг человека с большой осторожностью. Совершенно очевидно, что при базовом сходстве, существуют значительные различия между гомологичными типами клеток человека, нечеловекообразных обезьян и грызунов, включая резкие изменения в размерах, распределение по слоям, в морфологии и экспрессии генов. Эти данные вносят новые важные знания в биологию астроцитов и еще раз подчеркивают необходимость всестороннего исследования мозга человека.
ЗАКЛЮЧЕНИЕ
В последние десятилетия астроциты стали горячей темой в связи с открытиями, которые приблизили их к уровню нервных клеток в функциональном отношении, а по возможностям к регенерации – показали их преимущества по сравнению с нейронами. Мы постарались объединить новые, но разнонаправленные исследования в единое целое, чтобы дать наиболее полное представление о биологии астроцитов, и возможно найти общность в разных формах поведения этих клеток. Если посмотреть на функции астроцитов объемно, то становится ясно, что они осуществляют постоянный внутренний надзор за нервными клетками, начиная с раннего развития. Уже давно астроциты признаны важными структурными элементами нервной ткани, регуляторами гомеостаза и метаболизма, то только сейчас стало ясно, что их функция много шире, и они участвуют в контроле дифференцировки нейронов, образовании синапсов и их интеграции в сети. В сформированных синапсах астроциты отслеживают потоки информации, если нужно усиливают или ослабляют их, вплоть до полной элиминации. Астроциты объединяются в сети, поэтому могут контролировать работу синапсов как на локальном, так и на глобальном уровне мозга. Регуляция синаптической передачи делает астроциты равноправными партнерами нервных клеток и поднимает вопрос об их участии в когнитивных функциях мозга. Если нейроны представляют популяцию терминально дифференцированных клеток, то астроциты сохраняют высокую пластичность и эпигенетическую память. Общим базальным предшественником для нейронов и астроцитов является стволовая клетка радиальной глии, многие свойства которой передаются дифференцированным астроцитам. Нельзя исключить, что способность астроцитов к глиотрансмиссии (секреции и рецепции нейротрансмиттеров) является неким рудиментом нейронной функции, которая не блокируется полностью и сохраняется благодаря пластичности. При повреждении мозга астроциты первыми встают на его защиту и образуют специальные барьеры, отделяющие поврежденные ткани. В определенных условиях (изменение эпигенетического ландшафта, оверэкспрессия пронейральных факторов) астроциты проявляют свойства стволовых клеток, и могут репрограммироваться в нейроны in vitro и in vivo. Исследование механизмов репрограммирования астроцитов и их связь с процессами репарации мозга может послужить фундаментом для разработки новых терапевтических подходов к репарации поврежденного мозга.
Совершенно очевидно, что накопленные знания по физиологии и пластичности астроцитов показывают существование разнообразного и очень сложного набора механизмов, обеспечивающих их взаимодействие с нейронами в норме и при патологии. Еще предстоит пройти огромный путь, чтобы оценить реальный вклад астроцитов в когнитивные процессы и в регенерацию мозга и, говоря словами М. Гётц “…мы только прикоснулись к глубине их биологии” (Götz, Bocchi, 2021).
Список литературы
Браже А.Р., Доронин М.С., Попов А.В. и др. Исследование паттернов кальциевой динамики в сетях астроцитов головного мозга // Российский физиологический журн. им. И.М. Сеченова. 2019. Т. 105. № 11. С. 1436–1451.
Гомазков О.А. Астроциты как компоненты регуляции высших функций мозга // Нейрохимия. 2019. Т. 36. № 4. С. 267–274.
Дьяконова В.Е. Происхождение и эволюция нервной системы: новые данные сравнительных полногеномных исследований многоклеточных животных // Онтогенез. 2022. Т. 53. № 1. С. 63–74.
Ишунина Т.А., Боголепова И.Н., Свааб Д.Ф. Морфофункциональные изменения и компенсаторные механизмы в головном мозге человека при старении и болезни Альцгеймера // Журн. анатомии и гистопатологии. 2020. Т. 9. № 1. С. 77–85.
Коломеец Н.С. Роль астроцитов в нарушениях глутамат-ергической нейромедиации при шизофрении // Журн. неврологии и психиатрии им. C.C. Корсакова. 2015. Т. 115. № 1. С. 110–117.
Носова О.И., Суфиева Д.А., Коржевский Д.Э. Использование конфокальной микроскопии и программных методов 2d и 3d анализа для изучения стуктурной организации астроцитов // Цитология. 2021. Т. 63. № 1. С. 80–87.
Швалев В.Н., Сосунов А.А., Челышев Ю.А. Астроциты и пластичность синапсов. Часть 1. Синаптогенные молекулы // Неврологический вестник. 2018. Т. 50. № 2. С. 55–60.
Шушарина Н.Н., Патрушев М.В., Силина Е.В. и др. Экспрессия генов транспортеров нейромедиаторов в астроцитах разных отделов головного мозга в эксперименте // Журн. неврологии и психиатрии им. C.C. Корсакова. 2018. Т. 118. № 6. С. 58–64.
Цыба Д.Л., Кирик О.В., Колпакова М.Э. и др. Особенности экспрессии нестина и глиального фибриллярного кислого белка на границе очага ишемического повреждения головного мозга у крыс shr // Клеточные технологии в биологии и медицине. 2020. № 2. С. 118–124.
Adamsky A., Kol A., Kreisel T. et al. Astrocytic activation generates de novo neuronal potentiation and memory enhancement // Cell. 2018. V. 174. № 1. P. 59–71.
Akdemir E.S., Huang A.Y., Deneen B. Astrocytogenesis: where, when, and how // F1000Res. 2020. V. 9.https://doi.org/10.12688/f1000research.22405.1
Allen N.J., Eroglu C. Cell biology of astrocyte-synapse interactions // Neuron. 2017. V. 96. № 3. P. 697–708.
Allen N.J., Bennett M.L., Foo L.C. et al. Astrocyte glypicans 4 and 6 promote formation of excitatory synapses via GluA1 AMPA receptors // Nature. 2012. V. 486. № 7403. P. 410–414.
Alunni A., Bally-Cuif L. A comparative view of regenerative neurogenesis in vertebrates // Development. 2016. V. 143. № 5. P. 741–753.
Angulo M.C., Kozlov A.S., Charpak S. et al. Glutamate released from glial cells synchronizes neuronal activity in the hippocampus // J. Neurosci. 2004. V. 24. P. 6920–6927.
Araque A., Parpura V., Sanzgiri R.P. et al. Tripartite synapses: glia, the unacknowledged partner // Trends Neurosci. 1999. V. 22. № 5. P. 208–215.
Araque A., Carmignoto G., Haydon P.G. et al. Gliotransmitters travel in time and space // Neuron. 2014. V. 81. P. 728–739.
Aravantinou-Fatorou K., Vejdani S., Thomaidou D. Cend1 and Neurog2 efficiently reprogram human cortical astrocytes to neural precursor cells and induced-neurons // Int. J. Dev. Biol. 2021. V. 5. № 3. P. 405–418.
Arendt T. Cell cycle activation and aneuploid neurons in Alzheimer’s disease // Mol. Neurobiol. 2012. V. 46. P. 125–135.
Arellano J.I., Morozov Y.M., Micali N. et al. Radial glial cells: new views on old questions // Neurochem. Res. 2021. V. 46. № 10. P. 2512–2524.
Bak L.K., Schousboe A., Waagepetersen H.S. The glutamate/GABA-glutamine cycle: aspects of transport, neurotransmitter homeostasis and ammonia transfer // J. Neurochem. 2006. V. 98. № 3. P. 641–653.
Bandeira F., Lent R., Herculano-Houzel S. Changing numbers of neuronal and non-neuronal cells underlie postnatal brain growth in the rat // Proc. Natl. Acad. Sci. USA. 2009. V. 106. № 33. P. 14108–14113.
Bantle C.M., Hirst W.D., Weihofen A. et al. Mitochondrial dysfunction in astrocytes: a role in parkinson’s disease? // Front. Cell. Dev. Biol. 2021. V. 8. № 608026. eCollection 2020.
Barbar L., Jain T., Zimmer M. et al. CD49f is a novel marker of functional and reactive human iPSC-derived astrocytes // Neuron. 2020. V. 107. № 3. P. 436–453.
Barker R.A., Götz M., Parmar M. New approaches for brain repair-from rescue to reprogramming // Nature. 2018. V. 557. № 7705. P. 329–334.
Barnabé-Heider F., Wasylnka J.A., Fernandes K.J.L. et al. Evidence that embryonic neurons regulate the onset of cortical gliogenesis via Cardiotrophin-1 // Neuron. 2005. V. 48. № 2. P. 253–265.
Bayraktar O.A., Fuentealba L.C., Alvarez-Buylla A. et al. Astrocyte development and heterogeneity // Cold. Spring. Harb. Perspect. Biol. 2014. V. 7. № 1. P. a020362.
Bayraktar O.A., Bartels T., Holmqvist S. et al. Astrocyte layers in the mammalian cerebral cortex revealed by a single-cell in situ transcriptomic map // Nat. Neurosci. 2020. V. 23. № 4. P. 500–509.
Becerra-Calixto A., Cardona-Gómez G.P. The role of astrocytes in neuroprotection after brain stroke: potential in cell therapy // Front. Mol. Neurosci. 2017. V. 10. P. 88.
Bernardinelli Y., Randall J., Janett E. et al. Activity-dependent structural plasticity of perisynaptic astrocytic domains promotes excitatory synapse stability // Curr. Biol. 2014. V. 24. № 15. P. 1679–1688.
Berninger B., Costa M.R., Koch U. et al. Functional properties of neurons derived from in vitro reprogrammed postnatal astroglia // J. Neurosci. 2007. V. 27. № 32. P. 8654–8664.
Bindocci E., Savtchouk I., Liaudet N. et al. Three-dimensional Ca2+ imaging advances understanding of astrocyte biology // Science. 2017. V. 356. № 6339. P. eaai8185.
Blanchette M., Daneman R. Formation and maintenance of the BBB // Mech. Dev. 2015. V. 138. № 1. P. 8–16.
Bonni A., Sun Y., Nadal-Vicens M. et al. Regulation of gliogenesis in the central nervous system by the JAK-STAT signaling pathway // Science. 1997. V. 278. № 5337. P. 477–483.
Buffo A., Rite I., Tripathi P. et al. Origin and progeny of reactive gliosis: a source of multipotent cells in the injured brain // Proc. Natl. Acad. Sci. USA. 2008. V. 105. P. 3581–3586.
Bulstrode H., Johnstone E., Marques-Torrejon M.A. Elevated FOXG1 and SOX2 in glioblastoma enforces neural stem cell identity through transcriptional control of cell cycle and epigenetic regulators // Genes. Dev. 2017. V. 31. № 8. P. 757–773.
Burns K.A, Murphy B., Danzer S.C. et al. Developmental and post-injury cortical gliogenesis: a genetic fate-mapping study with Nestin-CreER mice // Glia. 2009. V. 57. № 10. P. 1115–1129.
Bushong E.A., Martone M.E., Jones Y.Z. et al. Protoplasmic astrocytes in CA1 stratum radiatum occupy separate anatomical domains // J. Neurosci. 2002. V. 22. № 1. P. 183–192.
Bushong E.A., Martone M.E., Ellisman M.H. Maturation of astrocyte morphology and the establishment of astrocyte domains during postnatal hippocampal development // Int. J. Dev. Neurosci. 2004. V. 22. № 2. P. 73–86.
Calvo-Rodriguez M., Kharitonova E.K., Bacskai B.J. Therapeutic strategies to target calcium dysregulation in Alzheimer’s disease // Cells. 2020. V. 9. № 11. P. 2513.
Chen G. In vivo confusion over in vivo conversion // Mol. Ther. 2021. V. 29. № 11. P. 3097–3098.
Chen Y.C., Ma N.X., Pei Z.F. et al. A NeuroD1 AAV-based gene therapy for functional brain repair after ischemic injury through in vivo astrocyte-to-neuron conversion // Mol. Ther. 2019. V. 28. P. 217–234.
Chiareli R.A., Carvalho G.A., Marques B.L. et al. The role of astrocytes in the neurorepair process // Front. Cell. Dev. Biol. 2021. V. 9. P. 665795.
Corti S., Nizzardo M., Simone C. et al. Direct reprogramming of human astrocytes into neural stem cells and neurons // Exp. Cell. Res. 2012. V. 318. № 13. P. 1528–1541. https://doi.org/10.1016/j.yexcr.2012.02.040
De Azevedo L.C., Fallet C., Moura-Neto V. et al. Cortical radial glial cells in human fetuses: depth-correlated transformation into astrocytes // J. Neurobiol. 2003. V. 55. № 3. P. 288–298.
Das G., Gupta V., Ghosh S. Glial-neuron transformation by “Chemical Cocktail” // ACS. Chem. Neurosci. 2019. V. 10. № 1. P. 42–43.
Deneen B., Ho R., Lukaszewicz A. et al. The transcription factor NFIA controls the onset of gliogenesis in the developing spinal cord // Neuron. 2006. V. 52. № 6. P. 953–968.
Doetsch F., Caillé I., Lim D.A. et al. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain // Cell. 1999. V. 97. P. 703–716.
Doetsch F. The glial identity of neural stem cells // Nat. Neurosci. 2003. V. 6. № 11. P. 1127–1134.
Dimou L., Götz M. Glial cells as progenitors and stem cells: new roles in the healthy and diseased brain // Physiol. Rev. 2014. V. 94. № 3. P. 709–737.
Duong T.A.D., Hoshiba Y., Saito K. et al. FGF signaling directs the cell fate switch from neurons to astrocytes in the developing mouse cerebral cortex // Neurosci. 2019. V. 39. № 31. P. 6081–6094.
Eilam R., Aharoni R., Arnon R. et al. Astrocyte morphology is confined by cortical functional boundaries in mammals ranging from mice to human // Elife. 2016. V. 5. P. e15915.
Falcone C., Wolf-Ochoa M., Amina S. et al. Cortical interlaminar astrocytes across the therian mammal radiation // J. Comp. Neurol. 2019. V. 527. № 10. P. 1654–1674.
Farhy-Tselnicker I., Allen N.J. Astrocytes, neurons, synapses: a tripartite view on cortical circuit development // Neural. Dev. 2018. V. 13. № 1. P. 7.
Flitsch L.J., Brüstle O. Evolving principles underlying neural lineage conversion and their relevance for biomedical translation // F1000Research. 2019. V. 8. P. F1000 Faculty Rev-1548.
Forsberg D., Herlenius E. Astrocyte networks modulate respiration-sniffing glue // Respir. Physiol. Neurobiol. 2019. V. 265. P. 3–8.
Freeman M.R. Specification and morphogenesis of astrocytes // Science. 2010. V. 330. № 6005. P. 774–778. https://doi.org/10.1126/science.1190928
Furness D.N., Dehnes Y., Akhtar A.Q. et al. A quantitative assessment of glutamate uptake into hippocampal synaptic terminals and astrocytes: new insights into a neuronal role for excitatory amino acid transporter 2 (EAAT2) // Neuroscience. 2008. V. 157. № 1. P. 80–94.
Garcia-Marques J., Lopez-Mascaraque L. Clonal identity determines astrocyte cortical heterogeneity // Cereb. Cortex. 2013. V. 23. P. 1463–1472.
Garcia A.D.R., Doan N.B., Imura T. et al. GFAP-expressing progenitors are the principal source of constitutive neurogenesis in adult mouse forebrain // Nat. Neurosci. 2004. V. 7. № 11. P. 1233–1241.
Gao H., A L., Huang X. et al. Müller glia-mediated retinal regeneration // Mol. Neurobiol. 2021. V. 58. № 5. P. 2342–2361.
Gao V., Suzuki A., Magistretti P.J. et al. Astrocytic β2-adrenergic receptors mediate hippocampal long-term memory consolidation // Proc. Natl. Acad. Sci. USA. 2016. V. 113. P. 8526–8531.
Gascon S., Masserdotti G., Russo G.L. et al. Direct neuronal reprogramming: achievements, hurdles, and new roads to success // Cell. Stem. Cell. 2017. V. 21. P. 18–34.
Ge W.P., Jia J.M. Local production of astrocytes in the cerebral cortex // Neuroscience. 2016. V. 323. P. 3–9.
Ge L.J., Yang F.H., Li W. et al. In vivo neuroregeneration to treat ischemic stroke through neuroD1 AAV-based gene therapy in adult non-human primates // Front. Cell. Dev. Biol. 2020. V. 8. P. 590008.
Goldman S.A. Glial evolution as a determinant of human behavior and its disorders // Ann. N.Y. Acad. Sci. 2020. V. 1471. № 1. P. 72–85.
Goss J.R., O’Malley M.E., Zou L. et al. Astrocytes are the major source of nerve growth factor upregulation following traumatic brain injury in the rat // Exp. Neurol. 1998. V. 149. № 2. P. 301–309.
Götz M., Bocchi R. Neuronal replacement: concepts, achievements, and call for caution // Curr. Opin. Neurobiol. 2021. V. 69. P. 185–192.
Griffiths B.B., Bhutani A., Stary C.M. Adult neurogenesis from reprogrammed astrocytes // Neural. Regen. Res. 2020. V. 15. № 6. P. 973–979.
Guo Z., Zhang L., Wu Z. et al. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model // Cell. Stem. Cell. 2014. V. 14. № 2. P. 188–202.
Halassa M.M., Fellin T., Takano H. et al. Synaptic islands defined by the territory of a single astrocyte // J. Neurosci. 2007. V. 27. № 24. P. 6473–6477.
Han X., Chen M., Wang F. et al. Forebrain engraftment by human glial progenitor cells enhances synaptic plasticity and learning in adult mice //Cell. Stem. Cell. 2013. V. 12. № 3. P. 342–353.
He F., Ge W., Martinowich K. et al. A positive autoregulatory loop of Jak-STAT signaling controls the onset of astrogliogenesis // Nat. Neurosci. 2005. V. 8. № 5. P. 616–625.
Heins N., Malatesta P., Cecconi F. et al. Glial cells generate neurons: The role of the transcription factor Pax6 // Nat. Neurosci. 2002. V. 5. P. 308–315.
Hirabayashi Y., Suzki N., Tsuboi M. et al. Polycomb limits the neurogenic competence of neural precursor cells to promote astrogenic fate transition // Neuron. 2009. V. 63. № 5. P. 600–613.
Hochstim C., Deneen B., Lukaszewicz A. et al. Identification of positionally distinct astrocyte subtypes whose identities are specified by a homeodomain code // Cell. 2008. V. 133. P. 510–522.
Hodge R.D., Bakken T.E., Miller J.A. et al. Conserved cell types with divergent features in human versus mouse cortex // Nature. 2019. V. 573. № 7772. P. 61–68.
Holst C.B., Brøchner C.B., Vitting-Seerup K. et al. Astrogliogenesis in human fetal brain: complex spatiotemporal immunoreactivity patterns of GFAP, S100, AQP4 and YKL-40 // J. Anat. 2019. V. 235. № 3. P. 590–615.
Houades V., Koulakoff A., Ezan P. et al. Gap junction-mediated astrocytic networks in the mouse barrel cortex // J. Neurosci. 2008. V. 28. № 20. P. 5207–5217.
Hu H., Miao Y.R., Jia L.H. et al. Animal TFDB 3.0: a comprehensive resource for annotation and prediction of animal transcription factors // Nucleic. Acids. Research. 2019. V. 47. P. D33–D38.
Iadecola C. The neurovascular unit coming of age: a journey through neurovascular coupling in health and disease // Neuron. 2017. V. 96. № 1. P. 17–42.
John G.R., Lee S.C., Brosnan C.F. Cytokines: powerful regulators of glial cell activation // Neuroscientist. 2003. V. 9. P. 10–22.
Kang P., Lee H.K., Glasgow S.M. et al. Sox9 and NFIA coordinate a transcriptional regulatory cascade during the initiation of gliogenesis // Neuron. 2012. V. 74. № 1. P. 79–94.
Kanski R., van Strien M.E., van Tijn P. et al. A star is born: new insights into the mechanism of astrogenesis // Cell. Mol. Life. Sci. 2014. V. 71. № 3. P. 433–447.
Kempf J., Knelles K., Hersbach B.A. et al. Heterogeneity of neurons reprogrammed from spinal cord astrocytes by the proneural factors Ascl1 and Neurogenin2 // Cell. Rep. 2021. V. 36. № 3. P. 109409.
Khakh B.S., Deneen B. The emerging nature of astrocyte diversity // Annu. Rev. Neurosci. 2019. V. 42. P. 187–207.
Khakh B.S., Sofroniew M.V. Diversity of astrocyte functions and phenotypes in neural circuits // Nat. Neurosci. 2015. V. 18. № 7. P. 942–952.
Kriegstein A., Alvarez-Buylla A. The glial nature of embryonic and adult neural stem cells // Annu. Rev. Neurosci. 2009. V. 32. P. 149–184.
Kugler E.C., Greenwood J., MacDonald R.B. The “neuro-glial-vascular” unit: the role of glia in neurovascular unit formation and dysfunction // Front. Cell. Dev. Biol. 2021. V. 9. P. 732820.
Lee J.H., Kim J.Y., Noh S. et al. Astrocytes phagocytose adult hippocampal synapses for circuit homeostasis // Nature. 2021. V. 590. № 7847. P. 612–617.
Li H., Chen G. In vivo reprogramming for CNS repair: regenerating neurons from endogenous glial cells // Neuron. 2016. V. 91. P. 728–738.
Li L., Lundkvist A., Andersson D. et al. Protective role of reactive astrocytes in brain ischemia // J. Cereb. Blood. Flow. Metab. 2008. V. 28. № 3. P. 468–481.
Li J., Pan L., Pembroke W.G. et al. Conservation and divergence of vulnerability and responses to stressors between human and mouse astrocytes // Nat. Commun. 2021. V. 12. № 1. P. 3958.
Limbad C., Oron T.R., Alimirah F. et al. Astrocyte senescence promotes glutamate toxicity in cortical neurons // PLoS One. 2020. V.15. № 1. P. e0227887.
Liu M.H., Li W., Zheng J.J. et al. Differential neuronal reprogramming induced by NeuroD1 from astrocytes in grey matter versus white matter // Neural. Regen. Res. 2020. V. 15. № 2. P. 342–351.
Liu Y., Miao Q., Yuan J. et al. Ascl1 converts dorsal midbrain astrocytes into functional neurons in vivo // J. Neurosci. 2015. V. 35. № 25. P. 9336–9355.
Llorens-Bobadilla E., Zhao S., Baser A. et al. Single-cell transcriptomics reveals a population of dormant neural stem cells that become activated upon brain injury // Cell. Stem. Cell. 2015. V. 17. P. 329–340.
Loprinzi P.D. The role of astrocytes on the effects of exercise on episodic memory function // Physiol. Int. 2019. V. 106. № 1. P. 21–28.
Lozzi B., Huang T.W., Sardar D. et al. Regionally distinct astrocytes display unique transcription factor profiles in the adult brain // Front. Neurosci. 2020. V. 14. № 61.
Ma N.X., Yin J.C., Chen G. Transcriptome analysis of small molecule-mediated astrocyte-to-neuron reprogramming // Front. Cell. Dev. Biol. 2019. V. 7. P. 82.
Ma Y., Xie H., Du X. et al. In vivo chemical reprogramming of astrocytes into neurons // Cell. Discov. 2021. V. 7. № 1. P. 12.
Magavi S., Friedmann D., Banks G. et al. Coincident generation of pyramidal neurons and protoplasmic astrocytes in neocortical columns // J. Neurosci. 2012. V. 32. № 14. P. 4762–4772.
Magnusson J.P., Frisén J. Stars from the darkest night: unlocking the neurogenic potential of astrocytes in different brain regions // Development. 2016. V. 143. № 7. P. 1075–1086.
Magnusson J.P., Göritz C., Tatarishvili J. et al. A latent neurogenic program in astrocytes regulated by notch signaling in the mouse // Science. 2014. V. 346. P. 237–241.
Magnusson J.P., Zamboni M., Santopolo G. et al. Activation of a neural stem cell transcriptional program in parenchymal astrocytes // eLife. 2020. V. 9. P. e59733.
McConnell S.K. The control of neuronal identity in the developing cerebral cortex // Curr. Opin. Neurobiol. 1992. V. 2. P. 23–27.
Merkle F.T., Tramontin A.D., Garcia-Verdugo J.M. et al. Radial glia give rise to adult neural stem cells in the subventricular zone // Proc. Natl. Acad. Sci. 2004. V. 101. P.17528–17532.
Miller F.D., Gauthier A.S. Timing is everything: making neurons versus glia in the developing cortex // Neuron. 2007. V. 54. № 3. P. 357–369.
Miller S.J., Philips T., Kim N. et al. Molecularly defined cortical astroglia subpopulation modulates neurons via secretion of Norrin // Nat. Neurosci. 2019. V. 22. № 5. P. 741–752.
Minge D., Domingos C., Unichenko P. et al. Heterogeneity and development of fine astrocyte morphology captured by diffraction-limited microscopy // Front. Cell. Neurosci. 2021. V. 15. P. 669280.
Molofsky A.V., Deneen B. Astrocyte development: a guide for the perplexed // Glia. 2015. V. 63. № 8. P. 1320–1329.
Molofsky A.V., Glasgow S.M., Chaboub L.S. et al. Expression profiling of Aldh1l1-precursors in the developing spinal cord reveals glial lineage-specific genes and direct Sox9-Nfe2l1 interactions // Glia. 2013. V. 61. P. 1518–1532.
Morel L., Men Y., Chiang M.S.R. et al. Intracortical astrocyte subpopulations defined by astrocyte reporter mice in the adult brain // Glia. 2019. V. 67. № 1. P. 171–181.
Mori T., Buffo A., Götz M. The novel roles of glial cells revisited: the contribution of radial glia and astrocytes to neurogenesis // Curr. Top. Dev. Biol. 2005. V. 69. P. 67–99.
Muroyama Y., Fujiwara Y., Orkin S.H. et al. Specification of astrocytes by bHLH protein SCL in a restricted region of the neural tube // Nature. 2005. V. 438. P. 360–363.
Namihira M., Kohyama J., Semi K. et al. Committed neuronal precursors confer astrocytic potential on residual neural precursor cells // Dev. Cell. 2009. V. 16. № 2. P. 245–255.
Hatada I., Namihira M., Morita S. et al. Astrocyte-specific genes are generally demethylated in neural precursor cells prior to astrocytic differentiation // PLoS One. 2008. V. 3. № 9. P. e3189.
Niu W., Zang T., Zou Y. et al. In vivo reprogramming of astrocytes to neuroblasts in the adult brain // Nature Cell Biology. 2013. V. 15. P. 1164–1175.
Noctor S.C., Martínez-Cerdeño V., Ivic L. et al. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases // Nat. Neurosci. 2004. V. 7. № 2. P. 136–144.
Oberheim N.A., Wang X., Goldman S. et al. Astrocytic complexity distinguishes the human brain // Trends Neurosci. 2006. V. 29. P. 547–553.
Oberheim N.A., Takano T., Han X. et al. Uniquely hominid features of adult human astrocytes // J. Neurosci. 2009. V. 29. № 10. P. 3276–3287.
Ofenbauer A., Tursun B. Strategies for in vivo reprogramming // Curr. Opin. Cell. Biol. 2019. V. 61. P. 9–15.
Ohab J.J., Fleming S., Armin Blesch A. et al. A neurovascular niche for neurogenesis after stroke // J. Neurosci. 2006. V. 26. № 50. P. 13007–13016.
Parnavelas J.G. Glial cell lineages in the rat cerebral cortex // Exp. Neurol. 1999. V. 156. P. 418–429.
Papouin T., Dunphy J., Tolman M. et al. Astrocytic control of synaptic function // Philos. Trans. R. Soc. Lond. Ser. B. Biol. Sci. 2017. № 1715. V. 372. P. 20160154.
Pavlou M.A.S., Grandbarbe L., Buckley N.J. et al. Transcriptional and epigenetic mechanisms underlying astrocyte identity // Prog. Neurobiol. 2019. V. 174. P. 36–52.
Pelvig D.P., Pakkenberg H., Stark A.K. et al. Neocortical glial cell numbers in human brains // Neurobiol. Aging. 2008. № 11. P. 1754–1762.
Perea G., Navarrete M., Araque A. Tripartite synapses: astrocytes process and control synaptic information // Trends Neurosci. 2009. V. 32. № 8. P. 421–431.
Perez-Catalan N.A., Doe C.Q., Ackerman S.D. The role of astrocyte-mediated plasticity in neural circuit development and function // Neural. Dev. 2021. V. 16. № 1. P. 1.
Qian X., Shen Q., Goderie S.K. et al. Timing of CNS cell generation: A programmed sequence of neuron and glial cell production from isolated murine cortical stem cells // Neuron. 2000. V. 28. P. 69–80.
Qian H., Kang X., Hu J. et al. Reversing a model of Parkinson’s disease with in situ converted nigral neurons // Nature. 2020. V. 582. P. 550–556.
Rahman A.A., Amruta N., Pinteaux E. et al. Neurogenesis after stroke: a therapeutic perspective // Transl. Stroke. Res. 2021. V. 12. № 1. P. 1–14.
Rakic P.J. Mode of cell migration to the superficial layers of fetal monkey neocortex // Comp. Neurol. 1972. V. 145. № 1. P. 61–83.
Raponi E., Agenes F., Delphin C. et al. S100B expression defines a state in which GFAP-expressing cells lose their neural stem cell potential and acquire a more mature developmental stage // Glia. 2007. V. 55. № 2. P. 165–177.
Raposo A.A.S.F., Vasconcelos F.F., Drechsel D. Ascl1 coordinately regulates gene expression and the chromatin landscape during neurogenesis // Cell. Rep. 2015. V. 10. № 9. P. 1544–1556.
Rivetti di Val Cervo P., Romanov R.A., Spigolon G. et al. Induction of functional dopamine neurons from human astrocytes in vitro and mouse astrocytes in a Parkinson’s disease mode // Nat. Biotechnol. 2017. V. 35. P. 444–452.
Robel S., Buckingham S.C., Boni J.L. et al. Reactive astrogliosis causes the development of spontaneous seizures // J. Neurosci. 2015. V. 35. № 8. P. 3330–3345.
Russo G.L., Sonsalla G., Natarajan P. et al. CRISPR-mediated induction of neuron-enriched mitochondrial proteins boosts direct glia-to-neuron conversion // Cell. Stem. Cell. 2021. V. 28 № 3. P. 524–534.
Santello M., Toni N., Volterra A. Astrocyte function from information processing to cognition and cognitive impairment // Nat. Neurosci. 2019. V. 22. № 2. P. 154–166.
Schmechel D.E., Rakic P. A golgi study of radial glial cells in developing monkey telencephalon: Morphogenesis and transformation into astrocytes // Anat. Embryol. 1979. V. 156. № 2. P. 115–152.
Sharif N., Calzolari F., Berninger B. Direct in vitro reprogramming of astrocytes into induced neurons // Methods. Mol. Biol. 2021. V. 2352. P. 13–29.
Shan L., Zhang T., Fan K. et al. Astrocyte-neuron signaling in synaptogenesis // Front. Cell. Dev. Biol. 2021. V. 9. P. 680301.
Shen Q., Wang Y., Dimos J.T. et al. The timing of cortical neurogenesis is encoded within lineages of individual progenitor cells // Nat. Neurosci. 2006. V. 9. P. 743–751.
Shen Q.,Wang Y., Kokovay E. et al. Adult SVZ stem cells lie in a vascular niche: A quantitative analysis of niche cell–cell interactions // Cell. Stem. Cell. 2008. V. 3. P. 289–300.
Shoneye T., Orrego A.T., Jarvis R. et al. Differential proliferation and maturation of subcortical astrocytes during postnatal development // Front. Neurosci. 2020. V. 14. P. 435.
Shimada I.S., LeComte M.D., Granger J.C. et al. Self-renewal and differentiation of reactive astrocyte-derived neural stem/progenitor cells isolated from the cortical peri-infarct area after stroke // J. Neurosci. 2012. V. 32. № 23. P. 7926–7940.
Sim F.J., Windrem M.S., Goldman S.A. Fate determination of adult human glial progenitor cells // Neuron. Glia. Biol. 2009. V. 5. № 3–4. P. 45–55.
Sirko S., Behrendt G., Johansson P.A. et al. Reactive glia in the injured brain acquire stem cell properties in response to sonic hedgehog // Cell. Stem. Cell. 2013. V. 12. P. 426–439.
Sloan S.A., Barres B.A. Mechanisms of astrocyte development and their contributions to neurodevelopmental disorders // Curr. Opin. Neurobiol. 2014. V. 27. P. 75–81.
Sofroniew M.V. Astrocyte reactivity: subtypes, states, and functions in CNS innate immunity // Trends. Immunol. 2020. V. 41. № 9. P. 758–770.
Sofroniew M.V., Vinters H.V. Astrocytes: biology and pathology // Acta. Neuropathol. 2010. V. 119. № 1. P. 7–35.
Sosunov A.A., Wu X., Tsankov N.M. et al. Phenotypic heterogeneity and plasticity of isocortical and hippocampal astrocytes in the human brain // J. Neurosci. 2014. V. 34. № 6. P. 2285–2298.
Stackhouse T.L., Mishra A. Neurovascular coupling in development and disease: focus on astrocytes // Front. Cell. Dev. Biol. 2021. V. 9. P. 702832.
Stogsdill J.A., Ramirez J., Liu D. et al. Astrocytic neuroligins control astrocyte morphogenesis and synaptogenesis // Nature. 2017. V. 551. № 7679. P. 192–197.
Sun W., Cornwell A., Li J. et al. SOX9 is an astrocyte-specific nuclear marker in the adult brain outside the neurogenic regions // J. Neurosci. 2017. V. 37. № 17. P. 4493–4507.
Sun X., Hu X., Wang D. et al. Establishment and characterization of primary astrocyte culture from adult mouse brain // Brain Res. Bull. 2017. V. 132. P. 10–19.
Susarla B.T., Villapol S., Yi J.H. et al. Temporal patterns of cortical proliferation of glial cell populations after traumatic brain injury in mice // ASN. Neuro. 2014. V. 6. № 3. P. 159–170.
Tabata H. Diverse subtypes of astrocytes and their development during corticogenesis // Front. Neurosci. 2015. V. 9. P. 114.
Tang F., Lane S., Korsak A. et al. Lactate-mediated glia-neuronal signalling in the mammalian brain // Nat. Commun. 2014. V. 5. P. 3284.
Tavazoie M., Van der Veken L., Silva-Vargas V. et al. A specialized vascular niche for adult neural stem cells // Cell. Stem. Cell. 2008. V. 3. P. 288–379.
Torres A. Extracellular Ca2+ acts as a mediator of communication from neurons to glia // Science Signaling. 2012. V. 5. № 208. P. 208.
Torper O., Pfisterer U., Wolf D.A. et al. Generation of induced neurons via direct conversion in vivo // Proc. Natl. Acad. Sci. USA. 2013. V. 110. P. 7038–7043.
Verkhratsky A., Nedergaard M. Physiology of astroglia // Physiol. Rev. 2018. V. 98. P. 239–389.
Verkhratsky A. Astroglial calcium signaling in aging and Alzheimer’s disease // Cold Spring Harb. Perspect. Biol. 2019. V. 11. № 7. P. a035188.
Vierbuchen T., Ostermeier A., Pang Z.P. et al. Direct conversion of fibroblasts to functional neurons by defined factors // Nature. 2010. V. 463. P. 1035–1041.
Vignoli B., Sansevero G., Sasi M. et al. Astrocytic microdomains from mouse cortex gain molecular control over long-term information storage and memory retention // Communications Biology. 2021. V.4. № 1. P. 1152.
Voigt T. Development of glial cells in the cerebral wall of ferrets: Direct tracing of their transformation from radial glia into astrocytes // J. Comp. Neurol. 1989. V. 289. № 1. P. 74–88.
von Bartheld C.S., Bahney J., Herculano-Houzel S. The search for true numbers of neurons and glial cells in the human brain: a review of 150 years of cell counting // J. Comp. Neurol. 2016. V. 524. № 18. P. 3865–3895.
Wade J.J., Mcdaid L.J., Harkin J. et al. Bidirectional coupling between astrocytes and neurons mediates learning and dynamic coordination in the brain: a multiple modeling approach // PLoS One. 2011. V. 6. P. e29445.
Walrave L., Vinken M., Leybaert L. et al. Astrocytic connexin43 channels as candidate targets in epilepsy treatment // Biomolecules. 2020. V. 10. № 11. P. 1578.
Xiang Z., Xu L., Liu M. et al. Lineage tracing of direct astrocyte-to-neuron conversion in the mouse cortex // Neural Regen. Res. 2021. V. 16. P. 750–756.
Yang H., Liu C., Fan H. et al. Sonic hedgehog effectively improves Oct4 mediated reprogramming of astrocytes into neural stem cells // Mol. Ther. 2019. V. 27. № 8. P. 1467–1482.
Yin J.C., Zhang L., Ma N.X. et al. Chemical conversion of human fetal astrocytes into neurons through modulation of multiple signaling pathways // Stem. Cell. Reports. 2019. V. 12. № 3. P. 488–501.
Zamboni M., Llorens-Bobadilla E., Magnusson J.P. et al. Widespread neurogenic potential of neocortical astrocytes is induced by injury // Cell. Stem. Cell. 2020. V. 27. № 4. P. 605–617.
Zamanian J.L., Xu L., Foo L.C. et al. Genomic analysis of reactive astrogliosis // J. Neurosci. 2012. V. 32. № 18. P. 6391–6410.
Zhang Y., Sloan S.A, Clarke L.A. et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse // Neuron. 2016. V. 89. № 1. P. 37–53.
Zhang K., Förster R., He W. et al. Fear learning induces α7-nicotinic acetylcholine receptor-mediated astrocytic responsiveness that is required for memory persistence // Nat. Neurosci. 2021. V. 24. № 12. P. 1686–1698.
Zhou B., Zuo Y.X., Jiang R.T. Astrocyte morphology: Diversity, plasticity, and role in neurological diseases // CNS. Neurosci. Ther. 2019. V. 25. № 6. P. 665–673.
Zhou H., Su J., Hu X. et al. Glia-to-neuron conversion by CRISPR-CasRx alleviates symptoms of neurological disease in mice // Cell. 2020. V. 181. P. 590–603.
Zhuo L., Theis M., Alvarez-Maya I. et al. hGFAP-cre transgenic mice for manipulation of glial and neuronal function in vivo // Genesis. 2001. V. 31. № 2. P. 85–94.
Zorec R., Araque A., Carmignoto G. et al. Astroglial excitability and gliotransmission: an appraisal of Ca2+ as a signalling route // ASN. Neuro. 2012. V. 4. P. 103–119.
Дополнительные материалы отсутствуют.