Онтогенез, 2022, T. 53, № 5, стр. 345-357
Влияние линолевой кислоты на криоконсервацию полученных путем ЭКО эмбрионов домашней кошки
С. В. Окотруб a, c, Д. А. Лебедева a, c, К. А. Окотруб b, Э. А. Чуйко a, Е. Ю. Брусенцев a, Т. А. Рахманова a, c, С. Я. Амстиславский a, *
a Федеральное государственное бюджетное научное учреждение
“Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения
Российской академии наук”
630090 Новосибирск, пр. ак. Лаврентьева, 10, Россия
b Институт автоматики и электрометрии СО РАН
630090 Новосибирск, пр. Коптюга, 1, Россия
c Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
* E-mail: amstis@yandex.ru
Поступила в редакцию 18.03.2022
После доработки 14.04.2022
Принята к публикации 20.04.2022
- EDN: ZGYSPA
- DOI: 10.31857/S0475145022050068
Аннотация
Изучение роли липидов в преимплантационном развитии млекопитающих является важной фундаментальной проблемой современной эмбриологии. Особенно это актуально при исследовании раннего развития представителей отряда хищных и некоторых других млекопитающих, ооциты и ранние эмбрионы которых содержат много внутриклеточных липидов. Одним из перспективных подходов к повышению криоустойчивости богатых липидами эмбрионов является модификация их липидома in vitro. Целью данной работы было изучение влияния линолевой кислоты (ЛК) на развитие эмбрионов домашней кошки in vitro и оценка того, как изменение состава и общего содержания внутриклеточных липидов влияет на эффективность их криоконсервации. Эмбрионы, полученные in vitro в результате экстракорпорального оплодотворения, культивировали с 400 мкМ ЛК в течение 66 ч, после чего случайным образом распределяли по трем группам: 1) для оценки общего количества липидов и стадии развития; 2) для исследования степени ненасыщенности и температуры начала фазового перехода липидов (Т*); 3) для криоконсервации при помощи программного замораживания. Воздействие ЛК при культивировании in vitro без криоконсервации не влияло на скорость развития эмбрионов. Окрашивание нильским красным не выявило изменений по количеству липидов в клетках после воздействия ЛК. Однако спектроскопия комбинационного рассеяния света показала, что степень ненасыщенности липидов была выше в эмбрионах после культивирования in vitro с ЛК. Воздействие ЛК приводило к снижению Т*, при этом наблюдали большее число ядер в бластоцистах в группе ЛК после криоконсервации по сравнению с контролем, что свидетельствует о более высоком темпе развития таких эмбрионов с модифицированным липидным составом. Таким образом, воздействие ЛК при культивировании in vitro приводило к увеличению степени ненасыщенности липидов и снижению Т* эмбрионов домашней кошки, что отразилось на их развитии после криоконсервации.
ВВЕДЕНИЕ
Изучение роли липидов в преимплантационном развитии млекопитающих является важной фундаментальной проблемой современной эмбриологии (Брусенцев и др., 2019; Idrissi et al., 2021а). В частности, исследование влияния липидных гранул в ходе созревания ооцитов и раннего развития эмбрионов млекопитающих находится в фокусе работ различных исследовательских групп (Welte, Gould, 2017; Ibayashi et al., 2021; Arena et al., 2021). Особенно актуальна эта проблема при исследовании раннего развития представителей отряда хищных и некоторых других млекопитающих, ооциты и ранние эмбрионы которых содержат повышенное содержание внутриклеточных липидов (Брусенцев и др., 2019; Amstislavsky et al., 2019; Bradley, Swann, 2019). Важным аспектом этой проблемы является изучение роли липидов в криорезистентности преимплантационных зародышей млекопитающих (Amstislavsky et al., 2019; Igonina et al., 2021; Брусенцев и др., 2022). Липидные гранулы (ЛГ) и цитоплазматические мембраны клеток чувствительны к охлаждению (Sieme et al., 2015), а процессы, приводящие к криоповреждениям при замораживании, в частности, у богатых липидами преимплантационных эмбрионов остаются плохо изученными. Выяснение фундаментальных механизмов, лежащих в основе высокой криочувствительности богатых липидами эмбрионов является важной задачей (Pereira, Marques, 2008; Amstislavsky et al., 2019; Idrissi et al., 2021b).
Фазовый переход воды в процессе охлаждения является причиной повреждения клетки из-за механического разрушения, как цитоплазматической мембраны, так и различных органелл (Mazur, 1990). Мы предполагаем, что липиды, содержащиеся в больших количествах в ЛГ клеток эмбрионов, также претерпевают фазовый переход и могут инициировать повреждения, связанные с перераспределением и упорядочением их молекул. Фазовый переход липидов (ФПЛ) в клеточных мембранах и ЛГ приводит к фазовому разделению, которое возможно влияет на их функциональные свойства, в частности, их пространственное распределение и текучесть (Quinn, 1985; Mokrousova et al., 2020b). Одной из стратегий уменьшения повреждения клеток при криоконсервации является модификация состава ЛГ с целью смягчения эффектов ФПЛ. Было высказано предположение, что снижение температуры начала ФПЛ (T*) повышает устойчивость репродуктивных клеток к замораживанию (Zeron et al., 2002). Установлено, что Т* зависит от степени ненасыщенности липидов (Zeron et al., 2002; Igonina et al., 2021). Поэтому важны исследования, направленные на модификацию состава внутриклеточных липидов, по изменению степени их ненасыщенности и, соответственно, влияния на Т*, а также на поиск корреляции этих изменений с криочувствительностью эмбрионов различных видов млекопитающих.
В исследованиях на разных видах животных было показано, что воздействие ненасыщенных жирных кислот (ЖК) при культивировании in vitro, в частности, линолевой кислоты (ЛК), улучшает развитие эмбрионов и их жизнеспособность (Fayezi et al., 2018; Karasahin, 2019). Линолевая кислота может влиять на физические свойства биологических мембран, увеличивая их текучесть (Schmitz, Ecker, 2008), что может частично объяснить эти положительные эффекты. Однако исследования модификации содержания липидов в ходе преимплантационного эмбрионального развития до сих пор проводили преимущественно на крупном рогатом скоте и овцах (Amini et al., 2016; Dias et al., 2020) или на лабораторных мышах (Igonina et al., 2021), но не на видах отряда хищных.
Для семейства кошачьих (Felidae) характерны богатые липидами ооциты и преимплантационные зародыши (Crichton et al., 2003; Zahmel et al., 2021). В частности, ранние эмбрионы домашней кошки содержат большое количество внутриклеточных липидов (Amstislavsky et al., 2019). Изучение процессов, которые происходят при криоконсервации ранних эмбрионов домашних кошек, важно для понимания фундаментальных механизмов криочувствительности, в том числе репродуктивных клеток (Okotrub et al., 2018; Mokrousova et al., 2020а), а также может повлиять на успех применения концепции криобанка генетических ресурсов по отношению к диким видам кошачьих (Amstislavsky et al., 2012; Jewgenow, Zahmel, 2020). Наша гипотеза состоит в том, что не только общее количество внутриклеточных липидов, но и их качественный состав, в частности, степень ненасыщенности, может влиять на криоустойчивость преимплантационных эмбрионов домашней кошки, которая достигается благодаря изменению температуры начала ФПЛ.
Цель настоящего исследования заключалась в изучении эффектов воздействия ненасыщенной ЛК в ходе культивирования, полученных в результате ЭКО эмбрионов домашних кошек на их развитие in vitro и криоустойчивость. В связи с этим были поставлены следующие задачи: 1) оценить изменение общего количества внутриклеточных липидов и степени их ненасыщенности в результате воздействия на преимплантационные эмбрионы домашней кошки ЛК при культивировании in vitro; 2) измерить температуру начала фазового перехода в процессе охлаждения эмбрионов домашней кошки как в контроле, так и после воздействия ЛК; 3) определить влияние ЛК на развитие преимплантационных зародышей кошек до и после криоконсервации.
МАТЕРИАЛЫ И МЕТОДЫ
Животные
Семенники с эпидидимисами домашних котов, а также яичники кошек получали после плановой орхиэктомии/овариогистерэктомии в пункте льготной стерилизации животных г. Новосибирска и доставляли в лабораторию. Яичники немедленно после операции помещали в среду “Collect”: 50 мл M199 (Merck, Германия) с добавлением 20 мМ HEPES (Biofroxx, Германия), 2.2 мМ пирувата натрия (Biofroxx, Германия), 2.2 мМ лактата натрия (Fisher Chemical, Германия), 3 г/л бычьего сывороточного альбумина – БСА (Merck, Германия), 50 мкг/мл гентамицина (PanReac Applichem, США), и хранили при 4°C до 4 ч после операции. Семенники с эпидидимисами помещали в стерильные сухие пробирки и хранили при 4°С до 24 ч с момента орхиэктомии. Все эксперименты на животных были одобрены Комитетом по биоэтике Института цитологии и генетики (протокол № 22.2 от 30 мая 2014 г.) и соответствовали стандартам Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей.
Получение и созревание ооцитов in vitro
Кумулюс-ооцитные комплексы (КОК-сы) выделяли из фолликулов в подогретой до 38.5°С среде “Collect”, используя стереомикроскоп S8 APO (Leica Microsystems, Германия). Ооциты с темной и гомогенной цитоплазмой, окруженные несколькими слоями клеток кумулюса, промывали для удаления дебриса и отбирали для созревания in vitro. Среда для созревания: 25 мл M199 в концентрации 9.5 г/л с добавлением 15 мМ бикарбоната натрия (Merck, Германия), 2.2 мМ пирувата натрия, 2.2 мМ лактата натрия, 3 г/л БСА, 50 мкг/мл гентамицина, 10 МЕ/мл хорионического гонадотропина человека – Хорулон (Intervet international, B.V., Нидерланды) и 2 МЕ/мл хорионического гонадотропина лошади – Фоллигон (Intervet international, B.V., Нидерланды). Помещали КОК-сы в 4-луночный планшет (SPL, Южная Корея) с предварительно выдержанной не менее двух часов в атмосфере 5% СО2 средой для дозревания (500 мкл на лунку), покрытой 400 мкл минерального масла FertiCult (FertiPro, Бельгия), и помещали в СО2-инкубатор New Brunswick™ Galaxy 48R (Eppendorf, Германия) при 38.5°С, 5% СО2, и 90% влажности на 24 ч.
Получение сперматозоидов и экстракорпоральное оплодотворение
Сперматозоиды получали из эпидидимисов девяти взрослых беспородных домашних котов, как описано ранее (Brusentsev et al., 2018). Вкратце, каудальные части эпидидимисов извлекали, переносили на чашку Петри и измельчали в одном мл среды “Collect”, подогретой до 37°C. Раствор со сперматозоидами дважды центрифугировали при 3000 об./мин в течение 5 мин в среде “Collect” и удаляли супернатант. Осадок смешивали с минимальным (5–10 мкл) количеством оставшегося супернатанта и сверху добавляли 200 мкл среды “Collect”. Пробирку помещали в СО2-инкубатор на 30 мин для всплытия сперматозоидов в верхний слой раствора, а затем их собирали и использовали для экстракорпорального оплодотворения (ЭКО). Концентрацию сперматозоидов и их подвижность оценивали в счетной камере Маклера (Merck, Германия). Оплодотворение проводили в среде для культивирования: 25 мл Ham’s F-10 (Merck, Германия) в концентрации 9.8 г/л с добавлением 5% фетальной телячьей сыворотки (Fetal Calf Serum) – FCS (Thermo fisher scientific, США) и 50 мкг/мл гентамицина. Созревшие ооциты переносили в 4-луночный планшет со средой для культивирования (по 500 мкл на лунку) предварительно выдержанной в атмосфере 5% СО2 в течение не менее двух часов. Сверху среда была покрыта 400 мкл минерального масла FertiCult (FertiPro, Бельгия). В чашку с 10–20 ооцитами на лунку объемом 500 мкл добавляли 8 мкл суспензии сперматозоидов с конечной концентрацией 1 × 106 подвижных сперматозоидов/мл. Гаметы совместно инкубировали в CO2-инкубаторе New Brunswick™ Galaxy 48R (Eppendorf, Германия) при 38.5°C, 5% CO2 и влажности 90% в течение 24 ч. Средний процент дробления in vitro составил 38.8%, который оценивали, как число 2-клеточных эмбрионов, развившихся из оплодотворенных зрелых ооцитов через 24 ч после ЭКО.
Приготовление раствора линолевой кислоты
Раствор ЛК готовили по протоколу (Aardema et al., 2011). Вкратце, 3.21 мл водного раствора 10 мМ гидроксида калия (Merck, Германия) смешивали с 19 мкл ЛК (Merck, Германия) при 70°C в течение 30 мин с получением 20 мМ раствора линолеата калия. Затем раствор инкубировали с 3.3 мМ БСА без жирных кислот (BSA Fatty Acid-free; Merck, Германия) с получением 10 мМ раствора ЛК-БСА в соотношении 3 : 1. Приготовленный раствор добавляли в среду для культивирования in vitro эмбрионов до конечной концентрации 400 мкМ.
Воздействие линолевой кислоты на эмбрионы in vitro и дизайн эксперимента
Дизайн эксперимента представлен графически на рис. 1. Двухклеточные эмбрионы домашней кошки, полученные в результате ЭКО, были разделены на две группы: контрольную и группу, которую культивировали с добавлением линолевой кислоты – группа ЛК. Эмбрионы контрольной группы культивировали в течение 66 ч в 20 мкл среды Ham’s F-10 с добавлением 5% FCS и 50 мкг/мл гентамицина. Эмбрионы из группы ЛК культивировали в течение того же времени и в той же среде, но с добавлением 400 мкМ ЛК, связанной с БСА. После культивирования некоторые из преимплантационных зародышей анализировали при помощи Рамановской спектроскопии для оценки степени ненасыщенности внутриклеточных липидов. Другие зародыши фиксировали в 400 мкл 4%-го формальдегида на фосфатно-солевом буферном растворе – PBS (Росмедбио, Россия) при рН 7.4–7.6 для дальнейшей оценки числа клеток и уровня фрагментации ядер (после окраски DAPI и флуоресцентной микроскопии) либо для оценки общего уровня внутриклеточных липидов (после окраски нильским красным и конфокальной микроскопии). Остальные эмбрионы замораживали, оттаивали и культивировали in vitro в течение 30 ч, а затем оценивали стадию развития при помощи световой микроскопии, фиксировали, как описано выше и производили оценку числа клеток и уровня фрагментации ядер после окрашивания DAPI и флуоресцентной микроскопии. Общее время культивирования in vitro эмбрионов, подвергавшихся замораживанию, на момент фиксации составило 96 ч.
Криоконсервация эмбрионов
Эмбрионы замораживали по протоколу Гомец с соавт. (2003) с модификациями (Gomez et al., 2003). Раствор криопротектора содержал 0.125 М сахарозы (Merck, Германия), 10% пропиленгликоля – ПГ (Merck, Германия) на среде “Collect” с добавлением 10% FCS. Эмбрионы обеих групп (контрольной и группы ЛК) выдерживали в криопротекторной смеси, разбавленной средой “Collect” в соотношении 1 : 2, а затем 2 : 1, по три минуты в каждой; после этого переносили в неразбавленный раствор криопротектора (10% ПГ и 0.125 М сахарозы) на 15 мин при комнатной температуре и помещали в пластиковую соломину объемом 0.25 мл (Cryo Bio System, Франция), заполненную раствором для замораживания (три сектора, разделенные пузырьками воздуха); зародыши помещали в средний сектор. Соломину с эмбрионами помещали в программный замораживатель CL 8800 (CryoLogic, Австралия) при 20°С, и охлаждали со скоростью 2°С/мин до –6°С, а затем выдерживали при этой температуре 10 мин. В течение этого 10-минутного периода вручную инициировали нуклеацию льда, прикасаясь к соломине предварительно охлажденным пинцетом к верхнему мениску первого и второго секторов. Затем возобновляли охлаждение со скоростью 0.3°С/мин до –30°С и выдерживали при этой температуре в течение 10 мин. После этого соломину погружали в жидкий азот (LN2). Для оттаивания соломину извлекали из LN2 и выдерживали на воздухе при комнатной температуре в течение двух минут, как было рекомендовано ранее для данного протокола криоконсервации (Gomez et al., 2003). Эмбрионы отмывали от криопротектора путем переноса между каплями растворов с различной концентрацией ПГ/сахарозы на основе среды “Collect” (0.95 М/0.25 М; 0.95 М/0.125 М; 0.45 М/0.125 М; 0 М/0.125 М; 0 М/0.0625 М) по 3 мин в каждой капле. Затем их переносили в среду для культивирования in vitro на 30 ч. После этого эмбрионы фиксировали и оценивали путем окрашивания DAPI с последующей флуоресцентной микроскопией, как описано ниже.
Окрашивание DAPI и флуоресцентная микроскопия
Фиксированные эмбрионы трижды отмывали от формальдегида при комнатной температуре в PBS с добавлением 1 мг/мл поливинилпирролидона – ПВП (Merck, Германия) в течение 5 мин, а затем инкубировали с 2 мг/мл DAPI для окрашивания ядер. После этого их снова промывали таким же образом и помещали на предметные стекла. Образцы оценивали с помощью микроскопа Axio Imager.M2 (Carl Zeiss, Германия), с фильтром, подходящим для окрашивания DAPI, цифровой камеры AxioCam 506 mono (Carl Zeiss, Германия) и программы ImageJ (NIH, США).
Для каждого эмбриона подсчитывали как общее число ядер, так и отдельно число интерфазных ядер и число фрагментированных ядер. Индекс фрагментации оценивали, как процент ядерных фрагментов к общему числу ядер. По общему числу ядер (Mokrousova et al., 2020b) преимплантационные зародыши классифицировали как остановившиеся в развитии (менее 8 ядер), на стадии дробления (9–16 ядер), морулы (17–50 ядер) и бластоцисты (более 50 ядер).
Окрашивание нильским красным и конфокальная микроскопия
Оценку интенсивности окрашивания внутриклеточных липидов контрольных и культивированных в течение 66 ч с ЛК эмбрионов проводили с помощью окрашивания нильским красным – Nile Red (Merck, Германия), как описано ранее (Romek et al., 2011). Вкратце, фиксированные эмбрионы трижды отмывали от формальдегида в PBS, содержащем 1 мг/мл ПВП, по 5 мин в каждой капле при комнатной температуре и инкубировали в растворе нильского красного с концентрацией 10 мкг/мл в течение трех часов при 37°C для достижения максимальной интенсивности окрашивания внутриклеточных липидов, как описано ранее (Genicot et al., 2005). Образцы помещали на предметные стекла в PBS. Изображения получали с помощью конфокального лазерного сканирующего микроскопа 780 NLO Axio Observer Z1 (Carl Zeiss, Германия) с использованием программного обеспечения Zen 2012 (Carl Zeiss, Германия). Эмбрионы, окрашенные нильским красным, облучали газовым аргоновым лазером (максимальная мощность 30 мВт) при 0.1% от максимальной мощности на длине волны 488 нм. Спектры получали в диапазоне длин волн 494–687 нм с шагом 9 нм. Все изображения были получены в режиме подсчета фотонов – “photon counting”. Суммирование оптических срезов и вычитание фоновой флуоресценции выполняли с помощью программы ImageJ. Микроскопические работы выполнены в ЦКП “Микроскопического анализа биологических объектов” ИЦиГ СО РАН (https://ckp.icgen.ru/ckpmabo).
Спектроскопия комбинационного рассеяния света
Изменение степени ненасыщенности липидов и температуру начала ФПЛ в эмбрионах домашней кошки изучали с помощью спектроскопии комбинационного рассеяния света.
Экспериментальная установка
Спектроскопию комбинационного рассеяния света проводили на экспериментальной установке, состоящей из прямого микроскопа Orthoplan (Leitz, Германия), оснащенного сканирующим пьезопозиционером PXY-200 (Newport, США) и монохроматора SP2500i (Princeton Instruments, США), снабженным зарядным устройством, сопряженным с инструментальным детектором Spec-10:2K/LN (Princeton Instruments, США). Оптический криостат THMS350V (Linkam, Великобритания) использовали для проведения измерений спектров при различных температурах. Источником монохроматического излучения для возбуждения комбинационного рассеяния света служил твердотельный лазер Excelsior (Spectra-Physics, США) с длиной волны 532.1 нм. Лазерный луч фокусировали в пятно диаметром ~1 мкм с помощью объектива ×60 CFI Plan Fluor 60XC (Nikon Instruments, Япония) с числовой апертурой 0.85. Мощность излучения после объектива составляла 20 мВт. Спектральное разрешение составляло 2.5 см–1. Длины волн всех измеренных спектров калибровали с помощью неоновой газоразрядной лампы. Спектры комбинационного рассеяния света измерялись в диапазоне от 800 до 3200 см–1.
Оценка степени ненасыщенности внутриклеточных липидов
Пять контрольных и шесть эмбрионов группы ЛК, культивированных в течение 66 ч, исследовали при помощи спектроскопии комбинационного рассеяния света. Для изучения степени ненасыщенности липидов в эмбрионах было измерено 100 спектров комбинационного рассеяния от разных случайно выбранных локальных областей внутри эмбрионов. Для выделения спектрального вклада липидов использовался метод главных компонент. Поскольку наиболее интенсивный сигнал комбинационного рассеяния исходит от липидных гранул, мы предполагаем, что полученная спектральная составляющая липидов в основном связана именно с ними. Метод выделения вклада липидов в спектры комбинационного рассеяния света был описан нами в работе Игониной и соавторов (2021) ранее (Igonina et al., 2021). Вкратце, чтобы извлечь вклад липидов, мы уменьшили размерность данных до трех главных компонент, связанных с вариацией в спектрах трех основных типов соединений: липидов, белков и воды, которые дают наиболее интенсивный вклад в измеряемые спектры. Затем подбирали такую линейную комбинацию этих компонент, чтобы результирующий спектр был свободен от пика фенилаланина при 1004 см–1 и полосы валентных колебаний ОН воды на частотах выше 3050 см–1. Поскольку в спектре комбинационного рассеяния света липидов отсутствуют линии на этих частотах, полученная комбинация главных компонент будет отражать липидный вклад в измеряемые спектры. Для оценки степени ненасыщенности липидов использовали соотношение интенсивностей линии валентных колебаний связей С=С при 1657 см–1 к линии ножничных деформационных колебаний СН2 (δСН). Интенсивность первой линии увеличивается с увеличением концентрации двойных связей С=С, интенсивность второй линии увеличивается с увеличением числа метиленовых групп. Для характеристики ненасыщенности мы использовали спектры комбинационного рассеяния, измеренные при T = 25°C.
Измерение температуры начала фазового перехода липидов при охлаждении эмбрионов
Для изучения зависимости фазового состояния липидов от температуры эмбрионы помещали в раствор EmbryoMax KSOM (Merck, Германия) с добавлением 0.2 М сахарозы и 1.5 М ПГ. Охлаждение эмбрионов проводили сходным образом, как описано выше для основного эксперимента (см раздел “Криоконсервация эмбрионов”). Вначале эмбрионы охлаждали до –7°С со скоростью 1°С/мин, затем вручную инициировали нуклеацию льда, и образец выдерживали в течение 10-минут при данной фиксированной температуре для перекристаллизации льда. После этого образец охлаждали со скоростью 0.3°С/мин. В процессе охлаждения делали дополнительные паузы ~20 мин для измерения спектров комбинационного рассеяния. Температуру на нужном уровне поддерживали при помощи криостата. Изменение фазового состояния липидов отслеживали по соотношению интенсивностей антисимметричных (aCH) и симметричных (sCH) валентных колебаний CH2 на 2880 и 2850 см–1 соответственно. Эта особенность в спектрах комбинационного рассеяния отражает изменение конформационного состояния липидов, происходящее при фазовом переходе. Из-за сложного состава внутриклеточных липидов ФПЛ в клетках происходит не при одной конкретной температуре, а в некотором температурном диапазоне. Поэтому мы отслеживали Т* при которой появляется пик aCH (Okotrub et al., 2018). Предварительная обработка данных включала коррекцию всплесков интенсивности в измеренных спектрах и интерполяцию фона линейной функции. Спектры анализировали и обрабатывали, как описано ранее (Okotrub et al., 2018; Igonina et al., 2021).
Статистика
Данные проверяли на нормальное распределение с помощью критерия Шапиро–Уилка и анализировали с помощью программы STATISTICA v 8.0 StatSoft, Inc. Данные с нормальным распределением сравнивали по t-критерию Стьюдента, в противном случае использовали U-критерий Манна–Уитни. Процент эмбрионов на разных стадиях развития до и после замораживания сравнивали с помощью критерия Хи-квадрат. Данные по фрагментации ядер представлены в виде медианы и 25–75% квартилей – Ме [Q1; Q3] и сравнены по U-критерию Манна–Уитни. Число клеток в морулах и бластоцистах до и после криоконсервации, интенсивность флуоресценции липидов (подсчет фотонов), а также степени ненасыщенности липидов и Т* представлены, как среднее ± ± стандартная ошибка среднего (M ± SEM). Различия по этим параметрам между группами сравнивали с помощью t-критерия Стьюдента. Различия при p < 0.05 считали статистически достоверными (k – число степеней свободы).
РЕЗУЛЬТАТЫ
Развитие эмбрионов in vitro после воздействия линолевой кислоты
Добавление в культуральную среду ЛК в дозе 400 мкМ не влияло ни на развитие эмбрионов, ни на фрагментацию их ядер (табл. 1). Достоверных различий между группой ЛК и контролем по числу ядер через 66 ч культивирования выявлено не было (табл. 2, рис. 2).
Таблица 1.
Влияние добавления линолевой кислоты при культивировании in vitro на стадию развития эмбрионов домашней кошки и фрагментацию ядер до криоконсервации
| Параметры | Группы1 | |
|---|---|---|
| контроль | ЛК | |
| Число эмбрионов | 39 | 43 |
| Не развивающиеся, % | 1 (2.6) | 4 (9.3) |
| Дробящиеся, % | 6 (15.4) | 5 (11.6) |
| Морулы, % | 24 (61.5) | 28 (65.1) |
| Бластоцисты, % | 8 (20.5) | 6 (14.0) |
| Индекс фрагментации2 | 2.0 [0;4.2] | 2.6 [0;6.1] |
Таблица 2.
Влияние добавления линолевой кислоты при культивировании in vitro на число ядер эмбрионов кошки до и после криоконсервации
| Группа | Число ядер до криоконсервации, культивирование in vitro – 66 ч | |||||
|---|---|---|---|---|---|---|
| морулы | бластоцисты | |||||
| число эмбрионов | общее число ядер | интерфазные ядра | число эмбрионов | общее число ядер | интерфазные ядра | |
| Контроль | 24 | 36.0 ± 2.2 | 31.7 ± 1.6 | 8 | 61.0 ± 2.9 | 58.5 ± 2.8 |
| ЛК | 28 | 32.3 ± 2.2 | 27.4 ± 1.7 | 6 | 65.8 ± 6.2 | 62.0 ± 5.2 |
| Число ядер после криоконсервации и последующего (30 ч) культивирования in vitro Общее время культивирования до и после криоконсервации – 96 ч |
||||||
| Контроль | 21 | 36.8 ± 2.9 | 33.9 ± 2.6 | 11 | 76.8 ± 10.6 | 62.6 ± 5.4 |
| ЛК | 21 | 27.7 ± 2.7* | 25.7 ± 1.7+ | 16 | 96.0 ± 12.3 | 91.8 ± 10.7# |
Анализ степени ненасыщенности и фазового перехода липидов
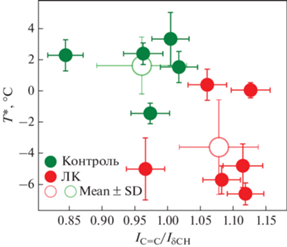
Среднее отношение интенсивностей IC=C/IδCH = = 0.96 ± 0.03 для эмбрионов, культивируемых без ЛК, а Т* = 1.6 ± 0.8°С (рис. 3). Добавление 400 мкМ ЛК в культуральную среду вызывало достоверное увеличение (k = 9; t = 3.333; p < 0.01) степени ненасыщенности (среднее IC=C/IδCH = = 1.08 ± 0.02), а также достоверное снижение (k = 9; t = 3.611; p < 0.01) температуры начала фазового перехода липидов до T* = –3.6 ± 1.2°С. Таким образом, воздействие ЛК на эмбрион значительно повышало степень ненасыщенности липидов и существенно снижало T*.
Рис. 3.
Степень ненасыщенности липидов и Т* в бластомерах эмбрионов домашней кошки. Степень ненасыщенности липидов после культивирования in vitro эмбрионов домашней кошки c линолевой кислотой достоверно больше (t = 3.333; p < 0.01) по сравнению с контролем. Число степеней свободы (k) – 9. Температура начала фазового перехода липидов после культивирования in vitro эмбрионов домашней кошки c линолевой кислотой достоверно ниже (t = 3.611; p < < 0.01) по сравнению с контролем. Число степеней свободы (k) – 9.
Оценка общего содержания внутриклеточных липидов
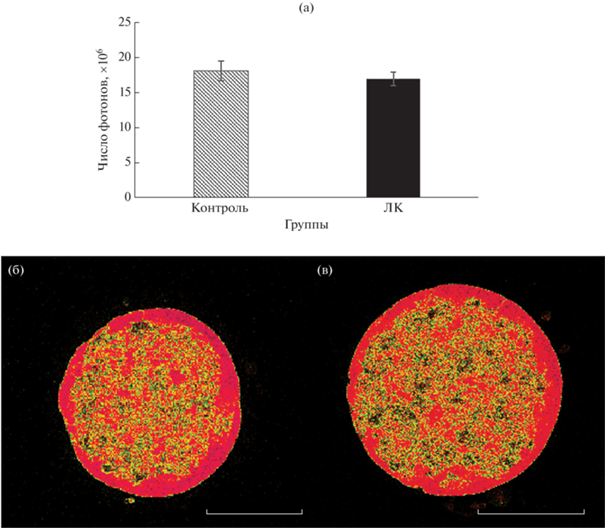
Добавление в среду 400 мкМ ЛК и культивирование в течение 66 ч не влияло на общее количество липидов в эмбрионах кошек. Интенсивность флуоресценции, измеренная по числу фотонов, в контроле – у эмбрионов, культивированных без добавления кислоты (18.08 × 106 ± 1.38 × 106) и в группе ЛК (16.92 × 106 ± 0.97 × 106), не отличалась (рис. 4).
Рис. 4.
Интенсивность флуоресценции нильского красного после 66 часов культивирования in vitro эмбрионов без и с линолевой кислотой. (а) Средняя интенсивность M ± SEM; (б, в) репрезентативные оптические срезы КЛСМ эмбрионов кошек, окрашенных нильским красным. (б) Без ЛК; (в) с ЛК. Цвет соответствует длинам доминирующих волн. Масштаб – 50 мкм.
Жизнеспособность эмбрионов после криоконсервации
Добавление 400 мкМ ЛК в культуральную среду не влияло на долю эмбрионов, находящихся на разных стадиях развития после оттаивания с последующим культивированием in vitro в течение 30 ч (табл. 3). В полученных таким образом морулах было меньше общее число ядер (k = 40; t = 2.275; p < 0.05), а также интерфазных ядер (k = 40; t = 2.612; p < 0.05) после воздействия ЛК при культивировании in vitro по сравнению с контролем (табл. 2). В бластоцистах ЛК группы, напротив, было обнаружено большее число интерфазных ядер (k = 25; t = 2.130; p < 0.05) по сравнению с контролем (табл. 2, рис. 5). Индекс фрагментации не отличался между группами после криоконсервации (табл. 3).
Таблица 3.
Влияние добавления линолевой кислоты при культивировании in vitro на стадию развития эмбрионов домашней кошки и фрагментацию ядер после криоконсервации
| Параметры | Группы1 | |
|---|---|---|
| контроль | ЛК | |
| Число эмбрионов | 36 | 43 |
| Не развивающиеся, % | 3 (8.3) | 4 (9.3) |
| Дробящиеся, % | 1 (2.8) | 2 (4.7) |
| Морулы, % | 21 (58.3) | 21 (48.8) |
| Бластоцисты, % | 11 (30.6) | 16 (37.2) |
| Индекс фрагментации2 | 6.0 [3.1;11.7] | 4.5 [2.0;7.7] |
ОБСУЖДЕНИЕ
В данном исследовании степень ненасыщенности внутриклеточных липидов в полученных путем ЭКО эмбрионах кошек возрастала после воздействия на них ЛК in vitro. Наши данные хорошо согласуются с более ранним наблюдением, в котором сообщалось об аналогичном увеличении уровня ненасыщенности внутриклеточных липидов у эмбрионов мышей, культивированных с ЛК (Igonina et al., 2021).
В работах, проведенных на эмбрионах крупного рогатого скота и эмбрионах мышей, культивируемых in vitro с ЛК или конъюгированной линолевой кислотой (КЛК), оценивали общее содержание липидов, которое либо изменялось, либо оставалось на прежнем уровне в зависимости от используемой дозы (Accorsi et al., 2016; Carvalho et al., 2019; Dias et al., 2020; Igonina et al., 2021). В частности, в упомянутом выше исследовании Игониной с соавт. (2021) общее количество внутриклеточных липидов возрастало у эмбрионов мышей после воздействия на них ЛК при культивировании in vitro, однако в настоящем исследовании на эмбрионах кошек изменений общего количества внутриклеточных липидов выявлено не было. Мы предполагаем, что это может быть результатом изначально высокого содержания липидов в преимплантационных зародышах кошек. Кроме того, непрозрачность эмбрионов, связанная с интенсивным рассеянием света на ЛГ, затрудняет объемную интеграцию флуоресцентного сигнала для эмбрионов кошек, в отличие от гораздо более прозрачных эмбрионов мышей, которые содержат меньше внутриклеточных липидов (Igonina et al., 2021). В нашей работе метод оценки общего содержания липидов в преимплантационных эмбрионах путем окраски их флуорохромом нильским красным и последующей конфокальной микроскопии был впервые применен в отношении кошачьих. Результаты исследования свидетельствуют о том, что в отличие от эмбрионов мышей, в отношении которых применение данного подхода является достаточно эффективным для определения влияния ЛК на ЛГ (Igonina et al., 2021), для преимплантационных зародышей кошек, которые богаты внутриклеточными липидами (Amstislavsky et al., 2019), этот метод не позволил обнаружить изменения общего содержания липидов и нуждается в существенной модификации. Мы полагаем, что увеличение степени ненасыщенности липидов в эмбрионах после воздействия ЛК, наблюдаемое в настоящем исследовании на кошках и предыдущей работе на мышах (Igonina et al., 2021), важно само по себе и эти изменения могут являться причиной изменения криобиологических характеристик эмбрионов, имевшего место в обоих случаях.
В принципе, добавление жирных кислот при культивировании преимплантационных эмбрионов не обязательно должно приводить к сдвигу температуры начала фазового перехода, но также может сопровождаться разделением липидов на фракции с высокой и низкой температурой плавления, кроме того, после оттаивания часть насыщенных липидов может оставаться в упорядоченной фазе, что возможно оказывает негативный эффект на жизнеспособность клетки (Okotrub et al., 2021). Мы предполагаем, что добавления ЛК может быть достаточным для снижения Т* за счет увеличения степени ненасыщенности внутриклеточных липидов, как это наблюдалось в нашем эксперименте. В нашей предыдущей работе (Igonina et al., 2021) мышиные эмбрионы, после воздействия ЛК, имели почти двукратное увеличение степени ненасыщенности. Для кошачьих эмбрионов из-за их высокого содержания жиров и в целом высокой степени их ненасыщенности мы наблюдаем только ~10% увеличение удельного числа двойных связей в липидах. Однако эффект снижения Т* оказался сопоставимым: –8 (±2)°С для мышей и –5 (±2)°С для эмбрионов кошек.
Наши результаты показывают, что в результате воздействия ЛК в ходе культивирования in vitro наблюдается большее число клеток в развивающихся бластоцистах кошек после процедур замораживания-оттаивания, что может свидетельствовать о переходе морул на более продвинутую стадию развития именно в группе ЛК. Подобные положительные эффекты ЛК или КЛК на развитие эмбрионов после криоконсервации были продемонстрированы на крупном рогатом скоте (Pereira et al., 2007; Accorsi et al., 2016). В частности, криоконсервированные эмбрионы крупного рогатого скота, после воздействия ЛК, восстанавливались быстрее, чем контрольные (Pereira et al., 2007), хотя, как показали позднее, этот эффект был временным (Accorsi et al., 2016). Точно так же эмбрионы крупного рогатого скота, после добавления 100 мкМ КЛК в культуральную среду, демонстрировали более высокую скорость реэкспандирования бластоцист после криоконсервации по сравнению с контролем, однако этот эффект нивелировался с увеличением времени воздействия (Dias et al., 2020).
На основе анализа литературы, нами ранее была выдвинута гипотеза о том, что не только общее количество внутриклеточных липидов, но и степень их ненасыщенности может влиять на криобиологические характеристики ооцитов и эмбрионов млекопитающих (Amstislavsky et al., 2019). Мы предположили, что наличие более насыщенных жиров в клетках повышает температуру начала фазового перехода липидов, и, соответственно, криоконсервация, с большей вероятностью, приводит к разрушению замораживаемого образца. С другой стороны, чем более ненасыщены внутриклеточные липиды, тем ниже температура начала фазового перехода липидов, и соответственно, возрастает толерантность к низким температурам у клеток. Результаты недавнего исследования на мышах подтвердили нашу гипотезу в том, что при культивировании эмбрионов in vitro с ЛК степень ненасыщенности внутриклеточных липидов возрастает и это сопровождается снижением температуры начала ФПЛ, однако, при этом, не было отмечено каких-либо признаков изменения криорезистентности эмбрионов (Igonina et al., 2021). Следует отметить, что эмбрионы мышей содержат мало липидов и эти внутриклеточные липиды не играют столь значимой роли в преимплантационном развитии мышей, какую они имеют у видов млекопитающих, ооциты и эмбрионы которых богаты внутриклеточными жирами (Bradley, Swann, 2019). Таким образом, гипотезу необходимо было проверить на другом виде животных, ооциты и эмбрионы которых богаты внутриклеточными липидами, к таким, в частности, относится домашняя кошка. Результаты настоящего исследования подтверждают нашу гипотезу, поскольку воздействие ненасыщенной ЛК при культивировании in vitro эмбрионов домашней кошки привело к повышению степени ненасыщенности внутриклеточных липидов и снижению температуры начала ФПЛ. При этом имело место возрастание числа клеток в бластоцистах, полученных после культивирования тех замороженно-оттаянных эмбрионов, которые подвергались воздействию ЛК до криоконсервации. Это свидетельствует о том, что возрастание степени ненасыщенности внутриклеточных липидов может отражаться на устойчивости к криоконсервации эмбрионов домашней кошки посредством влияния на температуру начала ФПЛ.
Исторически считали, что липидные гранулы в клетках животных являются исключительно хранилищем нейтральных липидов, но в последние два десятилетия их роль существенно пересмотрена и им посвящено большое число исследований различных групп (Welte, Gould, 2017; Herker et al., 2021; Ibayashi et al., 2021). Наряду с функцией сохранения энергетического субстрата, показана роль ЛГ во внутриклеточном метаболизме липидов (Athenstaedt, Daum, 2006), в частности, в их биосинтезе (Kuerschner et al., 2008), они способны удерживать некоторые токсичные липофильные молекулы, обеспечивая детоксикацию клетки (Welte, Gould, 2017), принимать участие в экспрессии генов, запасании белка, борьбе с некоторыми вирусными инфекциями и поддержании гомеостаза (Herker et al., 2021; Ibayashi et al., 2021). Развитие микроскопических и спектроскопических методов способствовало этим исследованиям и возрастающему интересу фундаментальной науки к внутриклеточным ЛГ, в том числе и в ходе созревания ооцитов и развития преимплантационных эмбрионов различных видов млекопитающих (Брусенцев и др., 2019; Ibayashi et al., 2021; Arena et al., 2021). В результате нашей работы показана принципиальная возможность влиять на криобиологические характеристики полученных in vitro эмбрионов кошек путем изменения степени ненасыщенности внутриклеточных липидов в результате их культивирования in vitro с ненасыщенной жирной кислотой. Этот результат важен как для эмбриологии, так и фундаментальной криобиологии. Кроме того, этот результат, полученный на эмбрионах домашних кошек может иметь значение и для сохранения исчезающих представителей кошачьих, поскольку многие представители этого семейства находятся под угрозой (Найденко, 2019), а репродуктивные технологии, такие как ЭКО и криоконсервация гамет и эмбрионов являются важными современными инструментами сохранения генетических ресурсов диких видов кошачьих (Амстиславский и др., 2021).
ЗАКЛЮЧЕНИЕ
Наши результаты подтверждают гипотезу о том, что качественный состав внутриклеточных липидов, в частности, повышение степени их ненасыщенности благодаря воздействию ЛК в процессе культивирования in vitro, влияет на криобиологические характеристики преимплантационных эмбрионов домашней кошки, вызывая, в частности, понижение температуры начала ФПЛ. Воздействие ЛК при культивировании in vitro эмбрионов кошек увеличивало степень ненасыщенности внутриклеточных липидов примерно на 10%, но не влияло на общее их количество. Эти изменения привели к снижению температуры начала ФПЛ на 5°С и более высоким темпам последующего развития in vitro эмбрионов после оттаивания. Таким образом, снижение температуры начала ФПЛ эмбрионов домашних кошек, после воздействия на них ЛК в ходе культивирования in vitro, может приводить к увеличению их криоустойчивости.
Список литературы
Амстиславский С.Я., Мокроусова В.И., Окотруб С.В., Брусенцев Е.Ю., Напримеров В.А. Применение концепции криобанка по отношению к диким и исчезающим видам отряда хищных (Carnivora) // Онтогенез. 2021. Т. 52. № 5. С. 345–366.
Брусенцев Е.Ю., Мокроусова В.И., Игонина Т.Н., Рожкова И.Н., Амстиславский С.Я. Роль липидных гранул в развитии ооцитов и преимплантационных эмбрионов млекопитающих // Онтогенез. 2019. Т. 50. № 5. С. 297–305.
Брусенцев Е.Ю., Игонина Т.Н., Окотруб С.В., Чуйко Э.А., Амстиславский С.Я. Влияние линолевой кислоты на эффективность витрификации эмбрионов мышей // Онтогенез. 2022. Т. 53. № 1. С. 58–62.
Найденко С.В. Биология размножения кошачьих: механизмы повышения репродуктивного успеха. Институт проблем экологии и эволюции имени А.Н. Северцова Российской академии наук. М.: КМК, 2019. 191 с.
Aardema H., Vos P., Lolicato F., et al. Oleic acid prevents detrimental effects of saturated fatty acids on bovine oocyte developmental competence // Biol. Reprod. 2011. V. 85. P. 62–69.
Accorsi M., Leao B., Rocha-Frigoni N., Perri S., Mingoti G. Reduction in cytoplasmic lipid content in bovine embryos cultured in vitro with linoleic acid in semi-defined medium is correlated with increases in cryotolerance // Zygote. 2016. V. 24. P. 485–494.
Amini E., Asadpour R., Roshangar L., Jafari-Joozani R. Effect of linoleic acid supplementation on in vitro maturation, embryo development and apoptotic related gene expression in ovine // Int. J. Reprod. Biomed. 2016. V. 14. P. 255–262.
Amstislavsky S., Lindeberg H., Luvoni G. Reproductive technologies relevant to the genome resource bank in Carnivora // Reprod. Dom. Anim. 2012. V. 47. P. 164–175.
Amstislavsky S., Mokrousova V., Brusentsev E., Okotrub K., Comizzoli P. Influence of cellular lipids on cryopreservation of mammalian oocytes and preimplantation embryos: a review // Biopreserv. Biobanking. 2019. V. 17. P. 76–83.
Arena R., Bisogno S., Gasior L. et al. Lipid droplets in mammalian eggs are utilized during embryonic diapause // Proc. Natl. Acad. Sci. USA. 2021. V. 118. e2018362118.
Athenstaedt K., Daum G. The life cycle of neutral lipids: synthesis, storage and degradation // Cell. Mol. Life Sci. 2006. V. 63. № 12. P. 1355–1369.
Bradley J., Swann K. Mitochondria and lipid metabolism in mammalian oocytes and early embryos // Int. J. Dev. Biol. 2019. V. 63. P. 93–103.
Brusentsev E., Kizilova E., Mokrousova V., Kozhevnikova V., Rozhkova I., Amstislavsky S. Characteristics and fertility of domestic cat epididymal spermatozoa cryopreserved with two different freezing media // Theriogenology. 2018. V. 110. P. 148–152.
Carvalho B., Costa F., Detoni D., Rosa F., Dias A. Use of conjugated linoleic acid (trans 10, cis 12) to cultivate bovine embryos: effect on cryoresistance and lipid content // Rev. Bras. Zoot. 2019. V. 48. e20180322.
Crichton E., Bedows E., Miller-Lindholm A. et al. Efficacy of porcine gonadotropins for repeated stimulation of ovarian activity for oocyte retrieval and in vitro embryo production and cryopreservation in Siberian tigers (Panthera tigris altaica) // Biol. Reprod. 2003. V. 68. P. 105–113.
Dias L., Leme L., Spricigo J., Pivato I., Dode M. Effect of delipidant agents during in vitro culture on the development, lipid content, gene expression and cryotolerance of bovine embryos // Reprod. Dom. Anim. 2020. V. 55. P. 11–20.
Fayezi S., Leroy J., Ghaffari Novin M., Darabi M. Oleic acid in the modulation of oocyte and preimplantation embryo development // Zygote. 2018. V. 26. P. 1–13.
Genicot G., Leroy J., Van Soom A., Donnay I. The use of a fluorescent dye Nile red to evaluate the lipid content of single mammalian oocytes // Theriogenology. 2005. V. 63. P. 1181–1194.
Gomez M., Pope E., Harris R., Mikota S., Dresser B. Development of in vitro matured, in vitro fertilized domestic cat embryos following cryopreservation, culture and transfer // Theriogenology. 2003. V. 60. V. 239–251.
Herker E., Vieyres G., Beller M., Krahmer N., Bohnert M. Lipid droplet contact sites in health and disease // Trends. Cell. Biol. 2021. V. 31. P. 345–358.
Ibayashi M., Aizawa R., Mitsui J., Tsukamoto S. Homeostatic regulation of lipid droplet content in mammalian oocytes and embryos // Reproduction. 2021. V. 162. R99–R109.
Idrissi S., Bourhis D., Lefevre A. et al. Effects of the donor factors and freezing protocols on the bovine embryonic lipid profile // Biol. Reprod. 2021a. ioab198.
Idrissi S., Bourhis D., Lefevre A. et al. Lipid profile of bovine grade-1 blastocysts produced either in vivo or in vitro before and after slow freezing process // Sci. Rep. 2021b. V. 11. P. 11618.
Igonina T., Okotrub K., Brusentsev E. et al. Alteration of the lipid phase transition during mouse embryos freezing after in vitro culture with linoleic acid // Cryobiology. 2021. V. 99. P. 55–63.
Jewgenow K., Zahmel J. Preservation of female genetic resources in feline species // Theriogenology. 2020. V. 156. P. 124–129.
Karasahin T. The effect of oleic and linoleic acid addition to the culture media on bovine embryonic development following vitrification // Pol. J. Vet. Sci. V. 22. P. 661–666.
Kuerschner L., Moessinger C., Thiele C. Imaging of lipid biosynthesis: how a neutral lipid enters lipid droplets // Traffic. 2008. V. 9. № 3. P. 338–352.
Mazur P. Equilibrium, quasiequilibrium, and nonequilib rium freezing of mammalian embryos // Cell. Biophys. 1990. V. 17. P. 53–92.
Mokrousova V., Okotrub K., Brusentsev E., Kizilova E., Surovtsev N., Amstislavsky S. Effects of slow freezing and vitrification on embryo development in domestic cat // Reprod. Dom. Anim. 2020a. V. 55. P. 1328–1336.
Mokrousova V., Okotrub K., Amstislavsky S., Surovtsev N. Raman spectroscopy evidence of lipid separation in domestic cat oocytes during freezing // Cryobiology. 2020b. V. 95. P. 177–182.
Okotrub K., Mokrousova V., Amstislavsky S., Surovtsev N. Lipid droplet phase transition in freezing cat embryos and oocytes probed by Raman spectroscopy // Biophys. J. 2018. V. 115. P. 577–587.
Okotrub K., Okotrub S., Mokrousova V., Amstislavsky S., Surovtsev N. Lipid phase transitions in cat oocytes supplemented with deuterated fatty acids // Biophys. J. 2021. V. 120. P. 5619–5630.
Pereira R., Baptista M., Vasques M. et al. Cryosurvival of bovine blastocysts is enhanced by culture with trans-10 cis‑12 conjugated linoleic acid (10t,12c CLA) // Anim. Reprod. Sci. 2007. V. 98. P. 293–301.
Pereira R., Marques C. Animal oocyte and embryo cryopreservation // Cell. Tissue. Bank. 2008. V. 9. P. 267–277.
Quinn P. A lipid-phase separation model of low temperature damage to biological membranes // Cryobiology. 1985. V. 22. P. 128–146.
Romek M., Gajda B., Krzysztofowicz E., Kepczynski M., Smorag Z. New technique to quantify the lipid composition of lipid droplets in porcine oocytes and pre-implantation embryos using Nile Red fluorescent probe // Theriogenology. 2011. V. 75. P. 42–54.
Schmitz G., Ecker J. The opposing effects of n-3 and n-6 fatty acids // Prog. Lipid. Res. 2008. V. 47. P. 147–155.
Sieme H., Oldenhof H., Wolkers W. Sperm membrane behaviour during cooling and cryopreservation // Reprod. Dom. Anim. 2015. V. 50. P. 20–26.
Welte M.A., Gould A.P. Lipid droplet functions beyond energy storage // Biochim. Biophys. Act. (BBA) Mol. Cell Biol. Lipids. 2017. V. 1862. № 10. P. 1260–1272.
Zahmel J., Jansch S., Jewgenow K., Sandgreen D., Skalborg Simonsen K., Colombo M. Maturation and fertilization of African lion (Panthera leo) oocytes after vitrification // Cryobiology. 2021. V. 98. P. 146–151.
Zeron Y., Sklan D., Arav A. Effect of polyunsaturated fatty acid supplementation on biophysical parameters and chilling sensitivity of ewe oocytes // Mol. Reprod. Dev. 2002. V. 61. P. 271–278.
Дополнительные материалы отсутствуют.





