Онтогенез, 2022, T. 53, № 6, стр. 494-511
Экспериментальное повышение и понижение уровня серотонина матери изменяет онтогенетические траектории потомков у рыб с эмбриональными диапаузами
В. Б. Борисов a, *, Ф. Н. Шкиль a, b
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский проспект, 33, Россия
b Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: v.borisov.sev@gmail.com
Поступила в редакцию 08.07.2022
После доработки 09.08.2022
Принята к публикации 21.08.2022
- EDN: GDXMYJ
- DOI: 10.31857/S0475145022060027
Аннотация
Карпозубые рыбы “killifish” (Cyprinodontiformes; Teleostei), населяющие эфемерные водоемы, характеризуются высокой степенью онтогенетической пластичности – способностью к адаптивным изменениям онтогенетической траектории в ответ на изменение внешних условий. Изменение онтогенетических траекторий происходит за счет эмбриональных диапауз, которые позволяют переживать неблагоприятные условия. В настоящей работе мы экспериментально протестировали отложенные эффекты фармакологического повышения (НТР группа) и понижения (РСРА группа) уровня серотонина в организме матери на ход онтогенеза потомства у афиосемиона Гарднера (Fundulopanchax gardneri). Контрольная группа продемонстрировала типичную для killifish высокую онтогенетическую и фенотипическую изменчивость. Выклев личинок был растянут во времени, но характеризовался ярко выраженным пиком. Вылупляющиеся личинки имели разную степень редукции желточного мешка и развития скелета. У эмбрионов, полученных от самок с искусственно измененным уровнем серотонина, наблюдались гетерохронии, т.е. изменения сроков и темпов онтогенеза, а также снижение онтогенетической и фенотипической изменчивости. Так, в НТР группе наблюдалось замедление раннего развития, но ускорение и синхронизация более поздних стадий эмбриогенеза. В результате, выклев носил массовый характер, а личинки были более развиты, чем в контрольной группе. В РСРА группе, несмотря на некоторое сокращение временного интервала выклева, произошло перераспределение частот рано и поздно выходящих из икры личинок, что привело к исчезновению пика выклева. Полученные данные указывают на то, что серотонин выступает в качестве эпигенетического сигнала, модулирующего ход онтогенеза потомства и имеющего высокий адаптационный потенциал.
ВВЕДЕНИЕ
Повышенный интерес биологов развития и эволюционных биологов к нетаксономической группе “killifish”, объединяющей более 1200 видов пресноводных икромечущих рыб отряда карпозубообразные (Cyprinodontiformes; Teleostei), обусловлен рядом факторов. Среди них ведущую роль играют: большое разнообразие фенотипов и жизненных циклов (Furness, 2015; Valenzano et al., 2015; Berois et al., 2017; Hu, Brunet, 2018; Willemsen et al., 2020); способность в короткие сроки приспосабливаться к новым, зачастую экстремальным внешним условиям (Whitehead et al., 2011; Wagner, Podrabsky, 2015; Eide et al., 2021); относительно небольшие размеры геномов, что позволяет широко применять современные методы молекулярно-генетического анализа (Reid et al., 2017; Romney, Podrabsky, 2017; Poeschla, Valenzano, 2020; Chalar et al., 2021; Astre et al., 2022; Di Genova et al., 2022); и простота содержания в лабораторных условиях. Особенный интерес представляет высокая степень онтогенетической пластичности killifish, многие виды которых способны к адаптивным изменениям онтогенетической траектории за счет эмбриональных диапауз – задержек или остановок развития зародыша, в ответ на изменение внешних факторов (Podrabsky et al., 2010a; Furness, 2015; Dominguez-Castanedo et al., 2017; Naumann, Englert, 2018).
Аннуальные виды killifish (annual killifishes) обладают коротким (менее одного года) жизненным циклом, характеризующимся интенсивными процессами роста, полового созревания и размножения в течение короткого благоприятного периода, и эмбрионами, способными выживать в крайне неблагоприятных сезонных условиях. Широко распространенные среди killifish эмбриональные диапаузы позволяют переживать засуху и критическое снижение концентрации растворенного в воде кислорода (Anderson, Podrabsky, 2014). Диапаузы могут быть факультативными или облигатными и происходить на разных стадиях эмбрионального развития: ранней гаструлы (DI), позднего сомитогенеза (DII) и полностью сформированного эмбриона (DIII) (Wourms, 1972а). DI характеризуется снижением или остановкой митотической активности клеток эмбриона (Romney, Podrabsky, 2017; Naumann, Englert, 2018; Dolfi et al., 2019). DII сопровождается максимальным замедлением метаболических процессов и отличается большой продолжительностью. Это позволяет эмбрионам переносить неблагоприятный период засухи, находясь в грунте под защитой яйцевых оболочек (Podrabsky et al., 2010b; Anderson, Podrabsky, 2014). DIII характеризуется снижением метаболизма у готового к выклеву эмбриона, что дает возможность выйти из яйца в момент наступления благоприятных условий (Martin, Podrabsky, 2017; Chalar et al., 2021).
Внутренние факторы, ответственные за наступление диапауз и реализацию той или иной онтогенетической траектории у killifish, активно изучаются (Karp, 2021; Singh et al., 2021). Считается, что вероятность DI определяется составом переданных от матери регуляторных РНК, влияющих на активность сигнальных каскадов клеток эмбриона (Romney, Podrabsky, 2017). Причины и механизмы впадения эмбриона в состояние DII и DIII остаются малоизученными. Предполагается, что вероятность наступления и сроки этих диапауз определяются активностью эндокринной системы эмбриона, изменяющейся в ответ на колебания температуры и содержания кислорода во внешней среде (Romney et al., 2018; Karp, 2021). Экспериментальными методами было показано, что ингибирование экспрессии инсулиноподобного фактора роста I (IGF-I) у эмбрионов модельных аннуальных killifish инициирует DII, в то время как увеличение уровня IGF-I стимулирует прямое развитие, без диапауз (Woll, Podrabsky, 2017). Однако, большинство исследователей сходятся во мнении, что IGF-I далеко не единственный фактор, играющий роль в выборе той или иной траектории развития killifish (Karp, 2021), и необходимо проведение дальнейших исследований с привлечением новых, немодельных объектов (Singh et al., 2021).
Одним из вероятных кандидатов на роль сигнального фактора, участвующего в регуляции онтогенетической пластичности killifish, является серотонин. Данный моноамин сочетает функции межклеточного мессенджера и гормона с плейотропным эффектом. Серотонин оказывает существенное влияние на онтогенез многоклеточных (Turlejski, 1996; Buznikov et al., 2001), однако, его роль в развитии рыб изучена слабо. Известно, что серотонин (по всей видимости, материнский) присутствует уже на самых ранних этапах развития рыб, в ранних бластомерах и неклеточных структурах (Côté et al., 2007; Ivashkin et al., 2019; Romero-Reyes et al., 2021), но его онтогенетическая роль остается неясной. На более поздних этапах онтогенеза серотонин может выступать в качестве морфогена (Nardi et al., 2017) и участвовать в регуляции развития центральной нервной системы (Airhart et al., 2012; Barreiro-Iglesias et al., 2015). Кроме того, серотонинергическая система задействована в регуляции синтезирующей активности различных эндокринных клеток (Canosa et al., 2007; Lillesaar, 2011; Prasad et al., 2015; McDonald, 2017; Thompson, Vijayan, 2022). Показано, что у рыб высокий уровень серотонина стимулирует продукцию гонадотропина, но подавляет синтез соматропного гормона (Wong et al., 1998; Prasad et al., 2015). У млекопитающих отмечены сходные эффекты: внутриутробная гиперсеротонемия подавляет синтез соматотропного гормона, дефицит которого, в свою очередь, приводит к снижению активности синтеза IGF-I (Musumeci et al., 2013), сигнала, ответственного за наступление диапауз у killifish (Karp, 2021). Учитывая, что у рыб экспрессия IGF-I также напрямую регулируется соматотропным гормоном (Triantaphyllopoulos et al., 2020), можно предположить, что изменения уровня серотонина будут иметь сходный эффект, но данные о взаимоотношениях этих сигнальных систем носят спорадический характер (Jonsson, Bjornsson, 2002).
В организме матери активность синтеза серотонина зависит от множества внешних и внутренних факторов, имеющих четкую сезонную динамику в эфемерных сообществах, в том числе от внешних температур, состава и обилия пищи, социальной активности и возраста (Winberg et al., 1991; Prasad et al., 2015; Winberg, Thornqvist, 2016; Nonnis et al., 2021; Evsiukova et al., 2021; Uyttebroek et al., 2022). С учетом этого, можно предположить, что материнский серотонин выступает в роли эпигенетического сигнала, определяющего наиболее адекватную в текущих условиях онтогенетическую траекторию потомков, как это было показано для других животных (Ivashkin et al., 2015; Andreatta et al., 2018; Voronezhskaya et al., 2022).
В настоящей работе мы экспериментально оценили, как фармакологическое повышение и понижение уровня серотонина в организме матери влияют на эмбриональное развитие афиосемиона Гарднера, Fundulopanchax gardneri (Boulenger, 1911) – западноафриканского представителя killifish, тип онтогенеза которого считается анцестральным для современных высокоспециализированных аннуальных видов (Peters, 1963).
МАТЕРИАЛЫ И МЕТОДЫ
Объектом изучения являлась лабораторная линия стального афиосемиона Fundulopanchax (=Aphyosemion) gardneri нигерийского происхождения. Этот представитель семейства нотобранхиевых (Nothobranchiidae) не относится к аннуальным видам и преимущественно населяет постоянные водоемы (Peters, 1963).
Изменение уровня серотонина у близкородственных десятимесячных самок достигалось традиционными методами (Airhart et al., 2012; Maximino et al., 2013; Ivashkin et al., 2019; Faria et al., 2021). Были созданы три экспериментальных группы, состоящие из трех-четырех самок: 1) контроль – группа, содержащаяся в чистой воде; 2) HTP группа – группа, содержавшаяся в воде с добавлением 10 мг/л 5–гидрокситриптофана (HTP) – непосредственного биохимического предшественника серотонина; 3) PCPA группа, содержавшаяся в воде с добавлением 1 мг/л пара-хлорофенилаланина (PCPA) – ингибитора триптофангидроксилазы, фермента ответственного за гидроксилирование HTP (рис. 1). Фармакологическая обработка самок продолжалась в течение 14 дней. Таким образом, предполагалось, что уровень серотонина будет повышен в тканях особей НТР группы и понижен в тканях особей PCPA группы. Учитывая продолжительность обработки, мы использовали 1/10 концентрации HTP и 1/20 PCPA, от концентраций, ранее использованных для краткосрочного воздействия на рыб (Airhart et al., 2012; Maximino et al., 2013; Ivashkin et al., 2019; Faria et al., 2021). Непосредственно перед скрещиванием самки каждой группы переводились в чистую воду. Полученная в результате естественного скрещивания оплодотворенная икра обрабатывалась метиленовым синим и раскладывалась поштучно в лунки иммунологического планшета для проведения индивидуальных наблюдений и минимизации взаимного влияния. Инкубация икры проводилась в условиях, считающихся оптимальными для данного вида (https:// www.seriouslyfish.com/species/fundulopanchax-gardneri-gardneri/): при постоянной температуре (22°С), естественном освещении, под слоем постоянно аэрируемой воды 1–2 сантиметра. Эксперимент был повторен дважды.
Рис. 1.
Схема эксперимента по изменению уровня серотонина у самок F. gardneri и выращиванию их потомства в стандартных условиях. (а) Маточное стадо F. gardneri; (б) фармакологическая обработка самок в течение 14 дней (H2O – контрольная группа, HTP – группа, обработанная биохимическим предшественником серотонина; PCPA – группа, обработанная ингибитором триптофангидроксилазы); (в) скрещивание экспериментальных самок с самцами в чистой воде; (г) инкубация икры в иммунологических планшетах при стандартных условиях, t = 22°С.

На 6 и 10 день после оплодотворения (дпо) оценивались длина (L) и ширина (W) головы, частота сердцебиения, число сомитов и общее морфологическое состояние эмбрионов. На основе этих данных делались выводы о наличии или отсутствии диапаузы (DII). Состояние диапаузы (DIII) определялось по продолжительной задержке выклева полностью сформированных эмбрионов одновременно с существенным уменьшением частоты сердечных сокращений и подвижности тела.
В момент выклева осуществлялось измерение стандартной длины (SL) личинок и их фиксация в 4% PFA. Небольшая часть личинок прижизненно окрашивалась флуоресцентным кальцеином (Calcein Am, Sigma) по методике Du et al. (2001). Изготовление тотальных препаратов скелета эмбрионов и личинок велось по методике Walker, Kimmel (2007). Изучение препаратов проводилось с помощью методов световой (стереомикроскопы Olympus SZx9 и Leica EZ4) и конфокальной (Zeiss LSM 800) микроскопии на базе Центра коллективного пользования ИБР РАН. Для каждого образца было подсчитано: число костей черепа, позвонков и лучей хвостового плавника (лепидотрихий). Критерием наличия окостенения являлась окраска костной ткани ализарином, видимая при помощи светового микроскопа. Конфокальная микроскопия использовалась для верификации результатов, полученных при помощи световой микроскопии, и получения иллюстративного материала. Таким образом, нами были изучены рост и развитие эмбрионов, динамика выхода личинок из яйца, размеры тела и состояние костного скелета в момент выклева в экспериментальных группах F. gardneri. Учитывались только эмбрионы, покинувшие яйцевые оболочки в виде жизнеспособных личинок. Всего изучено 148 эмбрионов в контрольной группе, 51 в группе “HTP” и 30 в группе “PCPА”.
Статистическая обработка данных производилась с помощью пакета программ Statistica 6.0. Определение статистически значимых различий частоты сердечных сокращений и размеров ранних эмбрионов производилось с использованием однофакторного дисперсионного анализа (ANOWA). Взаимная зависимость пяти исследуемых характеристик в момент выклева (число костей черепа, позвонков и лучей хвостового плавника, SL и возраст) анализировалась с помощью ранговой корреляции Спирмена. Попарное сравнение временной динамики выклева в различных экспериментальных группах производилось с использованием непараметрического критерия U Манна–Уитни, коэффициентов асимметрии и эксцесса распределения. Сравнение зависимости SL и степени развития скелета от возраста личинок проводилось с помощью построения линейных регрессионных моделей. Для выполнения попарных сравнений групповых средних (для 4х признаков: SL, число костей черепа, позвонков и лучей хвостового плавника в момент вылупления) нами был использован критерий достоверно значимой разности Тьюки (Tukey’s HSD test) для неравных выборок.
РЕЗУЛЬТАТЫ
Рост и развитие эмбрионов в контрольной группе
Эмбриогенез F. gardneri при 22°С характеризуется высокой пластичностью, вследствие чего могут быть описаны, по меньшей мере, четыре онтогенетических траектории. Первая из них – “быстрая” траектория характеризуется прямым развитием, происходящим без остановок роста и морфологической дифференциации эмбриона. Три “медленные” траектории характеризуются прохождением одной (DII или DIII) или обеих эмбриональных диапауз.
При прямом развитии к 3-му дпо формируется нейрула, а к 5-му дпо становятся хорошо различимыми хорда, глаза и отделы головного мозга, Купферов пузырек и несколько пар сомитов (не более 10). К этому времени эмбрионы характеризуются значительной синхронностью развития и сходством размеров головы (средние значения W ~ 0.2 мм, а L ~ 0.4 мм).
При увеличении количества сомитов от 10-ти до 15-ти пар происходит развитие органов чувств, исчезает Купферов пузырек, появляется нефункционирующее сердце.
При увеличении количества сомитов от 15-ти до 25-ти пар наблюдается активное развитие пигментной системы: тело эмбриона и желточный мешок покрываются меланофорами, меланин начинает откладываться и в глазах. Начинаются сокращения сердца зародыша, становятся различимыми бесцветные клетки крови. В это же время наблюдаются движения хвоста, конец которого больше не прилегает к желтку.
При увеличении количества сомитов от 25-ти до 35-ти пар продолжает увеличиваться количество меланофоров, становятся различимы иридофоры. Кровь начинает циркулировать по сосудам тела и провизорной кровеносной системы, окружающей желточный мешок. Значительно увеличивается частота сокращений сердца и активность движения тела, которое полностью окружает желток, соприкасаясь головой и хвостом. Появляются первые хрящевые элементы скелета: трабекулы черепа, парахордалии и элементы висцеральных дуг.
После увеличения количества сомитов до дефинитивного количества ~40 пар происходит постепенное завершение эмбрионального развития, и формируется готовый к выклеву эмбрион (prehatching embryo). У эмбриона имеется развитая провизорная кровеносная система, заполненная красной кровью. Крупные подвижные глаза имеют металлический блеск и золотистый круг, окружающий зрачок. Сформированы и подвижны хвостовой и грудные плавники. Количество сердечных сокращений достигает 70–90 ударов в минуту. Желточный мешок значительно редуцируется. Длина и ширина головы эмбриона перед выклевом составляют приблизительно 0.85 мм.
Диапауза II характеризуется остановкой развития после формирования дефинитивного количества сомитов. Ей предшествует продолжительный период замедленного развития. Отличия от прямого развития начинают проявляться после 5-го дпо при количестве сомитов от 10-ти до 15-ти пар. В обоих случаях продолжаются увеличение количества сомитов и рост эмбриона в длину. При этом размеры головы “быстрых” эмбрионов начинают существенно превышать W = 0.2 и L = 0.4 мм, в то время как размеры головы “медленных” особей практически не увеличиваются (рис. 2). Кроме того, у “медленных” эмбрионов не происходит развития меланофоров и провизорной кровеносной системы, а количество сокращений сердца значимо меньше, чем у “быстрых”. Таким образом, еще до наступления полной остановки развития при DII мы можем безошибочно отличать таких особей от эмбрионов с прямым типом развития (рис. 2).
Рис. 2.
Общая морфология эмбрионов F. gardneri с прямым типом развития и диапаузой II. Эмбрионы с различными онтогенетическими траекториями значительно отличаются размерами, пигментацией тела и глаз при одинаковом количестве сомитов.

Диапауза III характеризуется задержкой выклева полностью сформированных эмбрионов. Мы определяли данное состояние путем прямых наблюдений за особями, продолжающими оставаться в яйцевых оболочках. Важным индикатором, указывающим на состояние DIII, является резкое падение частоты сердечных сокращений вследствие снижения метаболизма зародыша (Martin, Podrabsky, 2017; Chalar et al., 2021). Особи с прямым развитием характеризуются частотой пульса 70–90 (и даже >100), в то время как частота пульса эмбрионов в DIII обычно снижается до 20–50, причем могут наблюдаться кратковременные остановки сердца.
Развитие эмбрионов в экспериментальных группах
Раннее развитие эмбрионов в контрольной группе и в группах с искусственно повышенным (HTP) и пониженным (PCPA) уровнем серотонина происходит сходным образом. К 5-му–6-му дпо эмбрионы из различных экспериментальных групп начинают значимо отличаться друг от друга размерами головы, а также частотой сердцебиения (рис. 3). Значения всех трех изученных признаков увеличиваются в ряду HTP – PCPA – Контроль. На данном этапе развития HTP эмбрионы являются достоверно менее развитыми, чем остальные группы (p < 0.005). PCPA эмбрионы достоверно уступают особям контрольной группы в значении признака W головы (p < 0.005), не демонстрируя значимых отличий по другим признакам.
Рис 3.
Средние значения и стандартные ошибки среднего для ширины и длины головы, а также частоты сердечных сокращений эмбрионов в возрасте 6 (а) и 10 (б) дней после оплодотворения в трех экспериментальных группах F. gardneri: Контроле, HTP и PCPA. L – длина головы, W – ширина головы.

На 10-й дпо HTP эмбрионы имеют достоверно меньшие L и W головы по сравнению с особями из других групп (p < 0.001), а также меньшую частоту сердцебиений по сравнению с контрольной группой (p < 0.005). При этом PCPA эмбрионы перестают значимо отличаться от контрольной группы (рис. 3).
Характерные фенотипические различия между эмбрионами с разными онтогенетическими траекториями – прямым развитием или развитием с DII – начинают проявляться к 6-му дпо. Эмбрионы, находящиеся в состоянии DII, имеют более 15-ти сомитов, относительно малые размеры головы, узкое тело, неразвитую провизорную кровеносную систему и не имеют меланофоров (рис. 2, 4). На 6 дпо в группах PCPA и Контроль число DII эмбрионов составляет 11 и 9% соответственно. В HTP группе к 6-му дпо фенотипические признаки, характерные для DII, еще не сформированы. На 10-й дпо доля DII эмбрионов среди HTP группы составляет 14%, в PCPA группе – 4.5% и Контроле – 2%. Необходимо отметить, что на данной стадии (6‑й–10-й дпо) наблюдалась высокая изменчивость темпов онтогенеза внутри групп. Наибольший диапазон наблюдается в контрольной группе, в которой есть как особи с ярко выраженной диапаузой, так и быстро развивающиеся эмбрионы (рис. 8). В PCPA группе различия в темпах онтогенеза менее выражены, чем в контроле. В HTP группе большинство эмбрионов развиваются относительно синхронно и заметно медленнее, чем в контрольной и PCPA группах (рис. 8).
Динамика выхода из яйцевых оболочек
Эмбриональное развитие F. gardneri в контрольной группе занимает от 14-ти до 63-х дней. Личинки покидают яйцевые оболочки очень неравномерно. Незначительное число особей (4%) выходит из икры на 14-й–16-й дпо. К 22-му дпо выклевывается 50% особей, с 22-го по 29-й дпо еще 25% особей. Оставшиеся в икре эмбрионы находятся в состоянии DIII (рис. 4), и их выклев растянут во времени (рис. 5, таб. 1).
Рис. 5.
Динамика выхода и частотные гистограммы распределения времени выхода личинок из яйцевых оболочек в трех экспериментальных группах F. gardneri. (а) Динамика выхода личинок; (б, в, г) – частотное распределение времени выхода личинок в контрольной, HTP и PCPA группах, соответственно. дпо – дней после оплодотворения, N, % – процент особей от общего числа личинок в группе.

В HTP группе эмбриональное развитие занимает от 20-ти до 32-х дней. При этом появление большинства личинок (98%) происходило в период 20-го–26-го дпо (рис. 5). Единственный эмбрион с более продолжительным развитием покинул зародышевые оболочки к 32-му дпо, таким образом, особи в состоянии DIII практически отсутствовали (рис. 5, табл. 1).
Таблица 1.
Временные характеристики динамики выхода личинок из яйцевых оболочек в трех экспериментальных группах F. gardneri. дпо – дней после оплодотворения
| Контроль | HTP | PCPA | |
|---|---|---|---|
| Возраст выклева (дпо) | 14–63 | 20–32 | 18–51 |
| Среднее значение | 26.3 ± 0.88 | 23.4 ± 0.25 | 29.0 ± 1.51 |
| Стандартное отклонение | 10.71 | 1.79 | 8.28 |
| Медиана | 23 | 23 | 28 |
| Коэффициент асимметрии | 1.35 ± 0.2 | 2.16 ± 0.33 | 0.63 ± 0.43 |
| Коэффициент эксцесса | 1.18 ± 0.4 | 9.58 ± 0.66 | 0.1 ± 0.83 |
В PCPA группе эмбриональное развитие занимает от 18-ти до 51-го дня. К 25-му дпо выклевывается приблизительно 40% личинок, к 32-му дпо – еще 30% (рис. 5). Оставшиеся эмбрионы находятся в состоянии DIII и постепенно покидают зародышевые оболочки в течение следующих 20 дней (рис. 5).
Попарное сравнение времени появления личинок в экспериментальных группах с использованием непараметрического критерия U Манна–Уитни выявило значимые различия в динамике выклева между контрольной и PCPA группами (p < 0.05). Коэффициенты асимметрии и эксцесса распределения во всех группах наглядно демонстрируют, что динамика выклева в PCPA и HTP группах отличается от Контроля (таб. 1). В группе PCPA выклев большей части эмбрионов отстает и растянут во времени. В то же время в группе HTP выклев происходит очень синхронно в короткий промежуток времени (рис. 5, 8).
Морфология личинок в момент вылупления
Несмотря на существенную изменчивость средней продолжительности эмбрионального развития, личинки, покидающие яйцевые оболочки, значимо не отличаются друг от друга размерами. Во всех экспериментальных группах SL личинок составляла 3.8–4.25 мм (рис. 6). Корреляция размеров и возраста эмбрионов не является статистически значимой во всех экспериментальных группах (рис. 6, табл. 2). Лишь в PCPA группе отмечается слабая положительная коррелятивная связь – SL незначительно увеличивается с возрастом (рис. 6, табл. 2). Единственным внешним различием эмбрионов, выходящих из яйца раньше или позже, является состояние желточного мешка. У эмбрионов, покинувших оболочки раньше, он значительно меньше редуцирован (рис. 4в, 4г).
Рис. 6.
Диаграммы рассеяния, показывающие зависимость количества костей черепа (а), позвонков (б), лучей хвостового плавника (в) и стандартной длины тела (г) от возраста у личинок трех экспериментальных групп. Для всех изучаемых признаков изображены линии регрессии. (а) регрессионный коэффициент; Дпо – дней после оплодотворения, N – число анализируемых структур, SL – длина личинки.

F. gardneri, как и остальные killifish, демонстрирует высокую степень эмбрионизации онтогенеза. Личинки покидают яйцевые оболочки с хорошо сформированным костным скелетом и могут сразу переходить на активное питание. При этом состав краниального и посткраниального скелета отличается высокой вариабельностью (рис. 7). К моменту выклева череп личинок насчитывает от 12-ти до 33-х различных костей, число позвонков варьирует от 21-го до 30-ти, а лучей хвостового плавника – от 6-ти до 13-ти (табл. 3).
Рис. 7.
Состояние костного скелета личинок F. gardneri в момент выклева. Схематическое изображение состояния скелета личинки в момент выхода из яйцевых оболочек: (а) слаборазвитая личинка, (б) промежуточное состояние и (в) сильноразвитая личинка. (г) Тотальная прижизненная окраска личинки кальцеином. (д–е) Тотальные препараты головы слабо- и сильноразвитой личинки, окрашенные ализарином. aa – anguloarticulare; boc – basioccipitale; bsr – branchiostegalia; cbr – ceratobranchialia; ch – ceratohyale; cl – cleithrum; d – dentale; eoc – exoccipitale; hm – hyomandibulare; hyp – hypuralia; lep – lepidotrichia; mx – maxillare; n.sp. – нейральные отростки; op – operculum; pmx – praemaxillare; pro – prooticum; prsph – parasphenoideum; q – quadratum; ra – retroarticulare; sop – suboperculum; sym – symplecticum; ust – urostyl; vert – vertebrae.

Таблица 2.
Состояние скелета личинок F. gardneri в момент выклева. a – коэффициент регрессии; N – число анализируемых структур, p – уровень значимости; R2 – коэффициент детерминации, SL – длина личинки
| Контроль | HTP | PCPA | |||||||
|---|---|---|---|---|---|---|---|---|---|
| a | p | R2 | a | p | R2 | a | p | R2 | |
| N костей черепа | 0.423 | ⪡0.001 | 0.578 | 0.646 | 0.032 | 0.033 | 0.487 | ⪡0.001 | 0.348 |
| N позвонков | 0.085 | ⪡0.001 | 0.483 | 0.092 | 0.257 | 0.007 | 0.106 | ⪡0.001 | 0.442 |
| N лучей хвоста | 0.082 | ⪡0.001 | 0.791 | 0.115 | 0.189 | 0.006 | 0.139 | ⪡0.001 | 0.575 |
| SL | 0.0024 | 0.174 | 0.054 | 0.0004 | 0.966 | 0.004 | 0.065 | 0.061 | 0.12 |
Таблица 3.
Состояние скелета личинок F. gardneri в трех экспериментальных группах в момент выхода из яйцевых оболочек
| Кости черепа | Позвонки | Лучи хвоста | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Контроль | HTP | PCPA | Контроль | HTP | PCPA | Контроль | HTP | PCPA | |
| Число структур
в момент выклева (min–max) |
12–33 | 16–33 | 13–33 | 22–30 | 25–30 | 25–30 | 6–13 | 7–12 | 8–13 |
| Среднее | 23.95 | 27.47 | 25.7 | 27.78 | 27.92 | 27.97 | 9.94 | 9.98 | 10.33 |
| Медиана | 24.5 | 28 | 26 | 28 | 28 | 28 | 10 | 10 | 10.5 |
| Стандартное отклонение | 5.94 | 3.85 | 6.43 | 1.5 | 1.02 | 1.33 | 1.62 | 1.09 | 1.42 |
| Коэффициент асимметрии | –0.23 ± 0.39 | –1.31 ± 0.33 | –0.6 ± 0.43 | –1.82 ± 0.39 | –0.43 ± 0.33 | –0.51 ± 0.43 | –0.2 ± 0.39 | –0.35 ± 0.33 | 0.05 ± 0.43 |
| Коэффициент эксцесса | –1.03 ± 0.77 | 1.75 ± 0.66 | –0.98 ± 0.83 | 5.43 ± 0.77 | 0.51 ± 0.66 | –0.06 ± 0.83 | –0.32 ± 0.77 | 0.07 ± 0.66 | –0.8 ± 0.83 |
Расчет коэффициентов корреляции Спирмена показал, что в контрольной группе параметры развития скелета: число костей черепа, позвонков и лучей хвостового плавника (лепидотрихий) имеют высокую положительную корреляцию между собой и с возрастом. SL демонстрирует слабую положительную корреляцию только с числом костей черепа и лучей хвостового плавника (табл. 4).
Таблица 4.
Корреляционная матрица (корреляция Спирмена) для особей из контрольной группы. Жирным шрифтом выделены статистически значимые коэффициенты детерминации (Rs). N – число анализируемых структур, SL – длина личинки
| дпо | SL | N костей черепа | N позвонков | |
|---|---|---|---|---|
| SL | 0.193 | |||
| N костей черепа | 0.76 | 0.419 | ||
| N позвонков | 0.695 | 0.283 | 0.813 | |
| N лучей хвоста | 0.89 | 0.377 | 0.863 | 0.733 |
Анализ зависимости признаков скелета от возраста в разных экспериментальных группах показал, что контрольная и PCPA группы характеризуются сходными регрессионными коэффициентами и достаточно высокими коэффициентами детерминации (табл. 2). Таким образом, в обеих группах личинки одинакового возраста имеют сходное число костей черепа, позвонков и лучей хвоста. На это указывают и характер расположения регрессионных прямых и облаков точек на приведенных диаграммах рассеяния (рис. 6). Попарные сравнение групповых средних показало, что на заданном уровне значимости р = 0.05 единственное значимое различие наблюдалось для признака “число костей черепа” между группами “HTP” (среднее = 27.47) и контрольной группой (среднее = 23.95). Эмбрионы от матерей, получавших HTP, к моменту выклева имеют в среднем больший набор краниальных окостенений, чем в норме (рис. 6, табл. 3). Данные результаты хорошо согласуются и с приведенными регрессионными коэффициентами (табл. 2).
В HTP группе коэффициенты детерминации значительно меньше, чем в других группах (табл. 2). Это обусловлено значительной вариабельностью зависимых признаков при существенно меньшей вариабельности продолжительности эмбрионального периода. В данной группе статистически значимой является только связь между числом костей черепа и возрастом (р < 0.05) (табл. 2). Анализ взаимного расположения регрессионных прямых и сравнение регрессионных коэффициентов демонстрируют, что череп HTP личинок характеризуется большим числом костей черепа, чем череп личинок того же возраста из других групп. Даже наиболее рано вышедшие из икры HTP личинки редко имеют минимальный набор скелетных элементов, отмечаемый у ранних личинок контрольной группы (рис. 6, табл. 3).
ОБСУЖДЕНИЕ
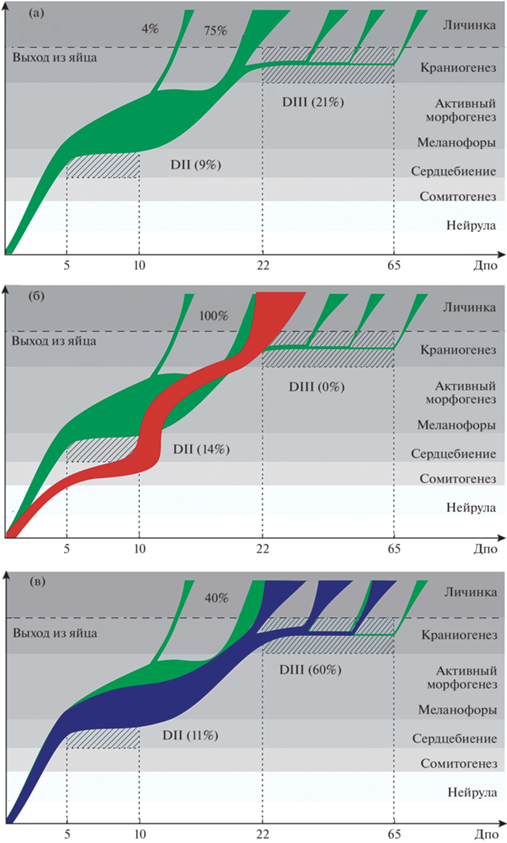
Экспериментальное изменение уровня серотонина у самок F. gardneri вызывает изменение временных характеристик онтогенеза их потомства, т.е. гетерохронии, и отражается на уровне его онтогенетической и фенотипической изменчивости (рис. 8). Контрольная группа характеризуется высокой изменчивостью онтогенеза, типичной для многих представителей killifish (Podrabsky et al., 2010а; Furness, 2015; Dominguez-Castanedo et al., 2017; Naumann, Englert, 2018): большинство эмбрионов развивается без диапауз; небольшая часть проходит диапаузу DII; остальные особи демонстрируют отложенный выход из икры, т.е. проходят диапаузу DIII (рис. 8). В результате, выклев очень растянут во времени и личинки сильно различаются фенотипически, так как степень их развития напрямую зависит от возраста. Ранние личинки характеризуются слабой степенью развития и оссификации скелета и большим желточным мешком (рис. 4, 7). Поздние, наоборот, обладают хорошо развитым скелетом и сильно редуцированным желточным мешком (рис. 4, 7). Считается, что подобная онтогенетическая пластичность позволяет killifish минимизировать риски гибели потомства при наступлении неблагоприятных условий (Podrabsky et al, 2010b; Anderson, Podrabsky, 2014; Martin, Podrabsky, 2017; Chalar et al., 2021).
В потомстве самок, обработанных биохимическим предшественником серотонина (HTP), наблюдаются гетерохронии и резкое сокращение онтогенетической и фенотипической изменчивости. У потомков происходит снижение темпов роста и частоты сердечных сокращений на ранних этапах развития (рис. 3), увеличение доли особей в состоянии DII и несколько более позднее, по сравнению с контрольной группой, начало выклева (рис. 5, табл. 1). При этом отмечается синхронизация онтогенеза, приводящая в итоге к значимому сокращению временного диапазона выхода личинок из икры и снижению их фенотипической изменчивости (рис. 5). Среди личинок нет особей с большим желточным мешком и небольшим числом костных структур, т.е. личинки находятся на более продвинутой стадии развития, чем в контрольной группе (табл. 3).
Ход эмбриогенеза рыб, матери которых были обработаны агентом, снижающим уровень серотонина в организме (PCPA), близок к контролю (рис. 3). Однако следует отметить, что динамика выхода из икры в PCPA группе значимо отличается от контрольной (рис. 5, табл. 1). Контрольная группа демонстрирует резко выраженный пик выклева личинок с прямым развитием. За этим пиком следует медленный и затянутый выход личинок, проходящих DIII (рис. 5). В PCPA группе доля эмбрионов с прямым развитием существенно ниже, а процент эмбрионов, проходящих DIII, значимо выше. В результате, пик массового выхода личинок выражен в этой группе заметно слабее (рис. 5, 8). При этом не наблюдается увеличения временного диапазона выклева, но происходит перераспределение плотности появления личинок с более ранних на более поздние сроки (рис. 5).
Рис. 8.
Схематичное представление онтогенетических траекторий в трех экспериментальных группах F. gardneri. (а) Контрольная группа, (б) HTP группа, (в) PCPA группа.
Полученные результаты не позволяют судить о механизмах, лежащих в основе наблюдаемых эффектов, возникающих вследствие изменения уровня серотонина матери. Однако, основываясь на данных о взаимодействии серотонинергической системы рыб и различных типов эндокринных клеток (Canosa et al., 2007; Lillesaar, 2011; Prasad et al., 2015; McDonald, 2017; Thompson, Vijayan, 2022) мы можем предположить, что серотонин матери выступает в роли эпигенетического сигнала, модулирующего онтогенез потомства. Известно, что у рыб высокий уровень серотонина подавляет синтез соматотропного гормона (Wong et al., 1998), который, в свою очередь, определяет активность экспрессии IGF-I (Triantaphyllopoulos et al., 2020). Таким образом, серотонин может изменять уровень IGF-I – фактора, определяющего онтогенетическую траекторию аннуальных killifish (Karp, 2021). Исходя из этого, замедление раннего онтогенеза у эмбрионов, полученных от матерей с высоким уровнем серотонина, может быть вызвано снижением активности соматотропной оси, а увеличение среди них числа особей в состоянии DII может быть вызвано снижением уровня IGF-I.
Предполагаемая связь между серотонином и IGF-I может объяснить и впадение в диапаузу DII эмбрионов в естественных условиях, наблюдаемую при резком снижении концентрации растворенного кислорода (Chalar et al., 2021). Серотонин является основной сигнальной молекулой, используемой нейроэндокринными гипоксия-чувствительными клетками рыб (Hockman et al., 2017). При снижении уровня кислорода происходит выброс в кровь серотонина, что может оказывать влияние на активность экспрессии IGF-I и, как следствие, вызывать DII.
Примечательно, что гетерохронии, индуцированные изменениями уровня серотонина матери, ранее отмечались у брюхоногих моллюсков, характеризующихся выраженными изменениями жизненных стратегий потомства в зависимости от сезона (Glebov et al., 2014; Ivashkin et al., 2015; Voronezhskaya, 2021). Это позволяет предположить, что онтогенетические и фенотипические эффекты, вызванные флуктуациями уровня серотонина матери, могут иметь большое адаптивное значение и для killifish, населяющих эфемерные водоемы с четко выраженной сезонной динамикой гидрологических, гидрохимических условий и трофности (Williams, 1987; Podrabsky et al., 1997).
Изменения температуры, содержания кислорода в воде, состава и обилия пищи, а также социальные факторы оказывают влияние на уровень серотонина взрослых рыб (Winberg et al., 1991; Prasad et al., 2015; Winberg, Thornqvist, 2016; Evsiukova et al., 2021; Nonnis et al., 2021; Uyttebroek et al., 2022). Мы предполагаем, что на пике трофности эфемерных водоемов, обычно наступающем в конце влажного периода, у самок происходит хроническое повышение уровня серотонина, наблюдаемое у рыб при обилии пищи (Uyttebroek et al., 2022), и усложнении социальных взаимоотношений (Backström, Winberg, 2017). Высокий уровень серотонина стимулирует синтез гонадотропных гормонов матери (Prasad et al., 2015), что ускоряет созревание половых продуктов, а также и ускоряет и синхронизирует онтогенез потомства. В результате личинки выходят из яйцевых оболочек на пике трофности водоема. В другие сезоны, когда внешние условия могут быть не столь благоприятными и/или часто меняющимися (начало влажного сезона, сухой сезон), активность синтеза серотонина в организме матери может быть снижена. В частности, снижение уровня серотонина отмечалось у рыб при резких кратковременных колебаниях температуры (Nonnis et al., 2021). В таких условиях может иметь свои преимущества растянутый во времени выклев личинок, который увеличивает шансы на выживание отдельных особей.
В пользу гипотетической “сезонности” уровня серотонина в популяциях аннуальных killifish говорит и то, что во время сухого сезона увеличивается доля “возрастных” самок (Reichard, 2015). При этом в потомстве таких самок снижается доля эмбрионов, реализующих быструю онтогенетическую траекторию, и появляется больше особей, проходящих позднюю диапаузу DIII (собственные наблюдения; Podrabsky et al., 2010а).
ЗАКЛЮЧЕНИЕ
Полученные нами данные наглядно свидетельствуют, что уровень серотонина в организме матери может прямо или косвенно выступать в роли эпигенетического сигнала, определяющего онтогенетическую траекторию потомства. Пути и механизмы передачи данного сигнала от матери к потомкам, его мишени у развивающихся эмбрионов, а также механизмы реакции эмбрионов на сигнал остаются неясными и требуют дальнейшего изучения. Несмотря на это, представленные результаты открывают новую страницу в понимании роли серотонина в процессах адаптации и эволюции killifish.
Список литературы
Airhart M., Lee D., Tracy D. et al. Adverse effects of serotonin depletion in developing zebrafish // Neurotoxicology and Teratology. 2012. V. 34. P. 152–160.
Anderson S., Podrabsky J. The effects of hypoxia and temperature on metabolic aspects of embryonic development in the annual killifish Austrofundulus limnaeus // J. Comp. Physiol. B. 2014. V. 184. P. 355–370.
Andreatta G., Kyriacou C., Flatt T. et al. Aminergic signaling controls cvarian dormancy in drosophila // Sci. Rep. 2018. 8: 2030.
Astre G., Moses E., Harel I. Chapter 11 – The African turquoise killifish (Nothobranchius furzeri): biology and research applications, Editor(s): Livia D’Angelo, Paolo de Girolamo // Laboratory Fish in Biomedical Research, Academic Press, 2022. P. 245–287.
Backström T., Winberg S. Serotonin coordinates responses to social stress-what we can learn from fish // Front. Neurosci. 2017. 11: 595.
Barreiro-Iglesias A., Mysiak K., Scott A. et al. Serotonin promotes development and regeneration of spinal motor neurons in zebrafish // Cell Rep. 2015. V. 13. P. 924–932.
Berois N., Garcia G., De Sá R.O. A global community effort to decipher the unique biology of annual killifish // Developmental Dynamics. 2017. V. 246. P. 807–811.
Buznikov G., Lambert H., Lauder J. Serotonin and serotonin-like substances as regulators of early embryogenesis and morphogenesis // Cell Tissue Res. 2001. V. 305. P. 177–186.
Canosa L., Chang J., Peter R. Neuroendocrine control of growth hormone in fish // Gen. Comp. Endocrinol. 2007. V. 15. P. 1–26.
Chalar C., Clivio G., Montagne J. et al. Embryonic developmental arrest in the annual killifish Austrolebias charrua: a proteomic approach to diapause III // PLoS One. 2021. 16(6): e0251820.
Côté F., Fligny C., Bayard E. Maternal serotonin is crucial for murine embryonic development // Proc. Nat. Acad. Sci. USA. 2007. V. 104. P. 329–334.
Di Genova A., Nardocci G., Maldonado-Agurto R. et al. Genome sequencing and transcriptomic analysis of the Andean killifish Orestias ascotanensis reveals adaptation to high-altitude aquatic life // Genomics. 2022. V. 114. P. 305–315.
Dolfi L., Ripa R., Antebi A. et al. Cell cycle dynamics during diapause entry and exit in an annual killifish revealed by FUCCI technology // EvoDevo. 2019. 10: 29.
Dominguez-Castanedo O., Rosales-Torres A.M., Uribe M.C. Life history strategies of annual killifish Millerichthys robustus (Cyprinodontiformes:Cynolebiidae) in a seasonally ephemeral water body in Veracruz, México // Environmental Biology of Fishes. 2017. V. 100. P. 995–1006.
Du S.J., Frenkel V., Kindschi G., Zohar Y. Visualizing normal and defective bone development in zebrafish embryos using the fluorescent chromophore calcein // Dev. Biol. 2001. V. 238. P. 239–246.
Eide M., Zhang X., Karlsen O. et al. The chemical defensome of five model teleost fish // Sci. Rep. 2021. 11: 10546.
Evsiukova V., Kulikova E., Kulikov A. Age-related alterations in the behavior and serotonin-related gene mRNA levels in the brain of males and females of short-lived Turquoise killifish (Nothobranchius furzeri) // Biomolecules. 2021. 11(10): 1421.
Faria M., Prats E., Bellot M. et al. Pharmacological modulation of serotonin levels in zebrafish larvae: lessons for identifying environmental neurotoxicants targeting the serotonergic system // Toxics. 2021. 9(6): 118.
Furness A. The evolution of an annual life cycle in killifish: adaptation to ephemeral aquatic environments through embryonic diapause // Biol. Rev. 2015. V. 91. P. 796–812.
Glebov K., Voronezhskaya E., Khabarova M. et al. Mechanisms underlying dual effects of serotonin during development of Helisoma trivolvis (Mollusca) // BMC Dev. Biol. 2014. 14: 14.
Hockman D., Burns A., Schlosser G. et al. Evolution of the hypoxia-sensitive cells involved in amniote respiratory reflexes // eLIFE. 2017. 6: e21231.
Hu C., Brunet A. The African turquoise killifish: a research organism to study vertebrate aging and diapause // Aging Cell. 2018. 17(3): e12757.
Ivashkin E., Khabarova M., Melnikova V. et al. Serotonin mediates maternal effects and directs developmental and behavioral changes in the progeny of snails // Cell Reports. 2015. V. 7(12). P. 1144–1158.
Ivashkin E., Melnikova V., Kurtova A. et al. Transglutaminase activity determines nuclear localization of serotonin immunoreactivity in the early embryos of invertebrates and vertebrates // ACS Chemical Neuroscience. 2019. V. 10. P. 3888–3899.
Jonsson E., Bjornsson B. Physiological functions of growth hormone in fish with special reference to its influence on behavior // Fisheries Science. 2002. V. 68. P. 742–748.
Karp X. Hormonal regulation of diapause and development in nematodes, insects, and fishes // Front. Ecol. Evol. 2021. 9: 735924.
Lillesaar C. The serotonergic system in fish // J. Chem. Neuroanat. 2011. V. 41. P. 294–308.
Martin K., Podrabsky J. Hit pause: developmental arrest in annual killifishes and their close relatives // Developmental Dynamics. 2017. V. 246. P. 858–866.
Maximino C., Puty B., Benzecry R. et al. Role of serotonin in zebrafish (Danio rerio) anxiety: relationship with serotonin levels and effect of buspirone, WAY 100635, SB 224289, fluoxetine and para-chlorophenylalanine (pCPA) in two behavioral models // Neuropharmacology. 2013. V. 71. P. 83–97.
McDonald D. An AOP analysis of selective serotonin reuptake inhibitors (SSRIs) for fish // Comp. Biochem. Physiol. C Toxicol. Pharmacol. 2017. V. 197. P. 19–31.
Musumeci G., Trovato F., Avola R. et al. Serotonin/growth hormone/insulin-like growth factors axis on pre- and post-natal development: A contemporary review // OA Anatomy. 2013. 1(2): 12.
Nardi I., De Lucchini S., Naef V. et al. Serotonin signaling contribution to an evolutionary success: the jaw joint of vertebrates // Eur. Zool. J. 2017. V. 84. P. 19–25.
Naumann B., Englert C. Dispersion/reaggregation in early development of annual killifishes: Phylogenetic distribution and evolutionary significance of a unique feature // Dev. Biol. 2018. V. 442. P. 69–79.
Nonnis S., Angiulli E., Maffioli E. et al. Acute environmental temperature variation affects brain protein expression, anxiety and explorative behaviour in adult zebrafish // Sci. Rep. 2021. 11: 2521.
Peters N. Embryonic adaptations of oviparous cyprinodonts from waters that are periodically desiccated // Internationale Revue der Gesamten Hydrobiologie. 1963. V. 48. P. 257–313.
Podrabsky J., Hrbek T., Hand, S. Physical and chemical characteristics of ephemeral pond habitats in the Maracaibo basin and Llanos region of Venezuela // Hydrobiologia. 1997. V. 362. P. 67–77.
Podrabsky J., Garrett I., Kohl Z. Alternative developmental pathways associated with diapause regulated by temperature and maternal influences in embryos of the annual killifish Austrofundulus limnaeus // J. Exp. Biol. 2010a. V. 213. P. 3280–3288.
Podrabsky J., Tingaud-Sequeira A., Cerda J. Metabolic dormancy and responses to environmental desiccation in fish embryos // Dormancy and resistance in harsh environments. Topics in Current Genetics / Eds. Lubzens E., Cerda J., Clark M. 2010b. P. 203–226.
Podrabsky J., Riggs C., Wagner J. Tolerance of environmental stress // Annual Fishes: Life History Strategy, Diversity, and Evolution / Eds. Berois N., Garcia G., De Sa R.O. 2015. P. 159–184.
Poeschla M., Valenzano D. The turquoise killifish: a genetically tractable model for the study of aging // J. Exp. Biol. 2020. 223 (Suppl. 1): jeb209296.
Prasad P., Ogawa S., Parhar I.S. Serotonin reuptake inhibitor citalopram inhibits GnRH synthesis and spermatogenesis in the male zebrafish // Biol. of Reprod. 2015. V. 93(4): 102.
Reichard M. Annual fishes: Life history strategy, diversity, and evolution. The Еvolutionary Еcology of African Аnnual Fishes / Eds. Berois N., Garcia G., De Sa R.O. 2015. P. 133–158.
Reid N., Jackson C., Gilbert D. et al. The landscape of extreme genomic variation in the highly adaptable Atlantic killifish // Genome Biol. Evol. 2017. V. 9. P. 659–676.
Romero-Reyes J., Molina-Hernandez A., Diaz N.F. et al. Role of serotonine in vertebrate embryo development // Rep. Biol. 2021. 21(1): 100475.
Romney A., Podrabsky J. Transcriptomic analysis of maternally provisioned cues for phenotypic plasticity in the annual killifish, Austrofundulus limnaeus // EvoDevo. 2017. 8: 6.
Romney A., Davis E., Corona M. et al. Temperature-dependent vitamin D signaling regulates developmental trajectory associated with diapause in an annual killifish // PNAS. 2018. V. 115. P. 12763–12768.
Singh P., Reeves A., Contrepois K. et al. Evolution of diapause in the African turquoise killifish by remodeling ancient gene regulatory landscape // bioRxiv 2021: 10.25.465616.
Thompson W., Vijayan M. Antidepressants as endocrine disrupting compounds in fish // Front. in Endocrinol. 2022. 13: 895064.
Triantaphyllopoulos K., Cartas D., Miliou H. Factors influencing GH and IGF-I gene expression on growth in teleost fish: how can aquaculture industry benefit? // Rev. Aquacult. 2020. V. 12. P. 1637–1662.
Turlejski K. Evolutionary ancient roles of serotonin: Long-lasting regulation of activity and development // Acta Neurobiol. Exp. 1996. V. 56. P. 619–636.
Uyttebroek L., Van Remoortel S., Buyssens L. et al. The effect of diet induced obesity on serotonin in zebrafish // J. Cell Signal. 2022. V. 3. P. 115–128.
Valenzano D., Benayoun B., Singh P. et al. The African turquoise killifish genome provides insights into evolution and genetic architecture of lifespan // Cell. 2015. V. 163. P. 1539–1554.
Voronezhskaya E. Maternal serotonin: shaping developmental patterns and behavioral strategy on progeny in molluscs // Front. Ecol. Evol. 2021. V. 9. P. 7–14.
Voronezhskaya E., Melnikova V., Ivashkin E. Monoamines as adaptive regulators of development: The phenomenon and its mechanisms of action // Neuroscience and Behav. Phys. 2022. V. 51. P. 1278–1285.
Wagner J., Podrabsky J. Extreme tolerance and developmental buffering of UV-C induced DNA damage of the annual killifish Australofundulus limnaeus // J. Exp. Zool. Part A: Ecol. Gen. and Phys. 2015. V. 323. P. 10–30.
Walker M., Kimmel C. A two-color acid-free cartilage and bone stain for zebrafish larvae // Biotech. Histochem. 2007. V. 82. P. 23–28.
Whitehead A., Roach J., Zhang S. et al. Genomic mechanisms of evolved physiological plasticity in killifish distributed along an environmental salinity gradient // PNAS. 2011. V. 108. P. 6193–6198.
Willemsen D., Cui R., Reichard M. et al. Intra-species differences in population size shape life history and genome evolution // eLife. 2020. 9: e55794.
Williams D. The ecology of temporary waters // Springer Dordrecht. 1987. P. 206.
Winberg S., Nilsson G., Olsén K. Social rank and brain levels of monoamines and monoamine metabolites in Arctic charr, Salvelinus alpinus (L.) // J. Comp. Physiol. A. 1991. V. 168. P. 241–246.
Winberg S., Thörnqvist P.-O. Role of brain serotonin in modulating fish behavior // Curr. Zool. 2016. V. 62. P. 317–323.
Woll S., Podrabsky J. Insulin-like growth factor signaling regulates developmental trajectory associated with diapause in embryos of the annual killifish Austrofundulus limnaeus // J. Exp. Biol. 2017. V. 220. P. 2777–2786.
Wong A., Murphy C., Chang J. et al. Direct actions of serotonin on gonadotropin-II and growth hormone release from goldfish pituitary cells: interactions with gonadotropin-releasing hormone and dopamine and further evaluation of serotonin receptor specificity // Fish Physiol. and Biochem. 1998. V. 19. P. 23–34.
Wourms J. The developmental biology of annual fishes. I. Developmental biology of annual fishes I. Stages in the normal development of Austrofundulus myersi Dahl // J. Exp. Zool. 1972a. V. 182. P. 143–168.
Yin J.-A., Liu X.-J., Yuan J. et al. Longevity manipulations differentially affect serotonin/dopamine level and behavioral deterioration in aging Caenorhabditis elegans // The J. Neuroscience. 2014. V. 34. P. 3947–3958.
Дополнительные материалы отсутствуют.



