Онтогенез, 2022, T. 53, № 6, стр. 401-418
Убиквитин-протеасомная система в индукции и поддержании клеточной плюрипотентности
И. В. Зубарев a, У. И. Поденкова a, А. Н. Томилин a, А. С. Цимоха a, *
a Институт цитологии РАН
194064 Санкт-Петербург, Тихорецкий пр., 4, Россия
* E-mail: atsimokha@incras.ru
Поступила в редакцию 25.05.2022
После доработки 21.06.2022
Принята к публикации 26.06.2022
- EDN: VDRKOX
- DOI: 10.31857/S047514502206009X
Аннотация
Эмбриональные стволовые клетки (ЭСК) происходят из ранних эмбрионов на этапе предимплантационной бластоцисты и способны дифференцироваться во все типы соматических клеток. Открытые позднее индуцированные плюрипотентные стволовые клетки (иПСК), имеющие схожие с ЭСК характеристики, также представляют собой удобную модель для изучения раннего эмбрионального развития млекопитающих и также перспективны для клеточной терапии различных заболеваний, связанных с клеточной и тканевой дисфункцией. Понимание механизмов, лежащих в основе самообновления и дифференцировки, а также репрограммирования соматических клеток в плюрипотентное состояние, крайне важно для успешного и безопасного использования ЭСК и иПСК в терапии. Одним из ключевых молекулярных механизмов, лежащих в основе обеспечения жизнедеятельности клетки, является деградация белков, опосредованная убиквитин-протеасомной системой (УПС). Настоящий обзор посвящен роли УПС в поддержании плюрипотентности и его индукции посредством регуляции ключевых факторов.
ВВЕДЕНИЕ
Эмбриональные стволовые клетки (ЭСК) – это один из первых охарактеризованных типов плюрипотентных стволовых клеток (ПСК), обладающие способностью дифференцироваться во все типы соматических клеток организма. ЭСК выделяют на этапе предимплантационной бластоцисты из внутренней клеточной массы (ВКМ) (Thomson et al., 1998). В настоящее время при соблюдении определенных условий ЭСК возможно культивировать неограниченное время in vitro. При этом они сохраняют свои свойства к самоподдержанию в недифференцированном состоянии и к дифференцировке. Известно, что ЭСК обладают способностью противостоять повреждающим факторам (Vilchez et al., 2014) и имеют повышенную устойчивость к повреждениям генома и пониженную частоту мутаций, продуцируют гораздо меньше радикалов кислорода по сравнению с дифференцированными клетками (Sinenko et al., 2021). Такие свойства ЭСК обеспечиваются усиленной активностью защитных систем клетки, включая системы поддержания протеостаза, одной из которых является убиквитин-протеасомная система (УПС) деградации белков. На долю УПС приходится большая часть регулируемого протеолиза в клетке и, тем самым, УПС является участником многих клеточных процессов, включая поддержание и индукцию плюрипотентности (Buckley et al., 2012; Okita, Nakayama, 2012; Vilchez et al., 2012; Selenina et al., 2017; Choi, Baek, 2018; Noormohammadi et al., 2018). В данной обзорной работе обобщены имеющиеся на сегодняшний день данные о роли компонент УПС в поддержании клеточной плюрипотентности и ее индукции в результате соматического репрограммирования. Также обсуждаются механизмы регуляции экспрессии и активности четырех репрограммирующих факторов Oct4, Sox2, Klf4 и c-Myc в результате их убиквитинирования и последующей деградации посредством УПС.
ПЛЮРИПОТЕНТНЫЕ СТВОЛОВЫЕ КЛЕТКИ (ПСК)
Научившись “удерживать” ЭСК в плюрипотентном состоянии in vitro, исследователи получили новые возможности для изучения этих клеток и более подробного изучения механизмов поддержания плюрипотентности, равно как и выхода из нее, в том числе с помощью модуляции функций отдельных генов. Помимо этого, ЭСК активно используют при разработке лекарств и/или моделировании заболеваний человека, поскольку комплексное представление о биологических процессах, лежащих в основе той или иной патологии человека, имеет решающее значение для разработки стратегии их профилактики и лечения. Существует, однако, много практических проблем, которые ограничивают использование ЭСК в клеточной терапии (Yamanaka, 2020), главная из которых связана с их получением, а именно с этическими вопросами использования человеческих эмбрионов для получения ЭСК. Еще одна сложность в использовании ЭСК в медицине связана с иммунным отторжением аллогенных ЭСК после трансплантации в поврежденную ткань пациента (Swijnenburg et al., 2008), а также с риском образования опухолей (тератом) (Amariglio et al., 2009). Решением этического вопроса и проблемы отторжения аллогенных ЭСК виделось создание ЭСК-подобных клеток из собственных соматических клеток пациента за счет переноса ядра (Wilmut et al., 1997) или слияния соматических клеток с ЭСК (Ying et al., 2002). Одновременно с попытками получения ЭСК-подобных клеток возникла идея об индукции клеточной плюрипотентности в соматических клетках, основанная на обратимости дифференцировки клеток животных, поскольку ДНК клеток взрослого организма по-прежнему содержит всю необходимую генетическую информацию (Gurdon, 1962). На основе данной гипотезы среди факторов, поддерживающих клеточную плюрипотентность в ЭСК мыши, был произведен поиск и были выявлены четыре фактора (Oct4, Sox2, Klf4 и c-Myc), сверхэкспрессия которых была способна индуцировать плюрипотентность у эмбриональных фибробластов мышей (Takahashi, Yamanaka, 2006). Клетки, полученные при помощи ретровирусной трансдукции данных факторов, во многих аспектах напоминали ЭСК, включая морфологию, пролиферацию, экспрессию маркеров плюрипотентности, профили экспрессии генов, эпигенетический статус. Также как и ЭСК, полученные клетки обладали способностью дифференцироваться в производные трех зародышевых листков (эктодерму, мезодерму и энтодерму) (рис. 1) и, в конечном итоге, во все клеточные типы взрослого организма. Данные клетки получили название “индуцированные плюрипотентные стволовые клетки”, иПСК (Takahashi, Yamanaka, 2006). Спустя год после получения иПСК мыши были получены иПСК человека (Takahashi et al., 2007; Yu et al., 2007).
Технология генетического репрограммирования оказалась легче и качественнее, чем ядерное клонирование, и, тем самым, сильно повысила ожидания в отношении применения иПСК в биомедицине. Во-первых, использование собственных соматических клеток пациента для получения иПСК обусловливает высокий уровень персонификации данных клеток для клеточной терапии, в том числе и для тестирования различных лекарственных препаратов in vitro. Во-вторых, иПСК можно получить из любых жизнеспособных клеток с функционирующим ядром, включая периферические клетки крови, которые легко замораживать и хранить долгое время (Loh et al., 2009). На сегодняшний день самая востребованная область, в которой используются иПСК, это тестирование лекарств и моделирование заболеваний человека. В частности, удалось смоделировать некоторые типы опухолей (глиомы) (Stricker et al., 2013; van Pel et al., 2018), несколько моногенных кардиозаболеваний (Moretti et al., 2010; Ma et al., 2013) и других заболеваний человека (Miyazaki et al., 2018; Stoddard-Bennett, Reijo Pera, 2019). Кроме того, с использованием иПСК были успешно смоделированы многие генетические нарушения, включая хромосомные и моногенные заболевания, такие как синдром Дауна (Briggs et al., 2013) и синдром Тернера (Li et al., 2012), а также сложные расстройства, включая расстройства аутистического спектра (DeRosa et al., 2012) и шизофрению (Brennand et al., 2011). Использование иПСК позволяет получать специфический для заболевания фенотип и тестировать на нем лекарственные препараты как на положительный эффект, так и на токсичность, например, на кардиотоксичность.
В области применения иПСК для клеточной терапии, как и в случае ЭСК, на данный момент имеется ряд проблем, препятствующих их широкому использованию в биомедицине. Во-первых, получение иПСК – это времязатратная технология, что исключает применение этих клеток в ситуации, когда пациенту требуется срочная помощь. Второй проблемой является туморогенность, которая ассоциирована как с присутствием остаточных иПСК, так и с появлением туморогенного дифференцированного потомства. Последняя проблема обусловлена тем что у части иПСК, которые подвергаются направленной дифференцировке в какой либо клеточный тип может сформироваться неправильный паттерн генов, приводящий к злокачественным образованиям при трансплантации (Lee et al., 2013). Еще один аспект туморогенности иПСК обусловлен возникновением мутаций в процессе культивирования и/или дифференцировки иПСК еще до их трансплантации в ткани пациента (Rouhani et al., 2016; Merkle et al., 2017). Кроме того, проблема ассоциирована с онкогенной активностью самих факторов репрограммирования (Oct4, Sox2, Klf4 и c-Myc), особенно c-Myc, который является одним из наиболее часто мутирующих генов при раке человека и часто действует как драйвер мутации (Okita et al., 2007; Miller et al., 2012). Другая проблема в использовании иПСК связана с тем что каждая линия иПСК не идентична другой: они отличаются морфологией, кривыми роста, паттернами экспрессии генов и склонностью к дифференцировке в различные типы клеток (Osafune et al., 2008). Даже при аутологичной трансплантации иПСК существуют проблемы с иммунологическим отторжением (Deuse et al., 2019). К тому же иПСК на данный момент более эффективны для моногенных заболеваний и их сложно применять для лечения полигенных и заболеваний неизвестной природы (Doss, Sachinidis, 2019).
Для реализации потенциала иПСК в клеточной терапии необходимо всестороннее исследование самой природы клеточной плюрипотентности, в том числе роли внутриклеточных систем, поддерживающих это состояние, одной из которых является регулируемый протеолиз. Убиквитин-протеасомная система (УПС) деградации белков осуществляет большую часть регулируемого протеолиза в клетке, осуществляя регуляцию многих клеточных процессов, включая поддержание и индукцию плюрипотентности (Buckley et al., 2012; Okita, Nakayama, 2012; Vilchez et al., 2012; Selenina et al., 2017; Choi, Baek, 2018; Noormohammadi et al., 2018).
УБИКВИТИН-ПРОТЕАСОМНАЯ СИСТЕМА (УПС)
Жизнеспособность и функционирование клетки напрямую зависит от качества клеточного протеома, которое определяется строгой регуляцией равновесия между синтезом и деградацией белковых молекул. Неправильно сложенные, поврежденные или уже отыгравшие свою роль белки должны быть распознаны и удалены. Удаление белков осуществляется посредством протеолитической деградации в ходе работы лизосомной (Delevoye et al., 2019) и убиквитин-протеасомной (Chondrogianni, Gonos, 2012) систем. В то время как основной задачей лизосомной системы является деградация внутриклеточных органелл и крупных белковых структур, убиквитин-протеасомная система (УПС) является наиболее важной в отношении распознавания и удаления поврежденных и короткоживущих белков. Предполагается, что от 70 до 90% неправильно свернутых, поврежденных или отработанных белков деградирует через протеасомный путь (Jung, Grune, 2012). Протеасомная система является эволюционно-древним механизмом протеолитической внутриклеточной системы регуляции протеома клетки и присутствует у некоторых архей (например, Thermoplasma acidophilum), а также у всех животных и растений.
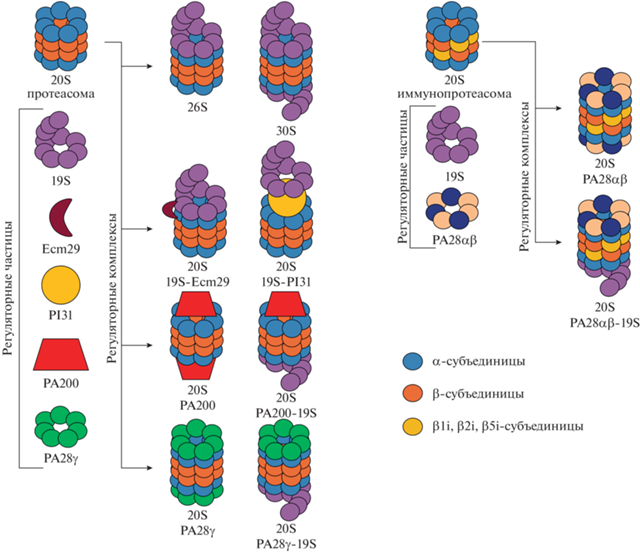
Центральным компонентом УПС является мультисубъединичный протеолитический комплекс – 20S-протеасома, – а также несколько различных регуляторов, которые могут изменять активность и специфичность 20S-протеасомы (Konstantinova et al., 2008). 20S-протеасома имеет форму полого бочонка, состоящего из семи различных α- и β‑субъединиц, расположенных в виде четырех гептамерных колец (7α,7β,7β,7α), общей массой 700 кДа (рис. 1). Внешние α-кольца образуют своего рода ворота, которые отвечают за регуляцию входа субстрата во внутреннюю протеолитическую камеру. Именно внутренние β-кольца отвечают за протеолитическую активность протеасомы, формируя протеолитическую камеру с каталитическими центрами на трех различных β-субъединицах: β1, β2 и β5 (Glickman, Ciechanover, 2002). Субъединица β1 обладает каспазаподобной активностью, расщепляя белки после кислых аминокиcлот, β2 имеет трипсин-подобную активность и расщепляет белки после основных аминокислот и β5 обладает химотрипсин-подобной активностью, расщепляя пептиды после гидрофобных аминокислот (Jung, Grune, 2012).
У млекопитающих при индукции IFN-γ происходит замена конститутивных каталитических субъединиц β1, β2 и β5 индуцибельными субъединицами β1i, β2i и β5i, и в результате формируется специфическая 20S-протеасома – иммунопротеасома, что приводит к эффективной генерации пептидов, представляемых комплексами MHC класса I. В дополнение к стандартным 20S-протеасомам и иммунопротеасомам было идентифицировано несколько тканеспецифичных видов 20S-комплексов, в том числе тимопротеасома и сперматопротеасома (Kniepert, Groettrup, 2014). 20S-частицы в тимусе преимущественно содержат специфическую субъединицу β5t и, как полагают, в первую очередь это связано с генерацией антигенных пептидов для положительной селекции Т-лимфоцитов (Murata et al., 2007). Специфическая 20S-протеасома семенников млекопитающих содержит альтернативные субъединицы α4s и участвует в деградации ацетилированных гистонов при сперматогенезе и репарации ДНК (Zhong, Belote, 2007; Qian et al., 2013).
Наиболее важным регулятором 20S-протеасомы является 19S-комплекс (или PA700). Схематически 19S-регулятор можно представить в виде кольцеобразного основания и крышки (рис. 2). Основание связывается с внешними α-кольцами 20S-коровой частицы и его основной функцией является открытие ворот, сформированных α‑кольцом, разворачивание белка и пропускание его в каталитическую полость 20S-протеасомы. Крышка 19S-регулятора распознает и связывает полиубиквитинированные белки, с последующим деубиквитинированием (Tanaka, 2009). 20S-частица может взаимодействовать с одним или двумя 19S-регуляторами и, таким образом, формировать 26S- или 30S-протеасому соответственно.
Другой регуляторной частицей, способной связываться с 20S-протеасомой является PA28-регулятор (или 11S). PA28 состоит из трех различных субъединиц (PA28α, PA28β и PA28γ), которые могут располагаться между собой в различных комбинациях, однако, в клетках существует лишь две формы PA28: PA28α4/β3, и PA28γ7 (Huber, Groll, 2017; Stohwasser, 2018). Данные комплексы PA28 способны связываться с внешними α-кольцами 20S-протеасомы и изменять свойства деградации субстрата (рис. 2). Однако, как и протеолиз свободной 20S-протеасомой, деградация субстратов протеасомным комплексом РА28–20S не зависит от АТФ. Функции PA28αβ способствуют высвобождению пептидных продуктов протеасомами, оптимизируя процесс презентации антигена MHC-I для поддержки адаптивных иммунных реакций организма. Интересно, что PA28γ имеет преобладающую ядерную локализацию и участвует в регуляции нескольких важных клеточных процессов, включая рост и пролиферацию клеток, апоптоз, структуру и организацию хроматина, а также ответ на повреждение ДНК. Кроме того, PA28αβ и, в меньшей степени, PA28γ значительно повышают способность 20S-протеасомы селективно расщеплять окисленные белки (Pickering, Davies, 2012).
Существует еще один регулятор активности протеасом – белок PA200 массой около 200 кДа, имеющий слегка асимметричную куполообразную структуру с внутренней полостью, которая находится на одном или обоих α-кольцах 20S-протеасомы (Ortega et al., 2005) (рис. 2). Точные функции PA200 до сих пор не ясны, однако известно, что PA200 преимущественно находится в ядре, и может играть роль в инициации репарации ДНК, а также при сперматогенезе (Ustrell et al., 2002; Khor et al., 2006).
Описан также адаптерный белок Ecm29 (рис. 2) с мол. массой около 200 кДа, который связываясь с 26S-протеасомой, может присоединять ее к различным клеточным компартментам, включая эндосомы, эндоплазматический ретикулум и везикулярно-тубулярный кластер, играя роль в элиминации неправильно сложенных белков посредством деградации, ассоциированной с эндоплазматическим ретикулумом (ERAD) и/или в другом протеолизе (Gorbea et al., 2004). Интересно, что Ecm29 также ответственен за ремоделирование 26S-протеасомы в клетках человека в ответ на окислительный стресс (Wang et al., 2017).
Еще один адаптерный белок PI31 (PSMF1) с массой порядка 30 кДа играет важную роль в контроле за функционированием протеасомы (рис. 2). Показано, что PI31 ингибирует 20S-протеасомы in vitro (McCutchen-Maloney et al., 2000), но способствует расщеплению белка in vivo (Bader et al., 2011; Yang et al., 2016). PI31 блокирует также АТФ-зависимую сборку 26S-протеасомы in vitro, но не оказывает влияния на активность in vitro уже собранной 26S-протеасомы (Li et al., 2014b). Согласно другим данным, рибозилирование PI31 способствует сборке 26S-протеасомы (Cho-Park, Steller, 2013). Важно отметить, что показана роль PI31 в транспорте протеасом в аксонах, и что он необходим для развития синапсов (Liu et al., 2019).
Помимо связывания с каким-то определенным регулятором 20S-протеасома может связываться сразу с различными регуляторами и образовывать гибридную протеасому (рис. 2). Хотя точная клеточная функция гибридных протеасом до сих пор неизвестна, предполагается, что протеолитическая специфичность 20S-протеасомы, связанной с одной 19S-частицей, изменяется за счет связывания дополнительного регулятора, что приведет к формированию другого набора олигопептидных продуктов.
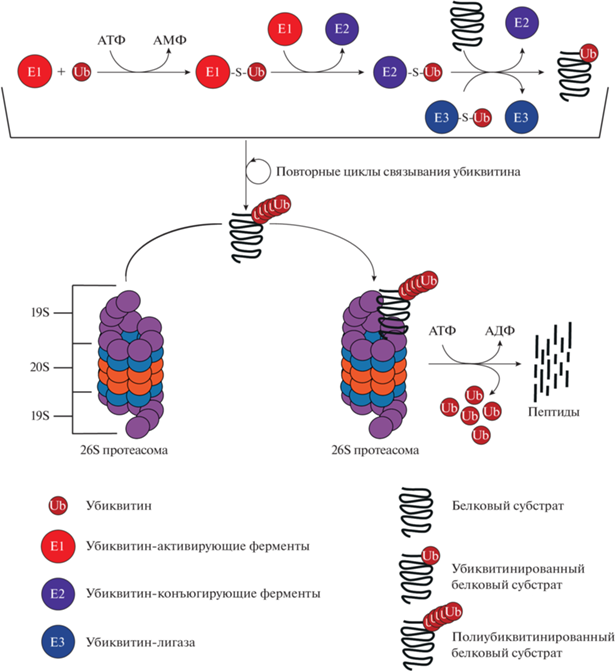
Протеасомная деградация опосредуется в основном полиубиквитинированием субстрата на основе лизина в 48 положении в качестве конъюгированного остатка, хотя цепи, основанные на лизинах в других положениях, также могут участвовать в нацеливании белков на протеасому (Saeki et al., 2009; Xu et al., 2009b). Мечение белков путем ковалентного присоединения убиквитина к белковым субстратам представляет собой многоступенчатый процесс, управляемый последовательным действием трех типов ферментов: убиквитин-активирующих ферментов (E1), убиквитин-конъюгирущих ферментов (E2) и убиквитин-лигаз (E3) (Chondrogianni, Gonos, 2012). Реакция начинается с фермента, активирующего убиквитин (E1), который первоначально аденилирует C-концевой остаток глицина молекулы убиквитина, и затем образует тиоэфирную связь между активированным остатком глицина и остатком цистеина на каталитическом сайте E1 посредством АТФ-зависимого механизма с получением реакционноспособного промежуточного тиоэфира E1-убиквитина. Активированный убиквитин впоследствии передается одному из ряда отдельных убиквитин-конъюгирующих ферментов (E2) путем транстиоляции в консервативный цистеин активного центра E2. Третий этап включает специфическую убиквитин-лигазу (E3), которая рекрутирует целевой белок и опосредует перенос активированного убиквитина от фермента E2 к субстрату. Полиубиквитиновая цепь наращивается добавлением другой молекулы убиквитина к лизину в 48 положении уже присоединенной молекулы убиквитина. В то время как Е1 фермент является высоко консервативным белком, Е2 представлены в большом количестве, а Е3 очень вариативны, что обеспечивает высокую адаптивность системы убиквитинирования под различные белки-мишени (Dikic, Robertson, 2012). Следующим этапом является узнавание и транспортировка меченого белка к 26S протеасоме, после чего убиквитиновые мономеры высвобождаются с помощью деубиквитинирующих ферментов (DUB) и далее рециркулируются, а белковый субстрат разворачивается и проталкивается во внутреннюю протеолитическую полость 20S-протеасомы. В протеолитической полости 20S-протеасомы субстрат расщепляется на короткие пептиды, которые могут отображаться на поверхности клетки для иммунного надзора или подвергаться окончательному протеолизу до свободных аминокислот различными аминопептидазами и, таким образом, использоваться для синтеза других белков (Glickman, Ciechanover, 2002) (рис. 3).
УПС В КЛЕТОЧНОЙ ПЛЮРИПОТЕНТНОСТИ
ЭСК и иПСК, как было отмечено выше, демонстрируют поразительную способность к непрерывной репликации при отсутствии старения. Несмотря на имеющиеся у нас знания о ПСК, механизмы, которые регулируют их плюрипотентность и дифференцировку, а также репрограммирование, остаются в значительной степени неизвестными. Накопленные за последние годы данные подчеркнули важность протеостаза в поддержании плюрипотентности ПСК и выхода из нее в процессе дифференцировки, а следовательно, и роль УПС, как одного из ключевых игроков протеостаза в клетке.
Появляется все больше свидетельств того, что перекрестная регуляция ключевых факторов транскрипции за счет Е1-E2-E3 и DUB-ферментов контролирует такие функции стволовых клеток, как плюрипотентность, дифференцировка и репрограммирование. Е1-E2-E3 ферменты убиквитинируют ключевые белки, связанные со стволовостью, и, тем самым, регулируют дифференцировку ПСК, тогда как DUB-ферменты, удаляя молекулы убиквитина у этих белков, удерживают их от протеасомной деградации и, тем самым, предотвращают дифференцировку (Ramakrishna et al., 2014). Таким образом, баланс между убиквитинированием и деубиквитинированием ключевых регуляторов ПСК определяет судьбу этих клеток.
Известно, что E2-убиквитин-конъюгирующий фермент Ube2S напрямую взаимодействует с Sox2, регулируя его уровень посредством убиквитинирования и поддерживая, таким образом, недифференцированное состояние ЭСК мыши (Wang et al., 2016). Кроме того, E2-фермент поддерживал недифференцированное состояние ЭСК мыши посредством индукции еще одного ключевого маркера самообновления – Esrrb. Сверхэкспрессия Ube2s в ЭСК мыши в дополнение к Esrrb также приводила к повышению уровней Nanog, Lin28 и Sall4, что наводит на мысль, что индуцированная экспрессия данных факторов может компенсировать сниженный уровень Sox2 для поддержания клеток в плюрипотентном состоянии.
Е3-убиквитин-лигаза Wwp2 убиквитинирует белок плюрипотентности Oct4 в ЭСК как мыши, так и человека (Xu et al., 2004; Xu et al., 2009a). Интересно, что нарушение опосредованного Wwp2 убиквитинирования Oct4 значительно повышало эффективность репрограммирования эмбриональных фибробластов мыши (Li et al., 2018). Также лигаза Wwp2 специфически взаимодействует с Set7-метилированным Sox2 и индуцирует убиквитинирование и деградацию Sox2 в ЭСК мыши, которым может противодействовать Akt1-опосредованное фосфорилирование (Fang et al., 2014). Активность Akt1 доминирует над Set7, поддерживая стабильность экспрессии Sox2 и плюрипотентность в ЭСК (Fang et al., 2014; Wang et al., 2019).
В исследовании с использованием скрининга интерферирующих РНК, нацеленных на компоненты УПС, было показано, что благодаря работе УПС поддерживается некий баланс, в котором DUB-ферменты Rpn11 (PSMD14) и Usp9X, а также E3-убиквитин-лигазы Rbx1, Rfwd2, Rnf12, Ubr5, Ddb1, Trim28 и Phf5a способствуют самообновлению ЭСК, тогда как другие убиквитин-лигазы – Fbw7, Rnf152, Rnf31, Rnf8, SOCS3, Topors, Rnf36, DR3/TNFRSF25 и убиквитин-подобный белок Ubl5 – регулируют раннюю дифференцировку ЭСК (Buckley et al., 2012). Нарушение активности DUB Rpn11 в составе протеасомы ведет к выходу из состояния плюрипотентности ЭСК, в то время как его сверхэкспрессия ингибирует дифференцировку этих клеток, поддерживая их плюрипотентное состояние (Buckley et al., 2012). Другая DUB, Usp21, поддерживает устойчивость ЭСК за счет стабилизации Nanog (Jin et al., 2016; Kwon et al., 2017). Для DUB Usp22 также показана критическая функция в раннем эмбриональном развитии мышей за счет стабилизации NAD-зависимой гистондеацетилазы Sirt1, которая вызывает снижение уровней ацетилирования p53 и подавление функций, опосредованных p53 (Lin et al., 2012). E3-лигаза Fbw7/Fbxw7 действует как ключевой регулятор плюрипотентности и дифференцировки ЭСК посредством регуляции стабильности c-Myc. Интересно, что нокдаун Fbxw7 в ЭСК мыши, вызывал стабилизацию c-Myc, но не оказывал эффект на факторы плюрипотентности Oct4, Nanog и Sox2 (Buckley et al., 2012). Также было продемонстрировано, что Ddb1, компонент E3-лигазного комплекса Cul4-Ddb1, вносит вклад в регуляцию плюрипотентности, так как нокдаун Ddb1 приводил к понижению уровней факторов плюрипотентности Nanog и Oct4, а также к усилению регуляции генов, связанных с дифференцировкой ЭСК (Buckley et al., 2012; Gao et al., 2015). E3-лигаза March5 также участвует в поддержании плюрипотентности ЭСК мыши (Gu et al., 2015). Лигаза Rnf12/RLIM контролирует судьбу ЭСК мыши, помечая негативный регулятор TGF-β сигналинга Smad7 для протеасомной деградации (Zhang et al., 2012). Лигаза Rnf12/RLIM инициирует инактивацию импринтированной Х‑хромосомы, осуществляя убиквитинирование Rex1 и его последующую деградацию (Shin et al., 2010; Gontan et al., 2012).
Высокий уровень экспрессии компонент УПС в ЭСК человека и его снижение во время дифференцировки данных клеток предполагает важную роль УПС в регуляции плюрипотентности (Szutorisz et al., 2006). Анализ транскриптома ЭСК при нокдауне Oct4 выявил значительные изменения в экспрессии более 1000 генов, из которых 18 генов были связаны с УПС (Babaie et al., 2007). Результаты некоторых исследований указывают также на усиленную протеасомную активность в ЭСК, которая характеризуется повышенными уровнями белка субъединицы 19S протеасомы Rpn6 (PSMD11) и соответствующей усиленной сборкой 26S/30S-протеасом (Vilchez et al., 2012). Интересно, что в ЭСК мыши мишенями протеасом являются РНК-полимераза II и факторы транскрипции, связывающиеся с тканеспецифическими регуляторными участками генов, с тем чтобы ограничивать транскрипцию этих генов в ЭСК и способствовать их быстрой активации при дифференцировке (Szutorisz et al., 2006). По результатам анализа транскрипционного профиля ЭСК человека, ген индуцибельной субъединицы протеасомы β5i был выявлен среди наиболее активно экспрессирующихся генов (Sato et al., 2003). В дальнейших исследованиях была обнаружена повышенная экспрессия и других генов УПС в ЭСК по сравнению с дифференцированными клетками, что может говорить о важности участия данной системы в поддержании плюрипотентности (Baharvand et al., 2006; Assou et al., 2009). Ингибирование протеасом вызывает прекращение самообновления и выход из плюрипотентного состояния (Assou et al., 2009; Atkinson et al., 2012; Vilchez et al., 2012). Замечено, что ингибирование протеасом приводило к подавлению экспрессии связанных с плюрипотентностью генов, таких как POU5F1, NANOG, C-MYC, SOX2, SSEA3, TRA-1-81 и TRA-1, а также к активации генов дифференцировки, таких как FGF5 и GATA4. Интересно, что селективное ингибирование активности иммунопротеасомных субъединиц β1i (UK-101) и β5i (PR-957) в ЭСК человека также сопровождается индукцией экспрессии соматических маркеров, таких как FGF5 и GATA4, что указывает на важность активности иммунопротеасом в поддержании клеточной плюрипотетности (Atkinson et al., 2012).
Транскрипционный фактор Nrf2, известный ключевой ген плюрипотентности, действует как регулятор активности протеасом в ЭСК человека частично через шаперон POMP (Jang et al., 2014). O-GlcNA-цилирование регулятора протеасомы PA28γ поддерживает плюрипотентность ЭСК мыши посредством контроля гомеостаза P-телец (Pecori et al., 2021). Эта модификация спобствует деградации Ddx6, который важен для сборки P-телец, и, напротив, потеря O-GlcNA-цилирования PA28γ стабилизирует Ddx6, повышая уровни P-телец и приводя к спонтанному выходу ЭСК мыши из плюрипотентного состояния.
В совокупности, существующие в литературе данные подтверждают, что повышенная активность протеасом является неотъемлемой характеристикой идентичности ЭСК. Почему эти клетки нуждаются в усиленной протеасомной активности? Одна из возможностей заключается в том, что ЭСК не могут переносить токсичные, неправильно свернутые белки, имеют повышенные требования к УПС, позволяя этим клеткам поддерживать интактный протеом для самообновления и производства предшественников трех зародышевых листков. Показано, например, что вместе с регуляторной частицей PA28, протеасомный комплекс удаляет большое количество поврежденных окислением белков при дифференцировке ЭСК (Hernebring et al., 2006, 2013). Также, УПС в ПСК активно задействована в регуляции стабильности различных регуляторных белков, особенно тех, которые участвуют в регуляции транскрипции и сигнальных каскадов (Naujokat, Saric, 2007). УПС модулирует судьбу ПСК посредством убиквитинирования/деубиквитинирования и последующей деградацией основных регуляторов плюрипотентности, таких как транскрипционные факторы Oct4, Nanog, c-Myc, Klf4 и Sox2 (Buckley et al., 2012; Hernebring et al., 2013), а также участники сигнальных путей LIF/JAK/STAT3, Nodal/TGFβ/Activin, Wnt/β-catenin, Notch, и BMP (James et al., 2005; Ogawa et al., 2006; Greber et al., 2008; Powers et al., 2009; Hatakeyama, 2012; Tanaka, 2013). Регуляция времени жизни регуляторных белков посредством УПС позволяет этим клеткам быстро реагировать на сигналы, поступающие из внешней среды, сохраняя при этом свои плюрипотентные свойства и способность реализовывать конкретные программы клеточной дифференцировки.
УПС В РЕПРОГРАММИРОВАНИИ
Изменение уровня экспрессии транскрипционных факторов, особенно Oct4, Nanog, Klf4, Sox2 и c-Myc, является важным регулирующим событием в судьбе ПСК (Lengner et al., 2007; Tolkunova et al., 2007; Xu et al., 2009b; DeVeale et al., 2013; Fang et al., 2014; Liu et al., 2020). Самые незначительные изменения в уровне экспрессии данных транскрипционных факторов в ПСК могут приводить к выходу из плюрипотентного состояния, дифференцировке или онкогенезу (Gidekel et al., 2003; Fang et al., 2014; Liu et al., 2020). Исследования показали, что УПС участвует в регуляции сложного процесса клеточного репрограммирования и что как ЭСК, так и иПСК используют УПС сходными способами для регуляции уровней и активности ключевых факторов плюрипотентности (Buckley et al., 2012). Среди этих транскрипционных факторов находятся и четыре транскрипционных фактора Яманаки, Oct4, Sox2, c-Myc, Klf4, которые репрограммируют соматические клетки в иПСК (Takahashi, Yamanaka, 2006).
Oct4 является транскрипционным фактором, имеющим POU-домен (Scholer et al., 1989; Choi, Baek, 2018), и специфично экспрессируется в ЭСК, ранних эмбрионах и в клетках зародышевой линии. Данный транскрипционный фактор играет важную роль в поддержании самообновления и плюрипотентности ЭСК, и является одним из факторов репрограммирования при получении иПСК (Takahashi, Yamanaka, 2006; Liu et al., 2020). Oct4 может образовывать димеры c транскрипции факторами POU-, HMG-box и других семейств (см. обзор (Bakhmet, Tomilin, 2021)). POU-домен необходим для цитоплазматической локализации белка Oct4 в клетке (Oka et al., 2013). Важно отметить, что экспрессия Oct4 необходима для регуляции плюрипотентности и ранней дифференцировки ЭСК, однако, уровень экспрессии Oct4 очень тонко регулируется в ЭСК, так как повышение или понижение может приводить к дифференцировке клеток. Так, показано, что сверхэкспрессия Oct4 индуцирует дифференцировку ЭСК в энтодерму и мезодерму, в то время как подавление экспрессии Oct4 приводит к дифференцировке этих клеток в трофэктодерму (Niwa et al., 2000). Oct4 имеет относительно короткий период полужизни, быстро деградируя в клетке посредством УПС (Li et al., 2018). Убиквитинирование Oct4 осуществляет Е3-убиквитин-лигаза Wwp2, несущая карбоксильный конец (HECT), и нокдаун Wwp2 в ЭСК мыши приводил к повышению уровня Oct4 (Xu et al., 2004). При этом было показано, что моноубиквитинирование инактивировало транскрипционную активность Oct4, тогда как полиубиквитинирование (преимущественно по К63) снижало уровень данного транскрипционного фактора в клетке (Liao, Jin, 2010). Другая HECT-лигаза Itch негативно регулирует активность Oct4 в клетке и, таким образом, поддерживает самообновление ЭСК (Liao et al., 2013). Несмотря на то, что Wwp2 и Itch принадлежат к одному семейству HECT-убиквитин-лигаз, они по-разному взаимодействуют с Oct4. Itch нацелен на определенный ДНК-связывающий домен Oct4, а Wwp2 может взаимодействовать с любым доменом Oct4 (Liao, Jin, 2010; Liao et al., 2013). Также, поддерживать состояние плюрипотентности ЭСК, регулируя уровень Oct4, могут E3-лигазы Rnf2 (RING-убиквитин лигаза) и Dpf2 (PHD-убиквитин-лигаза) (van der Stoop et al., 2008; Liu et al., 2015). При нокдауне Dpf2 повышался уровень Oct4, что приводило к индукции дифференцировки ЭСК человека (Liu et al., 2015). Помимо убиквитин-лигаз, в контроле уровня Oct4 в клетке задействованы DUB ферменты, например, Usp44 и Usp34 (Fuchs et al., 2012; Oh et al., 2017; Rhie et al., 2021). Замечено, что во время дифференцировки наблюдается снижение количества Usp44 и Usp34, что свидетельствует об их специфичности для ЭСК. Дефицит Usp34 приводил к накоплению Oct4, что поддерживало состояние плюрипотентности (Oh et al., 2017). Однако, отсутствие Usp44, напротив, вызывало снижение уровня Oct4 при дифференцировке ЭСК (Fuchs et al., 2012).
Sox2 (SRY box-containing gene 2) – транскрипционный фактор из семейства Sox, который экспрессируется в клетках половой линии, на ранних стадиях эмбриогенеза и в нейрональных стволовых клетках (НСК), а также является ключевым фактором при получении иПСК (Koopman et al., 2004; Liu et al., 2020). Sox2 содержит HMG-бокс (High Mobility Group-box), который взаимодействует с AT-богатыми мотивами ДНК цепи и индуцирует активацию транскрипции на данном участке. HMG-домен имеет несколько участков, связанных с трансактивационной активностью на С-конце. Sox2 необходим для регуляции факторов транскрипции, которые влияют на экспрессию Oct4, и считается, что работа транскрипционного фактора Sox2 важна для сохранения плюрипотентного состояния ЭСК за счет поддержания необходимого уровня экспрессии Oct4 (Masui et al., 2007). Интересно, что как подавление экспрессии Sox2, так и его повышенная экспрессия, вызывали снижение экспрессии Oct4 и Nanog, что приводило к активации трофэктодермальных генов и к трофэктодермальной дифференцировке ЭСК человека (Adachi et al., 2010). Замечено также, что повышенная экспрессия Sox2 в ЭСК и иПСК снижает экспрессию мезододермальных генов и индуцирует дифференцировку в нейроэктодермальные, мезодермальные и трофэктодермальные клетки (Suresh et al., 2016). Таким образом, как и в случае с Oct4, для определения судьбы ЭСК важен определенный уровень Sox2 (Strebinger et al., 2019). Уровень белка Sox2 регулируется в ЭСК посредством УПС, причем оказалось, что фосфорилирование Sox2 усиливает способность ЭСК мыши к самообновлению за счет стабилизации Sox2, предотвращая его убиквитин-зависимую деградацию (Ouyang et al., 2015). Ингибирование киназы Akt1, для которой показана способность фосфорилировать Sox2, вызывало снижение уровня Sox2 в клетке и подавляло способность ЭСК мыши к самообновлению (Jeong et al., 2010). Е3-лигаза Ubr5 индуцирует деградацию Sox2 посредством его убиквитинирования, а фосфорилирование Sox2 с помощью Akt ингибирует взаимодействие Ubr5 с Sox2, что стабилизирует Sox2 (Wang et al., 2019). Последующее исследование показало сложную регуляцию уровня Sox2 в ЭСК, в основе которой лежит сбалансированное переключение между метилированием и фосфорилированием этого белка (Fang et al., 2014). Метилтрансфераза Set7 монометилирует Sox2 по K119, что ведет к его убиквитинированию E3-лигазой Wwp2 и к последующей протеасомной деградации. Напротив, киназа Akt1 фосфорилирует Sox2 по T118, что приводит к стабилизации Sox2, предотвращая его метилирование с помощью Set7 (Fang et al., 2014). В стабилизации Sox2 также задействованы деметилаза Lsd1 и белок Phf20l1, а их нокдаун ухудшает самообновление ЭСК мыши (Zhang et al., 2018). С метилированным Sox2 также связывается белок L3mbtl3, что приводит к рекрутированию другой лигазы Crl4-Dcaf5 и убиквитин-зависимому протеолизу Sox2 (Zhang et al., 2019). Sox2 является также мишенью для DUB фермента Usp22 (Sussman et al., 2013). Помимо Usp22, DUB ферментами для Sox2 могут являться Usp7 (Cox et al., 2013; Huang et al., 2021), Usp9x (Oishi et al., 2016; Chen et al., 2020; Potu et al., 2021), Usp15, Usp24 (Wuebben, Rizzino, 2017), Usp25, Usp37 (Qiu et al., 2017), Usp34 (Oh et al., 2017), Usp44 и Usp49 (Boyer et al., 2005). Идентифицирован еще один RING-лигазный комплекс Cul4a-Det1-Cop1 и DUB фермент Otud7b, которые регулируют стабильность белка Sox2 во время дифференцировки нервных клеток-предшественников (Cui et al., 2018). Так, нокдаун Cop1 стабилизировал Sox2, предотвращая дифференцировку этих клеток, тогда как нокдаун Otud7b, напротив, дестабилизировал Sox, запуская дифференцировку.
Klf4 (Krüppel-like factor 4, также имеет название GKLF (Gut-enriched Krüppel- like factor)) – это цинк-фингерный транскрипционный фактор подсемейства Klf, которое относится к большому семейству транскрипционных факторов Sp1 (Kaczynski et al., 2003). Klf4 вовлечен в контроль таких биологических процессов как пролиферация, клеточная дифференцировка и апоптоз (Jiang et al., 2008). Помимо этого, Klf4 используют как один из факторов репрограммирования в ходе получения иПСК. Интересно, что в отличии от Oct4 и Sox2, Klf4 очень стабилен в ЭСК (период полужизни более 24 ч), однако, эта высокая стабильность заметно снижается при дифференцировке (Dhaliwal et al., 2019). Высокая стабильность Klf4 в ЭСК поддерживается за счет взаимодействия с факторами Nanog, Sox2 и Stat3. Пост-трансляционная модификация (убиквитинирование) Klf4 дестабилизирует белок, когда клетки выходят из плюрипотентного состояния, что указывает на роль пост-трансляционных механизмов в поддержании стабильности белка и плюрипотентного состояния. Обнаружено, что снижение уровня белка Klf4 связано с функцией протеасом (Chen et al., 2005). Erk1/2-опосредованное фосфорилирование по Ser123 подавляет активность Klf4, вызывая дифференцировку ЭСК (Kim et al., 2012). Это фосфорилирование является меткой для узнавания Klf4 E3-лигазы Scf-Trcp и последующей протеасомной деградации, что впоследствии и приводит к дифференцировке ЭСК. С другой стороны, Klf4 транскрипционно активирует экспрессию Е3-лигазы RING-типа March5, которая регулирует плюрипотентность, старение, генерацию активных форм кислорода (АФК) и деление митохондрий (Shiiba et al., 2020). В ЭСК мыши March5 действует как незаменимый фактор для поддержания плюрипотентности, полиубиквитинирует PRKAR1A при активации PKA, что в конечном итоге приводит к ингибированию сигнального пути Raf/MEK/ERK (Gu et al., 2015). Интересно, что фосфорилирование Klf4 с помощью другой киназы Plk1 вызывало рекрутирование E3-лигазы Traf6, что приводило к убиквитинированию Klf4 и его стабилизации в раковых клетках (Mai et al., 2019). Полногеномный скрининг E3-лигаз также определил еще одну лигазу Scf-Fbxo32, которая отвечает за убиквитинирование и деградацию Klf4 (Zhou et al., 2017).
c-Myc – транскрипционный фактор из семейства Myc, регулирующий многие клеточные процессы, включая пролиферацию, апоптоз, дифференцировку и онкогенез (Dang, 2013). Важно, что c-Myc поддерживает плюрипотентность ЭСК мыши и также является фактором репрограммирования при генерации иПСК (Schmidt, Plath, 2012; Takahashi, Yamanaka, 2016). Сверхэкспрессия c-Myc поддерживает плюрипотентное состояние ЭСК мыши, в то время как подавление активности c-Myc вызывает дифференцировку этих клеток (Cartwright et al., 2005). В случае ЭСК человека, активация c-Myc не поддерживала плюрипотентность, а, напротив, приводила к дифференцировке и апоптозу этих клеток (Sumi et al., 2007). c-Myc функционирует совместно с Oct4, Sox2 и Klf4, избирательно повышая эффективность транскрипции генов, специфичных для ЭСК; также он увеличивает эффективность образования иПСК (Nakagawa et al., 2008). Убиквитинирование и протеолиз важны для регуляции стабильности и правильного функционирования c-Myc. Известно, что c-Myc обладает малым периодом полужизни, что обеспечивается УПС (Farrell, Sears, 2014). В структуре c-Myc выделяют два домена гомологии MBI и MBII, для которых показана связь с убиквитинированием и протеолизом c-Myc (Flinn et al., 1998). Кроме того, за убиквитинирование c-Myc также отвечает N-концевая часть данного белка (Salghetti et al., 1999). Помимо этого, c-Myc имеет PEST-мотив, который также играет роль в быстрой деградации c-Myc, но не в его убиквитинировании (Gregory, Hann, 2000). Убиквитинирование c-Myc в клетке осуществляют несколько E3-убиквитин-лигаз, первой из которых была идентифицирована Skp2 (Kim et al., 2003). Оказалось, что Skp2 убиквитинирует c-Myc в разных доменах, являясь транскрипционным кофактором для c-Myc (von der Lehr et al., 2003). E3-убиквитин-лигаза Fbxw7 также убиквитинирует c-Myc и способствует его протеасомой деградации (Welcker et al., 2004). Важно отметить, что на уровень белка c-Myc влияют два последовательных и взаимозависимых пролин-направленных фосфорилирования S62 и Т58, при этом фосфорилирование в каждом из этих двух сайтов влияет на взаимодействие с-Myc с изомеразой Pin1 и его изомеризацию в положении P63 (Farrell et al., 2013; Helander et al., 2015). Инициирующее фосфорилирование S62 с помощью киназ MAPK, c‑JUN или CDK1 задействует с-Myc для последующего фосфорилирования T58 с помощью киназы GSK3 (Gregory et al., 2003). Фосфорилирование T58 приводит к удалению активирующего фосфата S62 за счет действия пролин-направленной транс-специфической фосфатазы PP2A-B56α (Arnold, Sears, 2006), что способствует дальнейшему полиубиквитинированию с помощью убиквитин-лигазы Fbw7 и протеасомной деградации c-Myc (Welcker et al., 2004). Показано, что STAT3-зависимая регуляция транскрипции c-Myc и подавление его фосфорилирования T58 имеют решающее значение для регуляции его активности в ЭСК мыши, и, следовательно, для поддержания самообновления ЭСК (Cartwright et al., 2005). Интересно, что лигаза Rnf12/RLIM полиубиквитинирует c-Myc независимо от фосфорилирования по S62 и T58, однако это убиквитинирование не влияет на стабильность c-Myc, но подавляет транскрипционную активность c-Myc (Gao et al., 2016). Также были выявлены DUB-ферменты, взаимодействующие с c-Myc – Usp13, Usp22, Usp28, Usp36 и Usp37. DUB Usp13 стабилизирует c-Myc посредством антагонизма с Fbxl14-опосредованным убиквитинированием, что важно для самообновления стволовых клеток глиомы (Fang et al., 2017). Другая DUB, Usp22, также способствует деубиквитинизации c-Myc, что приводит к увеличению уровня c-Myc в нескольких линиях раковых клеток (Kim et al., 2017). В регуляции активности c-Myc обнаружена петля обратной связи c-Myc–Sirt1, поскольку c-Myc индуцирует экспрессию Sirt1, который в свою очередь деацетилирует c-Myc, понижая стабильность c-Myc (Yuan et al., 2009). Однако, сверхэкспрессия Sirt1 также связана с c-Myc-индуцированной экспрессией Usp22, а это приводит к снижению убиквитинирования Sirt1 и повышению стабильности последнего (Li et al., 2014a). Предполагалось, что DUB Usp28 не может взаимодействовать с c-Myc напрямую, но может регулировать данный белок через взаимодействие с Fbxw7 (Popov et al., 2007). Однако, другое исследование показало, что Usp28 не зависит от присутствия Fbw7, при этом распознает и деубиквитилирует те же субстраты, что и лигаза Fbw7. Взаимодействие Fbw7 с c-Myc происходит через связывание с фосфорилированным мотивом, так называемым фосфодегроном (Welcker et al., 2004). Usp28 также взаимодействует с этим же мотивом, но только когда он не фосфорилирован (Diefenbacher et al., 2015). Usp36 и Usp37 деубиквитинируют и стабилизируют c-Myc в ядре клетки; при подавлении активности Usp36 и Usp37 повышается протеасомная деградация c‑Myc, и пролиферация ЭСК значительно снижается (Pan et al., 2015; Sun et al., 2015).
Важно отметить, что репрограммирование соматических клеток с помощью транскрипционных факторов Oct4, Sox2, Klf4 и c-Myc индуцирует окислительный стресс и значительно повышает уровни АФК как in vitro (Banito et al., 2009), так и in vivo (Mosteiro et al., 2018). Высокий уровень АФК приводит к повреждению клеток, старению и апоптозу, в то время как добавление антиоксидантов, таких как N-ацетилцистеин или витамин C, предотвращает вызванное АФК повреждения иПСК (Zhou et al., 2016; Cieślar-Pobuda et al., 2017; Lee et al., 2018). Как чрезмерная продукция АФК, так и снижение уровня АФК антиоксидантами на раннем этапе репрограммирования снижают эффективность получения иПСК (Zhou et al., 2016). Помимо этого, показано повышение уровня синтеза антиоксидантов в клетке на поздней стадии репрограммирования (Zhou et al., 2016). Также, было продемонстрировано, что для эффективного получения иПСК необходима активация врожденного иммунитета (Lee et al., 2012). В ходе соматического репрограммирования индуцируются NF-kB- и IRF3-опосредованные изменения в экспрессии эпигенетических модификаторов, которые обеспечивают открытое состояние хроматина (Lee et al., 2012). Исследования показывают, что повышение АФК-сигналинга активирует процессы врожденного иммунитета в соматических клетках (Nathan, Cunningham-Bussel, 2013; Panday et al., 2015).
Замечено, что ингибирование активности протеасом, как и иммунопротеасом, значительно снижало эффективность генерации иПСК (Atkinson et al., 2012; Buckley et al., 2012), что происходило несмотря на усиление экспрессии генов Oct4 и Nanog (Floyd et al., 2015). Одной из функций УПС является деградация поврежденных, в том числе, окисленных белков (Margulis et al., 2020). Показано, что в условиях окислительного стресса, протеолитической активности АТФ-зависимой 26S-протеасомы недостаточно для деградации быстро образующихся поврежденных белков (Seifert et al., 2010). Во время дифференцировки в условиях окислительного стресса количество 26S-протеасом практически не изменяется, тогда как резко повышается уровень иммунопротеасом и регуляторной частицы PA28α/β (Hernebring et al., 2013). Предполагают, что АТФ-независимый комплекс иммунопротеасомы с двумя регуляторными частицами PA28, а также АТФ-зависимая гибридная протеасома, состоящая из иммунопротеасомы и регуляторов 19S и PA28, ответственны, преимущественно, за снижение количества окислительно-модифицированных белков в процессе окислительного стресса (Hernebring et al., 2006, 2013). По сравнению с конститутивными субъединицами, индуцибельные субъединицы протеасом обладают более быстрым ответом и протеолитической активностью, что повышает эффективность деградации окисленных белков (Seifert et al., 2010).
ЗАКЛЮЧЕНИЕ
УПС регулирует протеостаз, осуществляя мониторинг стабильности и активности белка в клетке, и, следовательно, функционирует во всех белок-зависимых клеточных процессах, включая регуляцию клеточного цикла, транскрипции и трансляции, и работу ключевых сигнальных путей. Кроме того, известно, что УПС участвует в деградации поврежденных белков и большей части окисленных белков, обеспечивая усиленную защиту клеток от последствий окислительного и других стрессов. ЭСК, как и иПСК, характеризуются уникальными транскриптомными, эпигеномными и протеомными сигнатурами, которые организованы высокоточной регуляторной сетью, а также обладают повышенной активностью защитных систем клетки. Учитывая это, неудивительно, что в ЭСК сильно активированы гены, ассоциированные с УПС (Ramalho-Santos et al., 2002). Исходя из имеющихся на сегодняшний день данных, становится очевидно, что УПС играет важнейшую роль в становлении и поддержании плюрипотентности и в выборе направления специализации ПСК как через модуляцию экспрессии, активности и субстратной специфичности протеасомных комплексов, так и посредством перекрестной регуляции основных транскрипционных факторов плюрипотентности и участников регуляторной сети с помощью Е1-E2-E3 и DUB-ферментов УПС. Каждый год идентифицируют все новые E3-убиквитин-лигазы и ферменты DUB, связанные с поддержанием плюрипотентности ЭСК и их дифференцировкой. Совместная работа эти компонентов УПС в ПСК обеспечивает баланс между убиквитинированием и деубиквитинированием основных регуляторов плюрипотентности Oct4, Sox2, Nanog, Klf4 и других ключевых факторов и, тем самым, определяет судьбу этих клеток. Так, например, Е3-лигазы катализируют убиквитинирование белков, связанных со “стволовостью”, а также их последующую деградацию в протеасомах, что приводит к выходу ЭСК из состояния плюрипотентности посредством дифференцировки. Напротив, когда ассоцированные с плюрипотентностью белки деубиквитинируются DUB, дифференцировка ЭСК ингибируется. Возможность получения иПСК из соматических клеток в процессе репрограммирования также поставила вопрос о роли УПС в индукции клеточной плюрипотентности. Как уже упоминалось, репрограммирующие факторы Oct4, Klf4, Sox2, и с-Myc убиквитинируются и подвергаются протеолизу в протеасомах. С другой стороны, ингибирование протеасомной активности вызывает сильное снижение эффективности репрограммирования (Atkinson et al., 2012; Buckley et al., 2012; Floyd et al., 2015). Интересно, что селективное ингибирование активности иммунопротеасомы также приводит к снижению клонообразования в процессе репрограммирования (Atkinson et al., 2012), однако, функциональное значение иммунопротесом в становлении плюрипотентности остается неисследованным.
Несмотря на бурное развитие данной темы, всестороннее понимание роли УПС в регуляции плюрипотентности, дифференцировки и репрограммирования невозможно без ответов на такие вопросы, например, как УПС динамически регулирует разные этапы репрограммирования. Как координируется работа различных E3-лигаз в отношении своих мишеней – факторов плюрипотентности и других регуляторов – в равновесных состояниях ЭСК/иПСК и в процессах репрограммирования и дифференцировки? Более того, крайне фрагментарно понимание того как убиквитинирование сопряжено с другими пост-трансляционными модификациями белков, такими как метилирование, ацетилирование и фосфорилирование, в контексте организации молекулярных сигнатур плюрипотентности. Ответы на эти и другие вопросы позволят в будущем лучше понять биологию ПСК, а следовательно, приблизят их дальнейшее применение в клинической практике.
Список литературы
Adachi K., Suemori H., Yasuda S.Y. et al. Role of SOX2 in maintaining pluripotency of human embryonic stem cells // Genes to Cells. 2010. V. 15. № 5. P. 455–470.
Amariglio N., Hirshberg A., Scheithauer B.W. et al. Donor-derived brain tumor following neural stem cell transplantation in an ataxia telangiectasia patient // PLoS Medicine. 2009. V. 6. № 2. P. e1000029.
Arnold H.K., Sears R.C. Protein phosphatase 2A regulatory subunit B56α associates with c-Myc and negatively regulates c-Myc accumulation // Mol. and Cellular Biol. 2006. V. 26. № 7. P. 2832–2844.
Assou S., Cerecedo D., Tondeur S. et al. A gene expression signature shared by human mature oocytes and embryonic stem cells // BMC Genomics. 2009. V. 10. P. 10.
Atkinson S.P., Collin J., Irina N. et al. A putative role for the immunoproteasome in the maintenance of pluripotency in human embryonic stem cells // Stem Cells. 2012. V. 30. № 7. P. 1373–1384.
Babaie Y., Herwig R., Greber B. et al. Analysis of Oct4-dependent transcriptional networks regulating self-renewal and pluripotency in human embryonic stem cells // Stem Cells. 2007. V. 25. № 2. P. 500–510.
Bader M., Benjamin S., Wapinski O.L. et al. A conserved F box regulatory complex controls proteasome activity in Drosophila // Cell. 2011. V. 145. № 3. P. 371–382.
Baharvand H., Hajheidari M., Ashtiani S.K. et al. Proteomic signature of human embryonic stem cells // Proteomics. 2006. V. 6. № 12. P. 3544–3549.
Bakhmet E.I.,Tomilin A.N. Key features of the POU transcription factor Oct4 from an evolutionary perspective // Cellular and Mol. Life Sci. 2021. V. 78. № 23. P. 7339–7353.
Banito A., Rashid S.T., Acosta J.C. et al. Senescence impairs successful reprogramming to pluripotent stem cells // Genes & Development. 2009. V. 23. № 18. P. 2134–2139.
Boyer L.A., Lee T.I., Cole M.F. et al. Core transcriptional regulatory circuitry in human embryonic stem cells // Cell. 2005. V. 122. № 6. P. 947–956.
Brennand K.J., Simone A., Jou J. et al. Modelling schizophrenia using human induced pluripotent stem cells // Nature. 2011. V. 473. № 7346. P. 221–225.
Briggs J.A., Sun J., Shepherd J. et al. Integration-free induced pluripotent stem cells model genetic and neural developmental features of down syndrome etiology // Stem Cells. 2013. V. 31. № 3. P. 467–478.
Buckley S.M., Aranda-Orgilles B., Strikoudis A. et al. Regulation of pluripotency and cellular reprogramming by the ubiquitin-proteasome system // Cell Stem Cell. 2012. V. 11. № 6. P. 783–798.
Cartwright P., McLean C., Sheppard A. et al. LIF/STAT3 controls ES cell self-renewal and pluripotency by a Myc-dependent mechanism // Development. 2005. V. 132. № 5. P. 885–896.
Chen X., Zhang X., Cai H. et al. Targeting USP9x/SOX2 axis contributes to the anti-osteosarcoma effect of neogambogic acid // Cancer Letters. 2020. V. 469. P. 277–286.
Chen Z.Y., Wang X., Zhou Y. et al. Destabilization of Kruppel-like factor 4 protein in response to serum stimulation involves the ubiquitin-proteasome pathway // Cancer Research. 2005. V. 65. № 22. P. 10394–10400.
Cho-Park P.F., Steller H. Proteasome regulation by ADP-ribosylation // Cell. 2013. V. 153. № 3. P. 614–627.
Choi J., Baek K.H. Cellular functions of stem cell factors mediated by the ubiquitin-proteasome system // Cellular and Mol. Life Sci.: CMLS. 2018. V. 75. № 11. P. 1947–1957.
Chondrogianni N., Gonos E.S. Structure and function of the ubiquitin-proteasome system: modulation of components // Progress in Molecular Biology and Translational Science. 2012. V. 109. P. 41–74.
Cieślar-Pobuda A., Yue J., Lee H.-C. et al. ROS and oxidative stress in stem cells. Hindawi, 2017.
Cox J.L., Wilder P.J., Gilmore J.M. et al. The SOX2-interactome in brain cancer cells identifies the requirement of MSI2 and USP9X for the growth of brain tumor cells // PLoS One. 2013. V. 8. № 5. P. e62857.
Cui C.-P., Zhang Y., Wang C. et al. Dynamic ubiquitylation of Sox2 regulates proteostasis and governs neural progenitor cell differentiation // Nature Communications. 2018. V. 9. № 1. P. 1–15.
Dang C.V. MYC, metabolism, cell growth, and tumorigenesis // Cold Spring Harbor Perspectives in Medicine. 2013. V. 3. № 8. P. a014217.
Delevoye C., Marks M.S., Raposo G. Lysosome-related organelles as functional adaptations of the endolysosomal system // Current Opinion in Cell Biol. 2019. V. 59. P. 147–158.
DeRosa B.A., Van Baaren J.M., Dubey G.K. et al. Derivation of autism spectrum disorder-specific induced pluripotent stem cells from peripheral blood mononuclear cells // Neuroscience Letters. 2012. V. 516. № 1. P. 9–14.
Deuse T., Hu X., Gravina A. et al. Hypoimmunogenic derivatives of induced pluripotent stem cells evade immune rejection in fully immunocompetent allogeneic recipients // Nature Biotechnol. 2019. V. 37. № 3. P. 252–258.
De Veale B., Brokhman I., Mohseni P. et al. Oct4 is required ∼E7. 5 for proliferation in the primitive streak // PLoS Genetics. 2013. V. 9. № 11. P. e1003957.
Dhaliwal N.K., Abatti L.E., Mitchell J.A. KLF4 protein stability regulated by interaction with pluripotency transcription factors overrides transcriptional control // Genes & Development. 2019. V. 33. № 15–16. P. 1069–1082.
Diefenbacher M.E., Chakraborty A., Blake S.M. et al. Usp28 counteracts Fbw7 in intestinal homeostasis and cancer // Cancer Research. 2015. V. 75. № 7. P. 1181–1186.
Dikic I., Robertson M. Ubiquitin Ligases and Beyond Springer, 2012.
Doss M.X., Sachinidis A. Current challenges of iPSC-based disease modeling and therapeutic implications // Cells. 2019. V. 8. № 5. P. 403.
Fang L., Zhang L., Wei W. et al. A methylation-phosphorylation switch determines Sox2 stability and function in ESC maintenance or differentiation // Molecular Cell. 2014. V. 55. № 4. P. 537–551.
Fang X., Zhou W., Wu Q. et al. Deubiquitinase USP13 maintains glioblastoma stem cells by antagonizing FBXL14-mediated Myc ubiquitination // J. Experimental Medicine. 2017. V. 214. № 1. P. 245–267.
Farrell A.S., Pelz C., Wang X. et al. Pin1 regulates the dynamics of c-Myc DNA binding to facilitate target gene regulation and oncogenesis // Molecular and Cellular Biol. 2013. V. 33. № 15. P. 2930–2949.
Farrell A.S., Sears R.C. MYC degradation // Cold Spring Harbor Perspectives in Medicine. 2014. V. 4. № 3.
Flinn E.M., Busch C.M., Wright A.P. myc boxes, which are conserved in myc family proteins, are signals for protein degradation via the proteasome // Mol. and Cellular Biol. 1998. V. 18. № 10. P. 5961–5969.
Floyd Z.E., Staszkiewicz J., Power R.A. et al. Prolonged proteasome inhibition cyclically upregulates Oct3/4 and Nanog gene expression, but reduces induced pluripotent stem cell colony formation // Cellular Reprogramming. 2015. V. 17. № 2. P. 95–105.
Fuchs G., Shema E., Vesterman R. et al. RNF20 and USP44 regulate stem cell differentiation by modulating H2B monoubiquitylation // Molecular Cell. 2012. V. 46. № 5. P. 662–673.
Gao J., Buckley S.M., Cimmino L. et al. The CUL4-DDB1 ubiquitin ligase complex controls adult and embryonic stem cell differentiation and homeostasis // eLife. 2015. V. 4. P. e07539.
Gao R., Wang L., Cai H. et al. E3 ubiquitin ligase RLIM negatively regulates c-Myc transcriptional activity and restrains cell proliferation // PLoS One. 2016. V. 11. № 9. P. e0164086.
Gidekel S., Pizov G., Bergman Y. et al. Oct-3/4 is a dose-dependent oncogenic fate determinant // Cancer Cell. 2003. V. 4. № 5. P. 361–370.
Glickman M.H., Ciechanover A. The ubiquitin-proteasome proteolytic pathway: destruction for the sake of construction // Physiological Reviews. 2002. V. 82. № 2. P. 373–428.
Gontan C., Achame E.M., Demmers J. et al. RNF12 initiates X-chromosome inactivation by targeting REX1 for degradation // Nature. 2012. V. 485. № 7398. P. 386–390.
Gorbea C., Goellner G.M., Teter K. et al. Characterization of mammalian Ecm29, a 26 S proteasome-associated protein that localizes to the nucleus and membrane vesicles // The J. Biol. Chem. 2004. V. 279. № 52. P. 54849–54861.
Greber B., Lehrach H., Adjaye J. Control of early fate decisions in human ES cells by distinct states of TGFβ pathway activity // Stem Cells and Development. 2008. V. 17. № 6. P. 1065–1078.
Gregory M.A., Hann S.R. c-Myc proteolysis by the ubiquitin-proteasome pathway: stabilization of c-Myc in Burkitt’s lymphoma cells // Mol. and Cellular Biol. 2000. V. 20. № 7. P. 2423–2435.
Gregory M.A., Qi Y., Hann S.R. Phosphorylation by glycogen synthase kinase-3 controls c-myc proteolysis and subnuclear localization // J. Biol. Chem. 2003. V. 278. № 51. P. 51606–51612.
Gu H., Li Q., Huang S. et al. Mitochondrial E3 ligase March5 maintains stemness of mouse ES cells via suppression of ERK signalling // Nature Communications. 2015. V. 6. № 1. P. 1–12.
Gurdon J.B. The developmental capacity of nuclei taken from intestinal epithelium cells of feeding tadpoles // Journal of Embryology and Experimental Morphology published for the company of biologists limited Oxford: at the clarendon press, 1962.
Hatakeyama S. Ubiquitin-mediated regulation of JAK-STAT signaling in embryonic stem cells // Jak-Stat. 2012. V. 1. № 3. P. 168–175.
Helander S., Montecchio M., Pilstål R. et al. Pre-anchoring of Pin1 to unphosphorylated c-Myc in a fuzzy complex regulates c-Myc activity // Structure. 2015. V. 23. № 12. P. 2267–2279.
Hernebring M., Brolen G., Aguilaniu H. et al. Elimination of damaged proteins during differentiation of embryonic stem cells // Proceedings of the National Academy of Sciences of the United States of America. 2006. V. 103. № 20. P. 7700–7705.
Hernebring M., Fredriksson A., Liljevald M. et al. Removal of damaged proteins during ES cell fate specification requires the proteasome activator PA28 // Scientific Reports. 2013. V. 3. P. 1381.
Huang Z., Zhai K., Wu Q. et al. HAUSP Stabilizes SOX2 through deubiquitination to maintain self-renewal and tumorigenic potential of glioma stem cells // bioRxiv. 2021.
Huber E.M.,Groll M. The mammalian proteasome activator PA28 forms an asymmetric α4β3 complex // Structure. 2017. V. 25. № 10. P. 1473–1480. e1473.
James D., Levine A.J., Besser D. et al. TGFβ/activin/nodal signaling is necessary for the maintenance of pluripotency in human embryonic stem cells // Development. 2005. V. 132(6). P. 1273–1282. http//doi.org./10.1242/dev.01706. 2005
Jang J., Wang Y., Kim H.S. et al. Nrf2, a regulator of the proteasome, controls self-renewal and pluripotency in human embryonic stem cells // Stem Cells. 2014. V. 32. № 10. P. 2616–2625.
Jeong C.H., Cho Y.Y., Kim M.O. et al. Phosphorylation of Sox2 cooperates in reprogramming to pluripotent stem cells // Stem Cells. 2010. V. 28. № 12. P. 2141–2150.
Jiang J., Chan Y.S., Loh Y.H. et al. A core Klf circuitry regulates self-renewal of embryonic stem cells // Nature Cell Biol. 2008. V. 10. № 3. P. 353–360.
Jin J., Liu J., Chen C. et al. The deubiquitinase USP21 maintains the stemness of mouse embryonic stem cells via stabilization of Nanog // Nature Communications. 2016. V. 7. № 1. P. 1–15.
Jung T.,Grune T. Structure of the proteasome // Progress in Mol. Biol. and Translational Sci. 2012. V. 109. P. 1–39.
Kaczynski J., Cook T., Urrutia R. Sp1- and Kruppel-like transcription factors // Genome Biol. 2003. V. 4. № 2. P. 206.
Khor B., Bredemeyer A.L., Huang C.Y. et al. Proteasome activator PA200 is required for normal spermatogenesis // Molecular and Cellular Biol. 2006. V. 26. № 8. P. 2999–3007.
Kim D., Hong A., Park H.I. et al. Deubiquitinating enzyme USP22 positively regulates c-Myc stability and tumorigenic activity in mammalian and breast cancer cells // J. Cellular Physiology. 2017. V. 232. № 12. P. 3664–3676.
Kim M.O., Kim S.-H., Cho Y.-Y. et al. ERK1 and ERK2 regulate embryonic stem cell self-renewal through phosphorylation of Klf4 // Nature Structural & Mol. Biol. 2012. V. 19. № 3. P. 283–290.
Kim S.Y., Herbst A., Tworkowski K.A. et al. Skp2 regulates Myc protein stability and activity // Molecular Cell. 2003. V. 11. № 5. P. 1177–1188.
Kniepert A.,Groettrup M. The unique functions of tissue-specific proteasomes // Trends in Biochemical Sciences. 2014. V. 39. № 1. P. 17–24.
Konstantinova I.M., Tsimokha A.S., Mittenberg A.G. Role of proteasomes in cellular regulation // International Review of Cell and Mol. Biol. 2008. V. 267. P. 59–124.
Koopman P., Schepers G., Brenner S. et al. Origin and diversity of the SOX transcription factor gene family: genome-wide analysis in Fugu rubripes // Gene. 2004. V. 328. P. 177–186.
Kwon S.-K., Lee D.-H., Kim S.-Y. et al. Ubiquitin-specific protease 21 regulating the K48-linked polyubiquitination of NANOG // Biochemical and Biophysical Research Communications. 2017. V. 482. № 4. P. 1443–1448.
Lee A.S., Tang C., Rao M.S. et al. Tumorigenicity as a clinical hurdle for pluripotent stem cell therapies // Nature Medicine. 2013. V. 19. № 8. P. 998–1004.
Lee J., Cho Y.S., Jung H. et al. Pharmacological regulation of oxidative stress in stem cells // Oxidative Medicine and Cellular Longevity. 2018. V. 2018.
Lee J., Sayed N., Hunter A. et al. Activation of innate immunity is required for efficient nuclear reprogramming // Cell. 2012. V. 151. № 3. P. 547–558.
Lengner C.J., Camargo F.D., Hochedlinger K. et al. Oct4 expression is not required for mouse somatic stem cell self-renewal // Cell Stem Cell. 2007. V. 1. № 4. P. 403–415.
Li L., Osdal T., Ho Y. et al. SIRT1 activation by a c-MYC oncogenic network promotes the maintenance and drug resistance of human FLT3-ITD acute myeloid leukemia stem cells // Cell Stem Cell. 2014a. V. 15. № 4. P. 431–446.
Li S., Xiao F., Zhang J. et al. Disruption of OCT4 ubiquitination increases oct4 protein stability and ASH2L-B-mediated H3K4 methylation promoting pluripotency acquisition // Stem Cell Reports. 2018. V. 11. № 4. P. 973–987.
Li W., Wang X., Fan W. et al. Modeling abnormal early development with induced pluripotent stem cells from aneuploid syndromes // Human Mol. Genetics. 2012. V. 21. № 1. P. 32–45.
Li X., Thompson D., Kumar B. et al. Molecular and cellular roles of PI31 (PSMF1) protein in regulation of proteasome function // The J. Biol. Chem. 2014b. V. 289. № 25. P. 17392–17405.
Liao B., Jin Y. Wwp2 mediates Oct4 ubiquitination and its own auto-ubiquitination in a dosage-dependent manner // Cell Research. 2010. V. 20. № 3. P. 332–344.
Liao B., Zhong X., Xu H. et al. Itch, an E3 ligase of Oct4, is required for embryonic stem cell self-renewal and pluripotency induction // J. Cellular Physiology. 2013. V. 228. № 7. P. 1443–1451.
Lin Z., Yang H., Kong Q. et al. USP22 antagonizes p53 transcriptional activation by deubiquitinating Sirt1 to suppress cell apoptosis and is required for mouse embryonic development // Molecular Cell. 2012. V. 46. № 4. P. 484–494.
Liu C., Zhang D., Shen Y. et al. DPF2 regulates OCT4 protein level and nuclear distribution // Biochimica et Biophysica Acta. 2015. V. 1853. № 12. P. 3279–3293.
Liu K., Cao J., Shi X. et al. Cellular metabolism and homeostasis in pluripotency regulation // Protein & Cell. 2020. V. 11. № 9. P. 630–640.
Liu K., Jones S., Minis A. et al. PI31 is an adaptor protein for proteasome transport in axons and required for synaptic development // Developmental Cell. 2019. V. 50. № 4. P. 509–524. e510.
Loh Y.-H., Agarwal S., Park I.-H. et al. Generation of induced pluripotent stem cells from human blood // Blood, The J. American Society of Hematology. 2009. V. 113. № 22. P. 5476–5479.
Ma D., Wei H., Lu J. et al. Generation of patient-specific induced pluripotent stem cell-derived cardiomyocytes as a cellular model of arrhythmogenic right ventricular cardiomyopathy // European Heart J. 2013. V. 34. № 15. P. 1122–1133.
Mai J., Zhong Z.-Y., Guo G.-F. et al. Polo-Like Kinase 1 phosphorylates and stabilizes KLF4 to promote tumorigenesis in nasopharyngeal carcinoma // Theranostics. 2019. V. 9. № 12. P. 3541.
Margulis B., Tsimokha A., Zubova S. et al. Molecular chaperones and proteolytic machineries regulate protein homeostasis in aging cells // Cells. 2020. V. 9. № 5. P. 1308.
Masui S., Nakatake Y., Toyooka Y. et al. Pluripotency governed by Sox2 via regulation of Oct3/4 expression in mouse embryonic stem cells // Nature Cell Biol. 2007. V. 9. № 6. P. 625–635.
McCutchen-Maloney S.L., Matsuda K., Shimbara N. et al. cDNA cloning, expression, and functional characterization of PI31, a proline-rich inhibitor of the proteasome // The J. Biol. Chem. 2000. V. 275. № 24. P. 18557–18565.
Merkle F.T., Ghosh S., Kamitaki N. et al. Human pluripotent stem cells recurrently acquire and expand dominant negative P53 mutations // Nature. 2017. V. 545. № 7653. P. 229–233.
Miller D.M., Thomas S.D., Islam A. et al. c-Myc and cancer metabolism (AACR) // Clin. Cancer Res. 2012. V. 18. № 20. P. 5546-53. https://doi.org/10.1158/1078-0432.CCR-12-0977
Miyazaki K., Dyson M.T., Furukawa Y. et al. Generation of progesterone-responsive endometrial stromal fibroblasts from human induced pluripotent stem cells: role of the WNT/CTNNB1 pathway // Stem Cell Reports. 2018. V. 11. № 5. P. 1136–1155.
Moretti A., Bellin M., Welling A. et al. Patient-specific induced pluripotent stem-cell models for long-QT syndrome // New England J. Medicine. 2010. V. 363. № 15. P. 1397–1409.
Mosteiro L., Pantoja C., de Martino A. et al. Senescence promotes in vivo reprogramming through p16 INK 4a and IL-6 // Aging Cell. 2018. V. 17. № 2. P. e12711.
Murata S., Sasaki K., Kishimoto T. et al. Regulation of CD8+ T cell development by thymus-specific proteasomes // Science. 2007. V. 316. № 5829. P. 1349–1353.
Nakagawa M., Koyanagi M., Tanabe K. et al. Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts // Nature Biotechnology. 2008. V. 26. № 1. P. 101–106.
Nathan C., Cunningham-Bussel A. Beyond oxidative stress: an immunologist’s guide to reactive oxygen species // Nature Reviews Immunology. 2013. V. 13. № 5. P. 349–361.
Naujokat C., Saric T. Concise review: role and function of the ubiquitin-proteasome system in mammalian stem and progenitor cells // Stem Cells. 2007. V. 25. № 10. P. 2408–2418.
Niwa H., Miyazaki J.-I., Smith A.G. Quantitative expression of Oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells // Nature Genetics. 2000. V. 24. № 4. P. 372–376.
Noormohammadi A., Calculli G., Gutierrez-Garcia R. et al. Mechanisms of protein homeostasis (proteostasis) maintain stem cell identity in mammalian pluripotent stem cells // Cellular and Molecular Life Sciences: CMLS. 2018. V. 75. № 2. P. 275–290.
Ogawa K., Nishinakamura R., Iwamatsu Y. et al. Synergistic action of Wnt and LIF in maintaining pluripotency of mouse ES cells // Biochemical and Biophysical Research Communications. 2006. V. 343. № 1. P. 159–166.
Oh E., Kim J.Y., Sung D. et al. Inhibition of ubiquitin-specific protease 34 (USP34) induces epithelial-mesenchymal transition and promotes stemness in mammary epithelial cells // Cellular Signalling. 2017. V. 36. P. 230–239.
Oishi S., Premarathne S., Harvey T.J. et al. Usp9x-deficiency disrupts the morphological development of the postnatal hippocampal dentate gyrus // Scientific Reports. 2016. V. 6. № 1. P. 1–13.
Oka M., Moriyama T., Asally M. et al. Differential role for transcription factor Oct4 nucleocytoplasmic dynamics in somatic cell reprogramming and self-renewal of embryonic stem cells // J. Biol. Chem. 2013. V. 288. № 21. P. 15085–15097.
Okita K., Ichisaka T., Yamanaka S. Generation of germline-competent induced pluripotent stem cells // Nature. 2007. V. 448. № 7151. P. 313–317.
Okita Y., Nakayama K.I. UPS delivers pluripotency // Cell Stem. Cell. 2012. V. 11. № 6. P. 728–730.
Ortega J., Heymann J.B., Kajava A.V. et al. The axial channel of the 20S proteasome opens upon binding of the PA200 activator // J. Mol. Biol. 2005. V. 346. № 5. P. 1221–1227.
Osafune K., Caron L., Borowiak M. et al. Marked differences in differentiation propensity among human embryonic stem cell lines // Nature Biotechnology. 2008. V. 26. № 3. P. 313–315.
Ouyang J., Yu W., Liu J. et al. Cyclin-dependent kinase-mediated Sox2 phosphorylation enhances the ability of Sox2 to establish the pluripotent state // The J. Biol. Chem. 2015. V. 290. № 37. P. 22782–22794.
Pan J., Deng Q., Jiang C. et al. USP37 directly deubiquitinates and stabilizes c-Myc in lung cancer // Oncogene. 2015. V. 34. № 30. P. 3957–3967.
Panday A., Sahoo M.K., Osorio D. et al. NADPH oxidases: an overview from structure to innate immunity-associated pathologies // Cellular & Mol. Immunology. 2015. V. 12. № 1. P. 5–23.
Pecori F., Kondo N., Ogura C. et al. Site-specific O-GlcNAcylation of Psme3 maintains mouse stem cell pluripotency by impairing P-body homeostasis // Cell Reports. 2021. V. 36. № 2. P. 109361.
Pickering A.M.,Davies K.J. Differential roles of proteasome and immunoproteasome regulators Pa28alphabeta, Pa28gamma and Pa200 in the degradation of oxidized proteins // Archives of Biochemistry and Biophysics. 2012. V. 523. № 2. P. 181–190.
Popov N., Wanzel M., Madiredjo M. et al. The ubiquitin-specific protease USP28 is required for MYC stability // Nature cell biology. 2007. V. 9. № 7. P. 765–774.
Potu H., Kandarpa M., Peterson L.F. et al. Downregulation of SOX2 by inhibition of Usp9X induces apoptosis in melanoma // Oncotarget. 2021. V. 12. № 3. P. 160.
Powers E.T., Morimoto R.I., Dillin A. et al. Biological and chemical approaches to diseases of proteostasis deficiency // Annual Review of Biochemistry. 2009. V. 78. P. 959–991.
Qian M.X., Pang Y., Liu C.H. et al. Acetylation-mediated proteasomal degradation of core histones during DNA repair and spermatogenesis // Cell. 2013. V. 153. № 5. P. 1012–1024.
Qiu G.-Z., Sun W., Jin M.-Z. et al. The bad seed gardener: Deubiquitinases in the cancer stem-cell signaling network and therapeutic resistance // Pharmacology & Therapeutics. 2017. V. 172. P. 127–138.
Ramakrishna S., Kim K.-S.,Baek K.-H. Posttranslational modifications of defined embryonic reprogramming transcription factors // Cellular Reprogramming. 2014. V. 16. № 2. P. 108–120.
Ramalho-Santos M., Yoon S., Matsuzaki Y. et al. “Stemness”: transcriptional profiling of embryonic and adult stem cells // Science. 2002. V. 298. № 5593. P. 597–600.
Rhie B.-H., Antao A.M., Karapurkar J.K. et al. Ubiquitin-specific protease 3 deubiquitinates and stabilizes Oct4 protein in human embryonic stem cells // Intern. J. Mol. Sci. 2021. V. 22. № 11. P. 5584.
Rouhani F.J., Nik-Zainal S., Wuster A. et al. Mutational history of a human cell lineage from somatic to induced pluripotent stem cells // PLoS Genetics. 2016. V. 12. № 4. P. e1005932.
Saeki Y., Kudo T., Sone T. et al. Lysine 63-linked polyubiquitin chain may serve as a targeting signal for the 26S proteasome // The EMBO Journal. 2009. V. 28. № 4. P. 359–371.
Salghetti S.E., Kim S.Y., Tansey W.P. Destruction of Myc by ubiquitin-mediated proteolysis: cancer-associated and transforming mutations stabilize Myc // The EMBO J. 1999. V. 18. № 3. P. 717–726.
Sato N., Sanjuan I.M., Heke M. et al. Molecular signature of human embryonic stem cells and its comparison with the mouse // Developmental Biology. 2003. V. 260. № 2. P. 404–413.
Schmidt R., Plath K. The roles of the reprogramming factors Oct4, Sox2 and Klf4 in resetting the somatic cell epigenome during induced pluripotent stem cell generation // Genome Biology. 2012. V. 13. № 10. P. 251.
Scholer H.R., Balling R., Hatzopoulos A.K. et al. Octamer binding proteins confer transcriptional activity in early mouse embryogenesis // The EMBO J. 1989. V. 8. № 9. P. 2551–2557.
Seifert U., Bialy L.P., Ebstein F. et al. Immunoproteasomes preserve protein homeostasis upon interferon-induced oxidative stress // Cell. 2010. V. 142. № 4. P. 613–624.
Selenina A.V., Tsimokha A.S., Tomilin A.N. Proteasomes in protein homeostasis of pluripotent stem cells // Acta naturae. 2017. V. 9. № 3. P. 39–47.
Shiiba I., Takeda K., Nagashima S. et al. Overview of mitochondrial E3 ubiquitin ligase MITOL/MARCH5 from molecular mechanisms to diseases // Intern. J. Mol. Sci. 2020. V. 21. № 11. P. 3781.
Shin J., Bossenz M., Chung Y. et al. Maternal Rnf12/RLIM is required for imprinted X-chromosome inactivation in mice // Nature. 2010. V. 467. № 7318. P. 977–981.
Sinenko S.A., Starkova T.Y., Kuzmin A.A. et al. Physiological signaling functions of reactive oxygen species in stem cells: From flies to man // Frontiers in Cell and Developmental Biology. 2021. V. 9.
Stoddard-Bennett T., Reijo Pera R. Treatment of Parkinson’s disease through personalized medicine and induced pluripotent stem cells // Cells. 2019. V. 8. № 1. P. 26.
Stohwasser R. Proteasome activator 28γ: Impact on survival signaling and apoptosis // Current Understanding of Apoptosis: Programmed Cell Death. 2018. P. 71.
Strebinger D., Deluz C., Friman E.T. et al. Endogenous fluctuations of OCT 4 and SOX 2 bias pluripotent cell fate decisions // Mol. Syst. Biol. 2019. V. 15. № 9. P. e9002.
Stricker S.H., Feber A., Engström P.G. et al. Widespread resetting of DNA methylation in glioblastoma-initiating cells suppresses malignant cellular behavior in a lineage-dependent manner // Genes & Development. 2013. V. 27. № 6. P. 654–669.
Sumi T., Tsuneyoshi N., Nakatsuji N. et al. Apoptosis and differentiation of human embryonic stem cells induced by sustained activation of c-Myc // Oncogene. 2007. V. 26. № 38. P. 5564–5576.
Sun X.X., He X., Yin L. et al. The nucleolar ubiquitin-specific protease USP36 deubiquitinates and stabilizes c-Myc // Proceedings of the National Academy of Sciences of the United States of America. 2015. V. 112. № 12. P. 3734–3739.
Suresh B., Lee J., Kim K.S. et al. The importance of ubiquitination and deubiquitination in cellular reprogramming // Stem Cells Intern. 2016. V. 2016. P. 6705927.
Sussman R.T., Stanek T.J., Esteso P. et al. The epigenetic modifier ubiquitin-specific protease 22 (USP22) regulates embryonic stem cell differentiation via transcriptional repression of sex-determining region Y-box 2 (SOX2) // The J. Biol. Chem. 2013. V. 288. № 33. P. 24234–24246.
Swijnenburg R.-J., Schrepfer S., Govaert J.A. et al. Immunosuppressive therapy mitigates immunological rejection of human embryonic stem cell xenografts // Proceedings of the National Academy of Sciences. 2008. V. 105. № 35. P. 12991–12996.
Szutorisz H., Georgiou A., Tora L. et al. The proteasome restricts permissive transcription at tissue-specific gene loci in embryonic stem cells // Cell. 2006. V. 127. № 7. P. 1375–1388.
Takahashi K., Tanabe K., Ohnuki M. et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors // Cell. 2007. V. 131. № 5. P. 861–872.
Takahashi K., Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors // Cell. 2006. V. 126. № 4. P. 663–676.
Takahashi K., Yamanaka S. A decade of transcription factor-mediated reprogramming to pluripotency // Nature Rev. Mol. Cell Biol. 2016. V. 17. № 3. P. 183–193.
Tanaka K. The proteasome: overview of structure and functions // Proceedings of the Japan Academy Series B, Physical and Biol. Sci. 2009. V. 85. № 1. P. 12–36.
Tanaka K. The proteasome: from basic mechanisms to emerging roles // The Keio J. Medicine. 2013. V. 62. № 1. P. 1–12.
Thomson J.A., Itskovitz-Eldor J., Shapiro S.S. et al. Embryonic stem cell lines derived from human blastocysts // Science. 1998. V. 282. № 5391. P. 1145–1147.
Tolkunova E., Malashicheva A., Parfenov V.N. et al. PIAS proteins as repressors of Oct4 function // J. Mol. Biol. 2007. V. 374. № 5. P. 1200–1212.
Ustrell V., Hoffman L., Pratt G. et al. PA200, a nuclear proteasome activator involved in DNA repair // The EMBO J. 2002. V. 21. № 13. P. 3516–3525.
van der Stoop P., Boutsma E.A., Hulsman D. et al. Ubiquitin E3 ligase Ring1b/Rnf2 of polycomb repressive complex 1 contributes to stable maintenance of mouse embryonic stem cells // PLoS One. 2008. V. 3. № 5. P. e2235.
van Pel D.M., Harada K., Song D. et al. Modelling glioma invasion using 3D bioprinting and scaffold-free 3D culture // J. Cell Communication and Signaling. 2018. V. 12. № 4. P. 723–730.
Vilchez D., Boyer L., Morantte I. et al. Increased proteasome activity in human embryonic stem cells is regulated by PSMD11 // Nature. 2012. V. 489. № 7415. P. 304–308.
Vilchez D., Simic M.S., Dillin A. Proteostasis and aging of stem cells // Trends in Cell Biology. 2014. V. 24. № 3. P. 161–170.
von der Lehr N., Johansson S., Wu S. et al. The F-box protein Skp2 participates in c-Myc proteosomal degradation and acts as a cofactor for c-Myc-regulated transcription // Molecular Cell. 2003. V. 11. № 5. P. 1189–1200.
Wang J., Zhang Y., Hou J. et al. Ube2s regulates Sox2 stability and mouse ES cell maintenance // Cell Death & Differentiation. 2016. V. 23. № 3. P. 393–404.
Wang X., Chemmama I.E., Yu C. et al. The proteasome-interacting Ecm29 protein disassembles the 26S proteasome in response to oxidative stress // J. Biol. Chem. 2017. V. 292. № 39. P. 16310–16320.
Wang Z., Kang L., Zhang H. et al. AKT drives SOX2 overexpression and cancer cell stemness in esophageal cancer by protecting SOX2 from UBR5-mediated degradation // Oncogene. 2019. V. 38. № 26. P. 5250–5264.
Welcker M., Orian A., Jin J. et al. The Fbw7 tumor suppressor regulates glycogen synthase kinase 3 phosphorylation-dependent c-Myc protein degradation // Proceedings of the National Academy of Sciences of the United States of America. 2004. V. 101. № 24. P. 9085–9090.
Wilmut I., Schnieke A.E., McWhir J. et al. Viable offspring derived from fetal and adult mammalian cells // Nature. 1997. V. 385. № 6619. P. 810–813.
Wuebben E.L., Rizzino A. The dark side of SOX2: cancer-a comprehensive overview // Oncotarget. 2017. V. 8. № 27. P. 44917.
Xu H., Wang W., Li C. et al. WWP2 promotes degradation of transcription factor OCT4 in human embryonic stem cells // Cell Research. 2009a. V. 19. № 5. P. 561–573.
Xu H.M., Liao B., Zhang Q.J. et al. Wwp2, an E3 ubiquitin ligase that targets transcription factor Oct-4 for ubiquitination // The J. Biol. Chem. 2004. V. 279. № 22. P. 23495–23503.
Xu P., Duong D.M., Seyfried N.T. et al. Quantitative proteomics reveals the function of unconventional ubiquitin chains in proteasomal degradation // Cell. 2009b. V. 137. № 1. P. 133–145.
Yamanaka S. Pluripotent stem cell-based cell therapy–promise and challenges // Cell Stem. Cell. 2020. V. 27. № 4. P. 523–531.
Yang B.-J., Han X.-X., Yin L.-L. et al. Arabidopsis PROTEASOME REGULATOR1 is required for auxin-mediated suppression of proteasome activity and regulates auxin signalling // Nature Communications. 2016. V. 7. № 1. P. 1–9.
Ying Q.-L., Nichols J., Evans E.P. et al. Changing potency by spontaneous fusion // Nature. 2002. V. 416. № 6880. P. 545–548.
Yu J., Vodyanik M.A., Smuga-Otto K. et al. Induced pluripotent stem cell lines derived from human somatic cells // Science. 2007. V. 318. № 5858. P. 1917–1920.
Yuan J., Minter-Dykhouse K., Lou Z. A c-Myc–SIRT1 feedback loop regulates cell growth and transformation // J. Cell Biol 2009. V. 185. № 2. P. 203–211.
Zhang C., Hoang N., Leng F. et al. LSD1 demethylase and the methyl-binding protein PHF20L1 prevent SET7 methyltransferase-dependent proteolysis of the stem-cell protein SOX2 // J. Biol. Chem. 2018. V. 293. № 10. P. 3663–3674.
Zhang C., Leng F., Saxena L. et al. Proteolysis of methylated SOX2 protein is regulated by L3MBTL3 and CRL4DCAF5 ubiquitin ligase // J. Biol. Chem. 2019. V. 294. № 2. P. 476–489.
Zhang L., Huang H., Zhou F. et al. RNF12 controls embryonic stem cell fate and morphogenesis in zebrafish embryos by targeting Smad7 for degradation // Mol. Cell. 2012. V. 46. № 5. P. 650–661.
Zhong L., Belote J.M. The testis-specific proteasome subunit Prosalpha6T of D. melanogaster is required for individualization and nuclear maturation during spermatogenesis // Development. 2007. V. 134. № 19. P. 3517–3525.
Zhou G., Meng S., Li Y. et al. Optimal ROS signaling is critical for nuclear reprogramming // Cell Reports. 2016. V. 15. № 5. P. 919–925.
Zhou H., Liu Y., Zhu R. et al. FBXO32 suppresses breast cancer tumorigenesis through targeting KLF4 to proteasomal degradation // Oncogene. 2017. V. 36. № 23. P. 3312–3321.
Дополнительные материалы отсутствуют.
Инструменты
Онтогенез