Онтогенез, 2023, T. 54, № 2, стр. 148-161
Хемокин CCL2 активирует факторы гипоксического ответа, регулирует плюрипотентность и направленную эндотелиальную дифференцировку плюрипотентных стволовых клеток человека
А. И. Шевченко a, А. М. Арссан a, С. М. Закиян a, И. С. Захарова a, *
a Федеральное государственное бюджетное научное учреждение
“Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения
Российской академии наук”
630090 Новосибирск, просп. акад. Лаврентьева, 10, Россия
* E-mail: zakharova@bionet.nsc.ru
Поступила в редакцию 22.10.2022
После доработки 01.02.2023
Принята к публикации 15.02.2023
- EDN: XFKLPE
- DOI: 10.31857/S0475145023020052
Аннотация
Современные исследования плюрипотентных стволовых клеток (ПСК) человека ставят своей задачей подбор условий и факторов роста, которые позволят лучше имитировать преимплантационное развитие и дифференцировку зародышевых клеток, что имеет важное значение для создания клеточных моделей заболеваний. Ранее было показано, что в присутствии хемокина CCL2 ПСК человека приобретают свойства, присущие преимплантационным бластомерам, а именно активируют сигнальный путь JAK-STAT3 и повышают уровень мРНК генов гипоксического ответа. Однако CCL2 практически не используется при культивировании ПСК человека, а его действие описано в единственном исследовании. Мы продолжили изучение влияния CCL2 на ПСК человека и показали, что эмбриональные и индуцированные плюрипотентные стволовые клетки человека, культивированные с CCL2, имеют повышенный уровень белка кислородзависимых субъединиц HIF1A и HIF2A, необходимых для запуска гипоксического ответа, а также повышенный уровень белков ключевых транскрипционных факторов плюрипотентности OCT4, NANOG, KLF4, SOX2 и TFCP2L1. Кроме того, присутствие CCL2 положительно влияет на направленную эндотелиальную дифференцировку, ускоряя созревание предшественников и усиливая ангиогенный потенциал дифференцированных производных.
ВВЕДЕНИЕ
Актуальным направлением исследований культивируемых плюрипотентных стволовых клеток (ПСК) человека, к которым относят эмбриональные стволовые клетки (ЭСК) и индуцированные плюрипотентные стволовые клетки (ИПСК), остается совершенствование условий их получения, поддержания и дифференцировки. Обычные линии ПСК человека, получаемые и поддерживаемые за счет фактора bFGF, отражают более позднюю стадию эмбрионального развития, характерную клеткам постимплантационного эпибласта (Collier, Rugg-Gunn, 2018), что подтверждено данными транскриптомного анализа (Nakamura et al., 2016). Плюрипотентное состояние этих клеток определяется как “праймированное”. Смысл оптимизации условий культивирования ПСК человека – получение культур плюрипотентных клеток, соответствующих более ранним стадиям эмбрионального развития, а именно эпибласту преимплантационной бластоцисты. К преимуществам таких ПСК, названных “наивными”, относят их повышенную жизнеспособность и клоногенность, низкий уровень спонтанной дифференцировки при культивировании, способность более полно воспроизводить процессы раннего развития, а также неограниченный потенциал для получения дифференцированных производных, включая возможность формировать функциональные гаметы (Collier, Rugg-Gunn, 2018).
Для получения ПСК человека в “наивном” состоянии, в том числе из праймированых клеточных линий, предложен ряд протоколов (Hanna et al., 2010; Chan et al., 2013; Gafni et al., 2013; Takashima et al., 2014; Theunissen et al., 2014; Ware et al., 2014; Guo et al., 2017). Однако трудно сказать, какие из существующих подходов позволяют получать ПСК человека, максимально приближенные к “наивному” состоянию, из-за недостаточной изученности этого вопроса и отсутствия общепринятых критериев “наивной” плюрипотентности. Попытки совершенствования подходов к получению “наивных” ПСК человека продолжаются и направлены, главным образом, на усиление сигнального каскада JAK-STAT3, активируемого фактором LIF, и ослабление сигнальных путей, запускаемых фактором bFGF (An et al., 2020; Bi et al., 2020). Кроме того, считается, что становлению и поддержанию “наивного” состояния плюрипотентности могут способствовать пониженная концентрация кислорода (3–5%), в условиях которой в норме проходит раннее развитие и запускается сигнальный каскад транскрипционного фактора HIF, индуцируемого гипоксией (Dunwoodie, 2009; Sperber et al., 2015). Так, показано, что культивирование ПСК при 5% O2 способствует поддержанию плюрипотентности, препятствует спонтанной дифференцировке, уменьшает хромосомные аберрации, стабилизирует эпигенетическое состояние (Ezashi et al., 2005; Forsyth et al., 2006; Forristal et al., 2009; Lengner et al., 2010).
Данная работа посвящена исследованию влияния цитокина CCL2 на свойства плюрипотентных клеток человека и возможности его использования в протоколах направленной дифференцировки в эндотелиальные клетки. Ранее было продемонстрировано, что CCL2 в плюрипотентных клетках мыши, крысы и человека активирует сигнальный каскад JAK-STAT3 и может использоваться при культивировании ПСК вместо фактора LIF (Hasegawa et al., 2011, 2014). Данные транскриптомного анализа показывают, что культивирование ПСК человека с CCL2 усиливает экспрессию генов, связанных с плюрипотентным состоянием, и активирует гены, связанные с гипоксией, говоря о том, что CCL2 может индуцировать ответ, подобный тому, что возникает в клетках при пониженной концентрации кислорода (Hasegawa et al., 2014). Эти данные позволяют предположить, что хемокин CCL2 может быть перспективным фактором для получения и поддержания ПСК человека с более высоким статусом плюрипотентности. Однако исследование 2014 г., выявившее положительное влияние фактора CCL2 на плюрипотентное состояние четырех независимых линий ИПСК человека, было и остается единственным. В этой работе мы продолжили исследования эффектов фактора CCL2 на свойства плюрипотентных клеток и выяснили, как его применение при культивировании ЭСК и ИПСК человека влияет на экспрессию кислородзависимых субъединиц транскрипционного фактора HIF и генов плюрипотентности на уровне белка. Поскольку известно, что кислродзависимые субъединицы транскрипционного фактора HIF участвуют в регуляции ангиогенеза и свойств клеток сосудов (Skuli et al., 2009; Schödel et al., 2011), в данном исследовании мы уделили внимание вопросам о том, как добавление к среде CCL2 повлияет на направленную дифференцировку ПСК человека в эндотелиальные клетки, а также на свойства полученных эндотелиоцитов.
МАТЕРИАЛЫ И МЕТОДЫ
Культивирование клеток
В работе использовали линию эмбриональных стволовых клеток человека HuES9, (номер hPSCreg: HVRDe009-A) (Cowan et al., 2004) и линию индуцированных плюрипотентных стволовых клеток человека K7-4 (номер hPSCreg: ICGi022-A) (Malakhova et al., 2020). ПСК культивировали на слое митотически инактивированных эмбриональных фибробластов мыши в среде KnockOut DMEM (Thermo Fisher Scientific), содержащей 15% заменителя сыворотки KnockOut SR (Thermo Fisher Scientific), 1% раствора заменимых аминокислот NEAA, 0.25 мМ 2-меркаптоэтанола, 1 мМ глютамина GlutaMax (все – Thermo Fisher Scientific), 200 мкг/мл примоцина (InvivoGen) и 10 нг/мл bFGF (Sci-store). К среде добавляли CCL2 (Biolegend) в концентрации 10 нг/мл. Для пересадки колонии плюрипотентных клеток ферментативно диссоциировали с помощью TrypLE (Thermo Fisher Scientific) и рассаживали в соотношении 1 : 10 с добавлением 10 мМ ингибитора киназы Rho Y-27632 (Tocris Bioscience). Клетки культивировали при 37°C в атмосфере 5% CO2. Спонтанную дифференцировку ПСК проводили методом формирования эмбриоидных телец по ранее описанному протоколу (Zakharova et al., 2022).
Направленная дифференцировка ПСК в эндотелиальные клетки, магнитный сортинг и культивирование эндотелия
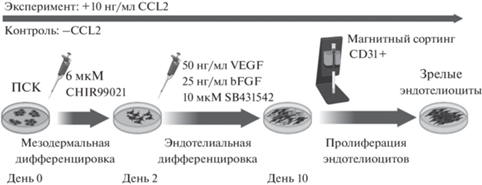
Направленную дифференцировку ПСК в эндотелиоциты проводили по ранее опубликованному протоколу с модификациями (Gu, 2018). Для этого ПСК пересаживали на поверхность, обработанную матригелем (Corning), так, чтобы через сутки конфлюентность клеток составляла 60–70%. На следующий день среду для ПСК заменяли средой для дифференцировки в мезодермальном направлении, содержащей среду RPMI 1640, добавку B27 без инсулина, 6 мкM CHIR99021 (все – Thermo Fisher Scientific), 200 мкг/мл примоцина (InvivoGen), и оставляли клетки на двое суток при 37°C в атмосфере 5% CO2. На третий день дифференцирующиеся клетки переводили на среду EGM-2 (Lonza) для роста эндотелия с добавлением 50 нг/мл VEGF, 25 нг/мл bFGF (все – Sci-store), 10 мкM SB431542 (Stem cell technologies). В дальнейшем на протяжении еще 10 дней культурам ежедневно проводили смену половины эндотелиальной среды. При использовании в протоколе дифференцировки хемокина CCL2 (Biolegend), его концентрация в средах составляла 10 нг/мл. Обогащение суммарной культуры после дифференцировки эндотелиальными клетками проводили методом магнитного сортинга с импользованием антител к СD31 (Miltenyi Biotec), высевали на культуральную поверхность, покрытую человеческим коллагеном 4 типа (Sigma-Aldrich) в среде EGM2 (Lonza) и помещали в инкубатор при 5% CO2 и 37°C.
Выделение РНК, синтез кДНК и ПЦР в режиме реального времени
РНК выделяли из клеток с помощью реактива TRIzol (Thermo Fisher Scientific) по инструкции производителя. Концентрацию РНК в препарате измеряли с помощью спектрофотометра NanoDrop. Синтез кДНК проводили с использованием набора SuperScript III First-Strand Synthesis System (Thermo Fisher Scientific), на одну реакцию обратной транскрипции использовали 1 мкг тотальной РНК. В качестве отрицательного контроля использовали реакционную смесь без ревертазы.
Реакции ПЦР в режиме реального времени проводили с ПЦР-смесью БиоМастер HS-qPCR SYBR Blue (Биолабмикс) по инструкции производителя на приборе LightCycler480 (Roche), программа 480 SW1.5.1. Каждый образец анализировали в трех биологических и трех технических повторностях. Последовательности праймеров приведены в табл. 1. В качестве референсных генов были выбраны ACTB, B2M и TFRC. Полуколичественный анализ результатов проводили, используя обобщенный метод ΔΔCt c учетом эффективности реакции, рассчитанной по результатам построения калибровочной кривой по пяти точкам (разведения матрицы с шагом в пять раз) (Hellemans et al., 2008).
Таблица 1.
Последовательности праймеров в реакциях полуколичественного ПЦР в режиме реального времени
| Ген | Последовательность олигонуклеотидов, 5' – 3' | Длина ампликона, п.н. |
|---|---|---|
| ACTB | AGGCACCAGGGCGTGAT GATAGCACAGCCTGGATAGCA |
308 |
| B2M | CACCCCCACTGAAAAAGATG ATATTAAAAAGCAAGCAAGCAGAA |
167 |
| TFRC | GTCGCTGGTCAGTTCGTGATT AGCAGTTGGCTGTTGTACCTCTC |
80 |
| HIF-1a | TGCAACATGGAAGGTATTGC TTCACAAATCAGCACCAAGC |
118 |
| HIF-2a | TGCTACGCCACCAGTACCA CAGTTCGGGCAGCAGGTAGG |
|
| GLUT1 | GATTGGCTCCTTCTCTGTGG TCAAAGGACTTGCCCAGTTT |
129 |
| GLUT3 | CAATGCTCCTGAGAAGATCATAA AAAGCGGTTGACGAAGAGT |
172 |
| BRACHYURY | ACCTTCCATGTGAAGCAGCAA CTCCACAGTTGGGTTCATCTGTAA |
258 |
Белковый иммуноблот
Белковый экстракт готовили из 105 клеток в буфере RIPA (Sigma-Aldrich). 8 мкг белкового экстракта для каждого образца разделяли с помощью 10% SDS-PAGE с использованием системы BIORAD Mini-Protein Electrophoresis Tetra System (Bio-Rad). Белки переносили на PVDF мембрану (Bio-Rad) с использованием системы влажного переноса Mini Trans-Blot (Bio-Rad). Мембрану делили на две части, руководствуясь предокрашеным белковым маркером молекулярного веса. Одну часть мембраны использовали для преципитации с исследуемым белком, другую – с референсным белком ACTB или SMC1. Для детекции использовали конъюгированные с пероксидазой хрена вторичные антитела к IgG кролика или мыши. Список первичных и вторичных антител и их разведения приведены в табл. 2. Детекцию хемилюминесцентного сигнала осуществляли набором Bio-Rad Clarity Max Western ECL Substrate (из расчета 30 мкл рабочего раствора на 1 см2 мембраны) на приборе Bio-Rad ChemiDoc MP. Денситометрический анализ для измерения различий в уровнях белков был выполнен с использованием программы ImageJ (https://ij.imjoy.io/). По результатам измерений получали отношение интенсивностей сигналов исследуемого белка к референсному. Статистические сравнения проводили с помощью однофакторного дисперсионного анализа.
Таблица 2.
Антитела, используемые при иммуноблоттинге и иммунофлуоресцентном окрашивании
| Антигены | Производитель | Каталожный номер |
Изотип | Разведение |
|---|---|---|---|---|
| OCT4 | Santa-Cruz | SC-5279 | Поликлональные IgG кролика | 1/1000 |
| NANOG | Reprocell | RCAB004P-F | Поликлональные IgG кролика | 1/500 |
| KLF4 | Abcam | Ab104846 | Моноклональные IgG1 мыши | 1/1000 |
| SOX2 | Cell Signaling | 3579S | Поликлональные IgG кролика | 1/1000 |
| TFCP2L1 | MERK | HPA029708 | Поликлональные IgG кролика | 1/1000 |
| STAT3 | Cell Signaling | 9131 | Поликлональные IgG кролика | 1/1000 |
| HIF-1a | Sigma Aldrich | SAB2703132 | Моноклональные IgG1 кролика | 1/2500 |
| HIF-2a | Sigma Aldrich | SAB2701992 | Моноклональные IgG1 кролика | 1/2500 |
| SMC1 | Bethyl | A300-055A | Поликлональные IgG кролика | 1/5000 |
| ACTB | Abcam | ab228001 | Поликлональные IgG кролика | 1/5000 |
| IgG мыши + + пероксидаза |
Jackson ImmunoResearch |
715-035-150 | Поликлональные IgG осла | 1/5000 |
| IgG кролика + + пероксидаза |
Jackson ImmunoResearch |
711-035-152 | Поликлональные IgG осла | 1/5000 |
| CD 31 | DAKO | 14028292 | Моноклональные IgG1 мыши | 1/200 |
| Фактор фон Виллебранда |
Life Technologies | A21134 | Поликлональные IgG кролика | 1/200 |
| GFAP | DAKO | Z0334 | Поликлональные IgG кролика | 1/1000 |
| CD90 | eBioscience | 14-0909-82 | Моноклональные IgG1 мыши | 1/100 |
| FOXA2 | Santa Cruz Biotechnology | sc-374376 | Моноклональные IgG1 мыши | 1/100 |
| TUBB3 | BioLegend | 801201 | Моноклональные IgG2a мыши | 1/500 |
| aSMA | DAKO | M0851 | Моноклональные IgG2a мыши | 1/100 |
| AFP | MAB1368 | R&D | Моноклональные IgG1 мыши | 1/200 |
| IgM мыши + + Alexa 568 |
Invitrogen | A21043 | Поликлональные IgG козы | 1/400 |
| IgG кролика + + Alexa 488 |
Invitrogen | A110088 | Поликлональные IgG козы | 1/400 |
Проточная цитометрия и иммунофлуоресцентное окрашивание клеток
Для характеристики клеточных культур с помощью проточной цитометрии проводили их дезагрегацию до одноклеточного состояния. Нефиксированные клетки окрашивали йодидом пропидия и анексином V, конъюгированным с FITC (набор компании BioLegend) для определения жизнеспособности, а также флуоресцентно меченными антителами, характеризующими разные стадии дифференцировки ПСК в эндотелиоциты: CD31-APC (17-0319-42, eBioscience), VEGFR2-PE (560494, BD Biosciences) и VE-Cadherin (17-0909-42, eBioscience), как описано ранее (Vaskova et al., 2015; Zakharova et al., 2017). В качестве негативного контроля использовали неокрашенные клетки и клетки, инкубированные с флуоресцентно меченными иммуноглобулинами мыши, соответствующими изотипу применяемых моноклональных антител. Анализ клеток (104 событий) проводили на приборе FACSAria III (Becton Dickinson).
При иммунофлуоресцентном окрашивании клетки, выращиваемые в культуральных планшетах, фиксировали 4% формальдегидом. Процедура иммуноокрашивания описана ранее (Vaskova et al., 2015; Zakharova et al., 2017, 2022). Использованные антитела, их производители, видовое происхождение и разведения перечислены в табл. 2. Препараты анализировали с помощью инвертированного флуоресцентного микроскопа Nikon Ti-E и программы Nikon AR.
Функциональная характеристика эндотелиальных клеток
Флуоресцентно меченную ацетилированную форму липопротеина низкой плотности (Thermo Fisher Scientific) добавляли к эндотелиальной среде EGM-2 (Lonza) без сыворотки в концентрации 15 мкг/мл и инкубировали клетки в течение 24 ч. Способность эндотелиоцитов поглощать acLDL анализировали с помощью инвертированного флуоресцентного микроскопа Nikon Ti-E.
При тестировании ангиогенного потенциала суспензию эндотелиальных клеток в количестве 2 × 105 в среде EGM-2 (Lonza) наносили на слой из 200 мкл матригеля (Corning), предварительно разведенного 1 : 1 со средой EGM-2 и полимеризованного в течение 15 мин при 37°С в лунке площадью 1 см2. Равномерно распределяли суспензию клеток по поверхности и помещали в инкубатор при 37°С. Детекцию капиляроподобных структур проводили через 4 ч. Оценка характеристик капилляроподобных структур, образованных эндотелиальными клетками, проводилась с помощью программы AngioTool (Zudaire et al., 2011).
РЕЗУЛЬТАТЫ
Влияние хемокина CCL2 на свойства ПСК
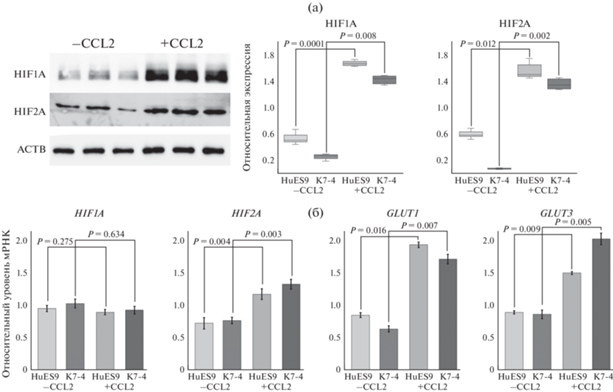
Ранее в единственном исследовании влияния фактора CCL2 на свойства плюрипотентных клеток человека было показано, что добавление ССL2 к ИПСК человека приводит к повышению уровня мРНК ряда генов, характерных для условий гипоксии (кислородного голодания) (Hasegawa et al., 2014). Мы продолжили это исследование и выяснили, как добавление CCL2 к ЭСК (линия HuES9) и ИПСК (линия K7-4) человека влияет на уровень кислородзависимых белков HIF1A и HIF2A, входящих в состав мультисубъединичного транскрипционного фактора, индуцируемого гипоксией (HIF). Известно, что HIF1A и HIF2A деградируют в клетках при атмосферной концентрации кислорода, но при концентрации кислорода менее 10% их деградация прекращается, формируется стабильный фактор HIF, способный связываться с сайтами в промоторах генов-мишеней, запуская гипоксический ответ (Hashimoto, Shibasaki, 2015). Мы обнаружили, что как в ЭСК, так и в ИПСК человека, обработанных CCL2 и находящихся при атмосферной концентрации кислорода (~21%), происходит значимое повышение уровней белков кислородзависимых субъединиц HIF1A и HIF2A (рис. 1a). Следует отметить, что при этом достоверное повышение уровня мРНК с помощью полуколичественного ПЦР в режиме реального времени детектируется только для гена HIF2A (рис. 1б). Кроме того, мы установили, что в клетках с повышенным уровнем белков HIF1A и HIF2A происходит повышение уровня мРНК транспортеров глюкозы GLUT1 и GLUT3 (рис. 1б), являющихся мишенью транскрипционного фактора HIF. Это свидетельствует об активации гипоксического ответа в плюрипотентных клетках, в частности, об усилении гликолитического метаболизма в ПСК в присутствии CCL2.
Рис. 1.
Добавление CCL2 к культуре плюрипотентных стволовых клеток человека вызывает гипоксический ответ при атмосферной концентрации кислорода. (а) Повышение уровней белков кислородзависимых субъединиц HIF1A и HIF2A при культивировании с хемокином CCL2 ЭСК линии HuES9 и ИПСК линии K7-4. Примеры иммуноблоттинга белковых лизатов линии HuES9. На диаграммах размаха представлены относительные уровни белков HIF1A и HIF2A, нормированные на ACTB и SMC1, на основании данных денситометрии по результатам белкового иммуноблота с лизатами эмбриональных стволовых клеток HuES9 и индуцированных плюрипотентных стволовых клеток K7-4, культивируемых с CCL2 (+CCL2) и без CCL2 (–СCL2). Примеры иммуноблоттинга белковых лизатов представлены для линии HuES9. (б) Сравнение относительного уровня экспрессии генов, связанных с гипоксией: HIF1A и HIF2A (a), GLUT1 и GLUT3 (б), в культурах ЭСК линии HuES9 и ИПСК линии K7-4, выращенных с добавлением (+CCL2) и без добавления (–СCL2) хемокина CCL2.
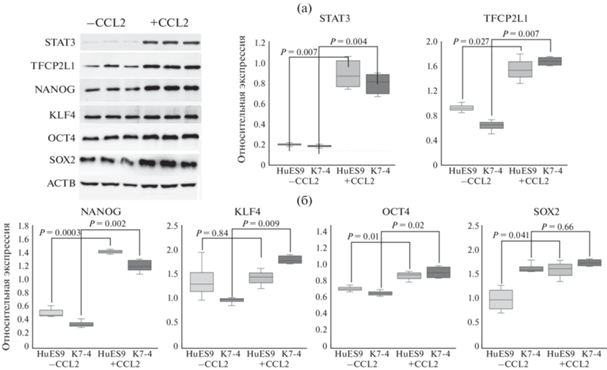
Мы выяснили, как добавление CCL2 влияет на уровень белков транскрипционных факторов, вовлеченных в поддержание плюрипотентности. С помощью полуколичественного иммуноблоттинга мы подтвердили, что в ПСК, обработанных ССL2, резко повышается уровень фосфорилированной (активной) формы транскрипционного фактора STAT3 (рис. 2), за трансактивацию которого отвечают киназы JAK1/2. Таким образом, мы еще раз продемонстрировали ранее установленный факт, что в присутствии CCL2 в плюрипотентных клетках активируется сигнальный каскад JAK-STAT3. Кроме того, полуколичественный иммуноблоттинг показал значимое повышение уровня белка для факторов OCT4, NANOG, TFCP2L1 в плюрипотентных клетках, обработанных CCL2, по сравнению с ПСК, культивируемыми только в присутствии bFGF (рис. 2). Повышение уровня белка KLF4 регистрировалось только в линии ИПСК, а SOX2 – только в линии ЭСК. Вероятно, эти различия в действии ССL2 могут быть связаны с исходным уровнем транскрипционных факторов в линиях плюрипотентных клеток. Если исходный уровень низкий – при добавлении CCL2 наблюдается статистически значимое повышение, если исходный уровень близок к максимально возможному, при культивировании с CCL2 включаются посттрансляционные механизмы, препятствующие резкому повышению уровня белка. Следует отметить, что прямыми мишенями транскрипционного фактора STAT3 являются гены NANOG, KLF4 и TFCP2L1. Известно, что повышенный уровень белка транскрипционных факторов TFCP2L1, KLF4 и NANOG является свойством наивных ПСК (Messmer et al., 2019; An et al., 2020; Bi et al., 2020). Таким образом, вероятно, присутствие в среде хемокина CCL2 способствует переходу культивируемых ПСК человека в более высокое плюрипотентное состояние.
Рис. 2.
Относительный уровень белков транскрипционных факторов плюрипотентности при культивировании плюрипотентных стволовых клеток человека с хемокином CCL2 (+CCL2) и без него (–СCL2). На диаграммах размаха представлены относительные уровни фосфорилированной формы транскрипционного фактора STAT3, а также факторов OCT4, TFCP2L1, KLF4, NANOG, SOX2, нормированные на ACTB и SMC1, на основании данных денситометрии по результатам белкового иммуноблота с лизатами эмбриональных стволовых клеток HuES9 и индуцированных плюрипотентных стволовых клеток K7-4. Примеры иммуноблоттинга белковых лизатов представлены для линии HuES9.
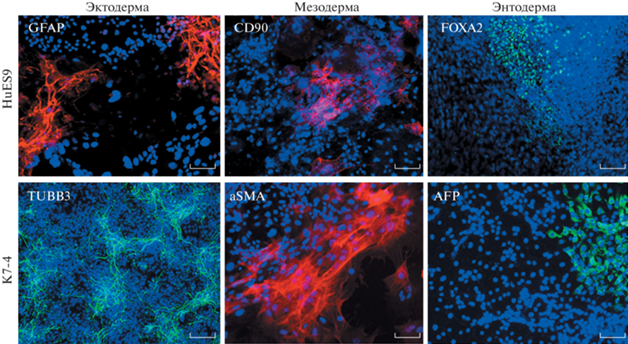
Мы подтвердили, что ПСК, культивируемые в присутствии CCL2, сохраняют способность давать производные трех зародышевых листков (экто-, мезо- и энтодермы) при спонтанной дифференцировке (рис. 3).
Рис. 3.
Производные трех первичных зародышевых листков (экто-, мезо- и энтодермы), детектируемые в производных ЭСК линии HuES9 и ИПСК линии K7-4 после спонтанной дифференцировки. Линейка – 100 мкм.
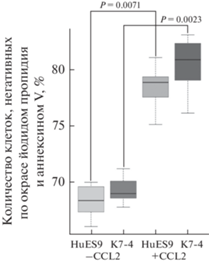
Ряд добавок, используемых при культивировании ПСК человека, могут понижать жизнеспособность и вызывать гибель части клеток в культуре (Theunissen et al., 2014; Guo et al., 2017). В связи с этим мы проанализировали жизнеспособность ПСК в присутствии CCL2 и без него с помощью маркеров некроза и апоптоза йодида пропидия и аннексина V методом проточной цитометрии (рис. 4). К удивлению, клетки в присутствии CCL2 не только не снижали, но воспроизводимо демонстрировали статистически более высокий уровень жизнеспособности, по сравнению с клетками, культивируемыми без CCL2.
Влияние хемокина CCL2 на направленную дифференцировку ПСК в эндотелиальные производные
В ряде работ показано, что гипоксия и повышение уровня кислородзависимых субъединиц HIF1A и HIF2A при атмосферной концентрации кислорода способствует эндотелиальной дифференцировке ПСК человека и повышает ангиогенный потенциал полученных эндотелиальных производных за счет регуляции генов-мишеней фактора HIF (Podkalicka et al., 2020). Этот эффект был установлен при исследовании направленной эндотелиальной дифференцировки более чем 50 линий ПСК. На основании этого мы предположили, что повышение белкового уровня субъединиц HIF-1a и HIF-2a, наблюдаемое в присутствии фактора CCL2, также может иметь позитивный эффект на направленную эндотелиальную дифференцировку ПСК и свойства дифференцированных производных. Для проверки этого предположения мы провели эксперимент по направленной дифференцировке, в котором линии ЭСК и ИПСК человека, культивируемые с ССL2, последовательно помещали в среды для мезодермальной и эндотелиальной дифференцировки, также содержащие CCL2 (рис. 5). Для контроля культивирование исходных линий ПСК и их последующую дифференцировку проводили в средах без CCL2.
После первого этапа дифференцировки ПСК в мезодермальном направлении мы с помощью метода полуколичественного ПЦР в режиме реального времени провели анализ экспрессии гена, который кодирует транскрипционный фактор BRACHYURY, являющийся ключевым для запуска развития мезодермы (рис. 6а). Результаты показывают, что относительный уровень мРНК данного гена достоверно не отличается между клетками линий HuES9 и K7-4, дифференцирующимися c CCL2 и без него. Таким образом, CCL2 не снижает эффективность мезодермальной дифференцировки.
Рис. 6.
Эффективность направленной мезодермальной и эндотелиальной дифференцировки плюрипотентных стволовых клеток линий HuES9 и K7-4, культивируемых без добавления (–CCL2) и с добавлением хемокина CCL2 (+CCL2). (а) Относительный уровень экспрессии мРНК гена BRACHYURY – раннего маркера мезодермальной дифференцировки. (б) Количественная оценка маркеров эндотелиальной дифференцировки методом проточной цитометрии.

На второй и восьмой день непосредственно эндотелиальной дифференцировки ПСК в среде EGM-2 мы оценили содержание эндотелиальных предшественников по наличию рецептора VEGFR2, а также долю клеток с маркерами VE-Cadherin и CD31, характерными для более поздних стадий эндотелиальной дифференцировки. На второй день дифференцированные производные, полученные с CCL2, имели на 20% больше клеток с маркером VE-Cadherin, который характерен более поздним стадиям эндотелиальной дифферренцировки (рис. 6б). Финальные результаты о доле клеток с маркерами VEGFR2, VE-Cadherin и CD31 на восьмой день не отличались между дифференцированными производными, полученными обычным способом, и с использованием CCL2 (рис. 6в). Таким образом, применение ССL2 не улучшает и не ухудшает эффективность протокола направленной эндотелиальной дифференцировки, однако, вероятно, способствует более быстрому переходу эндотелиальных предшественников к стадии более зрелых VE-Cadherin-позитивных эндотелиальных производных.
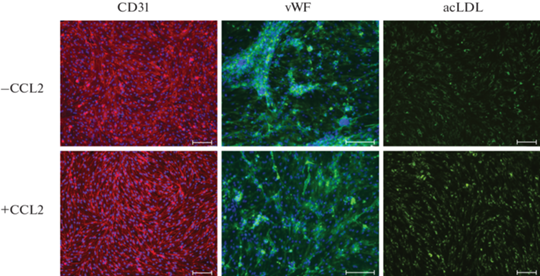
Эндотелиальные клетки, полученные в результате направленной дифференцировки двух линий ПСК человека в присутствии фактора CCL2, обладают характерными признаками: позитивны по маркеру зрелых эндотелиоцитов CD31, синтезируют фактор фон Виллебранда, поглощают ацетилированную форму липопротеина низкой плотности (рис. 7).
Рис. 7.
Эндотелиальные производные ПСК, полученные в результате дифференцировки линии HuES9 без добавления (–CCL2) и с добавлением хемокина CCL2 (+CCL2), демонстрируют свойства, характерные эндотелиоцитам: имеют поверхностный антиген CD31, синтезируют фактор фон Виллебранда (vWF), метаболизируют ацетилированную форму липопротеина низкой плотности (acLDL). Ядра окрашены DAPI. Линейка – 100 мкм.
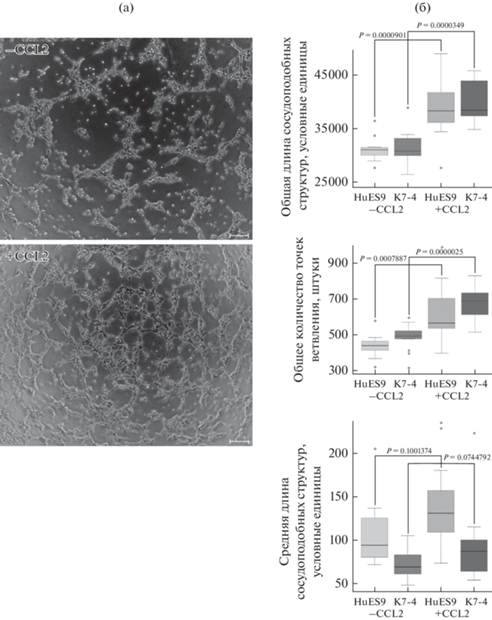
При исследовании ангиогенного потенциала по способности образовывать капилляроподобные структуры в матригеле мы обнаружили, что эндотелиальные производные, полученные с CCL2, имеют статистически достоверные преимущества по общей длине сети капилляроподобных структур, а также числу точек ветвления (рис. 8). Таким образом, эндотелиоциты, полученные и поддерживаемые с использованием CCL2, демонстрируют более высокий ангиогенный потенциал.
Рис. 8.
Ангиогенный потенциал in vitro дифференцированных эндотелиальных производных ПСК человека линий HuES9 и K7-4, полученных без добавления (–CCL2) и с добавлением хемокина CCL2 (+CCL2). (а) Репрезентативное изображение сети сосудоподобных структур эндотелиальных производных HuES9 на слое матригеля. Линейка – 100 мкм. (б) Количественная оценка общей и средней длины сосудоподобных структур, общего количества точек ветвления.
ОБСУЖДЕНИЕ
Первые исследования отрицали необходимость фактора LIF и запускаемого им сигнального каскада JAK-STAT3 в поддержании ПСК человека, приписывая ключевую роль сигнальному пути TGFβ-ACTIVIN-NODAL, активируемому фактором bFGF (Matsuda et al., 1999; Dahéron et al., 2004). Позже было показано, что путь JAK-STAT3, хотя и не способен поддерживать плюрипотентность клеток человека сам по себе, тем не менее способствует активации генов плюрипотентного состояния (Collier, Rugg-Gunn, 2018). Более того, в одном из протоколов фактор LIF совместно с добавлением ингибиторов киназ CHIR99021, PD0325901, Gö6983 позволяет обходиться при культивировании ПСК человека без фактора bFGF и приближает ПСК по свойствам к бластомерам ранних (32–64 клетки) преимплантационных бластоцист (Guo et al., 2017). В этой работе мы исследовали возможности использования при культивировании и дифференцировке ПСК человека хемокина CCL2, который, как было показано ранее, обладает свойством активировать сигнальный путь JAK-STAT3 (Hasegawa et al., 2014), но до сих пор практически не применяется для работы с ПСК. В данном исследовании мы продемонстрировали, что применение CCL2 при культивировании ПСК человека статистически значимо повышает уровень белков ключевых транскрипционных факторов ОСT4, NANOG, SOX2, KLF4 и TFCP2L1, а также фосфорилированной (активной) формы STAT3, что характерно для перехода ПСК к состоянию “наивной” плюрипотентности. Результаты нашего исследования согласуются с ранее полученными данными в работах на ИПСК человека (Hasegawa et al., 2014) и свидетельствуют, что CCL2 действительно способен активировать сигнальный каскад JAK-STAT3 и повышать уровень экспрессии белков, гены которых являются мишенями транскрипционного фактора STAT3. Таким образом, наши данные подтверждают ранее установленный факт, что CCL2 способен активировать тот же сигнальный каскад, что и LIF, а, следовательно, свидетельствуют в пользу сделанного ранее заключения о возможности рассматривать эти два фактора как альтернативу друг другу при культивировании ПСК.
При пониженной концентрации кислорода (менее 10%) ген белка CCL2 является мишенью и активируется гетеродимерным транскрипционным фактором HIF, в состав которого входит субъединица HIF1A (Mojsilovic-Petrovic et al., 2007; Baay-Guzman et al., 2012). Также ранее было показано, что при атомосферной концентрации кислорода белок CCL2, связывающийся с рецептором на поверхности клетки, приводит к повышению уровня мРНК субъединицы HIF2A и ряда генов гипоксического ответа в ПСК человека (Hasegawa et al., 2014). В данном исследовании мы установили, что в ПСК, культивируемых при атмосферной концентрации кислорода 21% в присутствии CCL2 значимо повышается уровень белка двух кислородзависимых субъединиц транскрипционного фактора HIF: HIF1A и HIF2A. Подобным свойством повышать уровень белка HIF при атмосферной концентрации кислорода обладают так называемые вещества-миметики гипоксии, такие как хлорид кобальта(II) (CoCl2) и диметилоксалилглицин (DMOG) (Mojsilovic-Petrovic et al., 2007; Binó et al., 2016). Миметики гипоксии используют при работе с разными типами клеток, включая плюрипотентные, в частности, их применяют в протоколах направленной дифференцировки (Ng et al., 2011; Jeon et al., 2014; Zhdanov et al., 2015; Binó et al., 2016; Salikhova et al., 2020). Неудобство использования CoCl2 и DMOG связано с тем, что они токсичны для клеток и снижают жизнеспособность (Isaja et al., 2020). Мы показали, что CCL2 обладает свойствами миметика гипоксии, при этом не является токсичным для плюрипотентных клеток, а, напротив, повышает их жизнеспособность. CoCl2 и DMOG обычно используют для кратковременного культивирования с клетками в течение нескольких дней, CCL2 можно использовать при длительном культивировании, при необходимости – на протяжении десятков пассажей. Тем не менее, следует учитывать, что гипоксический ответ, вызываемый CCL2, отличается от ответа клеток при пониженной концентрации кислорода. В условиях 5% O2 культуры ПСК человека в первые 48 часов во время адаптации к гипоксии активируется HIF1А, после чего ему на смену приходит HIF2A, который поддерживает длительный гипоксический ответ плюрипотентных клеток (Närvä et al., 2013; Forristal et al., 2010). При использовании CCL2 мы одновременно детектировали высокий уровень белков HIF1A и HIF2A после четырех пассажей (около 20 дней).
Известно, что HIF является активатором генов плюрипотентности и способствует поддержанию плюрипотентного состояния (Forristal et al., 2010; Närvä et al., 2013; Sugimoto et al., 2018). Это позволяет предположить, что наблюдаемое повышение уровня факторов плюрипотентности в ПСК человека, культивируемых с CCL2, может достигаться не только за счет запуска сигнального пути JAK-STAT3, но также регулируется и другими сигнальными каскадами, запускаемыми транскрипционным фактором HIF.
CCL2 хорошо зарекомендовал себя при использовании в протоколе эндотелиальной дифференцировки. Он не снижает эффективности дифференцировки в мезодермальном направлении, о чем свидетельствует отсутствие статистически значимых отличий в уровне мРНК основного транскрипционного фактора мезодермы BRACHYURY между культурами, дифференцирующимися в присутствии CCL2 и без него. Кроме того, на второй день эндотелиальной дифференцировки у культур с CCL2 выявлялось значимо больше клеток, позитивных по VE-Cadherin. Таким образом, культуры с CCL2 быстрее проходят стадию эндотелиальных предшественников и переходят на следующие стадии эндотелиальной дифференцировки к созреванию клеток. Полученные в присутствии CCL2 эндотелиоциты по сравнению с контролем демонстрируют более высокий ангиогенный потенциал в тесте образования капилляроподобных стуктур в матригеле. Повышение ангиогенного потенциала эндотелиальных клеток обычно связывают с изменениями в экспрессии генов, ответственных за миграцию и синтез внеклеточного матрикса. Известно, что подобные эффекты возникают в эндотелиальных клетках, находящихся в условиях кислородного голодания, а также при повышении уровней белков HIF1A и HIF2A при атмосферной концентрации кислорода (Sarkar et al., 2009; Skuli et al., 2009; Schödel et al., 2011; Hashimoto, Shibasaki, 2015; Hashimoto et al., 2016).
Таким образом, мы показали, что ПСК человека, обработанные CCL2, имеют высокий уровень субъединиц HIF1A и HIF2A, необходимых для запуска гипоксического ответа, активируют ключевые маркеры плюрипотентности ОСT4, NANOG, SOX2, KLF4 и TFCP2L1 на уровне белка, а также положительно влияют на направленную эндотелиальную дифференцировку клеток, усиливая ангиогенные свойства полученных дифференцированных производных. Мы надеемся, что обнаруженные нами эффекты фактора CCL2 будут способствовать его более широкому применению для получения и поддержания ПСК человека, а также использованию в протоколах направленной дифференцировки.
Список литературы
An C., Feng G., Zhang J. et al. Overcoming autocrine FGF signaling-induced heterogeneity in naive human ESCs enables modeling of random X chromosome inactivation // Cell Stem Cell. 2020. V. 27. № 3. P. 482–497.e4.
Baay-Guzman G.J., Bebenek I.G., Zeidler M. et al. HIF-1 expression is associated with CCL2 chemokine expression in airway inflammatory cells: implications in allergic airway inflammation // Respir. Res. 2012. V. 13. № 1. P. 60.
Bi Y., Tu Z., Zhang Y. et al. Identification of ALPPL2 as a naïve pluripotent state-specific surface protein essential for human naive pluripotency regulation // Cell Rep. 2020. V. 30. № 11. P. 3917–3931.e5.
Binó L., Kučera J., Štefková K. et al. The stabilization of hypoxia inducible factor modulates differentiation status and inhibits the proliferation of mouse embryonic stem cells // Chem. Biol. Interact. 2016. V. 244. P. 204–214.
Chan Y.-S., Göke J., Ng J.-H. et al. Induction of a human pluripotent state with distinct regulatory circuitry that resembles preimplantation epiblast // Cell Stem Cell. 2013. V. 13. № 6. P. 663–675.
Collier A.J., Rugg-Gunn P.J. Identifying human naïve pluripotent stem cells − evaluating state-specific reporter lines and cell-surface markers // BioEssays. 2018. V. 40. № 5. P. 1700239.
Cowan C.A., Klimanskaya I., McMahon J. et al. Derivation of embryonic stem-cell lines from human blastocysts // N. Engl. J. Med. 2004. V. 350. № 13. P. 1353–1356.
Dahéron L., Opitz S.L., Zaehres H. et al. LIF/STAT3 signaling fails to maintain self-renewal of human embryonic stem cells // Stem Cells. 2004. V. 22. № 5. P. 770–778.
Dunwoodie S.L. The role of hypoxia in development of the mammalian embryo // Dev. Cell. 2009. V. 17. № 6. P. 755–773.
Ezashi T., Das P., Roberts R.M. Low O2 tensions and the prevention of differentiation of hES cells // Proc. Natl. Acad. Sci. USA. 2005. V. 102. № 13. P. 4783–4788.
Forristal C.E., Wright K.L., Hanley N.A. et al. Hypoxia inducible factors regulate pluripotency and proliferation in human embryonic stem cells cultured at reduced oxygen tensions // Reproduction. 2009. V. 139. № 1. P. 85–97.
Forsyth N.R., Musio A., Vezzoni P. et al. Physiologic oxygen enhances human embryonic stem cell clonal recovery and reduces chromosomal abnormalities // Cloning Stem Cells. 2006. V. 8. № 1. P. 16–23.
Gafni O., Weinberger L., Mansour A.A. et al. Derivation of novel human ground state naive pluripotent stem cells // Nature. 2013. V. 504. № 7479. P. 282–286.
Gu M. Efficient differentiation of human pluripotent stem cells to endothelial cells // Curr. Protoc. Hum. Genet. 2018. V. 98. № 1. P. e64.
Guo G., von Meyenn F., Rostovskaya M. et al. Epigenetic resetting of human pluripotency // Development. 2017. V. 144. № 15. P. 2748–2763.
Hanna J., Cheng A.W., Saha K. et al. Human embryonic stem cells with biological and epigenetic characteristics similar to those of mouse ESCs // Proc. Natl. Acad. Sci. USA. 2010. V. 107. № 20. P. 9222–9227.
Hasegawa Y., Takahashi N., Forrest A.R.R. et al. CC chemokine ligand 2 and leukemia inhibitory factor cooperatively promote pluripotency in mouse induced pluripotent cells // Stem Cells. 2011. V. 29. № 8. P. 1196–1205.
Hasegawa Y., Tang D., Takahashi N. et al. CCL2 enhances pluripotency of human induced pluripotent stem cells by activating hypoxia related genes // Sci. Rep. 2014. V. 4. P. 5228.
Hashimoto T., Shibasaki F. Hypoxia-inducible factor as an angiogenic master switch // Front. Pediatr. 2015. V. 3. P. 33.
Hellemans J., Mortier G., De Paepe A. et al. qBase relative quantification framework and software for management and automated analysis of real-time quantitative PCR data // Genome Biol. 2008. V. 8. № 2. P. R19.
Isaja L., Mucci S., Vera J. et al. Chemical hypoxia induces apoptosis of human pluripotent stem cells by a NOXA-mediated HIF-1α and HIF-2α independent mechanism // Sci. Rep. 2020. V. 10. P. 20653.
Jeon E.S., Shin J.H., Hwang S.J. et al. Cobalt chloride induces neuronal differentiation of human mesenchymal stem cells through upregulation of microRNA-124a // Biochem. Biophys. Res. Commun. 2014. V. 444. № 4. P. 581–587.
Lengner C.J., Gimelbrant A.A., Erwin J.A. et al. Derivation of pre-X inactivation human embryonic stem cells under physiological oxygen concentrations // Cell. 2010. V. 141. № 5. P. 872–883.
Malakhova A.A., Grigor’eva E.V., Pavlova S.V. et al. Generation of induced pluripotent stem cell lines ICGi021-A and ICGi022-A from peripheral blood mononuclear cells of two healthy individuals from Siberian population // Stem Cell Res. 2020. V. 48. 101952.
Matsuda T., Nakamura T., Nakao K. et al. STAT3 activation is sufficient to maintain an undifferentiated state of mouse embryonic stem cells // EMBO J. 1999. V. 18. № 15. P. 4261–4269.
Messmer T., von Meyenn F., Savino A. et al. Transcriptional heterogeneity in naïve and primed human pluripotent stem cells at single-cell resolution // Cell Rep. 2019. V. 26. № 4. P. 815.
Mojsilovic-Petrovic J., Callaghan D., Cui H. et al. Hypoxia-inducible factor-1 (HIF-1) is involved in the regulation of hypoxia-stimulated expression of monocyte chemoattractant protein-1 (MCP-1/CCL2) and MCP-5 (Ccl12) in astrocytes // J. Neuroinflammation. 2007. V. 4. P. 12.
Nakamura T., Okamoto I., Sasaki K. et al. A developmental coordinate of pluripotency among mice, monkeys and humans // Nat. 2016. V. 537. № 7618. P. 57–62.
Närvä E., Pursiheimo J.-P., Laiho A. et al. Continuous hypoxic culturing of human embryonic stem cells enhances SSEA-3 and MYC levels // PLoS One. 2013. V. 8. № 11. P. e78847.
Ng K.M., Chan Y.C., Lee Y.K. et al. Cobalt chloride pretreatment promotes cardiac differentiation of human embryonic stem cells under atmospheric oxygen level // https://home.liebertpub.com/cell. 2011. V. 13. № 6. P. 527–537.
Podkalicka P., Stępniewski J., Mucha O. et al. Hypoxia as a driving force of pluripotent stem cell reprogramming and differentiation to endothelial cells // Biomolecules. 2020. V. 10. № 12. P. 1–30.
Salikhova D.I., Leonov G.E., Bukharova T.B. et al. Comparative analysis of the paracrine action of neuronal and glial progenitor cells derived from induced human pluripotent stem cells // Bull. Exp. Biol. Med. 2020. V. 169. № 1. P. 176–181.
Schödel J., Oikonomopoulos S., Ragoussis J. et al. High-resolution genome-wide mapping of HIF-binding sites by ChIP-seq // Blood. 2011. V. 117. № 23. P. e207–e217.
Skuli N., Liu L., Runge A. et al. Endothelial deletion of hypoxia-inducible factor–2α (HIF-2α) alters vascular function and tumor angiogenesis // Blood. 2009. V. 114. № 2. P. 469.
Sperber H., Mathieu J., Wang Y. et al. The metabolome regulates the epigenetic landscape during naive-to-primed human embryonic stem cell transition // Nat. Cell Biol. 2015. V. 17. № 12. P. 1523–1535.
Sugimoto K., Matsuura T., Nakazono A. et al. Effects of hypoxia inducible factors on pluripotency in human iPS cells // Microsc. Res. Tech. 2018. V. 81. № 7. P. 749–754.
Takashima Y., Guo G., Loos R. et al. Resetting transcription factor control circuitry toward ground-state pluripotency in human // Cell. 2014. V. 158. № 6. P. 1254–1269.
Theunissen T.W., Powell B.E., Wang H. et al. Systematic identification of culture conditions for induction and maintenance of naïve human pluripotency // Cell Stem Cell. 2014. V. 15. № 4. P. 471–487.
Vaskova E.A., Medvedev S.P., Sorokina A.E. et al. Transcriptome characteristics and X-chromosome inactivation status in cultured rat pluripotent stem cells // Stem Cells Dev. 2015. V. 24. № 24. P. 2912–2924.
Ware C.B., Nelson A.M., Mecham B. et al. Derivation of naive human embryonic stem cells // Proc. Natl. Acad. Sci. USA. 2014. V. 111. № 12. P. 4484–4489.
Zakharova I.S., Zhiven’ M.K., Saaya S.B. et al. Endothelial and smooth muscle cells derived from human cardiac explants demonstrate angiogenic potential and suitable for design of cell-containing vascular grafts // J. Transl. Med. 2017. V. 15. № 1. P. 54.
Zakharova I.S., Saaya S.B., Shevchenko A.I. et al. Mitomycin-treated endothelial and smooth muscle cells suitable for safe tissue engineering approaches // Front. Bioeng. Biotechnol. 2022. V. 10. P. 772981.
Zakharova I.S., Shevchenko A.I., Tmoyan N.A. et al. Induced pluripotent stem cell line ICGi036-A generated by reprogramming peripheral blood mononuclear cells from a patient with familial hypercholesterolemia caused due to compound heterozygous p.Ser177Leu/p.Cys352Arg mutations in LDLR // Stem Cell Res. 2022. V. 59. 102653.
Zhdanov A.V., Okkelman I.A., Collins FW.J. et al. A novel effect of DMOG on cell metabolism: direct inhibition of mitochondrial function precedes HIF target gene expression // Biochim. Biophys. Acta. 2015. V. 1847. № 10. P. 1254–1266.
Zudaire E., Gambardella L., Kurcz C., Vermeren S. A computational tool for quantitative analysis of vascular networks // PLoS One. 2011. V. 6. № 11. P. e27385.
Дополнительные материалы отсутствуют.