Палеонтологический журнал, 2022, № 4, стр. 95-106
Микробиолиты содово-соленого озера Лос-Сиснес (о. Огненная Земля, Чили)
О. С. Самылина a, b, *, Л. В. Зайцева b, **, Д. С. Груздев c, Е. О. Патутина d, А. А. Прокин e
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
117312 Москва, Россия
b Палеонтологический институт им. А.А. Борисяка РАН
117647 Москва, Россия
c SciBear OU
10115 Таллин, Эстония
d ЦКП “Биоинженерия”, ФИЦ Биотехнологии РАН
117312 Москва, Россия
e Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 пос. Борок, Россия
* E-mail: olga.samylina@gmail.com
** E-mail: l.zaytseva@mail.ru
Поступила в редакцию 24.11.2021
После доработки 29.12.2021
Принята к публикации 29.12.2021
- EDN: MLIGAO
- DOI: 10.31857/S0031031X22040109
Аннотация
Современные микробиолиты, образующиеся в содово-соленых и содовых озерах, представляют интерес как модельные системы для изучения геобиологических взаимодействий в докембрии, когда подобные геохимические обстановки предположительно были широко распространены. Описаны структура и минеральный состав микробиолитов из содово-соленого озера Лос-Сиснес (о. Огненная Земля, Чили), а также охарактеризовано биоразнообразие микроорганизмов, участвующих в их образовании. В составе микробиолита выявлены преимущественно карбонатные минералы, особый интерес из которых представляет моногидрокальцит. Показано, что образование микробиолитов происходит в щелочных условиях в присутствии таксономически и функционально разнообразных микроорганизмов при непосредственном контакте с экзополисахаридами, продуцируемыми микробным сообществом.
ВВЕДЕНИЕ
Микробиолиты представляют собой органоседиментационные структуры, образующиеся благодаря микробно-опосредованному осаждению или аккреции минералов (Burne, Moore, 1987). Массовое развитие микробиолитов приурочено к протерозою, когда эпиконтинентальные щелочные геохимические обстановки были широко представлены на Земле (Заварзин, 1993; Stüeken et al., 2015). Современными аналогами таких обстановок являются содово-соленые и содовые озера, которые распространены по всему миру, и в которых карбонатные микробиолиты образуются и в настоящее время (Kempe, Kazmierczak, 2011). Такие микробиолиты представляют значительный интерес, поскольку их можно рассматривать в качестве модельных систем для изучения геобиологических взаимодействий в докембрии.
К настоящему времени очевидным является тот факт, что образование микробиолитов происходит в результате жизнедеятельности физиологически различных групп микроорганизмов. С осаждением карбонатных минералов связывают различные типы метаболической активности, в том числе фотосинтез, сульфатредукцию, окисление сульфидов, анаэробное окисление метана, а также аэробный гетеротрофный метаболизм (Zhu, Dittrich, 2016; Petrash et al., 2017). Поэтому для понимания микробно-минеральных взаимодействий важно оценивать биологическое и функциональное разнообразие сообществ, ассоциированных с микробиолитами. Морфологических наблюдений в этом случае недостаточно, поскольку лишь некоторые из прокариот (такие как цианобактерии и актиномицеты) могут быть идентифицированы и функционально охарактеризованы этим методом. В случае современных микробиолитов молекулярно-биологические методы дают несомненное преимущество в идентификации и выявлении метаболических особенностей широкого спектра микроорганизмов.
Микробные сообщества микробиолитов из содово-соленых и содовых озер характеризуются большим таксономическим и функциональным разнообразием прокариот и эукариот (Lopez-Garcia et al., 2005; Couradeau et al., 2011; Gérard et al., 2018). Помимо фотосинтезирующих микроорганизмов (бактерий и водорослей), выявлены разнообразные гетеротрофы. Среди бактерий это сульфатредукторы, фирмикуты, планктомицеты и бактероидеты, способные разлагать сложные полимерные вещества; среди эукариот – грибы, Choanoflagellida, Nucleariida, Amoebozoa, Alveolata и Stramenopiles. Таким образом, разнообразие и обилие прокариот, не относящихся к цианобактериям, а также фототрофных и гетеротрофных эукариот в составе микробиолитов свидетельствуют об их важной, но слабоизученной роли в формировании этих геобиологических структур.
В южной части Чили (Южная Патагония и о. Огненная Земля) расположено множество водоемов, в т.ч. содово-соленых (Прокина, Мыльников, 2018). Один из них – оз. Лос-Сиснес, которое является частью озерной системы, сформированной более 16 тыс. лет назад после отступления ледника (Rabassa et al., 2000). В настоящее время территория этого озера является памятником природы, предназначенным для охраны наземных и морских видов птиц и доступным для свободного посещения. На окраине озера развиваются многочисленные микробиолиты (Solari, 2015), которые, несмотря на доступность и туристическую привлекательность местности, остаются практически неизученными. В настоящей работе, с целью выявления особенностей формирования микробиолитов в содово-соленых условиях, описаны структура и минеральный состав микробиолитов оз. Лос-Сиснес, а также таксономическое и функциональное разнообразие микроорганизмов, участвующих в их образовании.
МАТЕРИАЛ И МЕТОДЫ
Место сбора образцов. Оз. Лос-Сиснес (Laguna de los Cisnes) находится на о-ве Огненная Земля в 6 км на север от г. Порвенир (Чили). Координаты точки отбора образцов: 53°15′00.3′′ S, 70°20′46.4′′ W. Высота над уровнем моря – 3 м. Образцы были отобраны 5 и 15 ноября 2015 г.
Гидрохимические анализы. Общую соленость воды определяли непосредственно в поле рефрактометром-солемером Krüss S-10, температуру, рН и электропроводность – портативными приборами HI 98201 и Combo HI 98129 (Hanna Instruments). Общую карбонатную щелочность и содержание СО32- определяли титриметрическим методом (титровали 0.1 М р-ром HCl). Определение ионного состава воды (кроме ${\text{СО}}_{3}^{{2 - }}$) проводили на ионном хроматографе “Стайер” на кафедре геохимии ландшафтов и географии почв географического фак-та Московского государственного ун-та (МГУ) им. М.В. Ломоносова.
Исследование строения и вещественного состава микробиолитов проводили комплексом методов, включающих в себя световую и электронную микроскопию, а также инфракрасную спектроскопию (ИКС) и рентгено-фазовый анализ (РФА). Фото образцов получены на световом стереомикроскопе Leica M165C (Германия). Исследование образцов методом сканирующей электронной микроскопии (СЭМ) с применением рентгеноспектрального микроанализа (РСМА) проводили на электронном микроскопе EVO-50 Zeiss c микроанализатором INCA Oxford 350 (Великобритания). Образцы напыляли золотом. Определение минерального состава методом ИК-Фурье спектроскопии проводили на ИК-Фурье спектрометре FT/IR-4100 с использованием приставки НПВО PIKE MIRacleTM (США). Рентгеновская порошковая дифрактометрия (РФА) проводилась на дифрактометре Bruker D8 Advance (Германия).
Определение разнообразия микроорганизмов в составе микробиолитов проводили с использованием молекулярно-генетических методов. ДНК выделяли по методике, основанной на модифицированном методе щелочного выделения ДНК Бирнбойма-Доли и Wizard-технологии фирмы Promega (Булыгина и др., 2002). Очищенную ДНК хранили при –20°С. Препарат тотальной ДНК использовали для ПЦР с универсальными праймерами Univ27f и Univ1492r к гену 16S рРНК (Lane, 1991) и F566 и R1200r к гену 18S рРНК (Hadziavdic et al., 2014). Полученные ПЦР-продукты очищали от посторонних примесей и неспецифичных продуктов реакции при помощи электрофореза в легкоплавкой агарозе с применением набора “Wizard PCR Preps” (Promega). Очищенные ПЦР-продукты лигировали в вектор pGEM-T EasySystem (Promega), согласно рекомендациям производителя, и клонировали в штамм E. coli DH10B. Секвенирование ПЦР-продуктов и клонированных фрагментов проводили на секвенаторе ABI3730 DNA Analyzer (Applied Biosystems) с использованием набора реактивов Big Dye Terminator v 3.1 Cycle Sequencing Kit (Applied Biosystems), согласно рекомендациям производителя. Первичный сравнительный анализ полученных последовательностей проводили с помощью сервиса NCBI BLAST (http://www.ncbi.nlm.nih.gov/blast). Последовательности были проверены на химеры с помощью сервиса Bellerophon (Huber et al., 2004). Для построения филогенетических деревьев использовали алгоритм neighbor-joining, реализованный в программе MEGA 6.0 (Tamura et al., 2013). Клоны с уровнем сходства более 97% были объединены в операционные таксономические единицы (ОТЕ). Последовательности 16S рРНК были депонированы в ГенБанк с номерами OL587709–OL587711, OL587713–OL587717, OL587720, OL587722, OL587724, OL587725. Последовательности 18S рРНК были депонированы в ГенБанк с номерами OL489754–OL489767.
РЕЗУЛЬТАТЫ
Физико-химические характеристики воды оз. Лос-Сиснес представлены в табл. 1. По солености вода озера относится к рассолам (>50 г/л). По химическому составу рассола озеро относится к содово-соленому типу по классификации Э. Борос и М. Колпаковой (Boros, Kolpakova, 2018). Молярное соотношение Mg/Ca = 98.9.
Таблица 1.
Гидрохимические характеристики воды озера Лос-Сиснес
| Общие характеристики | Анионы, мг/л | Катионы, мг/л | Молярное отношение Mg/Ca | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Т, °C | pH | G, мкСм | S, ‰ | ТА, мМ | Cl– | ${\text{HCO}}_{3}^{ - }$ | ${\text{CO}}_{3}^{{2 - }}$ | ${\text{SO}}_{4}^{{2 - }}$ | ${\text{NO}}_{3}^{ - }$ | Na+ | K+ | Mg2+ | Ca2+ | |
| 16.4 | 9.42 | 78400 | 50 | 415 | 35 000 | 12 505 | 6300 | 4441 | 5.0 | 17 230 | 550 | 750 | 12.5 | 98.9 |
Строение микробиолитов. Микробиолиты оз. Лос-Сиснес представляют собой карбонатные постройки в форме продолговатых куполов, полых внутри и вытянутых перпендикулярно берегу (рис. 1, а, б). Частично они локализованы на берегу озера, частично – в воде. На исследованном участке озера тянутся вдоль берега на расстояние примерно 2 км.
Рис. 1.
Внешний вид микробиолитов, развивающихся в озере Лос-Сиснес: а, б – крупные карбонатные постройки в виде продолговатых куполов, полых внутри и вытянутых перпендикулярно берегу; в – карбонатные купола рыжевато-бурого цвета, развивающиеся в воде озера; г – неровная бугорчатая поверхность рыжевато-бурых куполов, которая состоит из многочисленных “шишек”; д, е – поперечный скол проверхности микробиолита с чередованием прослоев различного цвета.

Постройки, находящиеся на берегу, удалены на расстояние до 100–200 м и представляют собой образования серого цвета, длиной до 5 м, шириной до 0.8 м и высотой до 1 м. Внутри они пустотелые и расслаивающиеся. Постройки, расположенные в воде озера, уходят примерно на 100 м от уреза воды вглубь озера. Они представляют собой куполообразные округлые образования до 1 м в высоту и до 0.5 м в диаметре верхней части. Наиболее крупные приобретают ту же вытянутую форму с длинной осью, направленной перпендикулярно линии уреза воды, что и серые постройки, находящиеся на суше. Имеют рыжевато-бурый цвет и неровную бугорчатую поверхность, состоящую из многочисленных “шишек” различного размера и взаимного расположения, напоминающих соцветия цветной капусты (рис. 1, в, г). На сколе поверхностных структур видна слоистость (рис. 1, д, е). Постройки скользкие на ощупь из-за биопленок и обрастаний нитчатыми водорослями.
Карбонатные купола рыжевато-бурого цвета, находящиеся в озерной воде, представляют собой живые растущие микробиолиты. Карбонатные купола серого цвета, расположенные на берегу, не имеют контакта с водой и постепенно разрушаются под действием факторов окружающей среды. В данной работе детально рассмотрены только живые микробиолиты рыжевато-бурого цвета (рис. 1).
Минеральный состав микробиолитов был исследован методами РФА, РСМА и ИКС. Согласно данным РФА, карбонаты представлены, главным образом, высокомагнезиальными кальцитами (ВМК) и моногидрокальцитом (МГК). ВМК представлены двумя основными видами (рис. 2, а): преимущественно с содержанием MgCO3 около 24 мол. % (d104 = 2.96, I = 100%) и в меньшей степени с содержанием MgCO3 около 42 мол. % (d104 = 2.91, I = 50%) (Солотчина и др., 2011). На ИК-спектре на их присутствие указывают полосы поглощения с максимумами 721 и 727 см–1 (рис. 2, б). Интенсивность полосы поглощения с максимумом 721 см–1 выше, чем при 727 см–1, что указывает на преобладание Mg-кальцитов с более низким содержанием Mg. Эти данные согласуются с данными РФА.
Рис. 2.
Минеральный состав микробиолита: а – дифрактограмма (РФА): 1 – высокомагнезиальные кальциты: MgCO3 = 24 мол. % (1а), MgCO3 = 42 мол. % (1б); 2 – моногидрокальцит; 3 – кальцит; 4 – арагонит; 5 – кварц; б – ИК-спектр порошковой пробы микробиолита.
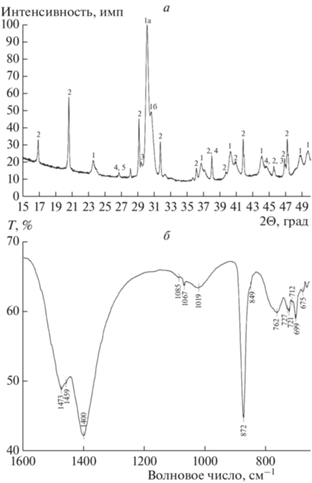
Для дифрактограммы МГК характерны межплоскостные расстояния d(Å) 4.31, 3.06, 1.93, 2.16, 2.37 (ICSD 200820, PDF 29-306), а для ИК-спектра – полосы поглощения с максимумами 1408 и 1487 (дуплет), 1068 и 760 см–1 (Farmer, 1974; Neuman, 2007). Поскольку кроме МГК в составе исследуемого микробиолита присутствуют и другие карбонатные минералы, которые влияют на положение максимумов полос поглощения в его ИК-спектре, то суммарный спектр имеет следующие значения: 1400 и 1473, 1067 и 762 см–1 (рис. 2, б). Кальцит и арагонит обнаружены в незначительных количествах, что подтверждают данные РФА (рис. 2, а). В ИК-спектре на присутствие кальцита указывает характеристическая полоса поглощения с максимумом 712(ν4) см–1, а на присутствие арагонита – полоса с максимумом 1085(ν1) см–1 (рис. 2, б). Кроме того, можно отметить присутствие небольшого количества силикатов (полоса с максимумом 1020 см–1).
Структурные и минеральные особенности микробиолитов. Рыжевато-бурый поверхностный слой микробиолитов был рассмотрен на разных его участках. На участке со свежевыпавшим малоизмененным минеральным осадком на поверхности микробиолита выявлены соли хлоридов и карбонатов натрия и калия, а также Са–Mg карбонатов. Отмечено высокое содержание магния (Mg/Ca ~ 0.8) и углерода (табл. XII , фиг. 1; см. вклейку). Другой участок рыжевато-бурой поверхности представляет собой уже высохший участок внешней корки с преобразованным осадком, который состоит из многочисленных кристаллов, соединенных полисахаридным матриксом (табл. XII , фиг. 2, 3). Здесь же выявлено большое количество одноклеточных и нитчатых водорослей и цианобактерий, а также свободный экзополисахарид (ЭПС). РСМ анализ кристаллов на таком участке выявил отсутствие магния и преобладание кальция в элементном составе (см. диаграмму состава в табл. XII , фиг. 2). Кристаллы на этом участке обнаруживают при увеличении изображения характерную долотообразную форму (табл. XIII , фиг. 1, 2; см. вклейку), что позволяет отнести составляющие этот участок кристаллы к МГК (Нечипоренко, Бондаренко, 1988). Этот минерал встречается в природе достаточно редко в силу специфических условий его образования и неустойчивости по отношению к кальциту и арагониту (Nishiyama et al., 2013).
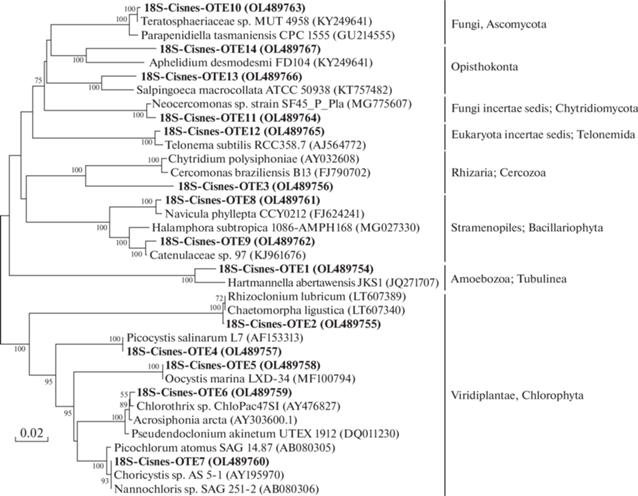
Рис. 3.
Филогенетическое дерево, построенное методом neighbor-joining на основании анализа нуклеотидных последовательностей генов 18S рРНК и отражающее разнообразие эукариот в исследуемых образцах микробиолитов.
В работе M. Солари (Solari, 2015) утверждается, что рыжевато-бурая окраска поверхности микробиолитов обусловлена осаждением гидроксидов железа, однако наши данные этого не подтверждают. Методом РСМА железо было обнаружено только в фоновом количестве как на поверхности микробиолитов (табл. XII , фиг. 1, 2), так и во внутренних слоях (табл. XIII , фиг. 7 ). В большинстве случаев присутствие Fe ассоциировано с ЭПС. Ранее было показано осаждение окрашенных в коричневый цвет сферолитов МГК из концентрированных растворов морской воды в присутствии органических соединений (Ferguson et al., 1978). Таким образом, можно предположить, что рыжевато-бурый цвет поверхности исследуемых микробиолитов обусловлен не гидроксидами железа, а присутствием окрашенных органических соединений.
Ниже внешнего слоя располагается слизистый зеленый слой. Этот слой не минерализован и представляет собой “альго-бактериальный мат”, состоящий из экзополисахаридного матрикса, в котором развиваются микроорганизмы, представленные нитями водорослей и цианобактерий, а также диатомовыми водорослями (табл. XII , фиг. 4, 5 ). В составе этого слоя определены различные минеральные образования, выпадающие из рассольных вод озера на поверхность ЭПС: хлориды натрия и калия, карбонат натрия, а также магнезиально-кальциевые карбонаты (табл. XII , фиг. 6 ). На некоторых участках видны начальные этапы формирования кристаллов (в т.ч. МГК) в ЭПС (табл. XII , фиг. 7 ). В более глубоких слоях микробиолита живые микроорганизмы частично разрушаются, частично подвергаются фоссилизации (табл. XII , фиг. 8 ).
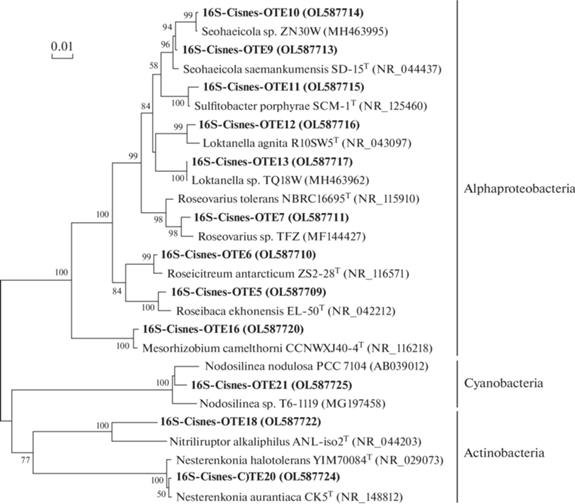
Рис. 4.
Филогенетическое дерево, построенное методом neighbor-joining на основании анализа нуклеотидных последовательностей генов 16S рРНК и отражающее разнообразие прокариот в исследуемых образцах микробиолитов.
Ниже зеленого слоя микробиолит полностью минерализован и состоит из различных карбонатов (табл. XIII , фиг. 3–8 ). Элементный состав кристаллов указывает на преобладание Ca–Mg-карбонатов с различной степенью магнезиальности. Присутствуют участки минералов с низкой упорядоченностью: это участки с плохо окристаллизованными фрагментами и участки с многообразными кристаллическими агрегатами разной формы и размеров, в том числе и долотообразной. Кроме того, присутствуют кристаллические агрегаты (блочные кристаллы) в виде тетраэдров, состоящие из более мелких кристаллов.
Аморфные сферические образования Ca–Mg-карбонатного состава с содержанием MgCO3 от 10 до 23% (табл. XIII , фиг. 3), обнаруженные в составе микробиолита, могут преобразовываться впоследствии в МГК и Ca–Mg карбонаты.
ВМК в составе микробиолита представлены различными формами. Чаще всего встречаются ВМК в виде веерообразных кристаллов с содержанием MgCO3 ~ 23–24% (табл. XIII , фиг. 4). Кристаллы ВМК в виде треугольных пирамид с содержанием MgCO3 ~ 41% представлены на этом участке в несколько меньшем объеме (табл. XIII , фиг. 5 ). Еще реже встречаются кристаллы ВМК с содержанием MgCO3 46.5–47%. Они представляют собой кристаллические агрегаты (блочные кристаллы) в виде тетраэдров размером 12–14 мкм, которые состоят из еще более мелких кристаллов размером 1–2 мкм (табл. XIII , фиг. 6 ). Такие кристаллы были отнесены нами к Са-избыточным доломитам, в структуре которых избыток CaCO3 может достигать 7 мол. % относительно стехиометрического доломита. В образцах микробиолита из оз. Лос-Сиснес стехиометрический доломит и признаки доломитового упорядочивания нами выявлены не были.
Аморфное вещество в виде комковатых округлых форм с высоким содержанием углерода и магния и низким содержанием кальция (табл. XIII , фиг. 7 ), вероятно, является магнезиальным гидрокарбонатом. Из-за высокой растворимости (Sanz-Montero et al., 2019) магнезиальные гидрокарбонаты могли сохраниться только в небольших замкнутых пространствах микробиолита, что мы и наблюдали. При кристаллизации аморфного магнезиального гидрокарбоната возможно образование кристаллов гидромагнезита (4MgCO3·Mg(OH)2·4H2O) или несквегонита (MgCO3·3H2O) (Purgstaller et al., 2019). Эти минералы в виде таблитчатых кристаллов обнаружены в исследуемых образцах позже, после их длительного хранения и естественной дегидратации на воздухе (табл. XIII , фиг. 8 ).
Разнообразие микроорганизмов в составе микробиолитов. При исследовании на сканирующем электронном микроскопе выявлены в первую очередь фототрофные организмы: нити эукариотических водорослей, диатомовые водоросли и нитчатые цианобактерии (табл. XII , фиг. 2–4). Поскольку осаждение карбонатных минералов индуцируется метаболической деятельностью микроорганизмов различной таксономической принадлежности и физиологии, мы проанализировали филогенетический состав микроорганизмов, ассоциированных с исследуемыми микробиолитами.
Анализ последовательностей генов, кодирующих малую субъединицу 18S рРНК, позволил установить филогенетическую принадлежность эукариотических организмов (рис. 3), среди которых действительно преобладали фототрофы, и, в первую очередь, водоросли филума Chlorophyta. Доминировали последовательности 18S-Cisnes-OTE4, близкие к Picocystis salinarum R.A. Lewin (класс Picocystophyceae) – организму, который является типичным представителем альгофлоры содово-соленых и содовых озер по всему миру (Tarazona et al., 2017). Другие последовательности филума принадлежали одноклеточным зеленым водорослям класса Trebouxiophyceae и были близки к представителям родов Oocystis (18S-Cisnes-OTE5) и Choricystis/Nannochloris (18S-Cisnes-OTE7), а нитчатые формы – к представителям класса Ulvophyceae и родам Chlorothrix (18S-Cisnes-OTE6) и Rhizoclonium/Chaetomorpha (18S-Cisnes-OTE2). Другие фототрофные эукариоты были представлены диатомовыми водорослями класса Bacillariophyceae (филум Bacillariophyta), среди которых выявлены последовательности, близкие к родам Navicula (18S-Cisnes-OTE8) и Halamphora (18S-Cisnes-OTE9). Из гетеротрофных эукариот обнаружены последовательности, принадлежащие представителям грибов, относящихся к филумам Ascomycota (18S-Cisnes-OTE10) и Chytridiomycota (18S-Cisnes-OTE11), а также единичные последовательности других эукариот неопределенного систематического положения: представители групп Amoebozoa (18S-Cisnes-OTE1), Rhizaria (18S-Cisnes-OTE3), Opisthokonta (18S-Cisnes-OTE13, 14) и порядка Telonemida (18S-Cisnes-OTE12).
Анализ последовательностей генов, кодирующих малую субъединицу рибосомы прокариот (16S рРНК), выявил, что доминирующими филумами в составе микробиолитов были Proteobacteria (класс Alphaproteobacteria), Actinobacteria и Cyanobacteria (рис. 4). Представители Firmicutes, Planctomycetes, Delta- и Gammaproteobacteria встречались значительно реже.
В составе класса Alphaproteobacteria преобладали представители порядка Rhodobacterales, среди которых известно много таксонов, способных к аноксигенному фотосинтезу. В исследуемом образце микробиолита Rhodobacterales были представлены восемью различными ОТЕ (16S-Cisnes-OTE6, 8-13), близкими к облигатно гетеротрофным таксонам (не способным расти фотоавтотрофно или фотоорганотрофно). Только последовательности 16S-Cisnes-OTE5 были близки к виду Roseibaca ekhonensis Labrenz et al., 2009, содержащему бактериохлорофилл a и способному к аэробному фотогетеротрофному росту. Единственная ОТЕ в классе Alphaproteobacteria, относящаяся к порядку Rhizobiales (16S-Cisnes-OTE16), близка к гетеротрофному виду Mesorhizobium camelthorni Chen et al., 2011. Филум Actinobacteria был представлен двумя ОТЕ, близкими к видам родов Nitriliruptor (16S-Cisnes-OTE18, 19) и Nesterenkonia (16S-Cisnes-OTE20), которые также являются гетеротрофами. В исследуемом образце микробиолита наиболее многочисленными прокариотами с фототрофным метаболизмом были представители филума Cyanobacteria. С использованием СЭМ в составе образцов выявлено два морфотипа нитчатых цианобактерий (табл. XII , фиг. 3, 4). Однако молекулярно-генетический анализ выявил только одну ОТЕ (16S-Cisnes-OTE21), близкую к представителям рода Nodosilinea (порядок Synechococcales). Нити, морфологически соответствующие этому роду, представлены в табл. XII , фиг. 4. Такое разночтение может быть связано с неоднородностью образца. Но, поскольку физиологические процессы, которые могут влиять на осаждение карбонатных минералов, одинаковы у большинства цианобактерий, расхождение морфологических и молекулярно-генетических данных в контексте данной работы значения не имеет.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ минерального состава микробиолитов из содово-соленого оз. Лос-Сиснес выявил их преимущественно карбонатный состав: магнезиальные кальциты с различным соотношением Ca и Mg, Са-избыточный доломит, МГК, кальцит, арагонит и гидрокарбонаты магния (предположительно гидромагнезит и несквегонит). Образование карбонатных минералов в природных условиях возможно как химическим путем, так и при участии живых организмов. Среди факторов, влияющих на этот процесс – такие, как соотношение Mg/Ca в воде, общая карбонатная щелочность, соленость, значение рН и величина органической продуктивности водоема (Солотчина и др., 2011). Последний фактор тесно связан с жизнедеятельностью биоты, развивающейся в зоне формирования микробиолитов.
Для морских и соленых обстановок влияние микробной метаболической активности на осаждение карбонатных минералов заключается в прямом или косвенном защелачивании среды и увеличении концентрации карбонат-иона $\left( {{\text{CO}}_{3}^{{2 - }}} \right),$ что локально создает условия, благоприятные для осаждения карбонатных минералов. При этом синтез и деградация органического вещества, в т.ч. ЭПС, определяет доступность центров нуклеации минералов (Decho, 2009; Zhu, Dittrich, 2016; Perri et al., 2017; Petrash et al., 2017). Однако этот механизм нельзя считать универсальным для всех гидрохимических обстановок. Отличительной чертой содово-соленых и содовых вод являются высокие концентрации карбонат- и бикарбонат-ионов. Следовательно, прямое влияние микробной активности на изменение гидрохимии среды в таких условиях может быть ограниченным или невозможным (Chagas et al., 2016). Обсуждение этой проблемы затрагивало такие метаболические процессы, как фотосинтетическая ассимиляция CO2 и сульфатредукция применительно к гипотезе докембрийского “содового океана” с предполагаемой общей щелочностью около 22 мМ (Arp et al., 1999, 2001; Bosak, Newman, 2003; Meister, 2013). В составе микробиолитов оз. Лос-Сиснес сульфатредуцирующие бактерии выявлены не были, но микроорганизмы, способные к фототрофной ассимиляции CO2 (цианобактерии и эукариотические водоросли) были представлены широко. Общая щелочность воды оз. Лос-Сиснес составляет 415 мМ (табл. 1), что может значительно ограничивать влияние фотосинтеза на локальные изменения химических условий.
Присутствие органических веществ в щелочных условиях должно, по всей видимости, играть ключевую роль. Так, было установлено, что на первоначальном этапе в щелочных условиях ЭПС связывает катионы Ca2+ и Mg2+, ингибируя нуклеацию карбонатных минералов. Осаждение карбонатов начинается либо после насыщения центров связывания в ЭПС, либо при гетеротрофной деградации ЭПС, которая приводит к высвобождению катионов (Arp et al., 1999). Данные СЭМ и РСМА указывают на то, что карбонатные минералы в микробиолитах оз. Лос-Сиснес начинают свое образование в непосредственном контакте с ЭПС (табл. XII фиг. 6, 7 ). Продуценты ЭПС в микробиолитах оз. Лос-Сиснес представлены как прокариотами (в первую очередь цианобактериями), так и эукариотами (в частности, многочисленными диатомовыми водорослями). Гетеротрофные организмы, способные к разложению ЭПС и другой органики, также многочисленны и разнообразны. Среди эукариот это, в первую очередь, грибы, а среди прокариот – альфапротеобактерии и актиномицеты (рис. 3, 4).
Особый интерес представляет МГК (CaCO3·H2O). Считается, что в современных отложениях этот минерал является продуктом биоминерализации и образуется в широком интервале соотношений Mg/Ca от 0.17 до 65 (Rodriguez-Blanco et al., 2014). К типичным условиям образования МГК относятся прибрежные соленые воды, со слабощелочными значениями рН, соотношением Mg/Ca до 60 и присутствием водорослей и цианобактерий (Сапожников, Цветков, 1959; Taylor, 1975; Swainson, 2008; Last et al., 2010; Солотчина и др., 2011; Страховенко и др., 2015). Воды оз. Лос-Сиснес отличаются от приведенных выше условий тем, что являются содово-солеными, имеют щелочные значения рН > 9 и значительный избыток Mg по отношению к Ca (~100, см. табл. 1).
Образование минерального вещества в процессе роста микробиолита можно представить следующим образом: из пересыщенного по отношению к Ca–Mg-карбонатам рассола на дно озера и на ослизненные поверхности выпадает карбонатный осадок в виде аморфного вещества, которое впоследствии может растворяться и вновь кристаллизоваться. В образцах микробиолитов из оз. Лос-Сиснес методами СЭМ и РСМА нами были выявлены Сa–Mg сферические образования со значительным содержанием углерода и соотношением Mg к Ca от 0.1 до 0.3, которые мы отнесли к аморфному карбонатному веществу, образованному в окружении ЭПС (табл. XIII , фиг. 3). Ион Mg2+ обладает высокой энергией гидратации и способностью удерживать вокруг себя воду и, таким образом, удерживается в растворе. Это приводит к тому, что, несмотря на почти 100-кратное преобладание магния над кальцием (в молярном соотношении) в составе воды оз. Лос-Сиснес, в контакте с ЭПС кристаллизуются преимущественно кальциевые карбонатные соединения. Состав и соотношение Mg и Ca в минерализованном ЭПС близки к образованным на нем микрокристаллам Ca–Mg карбонатов (табл. XII , фиг. 6, 7 ).
Уже на этапе образования аморфного карбонатного вещества появляются микроучастки с различной упорядоченностью, свойственной, например, кальциту, арагониту и пр. (Addadi et al., 2003; Cartwright et al., 2012). В дальнейшем при его переходе в кристаллическое состояние наличие таких микроучастков будет влиять на конечный результат перехода. Присутствие растворенной органики также влияет на свойства, состав и преобразования аморфного карбонатного вещества (Нечипоренко, Бондаренко, 1988; Солотчина и др., 2011; Wang et al., 2015). Таким образом, процесс кристаллизации аморфного вещества может проходить разными путями, в результате чего могут образовываться МГК, кальцит и арагонит (Nishiyama et al., 2013; Rodriguez-Blanco et al., 2014), а также кристаллы Ca-Mg карбонатов разного состава. Необходимо отметить, что аморфное карбонатное вещество трансформируется в МГК при обязательном присутствии магния в растворе (Taylor, 1975; Vasconcelos, McKenzie, 1997; Солотчина и др., 2011; Rodriguez-Blanco et al., 2014), что мы и наблюдаем на примере оз. Лос-Сиснес. Считается, что МГК кристаллизуется в четырехстадийном процессе (Wang et al., 2015). В первой фазе его нуклеации из сильно пересыщенных растворов образуется Мg-содержащий метастабильный водный карбонат кальция, образующий сферы. На втором этапе преобразования аморфного вещества идет кристаллизация сфер Мg-содержащего метастабильного водного карбоната кальция, на третьем – созревание МГК. На четвертом этапе (вторичного созревания) происходит высвобождение Mg из структуры МГК с сопутствующим образованием гидромагнезита (Rodriguez-Blanco et al., 2014).
Аморфный осадок на поверхности ЭПС на начальном этапе минералообразования может содержать также гидратированный карбонат магния, который в силу своей высокой растворимости неустойчив и способен как растворяться в окружающей его озерной воде, так и находиться в аморфном состоянии. В составе исследуемых микробиолитов гидромагнезит был выявлен на поверхности образцов после их высыхания, в то время как в свежих образцах (живых и влажных) его изредка можно было найти в замкнутых недоступных для воды участках. Р. Нишияма с соавт. (Nishiyama et al., 2013) полагают, что в силу высокой растворимости гидромагнезита этот минерал появляется после длительного старения осадка, содержащего МГК, что согласуется с нашими наблюдениями.
МГК нестабилен по отношению к кальциту и арагониту (Nishiyama et al., 2013) и является промежуточной фазой: образуется из аморфного материала и превращается со временем в кальцит или арагонит. В работе Дж. Тэйлора (Taylor, 1975) отмечено, что МГК в присутствии воды может медленно преобразовываться до кальцита, но такая трансформация может быть обратимой, если в воде присутствует Mg. Таким образом, было найдено, что МГК, погруженный в озерную воду, должен постоянно трансформироваться, тогда как не погруженная в воду часть осадка должна быть стабильна. Нестабильность МГК по отношению к кальциту объясняет его отсутствие в древних отложениях. Для микробиолитов из оз. Лос-Сиснес характерно образование кристаллов МГК, которые сохраняются продолжительное время, чему может способствовать присутствие минерализованной пленки ЭПС вокруг кристаллов, а также высыхание микробиолитов при отступлении береговой линии.
ЗАКЛЮЧЕНИЕ
Несмотря на то, что содовые и соленые щелочные озера в геологическом масштабе времени представляют собой эфемерные образования, в настоящее время накоплено достаточно доказательств того, что они могли быть широко распространены в архее – раннем протерозое (Stüeken et al., 2015). Предполагается, что такие эпиконтинентальные экосистемы играли важную роль как в формировании, так и в сохранении алкалофильных микробных сообществ в ходе эволюции (гипотеза “содового континента” Г.А. Заварзина) (Заварзин, 1993). Наши результаты еще раз подтверждают невозможность образования таких геологических структур, как строматолиты и микробиолиты, без участия живых организмов даже в условиях, благоприятных для химического осаждения карбонатных минералов. На примере современных микробиолитов оз. Лос-Сиснес (Чили) мы показали, что в щелочных геохимических обстановках происходит биологически опосредованная органоминерализация, а развитие филогенетически и функционально разнообразного микробного сообщества имеет для осаждения карбонатных минералов принципиальное значение. Конкретные механизмы влияния биологической активности на осаждение карбонатных минералов (и в особенности МГК) в таких условиях до конца не понятны и требуют дальнейшего изучения.
* * *
Работа выполнена при поддержке Министерства науки и высшего образования РФ, гос. задания ФИЦ Биотехнологии РАН (№ 1021052204209-8) и ПИН РАН. Работа А.А. Прокина выполнена в рамках гос. задания Министерства науки и высшего образования РФ, тема № 121051100109-1. Авторы выражают искреннюю благодарность за личное участие и живой интерес, проявленный к данной работе, и помнят $\boxed{{\text{Б}}{\text{.Б}}{\text{. Кузнецова}}}$ (ФИЦ Биотехнологии РАН). Авторы также благодарны $\boxed{{\text{Б}}{\text{.К}}{\text{. Бумажкину}}}$ (ФИЦ Биотехнологии РАН) за участие в получении молекулярно-генетических данных. А.А. Прокин благодарит Р.В. Латынцева (ТюмГУ, г. Тюмень), К.И. Прокину (ИБВВ РАН, пос. Борок) и А.А. Пржиборо (ЗИН РАН, СПб.) за помощь в полевых исследованиях.
Список литературы
Булыгина Е.С., Кузнецов Б.Б., Марусина А.И. и др. Изучение нуклеотидных последовательностей nifH генов у представителей метанотрофных бактерий // Микробиология. 2002. Т. 71. № 4. С. 500–508.
Заварзин Г.А. Эпиконтинентальные содовые водоемы как предполагаемые реликтовые биотопы формирования наземной биоты // Микробиология. 1993. Т. 62. С. 789–800.
Нечипоренко Г.О., Бондаренко Г.П. Условия образования морских карбонатов. М.: Наука, 1988. 136 с.
Прокина К.И., Мыльников А.П. Гетеротрофные жгутиконосцы пресноводных и морских местообитаний Южной Патагонии и Огненной Земли (Чили) // Зоол. журн. 2018. Т. 97. № 12. С. 1439–1460.
Сапожников Д. Г., Цветков А. И. Осаждение гидросодержащего карбоната кальция на дне озера Иссык-Куль // Докл. АН СССР. 1959. Т. 124. С. 131–133.
Солотчина Э.П., Скляров Е.В., Вологина Е.Г. и др. Климатические сигналы в карбонатной осадочной летописи голоцена озера Намши-Нур, Западное Прибайкалье // Докл. Акад. наук. 2011. Т. 436. № 6. С. 814–819.
Страховенко В.Д., Солотчина Э.П., Восель Ю.С., Солотчин П.А. Геохимические факторы аутигенного минералообразования в донных отложениях озер Тажеранской системы (Прибайкалье) // Геол. и геофиз. 2015. Т. 56. № 10. С. 1825–1841.
Addadi L., Raz S., Weiner S. Using advantage of disorder: amorphous calcium carbonate and its roles in biomineralization // Adv. Mater. 2003. V. 15. № 12. P. 959–970. https://doi.org/10.1002/adma.200300381
Arp G., Reimer A., Reitner J. Calcification in cyanobacterial biofilms of alkaline salt lakes // Eur. J. Phycol. 1999. V. 34. P. 393–403. https://doi.org/10.1080/09670269910001736452
Arp G., Reimer A., Reitner J. Photosynthesis-induced biofilm calcification and calcium concentrations in Phanerozoic oceans // Science. 2001. V. 292. P. 1701–1704. https://doi.org/10.1126/science.1057204
Boros E., Kolpakova M. A review of the defining chemical properties of soda lakes and pans: an assessment on a large geographic scale of Eurasian inland saline surface waters // PLoS ONE. 2018. V. 13. № 8:e0202205. https://doi.org/10.1371/journal.pone.0202205
Bosak T., Newman D.K. Microbial nucleation of calcium carbonate in the Precambrian // Geology. 2003. V. 31. № 7. P. 577–580. https://doi.org/10.1130/0091-7613(2003)031<0577:MNOCCI >2.0.CO;2
Burne R.V., Moore L.S. Microbialites: organosedimentary deposits of benthic microbial communities // Palaios. 1987. V. 2. № 3. P. 241–254. https://doi.org/10.2307/3514674
Cartwright J.H.E., Checa A.G., Gale J.D. et al. Calcium carbonate polymorphism and its role in biomineralisation: How many ACCs are there? // Angew. Chem., Int. Ed. 2012. V. 51. P. 11960–11970. https://doi.org/10.1002/anie.201203125
Chagas A.A.P., Webb G.E., Burne R.V., Southam G. Modern lacustrine microbialites: Towards a synthesis of aqueous and carbonate geochemistry and mineralogy // Earth-Sci. Rev. 2016. V. 162. P. 338–363. https://doi.org/10.1016/j.earscirev.2016.09.012
Couradeau E., Benzerara K., Moreira D. et al. Prokaryotic and eukaryotic community structure in field and cultured microbialites from the alkaline lake Alchichica (Mexico) // PLoS ONE. 2011. V. 6. № 12:e28767. https://doi.org/10.1371/journal.pone.0028767
Decho A.W. Overview of biopolymer-induced mineralization: What goes on in biofilms? // Ecol. Engineering. 2009. V. 36. P. 137–144. https://doi.org/10.1016/j.ecoleng.2009.01.003
Farmer V.C. The infrared spectra of minerals. L.: Mineralogical Soc. of Great Britain and Ireland, 1974. 539 p.
Ferguson J., Bubela B., Davies P.J. Synthesis and possible mechanism of formation of radial carbonate ooids // Chemical Geoly. 1978. V. 22. P. 285–308. https://doi.org/10.1016/0009-2541(78)90037-2
Gérard E., De Goeyse S., Hugoni M. et al. Key role of Alphaproteobacteria and Cyanobacteria in the formation of stromatolites of Lake Dziani Dzaha (Mayotte, Western Indian Ocean) // Front. Microbiol. 2018. V. 9. Article 796. https://doi.org/10.3389/fmicb.2018.00796
Hadziavdic K., Lekang K., Lanzen A. et al. Characterization of the 18S rRNA gene for designing universal eukaryote specific primers // PLoS ONE. 2014. V. 9. № 2: e87624. https://doi.org/10.1371/journal.pone.0087624
Huber T., Faulkner G., Hugenholtz P. Bellerophon: A program to detect chimeric sequences in multiple sequence alignments // Bioinformatics. 2004. V. 20. P. 2317–2319. https://doi.org/10.1093/bioinformatics/bth226
Kempe S., Kazmierczak J. Soda lakes // Encyclopedia of Geobiology. Encyclopedia of Earth Sciences Series / Eds. Reitner J., Thiel V. Dordrecht: Springer, 2011. P. 824–829. https://doi.org/10.1007/978-1-4020-9212-1_191
Last F.M., Last W.M., Halden N.M. Carbonate microbialites and hardgrounds from Manito Lake, an alkaline, hypersaline lake in the northern Great Plains of Canada // Sed. Geol. 2010. V. 225. P. 34–49. https://doi.org/10.1016/j.sedgeo.2010.01.006
Lane D.J. 16S/23S sequencing // Nucleic Acid Techniques in Bacterial Systematics / Eds. Stackebrandt E., Goodfellow M. Chichester: John Wiley and Sons, 1991. P. 115–175.
López-García P., Kaźmierczak J., Benzerara K. et al. Bacterial diversity and carbonate precipitation in the giant microbialites from the highly alkaline Lake Van, Turkey // Extremophiles. 2005. V. 9. P. 263–274. https://doi.org/10.1007/s00792-005-0457-0
Meister P. Two opposing effects of sulfate reduction on carbonate precipitation in normal marine, hypersaline, and alkaline environments // Geology. 2013. V. 41. № 4. P. 499–502. https://doi.org/10.1130/G34185.1
Neuman M., Epple M. Monohydrocalcite and its relation to hydrate amorphous calcium carbonate in biominerals // Eur. J. Inorg. Chem. 2007. № 14. P. 1953–1957. https://doi.org/10.1002/ejic.200601033
Nishiyama R., Munemoto T., Fukushi K. Formation condition of monohydrocalcite from CaCl2–MgCl2–Na2CO3 solutions // Geochim. Cosmochim. Acta. 2013. V. 100. P. 217–231. https://doi.org/10.1016/j.gca.2012.09.002
Perri E., Tucker M.E., Słowakiewicz M. et al. Carbonate and silicate biomineralization in a hypersaline microbial mat (Mesaieed sabkha, Qatar): Roles of bacteria, extracellular polymeric substances and viruses // Sedimentology. 2017. V. 65. № 4. P. 1213–1245. https://doi.org/10.1111/sed.12419
Petrash D.A., Bialik O.M., Bontognali T.R.R. et al. Microbially catalyzed dolomite formation: from near-surface to burial // Earth-Sci. Rev. 2017. V. 171. P. 558–582. https://doi.org/10.1016/j.earscirev.2017.06.015
Purgstaller B., Goetschl K., Mavromatis V., Dietzel M. Solubility investigations in the amorphous calcium magnesium carbonate system // CrystEngComm. 2019. V. 21. P. 155–164. https://doi.org/10.1039/c8ce01596a
Rabassa J., Coronato A., Bujalesky G. et al. Quaternary of Tierra del Fuego, Southernmost South America: an updated review // Quatern. Intern. 2000. V. 68–71. P. 217–240. https://doi.org/10.1016/S1040-6182(00)00046-X
Rodriguez-Blanco J.D., Shaw S., Bots P. et al. The role of Mg in the crystallization of monohydrocalcite // Geochim. Cosmochim. Acta. 2014. V. 127. P. 204–220. https://doi.org/10.1016/j.gca.2013.11.034
Sanz-Montero M.E., Cabestero O., Sanchez-Roman M. Microbial Mg-rich carbonates in an extreme alkaline lake (Las Eras, Central Spain) // Frontiers in Microbiol. 2019. V. 10. Article 148. https://doi.org/10.3389/fmicb.2019.00148
Solari M. Estromatolitos y trombolitos de Laguna de Los Cisnes, Tierra del Fuego, Chile. Departamento de Geología Básica. 2015. 18 p.
Stüeken E.E., Buick R., Schauer A.J. Nitrogen isotope evidence for alkaline lakes on late Archean continents // Earth Planet. Sci. Lett. 2015. V. 411. P. 1–10. https://doi.org/10.1016/j.epsl.2014.11.037
Swainson I.P. The structure of monohydrocalcite and the phase composition of the beachrock deposits of Lake Butler and Lake Fellmongery, South Australia // Amer. Mineral. 2008. V. 93. P. 1014–1018. https://doi.org/10.2138/am.2008.2825
Tamura K., Stecher G., Peterson D. et al. MEGA6: molecular evolutionary genetics analysis version 6.0 // Mol. Biol. Evol. 2013. V. 30. № 12. P. 2725–2729. https://doi.org/10.1093/molbev/mst197
Tarazona D., Montoya H., Astocóndor M.M., Mayta E. Picocystis salinarum (Prasinophyceae, Chlorophyta) en las Salinas de Chilca, Lima, primer registro para el Perú // Arnaldoa. 2017. V. 24. № 2. P. 557–566. https://doi.org/10.22497/arnaldoa.242.24208
Taylor G.F. The occurrence of monohydrocalcite in two small lakes in the south-east of South Australia // Amer. Mineral. 1975. V. 60. № 7–8. P. 690–697.
Vasconcelos C., McKenzie J.A. Microbial mediation of modern dolomite precipitation and diagenesis under anoxic conditions (Lagoa Vermelha, Rio de Janeiro, Brazil) // J. Sediment. Res. 1997. V. 67. P. 378–390. https://doi.org/10.1306/D4268577-2B26-11D7-8648000102C1865D
Wang Y.-Y., Yao Q.-Z., Zhou G.-T., Fu S.-Q. Transformation of amorphous calcium carbonate into monohydrocalcite in aqueous solution: A biomimetic mineralization study // Eur. J. Mineral. 2015. V. 27. P. 717–729. https://doi.org/10.1127/ejm/2015/0027-2486
Zhu T., Dittrich M. Carbonate precipitation through microbial activities in natural environment, and their potential in biotechnology: A Review // Front. Bioeng. Biotechnol. 2016. V. 4. Article 4. https://doi.org/10.3389/fbioe.2016.00004
Дополнительные материалы отсутствуют.
Инструменты
Палеонтологический журнал


