Палеонтологический журнал, 2023, № 4, стр. 74-93
Некоторые морфофункциональные особенности хвоста ранних архозавров в связи с адаптацией к плаванию
А. Г. Сенников *
Палеонтологический институт им. А.А. Борисяка РАН
117647 Москва, Россия
* E-mail: sennikov@paleo.ru
Поступила в редакцию 06.06.2022
После доработки 26.01.2023
Принята к публикации 26.01.2023
- EDN: OHNYPH
- DOI: 10.31857/S0031031X23040104
Аннотация
У древних и современных водных и полуводных тетрапод представлено несколько типов строения локомоторного аппарата, обеспечивающего различные стили плавания. При адаптации к плаванию важную роль играли морфологические преобразования хвоста, часто выполняющего основную пропульсивную функцию. Современные рептилии (кроме черепах) плавают преимущественно с помощью горизонтальных изгибов хвоста, тогда как млекопитающие – или вертикальных, или горизонтальных. Среди вымерших рептилий завроптеригии, вероятно, использовали вертикальную подвижность хвоста при плавании. У большинства архозавроморф хвост становился высоким, сжатым с боков, и они плавали преимущественно с помощью его горизонтальных движений. Среди ранних архозавров протерохампсии и досвеллииды отличаются широким и дорсовентрально уплощенным хвостом, что может указывать на адаптацию к плаванию с использованием его вертикальной подвижности.
ВВЕДЕНИЕ
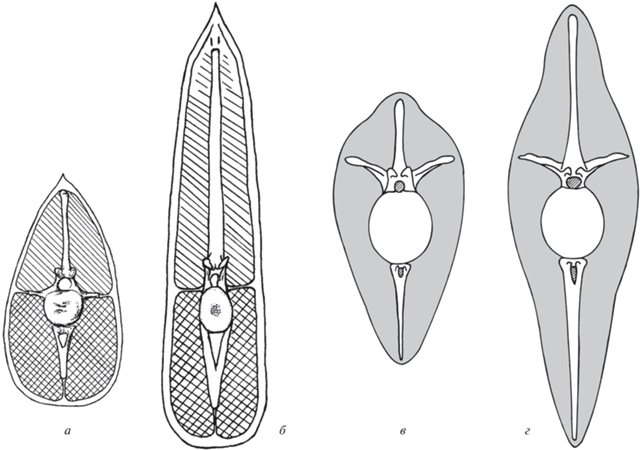
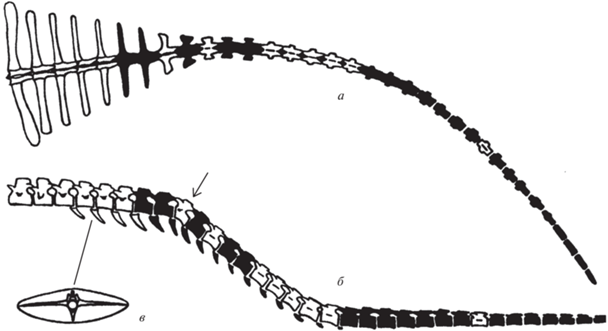
При переходе к полуводному и водному образу жизни рептилий и млекопитающих адаптация локомоторного аппарата к плаванию сопровождалась морфологическими и функциональными преобразованиями. Характер и направленность этих преобразований зависели от разного стиля плавания в различных группах. У водных и полуводных тетрапод при плавании для пропульсии и маневрирования могут использоваться конечности и хвост, претерпевающие определенные морфологические и функциональные преобразования. При анализе действия локомоторного аппарата водных тетрапод и, в частности, рептилий, как правило, обсуждаются функциональная морфология и биомеханика их конечностей, в той или иной степени преобразованных в ласты. Гораздо меньшее внимание уделяется хвосту, который по форме и функции преобразуется и существенно отличается у разных групп, играя у многих из них ведущую роль в водной локомоции. Строение хвоста существенно различается у групп, использующих преимущественно вертикальные (рис. 1, а–в) или горизонтальные (рис. 1, г–ж) движения хвоста при плавании.
Рис. 1.
Сравнение морфологии хвоста тетрапод, плавающих с помощью его вертикальных (а–в) и горизонтальных (г–ж) изгибов: а–в – американский ламантин Trichehus manatus: а, б – второй поясничный позвонок (по: Ламатин …, 1986): а – вид с краниальной стороны, б – вид с дорсальной стороны; в – поперечный разрез середины хвоста (по: Gregory, 1951); г, д – протоцератопид Bagaceratops sp.: г – среднехвостовой позвонок, вид с латеральной (левой) стороны, д – поперечный разрез середины хвоста; е – поперечный разрез середины хвоста крокодила Alligator mississippiensis; ж – поперечный разрез середины хвоста гигантской саламандры Megalobatrachus japonicus (г–ж – по: Терещенко, 2008).
ОСОБЕННОСТИ МОРФОЛОГИИ ХВОСТА ПОЛУВОДНЫХ И ВОДНЫХ ТЕТРАПОД
У наземных рептилий (как и млекопитающих) хвост, как правило, в поперечном сечении почти круглый, равномерно утончается к концу. Остеологические признаки, характеризующие такую форму хвоста, следующие. Высота остистых отростков и гемальных дуг хвостовых позвонков примерно равны длине поперечных отростков. При этом остистые отростки передне- и среднехвостовых позвонков обычно ниже таковых туловищных. Спереди назад высота остистых отростков, гемальных дуг и длина поперечных отростков равномерно уменьшается, так что позвонки заднехвостового отдела их лишены. Наиболее ярко это проявляется у наземных рептилий с длинным хвостом, кончик которого имеет хлыстообразную форму.
У всех вторичноводных тетрапод (рептилий и млекопитающих) хвост преобразуется. Вместо равномерного уменьшения спереди назад высоты остистых отростков и гемальных дуг и длины поперечных отростков и исчезновения их в конечном отделе хвоста, остистые отростки, гемальные дуги и поперечные отростки могут изменяться от переднехвостовых к заднехвостовым позвонкам неравномерно, и часто сохраняются до конца хвоста. Во многих случаях величина остистых отростков и гемальных дуг или поперечных отростков максимальна не в передней, а в средней части хвоста. На участках между крестцом и хвостом и между средним и конечным отделом хвоста может возникать антиклиния – встречный наклон тех или иных отростков. Эти участки являются зонами особой подвижности в позвоночнике. Кроме того, у вторичноводных тетрапод, использующих хвост как основной орган пропульсии, он становится более мощным и обычно более длинным.
Современные амфибии (кроме бесхвостых) и рептилии (кроме черепах) при плавании используют горизонтальные волнообразные изгибы хвоста. Среди современных морских и пресноводных рептилий (Williston, 1914) змеи, ящерицы и крокодилы плавают, используя латеральную гибкость туловища и хвоста, который является у них основным органом поступательного движения при плавании, а конечности играют второстепенную роль или отсутствуют (у змей). Хвост этих пресмыкающихся длинный, мощный, высокий и сжатый с боков, с чешуйчатым гребнем или кожистой оторочкой по большей части его длины. Остеологические признаки, характеризующие такую форму хвоста, – увеличение высоты остистых отростков хвостовых позвонков и гемальных дуг (рис. 1, г–ж; 2; 3). Остистые отростки передне- и среднехвостовых позвонков, как правило, превышают по высоте таковые туловищных. Поперечные отростки хвостовых позвонков у них относительно короткие, короче остистых отростков и гемальных дуг, уменьшаются по длине спереди назад и обычно изчезают посередине длины хвоста. Высота остистых отростков и гемальных дуг хвостовых позвонков не уменьшается равномерно спереди назад, но даже увеличивается в среднем отделе хвоста. Остистые отростки и гемальные дуги в заднем отделе хвоста не исчезают, но обычно сохраняются, даже почти до его конца, иногда достигая значительной высоты (рис. 2, 3). Кроме того, высота хвоста может становиться существенно больше за счет мягких тканей, образующих вертикальный гребень или оторочку по верхней и нижней стороне хвоста, как, например, у крокодилов (рис. 1, е) или ряда хвостатых амфибий (рис. 1, ж) (Терещенко, 2008). Это увеличивает высоту и общую площадь рабочей боковой поверхности хвоста, используемой при плавании с помощью его горизонтальных изгибов – в основном, площадь наиболее эффективных среднего и особенно заднего отделов, движущихся с наибольшей амплитудой. Следует подчеркнуть, что плавание с ведущей ролью горизонтальной подвижности обеспечивается именно таким строением хвоста. Этот тип плавания, вероятно, является исходным для водных рептилий. Его использовали, очевидно, древнейшие рептилии, вторично освоившие водную среду обитания, в т.ч., морские биотопы – мезозавры (Mesosauria), талаттозавры (Thalattosauria), хупехзухии (Hupehsuchia), плеврозавры (Pleurosauridae) и другие (Сенников, 2018). Все они имели мощный, длинный, высокий и сжатый с боков хвост, с высокими остистыми отростками и гемальными дугами. Для ископаемых форм такой высокий и сжатый с боков хвост обычно рассматривается как указание на водный образ жизни и приспособление к плаванию.
Рис. 2.
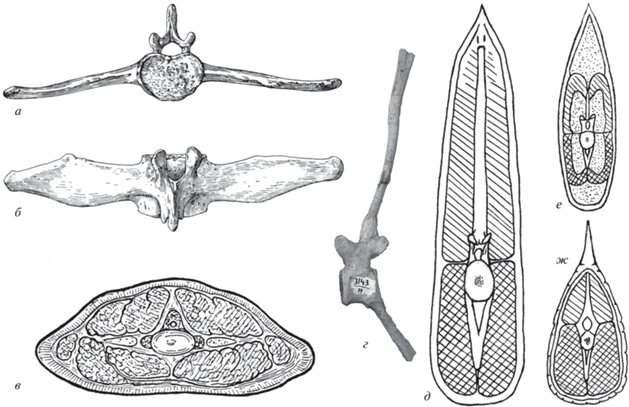
Крокодил Alligator mississippiensis, экз. б/н, Зоол. ин-т РАН, С.-Петербург, Россия, хвостовой отдел позвоночника в естественном сочленении, не полностью очищенный от мягких тканей: а – вид с правой стороны, б – вид с вентральной стороны. Фото Е.А. Сенниковой.

Рис. 3.
Крокодил Alligator mississippiensis, экз. № ЭФ 2341, Зоол. музей МГУ, Москва, Россия, средняя и задняя часть хвостового отдела позвоночника: а – вид с правой стороны, б – вид с дорсальной стороны. Фото Е.А. Сенниковой.

У сильно специализированных мезозойских морских рептилий – ихтиозавров (Sander, 2000; Motani, 2005 и др.), морских крокодилов (Young et al., 2010 и др.) и мозазавров (Lindgren et al., 2010, 2013 и др.) поступательное движение также производилось движениями хвоста в горизонтальной плоскости. Мощный, длинный, высокий и сжатый с боков хвост играл у них основную роль в пропульсии, а конечности – дополнительную роль. Отличительная черта этих специализированных морских форм – обособленный вертикальный терминальный плавник на конце хвоста, известный по экземплярам с сохранившимися отпечатками мягких тканей. У всех ихтиозавров, морских крокодилов и мозазавров в конце хвоста выделяется особый отдел, отогнутый в той или иной степени вниз, где последние хвостовые позвонки видоизменены, укорочены, сжаты с боков. Этот отогнутый вниз отдел хвоста и поддерживал терминальный хвостовой плавник. Формирование терминального хвостового плавника обеспечивало максимальное смещение назад и наиболее эффективное расположение основной рабочей плоскости на конечном отделе хвоста. Отклонение вниз участка позвоночника в конце хвоста, очевидно, является остеологическим признаком вертикального обратно-гетероцеркального (гипоцеркального) хвостового плавника и необходимым условием для его развития.
У водных и полуводных млекопитающих при плавании хвост может двигаться или в горизонтальной, или в вертикальной плоскости, причем в первом случае он высокий и сжатый с боков, а во втором — становится широким и плоским (сжатым дорсовентрально). Ряд полуводных зверей плавает, используя горизонтальные изгибы хвоста, например, выдровая землеройка (Potomogale), выхухоль (Desmana), ондатра (Ondatra) и др. Хвост у таких форм бывает несколько уплощен с боков (Fish, 1982; Ивлев и др., 2010; Fish et al., 2021). Другие демонстрируют при плавании и, особенно, при нырянии вертикальные изгибы хвоста; например, утконос (Ornithorhynchus) (Howell, 1937) и бобр (Castor) (Лавров, 1981; Мордвинов, 1984; Fish et al., 2021), хвост у которых короткий, мощный, широкий и плоский (рис. 4, 5). Представители подсемейства выдр тоже имеют в большей или меньшей степени дорсовентрально уплощенный, длинный и мощный хвост. Эта особенность максимально выражена у гигантской (бразильской) выдры (Pteronura) (рис. 6), что также связано с вертикальной подвижностью хвоста при плавании (Fish, 1994; Thewissen, Fish, 1997; Fish et al., 2021). Примеры этих полуводных млекопитающих подтверждают обусловленность такой формы хвоста его действием при плавании в вертикальной плоскости. Остеологические признаки, характеризующие хвост всех этих форм – относительно низкие остистые отростки и гемальные дуги и удлиненные, расширенные поперечные отростки хвостовых позвонков, сохраняющиеся до конца хвоста (рис. 7). В то же время, остистые отростки и гемальные дуги уменьшаются в высоте и могут исчезать посередине или в заднем отделе хвоста.
Рис. 4.
Бобр Castor fiber, экз. № ЭФ 2366, Зоол. музей МГУ, Москва, Россия, хвостовой отдел позвоночника: а – вид с правой стороны, б – вид с дорсальной стороны. Фото Е.А. Сенниковой.
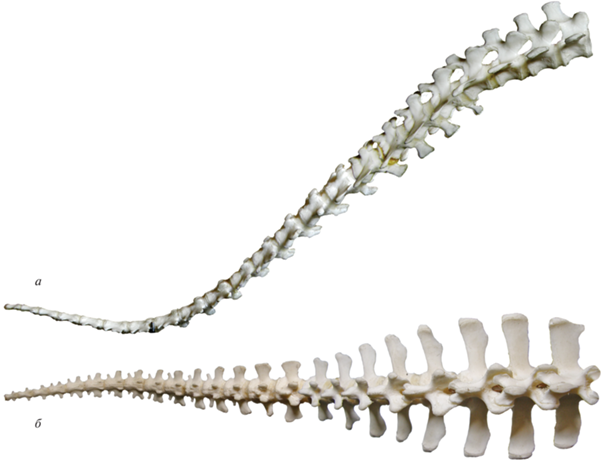
Рис. 5.
Утконос Ornithorhynchus anatinus: а, б – хвостовой отдел позвоночника: а – экз. № ЭФ 2778, Зоол. музей МГУ, Москва, Россия, вид с правой стороны, фото Е.А. Сенниковой, б – экз. № A1554, Музей Хорнимана, Лондон, Великобритания, вид с вентральной стороны, фото Е.А. Сенниковой; в – задняя часть тела (рентгеновский снимок), видно соотношение хвостового отдела позвоночника и мягких тканей, по: https://anatomytoyou.com/2016/05/03/platypus-x-rays-show-its-reptilian-history/.
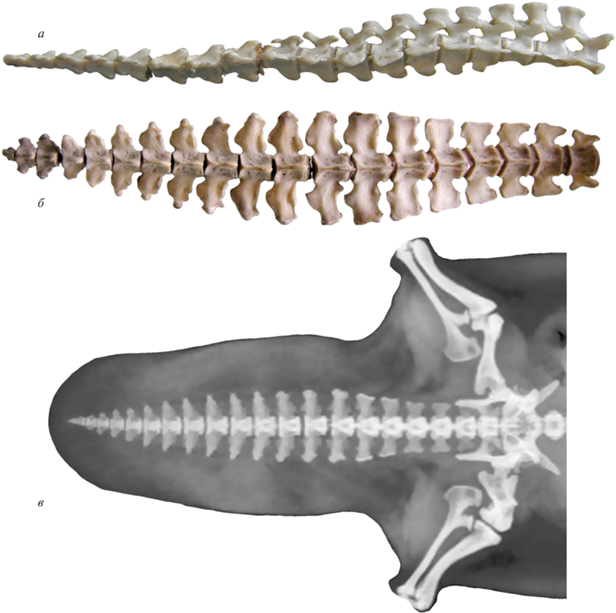
Рис. 6.
Бразильская выдра Pteronura brasiliensis, экз. MNHN-ZM-AC-A1918, Музей Естественной истории, Париж, Франция, хвостовой отдел позвоночника: а – вид с правой стороны, б – вид с дорсальной стороны. Фото Ж. Верон (Geraldine Veron, Paris).
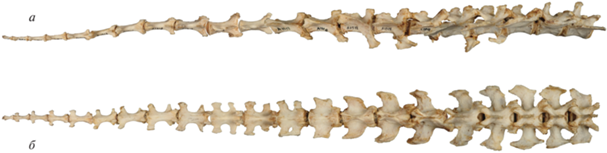
Рис. 7.
Хвостовой отдел позвоночника: а – утконос Ornithorhynchus anatinus, экз. № A1554, Музей Хорнимана, Лондон, Великобритания, вид с вентральной стороны, фото Е.А. Сенниковой; б – бобр Castor fiber, экз. № ЭФ 2366, Зоол. музей МГУ, Москва, Россия, вид с дорсальной стороны, фото Е.А. Сенниковой; в – бразильская выдра Pteronura brasiliensis, экз. MNHN-ZM-AC-A1918, Музей естественной истории, Париж, Франция, вид с дорсальной стороны, фото Ж. Верон (Geraldine Veron, MNHN, Paris).
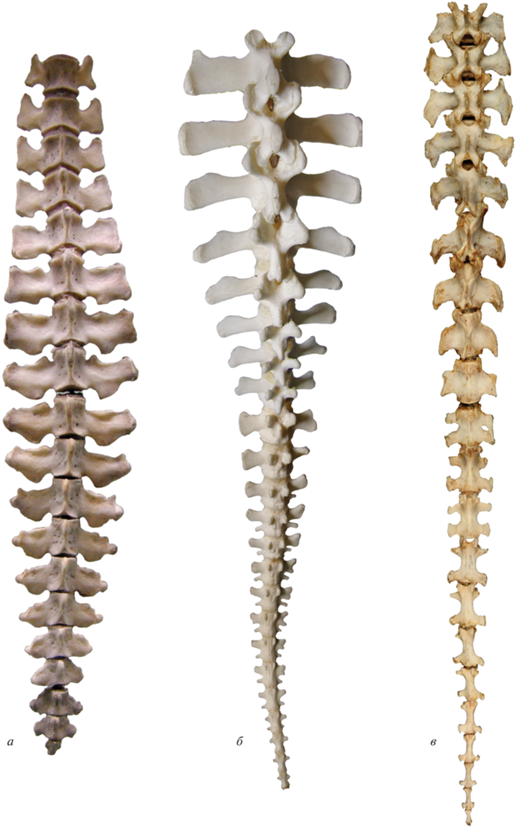
Специализированные морские млекопитающие – китообразные и сирены – также плавают, используя вертикальные изгибы хвоста. Хвост у них длинный, мощный, в передней и средней части широкий и уплощенный дорсовентрально за счет относительно низких остистых отростков и гемальных дуг и длинных поперечных отростков передне- и среднехвостовых позвонков, что наиболее выражено у сирен (рис. 1, а–в; 8; 9, а–в) (Ламантин…, 1986; Buchholtz et al., 2007). При этом высота остистых отростков передне- и среднехвостовых позвонков может быть меньше, чем туловищных. Расширенные поперечные отростки позвонков сохраняются почти до конца хвостового отдела позвоночника. В конце хвоста у китообразных и сирен выделяется особый отдел из укороченных консолидированных позвонков, поддерживающий горизонтальный терминальный плавник.
Хотя среди современных пресмыкающихся нет форм, плавающих с помощью вертикальных движений хвоста, это можно предположить для некоторых ископаемых групп рептилий, исходя из строения хвостового отдела позвоночника, сходного с таковым у млекопитающих, использующих вертикальную подвижность хвоста при плавании. Дополнительные аргументы в пользу такого предположения дают данные палеоихнологии и образцы с сохранившимися отпечатками мягких тканей.
Особенности морфологии позвонков и их сочленений обуславливают характер подвижности между ними (Терещенко, 1991; Кузнецов, Терещенко, 2010) и, в частности, могут указывать на использование преимущественно вертикальных или горизонтальных изгибов хвоста при плавании. Если передняя сочленовная поверхность тела позвонка не равна задней поверхности предыдущего позвонка, то это может говорить о большей подвижности между такими позвонками по сравнению с позвонками, у которых эти поверхности одинаковой величины. Степень и направление возможных смещений соседних позвонков друг относительно друга в значительной степени определяется положением, размерами и формой пре- и постзигапофизов и их фасеток. В передней части хвоста зигапофизы присутствуют, но в задней редуцируются (рис. 3–6, 8). Можно предположить, что относительно более вертикальное расположение и сближенность между собой левой и правой фасеток свидетельствует о преобладании вертикальной подвижности, а более горизонтальное положение и большая ширина фасеток – о преобладании горизонтальной подвижности. В первом случае фасетки зигапофизов из-за своей ориентации ограничивают размах поворотов соседних позвонков друг относительно друга в горизонтальной плоскости и дают большую возможность для вертикальных, а во втором – наоборот, ограничивают взаимную подвижность в вертикальной плоскости и обеспечивают больший размах для горизонтальных поворотов. Больший размер и неравенство фасеток пре- и постзигапофизов делает возможным более широкий размах движений одного позвонка относительного другого.
Рис. 8.
Африканский ламантин Trichehus senegalensis, экз. № 09-5-240, Национальный музей Уэльса, Кардифф, Уэльс, хвостовой отдел позвоночника: а — вид с правой стороны, б — вид с дорсальной стороны. Фото Е.А. Сенниковой.

Как и у полуводных и водных млекопитающих, использующих вертикальную подвижность хвоста при плавании, у ряда вымерших рептилий, например, завроптеригий хвост был широким, дорсовентрально уплощенным за счет увеличения длины поперечных отростков хвостовых позвонков (Sennikov, 2015, 2019; Сенников, 2018). Высота остистых отростков передне- и среднехвостовых позвонков у них меньше, чем у туловищных. По всей длине хвоста у таких форм длина поперечных отростков больше высоты остистых отростков и гемальных дуг. В переднем и среднем отделах хвоста поперечные отростки часто бывают плоскими и широкими в передне-заднем направлении, сближаясь между собой, иногда даже соприкасаясь (рис. 9). Такое строение поперечных отростков у современных млекопитающих, а именно сирен, ограничивает боковые изгибы хвоста в его переднем и среднем отделах, что, очевидно, было справедливо и для ископаемых рептилий с подобной морфологией этих отростков (Renesto, 2005; Renesto, Saller, 2018). Длина поперечных отростков хвостовых позвонков у таких рептилий, как и у млекопитающих с широким и плоским хвостом, действующим при плавании в вертикальной плоскости, не уменьшается равномерно спереди назад, но у некоторых даже увеличивается в среднем отделе хвоста (аналогично тому, что наблюдается у утконоса). Поперечные отростки в заднем отделе хвоста этих млекопитающих и вымерших рептилий обычно сохраняются, часто даже почти до его конца, иногда достигая значительной длины (рис. 4–9). Это увеличивает ширину и общую площадь горизонтальной проекции хвоста, в основном площадь наиболее эффективных среднего и, особенно, заднего отделов, отгибающихся вверх-вниз с наибольшей амплитудой. Ширина хвоста обычно существенно увеличивается еще и за счет мягких тканей, что видно, например, у утконоса (рис. 5, в), бобра или мелового плезиозавра Mauriciosaurus fernandezi (Frey et al., 2017).
Рис. 9.
Хвостовой отдел позвоночника, вид с дорсальной стороны: а – дюгонь Dugong dugon (по: Buchholtz et al., 2007); б – африканский ламантин Trichehus senegalensis, экз. № 09-5-240, Национальный музей Уэльса, Кардифф, Уэльс, фото Е.А. Сенниковой; в – стеллерова корова Hydrodamalis gigas, экз. № ЭФ 2756, Зоол. музей МГУ, Москва, Россия, фото А.Г. Сенникова; г – нотозавр Brevicaudosaurus jiyangshanensis (по: Shang et al., 2020); д – плезиозавр Brancasaurus brancai (по: Sachs et al., 2016); е – плезиозавр Cryptoclidus oxoniensis (по: Wilhelm, 2010).
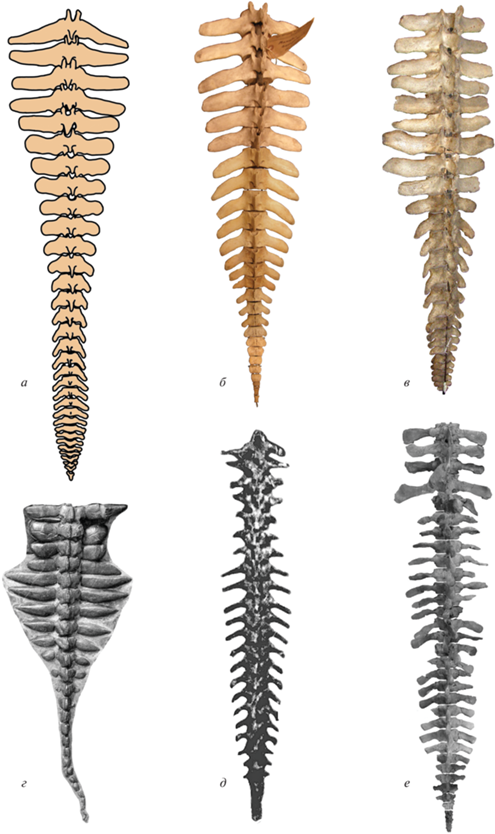
Современные крокодилы и ящерицы, плавающие с помощью боковых изгибов хвоста, обладают мощным m. caudofemoralis longus. В связи с этим длина поперечных отростков передне- и среднехвостовых позвонков, где крепится этот мускул, может быть достаточно большой, хотя и при незначительной ширине в передне-заднем направлении, а хвост в основании может быть довольно массивным и широким. Однако у них налицо все остальные вышеперечисленные остеологические признаки, обуславливающие большую высоту и сжатость хвоста с боков в его средней и задней части. В первую очередь, следует отметить сохранение и даже увеличение высоты остистых отростков и гемальных дуг, сохраняющихся почти до самого конца хвоста, а также уменьшение и исчезновение поперечных отростков в среднем и заднем отделах хвоста (рис. 2, 3). Это создает вертикальную гребную лопасть в среднем и заднем отделе хвоста, используемую при плавании с помощью его горизонтальных изгибов. Поэтому для ископаемых рептилий необходимо учитывать все признаки в поисках решения вопроса о преимущественно горизонтальных или вертикальных движениях хвоста при плавании. Как и современные млекопитающие, плавающие с помощью вертикальных движений хвоста, некоторые вымершие рептилии обладают сходным комплексом вышеперечисленных остеологических признаков, в первую очередь, сохранением и даже увеличением длины поперечных отростков и уменьшением и исчезновением остистых отростков и гемальных дуг в средней и задней части хвоста. Это позволяет реконструировать их хвост в качестве единой дорсовентрально уплощенной гребной лопасти или обособленного горизонтального терминального хвостового плавника. Предположение, что за счет мягких тканей высота хвоста у таких рептилий становилась больше ширины, кажется невероятным, так как у современных полуводных и водных тетрапод мягкие ткани наращивают высоту или ширину хвоста в направлении, заданном пропорциями отростков хвостовых позвонков и гемальных дуг.
Кроме того, для рептилий с широким и горизонтально уплощенным хвостом реконструируются (плезиозавры) или предполагаются по палеоихнологическим данным (нотозавры, плакодонты, танистрофеиды) синхронные взмахи задними конечностями при плавании, что, очевидно, связано с вертикальной гибкостью позвоночника и вертикальными движениями хвоста. В таком случае правый и левый m. caudofemoralis longus этих рептилий, очевидно, также сокращались синхронно, и опускали хвост в вертикальной плоскости. Однако рассмотрение возможного действия мускулатуры при движении хвоста требует дальнейших исследований.
Были высказаны предположения о плавании с помощью вертикальных изгибов хвоста, в первую очередь, плезиозавров (Fraas, 1910; Wegner, 1914; Sennikov, 2015, 2019; Sachs et al., 2016; Сенников, 2018; Otero et al., 2018), нотозавров и пистозавров (Sennikov, 2015, 2019; Сенников, 2018), плакодонтов (Pinna, Nosotti, 1989; Renesto, Tintori, 1995; Сенников, 2018; Sennikov, 2019), т.е., практически всех завроптеригий, кроме, возможно, наиболее базальных форм, таких, как пахиплеврозавры (Sennikov, 2015, 2019; Сенников, 2018). Родственные плакодонтам Eusaurosphargis и Largocephalosaurus (Scheyer et al., 2017) с очень широким и плоским хвостом также плавали, скорее всего, с помощью вертикальных изгибов хвоста. Открытие следов и следовых дорожек морских рептилий Dikoposichnus, вероятно, оставленных нотозаврами, плакодонтами или их родственниками, с синхронной опорой на дно передними конечностями (Zhang et al., 2014; Xing et al., 2020), является дополнительным аргументом в пользу нетипичного для пресмыкающихся использования вертикальной флексии позвоночника при плавании.
У плезиозавров, наиболее специализированных к жизни в море, подобно сиренам и китообразным, поперечные отростки позвонков в самом конце хвоста исчезают, что, по-видимому, связано с формированием “пигостиля” как опоры терминального горизонтального хвостового плавника. Тем самым обеспечивается максимальное смещение назад, в наиболее эффективное положение, основной рабочей плоскости (Sennikov, 2015, 2019; Сенников, 2018). Наибольшее сходство по строению хвостового отдела позвоночника плезиозавры обнаруживают с ламантином и другими сиренами (Sennikov, 2015, 2019; Сенников, 2018; Otero et al., 2018) (рис. 9). Горизонтальный хвостовой плавник у плезиозавров, известный по единственному отпечатку, был, скорее всего, как и у ламантина, ромбической формы (Сенников, 2018; Otero et al., 2018; Sennikov, 2019).
Подобно водным млекопитающим с плоским и широким хвостом, плавающим с помощью его вертикальных изгибов, для вымерших рептилий с подобным хвостом не были исключены его горизонтальные повороты при плавании, например, для маневрирования. Но горизонтальная подвижность хвоста не являлась для всех них основной при поступательном плавании.
НЕКОТОРЫЕ АДАПТАЦИИ АРХОЗАВРОМОРФ К ПЛАВАНИЮ
Нам известно не так много специализированных водных архозавров, и еще меньше – морских. Это, возможно, было обусловлено тем, что архозавры – наиболее успешная в эволюционном и экологическом плане группа рептилий, занявшая господствующее положение на суше в мезозое. Многие другие группы мезозойских пресмыкающихся перешли к водному образу жизни в основном в результате конкурентного вытеснения из наземных биотопов более успешными и продвинутыми сухопутными рептилиями, в первую очередь, именно архозаврами.
Многие водные архозавроморфы имели высокий и сжатый с боков хвост и, следовательно, плавали с помощью его горизонтальной подвижности. Это ряд водных эозухий, таких, как Hovasaurus, Tangasaurus (Currie, 1981) (рис. 10, а, б) и другие. Среди пролацертилий пермский Protorosaurus также имел высокие остистые отростки и гемальные дуги хвостовых позвонков, т.е., высокий хвост, и, вероятно, использовал при плавании его горизонтальные движения.
Рис. 10.
а – Эозухия Tangasaurus sp., среднехвостовой позвонок, вид с краниальной стороны, экз. № 990, Зоол. музей, Кэмбридж, Великобритания, фото Е.А. Сенниковой; б – эозухия Hovasaurus boulei, хвостовой отдел позвоночника, вид с левой стороны (по: Currie, 1981); в, г – хористодера Champsosaurus laramiensis, хвостовой отдел позвоночника: в – вид с левой стороны, г – вид с дорсальной стороны (по: Brown, 1905); д, е – хористодера Irenosaurus egloni, экз. ПИН, № 3386/2-11, переднехвостовой позвонок: д – вид с краниальной стороны, е – вид с дорсальной стороны, фото Е.А. Сенниковой.

В то же время, cреди ранних архозавроморф вертикальные движения хвоста при плавании, вероятно, использовали морские, сходные с завроптеригиями эозухии Claudiosaurus (McMenamin, 2019), а также водные пролацертилии – танистрофеиды (Renesto, 2005; Sennikov, 2015, 2019; Renesto, Saller, 2018), имевшие широкий и плоский в его передней части хвост. Находки следов Gwyneddichnium, относимых к танистрофеидам, скорее всего, к Tanytrachelos, с синхронной опорой на дно задними конечностями, являются важным аргументом, подтвержающим использование ими при плавании вертикальной гибкости позвоночника (Renesto, Saller, 2018). Удлинение поперечных отростков переднехвостовых позвонков наблюдается уже у близкого к танистрофеидам Macrocnemus, что может указывать на переход к вертикальной подвижности хвоста при плавании.
Хористодеры имели очень широкое дорсовентрально уплощенное тело, иммобилизованное пахиостозными грудными ребрами и массивным каркасом из расширенных брюшных ребер, соприкасающихся между собой (Erikson, 1985). Такое строение туловища ограничивало его латеральную и вертикальную гибкость. У некоторых хористодер поперечные отростки переднехвостовых позвонков длиннее, чем остистые отростки и гемальные дуги – например, у Champsosaurus (рис. 10, в, г) (Brown, 1905; Russell, 1956; Erikson, 1972, 1987) и у Irenosaurus, т.е., хвост в передней части у них был широкий и плоский, как и их туловище. Кроме того, пре- и постзигапофизы переднехвостовых позвонков Simoedosaurus, Champsosaurus (Erikson, 1972, 1987), Irenosaurus (рис. 10, д, е) и других хористодер очень узко поставлены: левые и правые сильно сближены, плоскости их фасеток расположены почти парасагиттально. Между презигапофизами остается лишь небольшая вертикальная щель, в которую входят постзигапофизы предыдущего позвонка. Это делало возможной в основном вертикальную подвижность и ограничивало горизонтальную, т.е., при плавании хористодеры должны были использовать вертикальные движения в основании хвоста. Однако в средней части хвоста у Champsosaurus (Erikson, 1985) и у Khurendukhosaurus (Matsumoto et al., 2009) остистые отростки чуть длинее поперечных, т.е., в этой части хвост был немного сжатым с боков, что может быть признаком горизонтальной подвижности хвоста при водной локомоции, как и сохранение остистых отростков и гемальных дуг в заднем отделе хвоста. Поэтому вопрос об использовании преимущественно вертикальных или горизонтальных изгибов хвоста у хористодер при плавании остается открытым и требует дальнейшего изучения.
Большинство архозавров, которые, по всей видимости, вели полуводный или водный образ жизни, имело высокий, сжатый с боков хвост с высокими остистыми отростками и гемальными дугами, и использовало при плавании его горизонтальные движения. Из ранних архозавров (текодонтов) можно привести паразухий, Vancleavea, Qianosuchus и Litorosuchus (Li et al., 2006, 2016; Nesbitt et al., 2009; Heckert et al., 2021 и др.) (рис. 11, а, б). Если паразухии и Vancleavea были обитателями континентальных водоемов, то Qianosuchus и Litorosuchus найдены в морских отложениях. Даже преимущественно наземные текодонты – эритрозухиды, рауизухиды, попозавриды и другие – имели довольно узкий и высокий хвост. Современные крокодилы, перешедшие к полуводному образу жизни, имеют высокий, сжатый с боков хвост (рис. 2, 3) и плавают с помощью его горизонтальных изгибов. Это справедливо и для всех ископаемых представителей этого отряда (рис. 11, в). Даже у нотозухий и себекозухий, наиболее наземных среди крокодилов, хвост был достаточно высоким, и они плавали с помощью его горизонтальных движений. У морских, чисто водных талаттозухий обособляется вертикальный терминальный хвостовой плавник (Sennikov, 2015, 2019; Сенников, 2018). Динозавры при плавании, очевидно, также использовали горизонтальные изгибы хвоста. Для спинозаврид, Ceratosaurus, гадрозаврид, игуанодонтид и ряда протоцератопид (Brown, 1916; Brown, Schlaikjer, 1942; Madsen, 1976; Taquet, 1976; Терещенко, 2008; Ibrahim et al., 2020 и др.) явным указанием на такой способ водной локомоции является форма хвоста – высокого и сжатого с боков, с очень высокими остистыми отростками и гемальными дугами хвостовых позвонков (рис. 11, г–е). Это подтверждается и следовыми дорожками плавающих динозавров, касавшихся дна попеременно левыми и правыми конечностями (Ezquerra et al., 2007; Xing et al., 2013 и др.).
Рис. 11.
Хвостовой отдел позвоночника, вид с правой стороны: а – протерозухия Litorosuchus somnii (по: Li et al., 2016); б – паразухия Smilosuchus gregorii (по: Heckert et al., 2021); в – крокодил Congosaurus bequaerti (по: Schwarz-Wings et al., 2009); г – гадрозавр Corythosaurus casuarius (по: Brown, 1916); д – цератопс Leptoceratops cerorhynchus (по: Brown, Schlaikjer, 1942); е – теропод Spinosaurus aegyptiacus (по: Ibrahim et al., 2020).

Следует обратить внимание, что даже в пределах одного семейства, как, например, у Protoceratopidae, по различию в строении хвоста можно предположить существование ряда форм – от относительно наземных до более или менее полуводных, в различной степени адаптированных к плаванию (Терещенко, 2008). Среди позднеюрских теропод можно аналогичным образом противопоставить предположительно более наземного Allosaurus, с почти округлым в сечении хвостом, и Ceratosaurus, очевидно, более приспособленного к плаванию, с высоким, сжатым с боков хвостом (Madsen, 1976) (рис. 12). Благодаря разной форме хвоста и, вероятно, разной способности к плаванию динозавры, сходные по строению черепа и скелета в целом, могли обитать в различных биотопах и занимать хотя и близкие, но не сильно перекрывающиеся экологические ниши.
ОСОБЕННОСТИ ВОДНОЙ ЛОКОМОЦИИ ДОСВЕЛЛИИД И ПРОТЕРОХАМПСИЙ
Хотя высокий и сжатый с боков хвост как основной движитель при плавании с помощью его горизонтальной ундуляции типичен для полуводных и водных архозавров, некоторые текодонты, возможно, являлись исключением. К ним, вероятно, относятся протерохампсии и родственные им досвеллииды, остатки которых обнаружены в континентальных отложениях.
Досвеллииды – своеобразные панцирные текодонты, вероятно, являющиеся специализированными протерозухиями (Weems, 1980). Строение черепа Doswellia – уплощенного, с орбитами, направленными вверх, очевидно, может служить указанием на их водный или, по крайней мере, полуводный образ жизни. Конечности относительно короткие. Туловище уплощенное дорсовентрально (горизонтально), покрытое на спине сплошным остеодермальным панцирем, что должно было существенно ограничивать его горизонтальные изгибы. Хвост в передней части также горизонтально уплощенный и широкий, т.к. длина поперечных отростков намного превышает высоту остистых отростков и гемальных дуг (рис. 13). В задней части хвоста сохраняются поперечные отростки, хотя и короткие. Остистые отростки хвостовых позвонков ниже, чем туловищных. Строение хвостовых позвонков Doswellia указывает на ограничение боковой гибкости и на возможность вертикальных изгибов хвоста (Weems, 1980). Фасетки пре- и постзигапофизов хвостовых позвонков расположены почти вертикально. Восьмой или девятый хвостовой позвонок, отличающийся по своему строению (перевернуто-трапециевидная форма его тела дает наклон последующей части хвоста вниз), очевидно, являлся шарнирным, и здесь было место максимальной подвижности в вертикальной плоскости. Автор первоописания (Weems, 1980) даже допускал для Doswellia возможность сворачиваться наподобие броненосца. Исходя из этого, для досвеллиид более вероятно было бы предположить плавание с помощью вертикальных изгибов хвоста.
Рис. 13.
Протерозухия Doswellia kaltenbachi (по: Weems, 1980): а, б – хвостовой отдел позвоночника: а – вид с дорсальной стороны, б – вид с левой стороны; в – поперечный разрез передней части хвоста. Стрелкой показан позвонок особенного строения, которое обуславливает наклон последующей части хвоста вниз.
Протерохампсии, включающие в себя семейства Cerritosauridae и Proterochampsidae, – своеобразные специализированные протерозухии, парадоксально сочетающие признаки возможного водного образа жизни и адаптации к наземной локомоции (Sill, 1967; Romer, 1972; Trotteyn et al., 2013). С одной стороны, череп у них дорсовентрально уплощенный, длинный и широкий в задней части, ноздри направлены вверх, несколько отстоят от переднего конца рыла, орбиты направлены немного вбок, но больше вверх, хоаны отодвинуты довольно далеко назад (начальная стадия образования вторичного неба). Эти признаки, интерпретируемые как результат адаптации к водному образу жизни, последовательно усиливаются в морфологическом ряду от Tropidosuchus до Proterochampsa, достигая у последнего гипертрофированной степени развития (Sill, 1967; Trotteyn et al., 2013). С другой стороны, по строению локомоторного аппарата протерохампсии, особенно церритозавриды, гораздо более продвинуты в сторону быстрой наземной локомоции, чем протерозухиды и эритрозухиды, и достигают уже псевдозухового уровня организации – скапулокоракоид узкий и высокий, гленоидная впадина обращена преимущественно назад, задние конечности значительно длиннее передних, дистальные отделы задних конечностей особенно удлиненные, кости ног грацильные (рис. 14), вертлужная впадина глубокая, супраацетабулярный гребень хорошо развит, бедренная кость сигмоидально изогнута, с мощным четвертым трохантером, стопа симметричная, третий палец заметно длиннее четвертого, пятый палец частично редуцирован, над позвоночником развит одинарный ряд остеодерм, сочлененных между собой (на один позвонок приходится около трех остеодерм) (Romer, 1972). Все эти признаки указывают на возможность быстрой наземной локомоции при приближенной к парасагиттальной постановке конечностей и, возможно, пальцехождении (Romer, 1972), по крайней мере, факультативном (рис. 15). Развитие сагиттального ряда сочлененых остеодерм, вероятно, связано с развитием у протерохампсий вертикальной флексии позвоночника, как у крокодилов (организация осевого комплекса по принципу балочного моста) (Frey, 1985, 1988) и псевдозухий (Сенников, 1995). Появление же у протерохампсий одинарного, а не двойного ряда остеодерм и своеобразное их строение, однозначно свидетельствует о независимом достижении ими псевдозухового уровня организации локомоторного аппарата, параллельно с псевдозухиями и орнитозухиями.
Рис. 14.
Протерохампсия Chanaresuchus sp., экз. PVL № 6244, Музей Естественной истории Фонда Мигэля Лилло, Тукуман, Аргентина, скелет правой задней конечности и тазовый пояс, вид с латеральной стороны, фото А.Г. Сенникова.

Рис. 15.
Реконструкция скелета протерохампсии Chanaresuchus bonapartei, вид с левой стороны (по: Romer, 1972).
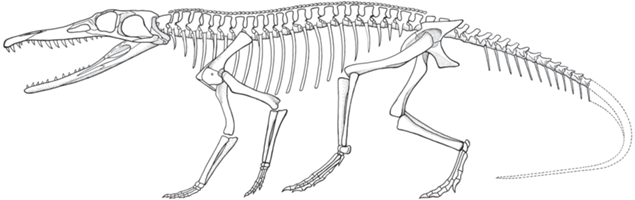
Такое противоречивое сочетание у протерохампсий ярко выраженных признаков в строении черепа, указывающих на глубокую специализацию к водному образу жизни, и признаков в строении посткраниального скелета, столь же очевидно говорящих о прогрессивном развитии способности к активной наземной локомоции, ставят в тупик исследователей, пытающихся определить, какой образ жизни вели протерохампсии – преимущественно наземный или водный. Гистологическое изучение строения их костей также не внесло ясность в этом вопросе (Arcucci et al., 2019).
Во время изучения материалов по ранним архозаврам в 2011 г. в Аргентине автор данной статьи обратил внимание на важную особенность морфологии церритозаврида Chanaresuchus bonapartei, не отмеченную до сих пор другими исследователями. У Ch. bonapartei, экз. PVL № 4575, достаточно полного и хорошо сохранившегося скелета, бросается в глаза необычное строение плоского и мощного хвоста (рис. 16). Остистые отростки и гемальные дуги хвостовых позвонков в передней половине хвоста короткие, зато поперечные отростки длинные, широкие и мощные, дорсовентрально уплощенные, более чем в два раза длиннее остистых отростков, что характерно для тетрапод, плавающих с помощью вертикальных изгибов хвоста. Длинные и широкие поперечные отростки в передней части хвоста имеются и у другого экземпляра Chanaresuchus – PVL № 6244. У церритозарида Tropidosuchus romeri (экз. PVL №№ 4601 и 4603) поперечные отростки на позвонках в передней части хвоста также достаточно длинные и широкие, сохраняются почти до конца хвоста, хотя и укорачиваются (рис. 17). Остистые отростки у хвостовых позвонков Chanaresuchus и Tropidosuchus ниже, чем у туловищных. Таким образом, хвост этих церритозаврид был длинным, широким и дорсовентрально уплощенным до самого его конца и представлял собой единый горизонтальный плавник. Его ширина увеличивалась, очевидно, еще и за счет мягких тканей, однако вряд ли имелся обособленный терминальный плавник. По мнению автора, наиболее близкий аналог церритозаврид по строению хвоста и по способу плавания – гигантская выдра (Pteronura brasiliensis) (рис. 18). Горизонтальные изгибы хвоста, видимые на некоторых образцах, например, Chanaresuchus bonapartei, экз. PVL № 4575 и Tropidosuchus romeri, экз. PVL № 4601, не противоречат использованию вертикальной гибкости хвоста при плавании, т.к. вертикальные изгибы сильно выражены у Tropidosuchus romeri, экз. PVL № 4603 (рис. 17, б). Во всяком случае, широкий и плоский по всей длине хвост протерохампсий мог действовать как эффективный движитель при плавании скорее посредством его вертикальных изгибов. Горизонтальные же движения могли играть важную роль при маневрировании животного. Таким образом, для Chanaresuchus и Tropidosuchus предположение о плавании преимущественно с помощью вертикальной подвижности хвоста кажется более вероятным. По аналогии, такой же способ плавания можно предположить и для остальных протерохампсий, однако они представлены недостаточно полным и сохранным материалом, что не позволяет сделать окончательные выводы.
Рис. 16.
Протерохампсия Chanaresuchus bonapartei, экз. PVL № 4575, Музей Естественной истории Фонда Мигэля Лилло, Тукуман, Аргентина, передняя часть хвостового отдела позвоночника на породе: а – вид с дорсальной стороны, б – вид с дорсо-латеральной стороны (сверху-слева). Фото А.Г. Сенникова.

Рис. 17.
Протерохампсия Tropidosuchus romeri, Музей естественной истории Фонда Мигэля Лилло, Тукуман, Аргентина, хвостовой отдел позвоночника на породе: а – экз. PVL № 4601, вид с вентральной стороны; б – экз. PVL № 4603, вид с правой стороны, над остистыми отростками в передней части хвоста расположен медиальный ряд сочлененных остеодерм. Обозначение: Ptr – поперечные отростки на заднехвостовых позвонках. Фото П.Е. Ортис (P.E. Ortiz).

Рис. 18.
Хвостовой отдел позвоночника: а – протерохампсия Chanaresuchus bonapartei, экз. PVL № 4575, Музей естественной истории Фонда Мигэля Лилло, Тукуман, Аргентина, вид с дорсальной стороны (зеркально отображено), фото А.Г. Сенникова; б – протерохампсия Tropidosuchus romeri, экз. PVL № 4601, Музей естественной истории Фонда Мигэля Лилло, Тукуман, Аргентина, вид с вентральной стороны, фото П.Е. Ортис (P.E. Ortiz); в – бразильская выдра Pteronura brasiliensis, экз. MNHN-ZM-AC-A1918, Музей естественной истории, Париж, Франция, вид с дорсальной стороны, фото Ж. Верон (Geraldine Veron, Paris). Для Pteronura brasiliensis показан внешний контур хвоста с мягкими тканями, для Tropidosuchus romeri – гипотетическая реконструкция контура хвоста с мягкими тканями.

Такое необычное специализированное строение хвоста Chanaresuchus и Tropidosuchus – дополнительный аргумент в пользу водного или полуводного образа жизни этих и других протерохампсий. В то же время, строение конечностей и их поясов говорит в пользу быстрой наземной локомоции и наземного образа жизни Chanaresuchus и других церритозаврид. В этом они также обнаруживают сходство с бразильской выдрой, которая и отлично плавает, но и достаточно ловко перемещается по суше. Во всяком случае, можно утверждать, что представители протерохампсий сочетали в себе специфические, необычные черты специализации и в водной, и в наземной локомоции.
ЗАКЛЮЧЕНИЕ
Проведенный анализ имеющихся данных показал, что ранее было недооценено разнообразие адаптаций к водному образу жизни и плаванию у ископаемых рептилий, в т.ч. в морфологии хвоста. Некоторым группам морских и пресноводных рептилий были присущи дорсовентрально уплощенная форма хвоста и, вероятно, плавание с помощью его вертикальных движений, что в настоящее время неизвестно среди пресмыкающихся, но характерно для многих водных млекопитающих. Развитие у ранних архозавров вертикальной гибкости позвоночника как важного звена локомоторного аппарата, очевидно, способствовало большей вертикальной подвижности хвоста.
* * *
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-04-00070.
Автор весьма признателен П.Е. Ортису (P.E. Ortiz) и Д.А.Г. Лопесу (D.A.G. Lopez, Cátedra de Paleontología, Facultad de Ciencias Naturales e Instituto Miguel Lillo, Universidad Nacional de Tucumán), Тукуман, Аргентина за предоставление фотографий образцов протерохампсий; Ж. Верон (G. Veron, Institut de Systématique, Evolution, Biodiversité, Muséum National d’Histoire Naturelle), Париж, Франция за предоставление фотографий образца Pteronura brasiliensis; А.В. Тихомировой, Зоологический музей МГУ, Москва и И.Г. Данилову, Зоологический ин-т РАН, С.-Петербург, Россия, за предоставление возможности изучения и фотографирования образцов тетрапод; М. Х. Троттейн (M.J. Trotteyn, Consejo Nacional de Investigaciones Científicas y Técnicas), Буэнос-Айрес, Аргентина за ценные консультации. Автор также выражает искреннюю благодарность Х.Б. Десохо (J.B. Desojo, Consejo Nacional de Investigaciones Científicas y Técnicas), Р.Н. Мартинесу (R.N. Martínez, Instituto y Museo de Ciencias Naturales, Universidad Nacional de San Juan) и всем аргентинским коллегам, благодаря содействию и помощи которых автор смог осуществить в 2011 г. визит в Аргентину и участие в “Четвертом Латиноамериканском конгрессе по палеонтологии позвоночных” и изучение материалов по ископаемым тетраподам.
Список литературы
Ивлев Ю.Ф., Кузнецов А.Н., Рутовская М.В. Предварительные данные о кинематике плавания русской выхухоли (Desmana moschata L.) // Докл. Акад. наук. Общ. биол. 2010. Т. 431. № 6. С. 836–840.
Кузнецов А.Н., Терещенко В.С. Методика расчета боковой и вертикальной подвижности между платицельными позвонками у тетрапод // Палеонтол. журн. 2010. № 2. С. 83–99.
Лавров Л.С. Бобры Палеоарктики. Воронеж: Изд-во Воронежского ун-та, 1981. 272 с.
Ламантин. Морфологические адаптации / Ред. В.Е. Соколов. М.: Наука, 1986. 404 с.
Мордвинов Ю.Е. Функциональная морфология плавания птиц и полуводных млекопитающих. Киев: Наук. думка, 1984. 168 с.
Сенников А.Г. Ранние текодонты Восточной Европы. М.: Наука, 1995. 142 с. (Тр. Палеонтол. ин-та РАН. Т. 263).
Сенников А.Г. Особенности строения и локомоторной функции хвоста у завроптеригий // Зоол. журн. 2018. Т. 97. № 8. С. 1041–1054.
Терещенко В.С. К реконструкции позвоночного столба протоцератопса // Палеонтол. журн. 1991. № 2. С. 86–96.
Терещенко В.С. Адаптивная специфика протоцератопоидов (Ornithischia: Neoceratopsia) // Палеонтол. журн. 2008. № 3. С. 50–64.
Arcucci A., Previtera E., Mancuso A.C. Ecomorphology and bone microstructure of Proterochampsia from the Chañares Formation // Acta Palaeontol. Pol. 2019. V. 64. № 1. P. 157–170.
Brown B. The osteology of Champsosaurus Cope // Mem. Amer. Mus. Natur. Hist. 1905. V. 9. № 1. P. 1–26.
Brown B. Corythosaurus casuarius: skeleton, musculature and epidermis. Second paper // Bull. Amer. Mus. Natur. Hist. 1916. V. 35. Art. 38. P. 709–716.
Brown B., Schlaikjer E.M. The skeleton of Leptoceratops with the description of a new species // Amer. Mus. Novit. 1942. № 1169. P. 1–15.
Buchholtz E.A. Implications of vertebral morphology for locomotor evolution in early Cetacea // The Emergence of Whales, Evolutionary Patterns in the Origin of Cetacea / Ed. Thewissen J.G.M. N.Y.: Plenum Press, 1998. P. 325–351.
Buchholtz E.A., Booth A.C., Webbink K.E. Vertebral anatomy in the Florida manatee, Trichechus manatus latirostris: A developmental and evolutionary analysis // The Anatomical Record. 2007. V. 290. № 6. P. 624–637.
Currie P.J. Hovasaurus boulei, an aquatic eosuchian from the Upper Permian of Madagascar // Palaeontol. Africana. 1981. V. 24. P. 99–168.
Erickson B.R. The lepidosaurian reptile Champsosaurus in North America // Monogr. Sci. Mus. Minnesota. 1972. V. 1. (Paleontol.). P. 1–91.
Erickson B.R. Aspects of some anatomical structures of Champsosaurus (Reptilia: Eosuchia) // J. Vertebr. Paleontol. 1985. V. 5. № 2. P. 111–127.
Erickson B.R. Simoedosaurus dakotensis, new species, a diapsid reptile (Archosauromorpha; Choristodera) from the Paleogene of North America // J. Vertebr. Paleontol. 1987. V. 7. № 3. P. 237–251.
Ezquerra R., Doublet S., Costeur L. et al. Were non-avian theropod dinosaurs able to swim? Supportive evidence from an Early Cretaceous trackway, Cameros Basin (La Rioja, Spain) // Geology. 2007. V. 35. № 6. P. 507–510.
Fish F.E. Function of the compressed tail of surface swimming Muskrats (Ondatra zibethicus) // J. Mammalogy. 1982. V. 63. № 4. P. 591–597.
Fish F.E. Association of propulsive swimming mode with behavior in river otters (Lutra canadensis) // J. Mammalogy. 1994. V. 75. № 4. P. 989–997.
Fish F.E., Rybczynski N., George V. et al. The role of the tail or lack thereof in the evolution of tetrapod aquatic propulsion // Integr. and Compar. Biol. 2021. V. 61. № 2. P. 398–413.
Fraas E. Plesiosaurier aus dem oberen Lias von Holzmaden // Palaeontogr. 1910. Bd 57. Lf. 3–4. S. 105–140.
Frey E. Biomechanics of terrestrial locomotion in crocodiles // Konstruktionsprinzipien lebender und ausgestorbener Reptilien: Konzepte SF B230. Stuttgart, 1985. H. 4. S. 145–169.
Frey E. Das Tragsystem der Krokodile – eine biomechanische und phylogenetische Analyse // Stuttg. Beitr. Naturk. Ser. A. 1988. № 26. S. 1–60.
Frey E., Mulder E.W.A., Stinnesbeck W. et al. A new polycotylid plesiosaur with extensive soft tissue preservation from the early Late Cretaceous of northeast Mexico // Bol. Soc. Geol. Mexicana. 2017. V. 69. № 1. P. 87‒134.
Gregory W.K. Evolution Emerging. V. 2. N.Y.: The Macmillan co., 1951. 1014 p.
Heckert A.B., Viner T.C., Carrano M.T. A large, pathological skeleton of Smilosuchus gregorii (Archosauriformes: Phytosauria) from the Upper Triassic of Arizona, U.S.A., with discussion of the paleobiological implications of paleopathology in fossil archosauromorphs // Palaeontol. Electron. 2021. V. 24. № 2. Iss. a21. P. 1‒36.
Howell A.B. The swimming mechanism of the Platypus // J. Mammalogy. 1937. V. 18. № 2. P. 217‒222.
Ibrahim N., Maganuco S., Dal Sasso C. et al. Tail-propelled aquatic locomotion in a theropod dinosaur // Nature. 2020. V. 581. № 7806. P. 67‒70.
Li C.,Wu X.-C., Cheng Y.-N. et al. An unusual archosaurian from the marine Triassic of China // Naturwiss. 2006. V. 93. № 4. P. 200–206.
Li C., Wu X.-C., Zhao L.-J. et al. A new armored archosauriform (Diapsida: Archosauromorpha) from the marine Middle Triassic of China, with implications for the diverse life styles of archosauriforms prior to the diversification of Archosauria // Sci. Natur. 2016. V. 103. № 95. P. 1–23.
Lindgren J., Caldwell M.W., Konishi T., Chiappe L.M. Convergent evolution in aquatic tetrapods: insights from an exceptional fossil mosasaur // PLoS ONE. 2010. V. 5. № 8. P. 1–10. e11998.
Lindgren J., Kaddumi H.F., Polcyn M.J. Soft tissue preservation in a fossil marine lizard with a bilobed tail fin // Nature Commun. 2013. V. 4. № 2423. P. 1–8.
Madsen J.H. Allosaurus fragilis: a revised osteology // Bull. Utah Geol. Miner. Surv. 1976. V. 109. P. 1–163.
Matsumoto R., Suzuki S., Tsogtbaatar K., Evans S.E. New material of the enigmatic reptile Khurendukhosaurus (Diapsida: Choristodera) from Mongolia // Naturwiss. 2009. V. 96. № 2. P. 233–242.
McMenamin M.A.S. Permian aquatic reptiles // Preprints. 2019. 2019080033 (doi: ). P. 1–10.https://doi.org/10.20944/preprints201908.0033.v1
Motani R. Evolution of fish-shaped reptiles (Reptilia: Ichthyopterygia) in their physical environments and constraints // Ann. Rev. Earth Planet. Sci. 2005. V. 33. P. 395–420.
Nesbitt S.J., Stocker M.R., Small B.J., Downs A. The osteology and relationships of Vancleavea campi (Reptilia: Archosauriformes) // Zool. J. Linn. Soc. London. 2009. V. 157. P. 814–864.
Otero R.A., Soto-Acuna S., Frank R.O., Keefe F.R. Osteology of Aristonectes quiriquinensis (Elasmosauridae, Aristonectinae) from the Upper Maastrichtian of Central Chile // J. Vertebr. Paleontol. 2018. V. 38. № 1. P. 1–19. e1408638.
Pinna G., Nosotti S. Anatomia, morfologia funzionale e paleoecologia del rettile Placodonte, Psephoderma alpinum Meyer, 1858 // Mem. Soc. Ital. Sci. Natur., Mus. Civ. Sci. Natur. Milano. 1989. V. 25. P. 17–49.
Renesto S. A new specimen of Tanystropheus (Reptilia, Protorosauria) from the Middle Triassic of Switzerland and the ecology of the genus // Riv. Ital. Paleontol. Stratigr. 2005. V. 111. № 3. P. 377–394.
Renesto S., Saller F. Evidences for a semiaquatic life style in the Triassic diapsid reptile Tanystropheus // Riv. Ital. Paleontol. Stratigr. 2018. V. 124. № 1. P. 23–34.
Renesto S., Tintori A. Functional morphology and mode of life of the Late Triassic placodont Psephoderma alpinum Meyer from the Calcare di Zorzino (Lombardy, N. Italy) // Riv. Ital. Paleontol. Stratigr. 1995. V. 101. № 1. P. 37–48.
Romer A.S. The Chanares (Argentina) Triassic reptile fauna. XII. The postcranial skeleton of the thecodont Chanaresuchus // Breviora. 1972. № 385. P. 1–21.
Russell L.S. The Cretaceous reptile Champsosaurus natator Parks // Bull. Nat. Mus. Canada. 1956. V. 145. P. 1–25.
Sachs S., Hornung J.J., Kear B.P. Reappraisal of Europe’s most complete Early Cretaceous plesiosaurian: Brancasaurus brancai Wegner, 1914 from the “Wealden facies” of Germany // PeerJ. 2016. № 4. P. 1–79. e2813. https://doi.org/10.7717/peerj.2813
Sander P.M. Ichthyosauria: their diversity, distribution, and phylogeny // Palӓontol. Z. 2000. Bd 74. № 1–2. P. 1–35.
Scheyer T.M., Neenan J.M., Bodogan T. et al. A new, exceptionally preserved juvenile specimen of Eusaurosphargis dalsassoi (Diapsida) and implications for Mesozoic marine diapsid phylogeny // Sci. Rep. 2017. V. 7. № 4406. P. 1–22.
Schwarz-Wings D., Frey E., Martin T. Reconstruction of the bracing system of the trunk and tail in hyposaurine dyrosaurs (Crocodylomorpha; Mesoeucrocodylia) // J. Vertebr. Paleontol. 2009. V. 29. № 2. P. 453–472.
Sennikov A.G. New data on the herpetofauna of the Early Triassic Donskaya Luka locality, Volgograd Region // Paleontol. J. 2015. V. 49. № 11. P. 1161–1173.
Sennikov A.G. Peculiarities of the structure and locomotor function of the tail in Sauropterygia // Biol. Bull. 2019. V. 46. № 7. P. 97–108.
Shang Q.-H., Wu X.-Ch., Lia Ch. New Ladinian nothosauroid (Sauropterygia) from Fuyuan, Yunnan Province, China // J. Vertebr. Paleontol. 2020. V. 40. № 3. P. 1–18.
Sill W.D. Proterochampsa barrionuevoi and the early evolution of the Crocodilia // Bull. Mus. Compar. Zool. 1967. V. 135. № 8. P. 415–446.
Taquet P. Géologie et Paléontologie du Gisement de Gadoufaoua (Aptien du Niger). P.: Ed. du Centre National de la Recherque Scientifique, 1976. 191 p.
Thewissen J.G.M., Fish F.E. Locomotor evolution in the earliest cetaceans: functional model, modern analogues and paleontological evidence // Paleobiology. 1997. V. 23. № 4. P. 482–490.
Trotteyn M.A., Arcucci A.A., Raugust T. Proterochampsia: an endemic archosauriform clade from South America // Geol. Soc. London, Spec. Publ. 2013. V. 379. P. 59–90.
Weems R.E. An unusual newly discovered archosaur from the Upper Triassic of Virginia, U.S.A. // Trans. Amer. Phil. Soc. New Ser. 1980. V. 70. № 7. P. 1–53.
Wegner T. Brancasaurus brancai n.g. n.sp., ein Elasmosauridae aus dem Wealden Westfalens // Branca-Festschrift. Gebrüda Bornträga / Ed. Schoendorf F. Berlin, 1914. S. 235–305.
Wilhelm B.C. Novel anatomy of cryptoclidid plesiosaurs with comments on axial locomotion. A Thesis submitted to the Graduate College of Marshall University. Huntington: Marshall Univ., 2010. P. 1–70.
Williston S.W. Water reptiles of the past and present. Chicago: Univ. Chicago Press, 1914. 251 p.
Xing L.D., Lockley M.G., Zhang J.P. et al. A new Early Cretaceous dinosaur track assemblage and the first definite non-avian theropod swim trackway from China // China Sci. Bull. 2013. V. 58. № 19. P. 2370–2378.
Xing L., Klein H., Lockley M.G. et al. Footprints of marine reptiles from the Middle Triassic (Anisian-Ladinian) Guanling Formation of Guizhou Province, southwestern China: The earliest evidence of synchronous style of swimming // Palaeogeogr., Palaeoclimatol., Palaeoecol. 2020. V. 558. 109943. P. 1–20.
Young M.T., Brusatte S.L., Ruta M., Andrade M.B. The evolution of Metriorhynchoidea (Mesoeucrocodylia: Thalattosuchia): an integrated approach using geometric morphometrics, analysis disparity and biomechanics // Zool. J. Linn. Soc. 2010. V. 158. № 4. P. 801–859.
Zhang Q., Wen W., Shixue H. et al. Nothosaur foraging tracks from the Middle Triassic of southwestern China // Nature Commun. 2014. V. 5. Iss. 3973. P. 1–12.
Дополнительные материалы отсутствуют.
Инструменты
Палеонтологический журнал