Петрология, 2021, T. 29, № 5, стр. 552-566
Экспериментальное изучение катионообменных равновесий твердых растворов галлиевых полевых шпатов (Na,K)GaSi3O8 с водно-солевым флюидом (NaCl–KCl–H2O) при 550°С и 1.5 кбар
А. Р. Котельников a, *, Н. И. Сук a, **, Г. М. Ахмеджанова a, b, З. А. Котельникова a, b
a Институт экспериментальной минералогии РАН
Черноголовка, Московская область, Россия
b Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН
Москва, Россия
* E-mail: kotelnik@iem.ac.ru
** E-mail: sukni@iem.ac.ru
Поступила в редакцию 18.12.2020
После доработки 01.02.2021
Принята к публикации 29.03.2021
Аннотация
Для получения данных о распределении Na и K между полевым шпатом и раствором при 550°С и 1.5 кбар в гидротермальных условиях проведены экспериментальные исследования катионообменных равновесий: NaGaSi3O8 + KCl aq = KGaSi3O8 + NaCl aq. Распределение Na и K между полевыми шпатами и флюидом неидеальное, в натровой части системы калий обогащает раствор относительно полевого шпата, затем происходит инверсия и при значениях $X_{{\text{K}}}^{{Fsp}}$ > 0.8 калий перераспределяется в полевой шпат относительно флюида. Определены границы области несмесимости твердого раствора и концентрационные зависимости коэффициентов распределения Na и K между полевым шпатом и флюидом. Уточнены параметры элементарных ячеек твердых растворов (Na,K)GaSi3O8. На основе данных порошковой рентгенографии проведена оценка избыточного объема смешения твердых растворов галлиевых щелочных полевых шпатов. Проведена корреляция избыточных интегрированных энергий и объемов смешения со структурными параметрами. Полученные закономерности позволяют оценивать величины энергетических функций смешения твердых растворов каркасных алюмосиликатов.
ВВЕДЕНИЕ
Галлиевые щелочные полевые шпаты ряда NaGaSi3O8–KGaSi3O8 интересны для изучения свойств минералов группы каркасных алюмосиликатов, а также как модели твердых растворов, в которых структурное упорядочение в значительной степени определяет их термодинамические свойства. Как было показано в работах (Котельников и др., 1995; Котельников, 1997; Kotelnikov et al., 2019), твердые растворы каркасных алюмосиликатов являются потенциальным матричным минералом для иммобилизации элементов радионуклидов и других промышленных отходов.
Впервые данные о синтезе Ga-полевых шпатов приводятся в монографии (Smith, 1974). В работе (Bambauer et al., 1974) представлены данные о твердых растворах полевых шпатов, в том числе и галлиевых щелочных полевых шпатов. В этой работе построена Т–Х диаграмма системы NaGaSi3O8–KGaSi3O8; показано существование обширной области распада твердых растворов. Более детально конечные миналы NaGaSi3O8 (галлиевый аналог альбита, в дальнейшем – галлиевый альбит) и KGaSi3O8 (галлиевый аналог санидина, в дальнейшем – галлиевый санидин) были изучены в основополагающей работе (Pentinghaus, 1980). Было показано, что галлиевый альбит аналогичен альбиту и его структура соответствует пространственной группе С1, в то время как структура синтетического KGaSi3O8 соответствует пространственной группе С2/m и имеет моноклинную сингонию. Н.С. Васильев (1990) экспериментально исследовал кинетику синтеза калиевых и натриевых галлиевых полевых шпатов и показал их высокую тенденцию к структурному упорядочению. Изучение кристаллической структуры упорядоченного галлиевого альбита проведено в работе (Fleet, 1992). А.Р. Котельников (1995) синтезировал галлиевые альбиты в гидротермальных условиях (Т = 600°С; Р = 1 кбар) и уточнил параметры их элементарных ячеек. В целом можно резюмировать неплохой уровень изучения галлийсодержащих щелочных полевых шпатов. Тем не менее до сих пор остаются неизученными ряд вопросов: (1) оценка величин коэффициентов распределения натрия и калия между галлиевым щелочным полевым шпатом и флюидом; (2) положение точки структурного перехода С1 ↔ С2/m (Ga-альбит ↔ Ga-санидин; (3) параметры элементарных ячеек твердых растворов галлиевых щелочных полевых шпатов; (4) определение термодинамических функций смешения твердых растворов (Na,K)GaSi3O8 полевых шпатов.
Целью нашего исследования было изучение катионообменных равновесий галлиевых полевых шпатов с раствором: NaGaSi3O8 + KCl aq = = KGaSi3O8 + NaCl aq для получения данных о распределении натрия и калия между полевым шпатом и раствором. Также предполагалось проведение уточнения параметров элементарных ячеек твердых растворов синтетических галлиевых полевых шпатов и оценка избыточных функций смещения.
МЕТОДИКА ЭКСПЕРИМЕНТОВ
Для исследования свойств твердых растворов галлиевых полевых шпатов применяли метод катионообменных реакций, детально описанный в работах (Orville, 1963; Зырянов, 1981; Котельников, 1995).
Исходные материалы. В качестве стартовых материалов использовали стекла NaGaSi3O8 и KGaSi3O8, полученные методом плавления смесей оксидов и карбонатов в печи КО-14 при 1250°С в платиновых ампулах в течение 6 ч. Проведенные исследования методами электронно-зондового микроанализа и порошковой рентгенографии показали их соответствие заданным составам, гомогенность и рентгеноаморфность. Состав раствора задавали одномолярными водными растворами NaCl и KCl. Для приготовления растворов использовали реактивы марки “осч”. Соотношение навеска/ раствор варьировало от 0.7 до 1.1. Используя различные составы исходных растворов и стекол, мы могли получать конечные составы фаз в широком интервале составов и обеспечивать подход к равновесной изотерме с двух сторон.
Аппаратура. Все опыты проводили на гидротермальных установках с внешним нагревом и холодным затвором (конструкции ИЭМ РАН). На установках использовали эксцентриковый затвор с водяным охлаждением. Точность регулировки и контроля температуры составляла ±2°С, давления – ±50 бар.
Методика опытов. Опыты проводили в платиновых и золотых ампулах объемом 500–600 мкл. В ампулы загружали смесь порошков стекол галлиевых полевых шпатов, заливали необходимое количество растворов 1 М NaCl и 1 М KCl. Затем ампулы заваривали электродуговой сваркой и проверяли на герметичность, взвешивали и помещали в реакторы установок высокого давления. Опыты проводили при температуре 550°С и давлении 1.5 кбар. Ввод в режим выполняли с опережающим ростом давления относительно температуры на ~200–300 бар. Ввод в режим занимал около 1–1.5 ч. Выдержка в режиме опытов составляла от 12 до 25 сут. Время закалки опытов (от температуры 550 до 100°С) не превышало 5–7 мин. Герметичность ампул после опытов контролировали весовым методом. Условия проведения и результаты опытов представлены в табл. 1.
Таблица 1.
Условия и фазовый состав продуктов опытов по изучению катионообменных равновесий галлиевый полевой шпат–флюид (Т = 550°С, Р = = 1.5 кбар)
| № оп. | Исходная навеска | Исходный раствор | K3) | $X_{{\text{K}}}^{{Fsp}}$, д/о4) | $X_{{\text{K}}}^{{{\text{fl}}}}$, д/о5) | Длит., сут 6) | Фазовый состав продуктов опыта |
|---|---|---|---|---|---|---|---|
| 7196 | 240 мг Ga-Ab gl.1) | 26 мкл H2O | 9.3 | 0 | – | 16 | Fsp (Ga-Ab) + Qz (мало) |
| 7197 | 260 мг Ga-Ksp gl.2) | 26 мкл H2O | 10 | 1 | – | 16 | Fsp (Ga-San) |
| 7229 | 100 мг Ga-Ab gl. | 100 мкл раствора 1M KCl | 0.93 | 0 | 1 | 12 | Fsp1 (Na-фаза) + Fsp2 (K-фаза) + + Qz (мало) + Ga2O3 (мало) |
| 7230 | 100 мг Ga-Ksp gl. | 100 мкл раствора 1M NaCl | 0.94 | 1 | 0 | 12 | Fsp1 (Na-фаза) + Fsp2 (K-фаза) + + Qz (мало) |
| 7231 | 100 мг Ga-Ab gl. | 50 мкл раствора 1M KCl + + 50 мкл раствора 1M NaCl | 0.93 | 0 | 0.5 | 12 | Fsp (K-фаза) + Qz (мало) + + Ga2O3 (следы) |
| 7232 | 100 мг Ga-Ksp gl. | 50 мкл раствора 1M KCl + + 50 мкл раствора 1M NaCl | 0.93 | 1 | 0.5 | 12 | Fsp (K-фаза) |
| 7233 | 50 мг Ga-Ab gl. + + 50 мг Ga-Ksp gl. |
100 мкл раствора 1M NaCl | 0.94 | 0.5 | 0 | 12 | Fsp1 (Na-фаза) + Fsp2 (K-фаза) + + Qz (мало) + Ga2O3 (мало) |
| 7234 | 50 мг Ga-Ab gl. + + 50 мг Ga-Ksp gl. |
100 мкл раствора 1M KCl | 0.93 | 0.5 | 1 | 12 | Fsp1 (Na-фаза) + Fsp2 (K-фаза) + + Qz (следы) + Ga2O3 (мало) |
| 7247 | 150 мг Ga-Ksp gl. | 45 мкл раствора 1M NaCl + + 115 мкл раствора 1M KCl | 0.93 | 1 | 0.72 | 20 | Fsp (K-фаза) + Ga2O3 (следы) |
| 7248 | 150 мг Ga-Ab gl. | 128 мкл раствора 1M NaCl + + 32 мкл раствора 1M KCl | 0.94 | 0 | 0.20 | 20 | Fsp (Na-фаза) + Qz (следы) |
| 7253 | 100 мг Ga-Ab gl. | 133 мкл раствора 1M NaCl + + 57 мкл раствора 1M KCl | 0.50 | 0 | 0.30 | 25 | Fsp (Na-фаза) |
| 7254 | 100 мг Ga-Ksp gl. | 114 мкл раствора 1M NaCl + + 76 мкл раствора 1M KCl | 0.50 | 1 | 0.40 | 25 | Fsp (K-фаза) |
1) Стекло галлиевого альбита состава NaGaSi3O8; 2) стекло галлиевого санидина состава KGaSi3O8; 3) массовое соотношение навеска/раствор; 4) мольная доля калия в полевом шпате $X_{{\text{K}}}^{{Fsp}}$ = K/(Na + K), где Na и K – атомные количества натрия и калия в полевом шпате; 5) мольная доля калия в исходном растворе $X_{{\text{K}}}^{{{\text{fl}}}}$ = K/(Na + K), где Na и K – атомные количества натрия и калия во флюиде; 6) продолжительность опытов, в сутках.
Критерии достижения равновесия. Достижение равновесия определялось для катионообменных опытов подходом к равновесной изотерме сосуществующих полевых шпатов и растворов с двух сторон. В пользу равновесности полученных в ходе экспериментов фаз свидетельствует также независимость результатов опытов от их продолжительности.
Фазовое состояние флюида. От фазового состава гидротермального раствора при заданных параметрах опытов зависит скорость их протекания, фазовый состав продуктов и интерпретация полученных результатов. Бинарные водные системы обеих солей, присутствующих во флюидообразующей смеси, имеют фазовые диаграммы первого типа: критические явления в них наблюдаются только в недосыщенных растворах; несмесимость в жидких фазах отсутствует (Равич, 1974; Валяшко, 1990). При давлении 1 кбар в системе H2O–NaCl по данным Р. Боднара и др. (Bodnar et al., 1985) жидкость и пар сосуществуют при температурах выше 625°С. Для системы H2O–KCl при этом давлении (1 кбар) гетерогенизация на паровую и жидкую фазы происходит при температурах выше 600°С (Котельникова и др., 1999). Экспериментальные данные о фазовом состоянии флюида при изучаемых параметрах 550°С и Р = 1.5 кбар, к сожалению, отсутствуют. Следует отметить, что повышение давления приведет и к повышению значений температур гетерогенизации. Наш опыт постановки экспериментов по синтезу флюидных включений при залечивании трещин в кварце с использованием в качестве флюидообразующей смеси, содержащей соли NaCl и KCl в разных соотношениях, показал, что область гетерогенизации в тройной системе обычно несколько шире, чем в бинарной. В работе (Sterner et al., 1992) были проведены термодинамические расчеты для тройной системы NaCl–KCl–H2O с целью оценки величин энергии смешения при Р-Т-Х условиях в окрестностях поверхности растворения. Полученные ими результаты свидетельствуют о том, что в этом диапазоне P-T-X в системе имеет место полное смешение жидкости между всеми тремя компонентами.
Таким образом, имеющиеся на сегодняшний день данные позволяют предположить, что флюид NaCl–KCl–H2O состава при Р = 1.5 кбар и Т = = 550°С был гомогенен.
Методика анализов продуктов опытов. Анализировали как твердые, так и жидкие продукты опытов. Для этого после вскрытия ампулы ее содержимое переводили в стакан на 100 мл, добавляли воду и кипятили в течение 10 мин. Затем содержимое стакана, осадок и ~100 мл раствора переносили на фильтр и промывали большим количеством дистиллированной воды, которую в дальнейшем собирали в мерную колбу на 250 мл.
Анализ раствора на содержание натрия и калия проводили методом атомно-абсорбционной спектроскопии на приборе “Квант”. Полученные значения пересчитывали на мольную долю калия в растворе $X_{{\text{K}}}^{{{\text{fl}}}}$ = K/(Na + K), где Na и K – атомные количества данных элементов в растворе. Точность анализа в растворе была не хуже чем 1–2 отн. % (по значению мольной доли калия ±0.01).
Состав синтезированных твердых продуктов опытов определяли методом локального рентгеноспектрального микроанализа с использованием следующих приборов (ИЭМ РАН): рентгеновского микроанализатора Camebax (Cameca, Франция) с энергодисперсионным спектрометром Link AN-10000 (Oxford Instruments, Англия), условия анализа: ускоряющее напряжение 15 кВ, ток зонда 2 нА, время анализа в точке 70 с; сканирующего электронного микроскопа Tescan Vega TS5130MM (Tescan, Чехия), оснащенного системой для рентгеноспектрального микроанализа INCA Energy 200 с энергодисперсионным спектрометром Link INCA Energy (Oxford Instruments, Англия), условия анализа: ускоряющее напряжение 20 кВ, ток поглощенных электронов на Co 1 нА; сканирующего электронного микроскопа Tescan Vega II XMU (Tescan, Чехия), оснащенного системой для рентгеноспектрального микроанализа INCA Energy 450 с энергодисперсионным (INCAx-sight) и кристалл-дифракционным (INCA wave 700) рентгеновскими спектрометрами (Oxford Instruments, Англия) и программной платформой INCA Energy+. Условия анализа при использовании только энергодисперсионного спектрометра были следующие: ускоряющее напряжение 20 кВ, ток поглощенных электронов на Co 0.3 нА, время анализа в точке 70 с. При использовании кристалл-дифракционного спектрометра совместно с энергодисперсионным условия анализа были другими: ускоряющее напряжение 20 кВ, ток поглощенных электронов на Co 20 нА, общее время анализа в точке 170 с. Точность количественного рентгеноспектрального анализа с применением энергодисперсионного спектрометра сопоставима с анализом, выполненным с использованием кристалл-дифракционного спектрометра при содержаниях элементов выше 1 мас. % (Reed, 2005). Содержания определяемых элементов в исследуемых образцах в большинстве случаев превышали 1 мас. %. Для некоторых образцов проводили валовый анализ навески методом кислотного разложения в плавиковой кислоте с последующим анализом раствора методом атомно-абсорбционной спектроскопии.
Изучение твердых растворов галлийсодержащих щелочных полевых шпатов проводили на дифрактометрах HZG-4 и “Bruker” в режиме постоянного сканирования. В качестве внутреннего стандарта применяли кремний спектральной чистоты (а = 5.4307 [Å]). Использовали полигональный метод коррекции рентгеновских отражений (Kroll et al., 1995; Котельников, 1995). Полученные результаты позволили рассчитать параметры элементарных ячеек твердых растворов. Уточнение параметров элементарных ячеек проводили по 45–103 отражениям в интервале углов 6.5°–44.5° (Θ). Для качественного расчета ПЭЯ минерала триклинной сингонии число отражений должно быть в 6–8 раз выше, чем количество расчетных параметров. Иными словами, для альбита следует определить: a, b, c, α, β, γ (всего шесть параметров). Для этого небходимо минимум 36 отражений. В нашем случае, при наличии в одном опыте фаз различного структурного типа (при их различном массовом соотношении), часто получалось набрать для одной фазы только 45 отражений. Для опытов, в которых встречена только одна структурная фаза, число отражений, использованных для расчета, достигало 103. Уточнение параметров элементарных ячеек выполняли с использованием программ LCC, PUDI, MINCRYST (Burnham, 1991; Chichagov, 1994).
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
Распределение щелочных элементов в системе галлиевый полевой шпат–флюид. Результаты опытов представлены в табл. 2. Катионообменные реакции в изучаемой системе проходят до конца – до равновесных значений составов сосуществующих фаз. Продукты опытов представлены кристаллами полевых шпатов, иногда в небольших количествах встречаются кварц и игольчатые кристаллы Ga2O3. На рис. 1а видны тонкопризматические кристаллики синтетического NaGaSi3O8 размером 2 × 20 мкм (обр. 7196). В этом же образце иногда наблюдаются неправильной формы кристаллы кварца размером до 2 × 5 мкм. На рис. 1б, 1в (обр. 7229) показаны сосуществующие фазы Na- и K-галлиевых полевых шпатов размером до 300–400 мкм. Хорошо видны светлые удлиненные призматические кристаллы K-фазы (К). Na-фаза имеет неправильные формы и выглядит как скопление мелких кристаллитов серого цвета (N); также отчетливо видны призмы кварца размером 25 × 100 мкм (Qz). В образце также присутствует небольшое количество игольчатых кристалликов (G) размером ~2 × 10 мкм (по данным качественного анализа это Ga2O3). На рис. 1г показаны кристаллы KGaSi3O8 размером до 400 мкм (обр. 7197). Составы синтезированных полевых шпатов представлены в табл. 3. Видно, что составы полевых шпатов в целом отвечают стехиометрии твердых растворов NaGaSi3O8–KGaSi3O8. В некоторых опытах (как указывалось выше, рис. 1б) наблюдается сосуществование разных по составу фаз. Это свидетельствует о наличии области распада твердого раствора. На основании данных о составах сосуществующих натриевых и калиевых фаз галлиевых полевых шпатов определены границы области несмесимости твердых растворов NaGaSi3O8–KGaSi3O8. Они следующие (в мольных долях калиевого минала): $X_{{\text{K}}}^{{(1)}}$ = 0.108(51); $X_{{\text{K}}}^{{(2)}}$ = 0.872(62); оценка проведена по пяти составам равновесных полевых шпатов. Сольвус галлиевых полевых шпатов более симметричен, в то время как границы области распада структурно упорядоченных щелочных (Al,Si)-полевых шпатов (Зырянов, 1981) при 550°C смещены в натровую область: 0.03–0.80 (в мольных долях калия). В то же время наши данные близки к данным работы (Bambauer et al., 1974), в которой получены следующие границы сольвуса: 0.07–0.88 (при 550°С).
Таблица 2.
Химические составы синтетических галлиевых полевых шпатов
| Оксиды | 7229 | 7230 | 7231 | 7232 | 7233 | ||||
|---|---|---|---|---|---|---|---|---|---|
| Na-фаза | K-фаза | Na-фаза | K-фаза | Na-фаза | K-фаза | – | Na-фаза | K-фаза | |
| Na2O | 8.61(33)1) | 1.31(22) | 7.98(53) | 0.99(41) | 8.80(27) | 0.43(3) | 0.32(13) | 8.50(44) | 1.98(51) |
| SiO2 | 59.05(35) | 56.86(40) | 60.45(78) | 56.78(58) | 59.74(44) | 56.06(58) | 55.51(1.05) | 58.16(84) | 56.30(1.22) |
| K2O | 1.03(11) | 13.05(43) | 2.51(34) | 13.62(65) | 0.92(20) | 14.61(49) | 14.35(53) | 0.85(16) | 11.13(93) |
| Ga2O3 | 30.52(36) | 28.18(44) | 29.02(63) | 28.60(51) | 30.35(37) | 28.92(50) | 28.68(56) | 31.38(93) | 30.78(1.18) |
| Сумма | 99.21 | 99.40 | 99.96 | 99.99 | 99.81 | 100.02 | 98.86 | 98.89 | 100.19 |
| Na | 0.864 | 0.133 | 0.790 | 0.102 | 0.868 | 0.044 | 0.033 | 0.855 | 0.204 |
| Si | 3.055 | 3.010 | 3.091 | 3.007 | 3.072 | 2.981 | 2.990 | 3.028 | 2.992 |
| K | 0.068 | 0.881 | 0.169 | 0.920 | 0.060 | 0.990 | 0.986 | 0.080 | 0.755 |
| Ga | 1.012 | 0.975 | 0.953 | 0.975 | 1.000 | 0.985 | 0.990 | 1.036 | 1.049 |
| $X_{{\text{K}}}^{{Fsp}}$ | 0.073(10) | 0.869(22) | 0.170(41) | 0.900(20) | 0.065(22) | 0.957(22) | 0.968(21) | 0.085(23) | 0.788(31) |
| $X_{{{\text{Ga}}}}^{{Fsp}}$ | 0.249(6) | 0.245(7) | 0.236(10) | 0.244(11) | 0.246(9) | 0.248(8) | 0.249(7) | 0.256(9) | 0.259(7) |
| Оксиды | 7234 | 7247 | 7248 | 72532) | 72542) | 71963) | 71973) | ||
| Na-фаза | K-фаза | – | – | – | – | – | – | ||
| Na2O | 8.51(45) | 1.45(43) | 0.35(12) | 9.06(23) | 9.41 | 0.80 | 9.96(32) | – | |
| SiO2 | 59.05(88) | 57.19(1.29) | 58.08(96) | 59.31(55) | 59.30 | 56.34 | 59.65(51) | 56.29(89) | |
| K2O | 2.28(15) | 11.79(33) | 13.38(53) | 0.21(5) | 0.84 | 12.95 | – | 14.42(32) | |
| Ga2O3 | 30.48(87) | 30.78(1.23) | 28.46(94) | 31.28(54) | 30.86 | 28.66 | 30.48(44) | 28.79(54) | |
| Сумма | 100.32 | 99.92 | 99.65 | 99.86 | 100.42 | 98.75 | 100.09 | 99.50 | |
| Na | 0.842 | 0.150 | 0.036 | 0.904 | 0.927 | 0.084 | 0.980 | – | |
| Si | 3.013 | 3.043 | 3.087 | 3.051 | 3.013 | 3.036 | 3.027 | 3.022 | |
| K | 0.148 | 0.800 | 0.907 | 0.014 | 0.055 | 0.890 | – | 0.987 | |
| Ga | 0.997 | 1.006 | 0.970 | 1.022 | 1.005 | 0.990 | 0.992 | 0.991 | |
| $X_{{\text{K}}}^{{Fsp}}$ | 0.150(60) | 0.842(52) | 0.962(32) | 0.015(5) | 0.056 | 0.914 | 0 | ||
| $X_{{{\text{Ga}}}}^{{Fsp}}$ | 0.249(6) | 0.249(7) | 0.239(8) | 0.253(9) | 0.250 | 0.246 | 0.247(7) | 0.246(9) | |
Рис. 1.
Кристаллы синтетических галлиевых полевых шпатов. (а) – обр. 7196, (б, в) – обр. 7229, (г) – обр. 7197. N – Na-галлиевые полевые шпаты, K – K-галлиевые полевые шпаты, G – Ga2O3, Qz – кварц.

Таблица 3.
Результаты опытов по равновесию галлиевый полевой шпат–флюид при 550°С и 1.5 кбар
| № оп. | $X_{{\text{K}}}^{{Fsp}}$, д/о | $X_{{\text{K}}}^{{{\text{fl}}}}$, д/о | $X_{{\text{K}}}^{{{\text{Na}}Fsp}}$ п/о1) | $X_{{\text{K}}}^{{{\text{K}}Fsp}}$ п/о2) | $X_{{\text{K}}}^{{{\text{fl}}}}$, п/о | KD(1)3) | lnKD(1) | KD(2) | lnKD(2) |
|---|---|---|---|---|---|---|---|---|---|
| 7229 | 0 | 1 | 0.073 | 0.869 | 0.390 | 0.123 | –2.094 | 10.376 | 2.339 |
| 7230 | 1 | 0 | 0.170 | 0.900 | 0.396 | 0.312 | –1.163 | 13.727 | 2.619 |
| 7231 | 0 | 0.5 | 0.065 | 0.957 | 0.390 | 0.109 | –2.219 | 34.810 | 3.550 |
| 7232 | 1 | 0.5 | – | 0.968 | 0.606 | – | – | 19.667 | 2.979 |
| 7233 | 0.5 | 0 | 0.085 | 0.788 | 0.404 | 0.137 | –1.987 | 5.483 | 1.702 |
| 7234 | 0.5 | 1 | 0.150 | 0.842 | 0.377 | 0.292 | –1.232 | 8.806 | 2.175 |
| 7247 | 1 | 0.72 | – | 0.962 | 0.720 | – | – | 9.485 | 2.287 |
| 7248 | 0 | 0.20 | 0.015 | – | 0.240 | 0.048 | –3.032 | – | - |
| 7253 | 0 | 0.30 | 0.056 | – | 0.310 | 0.132 | –2.025 | – | - |
| 7254 | 1 | 0.40 | – | 0.914 | 0.439 | – | – | 13.581 | 2.609 |
1) Мольная доля калия в полевом шпате (в натровом минале – для сосуществующих составов полевых шпатов в области распада твердого раствора); 2) мольная доля калия в полевом шпате (в калиевом минале – для сосуществующих составов полевых шпатов в области распада твердого раствора); 3)KD – коэффициент распределения калия между полевым шпатом и флюидом; KD = [$X_{{\text{K}}}^{{Fsp}}$(1 – XKfl)]/[(1 – $X_{{\text{K}}}^{{Fsp}}$)$X_{{\text{K}}}^{{{\text{fl}}}}$]. KD(1) – для распределения натровый минал–флюид; KD(2) – калиевый минал–флюид.
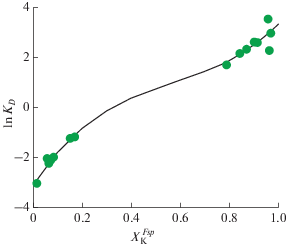
Распределение натрия и калия между полевыми шпатами и флюидом неидеальное, в натровой части системы калий обогащает раствор относительно полевого шпата, затем происходит инверсия и при значениях $X_{{\text{K}}}^{{Fsp}}$ > 0.8 калий перераспределяется в полевой шпат относительно флюида. На рис. 2 показаны результаты катионообменных опытов. Для количественной оценки распределения удобно использовать следующее выражение: KD = = [$X_{{\text{K}}}^{{Fsp}}$(1 – $X_{{\text{K}}}^{{{\text{fl}}}}$)]/[(1 – $X_{{\text{K}}}^{{Fsp}}$)$X_{{\text{K}}}^{{{\text{fl}}}}$]. На рис. 3 показана зависимость lnKD от состава галлиевого полевого шпата. Данная зависимость удачно описывается полиномом 3-й степени: lnKD = 3.0798 + + 14.897($X_{{\text{K}}}^{{Fsp}}$) – 20.4032($X_{{\text{K}}}^{{Fsp}}$)2 + 11.9309($X_{{\text{K}}}^{{Fsp}}$)3 (±0.20).
Рис. 2.
Распределение калия и натрия между галлиевыми щелочными полевыми шпатами и флюидом (550°С, 1.5 кбар).

В целом можно сделать вывод о топологическом сходстве диаграммы распределения Na и K в системе галлиевый полевой шпат–флюид с подобными диаграммами для алюмосиликатных полевых шпатов (Зырянов, 1981).
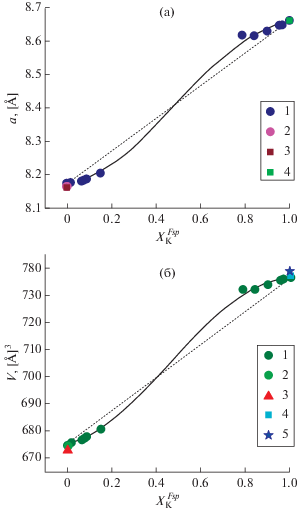
Уточнение параметров элементарных ячеек твердых растворов галлиевых полевых шпатов. Для расчетов параметров в качестве опорных исходных данных мы использовали известные ПЭЯ конечных миналов, взятых из разных источников (Pentinghaus, 1980; Fleet, 1992; Kimata et al., 1995; Котельников, 1995). Результаты расчетов представлены в табл. 4 и на рис. 4. Видно, что ПЭЯ имеют знакопеременное отклонение от идеального. Параметры элементарных ячеек твердого раствора (Na,K)GaSi3O8 полевых шпатов описываются следующими полиномами 3-й степени: Р = A + + BX + CX 2 + DX 3; где P – параметр элементарной ячейки, X – мольная доля калия в твердом растворе. Коэффициенты полиномов приведены в табл. 5. Кривые концентрационных зависимостей ПЭЯ для галлиевых полевых шпатов отличаются от аналогичных для (Al,Si)-полевых шпатов, в которых не наблюдается знакопеременного отклонения от линейного закона.
Таблица 4.
Параметры элементарных ячеек твердых растворов (Na,K)GaSi3O8
| № оп. | $X_{{\text{K}}}^{{Fsp}}$1) | a, [A] | b, [A] | c, [A] | α, [°] | β, [°] | γ, [°] | V, [A]3 | n2) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 0.0 | 8.166 | 12.857 | 7.203 | 94.37 | 116.54 | 87.17 | 674.4 | – |
| 2 | 0.0 | 8.161 | 12.851 | 7.191 | 94.39 | 116.52 | 87.38 | 672.4 | – |
| 3 | 0.0 | 8.166 | 12.858 | 7.204 | 94.37 | 116.52 | 87.14 | 674.6 | – |
| 7196 | 0.0 | 8.170(1) | 12.860(1) | 7.198(1) | 94.32(1) | 116.49(1) | 87.28(1) | 674.9(2) | 93 |
| 7248 | 0.015 | 8.173(1) | 12.864(1) | 7.197(1) | 94.29(1) | 116.46(1) | 87.31(1) | 675.4(2) | 76 |
| 7231 | 0.065 | 8.179(2) | 12.866(2) | 7.199(1) | 93.97(1) | 116.45(1) | 87.50(1) | 676.6(3) | 57 |
| 7229 | 0.074 | 8.182(1) | 12.869(2) | 7.199(1) | 93.93(1) | 116.42(1) | 87.55(1) | 677.1(3) | 54 |
| 7233 | 0.085 | 8.185(2) | 12.871(2) | 7.197(1) | 93.80(1) | 116.39(1) | 87.63(1) | 677.7(3) | 51 |
| 7234 | 0.150 | 8.204(1) | 12.882(1) | 7.198(1) | 93.41(1) | 116.33(1) | 87.90(1) | 680.5(2) | 49 |
| 7233 | 0.788 | 8.618(3) | 13.087(3) | 7.226(2) | 90.0 | 116.08(1) | 90.0 | 732.1(4) | 51 |
| 7234 | 0.842 | 8.616(1) | 13.094(1) | 7.225(1) | 90.0 | 116.10(1) | 90.0 | 732.0(2) | 68 |
| 7230 | 0.900 | 8.629(1) | 13.096(1) | 7.231(1) | 90.0 | 116.11(1) | 90.0 | 733.8(2) | 75 |
| 7231 | 0.957 | 8.647(2) | 13.094(2) | 7.232(2) | 90.0 | 116.08(2) | 90.0 | 735.5(5) | 27 |
| 7232 | 0.968 | 8.648(1) | 13.095(1) | 7.233(1) | 90.0 | 116.08(1) | 90.0 | 735.7(1) | 79 |
| 7197 | 1.00 | 8.661(1) | 13.085(1) | 7.238(1) | 90.0 | 116.11(1) | 90.0 | 736.5(1) | 103 |
| 4 | 1.00 | 8.660 | 13.100 | 7.229 | 90.0 | 116.06 | 90.0 | 736.8 | – |
| 5 | 1.00 | 8.661 | 13.110 | 7.239 | 90.0 | 116.08 | 90.0 | 738.8 | – |
Таблица 5.
Коэффициенты полинома 3-й степени для описания концентрационных зависимостей параметров элементарных ячеек твердых растворов (Na,K)GaSi3O8; вида P = A + BХ + CX 2 + DX 3
| P | A | B | C | D | Eх1) |
|---|---|---|---|---|---|
| a, [A] | 8.1698 | 0.07497 | 1.28774 | –0.875674 | 0.004 |
| b, [A] | 12.861 | 0.044630 | 0.786806 | –0.606182 | 0.003 |
| c, [A] | 7.1979 | –0.002199 | 0.053772 | –0.0122885 | 0.003 |
| β, [°] | 116.491 | –1.13487 | 0.953935 | –0.204766 | 0.007 |
| V, [A]3 | 674.88 | 19.6990 | 148.5299 | –106.9519 | 0.30 |
Оценка точки структурного перехода C1 ↔ C2/m. Изучение положения точки структурного перехода для твердых растворов щелочных полевых шпатов представляет значительный интерес для термодинамических оценок функций смешения, исследования процессов структурного упорядочения и др. Оценку положения точки мы проводили по методике, изложенной в работе (Bambauer et al., 1984). Метод основан на том, что в точке перехода C1 ↔ C2/m углы элементарной ячейки α и γ становятся равными 90°, и, соответственно, значения косинусов этих углов становятся равными 0. В работе (Bambauer et al., 1984) показано, что зависимости величин (1000 cos2α) и (1000 cos2γ) от состава полевого шпата линейны и описываются простыми уравнениями вида: (1000 × cos2α) = A + BX (где X – мольная калия в твердом растворе полевого шпата). Подобная методика оценки точки перехода ранее использовалась для систем (Na,Sr)-, (Na,Ba)-, (K,Rb)-полевых шпатов (Котельников 1995). В табл. 6 приведены исходные данные для расчета подобного типа уравнений. В результате получены следующие уравнения: (1000 cos2α) = = 5.776 – 15.201X; (1000 cos2γ) = 2.216 – 5.653X. Решение этих уравнений для нулевых значений (1000 cos2α) и (1000 cos2γ) дает следующее значение точки перехода: $X_{{\text{K}}}^{{Fsp}}$ = 0.385 (± 0.015). Эти значения близки к составам точки перехода Abh ↔ San для системы (Al,Si)-щелочных полевых шпатов ($X_{{\text{K}}}^{{Fsp}}$ ≈ 0.45) по данным, приведенным в работах (Smith, 1974; Kroll et al., 1986).
Таблица 6.
Зависимости углов α и γ, а также величин 103(cos2α) и 103(cos2γ) от состава галлиевого полевого шпата ($X_{{\text{K}}}^{{Fsp}}$)
| $X_{{\text{K}}}^{{Fsp}}$1) | α, [°] | 103(cos2α) | γ, [°] | 103(cos2γ) |
|---|---|---|---|---|
| 0.000 | 94.39 | 5.860 | 87.38 | 2.091 |
| 0.000 | 94.32(1) | 5.674 | 87.28(1) | 2.252 |
| 0.015 | 94.29(1) | 5.596 | 87.31(1) | 2.203 |
| 0.065 | 93.97(1) | 4.793 | 87.50(1) | 1.903 |
| 0.074 | 93.93(1) | 4.697 | 87.55(1) | 1.827 |
| 0.085 | 93.80(1) | 4.390 | 87.63(1) | 1.711 |
| 0.150 | 93.40(1) | 3.520 | 87.90(1) | 1.341 |
Примечание. 103(cos2α) = 5.776 – 15.201X; X(t/m) = 0.38(±0.05). 103(cos2γ) = 2.216 – 5.653X; X(t/m) = 0.39(±0.05). Сред. X(t/m) = = 0.385 ± 0.05, где Х – мольная доля калия в галлиевом полевом шпате; X(t/m) – состав полевого шпата, при котором осуществляется переход от триклинного типа структуры (t) к моноклинному (m). 1) Мольная доля калия в натровой фазе галлиевых полевых шпатов.
Расчет избыточных энергий смешения твердых растворов галлиевых полевых шпатов. Из полученных нами экспериментальных данных по свойствам твердого раствора полевых шпатов и результатов изучения катионообменных равновесий можно рассчитать избыточные энергии смешения. Для описания твердого раствора галлиевых щелочных полевых шпатов мы использовали двупараметрическую модель Маргулеса, описание которой дано в работах (Саксена, 1975; Перчук, Рябчиков, 1976). Показано, что эти модели хорошо описывают твердые растворы каркасных алюмосиликатов (Шведенков, Шведенкова, 1982; Котельников 1995). Данная модель описывается следующим уравнением: G ex = (1 – $X_{{\text{K}}}^{{Fsp}}$)($X_{{\text{K}}}^{{Fsp}}$)2W1 + (1 – $X_{{\text{K}}}^{{Fsp}}$)2($X_{{\text{K}}}^{{Fsp}}$) × × W2, где W1, W2 – энергетические константы твердого раствора. Расчет параметров модели Маргулеса можно проводить двумя способами: (1) по границам области распада твердого раствора, данный метод подробно описан в работах (Перчук, Рябчиков, 1976; Котельников, 1995). Этот метод позволяет получать непосредственные значения энергетических параметров W1 и W2. (2) метод расчета по зависимости логарифма коэффициента распределения калия в системе полевой шпат–флюид от состава твердого раствора. Этот способ расчета с использованием уравнения Гиббса–Дюгема был предложен в работах (Orville, 1963, 1972) и в дальнейшем использован для расчета коэффициентов активностей твердых растворов полевых шпатов и нефелина в работе В.Н. Зырянова (1981). Данный метод позволяет рассчитывать значения коэффициентов активностей миналов твердого раствора. При расчете используется допущение об идеальности флюидной фазы. Это допущение для гидротермальных растворов NaCl и KCl (c концентрацией солей 1М) было экспериментально подтверждено работами (Orville, 1963) и В.Н. Зырянова (1981). Расчет коэффициентов активности методом, предложенным в работах (Orville, 1963, 1972), позволяет оценить возможность применения модели Маргулеса к данному типу твердых растворов. По расчетным значениям коэффициентов активности методом наименьших квадратов подбираются значения энергетических параметров Маргулеса (W1, W2). Наши экспериментальные данные позволяют провести расчет параметров W1, W2, используя оба метода. Значения параметров Маргулеса, рассчитанные вышеприведенными методами, следующие: (1) расчет по границам области распада: W1 = 17.27 ± 2.2 и W2 = 18.64 ± 2.2 кДж/моль; (2) расчет по концентрационной зависимости lnKD: W1 = 12.34 ± 1.5 и W2 = 21.67 ± 3.8 кДж/моль. В данном случае, для дальнейших расчетов лучше использовать значения параметров Маргулеса, рассчитанных по границам области распада твердых растворов. Это связано с короткими краевыми отрезками изотерм, для которых рассчитывали зависимость величин lnKD от состава. Поэтому погрешность оценок величин коэффициентов распределения высока. Для обсуждения результатов мы использовали значения параметров Маргулеса, рассчитанных по границам области распада твердого раствора.
Расчет избыточных объемов смешения твердых растворов галлиевых полевых шпатов. В качестве исходных данных для расчета использовали ПЭЯ, рассчитанные для синтезированных галлиевых полевых шпатов (табл. 4, 5). Расчет выполняли по зависимости: V ex = V – V id; использовали следующее уравнение:
где Х – мольная доля калия в галлиевом полевом шпате.
Избыточный объем смешения имеет знакопеременный характер, при $X_{{\text{K}}}^{{Fsp}}$ < 0.4 объем отрицательный, при $X_{{\text{K}}}^{{Fsp}}$ > 0.4 положительный. Полученные значения избыточных объемов смешения хорошо описываются следующим полиномом 3-й степени:
Методом наименьших квадратов по данному полиному рассчитывали значения параметров модели Маргулеса: W1 = 9.84 ± 1.6 и W2 = –6.27 ± ± 0.8 см3/моль.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Наши данные по оценке избыточных функций смешения твердых растворов галлиевых щелочных полевых шпатов позволяют провести сравнение с другими твердыми растворами полевых шпатов и фельдшпатоидов. Величины отклонения от идеального поведения удобно оценивать, используя интегрированые значения величин G e и V e (Котельников, 1995). Данные значения получаются при интегрировании величин избыточных функций: $G_{{{\text{int}}}}^{e} = \int_0^1 {{{G}^{e}}d{{X}_{i}}} $; $V_{{{\text{int}}}}^{e} = \int_0^1 {{{V}^{e}}d{{X}_{i}}} ;$ где Xi – мольная доля i-го минала полевых шпатов. Эти интегрированные величины позволяют проводить сравнение различных твердых растворов каркасных алюмосиликатов вне зависимости от типа изоморфных замещений. Величина $G_{{{\text{int}}}}^{e}$ может использоваться только для сравнения суммарного отклонения твердых растворов от идеальности. Для термодинамических расчетов используются величины параметров модели Маргулеса или численные значения коэффициентов активности.
В табл. 7 представлены результаты расчетов интегрированных избыточных энергий (Котельников, 1995) твердых растворов полевых шпатов и фельдшпатоидов. Расчеты выполняли по изложенной выше методике. В основном использовали данные, полученные в диапазоне температур от 500 до 800°С, температурная зависимость избыточных энергий смешения в первом приближении считалась незначимой. Для описания избыточных энергий смешения использовали двупараметрическую модель Маргулеса (Саксена, 1975). В табл. 7 приведены: 1) разница радиусов изоморфных катионов (ΔRi); 2) значения средних расстояний кислород–каркасообразующий катион (〈T–O〉); 3) средние радиусы тетраэдрически координированных катионов в каркасных структурах полевых шпатов ($R_{i}^{{\text{T}}}$); 4) расчетные величины энергетических параметров модели Маргулеса (W1 и W2); 5) интегрированные избыточные энергии смешения ($G_{{{\text{int}}}}^{e}$). Показано, что величины (〈T–O〉) и $R_{i}^{{\text{T}}}$ для полевых шпатов находятся в линейной зависимости:
Таблица 7.
Значения параметров W1, W2 (кДж/моль) двупараметрической модели Маргулеса для избыточных энергий и объемов смешения твердых растворов полевых шпатов
| Изомор. элементы, тип КА1) | С2) | Р3) | ΔRi4) [A] |
$\left\langle {{\text{T}}{\kern 1pt} - {\kern 1pt} {\text{O}}} \right\rangle $ [A]5) | RiT6) [A] | A17) | A27) | W1G8) кДж/моль |
W2G8) кДж/моль |
Geint9) кДж/моль | W1V10) см3/моль |
W2V10) см3/моль |
Veint см3/моль11) |
Литературная ссылка |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Na-Ca Fsp | + | + | 0.060 | 1.660 | 0.449 | 0.036 | 0.134 | 6.5 | 2.9 | 0.781 | 0.16 | 0.15 | 0.03 | Котельников, 1980, 1995 |
| Na-Sr Fsp | + | – | 0.190 | 1.661 | 0.449 | 0.114 | 0.423 | 7.9 | 4.7 | 1.047 | 3.98 | 3.34 | 0.70 | Котельников и др., 1987 |
| Na-Ba Fsp | + | + | 0.240 | 1.675 | 0.449 | 0.143 | 0.534 | 12.5 | 16.5 | 2.411 | 17.5 | –4.9 | 1.05 | Котельников и др., 1990 |
| K-Ca Fsp | + | + | –0.480 | 1.661 | 0.449 | –0.289 | –1.069 | 24.4 | 16.6 | 3.400 | –2.8 | –3.4 | –0.52 | Lagache, 1988; Viswanathan, 1970 |
| K-Sr Fsp | – | – | –0.240 | 1.658 | 0.449 | –0.145 | –0.534 | 11.1 | 8.5 | 1.629 | –2.34 | –1.99 | –0.39 | Kroll et al., 1995 |
| K-Ba Fsp | – | – | –0.080 | 1.658 | 0.449 | –0.048 | –0.178 | 3.4 | 2.8 | 0.524 | 0.02 | 0.48 | 0.042 | Котельников и др., 1999 |
| Ca-Sr Fsp | + | – | 0.250 | 1.678 | 0.465 | 0.149 | 0.538 | 16.2 | 16.2 | 2.693 | 3.52 | –1.07 | 0.204 | Нагер, 1974; Котельников и др., 1989 |
| Sr-Ba Fsp | – | – | 0.160 | 1.675 | 0.465 | 0.095 | 0.344 | 9.2 | 9.2 | 1.538 | 0.46 | 0.68 | 0.095 | Kotelnikov, Chernysheva, 1995 |
| Ca-Ba Fsp | + | + | 0.410 | 1.678 | 0.465 | 0.244 | 0.882 | 31.3 | 28.8 | 4.996 | 6.40 | –3.30 | 0.258 | Котельников, 1995 |
| Na-K Fsp | + | + | 0.420 | 1.642 | 0.4329 | 0.256 | 0.972 | 11.7 | 24.8 | 3.040 | 3.30 | 3.69 | 0.570 | Зырянов, 1981; Kroll et al., 1986 |
| K-Rb Fsp | – | – | 0.080 | 1.642 | 0.432 | 0.049 | 0.185 | 4.2 | 4.2 | 0.723 | 1.71 | –0.60 | 0.092 | Carron, Lagache, 1980 |
| Na-Rb Fsp | + | + | 0.510 | 1.643 | 0.432 | 0.310 | 1.181 | 26.2 | 39.5 | 5.461 | – | – | То же | |
| Na-K GaFsp | + | + | 0.420 | 1.663 | 0.453 | 0.252 | 0.927 | 12.4 | 20.5 | 2.735 | 9.84 | –6.27 | 0.290 | Настоящая работа |
| Na-K GeFsp | + | + | 0.420 | 1.734 | 0.530 | 0.242 | 0.792 | 17.1 | 25.1 | 3.510 | – | – | Pentinghaus, 1980 | |
| Ca-Ba GeFsp | + | + | 0.410 | 1.730 | 0.530 | 0.237 | 0.773 | 22.3 | 19.7 | 3.491 | – | – | Pentinghaus, 1980 | |
| Na-K (Ge,Si)Fsp | + | + | 0.420 | 1.688 | 0.481 | 0.249 | 0.873 | 7.2 | 22.3 | 2.452 | Deckers et al., 1986 | |||
| (B,Al) Fsp | – | + | 0.280 | 1.615 | 0.397 | 0.173 | 0.705 | 23.9 | 16.6 | 3.366 | – | – | Pichavant et al., 1984 | |
| Na-Ca GaFsp | + | – | 0.060 | 1.679 | 0.479 | 0.035 | 0.125 | – | – | – | 1.92 | –2.33 | –0.036 | Котельников, 1995 |
| Al-Fe3+ KFsp |
– | + | 0.10 | 1.659 | 0.445 | 0.060 | 0.268 | 10.5 | 16.8 | 2.275 | – | – | Bambauer et al., 1974; Pentinghaus, 1980 | |
| Al-Ga NaGeFsp | – | – | 0.08 | 1.750 | 0.540 | 0.046 | 0.148 | – | – | – | 0.67 | 0.23 | 0.075 | Pentinghaus, 1980 |
| Al-Ga KGeFsp | – | – | 0.08 | 1.750 | 0.540 | 0.046 | 0.148 | – | – | – | 1.24 | –0.30 | 0.078 | Pentinghaus, 1980 |
| Na-K Ne-Ks | + | + | 0.420 | 1.640 | 0.465 | 0.256 | 0.903 | 22.8 | 11.4 | 2.843 | – | – | Зырянов, 1981 |
1) Изоморфные элементы в твердых растворах каркасных алюмосиликатов; 2) наличие структурного перехода (СП) в твердом растворе: (+) есть; (–) нет; 3) существование области распада твердого раствора: (+) есть; (–) нет; 4) ΔRi – разница величин ионных радиусов изоморфных катионов для соответствующего координационного числа; по данным (Shannon, Prewitt, 1970). Для изовалентного изоморфизма использовали значение абсолютной величины |ΔRi|; для гетеровалентного изоморфизма ΔRi = R(ii) – R(i), т.е. разница между радиусом двухвалентного катиона и радиусом одновалентного катиона; 5) средние расстояния T–O для тетраэдрических катионов в структурах полевых шпатов; по данным (Ribbe, Gibbs, 1969; Phillips, Ribbe, 1973; Pentinghaus, 1980); 6)$R_{i}^{{\text{T}}}$ – cредний размер тетраэдрического катиона; 7) параметры: А1 = |ΔRi|/(〈T–O〉); A2 = = |ΔRi|/($R_{i}^{{\text{T}}}$); для гетеровалентного изоморфизма использовано значение ΔRi = R(ii) – R(i), т.е. разница между радиусом двухвалентного катиона и радиусом одновалентного катиона. Соответственно величины А1 и А2 для систем с гетеровалентным изоморфизмом могут иметь отрицательные значения. 8) Параметры модели Маргулеса для описания избыточной энергии смешения; 9)$G_{{\operatorname{int} }}^{e}$ – интегрированная величина избыточной энергии смешения; 10) значения средних 〈T–O〉 и $R_{i}^{{\text{T}}}$ рассчитывали для состава Na(B0.5Al0.5)Si3O8; 11)$V_{{\operatorname{int} }}^{e}$ – интегрированная величина избыточного объема смешения.
Таким образом, можно рассчитывать средние длины связей 〈T–O〉 для полевошпатовых структур на основе данных о среднем размере каркасообразующего катиона (T), что значительно проще, чем пересчет данных рентгеновских измерений.
Для сравнения твердых растворов удобно использовать зависимости $G_{{{\text{int}}}}^{e}$ от приведенных безразмерных величин A1 и A2: A1 = (ΔRi)/(〈T–O〉) и A2 = (ΔRi)/$R_{i}^{{\text{T}}}$. Поскольку величины $G_{{{\text{int}}}}^{e}$ имеют положительные значения (независимо от типа изоморфизма), то для нахождения зависимостей использованы абсолютные величины |A1| и |A2|. Зависимости значений $G_{{{\text{int}}}}^{e}$ от величин |A1| и |A2| описываются линейными уравнениями регрессии:
Из табл. 7 видно, что интегральная избыточная энергия смешения для твердых растворов (Na,K)GaSi3O8 составляет 2.73 кДж/моль, что несколько меньше, чем для твердого раствора альбит–санидин (3.04 кДж/моль). Это может быть связано с большим размером элементарной ячейки галлиевых полевых шпатов, что может облегчать изоморфные замещения Na ↔ K. Тем не менее на рис. 5а, 5б видно, что галлиевые полевые шпаты по величине $G_{{{\text{int}}}}^{e}$ и значениям приведенных величин (A1, A2) близки к расчетной линии регрессии $G_{{{\text{int}}}}^{e}$ = a0 + a1(A1, A2), фактически не отличаясь от других твердых растворов полевых шпатов как с изо-, так и с гетеровалентным типом изоморфных замещений.
Рис. 5.
Зависимости интегрированных энергий смешения твердых растворов полевых шпатов от параметров А1 (а), А2 (б). A1 = (ΔRi)/($\left\langle {{\text{T}}{\kern 1pt} --{\kern 1pt} {\text{O}}} \right\rangle $); A2 = (ΔRi)/$R_{i}^{{\text{T}}}$.

На основе рентгеновских данных проведена оценка избыточного объема смешения твердых растворов галлиевых щелочных полевых шпатов.
Как было показано ранее (Kroll et al., 1995; Котельников, 1995), избыточные объемы смешения твердых растворов полевых шпатов, в отличие от избыточных энергий смешения, могут иметь отрицательные значения. Это наблюдается для систем с гетеровалентным типом изоморфизма. Для твердых растворов полевых шпатов было выведено следующее эмпирическое правило: избыточный объем смешения положительный в том случае, если меньший по размеру одновалентный катион замещается большим двухвалентным катионом (системы: Na–Sr, Na–Ba); в противном случае, когда больший по размерам одновалентный катион замещается на меньший двухвалентный (системы: K–Sr, K–Ca), избыточный объем смешения отрицательный. Значительная часть твердых растворов каркасных алюмосиликатов имеют знакопеременные значения избыточных объемов смешения (табл. 7). Чаще всего это связано с наличием структурного перехода. Для нахождения зависимости интегрированных избыточных объемов смешения от кристаллохимических параметров A1, A2 целесообразно разделить твердые растворы полевых шпатов на группы с изовалентным и гетеровалентным типом изоморфных замещений. Связь величин $V_{{{\text{int}}}}^{e}$ c параметрами A1, A2 (для изовалентного типа изоморфизма) описывается следующими уравнениями 2-й степени (рис. 6а):
Рис. 6.
Зависимость интегрированных объемов смешения от кристаллохимического параметра А2 для систем с изовалентным типом изоморфных замещений (а) и для систем с гетеровалентным типом изоморфных замещений (б).

Для систем твердых растворов с гетеровалентным типом изоморфизма (величины $V_{{{\text{int}}}}^{e}$ могут иметь отрицательные значения) связь интегрированных объемов смешения с параметрами A1, A2 хорошо описывается уравнениями 2-й степени (рис. 6б):
Резюмируя вышесказанное, можно сделать следующие заключения. Твердые растворы каркасных алюмосиликатов со структурами полевых шпатов и нефелина характеризуются четкой связью величин избыточных функций смешения (интегрированных избыточных энергий и объемов) со структурными особенностями. Показано, что практически все исследованные системы (в количестве 19 твердых растворов) имеют положительные значения избыточных энергий смешения; в то время как значения избыточных объемов смешения могут быть отрицательными (Котельников, 1995). Для систем твердых растворов, которые имеют структурный переход, величины избыточных объемов смешения могут иметь знакопеременный характер. Для твердых растворов с гетеровалентным типом изоморфных замещений с крупным одновалентным катионом, который замещается меньшим по размеру двухвалентным катионом, значения избыточных объемов смешения отрицательны. Показаны функциональные связи интегрированных величин избыточных энергий и объемов смешения с кристаллохимическими параметрами, количественно описанных полиномами первого и второго порядка. Изученные нами твердые растворы системы NaGaSi3O8–KGaSi3O8 также соответствуют этим зависимостям. Полученные закономерности позволяют по структурным параметрам оценивать величины энергетических функций смешения твердых растворов каркасных алюмосиликатов.
ВЫВОДЫ.
1. Проведено экспериментальное исследование катионообменных реакций в системе (Na,K)GaSi3O8–флюид при 550°С и 1.5 кбар для получения данных о распределении натрия и калия между полевых шпатом и раствором.
2. Определены границы области несмесимости твердого раствора, определены концентрационные зависимости коэффициентов распределения натрия и калия между полевым шпатом и флюидом.
3. Уточнены параметры элементарных ячеек твердых растворов (Na,K)GaSi3O8, показано, что зависимость объема смешения от состава имеет знакопеременный характер. Определен состав твердого раствора, при котором происходит структурный переход С1–С2/m.
4. На основании экспериментальных данных проведен расчет избыточных энергий смешения твердого раствора и рассчитаны параметры модели Маргулеса.
5. На основе литературных данных и результатов наших экспериментов проведена корреляция избыточных интегрированных энергий и объемов смешения со структурными параметрами.
Источники финансирования. Исследование выполнено в рамках программы НИР ИЭМ РАН тема № АААА-А18-118020590151-3.
Список литературы
Валяшко В.М. Фазовые равновесия и свойства гидротермальных систем. М.: Наука, 1990. 220 с.
Васильев Н.С. Стабильность и кинетика структурных превращений щелочных полевых шпатов. Автореф. дисс. канд. хим. наук. М.: ГЕОХИ АН СССР, 1990. 20 с.
Зырянов В.Н. Фазовое соответствие в системах щелочных полевых шпатов и фельдшпатоидов. М.: Наука, 1981. 181 с.
Котельников А.Р. Расчет функций смешения твердого раствора плагиоклаза // Геохимия. 1980. № 2. С. 226–230.
Котельников А.Р. Изоморфизм в каркасных алюмосиликатах. Автореф. дисс. докт. геол-мин. наук. М.: МГУ, 1995. 36 с.
Котельников А.Р., Бычков А.М., Зырянов В.Н. и др. Фазовое превращение цеолита в полевой шпат – способ создания алюмосиликатных матриц для связывания радионуклидов // Геохимия. 1995. № 10. С. 1527–1532.
Котельников А.Р. Минералы как матричные материалы для фиксации радионуклидов // Геоэкология. 1997. № 6. С. 3–15.
Котельникова З.А., Иванов Д.Ю., Котельников А.Р. Фазовое состояние высокотемпературных растворов хлоридов щелочных и щелочноземельных металлов по данным синтетических флюидных включений // Тр. IX Международной конференции по термобарогеохимии. Александров: ВНИИИСИМС, 1999. С. 252–262.
Котельников А.Р., Кравчук И.Ф., Романенко И.М., Карабцов А.А. Экспериментальное изучение распределения Na, Sr между плагиоклазом и водно-солевым флюидом при 800°С и 2 кбар // Геохимия. 1987. № 1. С. 33–43.
Котельников А.Р., Чернышева И.В., Романенко И.М., Тихомирова В.И. Экспериментальное определение энергий смешения Ca-Sr анортитов по данным катионообменных равновесий // Геохимия. 1989. № 11. С. 1575–1585.
Котельников А.Р., Романенко И.М., Котельникова З.А. Экспериментальное изучение распределения бария между плагиоклазом ряда NaAlSi3O8–BaAl2Si2O8 и водно-солевым флюидом при 800°С и 2 кбар // Геохимия. 1990. № 3. С. 346–355.
Котельников А.Р., Чернышева И.В., Котельникова З.А., Сенин В.Г. Экспериментальное изучение изоморфизма в (К,Ва)-полевых шпатах // Геохимия. 1999. № 4. С. 393–403.
Перчук Л.Л., Рябчиков И.Д. Фазовое соответствие в минеральных системах. М.: Недра, 1976. 287 с.
Равич М.И. Водно-солевые системы при повышенных температурах и давлениях. М.: Наука, 1974. 151 с.
Саксена С. Термодинамика твердых растворов породообразующих минералов. М.: Мир, 1975. 208 с.
Шведенков Г.Ю., Шведенкова С.В. Полевые шпаты под давлением воды и двуокиси углерода. Новосибирск: Наука CO, 1982. 166 с.
Bambauer H.U., Kroll H., Nager H.E., Pentinghaus H. Feldspat–Mischkristalle – Eine Ubersicht // Bull. Soc. Fr. Mineral. Cristallogr. 1974. V. 97. P. 313–345.
Bambauer H.U., Schops M., Pentinghaus H. Feldspar phase relations in the system NaAlSi3O8–SrAl2Si2O8 // Bull. Mineral. 1984. V. 107. P. 541–551.
Bodnar R.J., Burnham C.W., Sterner M.S. Synthetic fluid inclusions in natural quartz. III. Determination of phase equilibrium properties in the system H2O–NaCl to 1000°C and 1500 bars // Geochim. Cosmochim. Acta. 1985. V. 49. P. 1861–1873.
Burnham C.W. Least-squares refinement of crystallographic lattice parameters for IBM PC/XT/AT and compatibles. Cambridge: Harvard University, 1991. (Program Description, 24 p.).
Carron J.P., Lagache M. Étude expérimentale du fractionnement des éléments Rb, Cs, Sr, et Ba, entre les feldspaths alcalins, solutions hydrothermales et liquides silicatés dans le système Q.Ab.Or.H2O à 2 kbar entre 700 et 800°C // Bull. de Minéralogie. 1980. V. 103. P. 571–578.
Chichagov A.V. Information-calculating system on crystal structure data of minerals (MYNCRYST) // Materials Science Forum, vols. 166–169. Trans Tech Publications. Switzerland. 1994. P. 187–192.
Deckers B., Kroll H., Pentinghaus H. Mechanism and kinetics of Na,K-unmixing in Al(Si,Ge) alkali feldspars // Mater. Sci. For. 1986. V. 7. P. 103–112.
Fleet M.E. Structures of low gallium albite (NaGaSi3O8) and intermediate germanium albite (NaAlGe3O8): Tetrahedral-site ordering in sodium feldspar // Amer. Mineral. 1992. V. 77. P. 76–84.
Kimata M., Saito S., Shimizu M. Structure of sanidine type KGASi3O8 tetrahedral-site disordering in potassium feldspar // Eur. J. Mineral. 1995. V.7. P. 287–296.
Kotelnikov A.R., Schipalkina N.V., Suk N.I. Synthesis of As-containing feldspars and feldspathoids // Experiment in GeoSciences. 2019. V. 25. № 1. P. 99–102.
Kroll H., Kotelnikov A.R., Goettlisher J., Valyashko T.V. (K,Sr)-feldspar solid solutions: The volume behavior of heterovalent feldspars // Eur. J. Mineral. 1995. V. 7. P. 489–499.
Kroll H., Schmiemann I., von Colln G. Feldspar solid solutions // Amer. Mineral. 1986. V. 71. P. 1–16.
Lagache M. Etude experimentale du partage de K et Ca entre sanidine – anortite et solutions hydrothermales: Influence de la temperature // Bull. Mineral. 1988. V. 111. P. 471–475.
Orville P.M. Alkali ion exchange between vapor and feldspar phases // Amer. J. Sci. 1963. V. 261. P. 201–237.
Orville P.M. Plagioclase cation exchange equilibria with aqueous chloride solution: Results at 700°C and 2000 bars // Amer. J. Sci. 1972. V. 272. № 3. P. 234–273.
Pentinghaus H. Polimorphie in den feldspatbildenden systemen A + T3 + T4 + O8 und A2 + T23 + T24 + O8 alkali- und erdalkali-, bor-, aluminium-, gallium-, eisen-silicate und germanate // Habil. Diss. Munster. 1980. 210 p.
Phillips M.V., Ribbe P.H. The structures of monoclinic potassium – rich feldspars // Amer. Mineral. 1973. V. 58. P. 263–270.
Pichavant M., Schnapper D., Brown W.L. Al-substitution in alkali feldspars: Preliminary hydrothermal data in the system NaAlSi3O8–NaBSi3O8 // Bull. Mineral. 1984. V. 107. P. 529–537.
Reed S.J.B. Electron microprobe analysis and scanning electron microscopy in geology. Cambridge: Cambridge University Press, 2005. 192 p.
Ribbe P.H., Gibbs G.V. Statistical analysis and discussion of mean Al/Si-O bond distances and the aluminium content of tetrahedral in feldspars // Amer. Mineral. 1969. V. 54. P. 85–96.
Shannon R.P., Prewitt C.T. Revised values of effective ionic radii // Acta Crystallogr. 1970. V. 26. P. 1046–1048.
Smith J.V. Feldspar minerals. New York: Springer, 1974. 627 p.
Sterner S.M., Chou I.-Ming, Downs R.T., Pitzer Kenneth S. Phase relations in the system NaCl–KCl–H2O: V. Thermodynamic-PTX analysis of solid-liquid equilibria at high temperatures and pressures // Geochim. Cosmochim. Acta. 1992. V. 56. № 6. P. 2295–2309.
Дополнительные материалы отсутствуют.
Инструменты
Петрология