Петрология, 2022, T. 30, № 3, стр. 331-342
Экспериментальное исследование многокомпонентной химической диффузии петрогенных компонентов (SiO2, Al2O3, Na2O, CaО, MgO, FeO) и аниона ${\text{CO}}_{3}^{{2 - }}$ при взаимодействии базальтовых и кимберлитовых расплавов при умеренном давлении
Э. С. Персиков a, *, П. Г. Бухтияров a, **, А. Н. Некрасов a, ***
a Институт экспериментальной минералогии им. Академика Д.С. Коржинского РАН
Черноголовка, Московская обл., Россия
* E-mail: persikov@iem.ac.ru
** E-mail: pavel@iem.ac.ru
*** E-mail: alex@iem.ac.ru
Поступила в редакцию 09.08.2021
После доработки 23.09.2021
Принята к публикации 28.10.2021
- EDN: XWXMDA
- DOI: 10.31857/S0869590322020066
Аннотация
Представлены первые результаты экспериментальных исследований особенностей встречной химической диффузии главных петрогенных компонентов (SiO2, Al2O3, Na2O, CaО, MgO, FeO) и карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ при взаимодействии базальтовых и кимберлитовых расплавов при умеренном давлении. Исследования проводились с использованием оригинальной установки высокого газового давления при давлении Ar или CO2, равном 100 МПа, и температуре 1300°С с применением метода диффузионных пар. Установлено, что скорость встречной химической диффузии всех основных компонентов расплавов (SiO2, Al2O3, Na2O, CaО, MgO) и карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ практически идентична при взаимодействии модельных базальтовых и кимберлитовых карбонатсодержащих расплавов и примерно на порядок величины больше скорости диффузии этих компонентов при взаимодействии расплавов в более полимеризованной модельной системе андезит–базальт (Ab75Di25–Ab50Di50). Последнее обусловлено существенно меньшей вязкостью граничного расплава (граница Монтана), который образуется при взаимодействии модельных базальтового и кимберлитового расплавов. Равные скорости диффузии СаО и карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ свидетельствуют о минальном характере диффузии карбоната СаСО3 из кимберлитового в базальтовый (модельные и природные) расплав. Диффузионная картина существенно меняется при взаимодействии расплава природного магнезиального базальта и модельного кимберлита. При этом сохраняется минальный характер диффузии кальцита в магнезиальный базальт. Тогда как скорость диффузии остальных компонентов расплавов (SiO2, MgO и FeO) становится существенно выше. Установлена также слабая экспоненциальная концентрационная зависимость всех диффундирующих компонентов, которая близка к D(i) = constant.
ВВЕДЕНИЕ
Давно признано, что диффузия компонентов в силикатных расплавах играет решающую роль во множестве магматических процессов (Bowen, 1921). Многие силикатные расплавы, представляющие интерес, состоят из трех или более оксидных компонентов (например, SiO2, Al2O3, TiO2, FeO, MgO, CaO, Na2O, K2O, CO2 и H2O). Химическая диффузия в таких системах называется “многокомпонентной диффузией”. Многокомпонентная диффузия включает в себя массовые потоки, управляемые градиентами химического потенциала, и является важным механизмом массопереноса для многих транспортных процессов. Хотя диффузия является микроскопическим процессом, она может привести к макроскопическим эффектам. Например, начальная фаза взрывных вулканических извержений (или более часто встречающихся извержений типа шампанского) зависит от скорости роста пузырьков и, в свою очередь, контролируется диффузией, которая приводит молекулы газа в пузырьки. Поскольку диффузия играет решающую роль во многих геологических процессах, петрологии и геохимии, эти данные часто используют при разработке различных моделей, включая интерпретацию возраста горных пород и тепловых событий, условий формирования и сохранения химического состава и изотопного фракционирования минералов, контроля размеров пузырьков в вулканических породах и процессов, влияющих на характер вулканических извержений.
Одной из основных проблем, связанных с многочисленными приложениями данных о диффузии, является получение надежных экспериментальных данных, так как диффузионные свойства, определенные в разных лабораториях, могут отличаться на порядки (например, Liang, 2010). Особенности многокомпонентной химической диффузии петрогенных и летучих компонентов при взаимодействии магматических расплавов были изучены недостаточно (например, Watson, Baker, 1991; Watson, 1994; Kress, Ghiorso, 1995). Большинство опубликованных работ по химической диффузии петрогенных компонентов в магматических расплавах выполнены методом растворения минералов (Watson, Baker, 1991 и др.). Тогда как исследования химической встречной диффузии этих компонентов непосредственно в расплавах крайне ограничены (Yoder, 1973; Watson, Baker, 1991). И практически отсутствуют данные по многокомпонентной химической диффузии компонентов при взаимодействии базальтовых и ультраосновных карбонатсодержащих магм. В настоящей работе методом диффузионных пар, с использованием уникальной установки высокого газового давления, получены новые экспериментальные данные по встречной химической диффузии петрогенных компонентов (SiO2, Al2O3, Na2O, CaО, MgO, FeO) и карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ при взаимодействии кимберлитовых и базальтовых расплавов при умеренном давлении 100 МПа и температуре 1300°С.
ЭКСПЕРИМЕНТАЛЬНЫЕ И АНАЛИТИЧЕСКИЕ МЕТОДЫ
Эксперименты проводились на уникальной установке высокого газового давления с внутренним нагревом, снабженной оригинальным внутренним устройством с уравнителем-разделителем высокого давления. Диффузионные опыты проводились в платиновых ампулах, геометрия которых не изменялась в процессе опыта при высоких давлениях и температурах (рис. 1). Внутренний объем реактора (5) с заваренной платиновой ампулой со стартовой диффузионной парой (6) и уравнителем-разделителем (9) под поршнем (10) заполняли Ar или СО2 при давлении 10 МПа с использованием специальной системы.
Рис. 1.
Схема оригинального внутреннего устройства (уравнитель-разделитель) установки высокого газового давления с нагревателем. 1, 3 – изоляторы; 2 – двухсекционный нагреватель; 4 – измерительные термопары; 5 – молибденовый реактор; 6 – Pt-ампула с расплавом диффузионной пары; 7 – регулирующие термопары; 8 – заглушка; 9 – корпус уравнителя-разделителя; 10 – поршень; 11 – вентиль; 12 – датчик положения поршня; 13 – крышка; 14 – Pt-ампула с кислородным буфером (Persikov et al., 2018).
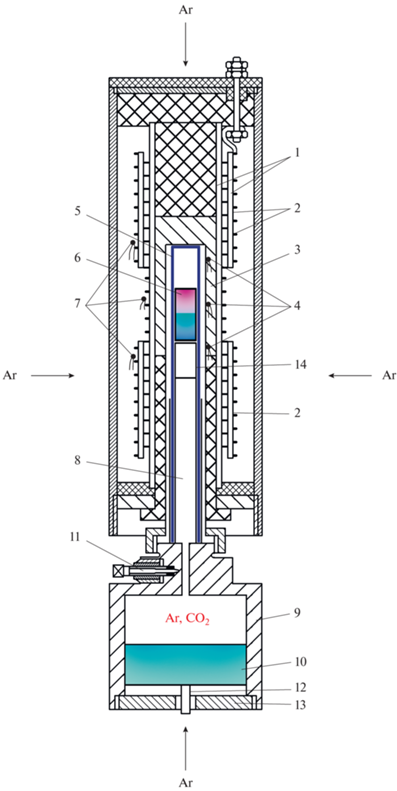
Собранное таким образом устройство вместе с внутренним нагревателем (2) размещали внутри сосуда высокого газового давления так, чтобы ампула с образцом (6) находилась в безградиентной температурной зоне нагревателя. За счет перемещения поршня (10) давление аргона в сосуде в процессе опыта всегда сохранялось равным давлению Ar или СО2 во внутреннем объеме реактора (5). В начале эксперимента давление аргона в сосуде и, соответственно, в реакторе (5) поднимали в течение одного часа до необходимого значения – 100 МПа. Далее повышали температуру опыта до 1100°С, и выдерживали опыт в течение двух часов в автоматическом режиме. При этих параметрах, т.е. еще до плавления образцов, скорость взаимной диффузии была очень мала. Далее в течение 1–2 мин температуру быстро увеличивали до нужного значения (1300°С) и выдерживали параметры в течение необходимого времени диффузионных опытов (180 и 360 с в первой серии опытов или 80 и 120 с во второй), после чего осуществлялась изобарическая закалка при выключенном внутреннем нагревателе установки. При этом достигалась достаточно высокая скорость закалки расплава (~300°С/мин), которая обеспечивала сохранение стекол без кристаллизации расплава. Погрешность измерения температуры опыта составляла ±5°С, а давления Ar или CO2 – ± 0.1 отн. %. После изобарической закалки устройство извлекали из сосуда, Pt-ампулу с образцом вынимали из молибденового реактора и далее изготовляли полированную с одной стороны поперечную пластину для последующего анализа диффузионного профиля, возникшего в расплаве во время опыта. В качестве исходных образцов для получения стекол, используемых в диффузионных опытах, применяли растертые в агатовой ступке порошки магнезиального базальта Большого трещинного извержения 1975–1976 г. вулкана Толбачик на Камчатке (Большое …, 1984), а также порошки модельных базальта (Ab50Di50, мол. %) и кимберлита (силикат 82 + карбонат 18, мас. %).
Химический состав модельных безводных кимберлитовых и базальтовых расплавов (стекол), а также стекол природного базальта, используемых в работе для характеристики основных особенностей их диффузионного взаимодействия, представлен в табл. 1. Средний состав базальтов (Le Maitre, 1976) приведен также в табл. 1 в качестве представительного состава базальтовой магмы для сравнения. Отметим, что состав кимберлитовых магм в мантии и при формировании даек и трубок в земной коре остается предметом многочисленных дискуссий (Wyllie, 1980; Sparks et al., 2006, 2009; Kamenetsky et al., 2009; Шарыгин и др., 2013). Изменение температуры и давления, растворение летучих компонентов и кристаллизация могут привести к значительным трансформациям состава кимберлитовых расплавов в процессе их эволюции.
Таблица 1.
Химический состав и структурно-химический параметр (100NBO/T) кимберлитовых и базальтовых расплавов
| Компоненты | Модельный кимберлит* | Кимберлит** | Базальт*** | Базальт модельный**** | Магнезиальный базальт***** |
|---|---|---|---|---|---|
| SiO2 | 34.4(5) | 26.71 | 49.2 | 62.7 | 49.5 |
| Al2O3 | 10.3(3) | 1.75 | 15.74 | 10.65 | 13.18 |
| Fe2O3 | no | 2.09 | 3.79 | no | 3.18 |
| FeO | no | 6.00 | 7.13 | no | 6.85 |
| MnO | no | 0.16 | 0.2 | no | 0.15 |
| MgO | no | 31.33 | 6.73 | 8.45 | 9.98 |
| CaO | 39.8(5) | 12.10 | 9.47 | 11.8 | 12.34 |
| Na2O | 4.9(2) | 3.23 | 2.91 | 6.5 | 2.18 |
| K2O | no | 1.33 | 1.1 | no | 0.93 |
| TiO2 | no | 1.25 | 1.84 | no | 1.01 |
| P2O5 | no | 0.49 | 0.35 | no | 0.25 |
| Н2О | no | no | 0.95 | no | no |
| OH– основание | no | no | 0.48 | no | 0.29 |
| ОН– кислота | 0.05(1) | 0.38 | no | no | no |
| CO2 | 0.15 | no | 0.11 | no | no |
| ${\text{CO}}_{3}^{{2 - }}$ | 10.4(5) | 9.42 | no | no | no |
| F | no | 0.15 | no | no | no |
| Cl | no | 2.38 | no | no | |
| Сумма | 100 | 99.26 | 100 | 100.1 | 99.69 |
| 100NBO/T | 313 | 352 | 58 | 67 | 80 |
* Модельный кимберлитовый расплав (Sil82Carb18, мас. %) после плавления исходной смеси (Ab38Cal62, мас. %) при 1300°C и при давлении СО2, равном 100 МПа (настоящая работа). ** Средний состав кимберлита тр. Удачная-Восточная, Якутия (Kamenetsky et al., 2009). *** Средний состав базальта (Le Maitre, 1976). **** Модельный базальт (Ab50Di50 мол. %, настоящая работа). ***** Магнезиальный базальт вулкана Толбачик (настоящая работа).
Например, предполагается, что зарождение кимберлитовых расплавов происходит за счет реакции карбонатитовых расплавов с перидотитом вблизи мантийного солидуса и последующего частичного плавления карбонатизированного перидотита при очень малых степенях плавления (≤1.0%), при давлениях (6–10 ГПа), глубинах ~(150–300) км и температурах ≤1500°С (Wyllie, 1980; Dalton, Presnall, 1998; Price et al., 2000; Dasgupta, Hirschmann, 2006; Sparks et al., 2006, 2009; Kopylova et al., 2007; Michell, 2008; Kavanagh, Sparks, 2009; Kamenetsky et al., 2009; Шарыгин и др., 2013; Persikov et al., 2018). Поэтому неизмененный кимберлит из трубки Удачная-Восточная, Якутия, Россия (Kamenetsky et al., 2009; Kopylova et al., 2007), выбранный в качестве представительного состава кимберлитовой магмы, сравнивается в табл. 1 с расплавом нашего модельного кимберлита (силикат 82 + карбонат 18, мас. %), используемого для экспериментального исследования диффузионного взаимодействия с базальтовыми расплавами. Хотя состав используемого модельного кимберлита не содержит некоторых основных оксидов (ТіО2, Аl2О3, МgО, К2O, FеO, Fе2О3), и поэтому не полностью воспроизводит составы природных кимберлитов (табл. 1), мы показали ранее, что этот состав соответствует по степени деполимеризации (100NBO/T = 313) природным кимберлитам (Persikov et al., 2018). Было установлено, что этот параметр правильно и с должной чувствительностью отражает особенности структуры и химического состава магматических расплавов (Persikov, 1998; Persikov et al., 2018). Расчет этого параметра производится по химическому составу расплава, выраженному в мас. % оксидов, по методике (Persikov, 1998; Persikov et al., 2018) с помощью следующего уравнения:
(1)
${{100{\text{NBO}}} \mathord{\left/ {\vphantom {{100{\text{NBO}}} {\text{T}}}} \right. \kern-0em} {\text{T}}} = {{200\left( {{\text{O}} - 2{\text{T}}} \right)} \mathord{\left/ {\vphantom {{200\left( {{\text{O}} - 2{\text{T}}} \right)} {\text{T}}}} \right. \kern-0em} {\text{T}}},$где T – общее число грамм-ионов сеткообразующих катионов (Si4+, Al3+, Fe3+, Ti4+, P5+, B3+), которые находятся в тетраэдрической координации по кислороду и входят в анионную часть структуры расплава; О – общее количество грамм-ионов кислорода в расплаве.
Полученные данные свидетельствуют о том, что значения 100NBO/T = 67–80 (базальтовый расплав) соответствуют диапазону основных расплавов (17 ≤ ≤ 100NBO/T < 200), а значение 100NBO/T = 313 (модельный кимберлит) соответствует диапазону ультраосновных расплавов (200 ≤ 100NBO/T ≤ 400) (Persikov, 1998; Dingwell et al., 2004; Kopylova et al., 2007) (табл. 1).
Безводные стекла исходного модельного базальтового расплава и природного базальта синтезированы плавлением порошков стехиометрического состава (Ab50Di50, мол. %) и природного базальта в платиновых ампулах с использованием вышеупомянутой установки высокого газового давления при 1300°С, давлении аргона 100 МПа, длительности опыта 3 ч, с последующей быстрой изобарической закалкой. Стекла модельного кимберлитового расплава синтезированы плавлением ~1.5 г порошкообразной смеси природного альбита и кальцита (Ab38Cal62, мас. %) в том же сосуде высокого газового давления с внутренним нагревом под давлением безводного CO2, равном 100 МПа. Образец выдерживался при температуре 850°C в течение 1 ч, а затем при температуре 1300°C в течение 3 ч. Затем осуществлялась быстрая изобарическая закалка путем выключения внутреннего нагревателя сосуда. Такая процедура приводила к быстрой реакции декарбонизации (Т = 850°С), выражающейся в потере веса (~21 мас. %) для каждого образца. Эта потеря определялась путем расчета баланса масс для каждого опыта. Потеря массы образцов (в виде СО2) при плавлении соответствовала следующей реакции декарбонизации (Persikov et al., 2018):
(2)
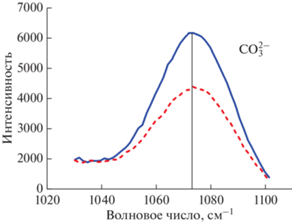
$\begin{gathered} 2{\text{NaAlS}}{{{\text{i}}}_{{\text{3}}}}{{{\text{O}}}_{8}} + 5{\text{CaC}}{{{\text{O}}}_{3}} = {\text{C}}{{{\text{a}}}_{{\text{2}}}}{\text{A}}{{{\text{l}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{7}} + 0.5\left[ {({\text{C}}{{{\text{a}}}_{{\text{5}}}}{\text{S}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}{{{{\text{(C}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}}}_{{\text{2}}}}} \right] + {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{i}}}_{{\text{4}}}}{{{\text{O}}}_{9}} + 0.5{\text{CaO}} + 4{\text{C}}{{{\text{O}}}_{2}} \hfill \\ \,\,\,\,\,{\text{albite}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\text{calcite}}\,\,\,\,\,\,\,\,\,\,\,\,\underline {{\text{gehlenite}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\text{tilleyite}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\text{tetrasilicate}}\,\,\,\,\,{\text{oxide}}} \hfill \\ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\text{расплав}} \hfill \\ \end{gathered} $Концентрацию силикатных (82 мас. %) и карбонатных фаз (18 мас. %) в синтезированных стеклах модельного кимберлита и, следовательно, концентрацию карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ (10.4 мас. %) в них определяли с помощью расчетов на основе полученных данных масс-баланса, которые соответствуют реакции декарбонизации (2) в каждом эксперименте по синтезу этих стекол. Растворение СО2 в расплавах преимущественно в виде карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ было качественно подтверждено результатами спектроскопии комбинационного рассеяния, которые представлены на рис. 2.
Рис. 2.
Спектры комбинационного рассеяния (рамановская спектроскопия) в диапазоне 1020–1120 см–1 для диффузионной пары модельные кимберлит–базальт, иллюстрирующие карбонатные пики (${\text{СО}}_{3}^{{2 - }}$) при 1073 см–1. Сплошная линия – зона кимберлита, пунктирная – диффузионная зона, граница Монтана.
Химический состав закаленных расплавов (стекол) определен с помощью электронно-микрозондового анализа (табл. 1). Сухие стекла были оптически однородными и свободными от пузырьков и кристаллитов. Небольшое содержание воды в этих стеклах (≤0.05 мас. %) определялось методом Карл–Фишер титрования. Эти стекла были извлечены из платиновых капсул и разрезаны на 5 мм цилиндры, в которых оба конца были отполированы. Из этих цилиндров формировали соответствующие диффузионные пары, которые размещали в Pt-ампулах того же диаметра, что и в ампулах, использованных при синтезе стартовых стекол. После этого ампулы герметизировали, приваривая плоские крышки к открытым концам ампулы с помощью электрода TIG. Приготовленную таким образом ампулу с диффузионной парой помещали в молибденовый реактор внутреннего устройства сосуда высокого давления в безградиентную зону (рис. 1).
Продукты опытов анализировали методом Карла–Фишера титрования с использованием прибора KFT AQUA 40.00 для определения малого содержания воды в синтезированных базальтовых и кимберлитовых стеклах (≤0.05 мас. %). Спектроскопия комбинационного рассеяния (рамановская спектроскопия) была использована для качественной иллюстрации концентрации карбонатов, которые были растворены в виде карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ в стеклах модельного кимберлита (рис. 2).
Рамановские спектры синтезированных модельных кимберлитовых стекол и стекол после диффузионных опытов на границе Монтана (Crank, 1975) были получены с помощью спектрометра RENIS/HAW-1000, оснащенного микроскопом Leica. Ширина зазора для получения спектров составляла 50 мкм, спектры обрабатывались с помощью стандартной программы GRAMS.
Химические составы исходных образцов и полученных в опытах стекол с диффузионными парами определяли с помощью цифрового электронного рентгеновского микроскопа CamScan MV2300 (VEGA TS 5130 MM) с приставкой для энерго-дисперсионного микроанализа INCA Energy 450 и WDS Oxford INCA Wave 700. Анализы проводились при ускоряющем напряжении 20 кВ с током пучка до 400 нA и время набора спектров составляло 50–100 с. Были использованы следующие стандарты: кварц для Si и О, альбит для Na, микроклин для K, волластонит для Cа, корунд для Al, чистый марганец для Mn, чистое железо для Fe, периклаз для Mg. Для стандартизации данных микрозондового анализа применяли программы: INCA Energy 200 и Nekrasov INCA (см. табл. 1).
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Два типа диффузионных пар (табл. 2, 3) были использованы в экспериментах длительностью 80–360 с:
Таблица 2.
Коэффициенты диффузии петрогенных компонентов и карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ в модельных расплавах системы базальт–кимберлит
| Компоненты | Опыт 2131 | Опыт 2141 | Среднее |
|---|---|---|---|
| *Sil82Carb18–Ab50Di50 | |||
| Коэффициенты диффузии оксидов 10–12 м2/с ± 20 отн. % | |||
| Na2О | 12.0 | 14.0 | 13.0 |
| MgО | 14.0 | 14.0 | 14.0 |
| SiО2 | 12.0 | 11.0 | 11.5 |
| CaО | 14.0 | 11.0 | 12.5 |
| ${\text{CO}}_{3}^{{2 - }}$ | 13.0 | 13.0 | 13.0 |
| Al2O3 | |||
| FeO | |||
Таблица 3.
Коэффициенты диффузии петрогенных компонентов и карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ в расплавах системы природный базальт–кимберлит
| Компоненты | Опыт 2146 | Опыт 2147 | Среднее |
|---|---|---|---|
| *Sil82Carb18–Mg-базальт | |||
| Коэффициенты диффузии оксидов 10–12 м2/с ± 20 отн. % | |||
| Na2О | 55.0 | 45.0 | 50.0 |
| MgО | 102.0 | 109.0 | 105.0 |
| SiО2 | 31.0 | 27.0 | 29.0 |
| CaО | 60.0 | 58.0 | 59.0 |
| ${\text{CO}}_{3}^{{2 - }}$ | 55.0 | 56.0 | 55.5 |
| Al2O3 | 31.0 | 30.0 | 30.5 |
| FeO | 100.0 | 106.0 | 103.0 |
1) безводные стекла модельного базальта (Ab50Di50, мол. %) и модельного кимберлита (Sil82Ca-rb18, мас. %) вводили в контакт и плавили в заваренных платиновых ампулах при давлении аргона 100 МПа и 1300оС, длительность диффузионных опытов составляла 180 и 360 с; 2) безводные стекла природного магнезиального базальта и модельного кимберлита (Sil82Carb18, мас. %) также вводили в контакт и плавили в заваренных платиновых ампулах при давлении аргона 100 МПа и 1300°С, длительность диффузионных опытов составляла 80 и 120 с.
Распределение петрогенных компонентов вдоль диффузионных профилей было измерено на рентгеновском микроанализаторе. Представлены результаты измерений диффузионных профилей для пары модельные базальт–кимберлит (рис. 3, опыты 2131 и 2141) и для пары природный базальт–модельный кимберлит (рис. 4, опыты 2146 и 2147).
Рис. 3.
Диффузионные профили главных компонентов и карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ при взаимодействии модельных расплавов базальта и кимберлита при 1300°С и 100 МПа общего давления (пунктирные линии на диаграммах – граница Монтана (Crank, 1975). (а) – время диффузионного опыта 360 с, (б) – время диффузионного опыта 180 с.
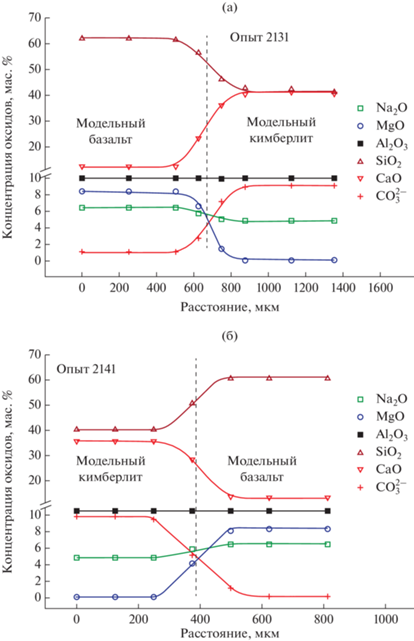
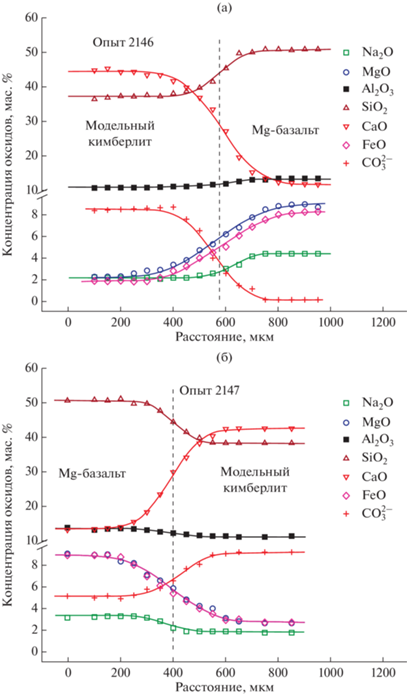
Рис. 4.
Диффузионные профили главных компонентов и карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ при взаимодействии природного расплава магнезиального базальта и модельного кимберлита при 1300°С и 100 МПа общего давления (пунктирные линии на диаграммах – граница Монтана, Crank, 1975). (а) – время диффузионного опыта 80 с; (б) – время диффузионного опыта 120 с.
Коэффициенты встречной химической диффузии (D) всех петрогенных компонентов и карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ в исследованных расплавах (табл. 2, 3) определены в линейном приближении путем минимизации методом наименьших квадратов функционала:
где Ci – экспериментально определенные значения содержания химического компонента, C(xi,t) – значения модельной функции, описывающей диффузионный профиль в точках с координатами xi через время t.
В качестве модельной функции C(x,t) было использовано решение трансцендентного уравнения:
(4)
$C\left( {x,t} \right) = {{C}_{0}} + ~~\Delta C \times {\text{erf}}\left[ {\frac{{x - {{x}_{0}}}}{{2\sqrt {tD\left( C \right)} }}} \right],$где C0 = (Cmax + Cmin)/2, ΔC = (Cmax – Cmin)/2, Cmin и Cmax – минимальное и максимальное значения концентраций компонента, x0 – граница Монтана, t – время опыта, D(C) – функция, описывающая зависимость коэффициента диффузии от концентрации компонента.
В настоящей работе преимущественно использовалась экспоненциальная зависимость коэффициента диффузии от концентрации компонента, т.е.:
где D0 – начальное значение коэффициента диффузии при С = 0, α – показатель экспоненты, и для сравнения учитывалась независимость коэффициента диффузии от концентрации компонента, т.е. D(C) = constant.
Для сравнения/оценки полученных результатов по диффузии различных компонентов расплавов использовалось среднее значение коэффициента диффузии для исследованного диапазона составов от Cmin до Cmax:
(6)
${{D}_{{{\text{ср}}{\text{.}}}}} = {{D}_{0}}\frac{{\exp \left( {\alpha {{C}_{{\max }}}} \right) - \exp \left( {\alpha {{C}_{{\min }}}} \right)}}{{\alpha \left( {{{C}_{{\max }}} - {{C}_{{\min }}}} \right)}}.$Анализ полученных результатов позволил сделать следующие выводы. Скорости встречной химической диффузии всех петрогенных компонентов (SiО2, Na2О, CaО, MgО), в пределах ошибки определения (±20 отн. %), практически идентичны при взаимодействии модельных безводных базальтовых и кимберлитовых карбонатсодержащих расплавов (табл. 2) и примерно на порядок величины больше скоростей диффузии компонентов в модельной системе (Ab75Di25–Ab50Di50, Персиков и др., 2011). Столь значительное увеличение скорости встречной химической диффузии петрогенных компонентов связано, прежде всего, с существенно меньшей вязкостью граничного расплава, формирующегося при взаимодействии модельных базальтового и кимберлитового расплавов. Оценка вязкости этого расплава по нашей модели прогноза вязкости магматических расплавов (Persikov et al., 2020), с учетом новых экспериментальных данных по вязкости базальтовых и кимберлитовых расплавов (Persikov et al., 2018), подтверждает это предположение. По этим оценкам вязкость граничного расплава (граница Монтана, Crank, 1975) модельной системы базальт–кимберлит на порядок величины меньше вязкости граничного расплава модельной системы (Ab75Di25–Ab50Di50) при заданных параметрах настоящего эксперимента. А равные скорости встречной химической диффузии всех петрогенных компонентов (SiO2, Na2O, CaO, MgO) свидетельствуют о минальном механизме встречной химической диффузии, т.е. о встречной диффузии с равными скоростями молекул диопсида и кальцита в противоположных направлениях при взаимодействии модельных базальтовых и карбонатсодержащих кимберлитовых расплавов. При этом скорость диффузии аниона-сеткообразователя (SiO2) примерно на два порядка величины выше по сравнению с трассерной диффузией (Watson, Baker, 1991). Напротив, скорость диффузии катионов-модификаторов (Na2O, CaO, MgO) меньше примерно на порядок величины по сравнению с их трассерной диффузией (Watson, Baker, 1991). Соответственно, минальный характер диффузии молекул альбита, ранее обнаруженный при взаимодействии модельных расплавов системы андезит–базальт (Персиков и др., 2011), не имеет место в системе модельные базальт–кимберлит.
Характерно, что для диффузионной пары расплавы природного базальта–модельного кимберлита не наблюдается одинаковая скорость встречной химической диффузии всех петрогенных компонентов (SiО2, Na2О, CaО, MgО, Al2О3, FeО), как в случае чисто модельной системы. При этом диффузионная подвижность большинства компонентов в этой паре примерно в четыре раза выше по сравнению с чисто модельной диффузионной парой (табл. 3, 4), в виду более низкой вязкости граничного расплава (граница Монтана, Crank, 1975) этой пары. Оценка вязкости этого расплава, по нашей модели прогноза вязкости магматических расплавов (Persikov et al., 2020) и с учетом новых экспериментальных данных по вязкости базальтовых и кимберлитовых расплавов (Persikov et al., 2018), подтверждает это предположение (табл. 2).
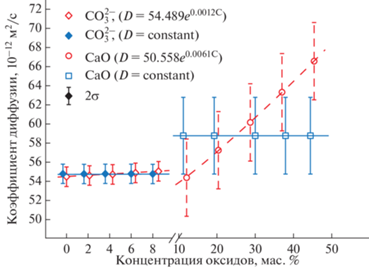
Концентрационная зависимость диффузионной подвижности компонентов установлена на основе численных расчетов по принятой методике (выражения (3), (4), (5)). Согласно полученным результатам, диффузионная подвижность всех компонентов в пределах ошибки определения (±20 отн. %) практически не зависит от их концентрации в расплавах диффузионных пар (рис. 5, 6). Так, например, на рис. 6 представлена концентрационная зависимость диффузии СаО и ${\text{СО}}_{3}^{{2 - }}$ при взаимодействии кимберлитового и базальтового расплавов с расчетной погрешностью 1 отн. %, которая существенно меньше реальной погрешности экспериментов (~20 отн. %). Тем не менее даже в этом случае два типа концентрационной зависимости (D(i) – constant и D(i) – экспонента) практически не различаются.
Рис. 5.
Пример аппроксимации диффузионных профилей всех компонентов при взаимодействии расплавов кимберлита и базальта (пунктирная линия практически не видна, при условии D(i) = constant, а сплошные линии при условии D(i) – слабая экспоненциальная зависимость). Обе аппроксимации реально совпадают.
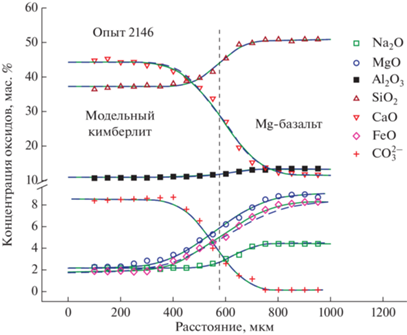
Рис. 6.
Пример сравнения двух концентрационных зависимостей диффузии СаО и ${\text{СО}}_{3}^{{2 - }}$ при взаимодействии кимберлитового и базальтового расплавов (опыт 2146, сплошные линии параллельны оси абсцисс – D(i) = сonstant, пунктир – экспоненциальная зависимость).
Особый интерес представляют новые результаты по диффузионной подвижности карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ при взаимодействии карбонатсодержащих расплавов с базальтовыми модельными и природными расплавами. На основе результатов спектроскопии комбинационного рассеяния установлено полное отсутствие молекулярного СО2 в процессе взаимодействия диффузионной пары (рис. 2). Установлено, что диффузионная подвижность карбонат-аниона (${\text{СО}}_{3}^{{2 - }}$) в этих условиях в пределах ошибки (~20 отн. %) равна скорости диффузии CaО (табл. 2, 3). Это свидетельствует о минальном характере диффузии молекул кальцита из карбонатсодержащего расплава (модельный кимберлит) в базальтовый расплав (модельный и природный). Подобный характер диффузии карбоната натрия с радиоактивной меткой (${\text{N}}{{{\text{a}}}_{{\text{2}}}}$14CO3) в модельный базальтовый расплав получен ранее в работе (Watson et al., 1982) при давлении 500 МПа. Авторы получили значение коэффициента диффузии карбоната натрия примерно на порядок величины большим по сравнению с нашими данными по диффузии карбоната кальция (CaCO3) в базальтовые расплавы (табл. 2, 3).
ВЫВОДЫ
Получены новые экспериментальные данные по встречной химической диффузии петрогенных компонентов (SiО2, Na2О, CaО, MgО, Al2О3, FeО) и карбонат-аниона ${\text{СО}}_{3}^{{2 - }}$ при непосредственном взаимодействии расплавов карбонатсодержащего модельного кимберлита и базальта при умеренном давлении 100 МПа и температуре 1300°С. Установлен минальный характер диффузии карбоната кальция из расплава модельного кимберлита в модельный и природный базальтовые расплавы. Слабая экспоненциальная концентрационная зависимость химической диффузии всех изученных компонентов взаимодействующих расплавов, близкая к D(i) = constant, характерна как для модельной системы, так и для системы модельный кимберлит–природный базальт.
Благодарности. Авторы признательны Г.В. Бондаренко (ИЭМ РАН) за помощь в использовании рамановской спектроскопии при анализе форм растворения СО2 в расплавах. Авторы благодарны Л.Я. Арановичу (ИГЕМ РАН) за ценные замечания, которые несомненно улучшили качество статьи.
Источники финансирования. Работа выполнена в рамках Государственного задания АААА-А18-118021990092-2-3 Института экспериментальной минералогии им. Д.С. Коржинского РАН.
Список литературы
Большое трещинное Толбачинское извержение 1975–1976 гг., Камчатка. М.: Наука, 1984. 637 с.
Персиков Э.С., Бухтияров П.Г., Некрасов А.Н. Особенности встречной химической диффузии петрогенных компонентов (SiO2, Al2O3, Na2O, CaO, MgO) в модельных и природных расплавах системы андезит–базальт при высоких давлениях во взаимосвязи с их вязкостью // XII Международная конференция: Физико-химические и петрофизические исследования в науках о Земле. М.: ИГЕМ РАН, 2011. С. 236–239.
Шарыгин И.С., Литасов К.Д., Шацкий А.Ф. и др. Экспериментальное исследование плавления кимберлита трубки Удачная-Восточная при 3.0–6.5 ГПа и 900–1500°С // Докл. АН. 2013. Т. 448. № 4. С. 452–457.
Bowen N.L. Diffusion in silicate melts // J. Geol. 1921. V. 29. P. 295–317.
Crank J. The Mathematics of Diffusion. London: Oxford University Press, 1975. 414 p.
Dalton J.A., Presnall D.C. The continuum of primary carbonatitic-kimberlite melt compositions in equilibrium with lherzolite: Data from the system CaO–MgO–Al2O3–SiO2–CO2 at 6 GPa // J. Petrol. 1998. V. 39. P. 1953–1964.
Dasgupta R., Hirschmann M.M. Melting in the Earth’s deep upper mantle caused by carbon dioxide // Nature. 2006. V. 440. P. 659–662.
Dingwell D.B., Copurtial P., Giordano D., Nichols A.R.L. Viscosity of peridotite liquid // Earth Planet. Sci. Lett. 2004. V. 226. P. 127–138.
Kamenetsky V.S., Kamenetsky M.B., Weiss Y. et al. How unique is the Udachnaya-East kimberlite? Comparison with kimberlites from the Slave Craton (Canada) and SW Greenland // Lithos. 2009. V. 112S. P. 334–346.
Kavanagh J.L., Sparks R.S.J. Temperature changes in ascending kimberlite magma // Earth Planet. Sci. Lett. 2009. V. 286. P. 404–413.
Kopylova M.G., Matveev S., Raudseep M. Searching for parental kimberlite melt // Geochim. Cosmochim. Acta. 2007. V. 71. P. 3616–3629.
Kress V.C., Ghiorso M.S. Multicomponent diffusion in basaltic melts // Geochim. Cosmochim. Acta. 1995. V. 59. P. 313–324.
Le Maitre R.W. The chemical variability of some common igneous rocks // J. Petrol. 1976. V. 117. № 4. P. 589–637.
Liang Y. Multicomponent diffusion in molten silicates: Theory, experiments, and geological applications // Rev. Mineral. Geochem. 2010. V. 72. P. 409–446. https://doi.org/10.2138/rmg.2010.72.9
Michell R.H. Petrology of hypabyssal kimberlites: Relevance to primary magma compositions // J. Volcanol. Geotherm. Res. 2008. V. 174. P. 1–8.
Persikov E.S. Viscosity of model and magmatic melts under P-T parameters, of the Earth’s crust and upper mantle // Russian Geol. Geophysics. 1998. V. 39. № 12. P. 1780–1792.
Persikov E.S., Bukhtiyarov P.G. Viscosity of magmatic melts: Improved structural – chemical model // Chemical Geol. 2020. V. 556. https://doi.org/10.1016/j.chemgeo.2020.119820
Persikov E.S., Bukhtiyarov P.G., Sokol A.G. Viscosity of haploкimberlite and basaltic melts at high pressures // Chemical Geol. 2018. V. 497. P. 54–63.
Price S.E., Russell J.K., Kopylova M.G. Primitive magma from the Jericho Pipe, N.W.T., Canada: Constraints on primary kimberlite melt chemistry // J. Petrol. 2000. V. 47. P. 789–808.
Sparks R.S.J., Brooker R.A., Field M. et al. The nature of erupting kimberlite melts // Lithos. 2009. V. 112. P. 429–438.
Sparks R.S.J., Baker L., Brown R.J. et al. Dynamical constraints of kimberlite volcanism // J. Volcanol. Geotherm. Res. 2006. V. 155. P. 18–48.
Watson E.B. Diffusion in volatile-bearing magmas. Volatiles in magmas // Rev. Mineral. Eds. M.R. Carrol, J.R. Holloway. Washington, Mineral. Soc. Amer. 1994. V. 30. P. 371–411.
Watson E.B., Baker D.R. Chemical diffusion in magma: An overview of experimental results and geochemical applications // Physical chemistry in magma. Eds. L.L. Perchuk, I. Kushiro. N.Y.: Springer, 1991. Advances in physical geochemistry. V. 9. P. 120–151.
Watson E.B., Sneeringer M.A., Ross A. Diffusion of dissolved carbonate in magmas: Experimental results and applications // Earth Planet. Sci. Lett. 1982. V. 61. P. 346–358.
Wyllie P.J. The origin of kimberlite // J. Geophys. Res. 1980. V. 85. P. 6902–6910.
Yoder H.S. Contemporaneous basaltic and rhyolitic magmas // Amer. Mineral. 1973. V. 5. P. 153–171.
Дополнительные материалы отсутствуют.
Инструменты
Петрология


