Петрология, 2022, T. 30, № 4, стр. 432-443
Экспериментальное изучение растворимости фторидов во флюидонасыщенном расплаве калиевого сиенита
О. Е. Плюснина a, b, В. Ю. Чевычелов a, *, А. В. Самсонов b, А. А. Вирюс a
a Институт экспериментальной минералогии им. академика Д.С. Коржинского РАН
Московская обл., Черноголовка, Россия
b Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН
Москва, Россия
* E-mail: chev@iem.ac.ru
Поступила в редакцию 06.12.2021
После доработки 31.01.2022
Принята к публикации 10.03.2022
- EDN: HTZLZF
- DOI: 10.31857/S0869590322040045
Аннотация
Представлены экспериментальные результаты по растворимости фторидов во флюидонасыщенном расплаве ультракалиевого щелочного сиенит-порфира из золоторудного месторождения Гросс в Южной Якутии при T = 600–800°C и P = 150–260 МПа. Эксперименты проводились с целью подтверждения предположения о высокой растворимости фтора в расплаве ультракалиевых сиенитов, что могло способствовать формированию специфических и маловязких расплавов при становлении силла сиенит-порфиров. Твердые продукты после экспериментов содержали алюмосиликатное стекло, калиевый полевой шпат, флюорит, кварц, а также две фторидные фазы (фторид калия и алюминия и фторид калия и магния). В результате была определена высокая максимальная растворимость фтора в исследованном расплаве до 4.2–4.6 мас. %, причем максимальное содержание фтора получено в наиболее низкотемпературном расплаве при 625°C. Оценены температуры солидуса (600–625°C) и ликвидуса (650–800°C) изученного сиенитового расплава. Установлена повышенная щелочность водного фторидного флюида, сосуществующего с расплавом. Начальная кристаллизация зерен калиевого полевого шпата из расплава в серии экспериментов совпадает с наблюдениями в природных образцах.
ВВЕДЕНИЕ
В процессе дифференциации силикатных расплавов происходит их обогащение летучими компонентами, такими как H2O, CO2, галогены и другие. Являясь несовместимыми, эти компоненты накапливаются в остаточных расплавах, что понижает их вязкость и температуру кристаллизации, а также влияет на фазовые соотношения в расплавных системах, заметно смещая положение котектических линий и эвтектические равновесия на фазовых диаграммах (Manning, 1981; Персиков, 1984; Dingwell et al., 1996). В итоге можно ожидать образование необычных по составу магматических пород, формирование которых невозможно при эволюции “сухой” магматической системы (Коваленко, 1979; Когарко, Кригман, 1981).
Одним из примеров этого являются ультракалиевые щелочные сиенит-порфиры раннемелового возраста, вскрытые разведочными скважинами на золоторудном месторождении Гросс (юг Угуйского грабена на западе Алданского щита) среди докембрийских песчаников (Зубков и др., 2020). Эти сиенит-порфиры слагают силл небольшой мощности (от нескольких метров до 10 см), прослеженный по простиранию на несколько километров. Они имеют все признаки магматических пород, такие как зоны закалки, вкрапленники и ксенолиты (рис. 1а, 1б), но при этом обладают необычным практически мономинеральным составом, отвечающим калиевому полевому шпату. Почему образовались такие необычные расплавы? Каким образом такие расплавы могли формировать столь маломощные и протяженные пластовые тела, что предполагает очень низкую вязкость и огромную скорость их перемещения? Одной из возможных причин образования наблюдаемой специфики сиенитов могло быть присутствие в их материнском расплаве фтора, который накапливался в процессе магматической эволюции и оказал сильное влияние на физические особенности остаточного расплава, существенно понизив его вязкость и температуру кристаллизации. О присутствии фтора в сиенитовом расплаве свидетельствуют петрографические данные. В ксенолитах гранитоидов, вынесенных сиенитами, присутствует значительное количество флюорита, который, вероятно, заместил Са-компоненту исходного плагиоклаза (рис. 2а, 2б). Флюорит встречается также в наиболее раскристаллизованных среднезернистых сиенитах в составе мелких миндалин (до 1 мм, рис. 3), представляя, вероятно, захваченную компоненту постмагматического флюида, и в подчиненных количествах в виде мелких зерен в составе основной массы. О высокой концентрации фтора в расплаве свидетельствуют химические составы минералов, таких как биотит, зональный апатит (в ядре 3 мас. % F, в краевых зонах до 4.9 мас. % F) и титанит (0.6 мас. % F). Повышение содержания фтора во внешних каймах зерен апатита, по всей видимости, связано с увеличением активности фтора на заключительных стадиях формирования породы. Значительная часть фтора в составе флюидной фазы, вероятно, была вынесена из системы при становлении силла сиенит-порфиров, о чем свидетельствует широкий ареал флюоритовой минерализации, проявленный по трещинам во вмещающих песчаниках.
Рис. 1.
Ультракалиевые сиенит-порфиры, обр. 102829-754.6 (изображение в проходящем поляризованном свете). (а) Контакт сиенит-порфира и вмещающего аркозового песчаника. Видна зона закалки. (б) Гломеропорфировый сросток двух зерен калиевого полевого шпата на фоне трахитоидной структуры основной массы, сложенной калиевым полевым шпатом и клинопироксеном, в подчиненном количестве присутствуют сидерит, магнетит, пирит, альбит.

Рис. 2.
Флюорит, развивающийся по Са-содержащим минералам: (а) – в ксенолите (обр. 97239-629.5); (б) – в фенокристе из состава ультракалиевого сиенит-порфира (обр. 102834-762.1, изображение в обратно-рассеянных электронах). K-Fsp – калиевый полевой шпат; Fl – флюорит; Ms – мусковит; Ab – альбит; Cpx – клинопироксен; Zeo – цеолит.

Рис. 3.
Миндалина в теле ультракалиевых сиенит-порфиров, заполненная флюоритом и смесью белых слюд и цеолитов (обр. 102834-765.5). Изображение в проходящем свете. Аббревиатуру фаз см. в подписи к рис. 2.

Экспериментальные данные по растворимости фторидов и фторсодержащих водных флюидов в различных магматических расплавах приводятся в целом ряде публикаций (Wyllie, Tuttle, 1961; Коваленко, 1979; Manning, 1981; Когарко, Кригман, 1981; Webster, 1990; Keppler, Wyllie, 1991; Johannes, Holtz, 1996; Price et al., 1999; Scaillet, Macdonald, 2004; Граменицкий и др., 2005; Чевычелов и др., 2005, 2010; Lukkari, Holtz, 2007; Алферьева и др., 2011; Щекина и др., 2013; Чевычелов, 2019; Yang, van Hinsberg, 2019; Li et al., 2020). Показано, что фтор в алюмосиликатных расплавах и магмах не является деполимеризатором, а связан в ионные группировки со щелочными элементами Na, K, Ca (Когарко, Кригман, 1981). Изучено влияние P-T параметров и состава расплава на растворимость фтора, так, например, согласно (Чевычелов и др., 2010), содержание фтора в кремнекислых расплавах с различным содержанием глинозема и щелочей максимально при давлении 100 МПа, оно понижается с увеличением давления до 400 МПа и уменьшением давления до 30 МПа. С ростом температуры от 650 до 850°C содержание фтора в этих расплавах увеличивается. Обычно риолитовые кварц-нормативные расплавы растворяют меньше фтора по сравнению с нефелин-нормативными (Граменицкий и др., 2005). Увеличение содержания фтора оказывает влияние на рост растворимости H2O в гранитном расплаве (Johannes, Holtz, 1996). В богатых фтором алюмосиликатных системах с кальцием кристаллизация флюорита контролируется содержанием кальция в расплаве (Dolejs, Baker, 2006; Lukkari, Holtz, 2007; Граменицкий и др., 2005).
В настоящей работе впервые в водонасыщенном специфическом калиево-полевошпатовом расплаве сиенит-порфира экспериментально получена величина предельного (максимального) содержания фтора, оценены температуры солидуса и ликвидуса этого расплава и изучены составы стекол и кристаллических фаз.
УСЛОВИЯ И МЕТОДИКА ПРОВЕДЕНИЯ ЭКСПЕРИМЕНТОВ
Химический состав использованных в экспериментах образцов сиенита приведен в табл. 1.
Таблица 1.
Химический состав использованных в экспериментах образцов калиевого сиенита, в мас. %
| Номер образца | SiO2 | TiO2 | Al2O3 | Fe2O3 | MnO | MgO | CaO | Na2O | K2O | SrO | BaO | P2O5 | П.п.п. | S |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 (99642-727.5) | 63.93 | 0.17 | 16.75 | 1.99 | 0.06 | 0.11 | 0.96 | 0.19 | 15.78 | 0.02 | 0.07 | 0.05 | 2.47 | <0.02 |
| 2 (102834-768) | 63.99 | 0.16 | 17.09 | 1.92 | 0.07 | 0.13 | 1.33 | 0.37 | 14.89 | 0.07 | 0.07 | 0.04 | 2.09 | 0.02 |
Эксперименты были проведены в двойных платиновых ампулах при T = 600–800°C и P = = 150–260 МПа. Водный флюид вводился в избытке относительно количества, необходимого для насыщения сиенитового расплава. Источниками фтора служили водный раствор 1н HF + 1н KF (или в опыте OP-2b раствор 2н HF + 2н KF) и порошок гиератита K2SiF6. В каждом опыте в малую ампулу (наружный диаметр 4 мм, толщина стенок 0.2 мм, длина 18–20 мм) помещали растертую в ступке смесь порошка калиевого сиенита (22.5 мг) и гиератита (7.5 мг), а также водный раствор HF + + KF (6–4 мг). Малую ампулу заваривали и помещали внутри большой ампулы (7 мм × 0.2 мм × 25–35 мм). Эту внешнюю большую ампулу использовали в опытах в связи с высокой концентрацией HF в исходном растворе, чтобы не испортить установку в случае разгерметизации ампулы. В большую ампулу заливали рассчитанное количество дистиллированной воды с учетом коэффициента заполнения и P-T условий опыта, и ампулу заваривали. Все операции контролировались взвешиванием с точностью до 10–4–10–5 г.
Для экспериментов была использована установка ИЭМ РАН “Сосуд высокого газового давления с внутренним нагревом СВГД-7”. Фугитивность кислорода log fO2 внутри ампул в наибольшей степени зависела от скорости диффузии (ухода) H2, образующегося при разложении водного флюида, сквозь платиновые стенки. В наших довольно длительных экспериментах f O2 соответствовала приблизительно (Ni-NiO) + 3.5, согласно оценке, приведенной в (Berndt et al., 2005). Была поставлена серия экспериментов при различных Р-Т параметрах: Т = = 800, 650, 625, 600°С и Р = 260–150 МПа. Каждый опыт сначала выводили на 850 или 800°C и 260 или 170 МПа, выдерживали в течение 5–6 ч для получения гомогенного расплава (подход к равновесию сверху; табл. 2). Затем P-T параметры опыта снижали и продолжали опыт уже при 800°C и 260 МПа, при 650°C и 150 МПа или при 600°C и 160 МПа в течение 7–8 сут. Продолжительность опыта OP-1a составляла около трех суток. Для уточнения температуры солидуса опыт OP-4b был проведен без предварительного плавления шихты (подход к равновесию снизу). Все опыты закаливали изобарически. Первоначальная скорость снижения температуры была не менее 70–80 град./мин.
Таблица 2.
Условия проведения экспериментов и полученные результаты
| Номер опыта | Номер исходного
образца (см. табл. 1), в скобках Ca, мас. % |
Т, °C, начального плавления |
Т, °C, опыта |
P1, МПа | Длительность, сут.2 | Диапазон содержания F в стекле3, мас. % | Твердые продукты опыта, в скобках % площади4 |
|---|---|---|---|---|---|---|---|
| OP-1a | 1 (0.96) | 850 | 800 | 250 | 0.13 + 3 | 3.4–4.1 | Алюмосиликатное стекло
(80–90), фторидная фаза K3.2Al1${\text{F}}_{5}^{5}$ (10–20) |
| OP-2a | 1 (0.96) | 850 | 800 | 260 | 0.2 + 7.8 | 3.4–4.2 | Алюмосиликатное стекло
(70–80), фторидная фаза K3.3Al1${\text{F}}_{5}^{5}$ (20–30) |
| OP-2b6 | 1 (0.96) | 850 | 800 | 260 | 0.2 + 7.8 | 3.2–4.0 | Алюмосиликатное стекло
(70–75), фторидная фаза K2.8Al1${\text{F}}_{5}^{5}$ (20–30), флюорит (3–4) |
| OP-3a | 1 (0.96) | 800 | 650 | (170) 150 | 0.2 + 6.8 | 2.8–3.6 | Алюмосиликатное стекло
(60–67), две фторидные фазы K3.1Al1${\text{F}}_{5}^{5}$ и K1.7Mg1.8${\text{F}}_{5}^{5}$ (20–30), КПШ (5–10), флюорит (3–5) |
| OP-3b | 2 (1.33) | 800 | 650 | (170) 150 | 0.2 + 6.8 | 2.9–3.7 | Алюмосиликатное стекло
(60–65), две фторидные фазы K3.2Al1${\text{F}}_{5}^{5}$ и K1.7Mg1.9${\text{F}}_{5}^{5}$ (20–30), КПШ (5–10), флюорит (5) |
| OP-4a | 1 (0.96) | 800 | 600 | (170) 160 | 0.3 + 7.0 | Нет алюмосиликатного стекла | Две фторидные фазы
K2.9Al1${\text{F}}_{5}^{5}$ и K2Mg1.6${\text{F}}_{5}^{5}$ (15–20), КПШ (60–70), кварц (10), флюорит (5–10) |
| OP-4b | 1 (0.96) | Не было предварительного плавления | 625 | 160 | 7.6 | 3.8–4.6 | Алюмосиликатное стекло (10–15), фторидная фаза K2.9Al1.4${\text{F}}_{5}^{5}$ (15–25), КПШ (55–65), флюорит (6–8) |
Примечание. 1 В скобках приведено давление при начальном плавлении, если оно отличалось от давления в опыте. 2 Длительность начального плавления и длительность опыта после этого. 3 Содержание фтора определяли с помощью волнового рентгеновского спектрометра. 4 Количественные оценки выполнены в ходе ЭЗРСА с использованием сделанных микрофотографий. 5 Рассчитанные формулы фторидных фаз для каждого опыта. 6 В опыте OP-2b был использован более концентрированный исходный раствор 2н HF + 2н KF (4 мг).
Твердые продукты опытов анализировали методом электронно-зондового рентгеноспектрального анализа (ЭЗРСА) на сканирующем электронном микроскопе (СЭМ) Tescan Vega II XMU с использованием энергодисперсионного (ЭДС, INCAx-sight) (на основные петрогенные элементы) и волнового (INCA Wave 700) (на фтор) рентгеновских спектрометров. Анализ фтора выполняли при следующих условиях: ускоряющее напряжение на вольфрамовом катоде составляло 20 кВ, ток поглощенных электронов на Co – 20 нА, время набора импульсов на пике аналитической линии FKα1,2 – 20 с, фон – по 10 с симметрично с двух сторон от аналитической линии. Кристалл-анализатор TAP. Метод матричной коррекции основан на зависимости φ(ρ,z), выполнялся в программе INCA. Доверительный интервал рассчитывался также в программе INCA с использованием статистики Пуассона. В качестве стандарта использовали синтетический CaF2, структурно более близкий к исследуемым фазам фторидов относительно стандарта MgF2. Кислород анализировали только при определении химического состава различных фторидных фаз с использованием ЭДС (U = 20 кВ, J = 200 pA, t = 70 с). Полученные данные по содержанию кислорода являются предварительными полуколичественными. Составы стекол измеряли сканированием площадок 10 × 10 мкм, анализ кристаллических фаз выполняли сфокусированным зондом.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
Количественные соотношения твердых продуктов экспериментов приведены в табл. 2. Средние составы отдельных фаз даны в табл. 3 и 4. Твердые продукты содержат алюмосиликатное стекло, калиевый полевой шпат, флюорит, кварц, а также две различающиеся по составу фторидные фазы (рис. 4 и 5). Как видно из рис. 4 и 5, полученные образцы отличались значительной пористостью, причем более высокотемпературные образцы имели большую пористость (до 30–45% площади).
Таблица 3.
Химический состав1 алюмосиликатного стекла и калиевого полевого шпата после экспериментов, в мас. %
| Компо-ненты | Алюмосиликатное стекло | Калиевый полевой шпат | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| OP-1a | OP-2a | OP-2b | OP-3a | OP-3b | OP-4b | OP-3a | OP-3b | OP-4a | OP-4b центр зерен |
OP-4b край зерен |
|
| n2 | 2 | 6 | 7 | 8 | 6 | 8 | 4 | 4 | 2 | 5 | 2 |
| SiO2 | 62.4 | 64.6 | 64.9 | 63.1 | 63.7 | 65.8 | 63.1 | 62.8 | 63.0 | 62.1 | 68.0 |
| TiO2 | <0.43 | <0.43 | <0.43 | <0.43 | <0.43 | <0.43 | <0.43 | <0.43 | 0 | 0 | 0 |
| Al2O3 | 11.9 | 12.6 | 12.4 | 10.5 | 10.6 | 8.4 | 16.3 | 16.3 | 14.8 | 16.5 | 13.7 |
| FeO | 2.1 | 1.9 | 1.8 | 2.1 | 2.0 | 2.8 | 2.0 | 1.9 | 2.9 | 1.3 | 3.2 |
| MnO | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | 0 | <0.33 | 0 |
| MgO | 0 | 0 | 0 | <0.33 | <0.33 | <0.33 | 0 | 0 | <0.33 | <0.33 | 0 |
| CaO | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 |
| Na2O | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | 0 | 0 | 0 | <0.33 | <0.33 |
| K2O | 11.7 | 11.1 | 10.8 | 14.0 | 13.7 | 11.8 | 17.3 | 17.6 | 16.7 | 17.2 | 15.4 |
| F | 3.7 | 3.8 | 3.6 | 3.2 | 3.3 | 4.2 | <0.13 | <0.13 | – | – | – |
| O=F4 | 6.2 | 6.4 | 6.1 | 5.4 | 5.6 | 7.1 | – | – | – | – | – |
| Σ5 | 86.0 | 88.5 | 88.2 | 88.8 | 88.5 | 86.7 | 99.7 | 99.3 | 98.4 | 98.2 | 101.7 |
| A/NKC6 | 0.92 | 1.02 | 1.03 | 0.68 | 0.69 | 0.65 | – | – | – | – | – |
Примечание. 1 Усредненные значения. Анализы на все элементы, кроме фтора, выполнены с использованием ЭДС. Фтор анализировали с помощью волнового спектрометра. Средние 2σ отклонения в анализах составляли: SiO2 1.4 мас. %; TiO2 0.4 мас. %; Al2O3 0.7 мас. %; FeO 0.5 мас. %; MnO 0.3 мас. %; MgO 0.3 мас. %; CaO 0.3 мас. %; Na2O 0.3 мас. %; K2O 0.6 мас. %; F 0.4 мас. % (стекло) и 0.1 мас. % (полевой шпат). 2 Количество измерений составов образцов методом ЭЗРСА. 3 Ниже предела обнаружения. 4 Часть кислорода, замещенного в составе стекла на фтор. 5 Сумма с учетом замены части кислорода на фтор. 6 Показатель насыщения алюминием (мольное Al2O3/(Na2O + K2O + CaO) отношение) в алюмосиликатном стекле.
Таблица 4.
Химический состав1 фторидных фаз и флюорита после экспериментов, в мас. %
| Компо- ненты | Фторидная фаза состава K3AlF5 | Фторидная фаза состава K2Mg2F5 |
Флюорит | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| OP-2a | OP-2b | OP-3a | OP-3b | OP-4a | OP-4b | OP-3a | OP-3b | OP-4a | OP-2b | OP-3a | OP-3b | OP-4a | OP-4b | |
| n2 | 2 | 2 | 3 | 5 | 11 | 6 | 1 | 4 | 3 | 1 | 1 | 2 | 1 | 1 |
| Si | 1.8 | 2.1 | <0.33 | ≤0.33 | <0.33 | <0.33 | <0.33 | ≤0.33 | 1.6 | <0.33 | 0 | <0.33 | <0.33 | <0.33 |
| Ti | 0 | 0 | <0.33 | <0.33 | ≤0.33 | <0.33 | <0.33 | 0 | 0 | 0 | <0.33 | <0.33 | 0 | 0 |
| Al | 9.5 | 10.7 | 9.9 | 10.2 | 10.3 | 10.6 | 0.3 | ≤0.23 | 1.1 | <0.23 | <0.23 | <0.23 | <0.23 | <0.23 |
| Fe | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | <0.33 | 0.5 | 0.5 | 0.8 | 0 | 0 | <0.33 | <0.33 | 0 |
| Mn | 0 | 0 | <0.33 | 0 | 0 | <0.33 | ≤0.33 | 0.6 | 1.3 | 0 | 0 | 0 | 0 | 0 |
| Mg | <0.23 | 0 | 0 | <0.23 | 0 | 0 | 16.3 | 17.6 | 15.4 | 0 | 0 | <0.23 | 0 | 0 |
| Ca | ≤0.43 | ≤0.43 | 0.5 | <0.43 | ≤0.43 | <0.43 | 1.3 | 0.6 | 0.8 | 55.6 | 55.1 | 53.5 | 53.2 | 54.1 |
| Na | <0.33 | <0.33 | ≤0.33 | 0.6 | ≤0.33 | ≤0.33 | 0 | <0.33 | <0.33 | ≤0.33 | 0 | 0 | 0 | 0 |
| K | 44.5 | 45.9 | 46.2 | 45.7 | 42.4 | 42.5 | 32.4 | 33.3 | 30.2 | ≤0.23 | 1.0 | 0.6 | 0.7 | 0.8 |
| Sr | <0.53 | <0.53 | <0.53 | <0.53 | <0.53 | <0.53 | 0.6 | <0.53 | <0.53 | 0.6 | 0.6 | 2.6 | <0.53 | <0.53 |
| Ba | ≤0.73 | <0.73 | ≤0.73 | <0.73 | <0.73 | <0.73 | <0.73 | <0.73 | <0.73 | <0.73 | <0.73 | 0 | <0.73 | <0.73 |
| O4 | 4.3 | 3.8 | 3.3 | 2.4 | 2.6 | <2.33 | <2.33 | ≤2.33 | 3.5 | <2.33 | 4.1 | 2.9 | <2.33 | <2.33 |
| F | 32.3 | 39.4 | 33.2/ 42.45 |
33.7/ 40.95 |
36.3 | 38.1/ 41.45 |
35.0/ 47.45 |
36.0/ 46.95 |
37.2 | 40.1 | 38.2/ 48.05 |
35.5/ 46.75 |
38.8 | 41.9 |
| Ʃ | 94.2 | 103.5 | 94.7 | 94.1 | 93.3 | 94.8 | 88.6 | 91.9 | 92.4 | 97.9 | 99.3 | 95.7 | 94.3 | 97.8 |
Примечание. 1Усредненные значения. Анализы на все элементы, кроме фтора, помеченного 5, выполнены с использованием энергодисперсионного рентгеновского спектрометра. Средние 2σ отклонения в анализах составляли: Si 0.3 мас. %; Ti 0.3 мас. %; Al 0.2 мас. % и 0.5 мас. % (фаза K3AlF5); Fe 0.3 мас. %; Mn 0.3 мас. %; Mg 0.2 мас. % и 0.7 мас. % (фаза K2Mg2F5); Ca 0.4 мас. % и 1.0 мас. % (флюорит); Na 0.3 мас. %; K 0.2 мас. % (флюорит), 0.8 мас. % (фаза K2Mg2F5) и 0.9 мас. % (фаза K3AlF5); Sr 0.5 мас. %; Ba 0.7 мас. %; O 2.3 мас. %; F 2.7 мас. %. 2 Количество измерений составов образцов методом ЭЗРСА. 3 Ниже или равно пределу обнаружения. 4 Содержание кислорода определяли методом ЭЗРСА. 5 Эти определения фтора выполнены с помощью волнового спектрометра. Среднее 2σ отклонение составляло 1.8 мас. %.
Рис. 4.
Твердые продукты экспериментов. (а) – OP-3b, (б) – OP-3a, T = 650°C, P =150 МПа. Изображение в обратно-рассеянных электронах (BSE). Gl – алюмосиликатное стекло; a-K3Al, b-K3Al, c-K3Al – первая фторидная фаза, имеющая три разные формы выделения (см. описание в тексте); K2Mg2 – вторая фторидная фаза. Аббревиатуру других фаз см. в подписи к рис. 2.

Рис. 5.
Твердые продукты экспериментов. OP-4b, T = = 625°C, P = 160 МПа. Опыт без предварительного плавления образца. Появление алюмосиликатного расплава в межзерновых промежутках. Изображение в обратно-рассеянных электронах (BSE). Аббревиатуру фаз см. в подписи к рис. 2 и 4.

После экспериментов в ампулах, наряду с твердыми продуктами, присутствовало незначительное количество водного раствора. pH этого раствора значительно изменялось в процессе опыта: исходный раствор был кислым (pH = 2–2.5), а раствор после опыта имел слабощелочную реакцию (pH = 9). pH раствора определялось с помощью универсальной индикаторной бумаги.
Полученные алюмосиликатные стекла являются гомогенными. В пределах одного опыта разброс между содержаниями элементов в разных областях поверхности исследуемого стекла в параллельных измерениях обычно не превышал 1–1.5 отн. %. Только в опыте OP-4b такой разброс мог увеличиваться до 2–3.5 отн. %, что, вероятно, связано с неполным достижением равновесия при низкой температуре опыта (625°C). При снижении температуры и давления в составе стекла уменьшается содержание глинозема и слабо возрастают содержания железа и калия (табл. 3). Содержания Ti, Mn, Mg, Ca и Na в стеклах ниже пределов обнаружения. Получено довольно высокое содержание фтора до 4.2 мас. % при Т = 650–800°C и P = = 150–260 МПа и до 4.6 мас. % при Т = 625°C и P = = 160 МПа (табл. 2).
Синтезированный калиевый полевой шпат кристаллизовался в виде идиоморфных зерен, размер которых увеличивался при более низкой температуре. Калиевый полевой шпат, помимо основных компонентов (Si, K, Al), содержит железо (1–3 мас. % FeO, табл. 3), количество которого несколько повышается в краевой части зерен, и не содержит Na и Ca. При расчете формулы КПШ на 8 атомов кислорода количество атомов кремния близко к норме, калий несколько завышен, а алюминий занижен – K1.03–1.07Al0.94–0.84Si2.99–3.04O8. Заниженное содержание алюминия и повышенное железа наблюдаются в КПШ из низкотемпературных опытов OP-4a и OP-4b. Скорее всего, при этом Fe+3 замещает Al, согласно (Bambauer et al., 1974).
Полученный флюорит может содержать примеси калия до 1 мас. %, стронция – до 2.6 мас. % и кислорода – до 4.1 мас. %. Данные по содержанию кислорода являются предварительными полуколичественными, так как получены с использованием ЭДС. Тем не менее, на наш взгляд, они представляют интерес в связи с обсуждением в литературе вопроса о возможности частичного (до 3 и более мас. %) замещения фтора на кислород в структуре флюорита (Перетяжко и др., 2020; Yang, van Hinsberg, 2019). Так как не все фазы, приведенные в табл. 4, были проанализированы на фтор с помощью волнового спектрометра, мы приводим в этой таблице также анализы фтора, полученные с использованием ЭДС. Эти анализы дают существенно более низкое содержание фтора по сравнению с параллельными анализами тех же образцов, выполненными на волновом спектрометре (табл. 4). Мы считаем, что содержание фтора, полученное с использованием ЭДС, является заниженным, тогда как фтор, определенный на волновом спектрометре, дает в пересчете формулу флюорита, близкую к теоретической – Ca1.05–1.10F2. Поэтому при расчете химических формул синтезированных фторидных фаз мы использовали анализы, полученные с помощью волнового спектрометра.
В продуктах экспериментов были определены две фторидные фазы: (1) фторид калия и алюминия K3.3–2.8Al1.0–1.4F5 (K3AlF5 = K3Al) и (2) фторид калия и магния K1.7–2.0Mg1.9–1.6F5 (K2Mg2F5 = K2Mg2). Формулы этих фаз получены при пересчете микрозондовых анализов на 5 атомов фтора, так как в этом случае коэффициенты при K, Al и Mg ближе к целочисленным. Можно предположить, что обе фторидные фазы были гидратированы, и в их составе, возможно, присутствует группа OH–, так как большинство анализов, по предварительным данным на ЭДС спектрометре, содержат 2.3–4.3 мас. % кислорода (табл. 4). Обе эти фторидные фазы образовывались из первоначально расплавленной и затем охлажденной до P-T параметров эксперимента исходной шихты. Их образование связано с высоким, возможно избыточным, содержанием фтора в системе, которое было необходимо для получения максимального растворения фтора в изучаемом сиенитовом расплаве. В таблице 2 в правом столбце приведены рассчитанные формулы фторидных фаз для каждого опыта. Среди них преобладает первая фторидная фаза, которая встречена во всех опытах. Эта фаза образует три формы выделений: (a-K3Al) округлые и овальные глобули, раскристаллизованные, вероятно, при закалке, размером 20–100 мкм в поперечнике, (b-K3Al) тонкие дендритовые кристаллы в алюмосиликатном стекле, (c-K3Al) хорошо ограненные кристаллы на поверхности образца (рис. 4 и 5). Приведенные в табл. 4 составы первой фторидной фазы соответствуют основной по площади, a-K3Al, форме выделения. Составы b-K3Al формы выделения получены только в смеси с алюмосиликатным стеклом. Сравнение c-K3Al (мас. %, 37.3 K, 12.2 Al, 39.7 F, 2.9 O) и a-K3Al (мас. %, 45.1 K, 9.8 Al, 43.1 F, 1.5 O) из опыта OP-4b (см. рис. 5) показывает небольшие различия в составах этих форм выделений, однако имеющихся данных недостаточно, чтобы судить одна эта фаза или две разных. Вторая фторидная фаза K2Mg2 обнаружена только в более низкотемпературных опытах при 650–600°C, и в количественном отношении она резко уступает первой (в исходном сиените содержалось только 0.11–0.13 мас. % MgO (табл. 1)). Эта фаза, помимо K, Mg, F и O, содержит Ca (0.6–1.3 мас. %), Mn (0.6–1.3 мас. %), Fe (0.5–0.8 мас. %) и Al (до 1.1 мас. %) (табл. 4). Фаза K2Mg2 выделяется в виде мелких образований до 20 мкм в поперечнике (рис. 4б), имеющих как овальную, так и ограненную форму. Ранее фаза, подобная K3Al, но с расчетом на 6 атомов фтора (K3AlF6), была экспериментально синтезирована Е.Н. Граменицким с соавторами (2005) в системе Si–Al–K–H–O–F при T = 800°C и P =100 МПа, а в калиево-натриевой части этой системы был получен непрерывный ряд твердых растворов Na3AlF6–K3AlF6. Цитируемые авторы рассматривали фазу K3AlF6 как “калиевый аналог криолита” на основании соотношения суммы щелочей к алюминию, которое соответствует криолиту. Содержание фтора в составе фазы определялось в цитируемой работе не аналитически, а по расчету. Мы считаем, что для уточнения содержания фтора и химических формул полученных фторидных фаз, необходимы дополнительные исследования.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
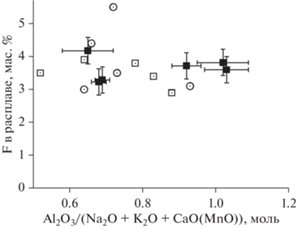
Полученные нами результаты не показывают явной зависимости содержания фтора в исследованном расплаве ультракалиевого сиенита от показателя насыщения алюминием A/NKC (рис. 6), хотя подобная зависимость была ранее установлена в других экспериментальных исследованиях (Scaillet, Macdonald, 2004; Gabitov et al., 2005; Dolejs, Baker, 2006; Lukkari, Holtz, 2007). Возможно, это связано с более низкими содержаниями фтора в перечисленных работах. Приведенные для сравнения на рис. 6 экспериментально определенные содержания фтора в гранитоидных расплавах с разной щелочностью – глиноземистостью (Al2O3/(Na2O + + K2O + MnO), мол.) при T = 900–1000°C и P = = 100 МПа (Чевычелов и др., 2005) также показывают отсутствие зависимости между содержанием фтора и показателем A/NKC. Мы полагаем, что в наших экспериментах была достигнута предельная (максимальная) растворимость фтора в изученном расплаве ультракалиевого сиенита, так как расплав в процессе эксперимента находился в равновесии с более богатыми фтором фторидными фазами. Эта предельная растворимость в нашей системе составляет приблизительно 3–4.5 мас. % F в расплаве. Она сопоставима с экспериментально определенной концентрацией насыщения фтором (3–4 мас. %) плюмазитового гранитоидного расплава (Коваленко, 1979) и с экспериментальными данными по максимальному содержанию фтора (3–5 мас. %) в расплавах SiO2–Al2O3–Na2O–F–H2O (Щекина и др., 2013).
Рис. 6.
Содержание фтора во флюидонасыщенном расплаве калиевого сиенита в зависимости от глиноземистости (показателя насыщения алюминием A/NKC (A/NKM)) этого расплава. Залитые квадраты – наши данные при T = 625–800°C и P = 150–260 МПа (табл. 3). Для сравнения на график нанесены экспериментальные данные по содержанию фтора в гранитоидных расплавах с разной щелочностью – глиноземистостью (в составе расплавов вместо Ca присутствовал Mn) при T = 900–1000°C и P = 100 МПа, взятые из (Чевычелов и др., 2005). Незалитые кружки – данные при T = 900°C; незалитые квадраты – данные при T = 1000°C.
Полученные результаты (табл. 2) позволяют оценить температуры солидуса и ликвидуса насыщенного водным флюидом и фтором сиенитового расплава, которые составляют Тсол = 600–625°C при P = 160 МПа и Тликв = 650–800°C при P = 150–260 МПа. В процессе экспериментов, в результате взаимодействия сиенитового расплава с водным HF + KF раствором и гиератитом, состав расплава изменяется относительно исходного сиенита (табл. 1 и 3). При этом в расплаве увеличивается содержание кремнезема и уменьшаются содержания алюминия и калия, которые в основном расходовались на образование фазы K3Al и, вероятно, частично выносились во флюид. Расчет нормативного состава стекла методом CIPW показывает присутствие, помимо КПШ (64–74 мас. %), кварца (20–25 мас. %), гиперстена (4–4.5 мас. %) и K2SiO3 (0–8 мас. %). Нормативный K2SiO3 появляется только при расчете составов стекла из низкотемпературных (650–625oC) опытов. Расчет нормативного состава стекла из опыта OP-4b (52 мас. % КПШ, 35 мас. % кварца, 6 мас. % гиперстена и 7.5 мас. % K2SiO3) выпадает из общего ряда, что, как можно предположить, связано с небольшим количеством образовавшегося расплава (10–15%) и, возможно, неполным достижением равновесия. При снижении температуры от 800 до 650°C и давления от 250–260 до 150 МПа в результате дифференциации расплава количество нормативного КПШ уменьшается от 72–74 до 64 мас. %. В опытах при 650°C в составе стекла появляется 7–8 мас. % нормативного K2SiO3, а количество нормативного кварца почти не меняется. С этими изменениями в составе стекла связано уменьшение показателя насыщения алюминием A/NKC от 0.92–1.03 при 800°C до 0.68–0.69 при 650oC (табл. 3).
Температура эвтектики смеси кристаллов санидин + кварц (Or58Qz42) в системе KAlSi3O8–SiO2–H2O (без фтора) при давлении воды 150–160 МПа составляет около 780°C (Shaw, 1963). Отсюда следует, что насыщение расплава фтором в наших экспериментах могло значительно (на 170°C) понижать температуру солидуса. Полученная нами Тсол ~613 ± 12°C заметно выше Тсол. < 550°C, которая была экспериментально определена для гаплогранитной системы Qz–Ab–Or в условиях избытка воды, добавки 4 мас. % F и при P = 100 МПа (Manning, 1981). Эта разница связана с тем, что изученная нами преимущественно калиево-полевошпатовая система является граничной для более сложной трехкомпонентной Qz–Ab–Or гаплогранитной системы. Сопоставление определенной нами температуры солидуса с таковыми для природных литий-фтористых гранитов Орловского месторождения, Восточное Забайкалье (Тсол = = 650°C), Вознесенского рудного узла, Приморье (Тсол = 620°C) и Салминского батолита, Южная Карелия (Тсол = 570°C), полученными экспериментально при давлении около 150 МПа и содержании 2–3 мас. % F (Аксюк и др., 2016; Шаповалов и др., 2019), показывает хорошую сходимость, учитывая различия в химических составах и содержании летучих компонентов. Для Орловского месторождения по данным гомогенизации расплавных включений определена также более низкая температура солидуса (~550°C) литий-фтористых гранитов (Badanina et al., 2004).
Вязкость насыщенных водой и фтором кислых щелочных расплавов недостаточно изучена экспериментально, однако, известно, что высокая щелочность может значительно понижать вязкость. Рейфом Ф.Г. с соавторами (Reyf et al., 2000) по результатам изучения расплавных и флюидных включений в кварце и топазе из литий-фтористых гранитов Орловского месторождения была определена аномально низкая вязкость расплава ~50 Па · с, при 660°C и среднем составе расплава включений (мас. %): F ~4, H2O ~6, SiO2 67.6, Al2O3 16.7, K2O 3.1, Na2O 2.3. В работе (Thomas et al., 1996) методом микротермометрии расплавных включений в кварце и топазе из гранитов и пегматитов (Рудных гор, Германия; Славковского леса, Чехия и Центрального массива, Франция) также получена низкая величина вязкости от 1000 до 10 Па · с при 800°C. Эти данные указывают на возможную аномально низкую вязкость изученных нами высокощелочных насыщенных H2O и F сиенит-порфировых расплавов. Хотя экспериментальные исследования методом радиационного вискозиметра (T = 900°C, P = 200 МПа, 1н HF) гранитных расплавов показывают величины вязкости на 2–3 порядка более высокие ~50 × 103 Па · с (Персиков, 1984). Возможно, эти расхождения в оценках вязкости связаны с различной щелочностью, а также с формой вхождения фтора (например, HF, KF, NaF) и тонкими различиями в химическом составе и структуре расплавов.
Во время эксперимента вместе сосуществовали алюмосиликатный расплав, кристаллы и надкритический водный фторидный флюид. В процессе эксперимента исходно кислый раствор 1н HF + 1н KF (pH = 2–2.5) становился щелочным (pH раствора после опыта = 9). Отметим, что 1н раствор KF имеет pH около 9, так как KOH является сильным основанием, а HF слабой кислотой. Химический состав раствора после опыта из-за малого его количества не анализировался. Известно, что фтор является одним из немногих элементов, которые способны вытеснять кислород из силикатов. В водном растворе HF обычно растворяют силикаты. Можно предположить, что в процессе наших экспериментов взаимодействие флюида с расплавом происходило по следующим реакциям:
(1)
$\begin{gathered} 2{\text{KAlS}}{{{\text{i}}}_{{\text{3}}}}{{{\text{O}}}_{{{\text{8}}\left( {{\text{расплав}}} \right)}}} + 36{\text{H}}{{{\text{F}}}_{{\left( {{\text{флюид}}} \right)}}} \to \\ \to {{{\text{K}}}_{{\text{2}}}}{{{\text{[Si}}{{{\text{F}}}_{{\text{6}}}}{\text{]}}}_{{{\text{(флюид)}}}}} + {\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{[Si}}{{{\text{F}}}_{{\text{6}}}}{\text{]}}}_{{{\text{3(флюид)}}}}} + \\ + \,\,2{{{\text{H}}}_{{\text{2}}}}{{{\text{[Si}}{{{\text{F}}}_{{\text{6}}}}{\text{]}}}_{{{\text{(флюид)}}}}} + 16{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\left( {{\text{флюид}}} \right)}}}, \\ \end{gathered} $(2)
$\begin{gathered} {\text{KAlS}}{{{\text{i}}}_{{\text{3}}}}{{{\text{O}}}_{{{\text{8}}\left( {{\text{расплав}}} \right)}}} + 22{\text{H}}{{{\text{F}}}_{{\left( {{\text{флюид}}} \right)}}} \to \\ \to {\text{K}}{{{\text{F}}}_{{\left( {{\text{флюид}}} \right)}}} + {\text{Al}}{{{\text{F}}}_{{{\text{3}}\left( {{\text{флюид}}} \right)}}} + \\ + \,\,3{{{\text{H}}}_{{\text{2}}}}{{{\text{[Si}}{{{\text{F}}}_{{\text{6}}}}{\text{]}}}_{{{\text{(флюид)}}}}} + 8{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\left( {{\text{флюид}}} \right)}}}, \\ \end{gathered} $(3)
$\begin{gathered} {\text{Si}}{{{\text{O}}}_{{{\text{2}}\left( {{\text{расплав}}} \right)}}} + 6{\text{H}}{{{\text{F}}}_{{\left( {{\text{флюид}}} \right)}}} \to \\ \to {{{\text{H}}}_{{\text{2}}}}{{{\text{[Si}}{{{\text{F}}}_{{\text{6}}}}{\text{]}}}_{{{\text{(флюид)}}}}} + 2{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\left( {{\text{флюид}}} \right)}}}, \\ \end{gathered} $(4)
$\begin{gathered} {\text{Si}}{{{\text{O}}}_{{{\text{2}}\left( {{\text{расплав}}} \right)}}} + 4{\text{H}}{{{\text{F}}}_{{\left( {{\text{флюид}}} \right)}}} \to \\ \to {\text{Si}}{{{\text{F}}}_{{{\text{4}}\left( {{\text{флюид}}} \right)}}}{\kern 1pt} \uparrow + \,2{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\left( {{\text{флюид}}} \right)}}}, \\ \end{gathered} $при этом HF из флюида расходовался, и флюид обогащался калием, алюминием и кремнием, поступающими из расплава. Кроме этого, слабощелочная среда могла создаваться по реакции высокотемпературного гидролиза:
(5)
$\begin{gathered} {\text{K}}{{{\text{F}}}_{{\left( {{\text{флюид}}} \right)}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\left( {{\text{флюид}}} \right)}}} = \\ = {\text{H}}{{{\text{F}}}_{{\left( {{\text{флюид}}} \right)}}}{\kern 1pt} \uparrow + \,\,{\text{KO}}{{{\text{H}}}_{{\left( {{\text{флюид}}} \right)}}}. \\ \end{gathered} $При этом образующийся HF покидал флюид и взаимодействовал с расплавом согласно реакциям (1)–(4). При понижении температуры и давления до 650–625°C и 150 МПа можно предполагать гетерогенизацию флюида на паровую и жидкую фазы. Жидкая фаза будет обогащаться K и Si.
(6)
$\begin{gathered} 2{\text{KO}}{{{\text{H}}}_{{\left( {{\text{флюид}}} \right)}}} + {\text{Si}}{{{\text{O}}}_{{{\text{2}}\left( {{\text{расплав}}} \right)}}} = \\ = {{{\text{K}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{{{\text{3}}\left( {{\text{флюид}}} \right)}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\left( {{\text{флюид}}} \right)}}}, \\ \end{gathered} $в результате чего образовывалось силикатное стекло K2SiO3 (водный щелочной раствор–расплав), способное концентрировать рудные компоненты, как описано в работе (Котельников и др., 2018).
Для природных образцов сиенит-порфиров характерна кристаллизация калиевого полевого шпата, как преобладающей фазы, и во вкрапленной ассоциации, и в составе основной массы породы. Расчет нормативного состава исходных для опытов образцов методом CIPW также показывает преобладание ортоклаза (90 мас. %) над всеми остальными нормативными минералами: 6 мас. % – диопсид, 1.5 мас. % – кварц, 1.5 мас. % – альбит, 1 мас. % приходится на магнетит, ильменит и апатит. В образцах после опытов, исключая фторидную фазу K3Al и незначительные выделения флюорита, основной фазой, кристаллизующейся из расплава, является калиевый полевой шпат (табл. 2). Зерна полевого шпата имеют довольно большие размеры и идиоморфные очертания. Таким образом, общая последовательность кристаллизации из расплава основных минеральных фаз является близкой как для природных, так и для экспериментальных образцов.
В природных образцах сиенит-порфиров одними из ранних фаз, помимо калиевого полевого шпата, присутствующими во вкрапленниках в подчиненных количествах, являются темноцветные минералы. Отсутствие темноцветных минералов в опытах связано с низкими содержаниями железа и магния в исходных смесях и не влияет на основные выводы настоящей работы.
ВЫВОДЫ
1. Определена высокая максимальная растворимость фтора во флюидонасыщенном ультракалиевом сиенитовом расплаве (2.8–4.2 мас. % в диапазоне 650–800°C, P = 150–260 МПа и 3.8–4.6 мас. % при 625°C, P = 160 МПа).
2. Оценены температуры солидуса (600–625°C) при P = 160 МПа и ликвидуса (650–800°C) при P = 150–260 МПа насыщенного флюидом и фтором щелочного сиенитового расплава.
3. Магматический водный фторидный флюид, сосуществующий с насыщенным фтором и водой расплавом щелочного сиенита, вероятно, являлся слабощелочным.
4. Начальная кристаллизация зерен калиевого полевого шпата из расплава в серии экспериментов совпадает с наблюдаемой в природных образцах.
Благодарности. Авторы благодарны А.Р. Котельникову за помощь и советы в работе, а также рецензентам А.В. Гирнису и Т.И. Щекиной за квалифицированные советы и замечания. Авторы выражают признательность и благодарность компании Норд-Голд за предоставленную возможность работы с керновым материалом.
Источники финансирования. Изучение петрологии раннемеловых щелочных сиенит-порфиров Западного Алдана проводится в рамках госбюджетной темы ИГЕМ РАН № 121041500222-4. Экспериментальные исследования выполнены за счет средств госбюджетной темы ИЭМ РАН FMUF-2022-0003.
Список литературы
Аксюк А.М., Конышев А.А., Коржинская В.С., Шаповалов Ю.Б. Экспериментальное исследование физико-химических условий плавления редкометальных гранитов Вознесенского рудного узла, Приморье // Докл. АН. 2016. Т. 470. № 1. С. 64–66.
Алферьева Я.О., Граменицкий Е.Н., Щекина Т.И. Экспериментальное изучение фазовых отношений в литийсодержащей богатой фтором гаплогранитной и нефелинсиенитовой системе // Геохимия. 2011. № 7. С. 713–728.
Граменицкий Е.Н., Щекина Т.И., Девятова В.Н. Фазовые отношения во фторсодержащих гранитной и нефелин-сиенитовой системах и распределение элементов между фазами (экспериментальное исследование). М.: ГЕОС, 2005. 188 с.
Зубков Ю.А., Сагир А.В., Чварова Н.В. “Угуйский” тип большеобъемных золоторудных месторождений, сформированных в линейной коре выветривания (Юго-Западная Якутия) // Отечественная геология. 2020. № 2. С. 32–45.
Коваленко Н.И. Экспериментальное исследование условий образования редкометальных литий-фтористых гранитов. М.: Наука, 1979. 152 с.
Когарко Л.Н., Кригман Л.Д. Фтор в силикатных расплавах и магмах. М.: Наука, 1981. 127 с.
Котельников А.Р., Коржинская В.С., Котельникова З.А. и др. Влияние силикатного вещества на растворимость пирохлора во фторидных растворах при Т = 550–850°C, P = 50–100 МПа (экспериментальные исследования) // Докл. АН. 2018. Т. 482. № 2. С. 196–199.
Перетяжко И.С., Савина Е.А., Сук Н.И. и др. Эволюция состава фторидно-кальциевого расплава по экспериментальным данным и процессы образования флюорита в риолитах // Петрология. 2020. Т. 28. № 3. С. 254–279.
Персиков Э.С. Вязкость магматических расплавов. М.: Наука, 1984. 160 с.
Чевычелов В.Ю. Распределение летучих, породообразующих и рудных компонентов в магматических системах: экспериментальные исследования. Автореф. дис. … д-ра геол.-мин. наук. М.: ИЭМ РАН, 2013. 62 с.
Чевычелов В.Ю. Распределение летучих компонентов (Cl, F, CO2) в водонасыщенных флюидно-магматических системах различного состава // Петрология. 2019. Т. 27. № 6. С. 638–657.
Чевычелов В.Ю., Зарайский Г.П., Борисовский С.Е., Борков Д.А. Влияние состава расплава и температуры на распределение Та, Nb, Mn и F между гранитным (щелочным) расплавом и фторсодержащим водным флюидом: фракционирование Ta, Nb и условия рудообразования в редкометальных гранитах // Петрология. 2005. Т. 13. № 4. С. 339–357.
Чевычелов В.Ю., Бородулин Г.П., Зарайский Г.П. Растворимость колумбита (Mn,Fe)(Nb,Ta)2O6 в гранитоидных и щелочных расплавах при 650–850°C и 30–400 МПа: экспериментальные исследования // Геохимия. 2010. № 5. С. 485–495.
Шаповалов Ю.Б., Чевычелов В.Ю., Коржинская В.С. и др. Физико-химические условия образования редкометальных месторождений во фторсодержащих гранитоидных системах по экспериментальным данным // Петрология. 2019. Т. 27. № 6. С. 617–637.
Щекина Т.И., Граменицкий Е.Н., Алферьева Я.О. Лейкократовые магматические расплавы с предельными концентрациями фтора: эксперимент и природные отношения // Петрология. 2013. Т. 21. № 5. С. 499–516.
Badanina E.V., Veksler I.V., Thomas R. et al. Magmatic evolution of Li-F, rare-metal granites: A case study of melt inclusions in the Khangilay complex, Eastern Transbaikalia (Russia) // Chem. Geol. 2004. V. 210. P. 113–133.
Bambauer H.U., Kroll H., Nager H.E., Pentinghaus H. Feldspat-mischkristalle – eine Ubersicht // Bull. Soc. Fr. Mineral. Cristallogr. 1974. V. 97. P. 313–345.
Berndt J., Koepke J., Holtz Fr. An experimental investigation of the influence of water and oxygen fugacity on differentiation of MORB at 200 MPa // J. Petrol. 2005. V. 46. № 1. P. 135–167.
Dingwell D.B., Hess K.-U., Knoche R. Granite and granitic pegmatite melts: Volumes and viscosities // Trans. R. Soc. Edinburgh, Earth Sci. 1996. V. 87. P. 65–72.
Dolejs D., Baker D.R. Fluorite solubility in hydrous haplogranitic melts at 100 MPa // Chem. Geol. 2006. V. 225. P. 40–60.
Gabitov R.I., Price J.D., Watson E.B. Solubility of fluorite in haplogranitic melt of variable alkalis and alumina content at 800–1000oC and 100 MPa // Geochem. Geophys. Geosyst. 2005. V. 6. № 3. Q03007.
Johannes W., Holtz F. Petrogenesis and experimental petro-logy of granitic rocks // Minerals and Rocks. № 22. Berlin Heidelberg: Springer-Verlag, 1996. 335 p.
Keppler H., Wyllie P.J. Partitioning of Cu, Sn, Mo, W, U, and Th between melt and aqueous fluid in the systems haplogranite-H2O-HCl and haplogranite-H2O-HF // Contrib. Mineral. Petrol. 1991. V. 109. P. 139–150.
Li X., Zhang C., Wang L. et al. Experiments on the saturation of fluorite in magmatic systems: Implications for maximum F concentration and fluorine-cation bonding in silicate melt // J. Earth Sci. 2020. V. 31. № 3. P. 456–467.
Lukkari S., Holtz F. Phase relations of a F-enriched peraluminous granite: an experimental study of the Kymi topaz granite stock, southern Finland // Contrib. Mineral. Petrol. 2007. V. 153. P. 273–288.
Manning D.A.C. The effect of fluorine on liquidus phase relationships in the system Qz–Ab–Or with excess water at 1 kbar // Contrib. Mineral. Petrol. 1981. V. 76. P. 206–215.
Price J.D., Hogan J.P., Gilbert M.C. et al. Experimental study of titanite-fluorite equilibria in the A-type Mount Scott Granite: Implications for assessing F contents of felsic magma // Geology. 1999. V. 27. № 10. P. 951–954.
Reyf F.G., Seltmann R., Zaraisky G.P. The role of magmatic processes in the formation of banded Li,F-enriched grani-tes from the Orlovka tantalum deposit, Transbaikalia, Russia: Microthermometric evidence // Can. Mineral. 2000. V. 38. P. 915–936.
Scaillet B., Macdonald R. Fluorite stability in silicic magmas // Contrib. Mineral. Petrol. 2004. V. 147. P. 319–329.
Shaw H.R. The four-phase curve sanidine-quartz-liquid-gas between 500 and 4000 bars // Amer. Mineral. 1963. V. 48. P. 883–896.
Thomas R., Rhede D., Trumbull R.B. Microthermometry of volatile-rich silicate melt inclusions in granitic rocks // Z. Geol. Wiss. 1996. V. 24. P. 507–528.
Webster J.D. Partitioning of F between H2O and CO2 fluids and topaz rhyolite melt. Implications for mineralizing magmatic-hydrothermal fluids in F-rich granitic systems // Contrib. Mineral. Petrol. 1990. V. 104. P. 424–438.
Wyllie P.J., Tuttle O.F. Experimental investigation of silicate systems containing two volatile components. Part II. The effects of NH3 and HF in addition to H2O on the melting temperatures of albite and granite // Amer. J. Sci. 1961. V. 259. P. 128–143.
Yang L., van Hinsberg V.J. Liquid immiscibility in the CaF2-granite system and trace element partioning between the immiscible liquids // Chemical Geology. 2019. V. 511. P. 28–41.
Дополнительные материалы отсутствуют.


