Почвоведение, 2019, № 11, стр. 1356-1364
Сезонная динамика биомассы микроорганизмов в дерново-подзолистой почве
Д. А. Никитин a, Т. И. Чернов a, *, А. Д. Железова a, А. К. Тхакахова a, С. А. Никитина b, М. В. Семенов a, Н. А. Ксенофонтова a, b, О. В. Кутовая a
a Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
b МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: chern-off@mail.ru
Поступила в редакцию 26.02.2019
После доработки 29.03.2019
Принята к публикации 24.04.2019
Аннотация
Проведена оценка сезонной динамики структуры микробной биомассы в залежной дерново-подзолистой почве (Eutric Albic Retisol (Loamic, Ochric)) методом люминесцентной микроскопии. Образцы почв ежемесячно отбирали из трех почвенных горизонтов (P – глубина отбора 5–15 см, BЕL – 30–40 см, ВT2 – 50–60 см) с марта 2017 по февраль 2018 гг. на территории стационара “Ельдигино” (Московская область). Параллельно с определением микробной биомассы проводили измерения температуры и влажности почвы. Во все сроки отбора в составе микробной биомассы доминировали грибы (до 93%). Минимальная численность и биомасса всех групп микроорганизмов приходится на период с ноября по март. В мае происходило увеличение биомассы прокариот в 2–3 раза, максимальные значения наблюдались в августе и сентябре. Длина мицелия актиномицетов была наибольшей в месяцы с низкой влажностью почвы: в июле и августе. Максимумы биомассы грибов выявлены в июле и сентябре. Сезонное изменение микробной биомассы было наиболее сильным в верхнем горизонте P и сглаженным – в горизонтах BEL и BT. С помощью регрессионного анализа выявлено значимое влияние факторов температуры и глубины отбора на показатели биомассы грибов и прокариот. Полученные результаты свидетельствуют о значительных сезонных вариациях биомассы почвенной микробиоты, которые следует учитывать при сравнении образцов, отобранных в разное время года.
ВВЕДЕНИЕ
Микробная биомасса представляет собой наиболее динамичный пул в составе органического вещества почв, отражает тренд его накопления или минерализации, быстро реагируя на изменения условий окружающей среды [12, 20, 28]. В настоящее время чрезвычайно актуальна проблема сохранения углерода в залежных почвах, а также влияния почвенной биоты на количественные показатели содержания почвенного органического углерода [28]. Дерново-подзолистые почвы России активно используются в сельскохозяйственной деятельности в нечерноземной зоне. Выведенные из сельскохозяйственного оборота в 1990–2000 гг. залежные дерново-подзолистые почвы вновь представляют производственный интерес. Начальные этапы реградации дерново-подзолистых почв связаны с восстановлением естественной растительности, происходит возобновление природных процессов почвообразования, что вызывает дифференциацию почвенного профиля [32].
Большая часть исследований по оценке биомассы различных таксономических групп микроорганизмов в дерново-подзолистых почвах проводилась непрямыми методами. Методом субстрат-индуцированного дыхания (СИД) показано, что микробная биомасса дерново-подзолистой почвы может достигать 900 мкг/г почвы [25], доля грибов в которой составляет более 60%, и отмечается ее увеличение вниз по профилю даже в пределах гумусовых горизонтов – с 63 (глубина 0–5 см) до 70% (глубина 5–10 см) [3]. Однако метод СИД дает большую погрешность при оценке вклада отдельных групп (бактерий и грибов) в общую микробную биомассу из-за неполного подавления жизнедеятельности нецелевых микроорганизмов антибиотиками [14, 16]. Кроме того, часть выделяющегося CO2 может быть адсорбирована почвенными частицами и/или растворена в жидкой фазе почв.
Люминесцентная микроскопия является прямым методом оценки микробной биомассы почв и позволяет определять численность бактерий и грибных спор, а также длину мицелия грибов и актиномицетов [2]. С помощью данного метода показано, что запасы микробной биомассы в дерново-подзолистых почвах составляют около 14 т/га, 98% от которой приходится на грибы. Численность бактерий в этих почвах максимальна в лесной подстилке (109 кл./г почвы) и значительно меньше (106–108 кл./г) в минеральных горизонтах [4, 10]. Наблюдается аналогичное профильное распределение длины грибного мицелия: 550 м/г почвы в подстилке, 230 м/г почвы в гор. A и ЕL, 25 м/г почвы в гор. ВС [4, 10]. Доля спор в общей грибной биомассе по всему почвенному профилю невелика (до 6–32%) [10, 17], она увеличивается от органогенных горизонтов к минеральным [4]. Снижение биомассы бактерий с увеличением глубины почвы под лесной и травянистой растительностью более выражено, чем уменьшение биомассы грибов; в почве под пашней наблюдается более равномерное распределение микробной биомассы по профилю почвы [31].
В зонах средней и южной тайги, где распространены дерново-подзолистые почвы, сезонные изменения температуры, влажности и других факторов хорошо выражены, следовательно, численность микроорганизмов в почве может существенно меняться в течение года. Согласно ранее полученным данным, в подзолистых почвах наименьшая биомасса грибов наблюдается весной, а наибольшая – осенью [5]. В зимний период в почве благодаря снежному покрову сохраняется температура около 0°С, что способствует сохранению активности микробного сообщества [26, 30]. При оценке запасов микробной биомассы в почве наиболее информативен профильный подход – измерение ее количества не только в верхнем органическом горизонте, но и в нижележащих органо-минеральных и минеральных горизонтах, где ее доля может составлять до 35–50% [1, 6, 13, 33]. Таким образом, для более полной характеристики запасов микробной биомассы в дерново-подзолистых почвах необходимо исследовать ее сезонные изменения в полном профиле почвы.
Цель исследования– анализ сезонной динамики биомассы бактерий, грибов и актиномицетов в горизонтах залежной дерново-подзолистой почвы и ее связи с изменениями почвенных условий.
ОБЪЕКТЫ И МЕТОДЫ
Объектами исследования являлись почвы залежи, находящейся на территории стационара “Ельдигино” (Зеленоградский опорный пункт Почвенного института им. В.В. Докучаева), Московская область, Пушкинский район (56°08′01.7″ N, 37°48′07.3″ E). Климат данного района умеренно-континентальный, со среднегодовой температурой воздуха 3.0–3.5°С, суммой активных температур 1900–2100°С и средней продолжительностью безморозного периода в 125–130 дней. Годовое количество осадков составляет 550–600 мм, с максимумом в осенне-весенний период.
Район исследований относится к южной подзоне тайги с преобладанием смешанных лесов. Растительный покров изученной территории представлен постагрогенным травянистым сообществом с преобладанием Vicia sativa (вика посевная), Equisetum arvense (хвощ полевой), Ranunculus acris (лютик едкий), Sonchus arvensis (осот полевой), Lactuca serriola (латук дикий), Poa pratensis (мятлик луговой), Taraxacum officinale (одуванчик лекарственный), Trifolium pratense (клевер луговой), Phleum pratense (тимофеевка луговая), Vicia cracca (горошек мышиный).
Почвенный покров изученной территории составляют дерново-подзолистые почвы на покровных суглинках, подстилаемых мореной (Eutric Albic Retisol (Loamic, Cutanic, Differentic, Ochric) согласно классификации WRB 2014). Площадка, где отбирали образцы, представляла собой прямоугольный участок залежи на плакорном пространстве 20 м шириной и 40 м длиной. Зональные дерново-подзолистые почвы на покровном лёссовидном суглинке описаны в районе д. Дарьино Пушкинского района Московской области, примерно в 4 км от исследуемой залежи; исследован их гранулометрический и агрегатный [15] состав. Отбор образцов из трех почвенных горизонтов проводили в пятикратной повторности ежемесячно с марта 2017 по февраль 2018 гг. в конце (23–31 числа) каждого месяца. Образцы отбирали при помощи ручного почвенного бура, точки пробоотбора располагали вдоль длинной стороны площадки через каждые 3–7 м. Глубины отбора образцов (10 ± 5, 35 ± 5 и 55 ± 5 см) соответствовали расположению генетических почвенных горизонтов, выявленных в опорном почвенном разрезе на данной площадке (P – старопахотный – 0–32 см, BEL – субэлювиальный – 32–40 см, BT1 – текстурный – 40–50 см, BT2 – текстурный – 50–67 см, BC – 67–130 см). Почва определена как дерново-подзолистая, названия горизонтов приведены согласно Классификации почв России 2004 [8]. До приготовления препаратов для микроскопирования образцы хранили в холодильнике при 4°С.
Абсолютную влажность почвы определяли термостатно-весовым методом с помощью взвешивания отобранных образцов в алюминиевых бюксах с известной массой и прокаливаемых в сушильном шкафу в течение суток при температуре 105°С. Температуру горизонтов почвы измеряли с помощью автоматической стационарной метеостанции Vantage Pro2, установленной вблизи опытного участка. Для анализа фиксировали средние значения температур почвенных горизонтов в 14:00 за каждые трое суток.
Микробную биомассу оценивали с помощью метода люминесцентной микроскопии [7]. Почвенную суспензию для препаратов, где учитывали прокариот, обрабатывали на ультразвуковой установке Branson Digital Sonifier S-450 (США) в течение 2 мин при мощности 70% от максимальной; почвенную суспензию для препаратов, где учитывали грибы – на вортексе MSV-3500 (Латвия) при скорости 3500 об./мин в течение 5 мин. После чего суспензию наносили на очищенное стекло, распределяя по площади 4 см2. Численность грибных спор, длину и толщину гиф выявляли при окраске калькофлуором белым, который связывается с хитином их клеточных стенок [11, 21]. Количество клеток прокариот оценивали при окраске акридиновым оранжевым, который связывается с ДНК [7]. Препараты просматривали на люминесцентном микроскопе “Биомед 2” (Россия) по 90 полей зрения для одного образца. Расчеты бактериальной биомассы проводили, учитывая, что масса одной клетки объемом 0.1 мкм3 равна 2 × 10–14 г [11]. Содержание биомассы грибов в изученных субстратах определяли с учетом того, что плотность спор равна 0.837 г/см3, мицелия – 0.628 г/см3 [11]. Содержание микробной биомассы рассчитывали в мг сухой биомассы/г абсолютно сухой почвы. Всего проанализировано 180 почвенных образцов (5 точек пробоотбора × × 3 почвенных горизонта × 12 мес.).
Статистическую обработку данных проводили с использованием программ Microsoft Оffice Excel 2010 и Statistica 8.0. Для значений влажности, биомассы бактерий, актиномицетов и грибов, длины мицелия грибов рассчитывали среднее и стандартное отклонение.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влажность почвенных горизонтов на протяжении исследования менялась от 16.8 до 40.1 мас. % (рис. 1). Максимальные ее значения наблюдались в марте во время активного снеготаяния; а минимальные – в августе, в период с наименьшим количеством осадков. Влажность изменялась в диапазонах от 21.0 до 40.1 мас. % для гор. P, от 16.8 до 33.7 мас. % для гор. BEL, от 21.5 до 33.5 мас. % для гор. BT2. За период исследований влажность в гор. P (5‒15 см) была выше, чем в гор. BEL (30‒40 см) и BT2 (50‒60 см), за исключением августа и сентября, когда значения были равны для гор. P и BEL. Близость значений влажности в гор. BEL и BT2 может быть связана с водоупорными свойствами иллювиального слоя тяжелого гранулометрического состава. Снежный покров присутствовал на площадке с октября по март (в марте 2017 г. и с октября 2017 г. по февраль 2018 г.).
Рис. 1.
Сезонные изменения влажности (А) и температуры (Б) в генетических почвенных горизонтах (1 – P – глубина 5‒15 см, 2 – BЕL – 30‒40 см, 3 – BT2 – 50‒60 см).
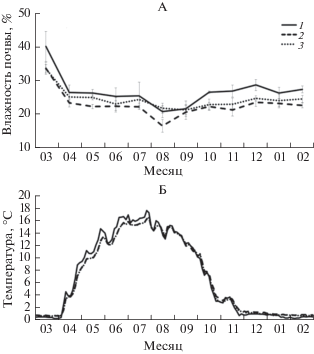
Температура всех горизонтов почвы с ноября по март была минимальной (0.5‒2°С). За весь период исследования температура почвенных горизонтов была положительной, что связано с отсутствием длительных заморозков до формирования снежного покрова. Существенное увеличение температуры наблюдалось с середины апреля по конец мая, в начале июня отмечалось локальное похолодание. Максимальные значения температуры (15‒17.2°С) выявлены с конца июня по начало августа, далее наблюдалось постепенное снижение температуры до минимума. Колебания температур в поверхностном горизонте были сильнее, чем в гор. BEL и BT2. В течение срока исследования температура в гор. BEL и BT2 практически не различалась.
Общая микробная биомасса
Наибольшая микробная биомасса в течение всего сезона отмечалась в верхнем гор. P. Подобная закономерность отмечена ранее для других дерново-подзолистых почв [5]. На протяжении всего года наибольшие значения наблюдались для биомассы грибов, которая в 7–10 раз превышала биомассу прокариот. Это соответствует данным о доминировании грибов в микробной биомассе в почве, полученным с помощью спектра различных методов (прямого микроскопирования, фумигации–экстракции, селективного ингибирования СИД антибиотиками) для почв под разными типами землепользования [27]. Высокая доля биомассы грибов в общей микробной биомассе свидетельствует об устойчивости биогеоценоза [35].
Биомасса грибов
Биомасса грибов в исследуемых образцах сильно варьировала в зависимости от глубины залегания горизонта и сезона – от 65 до 1123 мкг/г почвы (рис. 2, А). Значительно менялась структура биомассы грибов: количество спор составляло 105–106 шт./г почвы, длина мицелия – от 46.8 до 312.7 м/г почвы (рис. 2, Б). В зимний период биомасса грибов была наименьшей во всех исследованных горизонтах. Наблюдалось ее постепенное возрастание с апреля по июнь, а максимальные значения были достигнуты в июле. Подобное увеличение биомассы, вероятнее всего, связано с развитием грибного мицелия. Значительное снижение биомассы грибов в гор. P наблюдалось в августе, что могло быть следствием уменьшения влажности. В течение осенних месяцев биомасса грибов постепенно снижалась во всех горизонтах до минимума.
Рис. 2.
Сезонные изменения биомассы (А) и длины мицелия грибов (Б) в почвенных генетических горизонтах (1 – P – глубина 5‒15 см, 2 – BЕL – 30‒40 см, 3 – BT2 – 50‒60 см). В – сезонные изменения температуры воздуха, температуры верхнего гор. P и длины мицелия грибов в гор. P.
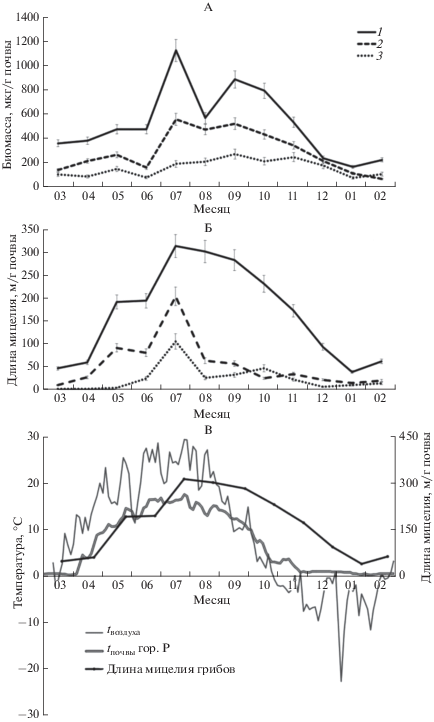
Важным показателем состояния пула почвенной микобиоты является оценка биоморфологической структуры биомассы грибов [9]. В составе биомассы грибов выявлены как мелкие (d = 2–3 мкм), так и крупные (d = 5–7 мкм) покоящиеся пропагулы. Численность спор большого размера была выше в гор. Р (до 7.7 × 103 шт./г почвы), снижаясь примерно в 2 раза в элювиальном гор. BЕL (глубина 30‒40 см) и более чем на порядок (до 3.4 × 102 шт./г почвы) – в иллювиальном гор. ВT2 (50‒60 см). Численность спор малого диаметра (d = 2–3 мкм) с максимумом в гор. P (до 2.6 × 105 шт./г почвы) также двукратно снижалась в гор. BEL, но возрастала в слое ВT2 (до 2.0 × × 105 шт./г почвы). Такая закономерность может быть связана с наличием в гор. BT2 большего количества глинистых минералов и, как следствие, адсорбцией на них спор грибов. При микроскопировании образцов зимнего периода в минеральных гор. BEL и ВT2 встречались прорастающие споры.
Известно, что большая часть (до 95%) грибной биомассы в дерново-подзолистых почвах представлена активными формами – мицелием [10]. Однако в настоящей работе показано, что в минеральных слоях доля покоящихся пропагул – спор – может доходить до 84% (гор. BT2, март), что, вероятно, связано с малым количеством доступных органических веществ и меньшей температурой в глубоких слоях. Наибольшая доля грибного мицелия по биомассе (49%) была выявлена в верхнем гор. P в июне.
Длина мицелия грибов достигала максимальных значений в июле так же, как показатели биомассы. В гор. P в зимние месяцы наблюдается минимальная длина мицелия грибов, которая резко возрастает в мае, достигает максимума в июле и медленно снижается к декабрю–январю. Элювиальный гор. BEL повторяет тенденцию гумусово-аккумулятивного с меньшими значениями длины мицелия. Развитие грибного мицелия в гор. ВT2 наблюдается с июня. В минеральных гор. BEL и BT2 длина мицелия снижается уже в августе и сохраняется на одинаково низком уровне на протяжении осенних и зимних месяцев, то есть активное функционирование почвенных грибов происходило, в основном, в гумусовом горизонте, а в минеральных горизонтах лишь на протяжении 2–3-летних месяцев.
Прокариотная биомасса
Численность прокариот за год исследований колебалась от 108 до 109 кл./г почвы, длина актиномицетного мицелия варьировала в диапазоне от 2.5 до 31.9 м/г почвы, а биомасса бактерий колебалась от 22 до 84 мкг/г (рис. 3, А). Наименьшая биомасса прокариот во всех горизонтах была отмечена в зимний период, тогда как в марте и апреле она постепенное увеличивалась. В мае биомасса прокариот увеличилась в 2 раза по сравнению с апрелем. В июне было выявлено снижение биомассы прокариот в гор. P, а максимальные значения были достигнуты в августе (на глубине 5‒15 см) и сентябре (на глубине 30‒40 см) (рис. 3, А). Наибольшая разница в биомассе бактерий между гор. P и BEL была выявлена в августе, а минимальная – в июне. Наименьшая разница по длине мицелия актиномицетов в отличие от биомассы прокариот зарегистрирована в октябре (рис. 3, Б).
Рис. 3.
Сезонные изменения биомассы прокариот (А) и длины актиномицетного мицелия (Б) в почвенных генетических горизонтах (1 – P – глубина 5‒15 см, 2 – BЕL – 30‒40 см, 3 – BT2 – 50‒60 см).
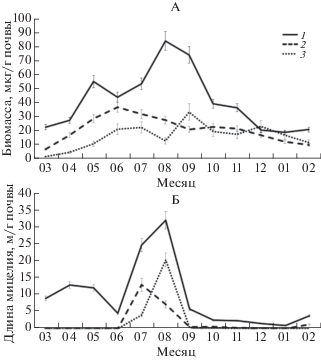
На долю актиномицетов приходилось около 1% от общей биомассы прокариот. Максимальная длина актиномицетного мицелия наблюдалась в августе на глубинах 5‒15 и 50‒60 см и в июле на глубине 30‒40 см. Необходимо отметить, что в минеральных горизонтах актиномицеты зафиксированы лишь в июле и августе, в самые сухие месяцы (рис. 3, Б). Предположительно, данное явление связано с тем, что многие актиномицеты хорошо приспособлены к низким значениям влажности. На глубине 30‒40 см в июле влажность была наименьшей, поэтому на данной глубине актиномицеты, вероятно, быстрее развивались, используя все доступные им питательные субстраты, и к августу переходили в состояние спор. В других горизонтах (5‒15 и 50‒60 см) в июле и предыдущих месяцах влажность превышала оптимальную, и только к августу выявлялся активный рост актиномицетов. В последующие месяцы наблюдалось закономерное уменьшение длины актиномицетного мицелия в гумусовом горизонте.
Сезонная динамика биомассы почвенных микроорганизмов
С ноября по март биомасса прокариот и грибов практически не изменялась. В середине апреля произошло резкое увеличение температуры почвы, однако соответствующее возрастание биомассы прокариот проявилось лишь в мае. Скорее всего, весеннее увеличение численности микроорганизмов в первую очередь связано с активностью растений, увеличившейся с ростом температуры. Пониженные значения микробной биомассы в почвах умеренного климата с ноября по май – известный паттерн [24]. В июне наблюдалось локальное снижение биомассы бактерий и отсутствие увеличения длины мицелия грибов на глубине 5‒15 см, что может быть обусловлено похолоданием в начале июня (рис. 1), которое могло стать стрессовым фактором для растительного сообщества и, следовательно, для почвенной микробиоты. Известно, что грибы по сравнению с бактериями более устойчивы к изменениям температуры и влажности [34], что объясняет более выраженное воздействие снижения температуры в июне на биомассу бактерий. Максимальные значения микробной биомассы отмечались в июле–сентябре. Максимальные значения эмиссии CO2 из почвы также часто фиксируются в конце лета [23, 36]. Возможной причиной этого является большее количество доступных органических веществ – по некоторым данным, количество корневых экссудатов увеличивается с возрастом однолетних растений [19, 22]. Прекращение активного роста растений приводит к увеличению выделения корнями органических веществ, доступных для почвенных микроорганизмов. Биомасса грибов сохранялась на высоком уровне в октябре и ноябре, что может быть следствием наличия доступного органического вещества в виде отмирающих корней растений. Сезонные изменения микробной биомассы в гор. BEL и BT2 более сглажены по сравнению с верхним горизонтом. Значительное количество микробной биомассы в нижележащих горизонтах в течение длительного периода (с июля по ноябрь) может быть обусловлено переносом органического вещества вниз по профилю почвы [29].
Для выявления факторов, определяющих сезонные изменения биомассы грибов и прокариот в почве, проведен корреляционный и регрессионный анализ. Статистически достоверная (p < 0.05) положительная корреляция (табл. 1) наблюдалась между биомассой микроорганизмов и температурой почвы, отрицательная – между биомассой и глубиной. С помощью регрессионного анализа были оценены параметры множественной линейной регрессии, показано значимое влияние факторов глубины отбора и температуры почвенного горизонта на показатели биомассы (табл. 2).
Таблица 1.
Коэффициенты ранговой корреляции Спирмена (полужирным шрифтом выделены значения, достоверные при p < 0.05)
| Параметр | Биомасса грибов | Биомасса прокариот |
|---|---|---|
| Глубина | –0.65 | –0.56 |
| Влажность | –0.17 | –0.20 |
| Температура в день пробоотбора | 0.39 | 0.55 |
Таблица 2.
Коэффициенты множественной линейной регрессии (b* – нестандартизированный, b – стандартизированный) для факторов, определяющих биомассу грибов и прокариот (полужирным шрифтом выделены значения, достоверные при p < 0.05)
| Параметр | b* | Стандартная ошибка | b | Стандартная ошибка | t-критерий (количество степеней свободы 32) |
p-value (уровень значимости) |
|---|---|---|---|---|---|---|
| Биомасса грибов | ||||||
| Глубина | –0.6514 | 0.1274 | –0.0085 | 0.0017 | –5.1137 | 0.00001 |
| Влажность | –0.1548 | 0.1416 | –0.9104 | 0.8325 | –1.0935 | 0.28232 |
| Температура | 0.2891 | 0.1369 | 0.0109 | 0.0052 | 2.1117 | 0.04261 |
| Биомасса прокариот | ||||||
| Глубина | –0.6492 | 0.1120 | –0.0006 | 0.0001 | –5.7990 | 0.00000 |
| Влажность | –0.2375 | 0.1244 | –0.1029 | 0.0539 | –1.9093 | 0.06523 |
| Температура | 0.3837 | 0.1203 | 0.0011 | 0.0003 | 3.1896 | 0.00318 |
ЗАКЛЮЧЕНИЕ
Показатели биомассы микроорганизмов значительно изменяются в течение года во всех генетических горизонтах дерново-подзолистой почвы. Наиболее значимые сезонные изменения микробной биомассы отмечены для верхнего гор. P. В гор. BEL и BT2 сезонная динамика микробного сообщества более сглажена. Минимальную численность и биомассу всех групп микроорганизмов регистрировали в период с ноября по март. Изменения в запасах и структуре микробной биомассы в исследованной почве происходят с задержкой относительно изменений температуры почвы. Температура может влиять на микробную биомассу дерново-подзолистой почвы как прямо, так и опосредованно, через регуляцию роста растений. При этом основным фактором сезонной динамики микробной биомассы, предположительно, является поступление органических веществ в виде корневых экссудатов и отмирающих корней растений.
Полученные результаты необходимо принимать во внимание при сравнении численности микроорганизмов в почвенных образцах, отобранных в разное время. Даже в рамках летнего сезона суммарная численность и биомасса микроорганизмов могут изменяться в несколько раз, а численность отдельных групп, например, актиномицетов, по полученным данным, может меняться на 2 порядка. Необходимо отметить, что данные результаты получены для конкретной залежной дерново-подзолистой почвы. Для других типов почв сезонная динамика микробной биомассы может существенно отличаться.
Список литературы
Agnelli A., Ascher J., Corti G., Ceccherini M.T., Nannipieri P., Pietramellara G. Distribution of microbial communities in a forest soil profile investigated by microbial biomass, soil respiration and DGGE of total and extracellular DNA // Soil Biol. Biochem. 2004. V. 36. № 5. P. 859–868. https://doi.org/10.1016/j.soilbio.2004.02.004
Ананьева Н.Д., Полянская Л.М., Сусьян Е.А., Васенкина И.В., Вирт С., Звягинцев Д.Г. Сравнительная оценка микробной биомассы почв, определяемой методами прямого микроскопирования и субстрат-индуцированного дыхания // Микробиология. 2008. Т. 77. № 3. С. 404–412.
Ананьева Н.Д., Сусьян Е.А., Чернова О.В., Чернов И.Ю., Макарова О.Л. Соотношение грибов и бактерий в биомассе разных типов почв, определяемое селективным ингибированием // Микробиология. 2006. Т. 75. № 6. С. 807–813.
Виноградова Ю.А., Лаптева Е.М., Перминова Е.М., Анисимов С.С., Новаковский А.Б. Микробные сообщества подзолистых почв на вырубках среднетаежных лесов // Известия Самарского научного центра РАН. 2014. Т. 16. № 5. С. 74–80.
Головченко А.В., Полянская Л.М. Сезонная динамика численности и биомассы микроорганизмов по профилю почвы // Почвоведение. 1996. № 10. С. 1227–1233.
Железова А.Д., Кутовая О.В., Дмитренко В.Н., Тхакахова А.К., Хохлов С.Ф. Оценка количества ДНК разных групп микроорганизмов в генетических горизонтах темно-серой почвы // Бюл. Почв. ин-та им. В.В. Докучаева. 2015. № 78. С. 87–98.
Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. М., 1991. 305 с.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Марфенина О.Е., Никитин Д.А., Иванова А.Е. Структура грибной биомассы и разнообразие культивируемых микромицетов в почвах Антарктиды (станции Прогресс и Русская) // Почвоведение. 2016. № 8. С. 991–999. https://doi.org/10.7868/S0032180X16080074
Полянская Л.М., Гейдебрехт В.В., Звягинцев Д.Г. Биомасса грибов в различных типах почв // Почвоведение. 1995. № 5. С. 566–572.
Полянская Л.М., Звягинцев Д.Г. Содержание и структура микробной биомассы как показатель экологического состояния почв // Почвоведение. 2005. № 6. С. 706–714.
Семенов В.М., Когут Б.М. Почвенное органическое вещество. М.: ГЕОС, 2015. 233 с.
Семенов М.В., Манучарова Н.А., Степанов А.Л. Распределение метаболически активных представителей прокариот (архей и бактерий) по профилям чернозема и бурой полупустынной почвы // Почвоведение. 2016. № 2. С. 239–248. https://doi.org/10.7868/S0032180X16020106
Семенов М.В., Стольникова Е.В., Ананьева Н.Д., Иващенко К.В. Структура микробного сообщества почвы катены правобережья р. Оки // Известия РАН. Сер. Биологическая. 2013. № 3. С. 299–308.
Скворцова Е.Б., Рожков В.А., Абросимов К.Н., Романенко К.А., Хохлов С.Ф., Хайдапова Д.Д., Клюева В.В., Юдина А.В. Микротомографический анализ порового пространства целинной дерново-подзолистой почвы // Почвоведение. 2016. № 11. С. 1328–1336. https://doi.org/10.7868/S0032180X16110095
Сусьян Е.А., Ананьева Н.Д., Благодатская Е.В. Разделение грибного и бактериального субстрат-индуцированного дыхания с использованием антибиотиков в почвах разных экосистем // Микробиология. 2005. Т. 74. № 3. С. 1–7.
Хабибуллина Ф.М., Кузнецова Е.Г., Васенева И.З. Микромицеты подзолистых и болотно-подзолистых почв в подзоне средней тайги на северо-востоке Европейской части России // Почвоведение. 2014. № 10. С. 1228–1234. https://doi.org/10.7868/S0032180X14100049
Шеин Е.В., Скворцова Е.Б., Дембовецкий А.В., Абросимов К.Н., Ильин Л.И., Шнырев Н.А. Распределение пор по размерам в суглинистых почвах: сравнение микротомографического и капилляриметрического методов определения // Почвоведение. 2016. № 3. С. 344–354. https://doi.org/10.7868/s0032180x16030096
Aulakh M.S., Wassmann R., Bueno C., Kreuzwieser J., Rennenberg H. Characterization of root exudates at different growth stages of ten rice (Oryza sativa L.) cultivars // Plant Biology. 2001. V. 3. №2. P. 139–148. https://doi.org/10.1055/s-2001-12905
Bending G.D., Turner M.K., Rayns F., Marx M.C., Wood M. Microbial and biochemical soil quality indicators and their potential for differentiating areas under contrasting agricultural management regimes // Soil Biol. Biochem. 2004. V. 36. № 11. P. 1785–1792. https://doi.org/10.1016/j.soilbio.2004.04.035
Bloem J. Microscopic methods for counting bacteria and fungi in soil // Methods Appl. Soil Microbiol. Biochem. 1995. P. 162–173.
Dechassa N., Schenk M.K. Exudation of organic anions by roots of cabbage, carrot, and potato as influenced by environmental factors and plant age // J. Plant Nutrition Soil Sci. 2004. V. 167. № 5. P. 623–629. https://doi.org/10.1002/jpln.200420424
Epron D., Le Dantec V., Dufrene E., Granier A. Seasonal dynamics of soil carbon dioxide efflux and simulated rhizosphere respiration in a beech forest // Tree Physiology. 2001. V. 21. № 2–3. P. 145–152. https://doi.org/10.1093/treephys/21.2-3.145
Franzluebbers A.J., Hons F.M., Zuberer D.A. Tillage and crop effects on seasonal soil carbon and nitrogen dynamics // Soil Sci. Soc. Am. J. 1995. V. 59. № 6. P. 1618–1624. https://doi.org/10.2136/sssaj1995.03615995005900060016x
Habashi H. Effect of forest and soil type on microbial biomass carbon and respiration // Eurasian Soil Sci. 2016. V. 49. № 9. P. 1084–1089. https://doi.org/10.1134/S1064229316090064
Isobe K., Oka H., Watanabe T., Tateno R., Urakawa R., Liang C., Senoo K., Shibata H. High soil microbial activity in the winter season enhances nitrogen cycling in a cool-temperate deciduous forest // Soil Biol. Biochem. 2018. V. 124. P. 90–100. https://doi.org/10.1016/j.soilbio.2018.05.028
Joergensen R.G., Wichern F. Quantitative assessment of the fungal contribution to microbial tissue in soil // Soil Biol. Biochem. 2008. V. 40. № 12. P. 2977–2991. https://doi.org/10.1016/j.soilbio.2008.08.017
Khan K.S., Mack R., Castillo X., Kaiser M., Joergensen R.G. Microbial biomass, fungal and bacterial residues, and their relationships to the soil organic matter C/N/P/S ratios // Geoderma. 2016. V. 271. P. 115–123. https://doi.org/10.1016/j.geoderma.2016.02.019
Kramer S., Marhan S., Haslwimmer H., Ruess L., Kandeler E. Temporal variation in surface and subsoil abundance and function of the soil microbial community in an arable soil // Soil Biol. Biochem. 2013. V. 61. P. 76–85. https://doi.org/10.1016/j.soilbio.2013.02.006
Kuhnert R., Oberkofler V., Peintner U. Fungal Growth and Biomass Development is Boosted by Plants in Snow-Covered Soil // Microb. Ecol. 2012. V. 64. № 1. P. 79–90. https://doi.org/10.1007/s00248-011-0001-y
Leeuwen J.P. van, Djukic V., Bloem J., Lehtinen T., Hemerik L., Ruiter de P.C., Lair G.J. Effects of land use on soil microbial biomass, activity and community structure at different soil depths in the Danube floodplain // Eur. J. Soil Biol. 2017. V. 79. P. 14–20. https://doi.org/10.1016/j.ejsobV.2017.02.001
Lesiv M., Schepaschenko D., Moltchanova E., Bun R., Dürauer M., Prishchepov A.V., Schierhorn F., Estel S., Kuemmerle T., Alcántara C., Kussul N., Shchepashchenko M., Kutovaya O., Martynenko O., Karminov V. et al. Spatial distribution of arable and abandoned land across former Soviet Union countries // Sci. Data. 2018. V. 5. P. 1–12. https://doi.org/10.1038/sdata.2018.56
Semenov M.V., Chernov T.V., Tkhakakhova A.K., Zhelezova A.D., Ivanova E.A., Kolganova T.V., Kutovaya O.V. Distribution of prokaryotic communities throughout the Chernozem profiles under different land uses for over a century // Apll. Soil Ecol. 2018. V. 127. P. 8–18. https://doi.org/10.1016/j.apsoil.2018.03.002
Strickland M.S., Rousk J. Considering fungal: Bacterial dominance in soils - Methods, controls, and ecosystem implications // Soil Biol. Biochem. 2010. V. 42. № 9. P. 1385–1395. https://doi.org/10.1016/j.soilbio.2010.05.007
Vries F.T., Hoffland E., Eekeren van N., Brussaard L., Bloem J. Fungal/bacterial ratios in grasslands with contrasting nitrogen management // Soil Biol. Biochem. 2006. V. 38. № 8. P. 2092–2103. https://doi.org/10.1016/j.soilbio.2006.01.008
Zhang D., Sun X., Zhou G., Yan J., Wang Y., Liu S., Zhou C., Liu J., Tang X., Li J., Zhang Q. Seasonal dynamics of soil CO2 effluxes with responses to environmental factors in lower subtropical forests of China // Sci. China Series D: Earth Sci. 2006. V. 49. № 2. P. 139–149. https://doi.org/10.1007/s11430-006-8139-z
Дополнительные материалы отсутствуют.


