Почвоведение, 2019, № 11, стр. 1322-1338
Состав водорастворимой фракции почв побережья Баренцева моря: органический углерод и азот, низкомолекулярные компоненты
Е. В. Шамрикова a, *, О. С. Кубик a, С. В. Денева a, В. В. Пунегов a
a Институт биологии ФИЦ Коми НЦ УрО РАН
167982 Сыктывкар, Коммунистическая, 28, Россия
* E-mail: shamrik@ib.komisc.ru
Поступила в редакцию 13.11.2018
После доработки 27.02.2019
Принята к публикации 27.03.2019
Аннотация
В водных вытяжках из почв побережья Баренцева моря (Хайпудырская губа) методом высокотемпературного
каталитического окисления с бездисперсионной ИК-регистрацией определено содержание
органического углерода и общего азота, методами газовой хроматографии и хромато-масс-спектрометрии
– содержание низкомолекулярных кислот, углеводов и спиртов. Массовая доля неорганического
углерода $\left( {{\text{НСО}}_{{\text{3}}}^{{\text{-}}}} \right)$ измерена потенциометрическим, неорганического азота (N–${\text{NO}}_{3}^{-},$ N–${\text{NН}}_{4}^{ + }$) – фотометрическим методом. В маршевых почвах (Tidalic Fluvisol (Arenic or Loamic,
Epiprotosalic)) содержание ${\omega }{{({{{\text{C}}}_{{{\text{орг}}}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 0.1–0.8, ${\omega }{{({{{\text{N}}}_{{{\text{орг}}}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 0.01–0.05 г/кг, ${\omega }{{({{{\text{N}}}_{{{\text{орг}}}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 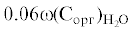 + 0.01, ${{({{\text{C}} \mathord{\left/ {\vphantom {{\text{C}} {\text{N}}}} \right. \kern-0em} {\text{N}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 7–21. Содержание индивидуальных компонентов не превышает 20 мг/кг, доля углеводов
составляет 50–90, кислот – 10–50, спиртов – менее 3%. В торфяной толще тундровых почв
(Cryic Histosol and Histic Cryosol) ${\omega }{{({{{\text{C}}}_{{{\text{орг}}}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 4–10, ${\omega }{{({{{\text{N}}}_{{{\text{орг}}}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ ~ 0.2 г/кг, ${{({{\text{C}} \mathord{\left/ {\vphantom {{\text{C}} {\text{N}}}} \right. \kern-0em} {\text{N}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 25–56. В подстилочно-торфяных горизонтах выражено накопление индивидуальных компонентов
гумуса, как и общего углерода растворимых органических соединений. Общая масса идентифицированных
веществ составляет 200–300 мг/кг, 80–90% приходится на углеводы, 10–20% – кислоты,
0–9% – спирты. Установлена надмерзлотная аккумуляция ${{({{{\text{C}}}_{{{\text{орг}}}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ и (N–${\text{NH}}_{4}^{ + }{{)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$. Обоснована возможность использования отношения органических форм углерода и азота
водных экстрактов из почв, а также содержание низкомолекулярных органических соединений
почв в качестве индикаторов процессов почвообразования на Крайнем Севере.
+ 0.01, ${{({{\text{C}} \mathord{\left/ {\vphantom {{\text{C}} {\text{N}}}} \right. \kern-0em} {\text{N}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 7–21. Содержание индивидуальных компонентов не превышает 20 мг/кг, доля углеводов
составляет 50–90, кислот – 10–50, спиртов – менее 3%. В торфяной толще тундровых почв
(Cryic Histosol and Histic Cryosol) ${\omega }{{({{{\text{C}}}_{{{\text{орг}}}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 4–10, ${\omega }{{({{{\text{N}}}_{{{\text{орг}}}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ ~ 0.2 г/кг, ${{({{\text{C}} \mathord{\left/ {\vphantom {{\text{C}} {\text{N}}}} \right. \kern-0em} {\text{N}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 25–56. В подстилочно-торфяных горизонтах выражено накопление индивидуальных компонентов
гумуса, как и общего углерода растворимых органических соединений. Общая масса идентифицированных
веществ составляет 200–300 мг/кг, 80–90% приходится на углеводы, 10–20% – кислоты,
0–9% – спирты. Установлена надмерзлотная аккумуляция ${{({{{\text{C}}}_{{{\text{орг}}}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ и (N–${\text{NH}}_{4}^{ + }{{)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$. Обоснована возможность использования отношения органических форм углерода и азота
водных экстрактов из почв, а также содержание низкомолекулярных органических соединений
почв в качестве индикаторов процессов почвообразования на Крайнем Севере.
ВВЕДЕНИЕ
Для оценки современного состояния почв важное значение имеет характеристика органического вещества [4, 14]. Согласно [14], система показателей состава гумусовых соединений включает около двадцати параметров, в том числе долю водорастворимых органических соединений ${{({{{\text{C}}}_{{{\text{орг}}}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ от общего органического углерода почв Сорг. По мнению авторов, использование указанных, дополнительных, параметров гумусного состояния позволяет “дифференцировать почвы не только в широтном зонально-географическом ряду, но и в пределах отдельных небольших регионов, а также в пределах почвенного профиля …” [14, с. 925].
Информация о закономерностях накопления мобильных компонентов гумуса почв высоких широт весьма ограниченна. Имеются отдельные сведения о концентрациях растворимых органических соединений в мерзлотных почвах Аляски [54, 55], о. Шпицберген [49, 50], северо-востока Сибири [52]. При этом сведения о содержании водноэкстрагируемого органического азота, а также о составе индивидуальных соединений гумуса почв единичны [50, 54], а для побережья Баренцева моря, как наименее изученного [16], отсутствуют. Вместе с тем своеобразная совокупность факторов педогенеза прибрежных территорий обусловливает чрезвычайно высокую пестроту почвенного и растительного покровов. Здесь встречаются и засоленные маршевые почвы, формирующиеся в условиях периодического затопления приливными и нагонными морскими водами, и почвы водораздельных экосистем, часто подверженные выпадению морских аэрозолей [21].
Цель работы – выявление специфики аккумуляции и распределения водорастворимых форм органического углерода и азота, а также низкомолекулярных органических соединений в почвах под различными типами растительности прибрежной части Баренцева моря.
ОБЪЕКТЫ И МЕТОДЫ
Район исследований располагается в прибрежной части Хайпудырской губы Баренцева моря [21]. Рассмотрены две группы почв, существенно различающиеся по генезису: маршевые почвы, а также зональные, формирующиеся на водораздельных возвышенных территориях. По снижению степени засоленности морскими водами рассматриваемые участки образуют ряд. Участок I (68°19′49.0″ N, 59°31′05.0″ E): марши низкого уровня, моноценоз Carex subspathacea; почва – маршевая примитивная гиттиевая иловато-легкосуглинистая (Tidalic Fluvisol (Loamic, Protosalic)). Участок II (68°19′49.4″ N, 59°31′07.8″ Е): марши среднего уровня, опушечное осоково-злаковое сообщество с галофитами; почва – маршевая дерново-глеевая супесчаная (Tidalic Fluvisol (Arenic, Ochric, Epiprotosalic)). Участок III (68°18′26.5″ N, 59°44′12.8″ E): марши среднего уровня, опушечное разнотравно-злаковое сообщество с галофитами; почва – маршевая примитивная дерново-глеевая тяжелосуглинистая (Tidalic Fluvisol (Loamic, Ochric, Epiprotosalic)). Участок IV (68°20′05.7″ N, 59°33′21.9″ E): плоскополигональный болотный комплекс, подвергается влиянию засоленных вод опосредованно, в результате импульверизации; почва – торфяная олиготрофная мерзлотная (Cryic Folic Histosol). Участок V (68°16′58.9″ N, 59°54′49.5″ E): пушицево-кустарничковая моховая тундра, в наименьшей степени подвержен влиянию засоленных морских вод; почва – торфяно-глеезем криогенно-ожелезненный мерзлотный (Histic Reductaquic Cryosol). Особенности распределения содержания органического и неорганического углерода, общего азота в этих почвах, катионного-анионный состав водных вытяжек из почв, а также связь данных показателей с их количеством в современных растительных группировках приведены ранее [19, 21]. Названия тундровых почв (участки IV и V) даны в соответствии с классификацией и диагностикой почв России [7, 15]. Для классификации маршевых почв использовали принципы ранее опубликованных схем разделения их по разным таксономическим единицам [23, 51]. Приведены наименования почв в соответствии с системой мировой базы почвенных ресурсов (табл. 1) [12].
Содержание углерода органических соединений ${\omega }{{({{{\text{C}}}_{{{\text{орг}}}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ и общего азота ${\omega }{{({{{\text{N}}}_{{{\text{орг}}}}})}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ в водных вытяжках из образцов трех верхних горизонтов почв участков I–IV и полного профиля почвы участка V измеряли методом высокотемпературного каталитического окисления с бездисперсионной ИК-регистрацией на анализаторе общего углерода ТОС VCPH. Относительная погрешность измерения составляет ±δ = 12%. Массовая доля гидрокарбонат иона в водных вытяжках определена потенциометрическим методом согласно ГОСТ 26424-8511. Относительная погрешность измерения равна ±δ = 6.1%. Массовые доли неорганического азота, входящего в состав нитрат-анионов22 и ионов аммония33, измерены фотометрическим методом. Относительная погрешность определения N–${\text{NO}}_{3}^{--}$ в минеральных горизонтах +δ = 20% при массовой доле азота нитратов в почве до 5 мг/кг и 7.5% – выше 5 мг/кг. Относительная погрешность определения N‒${\text{NН}}_{4}^{ + }$ составляет +δ = 15% при содержании в почве до 10 мг/кг, 10% – 10–30 мг/кг и 7.5% – выше 30 мг/кг. Массовую долю N в составе органических соединений вытяжек находили по разности между общим содержанием элемента и его количеством в составе неорганических соединений.
Таблица 1.
Формы соединений углерода в почвах
| Горизонт | Глубина | ${\text{р}}{{{\text{Н}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ | Массовая доля компонента в единице массы почвы | Отношение массовых долей компонентов | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ω(Сорг)/ω(Снеорг) | $\frac{{{\omega }{{{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}}}{{{\omega }{{{\left( {{{{\text{С}}}_{{{\text{неорг}}}}}} \right)}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}}}$ | низкомолекулярные соединения (НС) | ||||||||
| ωкислот | ωспиртов | ωуглеводов | ω(СНС) | $\frac{{{\omega (}{{{\text{С}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}}}{{{\omega (}{{{\text{С}}}_{{{\text{орг}}}}}{\text{)}}}}$ | $\frac{{{\omega (}{{{\text{С}}}_{{{\text{НС}}}}}{\text{)}}}}{{{\omega (}{{{\text{С}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}}}$ | |||||
| см | г/кг | мг/кг | % | |||||||
| Почва I. Маршевая примитивная гиттиевая иловато-легкосуглинистая (Tidalic Fluvisol (Loamic, Protosalic)) | ||||||||||
| W | 0–3 | 7.03 | 7.3/1.8 | 0.33/0.11 | 0.26 | 0.01 | 1.30 | 0.63 | 4.23б | 0.19 |
| AOhC | 3–24 | 5.50 | 41.0/0 | 0.11/0.02 | 0.15 | 0 | 1.59 | 0.70 | 0.27д | 0.64 |
| AOiCg | 24–67 | 6.42 | 10.3/0.4 | 0.11/0.02 | 0.25 | 0 | 1.17 | 0.57 | 1.03в | 0.52 |
| Почва II. Маршевая дерново-глеевая супесчаная (Tidalic Fluvisol (Arenic, Ochric, Epiprotosalic)) | ||||||||||
| AYao | 0–10 | 4.88 | 75.0/0 | 0.70/0 | 1.30 | 0.23 | 16.62 | 7.27 | 0.93г | 1.04 |
| AYh | 10–19 | 5.65 | 13.4/0 | 0.09/0.10 | 0.68 | 0.07 | 1.38 | 0.96 | 0.67г | 1.07 |
| AOiCg | 19–30 | 3.37 | 4.8/0 | 0.23/0 | 1.81 | 0.11 | 1.70 | 1.69 | 4.79б | 0.73 |
| Почва III. Маршевая примитивная дерново-глеевая тяжелосуглинистая (Tidalic Fluvisol (Loamic, Ochric, Epiprotosalic)) | ||||||||||
| AYao | 0–4 | 6.57 | 6.1/ 0 | 0.78/0.10 | 0.22 | 0.01 | 1.55 | 0.71 | 12.79а | 0.09 |
| AYh | 4–11 | 6.91 | 38.0/ 0 | 0.52/0.08 | 1.38 | 0.31 | 15.03 | 6.70 | 1.37в | 1.29 |
| AOhiCg | 11–30 | 6.93 | 26.0/0 | 0.17/0.04 | 0.27 | 0 | 1.21 | 0.60 | 0.65г | 0.35 |
| Почва IV. Торфяная олиготрофная мерзлотная (Cryic Folic Histosol) | ||||||||||
| O | 0–1 | 4.10 | 434.0/0 | 7.35/0 | 19.65 | 15.42 | 145.25 | 71.51 | 1.69в | 0.97 |
| Т1 | 1–16 | 4.15 | 447.0/0 | 3.86/0 | 6.50 | 0.73 | 51.13 | 23.17 | 0.86г | 0.60 |
| Т2 | 16–23 | 4.06 | 444.0/0 | 3.59/0 | 1.49 | 0 | 13.22 | 5.83 | 0.81г | 0.16 |
| Почва V. Торфяно-глеезем криогенно-ожелезненный мерзлотный (Histic Reductaquic Cryosol) | ||||||||||
| O | 0–3 | 4.16 | 403.0/0 | 9.92/0 | 127.73 | 48.65 | 496.54 | 265.74 | 2.46б | 2.68 |
| Т1 | 3–11 | 4.20 | 409.0/0 | 3.99/0 | 12.66 | 3.90 | 107.28 | 49.28 | 0.98г | 1.24 |
| Т2 | 11–13 | 4.54 | 310.0/0 | 4.56/0 | 4.34 | 1.04 | 51.44 | 22.84 | 1.47в | 0.50 |
| Gсfтикc | 13–27 | 5.5 | 3.7/0 | 0.046/0 | – | – | – | – | 1.24в | – |
| G1 | 27–38 | 5.48 | 3.9/0 | 0.030/0 | – | – | – | – | 0.78г | – |
| G2 | 38–55(69) | 5.53 | 7.5/0 | 0.048/0 | – | – | – | – | 0.64г | – |
| G⊥ | 55(69)–76 | 5.92 | 4.6/0 | 0.041/0 | – | – | – | – | 0.88г | – |
Примечание. Сорг/${{{\text{С}}}_{{{\text{неорг,}}\,{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ (${{{{{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}} \mathord{\left/ {\vphantom {{{{{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}} {{{{\left( {{{{\text{С}}}_{{{\text{неорг}}}}}} \right)}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}}}} \right. \kern-0em} {{{{\left( {{{{\text{С}}}_{{{\text{неорг}}}}}} \right)}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}}}$) – органический/неорганический углерод почв (вытяжек из почв), СНС – углерод низкомолекулярных органических соединений, прочерк – не определяли. Содержание растворимых органических веществ: а – сверхвысокое, б – очень высокое, в – высокое, г – выше среднего, д – среднее по [14].
Содержание низкомолекулярных органических соединений ω(СНС) определяли методом газовой хроматографии и хромато-масс-спектрометрии в виде триметилсилированных производных. Относительная погрешность измерения составляет ±δ ≤ 3% [20]. Значения ${\text{p}}{{{\text{H}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ измеряли потенциометрически, погрешность методики 0.1 ед. рН44. Вещественный состав засоленных почв представлен органоминеральными и минеральными субстратами. Водные вытяжки из почв готовили в соотношении 1 : 25 и 1 : 2.5 для органогенных и минеральных горизонтов соответственно. Обработку аналитических данных проводили с использованием пакета программы EXCEL 5.0.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Источники водорастворимых органических веществ почв
Маршевые почвы. В зоне непосредственного влияния моря основным источникам растворимой фракции органического вещества почв является специфичная солеустойчивая флора. Аккумуляция осмолитов – растворимых органических, в том числе N-содержащих, соединений является проявлением адаптации растений к условиям засоленной среды [34, 48]. В водных вытяжках из образцов наземной живой биомассы растений55, составляющих напочвенный покров территории маршей, содержание элементов составляет ${\omega }{{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 32–72, ${\omega (}{{{\text{N}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 4–8 г/кг. Доля неорганического азота ${\omega }{{\left( {{\text{N}}{\kern 1pt} --{\kern 1pt} {\text{NH}}_{{\text{4}}}^{{\text{ + }}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ от общего азота вытяжек не превышает 3%, содержание ${\omega }{{\left( {{\text{N}}{\kern 1pt} --{\kern 1pt} {\text{NO}}_{{\text{3}}}^{ - }} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ ниже предела обнаружения (данные не опубликованы). Отношение водорастворимых органических форм элементов ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 4–18 (рис. 1). Это ниже по сравнению с отношением органических форм элементов собственно биоматериала C/N = 12–21 [19], у которого доля неорганического азота от его общего количества еще меньше, чем в водных вытяжках $\left( {\frac{{{\omega }({{{\text{N}}}_{{{\text{неорг}}}}})}}{{{\omega }({{{\text{N}}}_{{{\text{общ}}}}})}} < 1\% } \right).$ Данный факт свидетельствует о бóльшей экстрагируемости N-замещенных органических соединений по сравнению с безазотистыми [35, 43], возможно, в связи с тем, что наличие NH2-группы повышает растворимость органических соединений в воде.
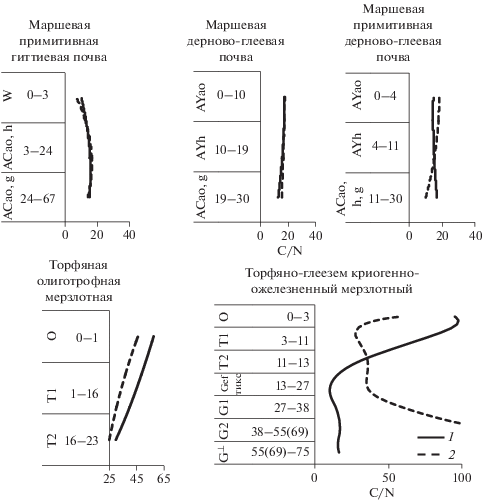
Рис. 1.
Отношение органических форм углерода и азота в наземном биоматериале доминирующих видов растений участков I–V (1), в водных вытяжках из него (2) по [46].
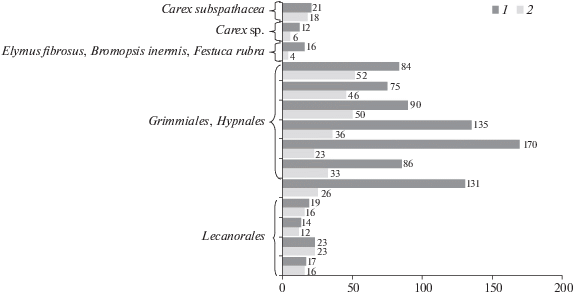
Обогащению всех маршевых почв растворимыми формами углерода и азота в той или иной степени способствует активная жизнедеятельность птиц, поскольку помет состоит из N-содержащих органических соединений, мочевой, щавелевой кислот и их солей. Кроме того, для орнитопочв свойственна повышенная активность микроорганизмов и почвенной фауны [27, 57], которые играют существенную роль в циклах углерода и азота [31, 56].
Появление растворимых N-содержащих органических соединений в почвах обеспечивают не только компоненты континентальной биосферы, но и морская вода. При этом подавляющая их часть возникает в результате разложения биологического материала морских организмов (водорослей, бентоса, рыбы), поступающего как в связи с его выносом на побережье водой [26, 32], так и за счет переноса перелетными птицами [57]. В процессе деструкции органических остатков в морской воде важную роль играют бактерии, при участии которых происходит промежуточный синтез сложных веществ из простых одновременно с распадом крупных молекул. Гетеротрофные организмы, в основном вызывающие процессы разложения, концентрируются близ твердых поверхностей. Таким образом, низкомолекулярные компоненты сохраняются лучше в морской биосфере, чем в земной, а количество растворенного органического вещества в морской воде находится в обратной зависимости от количества взвеси [18]. Среднее значение отношения углерода к азоту взвесей вод Белого моря колеблется в пределах 6–10 [2].
В качестве источника растворимых органических соединений нельзя не учитывать процессы обмена и разложения в осадках, а также продукты жизнедеятельности живых организмов. Морские водоросли выделяют от 3 до 25% ассимилированного углерода, который на 9–38% приходится на долю гликолевой кислоты, 0.2–10% – на долю протеинов. Растворенное органическое вещество морской воды представлено также углеводами, аминокислотами (глутаминовая, лизин, глицин, аспарагиновая кислота в количестве более 1 мг/дм3 каждая), жирными кислотами (насыщенные С16, С20 в количестве от 2 до 20 мкг/дм3), витаминами (тиамин) и др. [18]. Согласно [37], отношение C/N = 4–10, как правило, свидетельствует о морском происхождении органического вещества (водоросли, фитопланктон), а при значении показателя более 12 – земной его природе.
Почвы тундры. Состав водорастворимой фракции органического углерода торфяной олиготрофной мерзлотной (Cryic Folic Histosol) и торфяно-глеезема криогенно-ожелезненного мерзлотного (Histic Reductaquic Cryosol) (особенно их поверхностных горизонтов) в основном определяется поступающими на поверхность остатками мохообразных, опадом кустарничков и немногочисленных травянистых растений, а также условиями их разложения. Для тундровых растительных сообществ высоких широт характерен замедленный и малоемкий биологический круговорот веществ, что является следствием ограниченной продуктивности. Содержание ${{{\text{(}}{{{\text{C}}}_{{{\text{орг}}}}}{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ в биомассе представителей зональной тундровой растительности участков IV и V в 2–3 раза ниже по сравнению с солеустойчивой флорой, а количество общего азота ниже на порядок и более. В частности, массовая доля водорастворимых форм углерода и азота леканоровых лишайников, а также гриммиевых и гипновых мхов (рис. 1), представленных в мохово-лишайниковом и моховом напочвенном покрове участков водораздельных территорий, равна ${\omega (}{{{\text{C}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 10–40, ${\omega (}{{{\text{N}}}_{{{\text{общ}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ ~ ~ ${\omega (}{{{\text{N}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ < 1 г/кг [20]. Неорганический азот наземной фитомассы представлен только ионом аммония в количестве менее 0.6 и 4% от общего азота соответственно собственно биоматериала и водных вытяжек из него, содержание нитратов ниже предела обнаружения (данные не опубликованы).
Соотношение элементов в вытяжках ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = = 30–60, в то время как в биоматериале C/N = 80–140 [19]. Таким образом, для биомассы разных растительных объектов кратность снижения значений ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ вытяжек из биоматериала к C/N биомассы различна. У мхов и лишайников, как и у представителей солеустойчивой флоры [8], C/N биоматериала в 1.5–2.5 раза больше по сравнению с ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}},$ в то время как у леканоровых лишайников частное достигает шести [20].
Общим для обеих групп почв является то, что источником связанного азота является фиксированный аммоний и/или азот протеинов и близких к ним N-содержащих соединений, адсорбированных глинистыми минералами и гидроксидами Fe [24, 29, 36]. Исследованиями [55] показано, что для фракции почв с размером частиц 0.42–2 мкм, удерживающей наибольшее количество полипептидов и протеинов, отношение C/N = 18–27, тогда как для почвенных образцов этот показатель несколько ниже – (17–23). Существует мнение, что значительную конкуренцию сорбции аминокислот (как и других низкомолекулярных органических соединений) почвенной матрицей составляет микробное поглощение [30].
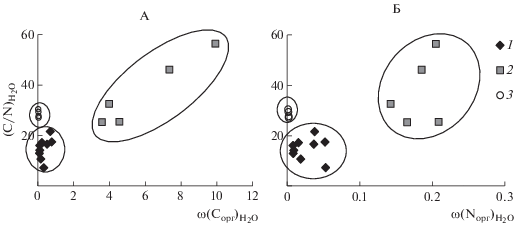
В изучаемых маршевых и тундровых почвах доля неорганического азота от общего его содержания не превышает 3%. В засоленных почвах ω(N–${\text{NН}}_{{\text{4}}}^{{\text{ + }}}$)КСl = 4–18 мг/кг, азот в составе нитрат-ионов присутствует только в почвах первых двух участков в количестве 0.4–4.6 мг/кг (табл. 2). Содержание органического азота почв (выборка не включает погребенные горизонты маршевых примитивных почв участков I и III) коррелирует с массовой долей илистой фракции (r = 0.67, табл. 3). Однако более тесная связь была ранее [19] установлена при учете обеих (и органических и неорганических) форм элемента (r = 0.75, рис. 2, А).
Таблица 2.
Формы соединений азота в почвах
| Горизонт | Массовая доля компонента в единице массы почвы | Отношение массовых долей компонентов | ||||
|---|---|---|---|---|---|---|
| общий азот | неорганический азот | |||||
| ω(Noбщ) | ${\omega (}{{{\text{N}}}_{{{\text{общ}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ | ω(N–${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$)KCl | ω(N–${\text{NО}}_{3}^{ - }$)KCl | ${\omega }{{\left( {{\text{N--NH}}_{{\text{4}}}^{{\text{ + }}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ | $\frac{{{\omega (}{{{\text{N}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}}}{{{\omega (}{{{\text{N}}}_{{{\text{орг}}}}}{\text{)}}}}$ | |
| г/кг | мг/кг | % | ||||
| Маршевая примитивная гиттиевая иловато-легкосуглинистая | ||||||
| W | 0.89 | 0.06 | 11.2 | 4.59 | 7.0 | 6.1 |
| AOhC | 3.30 | 0.01 | 4.3 | 0.75 | 2.0 | 0.2 |
| AOiCg | 0.79 | 0.01 | 4.3 | 0 | 0.94 | 1.2 |
| AYao | 5.00 | 0.05 | 18.0 | 0.42 | 12.2 | 0.8 |
| AYh | 0.95 | 0.01 | 4.5 | 0 | 1.89 | 0.9 |
| AOiCg | 0.43 | 0.02 | 8.3 | 0 | 4.4 | 3.7 |
| Маршевая дерново-глеевая супесчаная | ||||||
| AYao | 0.49 | 0.06 | 16.6 | 0 | 7.9 | 11.0 |
| AYh | 3.00 | 0.04 | 12.1 | 0 | 3.4 | 1.2 |
| AOhiCg | 1.80 | 0.02 | 7.5 | 0 | 1.42 | 1.0 |
| Торфяная олиготрофная мерзлотная | ||||||
| O | 7.90 | 0.22 | 48.0 | 0 | 34.4 | 0.3 |
| Т1 | 14.00 | – | 77.0 | 0 | 40.3 | 0.0 |
| Т2 | 18.00 | 0.22 | 79.0 | 0 | 54.6 | 0.9 |
| Торфяно-глеезем криогенно-ожелезненный мерзлотный | ||||||
| O | 5.00 | 0.25 | 51.0 | 0 | 45.0 | 4.1 |
| Т1 | 6.50 | 0.17 | 48.0 | 0 | 27.3 | 2.2 |
| Т2 | 12.50 | 0.26 | 64.0 | 0 | 51.0 | 1.7 |
| Gсfтикc | 0.34 | 0.0020 | 5.3 | 0 | 0.95 | 0.3 |
| G1 | 0.35 | 0.0011 | 2.8 | 0 | 0.35 | 0.2 |
| G2 | 0.50 | 0.0021 | 4.5 | 0 | 3.32 | 0.0 |
| G│ | 0.33 | 0.0016 | 4.0 | 0 | 1.06 | 0.2 |
Таблица 3.
Уравнения взаимных связей отдельных свойств почв
| Пары свойств | Объекты исследований | Водные вытяжки из почв | Почвы |
|---|---|---|---|
| ωИФ* и ω(Nобщ) | Маршевые почвы (за исключением погребенных горизонтов) | Отсутствует | ωИФ = 0.06ω(Nобщ) – 0.06 r = 0.75 |
| Минеральные горизонты торфяно-глеезема | ωИФ = 0.06ω(Nобщ) – 0.50 r = 0.97 |
||
| ωИФ* и ω(Nорг) | Маршевые почвы (за исключением погребенных горизонтов) | Отсутствует | ωИФ = 0.06ω(Nорг) + 0.02 r = 0.67 |
| ω(Nорг) и ω(Сорг) | Маршевые почвы (за исключением погребенных горизонтов) | ${\omega (}{{{\text{N}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ =  + 0.01 + 0.01r = 0.67 |
ω(Nорг) = 0.07ω(Сорг) + 0.12 r = 0.99 |
| Минеральные горизонты торфяно-глеезема | Отсутствует | ω(Nорг) = 0.04ω(Сорг) + 0.17 r = 0.95 |
Рис. 2.
Взаимосвязь массовых долей илистой фракции и общего азота в почвах (А) и их водных вытяжках (Б): 1 – погребенные горизонты: ACao,h маршевой примитивной гиттиевой почвы и AYh маршевой примитивной дерново-глеевой; 2 – горизонты маршевых почв за исключением погребенных горизонтов, 3 – минеральные горизонты торфяно-глеезема.

Взаимозависимость массовой доли фракции ила и содержания водоэкстрагируемого (как общего, так и органического) азота почв отсутствует (рис. 2, Б). Вероятно, N-содержащие компоненты (как органической, так и неорганической природы), адсорбированные тонкодисперсными частицами почв, достаточно прочно удерживаются твердой фазой и количественно дистиллированной водой не экстрагируются. В минеральных горизонтах торфяно-глеезема ω(N–${\text{NН}}_{{\text{4}}}^{{\text{ + }}}$)КСl < 5.3 мг/кг, связь с содержанием илистой фракции отсутствует.
Таким образом, переход N-органических соединений в водную вытяжку из почв определяется как минимум двумя факторами, имеющими разнонаправленные эффекты. С одной стороны, большая растворимость N-замещенных органических соединений по сравнению с соответствующими незамещенными обеспечивает C/N > ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}{\text{.}}$ Это явление может проявляться во всех горизонтах почв, содержащих органический углерод и азот, но в большей степени, очевидно, выражено в органогенных. С другой стороны, в минеральных горизонтах почв фиксация илистой фракцией N‑содержащих соединений, в том числе N-органических (в отличие от безазотистых) препятствует их переходу в вытяжку, что определяет обратную зависимость C/N < ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}{\text{.}}$ Следовательно, в минеральных горизонтах соотносительность C/N и ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ зависит от содержания и природы соединений азота, а также гранулометрического и минералогического состава почв. Более подробно влияние некоторых из названных факторов рассмотрим ниже.
Углерод и азот водных вытяжек из почв
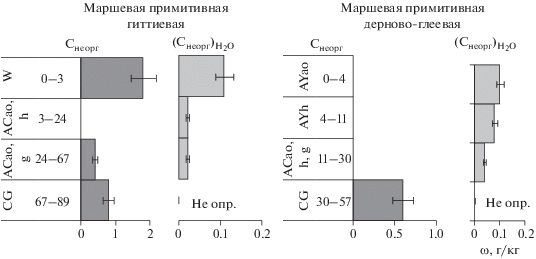
Маршевые почвы. Углерод в составе гидрокарбонат-иона присутствует только в водных вытяжках из маршевых почв ${\omega }{{\left( {{{{\text{С}}}_{{{\text{неорг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 0.02–0.11 г/кг, что составляет менее 10% от общего неорганического углерода почв (рис. 3, [19]). Наибольшее, сопоставимое, содержание ${\text{HCO}}_{3}^{--}$ отмечено в маршевых примитивных почвах участков I и III, максимальные значения ${\omega }{{\left( {{{{\text{С}}}_{{{\text{неорг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ свойственны поверхностным горизонтам. Главным источником растворимого неорганического углерода этих почв, вероятно, является морская вода. Почва маршей низкого уровня затапливается в каждый прилив, почва маршей среднего уровня – нагонными водами р. Море-ю, несущей во время приливов большой объем морской воды вглубь материка. При солености, равной 35‰, близкой к солености Баренцева моря [6], содержание гидрокарбонат-иона в морской воде составляет 0.14 г/кг (или ${\omega }{{\left( {{{{\text{С}}}_{{{\text{неорг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 0.03 г/кг), что сопоставимо с данными по водным вытяжкам исследуемых почв. Это объясняется тем, что водные объекты с прилегающей к ним литосферой представляют собой целостную систему, в которой осуществляется непрерывный обмен материей, поэтому жидкая фаза почвы находится в некотором динамическом равновесии с морской водой. Источником неорганического углерода в этих двух почвах также, вероятно, являются карбонатные отложения, приносимые морем [19]. В бескарбонатной маршевой дерново-глеевой почве участка II, формирующейся на маршах среднего уровня и затапливаемой лишь во время сизигийных приливов, штормов и нагонов вод, а также в моменты массовых разливов в связи с таянием снега, количество гидрокарбонат-иона в основном ниже предела обнаружения.
Рис. 3.
Содержания (ω) углерода неорганических соединений в почвах Снеорг [19] и в водных вытяжках из них ${{{\text{(}}{{{\text{С}}}_{{{\text{неорг}}}}}{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}{\text{.}}$ Здесь и далее планки погрешности отображают относительную погрешность измерения физических величин.
Водноэкстрагируемый азот маршевых почв в большей мере представлен N-органическими соединениями и лишь на 7–25% ${\omega (}{{{\text{N}}}_{{{\text{общ}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ находится в форме ${\text{NH}}_{{\text{4}}}^{{\text{ + }}}{\text{.}}$ Содержание N в виде нитрат-иона в водных вытяжках из почв ниже предела обнаружения. Сведения о растворимых формах азота в почвах арктических маршей отсутствуют в литературе. Однако полученные нами данные близки к выводам [52], согласно которым азот водных вытяжек из сезонно-талых минеральных горизонтов глееземов северо-востока Сибири (р. Колыма) на 92–95% от ${\omega (}{{{\text{N}}}_{{{\text{общ}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ представлен органическими соединениями, в многолетнемерзлой минеральной толще доля органического азота снижается до 80%. Количества органических форм элементов в вытяжках соответствуют диапазонам ${\omega }{{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 0.1–0.8 и ${\omega (}{{{\text{N}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = = 0.01–0.05 г/кг. Эти два показателя взаимосвязаны так же, как коррелируют между собой и органический углерод, и органический азот почв (r = 0.67 и 0.99). Отношение элементов, измеренных в водных вытяжках засоленных почв, составляет ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 7–21 (рис. 5), что близко к аналогичным показателям для водных вытяжек из образцов наземной живой биомассы растений, составляющих напочвенный покров маршевых почв. В пределах всех трех участков наблюдаются признаки жизнедеятельности птиц: помет, перья, поеди, что значительно влияет на круговорот C и N. По данным [49, 50] C/N водной фракции орнитопочв о. Шпицберген, развивающихся под тундровой растительностью, весьма низкó – ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ ~ 13. Подобные результаты, согласно [41, 44, 47], проводившим комплексные почвенно-геоботанические исследования приливно-отливных зон, являются примером “экологической преемственности свойств почв”.
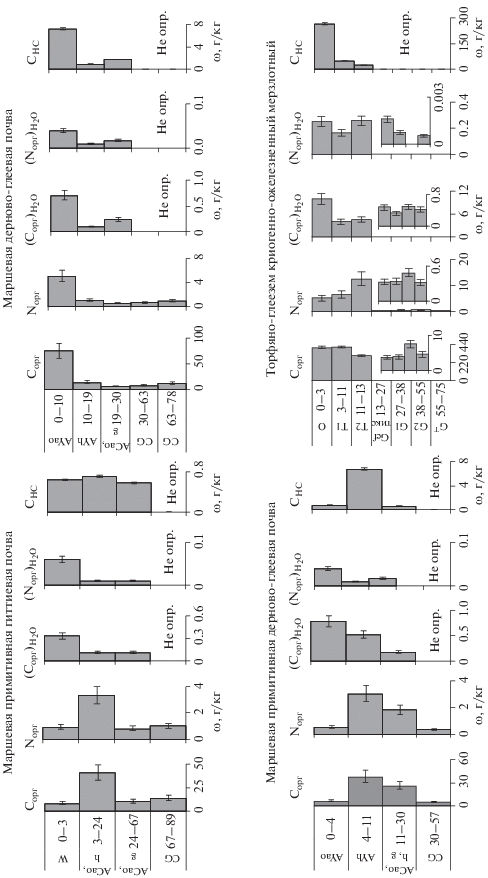
Рис. 4.
Содержания (ω) органического С и N в почвах и вытяжках из них: Сорг, Nорг [19], ${{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ и ${{{\text{(}}{{{\text{N}}}_{{{\text{общ}}}}}{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ (г/кг), углерод низкомолекулярных органических соединений СНС (мг/кг).
По данным [14] обогащение гумуса маршевых почв азотом оценивается как низкое и очень низкое (C/N почв соответственно 11–14 и >14). Отмечена близость значений C/N почв и водных вытяжек из них (рис. 5), в то время как для фитомассы растений засоленных местообитаний отмечено (1.5–3)-кратное превышение C/N фитомассы над C/N ее водных экстрактов (рис. 1). Очевидно, что одной из причин сближения значений C/N и ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ в маршевых почвах является фиксации N-содержащих органических соединений минеральными частицами, препятствующая переходу соединений азота в жидкую фазу.
Близкие результаты – C/N почв на 2–6 ед. больше, чем C/N вытяжек из них – получены для четырех образцов гумусовых горизонтов почв разного генезиса (ω(Сорг) = 19–63, ω(Nорг) = 2–5.3 г/кг, ${\text{р}}{{{\text{Н}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ 4.2–7.0, сведения о содержании илистой фракции отсутствуют) [10]. Лабильные формы углерода и азота были определены при экстракции раствором сульфата калия с молярными концентрациями 0.05 и 0.5 моль/дм3. Вероятно, в данном исследовании переход N-содержащих соединений также сдерживают минеральные компоненты почв. Кроме того, на экстракционные процессы может влиять и высокая ионная сила растворов I. Авторы [10] указывают на повышении растворимости органического углерода почв при увеличении I, хотя в литературе встречаются противоречивые сведения о степени экстракции органических соединений (в частности, белков) в зависимости от природы и концентрации электролита.
Всем поверхностным горизонтам маршевых почв свойственно максимальное значение растворимых органического форм углерода и азота в связи с поступлением свежего органического материала земного и морского происхождения. Минимальное содержание характерно для почвы, наиболее близко расположенной к морю. Как и в случае с неорганическим углеродом, оно сопоставимо с содержанием растворенного органического вещества в водах окраинных морей Российской Арктики (3.5–6 мг/дм3 [2]) и лишь в поверхностном горизонте незначительно превышает это количество. Значения органического углерода вытяжек из образцов поверхностных горизонтов двух других почв близки. Снижение ${{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ с глубиной в маршевых примитивных почвах участков I и III несущественно (в 3–4 раза), тогда как в маршевой дерново-глеевой почве участка II – в 35 раз. Особенностью почвенных профилей первого и третьего участков является наличие на глубине 3–30 см погребенных горизонтов с максимальным количеством слаборазложившихся торфяных слоев, переплетенных многочисленными корнями, чередующихся с заиленными тонкими прослойками. Ниже по профилю количество торфяной составляющей снова уменьшается в пользу минеральной. Подобное строение профиля связано с регулярной аккумуляцией на поверхности свежего минерального материала, приносимого непосредственно морем (участок I), либо крупной водной артерией р. Море-ю (участок III). Это приводит к постоянному омолаживанию субстрата, вызывает рост почвенного профиля вверх и погребение ранее сформировавшихся горизонтов. В результате часть площади первого и в меньшей степени третьего участков лишена растительного покрова. Поступление свежих растительных остатков на поверхность почв и разложение их in situ ограничено, что является важнейшей причиной низкого содержания углерода и азота органических соединений в поверхностных горизонтах участков I и III (ω(Сорг) ~ 7, ω(Nорг) ~ 0.9 г/кг). Существенно более высокие значения данных показателей (~40 и 3.3 г/кг соответственно) отмечены в подповерхностных горизонтах почв. Таким образом, аккумулированное грубое органическое вещество в виде осоково-злаковых растительных остатков и водорослевых выбросов в подповерхностных слоях является существенным источником водорастворимых органических соединений, что нивелирует разницу значений этого показателя в поверхностной и подповерхностной толще участков I и III.
Иная картина распределения значений ${{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ наблюдается в почвенном профиле участка II, затапливаемого, как указывалось выше, лишь периодически. Специфика почвообразования способствуют морфологической сохранности поверхностного гумусово-аккумулятивного горизонта данной почвы с соответствующими показателями ω(Сорг) = 75, ω(Nорг) = 5 г/кг при закономерном снижении их содержания с глубиной. Менее выраженные седиментационные явления определяют столь резкое изменение содержания растворимых органических соединений в пределах трех верхних горизонтов профиля почвы данного участка.
Массовая доля углерода водорастворимых органических соединений от общего органического углерода почв в пределах трех верхних слоев различается в 16–20 раз и равна 0.2–13%, что, согласно [14], соответствуют пяти градациям от “сверхвысокого” до “среднего”. В профилях с глубиной показатель имеет тенденцию к снижению, что свидетельствует о различной экстрагируемости водой органических соединений из твердой фазы. Наименьшей растворимостью характеризуются органические соединения погребенного горизонта почвы участка I.
Закономерности изменения доли растворимого органического азота от его общего количества $\frac{{{\omega }{{{({{{\text{N}}}_{{{\text{орг}}}}}{\text{)}}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}}}{{{\omega (}{{{\text{N}}}_{{{\text{орг}}}}}{\text{)}}}}$ в маршевых почвах аналогичны изменению в профилях $\frac{{{\omega }{{{({{{\text{С}}}_{{{\text{орг}}}}}{\text{)}}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}}}{{{\omega (}{{{\text{С}}}_{{{\text{орг}}}}}{\text{)}}}},$ поскольку содержание азота и в исходных образцах, и в водорастворимой фракции коррелирует с соответствующими показателями по органическому углероду. Диапазон колебаний также значителен $\frac{{{\omega }{{{({{{\text{N}}}_{{{\text{орг}}}}}{\text{)}}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}}}{{{\omega (}{{{\text{N}}}_{{{\text{орг}}}}}{\text{)}}}}$ = 0.2–11%.
Полноте водной экстракции органических веществ, особенно из поверхностных горизонтов маршевых почв, возможно, препятствует регулярное воздействие солевых морских растворов, определяющее засоление почв. Во всех разрезах максимальное значение удельной электропроводности æ присуще водным вытяжкам (почва : вода = 1 : 25) из образцов поверхностных горизонтов. Удельная электропроводность водной вытяжки из почвы участка I составляет æ = 2.6–5.3, участка II – 1.8–4.4, участка III – 1.3–2.1, участков IV и V – 0.05–0.1 дСм/м. Ранее была выявлена тенденция к уменьшению степени экстракции углерода органических соединений из почв при повышении ионной силы раствора, в среднем отношение $\frac{{{\omega (}{{{\text{С}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{\text{солев}}}}}}}{{{\omega (}{{{\text{С}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}$ = 0.9. В качестве модельного использован солевой раствор с ионной силой I = 1 моль/дм3 [20]. Данный показатель для морской воды в среднем составляет I ~ ~ 0.7 моль/дм3 [18].
Почвы тундры. В органогенной толще торфяной олиготрофной мерзлотной (Cryic Folic Histosol) и торфяно-глеезема криогенно-ожелезненного мерзлотного (Histic Reductaquic Cryosol) содержание водорастворимого органического углерода близко к данным, полученным для торфяных почв южной тундры и тайги [46] ${\omega }{{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 4–10, ${\omega (}{{{\text{N}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ ~ 0.2 г/кг. Водноэкстрагируемый неорганический азот представлен только ионом аммония в количестве 30–50 г/кг, что соответствует 15–20% от общего азота вытяжек. Отношения органических форм элементов в водорастворимой фракции торфяных горизонтов почв составляют ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 25–56. Близкие результаты получены для поверхностных горизонтов почв Швеции [43], а также почв о. Шпицберген, развивающихся под лишайниково-вересковой тундровой растительностью и полигинональными тундровыми сообществами – соответственно равны 17 и 65 [49, 50]. Эти значения, как было показано выше, совпадают с аналогичными характеристиками водных вытяжек из наземного биоматериала представителей тундровой растительности. Собственно образцы торфяных горизонтов почв (рис. 5), как и биоматериал доминирующих видов растений (вероятно, по той же причине), характеризуются более высоким отношением элементов C/N = 30–95 по сравнению с соответствующими значениями ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ водных вытяжек и почв, и биомассы растений.
В водных экстрактах из минеральных горизонтов торфяно-глеезема ${\omega }{{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 30–50 мг/кг, ${\omega }{{\left( {{{{\text{N}}}_{{{\text{орг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ < 1 мг/кг, ${\omega }{{\left( {{\text{NH}}_{4}^{ + }} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 0.4–3.3 мг/кг (30–100 % общего азота вытяжек), содержание ${\text{N - NO}}_{{\text{3}}}^{{\text{--}}}$ ниже предела обнаружения (табл. 2). Содержание растворимых органических форм углерода и азота на два-три порядка ниже, чем в органогенных, причем эти показатели не коррелируют между собой. Для минеральных горизонтов значения C/N = 13–18, что существенно ниже по сравнению с ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ > 46 (рис. 5). Это совпадает с выводами, сделанными в отношении минеральной толщи глееземов [52]. Вероятно, растворению в воде N-содержащих органических соединений минеральных горизонтов препятствует их фиксация илистыми частицами, о чем упоминалось выше.
Рассмотрим закономерности накопления растворимых форм элементов в пределах почвенных профилей. Для обеих зональных почв подтверждается закономерность, выявленная ранее для целинных почв тайги и южной тундры [46] – поверхностные горизонты имеют максимальное содержание органического углерода водных вытяжек, с глубиной этот показатель снижается. В среднем отмеченное двукратное уменьшение ${{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ в пределах торфяной толщи может быть связано с тем, что группа водорастворимых органических соединений в большей степени присутствуют на ранних стадиях разложения растительных остатков [40], которые далее разлагаются, либо трансформируются в специфические гумусовые вещества [13, 40, 42]. Дискуссионный вопрос о природе гумусовых соединений – гетерополимеры или супрамолекулярные ансамбли – остается за пределами данной работы. Значения ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ в пределах трех верхних горизонтов торфяных почв, так же как и C/N, с глубиной существенно снижается. Согласно [14], обе изучаемые почвы, как имеющие значения C/N > 14, относятся разряду с очень низкой обогащенностью гумуса азотом.
В минеральной толще торфяно-глеезема над мерзлотой отмечена аккумуляция водорастворимых органического углерода (1.2–1.9 раз) и аммонийного азота (3–10 раз) по сравнению с выше- и нижележащим горизонтами, также как и концентрирование (1.5–1.9 раз) Cорг и Nобщ почв [19] (рис. 4). На накопление органического углерода над мерзлотой указывают и темно-бурые пятна. Надмерзлотная толща среди минеральных горизонтов характеризуется минимальной обогащенностью органического вещества азотом. В этой части профиля максимальны значения как C/N = 18 (при разбросе 13–18), так (${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$, причем ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ → ∞ поскольку ${\omega }{{\left( {{{{\text{N}}}_{{{\text{орг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ → 0. В трех других глеевых горизонтах ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 50–90.
Таким образом, в минеральной части профиля торфяно-глеезема происходит естественное фракционирование соединений органического углерода и азота. Во-первых, в водные вытяжки в большей степени переходят безазотистые органические соединения в связи с закреплением N-содержащих компонентов минеральной матрицей (это явление характерно для всех слоев минеральной толщи). Во-вторых, в толще над мерзлотой аккумулируется аммонийный азот. Среди возможных причин накопления – наличие мерзлотного барьера, препятствующего его нисходящей миграции.
Допустимо предположить, что надмерзлотная аккумуляция безазотистого органического углерода, в том числе растворимого, осуществляется под влиянием процессов, сущность которых раскрыта в ходе проведения модельных экспериментов по воздействию отрицательных температур на состав гумусовых веществ почв. Согласно [1], промораживание вызывает криогенное концентрирование подвижных органических и минеральных компонентов у промерзающей поверхности, что способствует коагуляции этих веществ, дегидратации и закреплению на месте образования в ходе полного промерзания минеральной массы. Подтягиванию влаги (и растворенных веществ) из надмерзлотных горизонтов к корнеобитаемому слою препятствует и образование в почве слоев льда (шлиров), приводящее к разрыву капилляров. Изменения, вызванные криогенными процессами, являются устойчивыми, что обусловливает усиление их при повторном развитии тех же процессов [1]. В пользу подобного механизма также свидетельствуют результаты модельных опытов по промораживанию [22]. На примере минеральных горизонтов темно-каштановых почв зафиксировано, что воздействие отрицательных температур вызывает достоверное снижение количества водорастворимой фракции органического углерода при одновременном увеличении щелочногидролизуемых форм гумуса. О “мерзлотной ретинизации гумуса” (вмывание и накопление бесцветного органического вещества) говорится в ряде работ [11].
Наряду с процессами пропитывания и ретинизации гумуса, нет оснований исключать и вклад криотурбационных процессов, определяющих “затаскивание” малоподвижного гумуса из верхних горизонтов вглубь профиля [5, 39]. В пользу этого аргумента выступает меньшая экстрагируемость дистиллированной водой органического углерода – $\frac{{{\omega (}{{{\text{С}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}}}{{{\omega (}{{{\text{С}}}_{{{\text{орг}}}}}{\text{)}}}}$ из надмерзлотного слоя по сравнению с мерзлотным. Для понимания механизмов распределения и накопления водорастворимых органических, в том числе N-содержащих, веществ в мерзлотных почвах необходимы дополнительные исследования.
В тундровых почвах доля растворимой фракции органического углерода от его общего содержания колеблется от 0.8 до 3% (от высокого до выше среднего), что согласуется с результатами по арктическим почвам Аляски и Западной Сибири [52, 54, 55]. Доля растворимого органического азота от Nорг в торфяных горизонтах составляет 1–5%.
Таким образом, вслед за [29, 44], наши исследования показывают, что информативным показателем, характеризующим состав органического вещества почв и диагностирующим почвенные процессы, является отношение органических форм углерода и азота водных вытяжек из почв. Данный показатель отражает не только особенности состава растворимых органических соединений почв, связанные со спецификой напочвенного покрова [43, 54], но и различие природы органического вещества, приуроченного к разным частям профиля (рис. 6). Аргументом в пользу его использования выступает также относительная простота его определения. Особенно актуальным и чувствительным этот показатель может быть при исследовании почв высоких широт в связи с проблемой потепления климата [44]. Рост температуры в Арктике может вызвать усиление гумификации, способствовать большему образованию мобильных органических соединений (в том числе N-содержащих) за счет увеличения первичной продукции, оттаивания вечномерзлых грунтов [53, 54], а также усиления микробиологической активности почв [25, 28].
Низкомолекулярные органические соединения
Известно, что содержание растворимой фракции почвенного органического вещества подвержено существенным сезонным колебаниям. В этой связи для диагностики почвенных процессов в дополнение к интегральной характеристике содержания ${\omega (}{{{\text{C}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ важно получать сведениями по химическому составу отдельных индивидуальных компонентов гумуса [35, 54].
Абсолютное содержание низкомолекулярных органических соединений (спиртов, углеводов и кислот) в почвах, испытывающих влияние морских вод, не превышает 20, в зональных почвах – колеблется от 200 (участок IV) до 300 мг/кг (участок V). Данные сопоставимы с торфянистыми почвами тайги и южной тундры [20]. Доля углерода идентифицированных соединений в основном не превышает 3% от углерода водных вытяжек.
В почвах тундры отмечено накопление индивидуальных органических соединений, как и общего углерода растворимых органических соединений, в поверхностных горизонтах. В маршевых почвах в пределах трех верхних горизонтов содержание низкомолекулярных соединений (НС) изменяется разнонаправленно. Последовательное снижение количества новообразованных соединений, так же как содержания органического углерода и в почве, и в водорастворимой фракции, отмечено в профиле почвы участка II, менее других испытывающей влияние водных объектов. Регулярное перемешивание и погребение материала, вымывание как органических остатков, так и наиболее мобильных органических соединений (в первую очередь низкомолекулярных) определяют иную последовательность содержания ω(СНС) в трех верхних горизонтах маршевых примитивных почв участков I и III. Погребенные подповерхностные горизонты имеют максимум содержания НС, что аналогично распределению общего углерода в почвах, но не соответствует распределению общего содержания элемента в водорастворимой фракции. Особенно четко это явление выражено в почве участка III. Вероятно, идентифицированные соединения (С2–С12), как наиболее мобильные, в первую очередь выносятся водой из поверхностных горизонтов. Их аккумуляция в подповерхностной толще может быть дополнительно связана с захоронением органических остатков. Менее выраженный максимум НС в погребенной толще почвы I, видимо, определяется убылью низкомолекулярных соединений в результате непрерывного взаимодействия с морской водой.
Дополнительной причиной низкого содержания НС в поверхностных горизонтах почв участков I и III может быть выраженное снижение степени их экстракции при увеличении ионной силой раствора, причем более существенное, чем в случае с общим углеродом вытяжек $\frac{{{\omega (}{{{\text{С}}}_{{{\text{HС}}}}}{{{\text{)}}}_{{{\text{солев}}}}}}}{{{\omega (}{{{\text{С}}}_{{{\text{H}}{{{\text{С}}}_{ - }}}}}{{{\text{)}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}$ = 0.5 [20]. Перечень низкомолекулярных кислот и углеводов в солевых вытяжках из почв меньше, чем в водной, причем в солевые растворы переходят мажорные водорастворимые представители своих классов.
Содержание разных классов низкомолекулярных органических соединений исследуемых объектов различается существенно. Поверхностные горизонты торфяных почв – это материал, состоящий из полуразложившихся растительных остатков (напочвенный покров данных участков сплошной, до 95% представлен мхами [21]). Кроме того, именно в поверхностные горизонты в первую очередь поступают корневые выделения и растворимые метаболиты, смываемые атмосферными осадками с живых растений напочвенного покрова. В этой связи горизонты О почв тундры, как по относительному содержанию отдельных классов индивидуальных соединений в общей их массе, так и по доминирующим индивидуальным компонентам сходны с составом растворимых метаболитов наземной биомассы мхов, идентифицированных методом ГХ-МС [20]. В частности, около 80% от общей массы соединений в подстилочно-торфяном гор. О обеих почв участков IV и V приходится на углеводы, 0–9% – спирты, 10–20% – кислоты. Среди кислот в поверхностных горизонтах, как и у мхов, преобладают яблочная, а также триоксимасляная кислоты, суммарный вклад которых достигает 90%. Вглубь профиля доля кислот и спиртов снижается в пользу углеводов. Отмечено и изменение состава кислот – при снижении доли яблочной возрастает вклад (до 30–40%) молочной и гликолевой кислот. В незначительных количествах также диагностированы валериановая, янтарная, оксимасляная, глицериновая, рибоновая, адипиновая, галактоновая кислоты.
В засоленных маршевых почвах доля кислот в общей массе идентифицированных соединений выше (10–50%) по сравнению с почвами тундры. Это также согласуется с ранее полученными результатами по изучению состава растворимых соединений наземной биомассы растений засоленных местообитаний, а также растительного материала галофитов Carex subspathacea и Triglochin maritimum. Особенностью состава водорастворимых метаболитов солеустойчивых растений по сравнению упомянутыми выше видами мхов является повышенное содержание низкомолекулярных органических кислот. К доминирующим соединениям кислой природы в засоленных почвах относятся молочная, гликолевая и валерьяновая кислоты [8]. Вклад спиртов незначителен (менее 3%).
Всем изучаемым почвам характерно присутствие восьми растворимых углеводов: арабинозы, рибозы (С5), ксилозы, глюкозы, галактозы, маннозы (С6), сахарозы и туранозы (С12). Сумма масс арабинозы и глюкозы на 50–100% определяет общую массу соединений этой группы. Считается, что содержание углеводов в почвах является индикатором происхождения почвенного органического вещества и может свидетельствовать об эволюции экосистем. Пентозы не синтезируются микроорганизмами, в то время как значительное количество С5-углеводов содержится в тканях растений. Предложен коэффициент k, рассчитываемый по отношению сумм масс С6-углеводов галактозы и маннозы к С5-углеводам ксилозе и арабинозе, экстрагированных из почв этиловым спиртом. Значения k < 0.5 свидетельствует о растительной природе углеводов, тогда как k > 2 – микробной. Кроме того, k, рассчитанный для органогенных горизонтов, имеет более высокие значения по сравнению с k биоматериала (хвоя сосны), образующего эти подстилки. Данный результат указывает, что определенным источником углеводов подстилок являются микроорганизмы [33, 39, 45]. Полученные нами данные в целом подтверждают данную концепцию. Коэффициент, рассчитанный по содержанию четырех упомянутых углеводов для мхов, равен k = 0.2–0.4, для лишайников в основном k < 1.8 [20]. Несколько более высокие значения k последних, вероятно, связаны с тем, что лишайники – это симбиотические организмы. В поверхностных горизонтах зональных почв данный коэффициент равен k = 1.5–3.5, что выше по сравнению с k мхов, образующих напочвенный покров [21]. Последовательное снижение этого показателя в пределах торфяной толщи обеих почв с k = 0.6–0.7 в гор. Т1 и до k = 0–0.09 в Т2 может косвенно свидетельствовать об уменьшении микробиологической активности вглубь профиля. Исследованиями мерзлотных торфяных почв Европейского северо-востока [3, 9, 17] выявлено существенное разнообразие вертикальных структур почвенной микробиоты (бактерии и грибы), микро- (коллемболы, орибатиды) и мезофауны (крупные беспозвоночные животные), включающее в том числе и закономерное снижение биомассы почвы с глубиной. Однако требуются дополнительные исследования данного вопроса. В маршевых почвах k = 0–0.29, что ниже, чем в зональных почвах, и теоретически должно свидетельствовать о растительном происхождении органического вещества.
Таким образом, содержание различных классов низкомолекулярных компонентов почвенного гумуса и их соотношения также полезно для понимания процессов, протекающих в почвах Крайнего севера. Аналогичный вывод был получен нами ранее при анализе состава индивидуальных соединений сезонно-талых слоев и многолетнемерзлой толщи (до глубины более 2 м) торфяных мерзлотных почв Европейского северо-востока России [20].
Вероятно, сведения об индивидуальных органических соединениях наиболее актуальны при характеристике почвенных профилей, сложность строения которых определяет чередование условий почвообразования, обусловленное существенным изменением комплекса абиотических факторов, влекущего за собой смену типа растительности. Поэтому спектры распределения низкомолекулярных соединений и соотношения их содержаний могут быть индикаторами процессов современного и предшествующих этапов почвообразования.
ЗАКЛЮЧЕНИЕ
Для почв побережья Хайпудырской губы Баренцева моря выполнен анализ водных вытяжек из почв на содержание органических форм углерода и азота, а также низкомолекулярных компонентов гумуса (спиртов, углеводов, кислот).
1. В засоленных маршевых почвах, формирующихся в условиях периодического затопления
приливными и нагонными морскими водами, содержание водорастворимого органического
углерода ${{{\text{(}}{{{\text{C}}}_{{{\text{орг}}}}}{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ варьирует от 0.1 до 0.8, ${{{\text{(}}{{{\text{N}}}_{{{\text{орг}}}}}{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ – от 0.01 до 0.05 г/кг, ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 7–21 (${\omega (}{{{\text{N}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = =  + 0.01). Содержание низкомолекулярных органических соединений не превышает 20 мг/кг,
доля углеводов составляет 50–90, кислот – 10–50, спиртов – менее 3%. В пределах трех
верхних горизонтов все параметры изменяются разнонаправленно. Погребенные органо-минеральные
горизонты почв имеют максимум содержания индивидуальных компонентов, что аналогично
распределению органического углерода в почвах, но не соответствует последовательности
изменения содержания данного элемента в водорастворимой фракции. Высокую неоднородность
гумусового состояния почв маршей характеризует массовая доля углерода водорастворимых
органических соединений от общего органического углерода вытяжек, составляющая 0.3–13%
и различающаяся в пределах трех верхних слоев до 20 раз.
+ 0.01). Содержание низкомолекулярных органических соединений не превышает 20 мг/кг,
доля углеводов составляет 50–90, кислот – 10–50, спиртов – менее 3%. В пределах трех
верхних горизонтов все параметры изменяются разнонаправленно. Погребенные органо-минеральные
горизонты почв имеют максимум содержания индивидуальных компонентов, что аналогично
распределению органического углерода в почвах, но не соответствует последовательности
изменения содержания данного элемента в водорастворимой фракции. Высокую неоднородность
гумусового состояния почв маршей характеризует массовая доля углерода водорастворимых
органических соединений от общего органического углерода вытяжек, составляющая 0.3–13%
и различающаяся в пределах трех верхних слоев до 20 раз.
2. В торфяной толще почв тундровых экосистем, подверженных влиянию моря лишь посредством выпадения морских аэрозолей, ${\omega }{{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = = 4–10, ${\omega (}{{{\text{N}}}_{{{\text{орг}}}}}{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ ~ 0.2 г/кг, ${{{\text{(C/N)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ = 25–56. В подстилочно-торфяных горизонтах отмечено накопление индивидуальных органических соединений, как и органического углерода почв, и вытяжек из них. В вытяжках около 80% от общей массы идентифицированных веществ, составляющей 200–300 мг/кг, приходится на углеводы, 10–20% – кислоты, 0–9% – спирты. Установлена аккумуляция ${{\left( {{{{\text{С}}}_{{{\text{орг}}}}}} \right)}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ и (N–${\text{NH}}_{4}^{ + }{{{\text{)}}}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ в надмерзлотной толще по сравнению с нижележащим мерзлого грунта (в 1.6 и 3 раза соответственно).
3. В почвах выражено софракционирование соединений C и N. В органогенных субстратах повышенная растворимость N-органических соединений по сравнению с соответствующими безазотистыми обеспечивает превышение C/N почв над C/N вытяжек. В минеральных горизонтах отмечено обратное соотношение, поскольку водная экстракция N-содержащих соединений ограничена их фиксацией илистой фракцией почв. В органо-минеральных горизонтах в зависимости от количества и природы соединений N, специфики гранулометрического и минералогического состава возможна разная соотносительность C/N почв и вытяжек.
Список литературы
Арчегова И.Б. Гумусообразование на севере европейской территории СССР. Л.: Наука, 1985. 136 с.
Беляев Н.А. Органическое вещество и углеводородные маркеры Белого моря. Автореф. дис. … канд. геол.-минерал. н. М., 2015. 24 с.
Виноградова Ю.А., Лаптева Е.М. Пространственное распределение микроорганизмов в почвах бугристых торфяников лесотундры // Тез. докл. III Всерос. научн. конф. “Биоразнообразие экосистем Крайнего Севера: инвентаризация, мониторинг, охрана”. Сыктывкар: ИБ Коми НЦ УрО РАН, 2017. С. 265–269.
Гришина Л.А., Орлов Д.С. Система показателей гумусного состояния почв // Проблемы почвоведения. М.: Наука, 1978. С. 42–47.
Губин С. Динамика верхней границы многолетней мерзлоты и проблема ретинизации гумуса в тундровых почвах Северо-Востока России // Проблемы эволюции почв. Пущино, 2003. С. 168–172.
Добровольский А.Д., Залогин Б.С. Моря СССР. М.: Изд-во МГУ, 1982. 192 с.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Кубик О.С., Шамрикова Е.В., Денева С.В., Панюков А.Н., Пунегов В.В. Растворимые органические соединения представителей солеустойчивой флоры // Мат. VII Всерос. научн. конф. с междунар. участием “Гуминовые вещества в биосфере”. М., 2018. С. 17–18.
Лаптева Е.М., Виноградова Ю.А., Чернов Т.И., Ковалева В.А., Перминова Е.М. Структура и разнообразие почвенных микробных сообществ в бугристых болотах северо-запада Большеземельской тундры // Извести Коми НЦ УрО РАН. 2017. № 4. С. 5–14.
Макаров М.И., Шулева М.С., Малышева Т.И., Меняйло О.В. Растворимость лабильных форм углерода и азота почв в K2SO4 разной концентрации // Почвоведение. 2013. № 4. С. 408–413.
Мергелов Н.С., Таргульян В.О. Процессы накопления органического вещества в минеральной толще мерзлотных почв приморских низменностей Восточной Сибири // Почвоведение. 2011. № 3. С. 275–287.
Мировая реферативная база почвенных ресурсов 2014. Международная система почвенной классификации для диагностики почв и создания легенд почвенных карт. Исправленная и дополненная версия 2015 / Научные ред. перевода: Герасимова М.И., Красильников П.В. ФАО и МГУ им. М.В. Ломоносова, 2017. 216 с.
Орлов Д.С. Химия почв. М.: Изд-во Моск. ун-та, 1992. 401 с.
Орлов Д.С., Бирюкова О.Н., Розанова М.С. Дополнительные показатели гумусного состояния почв и их генетических горизонтов // Почвоведение. 2004. № 8. С. 918–925.
Полевой определитель почв России. М.: Почв. ин-т им. В.В. Докучаева, 2008. 182 с.
Сергиенко Л.А., Минаева Т.Ю., Денева С.В. Прибрежные экосистемы – уникальное биоразнообразие и пути его сохранения // Матер. междунар. науч.-практ. конф. “ЭкоПечора 2014”: “Экосистемный подход природопользования в Арктике: преимущества и перспективы”. Нарьян-Мар, 2014. С. 46–52.
Состояние биотического комплекса тундровых почв окрестностей Воркуты // Полярная криосфера и воды суши / Под ред. Котлякова В.М. М., 2011. С. 205–214.
Хорн Р. Морская химия (структура воды и химия гидросферы). М.: Мир, 1972. 400 с.
Шамрикова Е.В., Денева С.В., Кубик О.С. Распределение углерода и азота в почвенном покрове прибрежной территории Баренцева моря (Хайпудырская губа) // Почвоведение. 2019. № 5. С. 558–569. https://doi.org/10.1134/S0032180X19030092
Шамрикова Е.В., Денева С.В., Кубик О.С., Пунегов В.В., Кызъюрова Е.В., Боброва Ю.И., Зуева О.М. Кислотность органогенных горизонтов арктических почв побережья Баренцева моря // Почвоведение. 2017. № 11. С. 1325–1335. https://doi.org/10.7868/S0032180X17110107
Шамрикова Е.В., Денева С.В., Панюков А.Н., Кубик О.С. Свойства почв и характера растительности побережья Хайпудырской губы Баренцева моря // Почвоведение. 2018. № 4. С. 401–412. https://doi.org/10.7868/S0032180X18040020
Швабенланд И.С. Запас и динамика легкоминерализуемого органического вещества в почвах Хакасии. Дис. … канд. биол. наук. Абакан, 2002. 162 с.
Шляхов С.А. Классификация почв морских побережий. Владивосток, 1996. 35 с.
Bai J., Ouyang H., Deng W., Zhu Y., Zhang X., Wang Q. Spatial distribution characteristics of organic matter and total nitrogen of marsh soils in river marginal wetlands // Geoderma. 2005. V. 124. P. 181–192. https://doi.org/10.1016/j.geoderma.2004.04.012
Blagodatskaya E., Kuzyakov Y. Mechanisms of real and apparent priming effects and their dependence on soil microbial biomass and community structure: critical review // Biol. Fertil. Soils. 2008. V. 45. P. 115–131.
Cesário M. Teresa, Fonseca M. Manuela R., Marques Mafalda M., de Almeida M. Catarina M.D. Marine algal carbohydrates as carbon sources for the production of biochemicals and biomaterials // Biotechnol. Adv. 2018. V. 36. P. 798–817. https://doi.org/10.1016/j.biotechadv.2018.02.006
Cocks M.P., Harris J.M., Steele W.K., Balfour D.A. The influence of ornithogenic products on the nutrient status of soils surrounding nests in nunataks in Dronning Maud Land, Antarctica // Polar Res. 1999. V. 18. P. 19–26.
Dijkstra F.A., Carrillo Y., Pendall E., Morgan J.A. Rhizosphere priming: a nutrient perspective // Frontiers in Microbiology. 2013. V. 4. P. 1–8.
Eldor A.P. The nature and dynamics of soil organic matter: Plant inputs, microbial transformations, and organic matter stabilization // Soil Biol. Biochem. 2016. V. 98. P. 109–126.
Fischera H., Ingwersenc J., Kuzyakov Y. Microbial uptake of low-molecular-weight organic substances out-competes sorption in soil // Europ. J. Soil Sci. 2010. V. 61. 504–513. https://doi.org/10.1111/j.1365-2389.2010.01244.x
Frouz J. Effects of soil macro- and mesofauna on litter decomposition and soil organic matter stabilization // Geoderma. 2018. V. 332. P. 161–172. https://doi.org/10.1016/j.geoderma.2017.08.039
Harris C.M., McTigue N.D., McClelland J.W., Dunton K.H. Do high Arctic coastal food webs rely on a terrestrial carbon subsidy? // Food Webs. 2018. V. 15. P. 1–14. https://doi.org/10.1016/j.fooweb.2018.e00081
Hayes T.M., Hayes M.H. B., Swift R.S. Detailed investigation of organic matter components in extracts and drainage waters from a soil under long term cultivation // Org. Geochem. 2012. V. 52. P. 13–22. https://doi.org/10.1016/j.orggeochem.2012.07.011
Ishrat M., Hassan Md. I., Ahmad F., Islam A. Sugar osmolytes-induced stabilization of RNase A in macromolecular crowded cellular environment // Int. J. Biol. Macromolecules. 2018. V. 115. P. 349–357. https://doi.org/10.1016/j.ijbiomac.2018.04.073
Kaiser K., Guggenberger G., Haumaier L. and Zech W. Seasonal variations in the chemical composition of dissolved organic matter in organic forest floor layer leachates of old-growth Scots pine (Pinus sylvestris L.) and European beech (Fagus sylvatica L.) stands in northeastern Bavaria, Germany // Biogeochemistry. 2001. V. 55. P. 103–143.
Kleber M. Minerals and carbon stabilization: towards a new perspective of mineralorganic interactions in soils // 19th World Congress of Soil Science, Soil Solutions for a Changing World 1–6 August 2010. Brisbane, Australia. 2010. Published on DVD.
Lamb A.L., Wilson G.P., Leng M.J. A review of coastal palaeoclimate and relative sea-level reconstructions using δ13C and C: N ratios in organic material // Earth Sci. Rev. 2006. V. 75. P. 29–57.
Michaelson G.J., Dai X.Y., Ping C.L. Organic matter and bioactivity in Cryosols o Arctic Alaska // Cryosols. 2004. P. 463–477.
Moers M.E., Baas M., de Leeuw J.W., Boon J.J. Schenck P.A. Occurrence and origin of carbohydrates in peat samples from a red mangrove environment as reflected by abundances of neutral monosaccharides // Geochim. Cosmochim. Acta. 1990. V. 54. P. 2463–2472.
Osman K.T. Soil Organic Matter. // Capter 7. Soils: Principles, Properties and Management. Dordrecht: Springer, 2013. P. 89–96. https://doi.org/10.1007/978-94-007-5663-2_7
Otero X.L., Macías F. Caracterización y clasificación de los suelos de las marismas de la Ría de Ortigueira en relación con su posición fisiográfica y vegetación (Galicia-NO de la Península ibérica) // Edafologia. 2001. V. 8. P. 37–62.
Prescott C.E., Maynard D.G., Laiho R. Humus in northern forests: friend or foe? // Forest Ecol. Management. 2000. V. 133. P. 23–36. https://doi.org/10.1016/S0378-1127(99)00295-9
Raastad I.A., Mulder J. Dissolved organic matter (DOM) in acid forest soils at Gårdsjön (Sweden): natural variabilities and effects of increased input of nitrogen and of reversal of acidification // Water, Air, and Soil Pollution. 1999. V. 114. P. 199–219.
Ríos I., Bouza P.J., Bortolus A., Alvarez M. del P. Soil-geomorphology relationships and landscape evolution in a southwestern Atlantic tidal salt marsh in Patagonia, Argentina // J. South Am. Earth Sci. 2018. V. 84. P. 385–398. https://doi.org/10.1016/j.jsames.2018.04.015
Sanger L.J., Cox P., Splatt P., Whelan M., Anderson J.M. Variability in the quality and potential decomposability of Pinus sylvestris litter from sites with different soil characteristics: acid detergent fibre (ADF) and carbohydrate signatures // Soil Biol. Biochem. 1998. V. 30. № 4. P. 455–461.
Shamrikova E.V., Kubick O.S., Kaverin D.A., Pastuhov A.V., Zavarzina A.G., Punegov V.V. Soluble organic compounds as a regulator of biochemical processes in the North (Electronic resource) // Dissolved Organic Matter (DOM): Properties, Applications and Behavior. N.Y.: Nova science publishers, 2017. P. 55–80.
Silvestri S., Defina A., Marani M. Tidal regime, salinity and salt marsh plant zonation // Estuar. Coast Shelf Sci. 2005. V. 62. P. 119–130.
Singh L.R., Poddar N.K., Dar T.A., Kumar R., Ahmad F. Protein and DNA destabilization by osmolytes: The other side of the coin // Life Sci. 2011. V. 88. P. 117–125. https://doi.org/10.1016/j.lfs.2010.10.020
Szymański W. Chemistry and spectroscopic properties of surface horizons of Arctic soils under different types of tundra vegetation – A case study from the Fuglebergsletta coastal plain (SW Spitsbergen) // Catena. 2017. V. 156. P. 325–337. https://doi.org/10.1016/j.catena.2017.04.024
Szymański W. Quantity and chemistry of water-extractable organic matter in surface horizons of Arctic soils under different types of tundra vegetation – A case study from the Fuglebergsletta coastal plain (SW Spitsbergen) // Geoderma. 2017. V. 305. P. 30–39.
Tseits M.A., Dobrynin D.V. Classification of Marsh Soils in Russia // Eurasian Soil Science. 2005. V. 38. Suppl. 1. P. 44–48.
Uhlířová E., Šantrůčková H., Davidov S.P. Quality and potential biodegradability of soil organic matter preserved in permafrost of Siberian tussock tundra // Soil Biol. Biochem. 2007. V. 39. P. 1978–1989. https://doi.org/10.1016/j.soilbio.2007.02.018
Wild B., Schnecker J., Eloy A. ves R. J. et al. Input of easily available organic C and N stimulates microbial decomposition of soil organic matter in arctic permafrost soil // Soil Biol. Biochem. 2014. V. 75. P. 143–151. https://doi.org/10.1016/j.soilbio.2014.04.014
Xu C., Guo L., Dou F., Ping C.-L. Potential DOC production from size-fractionated Arctic tundra soils // Cold Regions Sci. Technol. 2009. V. 55. P. 141–150. https://doi.org/10.1016/j.coldregions.2008.08.001
Xu C., Guo L., Ping C.-L., White D.M. Chemical and isotopic characterization of size-fractionated organic matter from cryoturbated tundra soils, northern Alaska // J. Geophys. Res. 2009. V. 114. G03002. P. 1–11. https://doi.org/10.1029/2008JG000846
Yana J., Wanga L., Hua Yu, Tsangc Yiu Fai, Zhanga Y., Wud J., Fua X., Sun Y. Plant litter composition selects different soil microbial structures and in turn drives different litter decomposition pattern and soil carbon sequestration capability // Geoderma. 2018. V. 319. P. 194–203.
Zmudczyńska-Skarbek K., Balazy P. Following the flow of ornithogenic nutrients through the Arctic marine coastal food webs // J. Marine Systems. 2017. V. 168. P. 31–37. https://doi.org/10.1016/j.jmarsys.2016.12.006
Дополнительные материалы отсутствуют.