Почвоведение, 2019, № 2, стр. 234-245
Оценка вклада корневого и микробного дыхания в общий поток СО2 из торфяных почв и подзолов севера Западной Сибири методом интеграции компонентов
О. Ю. Гончарова 1, *, Г. В. Матышак 1, А. А. Бобрик 1, М. В. Тимофеева 1, А. Р. Сефилян 1
1 МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: goncholgaj@gmail.com
Поступила в редакцию 08.02.2018
После доработки 24.05.2018
Принята к публикации 26.09.2018
Аннотация
В ходе исследований, проведенных в типичных биогеоценозах севера Западной Сибири, апробирован метод интеграции компонентов. Данный метод, примененный в модификации погоризонтного исследования, позволил не только оценить вклад различных источников в общий поток СО2 из почв, но и определить долевое участие в нем отдельных горизонтов. Для мерзлотной торфяной почвы (Hemic Cryic Histosol) вклад корневого дыхания составил 14 ± 3%, для подзола языковатого (Glossic Albic Rustic Podzol (Arenic)) – 29 ± 6%. Торфяная почва характеризуется высокими запасами углерода (сумма органического и неорганического) (26 кг С/м2), экстрагируемого углерода (Сэкстр) (32 г C/м2) и микробного углерода (Смик) (43 г C/м2). На верхний горизонт (ТО) приходится около половины профильного запаса Смик и 100% запаса корней (до 300 г/м2), в нем зафиксирована максимальная активность микробиоты, он обусловливает более 70% всего потока СО2 из деятельного слоя (в среднем 35 см) торфяной мерзлотной почвы. При невысоком запасе С (6 кг C/м2) подзол характеризуется значительными запасами Смик (38 г C/м2) и очень высокой микробной активностью. Данное обстоятельство в сочетании с большѝм запасом корневой биомассы (до 3000 г/м2) и благоприятным температурным режимом обусловливает высокие величины как гросс продукции СО2, так и его эмиссии с поверхности, в 3–5 раз превосходящие таковые для органогенных мерзлотных почв. Минеральный профиль подзола обеспечивает около 20% общего потока СО2 из профиля (в среднем 38 см).
ВВЕДЕНИЕ
В исследованиях цикла углерода в наземных экосистемах почвам уделяется значительное внимание из-за их решающей роли в долгосрочном хранении углерода, секвестрированного из атмосферы. Баланс углерода в почве зависит от баланса его поступления с растительными остатками и эмиссии, которые в свою очередь характеризуются разной временной динамикой (например, сезонной или межгодовой) и по-разному реагируют на изменения экологических факторов [54]. К настоящему времени накоплен значительный объем данных по оценке величины эмиссии углекислого газа почвами (почвенное дыхание) в широком диапазоне экосистем, а также ее временной динамики и влиянии на нее абиотических факторов [10, 12, 18, 42, 46, 47]. Однако, хотя это знание улучшило общее понимание цикла углерода в системе растения–почва–атмосфера, оно имеет значение только с точки зрения долгосрочной секвестрации углерода в почве [18, 54]. Несмотря на обилие исследований в этой области, разделение потока СО2 из почв на составляющие является до сих пор нерешенной проблемой. Данное разделение необходимо, во-первых, для корректной оценки баланса углекислого газа, поскольку баланс углерода в экосистеме рассчитывается как разность между чистой первичной продукцией и дыханием почвенных микроорганизмов, которое представляет собой разность между эмиссий СО2 с поверхности почвы и дыханием корней [14]. И, во-вторых, для обеспечения адекватных прогнозов при изменении условий окружающей среды, поскольку компоненты почвенного дыхания имеют различные реакции на данные изменения [41, 51].
Выделяют пять основных источников общего потока СО2 из почв [41, 51, 54]:
1. Микробное разложение почвенного органического вещества (ПОВ), часто называемое базальным дыханием.
2. Микробное разложение ПОВ, инициированное недавним поступлением ризодепозитов и/или свежих растительных остатков (называемое прайминг эффектом).
3. Микробное разложение мертвых растительных остатков (подстилка и корневой опад).
4. Микробное разложение ризодепозитов (углеводов) живых корней, называемое ризомикробным дыханием.
5. Собственно корневое дыхание (дыхание роста плюс дыхание поддержания). В дополнение выделяют разрушение почвенных карбонатов.
В связи с этим, с точки зрения терминологии, следует разделять понятия “автотрофное” (пятый источник) и “гетеротрофное” (все остальные источники) дыхание, а также источники, связанные с растениями (п. 3 + 4 + 5), и связанные с ПОВ (п. 1 + 2). Иногда выделяют отдельно корневое дыхание (п. 4 + 5).
В настоящее время существует несколько методологических подходов для определения составляющих почвенного дыхания [7, 11, 34, 39, 41, 54], которые делятся на изотопные и неизотопные. В полевых условиях чаще применяют неизотопные методы, так как они менее затратны и не связаны с использованием радиоактивных веществ [7, 39]. Детально разрабатывается и подробно освещен в российской литературе модифицированный полевой метод субстрат-индуцированного дыхания [7]. За рубежом в основном применяются следующие методы: исключение корней (root exclusion technique) – разделение потока почвенного СО2 на дыхание неризосферных микроорганизмов и корневого дыхания совместно с ризосферным [34]; затенение, срезание (shading and clipping), основанные на остановке листового фотосинтеза с последующим подавлением корневого дыхания; метод регрессии (regression technique), основанный на предположении, что существует линейная зависимость между корневой биомассой и количеством СО2, выделенным корнями и ризосферными микроорганизмами; окольцовывание (tree girdling) [39] – метод специфический для лесных экосистем. Один из методов, применяемых для определения вклада дыхания отдельных почвенных источников – интеграции компонентов. Он основан на физическом разделении пулов углерода (корни, почва без корней и подстилка), вносящих вклад в поток CO2 с поверхности почвы, и последующего измерения удельных скоростей дыхания всех компонентов в контролируемых условиях [34]. Удельные скорости дыхания каждого компонента умножаются на их массу и суммируются для получения интегрированной величины дыхания, а также расчета вклада отдельных компонентов. В идеальном случае рекомендуется параллельно измерять эмиссию СО2 в ненарушенной почве и сравнивать с суммарной величиной дыхания, полученной для отдельных компонентов [14, 34, 39]. Так как при отборе корней и отмывании почвы отмечаются потери тонких корней, для оценки вклада корней в общую эмиссию сравнивают дыхание почвы с корнями и почвы без корней [39] или вклад корней рассчитывают, как разницу между общим потоком CO2 из почвы и удельным потоком CO2, полученным при разложении подстилки и почвенного органического вещества [33]. Основным недостатком этого метода является сильное влияние физического нарушения почвы и повреждения корней на величины дыхания, а также трудоемкость самой процедуры разделения компонентов, например, удаление всех корневых волосков [34]. Несмотря на все недостатки, данный метод широко используется [24, 27, 32, 55] и считается эффективным, особенно в сочетании с другими способами [39].
Следует отметить, что ни одна из перечисленных выше методик не предусматривает выделения всех источников, и ни одна не имеет четкого протокола. Вероятно, это является одной из причин столь широкой вариабельности представленных в литературе данных по оценке вклада отдельных компонентов в общее почвенное дыхание. Вклад корней в общую эмиссию СО2 почвами варьирует от 10 до 90% в зависимости от состава растительных сообществ, сезона года и методических подходов [34, 54]. Наибольшее количество данных касается лесных экосистем. Данных по вкладу корневого дыхания в общий поток СО2 из почв высоких широт крайне мало [8, 18, 25, 27], они основаны на единичных измерениях, иногда косвенных и расчетных методах. Нужно отметить, что редки исследования по сравнению различных техник раздельного определения дыхания, хотя настоятельно отмечается такая необходимость.
Цель работы – оценка дыхательной активности корней и микроорганизмов и их долевого участия в общем потоке СО2 методом интеграции компонентов на примере почв типичных биогеоценозов севера Западной Сибири: торфяной олиготрофной остаточно эутрофной мерзлотной и подзола языковатого. В задачи исследования также входила отработка методических подходов и адаптация заявленного метода.
ОБЪЕКТЫ И МЕТОДЫ
Природные условия района исследования. Район исследования расположен в зоне прерывистого распространения многолетнемерзлых пород (ММП) на северной границе северной тайги Западной Сибири в пределах третьей озерно-аллювиальной равнины (отн. высота 25–35 м) в междуречье рек Лев. Хетта и Хейгияха (Надымский район, Тюменская область, ЯНАО). Для района характерен продолжительный зимний период (7–8 мес.), низкая среднегодовая температура воздуха (–5°С), количество осадков варьирует от 450 до 650 мм/год. Зональным типом растительности в автоморфных условиях являются березово-лиственничные и березово-сосновые кустарничково-лишайниково-зеленомошные редколесья [17]. На плоской заболоченной центральной поверхности равнины доминируют багульниково-сфагновые бугристые торфяники и кустарничково-моховые болота. ММП отсутствуют с поверхности под островами лесных урочищ и болотами и приурочены к массивам торфяников. Почвообразующие породы в основном песчаные с линзами легкого и среднего суглинка. Повсеместно с поверхности распространены торфяные отложения переменной мощности 0.5–1.5 м [1, 13]. На торфяниках и окружающих их болотных участках формируется комплекс почв, в котором доминируют следующие типы: торфяная олиготрофная (болотная), торфяная олиготрофная мерзлотная (на мерзлых торфяных отложениях), торфяно-криозем, торфяно-подзол. В редколесьях формируются различные подтипы подзолов и подбуров [16].
Объекты исследования. Исследования проводили на двух ключевых участках. Первый располагался в сосняке кустарничково-зеленомошниковом с преобладанием в напочвенном покрове Pleurozium Mitt. (плевроциум Шребера) и кустарничков Vaccinium uliginosum L. (голубика) и Vaccinium vitis-idaea L. (брусника). Проективное покрытие кустарничков 60–70%. Почва классифицирована как подзол языковатый (Glossic Albic Rustic Podzol (Arenic)) [9, 37]. Профиль представлен влажной, рыхлой оторфованной подстилкой (О) мощностью 5–10 см, состоящей из слаборазложившегося опада березы и сосны с большим количеством корней; фрагментарно выраженного маломощного светло-серого супесчаного гор. АЕ с небольшим количеством корней и языковатой границей; неоднородно окрашенного (буровато-коричневый, коричневый, желтовато-серый, охристый) легкосуглинистого гор. ВНF мощностью около 20 см с единичными крупными древесными корнями; и желтовато-серого легкосуглинистого пористого гор. С.
Второй участок располагался на кустарничково-лишайниковом плоскобугристом торфянике с преобладанием Cladonia rangiferina (L.) Weberex F.H. Wigg (кладония альпийская) в напочвенном покрове и кустарничка Ledum decumbens (Ait.) Lodd. ex Steud (багульник). Проективное покрытие кустарничков составляло 5–20%. ММП залегали на глубине около 40 см. Почва классифицирована как торфяная олиготрофная остаточно-эутрофная мерзлотная (Hemic Cryic Histosol). Состояла из лишайникового очеса мощностью 3–5 см и нескольких торфяных горизонтов различного ботанического состава. Гор. ТО – красновато-коричневый, ерниково-моховый (Polytrichum sp.), среднеразложенный, слабослоистый, мощностью около 10 см. Гор. ТЕ – темно-серо-коричневый, осоково-березовый, сильнослоистый, плотный с хорошо сохранившимися растительными остатками мощностью 15–20 см, к низу темнеет и переходит в гор. ⊥ТЕ (надмерзлотный).
На каждом из участков заложили по 3 почвенных разреза. Они располагались на равном удалении от крупных деревьев (для лесного участка) и имели идентичную растительность. Расстояние между разрезами не более 5–7 м. По результатам описания профилей, почвы каждого участка отнесены к одной почвенной разности (подзол языковатый и торфяная олиготрофная остаточно эутрофная мерзлотная).
Методы исследования. Все описанные ниже аналитические процедуры, как полевые, так и лабораторные, проводили для каждого из шести разрезов погоризонтно. Эмиссию CO2 измеряли методом статичных закрытых камер в трехкратной повторности [22, 48] дважды. Для подзола – 6 и 8 августа 2017 г. в 18 ч (через 6 и 54 ч после подготовки разрезов), для торфяной почвы – 7 и 8 августа в 18 ч (через 6 и 30 ч после подготовки разрезов). Данная задержка по времени необходима, так как запас накопленного в нижних горизонтах почвы CO2 может формировать в начальные моменты после вскрытия высокие величины эмиссии, объясняемые дегазацией почвенно-грунтового раствора и десорбцией газа [21]. В течение двух суток происходило постепенное снижение дневной температуры воздуха с 12 до 7°С, и наблюдались затяжные дожди слабой интенсивности. Измерение эмиссии проводили с помощью стальных камер объемом 900 см3, которые устанавливали на поверхность почвы с предварительно удаленной растительностью и на поверхность каждого из горизонтов в трехкратной повторности. Время экспозиции составляло 30 мин. Для измерения концентрации углекислого газа на глубинах (10, 20 и 40 см) в почву помещали герметично закрытые трубки диаметром 1 см с перфорацией в нижней части. Отбор проб производили через резиновую пробку. Концентрацию CO2 определяли в полевых условиях с помощью портативного газового анализатора с инфракрасным датчиком RMT DX 6210 (точность 0.002%) [4]. Во время исследований контролировали температуру воздуха, измеряли температуру почвы с помощью логгеров Thermochron iButton TM (Dallas Semiconductor Corporation, TX, USA; разрешение 0.5°C, точность ±1°C) и электронных термометров TP3001 (разрешение 0.1°C, точность ±1°C), а также объемную влажность с помощью полевого влагомера Field Scout TDR 100 (разрешение 0.1%, точность ±3.0%) на 5 см от поверхности каждого горизонта в трехкратной повторности.
Для определения запасов корней и их удельного дыхания отобрали монолиты объемом от 850 до 1350 см3, взвешивали для определения плотности. Из каждого монолита отобрали корни, отмывали и разделяли на 3 фракции: <1, 1–5 и >5 мм. Для каждой фракции в полевых условиях определяли удельное дыхание корней (УДК, мг СО2/(кг ч)). Для этого навеску корней от 1.5 до 4 г (в 3–5-кратной повторности) помещали в 125-миллилитровые флаконы, измеряли начальную концентрацию СО2 путем отбора газовых проб через резиновую мембрану. Корни инкубировали 30 мин при полевой температуре (значение фиксировали) и измеряли конечную концентрацию СО2. Все измерения проводили в течение 2–3 ч после взятия монолитов. УДК определяли только для верхних горизонтов. Таким образом, для каждого типа почв для каждой фракции было сделано от 3 до 15 измерений величины УДК. Из каждой фракции корней были взяты пробы для определения влажности. Затем все корни по фракциям помещали в бумажные пакеты и в лабораторных условиях при температуре 60°С высушивали и взвешивали. Биомассу корней рассчитывали в кг/м2 в горизонте. Суммарное дыхание корней (из расчета на м2) в каждом горизонте рассчитывали в двух вариантах по формулам:
(2)
${\text{Д К }} = \left( {\sum {{{{\text{У Д К }}{{{\text{ф }}}_{i}}} \mathord{\left/ {\vphantom {{{\text{У Д К }}{{{\text{ф }}}_{i}}} n}} \right. \kern-0em} n}} } \right)m,$(3)
${\text{Д К }}{{{\text{ф }}}_{i}} = {{({\text{У Д К }}{{{\text{ф }}}_{i}} \times 100)} \mathord{\left/ {\vphantom {{({\text{У Д К }}{{{\text{ф }}}_{i}} \times 100)} {{\text{Д К }}}}} \right. \kern-0em} {{\text{Д К }}}}.$Микробное дыхание (МД) почвы измеряли в полевых и лабораторных условиях. После отбора корней почву аккуратно протирали вручную через сито 3 мм. В поле измерения проводили не ранее чем через 2 сут после отбора образцов и их подготовки, чтобы минимизировать прибавку в дыхании за счет возможных оставшихся в пробах тонких корней, а также механических нарушений. По литературным данным дыхательная активность корней после их срезания уменьшалась в течение первых двух суток в 2–3 раза, а к пятым суткам в 6 раз [55]. В полевых условиях измерения проводили аналогично определению УДК. Навеска почвы составляла 5 г почвы естественной влажности для органогенных горизонтов и 10 г для минеральных. Почву инкубировали 30 мин. В лабораторных условиях микробное дыхание определяли по скорости выделения СO2 почвой за 12–15 ч инкубации при температуре 22°С и естественной влажности [22]. Скорость МД выражали в мг СO2/(кг ч). Переход от массовых к объемным характеристикам почвы осуществляли через ее плотность. Таким образом, микробное дыхание из расчета на горизонт:
где МД – микробное дыхание из расчета на горизонт, мг СО2/(м2 ч), МДν – объемное МД почвы для данного горизонта, ρ – плотность сложения почвы, г/см3, V – объем горизонта, м3, 1000 – пересчетный коэффициент с учетом единиц измерения.Определение содержания общего углерода и азота проводили на экспресс-анализаторе VarioElIII (Elementar). Влажность образцов почв определяли с помощью измерителя влажности весового OHAUS МВ-35.
Определение микробного и экстрагируемого углерода. Из образцов естественной влажности (до измерений хранили не более двух недель в холодильнике при температуре +4°С) отбирали по четыре пробы по 2 г для органогенных горизонтов и 5 г минеральных. Из первых двух проб экстрагировали лабильные соединения углерода с использованием 0.05 M K2SO4 при взбалтывании в течение 1 ч и соотношении почва : раствор 1 : 5 [15]. В двух других пробах аналогичную экстракцию проводили после фумигации парами хлороформа, стабилизированного амиленом, в течение суток в эксикаторе под разряжением. В экстрактах определяли концентрацию углерода на автоматическом анализаторе ТОС-VCPN (Shimadzu). Смик рассчитывали, как разницу концентраций углерода в фумигированных и нефумигированных образцах [26, 56] с учетом поправочного коэффициента [28, 29], равного 0.45 [53].
Расчет запасов всех компонентов проводили для торфяной почвы до горизонта ММП (общая мощность профиля в среднем 35 см), для подзола были взяты все генетические горизонты включая 10-сантиметровый слой гор. С (общая мощность профиля в среднем 38 см).
Обработку данных проводили в программном пакете Statistica 7.0. Результаты представлены в форме среднее значение ± стандартное отклонение.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Общий углерод, углерод микробной биомассы, углерод лабильного органического вещества. Запасы С в торфяной почве составили в среднем 26 кг С/м2, в подзоле около 6 кг С/м2 (из расчета на весь исследованный профиль). В торфяной почве содержание С значимо не различается по горизонтам, но в силу различной мощности и плотности горизонтов максимальные запасы сосредоточены в гор. ТЕ и ⊥ТЕ. По повышенному соотношению С/N выделятся верхний гор. ТО, что свидетельствует о меньшей степени разложенности торфа его слагающего (табл. 1). В отличие от торфяной почвы распределение запасов С по профилю подзола неравномерное. Максимальное содержание и запасы характерны для горизонта подстилки, но при этом в минеральном профиле сосредоточена половина общего запаса С. По соотношению С/N выделяется только горизонт подстилки. Низкая обогащенность азотом органического вещества в минеральном профиле свидетельствует о небольшой степени его гумифицированности.
Таблица 1.
Физические и химические свойства почв (средние значения, в скобках стандартные отклонения)
| Горизонт | Мощностьa, см | Плотностьa, г/см3 | Содержание Сb, % | C/Nb | Смикc, мг С/кг | Сэкстрc, мг С/кг |
|---|---|---|---|---|---|---|
| Торфяная почва | ||||||
| Ягелевый очес | – | – | 43.6 (0.2) | 96 (20.7) | 2197 | 548 (10) |
| ТО | 9 (3.1) | 0.08 (0.026) | 42.7 (3.2) | 27 (0.7) | 1859 (834) | 445 (72) |
| ТЕ | 10 (4.5) | 0.20 (0.023) | 45.8 (1.4) | 20 (2.3) | 481 (290) | 517 (159) |
| ⊥ТЕ | 12 (4.9) | 0.22 (0.023) | 46.8 (0.9) | 22 (0.6) | 181 (97) | 594 (97) |
| Подзол | ||||||
| О | 8 (2.1) | 0.09 (0.018) | 41.1 (3.5) | 41 (2.8) | 5401 (1491) | 580 (254) |
| AE | 3 (0.8) | 0.98 (0.297) | 2.6 (0.9) | 20 (4.3) | 210 (69) | 34 (11) |
| BHF | 17 (6.4) | 1.05 (0.049) | 0.9 (0.4) | 22 (0.3) | 30 (10) | 37 (5) |
| C | 10 (0) | 1.15 (0.011) | 0.5 (0.3) | 25 (4.7) | 16 (17) | 27 (17) |
Максимальное содержание Смик в торфяной почве отмечено для гор. ТО. Содержание Смик в нижележащих горизонтах ниже в 3–4 раза. На гор. ТО приходится 50% общего запаса Смик, рассчитанного для всего профиля. Вклад остальных горизонтов приблизительно одинаков. Содержание Сэкстр в отличие от Смик не сильно различается по горизонтам и колеблется от 450 до 600 мг С/кг почвы. Вклад в общий запас Сэкстр разный для горизонтов и увеличивается от гор. ТО к ⊥ТЕ в 10 раз. Общее содержание Сэкстр на весь почвенный профиль составляет в среднем 32 г С/м2, Смик – 43 г С/м2.
Содержание Смик в подстилочно-торфяном горизонте подзола составляет более 5000 мг С/кг почвы и резко убывает вниз по профилю, на порядок в каждом последующем горизонте. Его содержание в гор. С составляет в среднем около 6 мг С/кг почвы. Запас углерода микробной биомассы в гор. О составляет 80% от общего запаса профиля. В отличие от торфяной почвы содержание Сэкстр существенно изменяется по профилю: от 580 в подстилке до 30–40 мг С/кг почвы в минеральном профиле. При этом максимальный вклад в общий запас Сэкстр вносит гор. BHF. Общее содержание Сэкстр на весь почвенный профиль составляет в среднем 15 г С/м2, Смик – 38 г С/м2.
К сожалению, не удалось найти литературных данных по профильному распределению запасов Сорг и Смик в почвах исследованного региона. Но полученные данные сопоставимы с таковыми для подзолов и подбуров Приполярного Урала [6] и почв хвойных лесов центральной Сибири и Канады [49, 55]. По данным Дымова с соавт. [6], на горизонты подстилки приходится лишь 10–30% общих запасов С, остальной углерод содержится в минеральном профиле. Данные по содержанию Смик торфяной почвы сопоставимы с таковыми для органогенных горизонтов тундровых почв [30, 31, 45] и являются высокими по сравнению с почвами других регионов. Несмотря на существенно большие запасы С в торфяной почве по сравнению с подзолом (более чем в 4 раза), запасы Смик в них практически одинаковы, а запасы Сэкстр в торфяной почве больше лишь в 2 раза.
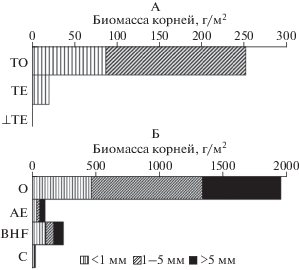
Запасы корней и их удельное дыхание. Запасы корневой биомассы в торфяной почве составляют от 200 до 300 г/м2, причем практически 100% всех корней находится в верхнем гор. ТО мощностью 6–10 см (рис. 1A). Представленные в литературе данные по схожим экосистемам Западной Сибири выше – от 300 до 1200 г/м2 [38]. В почве отсутствуют корни больше 5 мм, долевое участие тонких корней составляет от 25 до 45%. Удельное дыхание тонких корней для торфяной почвы (измеренное при 13°С) составляет 405 ± 95 мг СО2/(кг ч) (n = = 12). Интенсивность дыхания средних корней ниже – 267 ± 42 мг СО2/(кг ч) (n = 12).
В подзоле запасы корневой биомассы составляют от 1800 до 3000 г/м2. В верхнем подстилочно-торфяном горизонте сосредоточено от 80 до 90% корней. В отличие от торфяной почвы заметное количество корней отмечено в нижних горизонтах, 5–15% всей корневой биомассы приходится на гор. BHF (рис. 1б). Максимальное долевое участие отмечено для корней средней толщины в верхнем горизонте и тонких в нижних. УДК в подзоле (≈13°С) убывает по мере увеличения их толщины: тонкие: 285.4 ± 83.0 мг СО2/(кг ч) (n = 10), средние: 148.5 ± 22.7 мг СО2/(кг ч) (n = = 13), толстые: 122.2 ± 17.4 мг СО2/(кг ч) (n = 6). В целом УДК в торфяной почве выше, чем в подзоле почти в 2 раза.
Величины УДК для подзола сопоставимы с представленными в литературе немногочисленными данными, например, для лесов Канады с преобладанием Picea Mariana [55]. Для арктических видов мы ориентировались на работы группы ученых под руководством О.А. Семихатовой на острове Врангеля и в других арктических регионах [17]. Представленный ими диапазон УДК составляет при 10°С 0.13–0.32 мг СО2/(г сыр. массы ч), что полностью соответствует нашим данным. В данный же диапазон укладываются данные, представленные для растений болотных экосистем [18]. Несколько большие величины отмечены в работах по Аляске и Норвегии [27, 52].
На основании формул (1)–(3) рассчитано суммарное дыхание корней для верхнего горизонта почв и долевое участие каждой фракции в общем дыхании (табл. 2). В торфяной почве максимальный вклад в общее дыхание вносят корни толщиной 1–5 мм, в подзоле доля участия тонких и средних корней практически равнозначна. Суммарное корневое дыхание (гросс продукция СО2 корнями) на профиль рассчитывали как сумму корневого дыхания всех горизонтов. При этом расчет проводили двумя способами: с учетом дыхания каждой фракции (формула (1)) и через усреднение УДК всех фракций (формула (2)). КД для торфяной почвы варьирует от 53 до 107 мг СО2/(м2 ч) (при усреднении от 54 до 115), для подзола от 360 до 480 мг СО2/(м2 ч) (при усреднении от 370 до 520). Мы не стали усреднять значения гросс продукции СО2 корнями по разрезам, поскольку наблюдалась высокая вариабельность запасов корневой биомассы.
Таблица 2.
Дыхание корней в верхнем горизонте торфяной почвы (ТО) и подзола (О) (для каждого типа почв среднее по 3 разрезам), мг СО2/(м2 ч) и долевое участие (%) каждой фракции (± стандартное отклонение)
| Фракция, мм | Гор. ТО торфяной почвы | Гор. О подзола |
|---|---|---|
| <1 | 35 ± 6 (44%) | 130 ± 10 (39%) |
| 1–5 | 44 ± 10 (66%) | 130 ± 22 (39%) |
| >5 | 0 | 72 ± 37 (22%) |
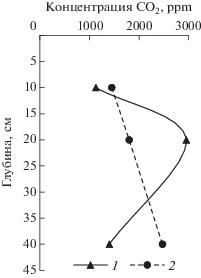
Эмиссия и концентрация СО2. Для оценки запасов накопленного в почве СО2 измерена его концентрация в почвенном воздухе (рис. 2). Для подзола наблюдается равномерное увеличение концентрации с глубиной до 0.25% на 40 см. Такой газовый профиль характерен для лесных почв [22]. В торфяной почве наблюдался максимум концентрации (0.30%) на глубине 20 см с резким снижением в надмерзлотном горизонте. Такой профиль может быть связан как с низким продуцированием газа в надмерзлотных горизонтах, так и с процессами его растворения в холодном растворе, образующемся при таянии сезонно-мерзлого слоя, затрудненной диффузии и др.
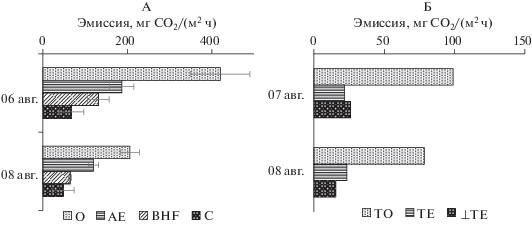
Эмиссия СО2 с поверхности подзола составила 420 ± 70 и 206 ± 22 мг СО2/(м2 ч) (n = 9) в первый и второй день измерений соответственно. Столь резкое уменьшение эмиссии можно объяснить падением температуры воздуха и, соответственно, температуры верхнего горизонта почвы (≈ на 1.5°С). А также увеличением влажности верхних горизонтов (почти в 2 раза). На рис. 3 представлена величина эмиссии СО2 с поверхности всех вскрытых горизонтов. На торфянике эмиссия СО2 с поверхности почвы была почти в 4 раза ниже, чем в лесу и составила в среднем 100 мг СО2/(м2 ч) в первый день и 80 мг СО2/(м2 ч) через сутки. Полученные данные по эмиссии СО2 и его концентрации в почвенном профиле являются типичными для данных ландшафтов [2, 3].
Рис. 3.
Эмиссия СО2 с поверхности всех вскрытых горизонтов через 6 ч после вскрытия (6 и 7 августа) и через 30–56 ч (8 августа) для подзола (А) и торфяной почвы (Б).
Микробное дыхание. МД было определено в полевых условиях при температуре воздуха и в лабораторных по стандартной методике (22°С). По лабораторным данным, величина МД в верхнем органогенном горизонте подзола приблизительно в 2 раза выше, чем в торфяной и варьирует (для трех разрезов) от 80 до 140 мг СО2/(кг ч) (рис. 4А). В минеральном профиле подзола величина МД не превышает 5 мг СО2/(кг ч). В нижних горизонтах торфяной почвы МД ниже, чем в верхнем, но значимо: 10–20 мг СО2/(кг ч). Величины МД, полученные в полевых условиях, отличаются от лабораторных. При этом для гор. О и АЕ подзола полевые данные выше лабораторных, а для горизонтов торфяной почвы, особенно нижних, – существенно ниже, более чем в 2 раза. Эта закономерность прослеживается для всех разрезов. В полевых условиях для некоторых горизонтов торфяной почвы были получены нулевые значения. Полученные величины МД для торфяной почвы несколько выше, представленных в литературе [5, 20]. Исходя из того, что почвы района исследования характеризуются выраженной вертикальной анизотропностью по плотности для сравнительной оценки вклада отдельных горизонтов в общий поток СО2 целесообразно использовать показатели, нормированные объемом почвы [22]. При переходе на объемные величины МД существенно возрастает вклад нижних торфяных горизонтов в торфяной мерзлотной почве и минерального профиля в подзоле в общий поток СО2 (рис. 4Б).
Рис. 4.
Величина МД (А) и МДν (Б) для горизонтов торфяной почвы и подзола, измеренная в лабораторных (1) и полевых (2) условиях.

Исходя из значений МДν погоризонтно, а также для всего профиля рассчитана величина МД по полевым и лабораторным данным, а также вклад корневого дыхания в общий поток (гросс продукцию) СО2 почвами (табл. 3). Данные расчеты проводили отдельно для каждого разреза, так как в процессе исследований, несмотря на тщательный выбор мест закладки разрезов, выявилась существенная вариабельность таких параметров, как мощности горизонтов, величины МД, запасы корней. Усреднение проводили только на конечном этапе, когда были получены искомые величины для каждого разреза. На торфянике вклад корневого дыхания составил в среднем 14 ± 3% (расчет по полевым данным) и на подзоле – 29 ± 6%. При расчете по лабораторным данным, вклад корневого дыхания в лесу практически такой же, а на торфянике ниже в 2 раза.
Таблица 3.
Корневое и микробное почвенное дыхание, мг СО2/(м2 ч) и вклад корневого дыхания в общий поток СО2, рассчитанный на основе полевых и лабораторных данных (метод интеграции компонентов) (± стандартное отклонение)
| Почва | КД | МД | КД, % | МД | КД, % |
|---|---|---|---|---|---|
| полевые данные | лабораторные данные | ||||
| Торфяная | 92 ± 33 | 607 ± 272 | 14 ± 6 | 1326 ± 355 | 6 ± 1 |
| Подзол | 424 ± 91 | 1023 ± 167 | 29 ± 3 | 840 ± 230 | 34 ± 2 |
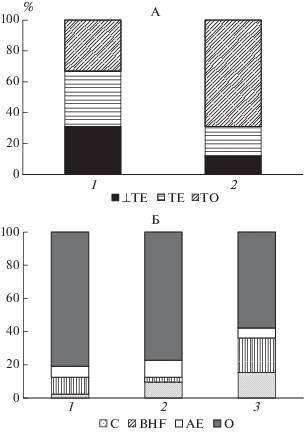
По полевым, лабораторным данным и по послойной эмиссии рассчитан вклад отдельных горизонтов в суммарную продукцию СО2 (рис. 5). Нам не удалось рассчитать вклад отдельных горизонтов в общую эмиссию для торфяной почвы по данным послойной эмиссии, так как величины для гор. ТЕ (а для одного разреза для ТО) получались отрицательные. Для подзола данные полевые и лабораторные близки. Для торфяника они сильно различаются. Например, по полевым данным вклад гор. ТО составляет 70%, по лабораторным – 33%. Это свидетельствует о высокой температурной чувствительности минерализации органического вещества торфов данного типа. Мы рассчитали ее по нашим данным, используя формулу ${{Q}_{{10}}} = {{\left( {\frac{{R{{t}_{{{\text{л а б }}}}}}}{{R{{t}_{{{\text{п о л е }}}}}}}} \right)}^{{\frac{{10}}{{{{t}_{{{\text{л а б }}}}} - {{t}_{{{\text{п о л е }}}}}}}}}}$ [35]. Для верхних горизонтов торфяника Q10 составляет около 1.2–1.3, для нижних более 2. Учитывая то, что в поле измерения проходили при температуре 8–12°С, в лаборатории при 22°С, а температура функционирования торфяных горизонтов от 3 до 5°С, реальная величина МД еще ниже, приблизительно в 1.3–1.5 раз по сравнению с полевыми данными. Но при этом величина вклада отдельных горизонтов сильно не меняется (данные не представлены). Даже несмотря на все эти приближения, величина эмиссии с поверхности почвы, как для торфяника, так и для леса, существенно меньше суммарных оценок гросс продукции СО2 методом интеграции компонентов. Причиной этого могут быть как методические аспекты (изменение величины дыхания при нарушении почвы, срезании корней), так и физические причины. То есть существуют причины, по которым не весь продуцирующийся газ выходит с поверхности, часть его может уходить в нижние слои почвы, растворяться в жидкой фазе, адсорбироваться [22].
Рис. 5.
Вклад отдельных горизонтов в общий поток СО2 из торфяной почвы (А) и подзола (Б) по лабораторным (1), полевым данным (2), а также значения, рассчитанные по эмиссии (3) (для подзола).
Методические аспекты. Одна из задач исследования – оценка особенностей метода интеграции компонентов (или раздельной инкубации источников СО2), возможности его применения в различных условиях и на почвах разного генезиса. Мы можем выделить несколько положительных моментов: метод хотя и трудоемкий, но дает возможность одновременно получить информацию о вкладе в общий поток СО2 не только отдельных компонентов, но и почвенных горизонтов, фракций корней и др. В отличие от методов, основанных на измерении потока СО2 с поверхности, отсутствуют причины, меняющие скорость потока (изменение температуры, влажности и др.). Но при этом, метод имеет ряд недостатков, которые отмечены и другими исследователями [34]. А именно: вероятное изменение дыхания компонентов вследствие нарушения сложения почвы, а также срезания корней. Также недостатком метода является недоучет ряда составляющих почвенного дыхания, связанных с микробным разложение ПОВ, инициированного недавним поступлением ризодепозитов и ризомикробным дыханием.
Мы сделали несколько методических замечаний-рекомендаций, исходя из полученных данных:
1. Недопустимо использовать модификацию метода, применяемую некоторыми авторами, а именно расчет вклада одного компонента путем вычитания (или сравнения) продукции СО2 другого компонента из потока СО2 с поверхности почвы [33, 36, 42, 44, 50, 55], которая, как нам кажется, ошибочна в своей сути, так как мы подводим под одну черту с одной стороны продукцию СО2 индивидуальным компонентом (гросс продукцию), а с другой – эмиссию с поверхности почвы, которая зависит от массы факторов и меняется во времени.
Таблица 4.
Эмиссия СО2 из горизонтов почв за два дня измерений и гросс продукция СО2 почвами методом интеграции компонентов, мг СО2/(м2 ч) (представлены данные для индивидуальных разрезов)
| Горизонт | Эмиссия из горизонта | Корневое дыхание | Микробное дыхание | Гросс продукция СО2 | |
|---|---|---|---|---|---|
| 06. авг. | 08. авг. | Подзол | |||
| О | 227 | 105 | 384 | 1074 | 1458 |
| AE | 24 | 45 | 14 | 88 | 102 |
| BHF | 82 | 26 | 77 | 0 | 77 |
| C | 60 | 36 | 4 | 0 | 4 |
| 07. авг. | 08. авг. | Торфяная мерзлотная | |||
| TО | 166 | 180 | 87 | 530 | 617 |
| TЕ | –14 | –49 | 20 | 286 | 306 |
| ⊥TЕ | 35 | 30 | 0 | 102 | 102 |
2. Для торфяной мерзлотной почвы необходимо вносить расчетные поправки на низкие температуры функционирования в нижних горизонтах, а также учитывать возможные потери продуцируемого СО2 за счет латеральной диффузии и растворения в холодных почвенных растворах в надмерзлотном горизонте.
3. Используя различные варианты расчетов, мы показали, что для исследуемого объекта возможен расчет суммарного ДК как по вкладу отдельных фракций, так и по средней величине УДК.
4. Целесообразно вводить поправочные коэффициенты, учитывающие изменение величин МД и УДК при нарушении почвы и срезании корней.
5. Метод оценки вклада отдельных горизонтов в общий поток СО2 по измерению послойной эмиссии показал противоречивые результаты. Величины вклада нижних горизонтов получились явно завышенными даже через двое суток после вскрытия горизонтов, что, вероятно, связано с продолжающейся диффузией газа, накопленного в нижних горизонтах. Данные полученные для торфяной мерзлотной почвы свидетельствуют о боковой диффузии газа, возможно, обусловленной перераспределением газа вдоль поверхности мерзлоты.
В ходе исследований остались невыясненными несколько аспектов, что предполагает продолжение исследований. Мы не можем объяснить причину существенных различий в величинах УДК для подзола и торфяной почвы. Хотя видовой состав кустарничков и различен для двух биогеоценозов, они относятся к одному семейству (вересковые) и характеризуются схожими физиологическими аспектами: например, образуют специфическую эрикоидную микоризу, имеют хорошо развитые подземные побеги и др. Возможно, это связано с переходом от более низких температур функционирования к повышенным, при которых проводились измерения (данное обстоятельство наблюдалось только для торфяной почвы). На такую возможность указывала Ларионова с соавт. [14].
Второй аспект – это повышенные величины МД, полученные в полевых условиях для верхних горизонтов подзола по сравнению с данными при стандартных условиях в лаборатории. Возможным объяснением может быть дополнительное дыхание за счет оставшихся тонких корней. На это обстоятельство обращают внимание и другие исследователи [39]. Вероятно, двух суток оказалось недостаточно для значительного подавления корневого дыхания. Если предположить, что температурная чувствительность верхних горизонтов подзола близка к таковой в торфяной почве (около 2) и рассчитать величину суммарного микробного дыхания с учетом лабораторных данных и температуры функционирования (около 9°С), то конечная величина вклада корневого дыхания возрастет с 30 до 55%. В дальнейшем предполагается провести полевой эксперимент по оценке скорости изменения дыхания почвы с тонкими корнями для корректировки конечных оценок вклада компонентов в общий поток СО2.
ЗАКЛЮЧЕНИЕ
В ходе исследований, проведенных в типичных биогеоценозах Севера Западной Сибири, апробирован метод интеграции компонентов для разделения потока СО2 из почв на микробное и корневое дыхание. Данный метод, примененный в модификации погоризонтного исследования, позволил не только оценить вклад различных источников в общий поток СО2 из почв, но и определить долевое участие горизонтов в этом потоке. Также в ходе исследования было оценено профильное распределение запасов углерода, Смик и Сэкстр, изменение с глубиной активности микробиоты, а также запасов корневой биомассы. Для мерзлотной торфяной почвы вклад корневого дыхания составил 14 ± 3%, для подзола – 29 ± 6% (усреднение для трех разрезов каждого типа почв). Верхний гор. ТО торфяной мерзлотной почвы обеспечивает более 70% всего потока СО2 (из расчета на деятельный слой мощностью в среднем 35 см), гор. О подзола – около 80% (из расчета на полный профиль, включая 10 см гор. С, в среднем 38 см). Верхний горизонт обеих почв характеризуется высоким микробным дыханием, в 2–10 раз превышающим таковое для нижележащих горизонтов. В полевых условиях получены данные по УДК, в том числе для отдельных фракций. В среднем для подзола УДК меньше, чем для торфяника (185 и 335 мгСО2/(кг ч) соответственно). Эти данные могут быть использованы для расчета корневого дыхания в почвах со схожим растительным покровом. Величины гросс продукции СО2 исследованными почвами в несколько раз превысили значения эмиссии с поверхности почв. Это обстоятельство исключает возможность расчета величины вклада одного компонента как разницы между эмиссией и дыханием другого компонента. В ходе исследований показано, что различные объекты: торфяная почва на мерзлоте и минеральная (подзол) – требуют разных методических подходов. В данном случае различия обусловлены как сложением почв, так и их температурным режимом и режимом влажности.
Благодарность. Авторы выражают благодарность профессору факультета почвоведения МГУ им. М.В. Ломоносова Андрею Валентиновичу Смагину за неоценимую помощь в методических аспектах работы. Работа выполнена при финансовой поддержке РФФИ № 16-04-00808 А.
Список литературы
Васильев С.В. Лесные и болотные ландшафты Западной Сибири. Томск: Изд-во НТЛ, 2007. 276 с.
Бобрик А.А., Рыжова И.И., Гончарова О.Ю., Матышак Г.В., Макаров М.И., Волкер Д.А. Эмиссия СО2 и запасы органического углерода в почвах северотаежных экосистем Западной Сибири в различных геокриологических условиях // Почвоведение. 2018. № 6. С. 674–682. doi 10.7868/S0032180X18060035
Гончарова О.Ю., Бобрик А.А., Матышак Г.В., Макаров М.И. Роль почвенного покрова в сохранении структурной и функциональной целостности северотаежных экосистем Западной Сибири // Сиб. эколог. журн. 2016. № 1. С. 3–12. doi 10.15372/ SEJ20160101
Гончарова О.Ю., Матышак Г.В., Бобрик А.А., Москаленко Н.Г. Продуцирование диоксида углерода почвами северной тайги Западной Сибири (Надымский стационар) // Криосфера Земли. 2014. Т. 18(2). С. 66–71.
Гродницкая И.Д., Карпенко Л.В., Кнорре А.А., Сырцов С.Н. Микробная активность торфяных почв заболоченных лиственничников и болота в криолитозоне Центральной Эвенкии // Почвоведение. 2013. № 1. С. 67–79. doi 10.7868/S0032180X13010048
Дымов А.А., Жангуров Е.В., Старцев В.В. Почвы северной части Приполярного Урала: морфология, физико-химические свойства, запасы углерода и азота // Почвоведение. 2013. № 5. С. 507–516. doi 10.7868/S0032180X1305002X
Евдокимов И.В., Ларионова А.А., Шмитт М., Лопес де Гереню В.О., Бан М. Экспериментальная оценка вклада дыхания корней растений в эмиссию углекислого газа из почвы // Почвоведение. 2010. № 12. С. 1479–1488.
Карелин Д.В., Замолодчиков Д.Г. Углеродный обмен в криогенных системах. М.: Наука, 2008. 343 с.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Кудеяров B.Н., Курганова И.Н. Дыхание почв России: анализ базы данных, многолетний мониторинг, общие оценки // Почвоведение. 2005. № 9. С. 1112–1121.
Кузяков Я.В., Ларионова А.А. Вклад ризомикробного и корневого дыхания в эмиссию СО2 из почвы // Почвоведение. 2006. № 7. С. 824–854.
Курганова И.Н., Кудеяров В.Н. Оценка потоков диоксида углерода из почв таежной зоны России // Почвоведение. 1998. № 9. С. 1058–1070.
Ландшафты криолитозоны Западно-Сибирской нефтегазоносной провинции / Под ред. Е.С. Мельникова. Новосибирск: Наука. 1983. 165 с.
Ларионова А.А., Евдокимов И.В., Курганова И.Н., Сапронов Д.В., Кузнецова Л.Г., Лопес де Гереню В.О. Дыхание корней и его вклад в эмиссию СО2 из почвы // Почвоведение. 2003. № 2. С. 183–194.
Макаров М.И., Шулева М.С., Малышева Т.И., Меняйло О.В. Растворимость лабильных форм углерода и азота почв в К2SO4 разной концентрации // Почвоведение. 2013. № 4. С. 408–413. doi 10.7868/ S0032180X13040096
Матышак Г.В., Богатырев Л.Г., Гончарова О.Ю., Бобрик А.А. Особенности развития почв гидроморфных экосистем северной тайги Западной Сибири в условиях криогенеза // Почвоведение. 2017. № 10. С. 1155–1164. doi 10.7868/S0032180X17100069
Москаленко Н.Г. Антропогенная динамика растительности равнин криолитозоны России. Новосибирск: Наука, Сибирская издательская фирма РАН, 1999. 280 с.
Наумов А.В. Дыхание почв: составляющие, экологические функции, географические закономерности. Новосибирск: Изд-во СО РАН, 2009. 208 с.
Семихатова О.А., Иванова Т.И., Кирпичникова О.В. Дыхание корней у растений острова Врангеля // Бот. журн. 2010. Т. 95. № 5. С. 656–666.
Сергеева М.А., Хохлова А.М. Микробная биомасса и ее активность в торфяных болотах Сибири // Вестник ТГПУ (TSPU Bulletin). 2015. № 2(155). С. 143–149.
Смагин А.В. Газовая фаза почв. М.: Изд-во Моск. ун-та, 2005. 301 с.
Смагин А.В., Долгих А.В., Карелин Д.В. Экспериментальные исследования и физически обоснованная модель эмиссии диоксида углерода из вскрытого культурного слоя в Великом Новгороде // Почвоведение. 2016. № 4. С. 489–495. doi 10.7868/ S0032180X16040122
Стольникова Е.В., Ананьева Н.Д., Чернова О.В. Микробная биомасса, ее активность и структура в почвах старовозрастных лесов Европейской территории России // Почвоведение. 2011. № 4. С. 479–494.
Трефилова О.В. Интенсивность гетеротрофного дыхания в сосняках средней тайги: сравнительный анализ методов оценки // Хвойные бореальной зоны. 2007. Т. 24. № 4–5. С. 467–473.
Федоров-Давыдов Д.Г. Дыхательная активность тундровых биогеоценозов и почв Колымской низменности // Почвоведение. 1998. № 3. С. 291–301.
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biol. Biochem. 1978. V. 10. P. 215–221.
Billings W.D., Peterson K.M., Shaver G.R., Trent A.W. Root growth, respiration and carbon dioxide evolution in an arctic soil // Arctic Alpine Res. 1977. V. 9. № 2. P. 129–137.
Brookes P.C., Landman A., Pruden G., Jenkinson D.S. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil // Soil Biol. Biochem. 1985. V. 17. P. 837–842.
Cheng W., Virginia R.A. Measurement of microbial biomass in Arctic tundra soils using fumigation-extraction and substrate-induced respiration procedures // Soil Biol. Biochem. 1993. V. 25. № 1. P. 135–141.
Cheng W., Virginia R.A., Oberbauer S.F., Tenhunen J.D., Gillespie C.T., Reynolds J.F. Soil nitrogen, microbial biomass and respiration along an arctic toposequence // Soil Sci. Soc. Am. J. 1998. V. 62. P. 654–662.
Edwards K.A., Jefferies R.L. Inter-annual and seasonal dynamics of soil microbial biomass and nutrients in wet and dry low-Arctic sedge meadows // Soil Biol. Biochem. 2013. V. 57. P. 83–90. https://doi.org/10.1016/ j.soilbio.2012.07.018.
Edwards N.T., Sollins P. Continuous measurement of carbon dioxide evolution from partitioned forest floor components // Ecology. 1973. V. 54. P. 406–412.
Ewel K.C., Cropper W.P., Jr., Gholz H.L. Soil CO2 evolution in Florida slash pine plantations. II. Importance of root respiration // Canad. J. Forest Res. 1987. V. 17. P. 330–333.
Hanson P.J., Edwards N.T., Garten C.T., Ansrews J.A. Separating root and soil microbial contributions to soil respiration: A review of methods and observations // Biogeochem. 2000. V. 48. № 1. P. 115–146.
Hilasvuori E. et al. Temperature sensitivity of decomposition in a peat profile // Soil Biol. Biochem. 2013. V. 67. P. 47–54. https://doi.org/10.1016/j.soilbio.2013.08.009.
Irwine J., Law B.E. Contrasting soil respiration in young and old-growth ponderosa pine forests // Global Change Biology. 2002. V. 8. P. 1183–1194. doi 10.1046/j.1365-2486.2002.00544.x
IUSS Working Group WRB. 2015. World Reference Base for Soil Resources 2014, update 2015 International soil classification system for naming soils and creating legends for soil maps. World Soil Resources Reports No. 106, FAO, Rome.
Kosykch N.P., Koronatova N.G., Naumova N.B., Titlyanova A.A. Above- and below-ground phytomass and net primary production in boreal mire ecosystems of West Siberia // Wetland Ecol. Manage. 2008. V. 16. P. 139–153. doi 10.1007/s11273-007-9061-7
Kuzyakov Y. Sources of CO2 efflux from soil and review of partitioning methods // Soil Biol. Biochem. 2006. V. 38. № 3. P. 425–448. https://doi.org/10.1016/j.soilbio.2005.08.020.
Kuzyakov Y., Gavrichkova O. Time lag between photosynthesis and carbon dioxide efflux from soil: a review of mechanisms and controls // Global Change Biol. 2010. V. 16. № 12. P. 3386–3406. doi 10.1111/j.1365-2486.2010.02179.x
Kuzyakov Y., Larionova A.A. Root and rhizomicrobial respiration: a review of approaches to estimate respiration by autotrophic and heterotrophic organisms in soil // J. Plant Nutrition Soil Sci. 2005. V. 168. P. 503–520. doi 10.1002/jpln.200421703
Law B.E., Thornton P.E., Irvine J., Anthoni P.M., VanTuyl S. Carbon storage and fluxes in ponderosa pine forests at different developmental stages // Global Change Biol. 2001. V. 7. P. 755–777. doi 10.1046/ j.1354-1013.2001.00439.x
Lloyd J., Taylor J.A. On the temperature dependence of soil respiration // Functional Ecology. 1994. V. 8. P. 315–323.
Maier C.A., Kress L.W. Soil CO2 evolution and root respiration in 11 year-old loblolly pine (Pinustaeda) plantations as affected by moisture and nutrient availability // Can. J. For. Res. 2000. V. 30. P. 347–359.
Potila H., Sarjala T. Seasonal fluctuation in microbial biomass and activity along a natural nitrogen gradient in a drained peatland // Soil Biol. Biochem. 2004. V. 36(7). P. 1047–1055. https://doi.org/10.1016/j.soilbio.2004.02.014.
Raich J.W., Potter C.S., Bhagawati D. Interannual variability in global soil respiration, 1980–94 // Global Change Biol. 2002. V. 8. P. 800–812. doi 10.1046/ j.1365-2486.2002.00511.x
Raich J.W., Schlesinger W.H. The global carbon dioxide flux in soil respiration and its relationship to vegetation and climate // Tell. Series B. 1992. V. 44. P. 81–99.
Riveros-Iregui D.A., McGlynn B.L., Epstein H.E., Welsch D.L. Interpretation and evaluation of combined measurement techniques for soil CO2 efflux: Discrete surface chambers and continuous soil CO2 concentration probes // J. Geophys. Res. 2008. V. 113. G04027. P. 1–11. doi 10.1029/2008JG000811
Ross D.J., Kelliher F.M., Tate K.R. Microbial processes in relation to carbon, nitrogen and temperature regimes in litter and a sandy mineral soil from a central Siberian Pinussylvestris forest // Soil Biol. Biochem. 1999. V. 31. P. 757–767.
Ryan M.G., Lavigne M.B., Gower S.T. Annual carbon cost of autotrophic respiration in boreal forest ecosystems in relation to species and climate // J. Geophys. Res. 1997. V. 102(D24). P. 28871–28884.
Ryan M.G., Law B.E. Interpreting, measuring, and modeling soil respiration. Biogeochem. 2005. V. 73. P. 3–27. https://doi.org/10.1007/s10533-004-5167-7.
Skre O. CO2 exchange in Norwegian tundra plants studied by infrared gas analyzer technique. Fennoscandian tundra ecosystems. Part 1: Plants and microorganisms / Ed. F.E. Wielgolaski Berlin, Heidelberg, N.Y. Springer, 1975. P. 168–183.
Sparling G.P., Feltham C.W., Reynolds J., West W., Singleton P. Estimation of soil microbial C by a fumigation-extraction method: use on soils of high organic matter content, and a reassessment of the kec-factor // Soil Biol. Biochem. 1990. V. 22(3). P. 301–307.
Subke J.A., Inglima I., Cotrufo M.F. Trends and methodological impacts in soil CO2 efflux partitioning: A metaanalytical review // Global Change Biol. 2006. V. 12. P. 921–943. doi 10.1111/j.1365-2486.2006.01117.x
Uchida M., Nakatsubo T., Horikoshi T., Nakane K. Contribution of micro-organisms to the carbon dynamics in black spruce (Piceamariana) forest soil in Canada // Ecol. Res. 1998. V. 13. P. 17–26.
Xu X., Inubushi K., Sakamoto K. Effect of vegetations and temperature on microbial biomass carbon and metabolic quotients of temperate volcanic forest soils // Geoderma. 2006. V. 136. P. 310–319. https://doi.org/ 10.1016/j.geoderma.2006.03.045.
Дополнительные материалы отсутствуют.