Почвоведение, 2019, № 3, стр. 317-329
Молекулярная структура гумусовых веществ мерзлотных бугристых торфяников лесотундры
Р. С. Василевич 1, *, В. А. Безносиков 1, Е. Д. Лодыгин 1
1 Институт биологии Коми научного центра Уральского отделения РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: vasilevich.r.s@ib.komisc.ru
Поступила в редакцию 06.02.2017
После доработки 19.02.2018
Принята к публикации 26.09.2018
Аннотация
Впервые с использованием современных физико-химических методов анализа (13С ЯМР, ЭПР спектроскопия) дана характеристика молекулярной структуры гумусовых веществ из мерзлотных бугристых торфяников лесотундровой подзоны европейского Северо-Востока России. Структурно-функциональные параметры гумусовых веществ исследованных почв определяются совокупным действием криогенных процессов в сезонно-талом слое, естественным отбором ароматических структур в процессе гумификации, видовым составом и степенью разложения торфа, что является отражением климатических условий торфообразования в голоцене. Гуминовые кислоты торфяников представлены слабоконденсированными молекулярными структурами с низкой долей атомов углерода ароматических компонентов, увеличивающейся вниз по профилю и высоким содержанием неокисленных алифатических фрагментов. Интенсивные изменения доли ароматических и неокисленных алифатических фрагментов на границе сезонно-талого слоя почв оголенных торфяных пятен могут послужить дальнейшей основой для поиска биомаркеров изменения современных климатических условий.
ВВЕДЕНИЕ
Болотные экосистемы Арктики находятся в экстремальных условиях и играют ключевую роль в глобальных процессах связывания углерода и регенерации кислорода, поддержания водного баланса, сохранения биологического разнообразия на обширных территориях тундровых ландшафтов. Высокоширотные торфяные экосистемы, расположенные на севере России, особенно чувствительны к изменениям климата. Таяние многолетней мерзлоты и последующее высвобождение углерода может оказать воздействие на глобальное изменение климата вследствие потенциального выброса большого количества парниковых газов от торфяных месторождений [51, 59]. Общеизвестно, что функциональная роль гумусовых веществ (ГВ) заключается в регуляции устойчивости почв, способствуя сохранению торфяных отложений от деградации [26]. Состав ГВ торфяников является характеристическим показателем, отражающим климатические условия периода его формирования. Это связано с составом ботанического и палинологического материала в периоды голоцена [16]. Различный состав фитоценозов определяет структурно-функциональные параметры ГВ стратифицированных слоев торфа. Содержание функциональных групп и молекулярных фрагментов ГВ торфа зависит от его ботанического состава и степени разложения исходных растительных остатков. Соотношения алифатических и ароматических фрагментов, как правило, связаны с типами и видами торфов, а содержание кислородсодержащих карбоксильных и фенольных групп указывает на степень гумификации растительного опада [22–24, 43, 57]. В жестких условиях промерзания и слабой интенсивности микробиологической деятельности почв лесотундры протекают процессы, связанные с криогенной денатурацией и трансформацией дисперсных ГВ. В результате промораживания почв происходят изменения как в фракционно-групповом, так и в качественном состоянии гумуса, изменяются его коллоидно-химические свойства [2]. Ряд исследователей пришли к заключению, что чередование промораживания и оттаивания повышает подвижность ГВ за счет увеличения дисперсности их молекул [9]. Изменения условий окружающей среды, имеющие как сезонный характер, так длительную временную динамику, связанную, например, с изменением климата имеют последствия в изменении состава ГВ почв. Эти изменения должны наиболее отчетливо прослеживаться на верхней профильной границе многолетней мерзлоты.
Многочисленными экспериментами в области изучения органического вещества почв доказана огромная роль свободных радикалов (СР) семихиноидного типа в биохимических процессах [36, 38, 45]. На концентрацию свободных радикалов в гумусовых соединениях сильное влияние оказывают как различные зональные биоклиматические факторы, так и деятельность человека [32, 33, 41, 46]. По современным представлениям эти радикалы являются непосредственными промежуточными участниками ступенчатого окислительно-полимеризационного процесса гумусообразования, свободнорадикальная активность – фундаментальное свойство ГВ [12, 35, 49].
Изменение климата и риски, обусловленные крупными инфраструктурными проектами развития арктического сектора, связанные с нефтегазовым комплексом, ведут к изменению гидрологии арктических болот и необратимым нарушениям торфяных слоев. Как следствие, это приводит к таянию или исчезновению мерзлоты и увеличению выбросов парниковых газов. Комплексная оценка трансформации специфических органических соединений позволит сделать значительный шаг к оценке устойчивости экологических систем Арктики и Субарктики, а по их изменению выявить влияние изменения климата на их структурно-функциональные параметры.
Цель работы: исследование молекулярного строения гумусовых веществ бугристых торфяников лесотундры и выявление индикаторов, маркирующих климатические изменения в голоцене.
ОБЪЕКТЫ И МЕТОДЫ
Методы исследований. Отбор и пробоподготовка торфа проведены согласно ГОСТ 17644-83, ГОСТ 11306-2013. Общее содержание липидной фракции торфа определены экстракцией смесью спирт–бензол по Е.В. Фридланду [27]. Препараты гуминовых (ГК) и фульвокислот (ФК) выделены из образцов торфа по методике, широко используемой Международным обществом по изучению гумусовых веществ IHSS [53]. Для всех исследованных образцов ГВ доля гигроскопической влаги составляла около 7%, зольность – менее 2%. Спектры 13С ЯМР воздушно-сухих препаратов ГК и ФК регистрировали на ЯМР спектрометре JNM-ECA 400 (JEOL, Япония) с рабочей частотой 100.53 МГц с использованием твердофазной методики CP/MAS (кросс-поляризация с вращением под “магическим” углом). Частота вращения образца 6 кГц, время контакта 5 мс, время релаксации 5 с, количество накоплений 13 000 сканов. Несмотря на ряд известных проблем, которые ограничивают использование CP/MAS методики в качестве количественного инструмента измерения [42], данная техника позволяет проводить полуколичественную оценку и сравнительный анализ содержания атомов углерода различных функциональных групп и молекулярных фрагментов в структуре однотипных соединений при условии контроля времени контакта и релаксации при исследовании серии однотипных образцов [37, 48].
Химические сдвиги представлены относительно тетраметилсилана со сдвигом 0 ppm, в качестве стандарта использовали пик адамантана (в слабом поле) при 38.48 ppm. Для обработки спектров использовали метод Фурье-преобразования с последующей корректировкой базовой линии. Для количественной обработки применялось численное интегрирование по областям, соответствующим расположению функциональных групп и молекулярных фрагментов, с использованием программы Delta v. 5.0.2. (JEOL, Япония) согласно [28, 46].
Регистрацию спектров ЭПР проводили при комнатной температуре на спектрометре JES FА 300 (JEOL, Япония) в X-диапазоне. Условия измерения: СВЧ мощность 1 мВт, амплитуда высокочастотной модуляции 0.06 мТл. В качестве внешнего стандарта использовали марганец с известным содержанием радикалов. Концентрацию парамагнитных центров (ПМЦ) в образцах определяли методом сравнения относительных интенсивностей сигналов образца и стандарта с помощью программы JES-FA swESR v. 3.0.0.1 (JEOL, Япония). Абсолютная ошибка определения концентрации свободных радикалов методом ЭПР составляет до 20% [6].
Инструментальные измерения температур торфяных горизонтов проводили с помощью цифровых логгеров HOBO, установленных на глубине 0, 10, 20, 50 см и запрограммированных на 24 измерения в сутки. Ботанический состав и степень разложения торфа определены в лаборатории болотных экосистем Института биологии Кар НЦ РАН. Радиоуглеродное датирование торфяных слоев было проведено в ЦКП “Лаборатория радиоуглеродного датирования и электронной микроскопии” Института географии РАН (лабораторный индекс ИГ РАН). Измерение активности радиоуглерода производили на ультранизкофоновом жидкосцинтилляционном альфа/бета спектрометре-радиометре Quantulus 1220 (PerkinElmer, Финляндия). Калибровка выполнена согласно Radiocarbon calibration program calib rev 7.1.0, погрешность метода датировки не превышает 70–80 лет для каждой даты [19, 30]. Статистическая обработка результатов проведена с использованием программного пакета Statistica 6.1.
Объекты исследований. Изучаемая территория расположена в северной лесотундре (бассейн р. Сейда, входящий в Печорский речной бассейн) Воркутинского района Республики Коми. На территории района распространена островная многолетняя мерзлота. Климат умеренно континентальный, среднегодовая температура воздуха по метеостанции г. Воркута (сезон 2014–2015) – –4.0°С, (сезон 2015–2016) – –2.0°С, среднесуточная сумма положительных температур – 1150–1380°С, среднегодовое количество осадков – 550–600 мм.
В качестве объектов исследования выбраны почвы бугристо-мочажинного комплекса: сухоторфяная мерзлотная почва бугров (Cryic Histosol) (разр. 2014-1) и почва оголенных торфяных пятнен (Cryic Histosol (Turbic)) (разр. 2014-2). Послойный отбор проб проведен до глубины 2.0 м. Верхняя граница многолетней мерзлоты в летнее время находится на глубине 40–60 см. Торф по всей толще темно-коричневый, средней и высокой степени разложения, перегнойного типа. Растительный покров на буграх представлен комплексом морошково-багульниково-мохово-лишайниковых растительных сообществ. Покров на вершинах бугров часто бывает нарушен – обнажается черный торф под влиянием ветровой эрозии и морозной корразии, криогенных процессов. Общая площадь оголенных торфяных пятен составляет около 8% от площади исследуемого бугристо-мочажинного комплекса. Генетические особенности формирования исследованных торфяных почв подробно описаны Кавериным, Пастуховым [11].
Физико-химическая характеристика разрезов и ботанический состав торфа приведены в табл. 1, морфологическое описание и температурные режимы и подробный видовой состав торфообразователей исследованных почв представлены ранее [4].
Таблица 1.
Физико-химические характеристики и ботанический состав торфа
| Глубина, см | Тип, вид торфа | Степень разложения, % | Зольность, % | pH водный | C/N | Массовая доля, % | |
|---|---|---|---|---|---|---|---|
| ГК | липиды | ||||||
| Разрез 2014-1 | |||||||
| 0–10 | Верховой (В) политриховый | 20–25 | 5.4 | 3.75 | 30.1 | 16.6 | 10.9 |
| 10–20 | Кустарничковый В | 35–40 | 5.9 | 3.70 | 24.5 | 24.8 | 13.9 |
| 20–40 | Низинный (Н) осоково-пушицевый | 30–40 | 4.2 | 3.74 | 21.4 | 21.8 | 13.9 |
| 40–60 | Березовый Н мерзлый | 30–35 | 6.4 | 4.34 | 32.0 | 26.9 | 14.7 |
| 60–80 | Вахтово-осоковый Н мерзлый | 30–35 | 33.1 | 4.86 | 22.4 | 11.2 | 6.8 |
| 80–100 | Древесно-осоковый Н мерзлый | 35–40 | 16.6 | 4.94 | 26.8 | 3.9 | –* |
| 100–150 | Древесно-осоковый Н мерзлый | 30–40 | 47.5 | 4.95 | 22.2 | 2.4 | – |
| 150–175 | Древесно-осоковый Н мерзлый | 35–40 | 54.7 | 5.37 | 22.0 | 4.1 | – |
| 175–200 | Древесно-травяной Н мерзлый | 50 | 86.3 | 5.33 | 17.2 | 3.4 | – |
| Разрез 2014-2 | |||||||
| 0–5 | Верховой (В) политриховый | 20–25 | 8.0 | 3.61 | 28.7 | 27.6 | 15.7 |
| 5–20 | Переходный (П) кустарничково-пушицевый | 40–45 | 4.9 | 3.42 | 25.5 | 24.1 | 7.8 |
| 20–40 | Осоковый Н | 30–35 | 4.6 | 3.66 | 26.6 | 14.2 | 3.4 |
| 40–60 | Гипново-осоковый Н | 30–50 | 14.1 | 4.24 | 23.6 | 8.5 | 3.0 |
| 60–80 | Кустарничково-осоковый Н мерзлый | 35–40 | 54.3 | 5.05 | 25.0 | 3.8 | 3.5 |
| 80–100 | Осоковый Н мерзлый | 35 | 44.9 | 5.00 | 24.1 | 3.4 | 2.8 |
| 100–150 | Древесно-осоковый Н мерзлый | 35–40 | 65.1 | 5.47 | 23.4 | 5.0 | 2.6 |
| 150–175 | Древесно-осоковый Н мерзлый | 40–45 | 76.9 | 5.32 | 21.0 | 1.9 | 1.8 |
| 175–200 | Хвощово-древесный Н мерзлый | Более 50 | 88.2 | 5.51 | 18.6 | 4.3 | – |
Разр. 2014-1 – сухоторфяная мерзлотная почва бугров. Координаты: 67°03′ с. ш. 62°56′ в. д. Почва описана в 7 км к юго-западу от ст. Сейда. Моренная пониженная равнина. Разрез заложен на бугре, диаметр 12 м. В растительном покрове водяника, брусника, голубика, морошка, политрихум, карликовая береза по краям бугра.
Разр. 2014-2 – почва оголенных торфяных пятен. Координаты: 67°03′ с. ш., 62°56′ в. д. Пятно без растительности диметром 5 м на восточной части плоского торфяного бугра. На поверхности криогенное растрескивание и пучение верхнего горизонта, фрагменты коры карликовой березы. Край пятна покрыт лишайниками и зелеными мхами.
Начало торфонакопления приходится на ранний атлантический период (табл. 2). Заболачиванию подвергся облесенный елью и березой участок с господством эвтрофных сообществ: Equisetum, Carex cespitosa, Menyanthes и др. при отсутствии вечной мерзлоты. Резкое похолодание и уменьшение увлажнения среднего суббореала и раннего субатлантика 3754–1357 кал. л. н. (ИГРАН 4641, 4640) привело к образованию многолетней мерзлоты [50] и к доминированию в составе растительного покрова представителей мезотрофного (Betula nana, Eriophorum), а затем и олиготрофного сообществ: бриевых мхов, лишайников и кустарничков.
Таблица 2.
Хронология тундрового бугристого торфяника с соответствующими калиброванными возрастами
| Профиль, № ИГ РАН | Глубина, см | Радиоуглеродный возраст, лет назад, BP | Калиброванный возраст, cal BP, лет назад | |
|---|---|---|---|---|
| медиана | 1 σ диапазон | |||
| 2014-1, 4640 | 0–10 | 1450 ± 70* | 1357 | 1295–1403 |
| 2014-1, 4641 | 20–30 | 3480 ± 70 | 3754 | 3644–3665 |
| 2014-1, 4642 | 40–60 | 5230 ± 80 | 6011 | 5913–6026 |
| 2014-1, 4643 | 60–80 | 5680 ± 80 | 6473 | 6352–6366 |
| 2014-1, 4644 | 80–100 | 5710 ± 80 | 6508 | 6409–6567 |
| 2014-1, 4645 | 125–150 | 6130 ± 80 | 7022 | 6937–7158 |
| 2014-1, 4646 | 175–200 | 7160 ± 80 | 7984 | 7868–7898 |
| 2014-2, 4647 | 0–10 | 1310 ± 70 | 1231 | 1179–1298 |
| 2014-2, 4648 | 20–30 | 4720 ± 70 | 5457 | 5326–5389 |
| 2014-2, 4649 | 40–50 | 5270 ± 80 | 6062 | 5942–5973 |
Степень гумификации органического вещества в большей степени связана с температурными режимами почв в теплый период года. Анализ температурных режимов исследованных почв показал, что в летний период почвы оголенных торфяных пятен прогреваются интенсивнее, сумма положительных температур для слоев торфа с глубины 10 см выше в 2–5 раз. В вегетационный период по профилю этих почв биологически активные температуры (>10°С) достигают глубин 20 см. Почвы оголенных торфяных пятен имеют более низкую сумму отрицательных температур в осенне-зимний периоды, вследствие отсутствия термоизолирующего мохового слоя, по сравнению сухоторфяными мерзлотными почвами бугров под растениями [4].
До верхней границы многолетней мерзлоты (40–60 см) образцы торфа кислые с pH 3.5–3.9 с зольностью 3.8–6.0%. Химический состав нижележащих слоев торфа характеризуется высокой долей обменных кальция и магния, определяющих бóльшие значения pH, увеличивающиеся в нижней части массива до 5.5, высокое содержание валового Fe и Al (до 3%) и Ca (до 1%) определяет высокую зольность торфа. Фракционно-групповой состав гумуса определяется значительным превалированием гуминовых кислот над фульвокислотами. Массовая доля первых достигает максимума в верхних торфяных горизонтах (до 27.6% от сухого веса образца торфа) и постепенно уменьшается к почвообразующей породе. Расчет критериев Вилкоксона показал отсутствие значимых различий в степени разложения торфа (p = 0.051), pH (p = 0.86), соотношения C/N (p = = 0.95) для двух исследованных разрезов. Таким образом, по исследованным характеристикам почвы оголенных торфяных пятен однотипны сухоторфянным мерзлотным почвам бугров и отличаются только по температурным режимам сезонно-талого слоя (СТС), что может служить модельной основой прогноза изменения структурно-функциональных параметров гумусовых веществ при изменении современных климатических параметров [4].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Структурно-функциональный состав торфа и гумусовых веществ бугристых торфяников лесотундры по данным 13С ЯМР спектроскопии. Исследуемые ГВ тундровых торфяников, а также образцов торфа имеют характерные спектры поглощения: углеводных, незамещенных алифатических фрагментов, углерода карбоксильных групп и атомов ароматического углерода (рис. 1). Сопоставление 13С ЯМР спектров гуминовых и фульвокислот показывает бóльшую интенсивность линий ГК, соответствующую парафиновым, метокси- и аминогруппам, ароматическим фрагментам и меньшую – углеводным фрагментам. Результаты измерения методом 13С ЯМР спектроскопии содержания функциональных групп и молекулярных фрагментов и интегральные показатели образцов торфа и ГВ приведены в табл. 3, 4.
Рис. 1.
CP/MAS 13С ЯМР спектры препаратов ГК сухоторфяной мерзлотной почвы бугров (А) и почвы оголенных торфяных пятен (Б).
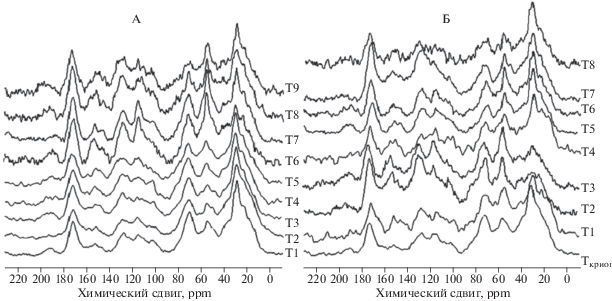
Таблица 3.
Относительная доля углерода функциональных групп (%) и молекулярных фрагментов торфа по данным 13С ЯМР спектроскопии
| Горизонт, глубина, см | Химический сдвиг, ppm | Интегральные показатели | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| AR/AL* | fa**, % | |||||||||
| 0–47 | 47–60 | 60–108 | 108–144 | 144–164 | 164–183 | 183–190 | 190–204 | |||
| алкиль-ные | O,N-алкильные | ароматические | карбо-ксильные | хинон-ные | карбо-нильные | |||||
| Разрез 2014-1 | ||||||||||
| Т1, 0–10 | 36.8 | 0.9 | 55.5 | 1.7 | 0.7 | 4.2 | 0.0 | 0.1 | 0.02 | 2.4 |
| Т2, 10–20 | 47.6 | 1.1 | 44.4 | 1.2 | 0.7 | 5.0 | 0.1 | 0.0 | 0.02 | 2.0 |
| Т3, 20–40 | 54.1 | 1.5 | 37.4 | 0.9 | 0.2 | 5.4 | 0.2 | 0.2 | 0.01 | 1.3 |
| Т4, 40–60 | 57.4 | 1.8 | 34.8 | 1.6 | 0.2 | 3.7 | 0.1 | 0.3 | 0.02 | 1.9 |
| Т5, 60–80 | 61.3 | 1.3 | 30.5 | 1.5 | 0.8 | 4.6 | 0.0 | 0.2 | 0.02 | 2.3 |
| Разрез 2014-2 | ||||||||||
| Ткриог, 0–5 | 50.6 | 4.1 | 33.2 | 5.8 | 1.2 | 4.9 | 0.0 | 0.2 | 0.08 | 7.1 |
| Т1, 5–20 | 33.1 | 2.1 | 49.5 | 6.6 | 2.6 | 5.3 | 0.2 | 0.5 | 0.10 | 9.4 |
| Т2, 20–40 | 40.1 | 4.7 | 40.1 | 5.6 | 4.0 | 5.2 | 0.0 | 0.2 | 0.11 | 9.6 |
| Т3, 40–60 | 32.9 | 2.5 | 45.2 | 7.0 | 7.1 | 4.7 | 0.30 | 0.3 | 0.17 | 14.4 |
| Т4, 60–80 | 30.7 | 5.4 | 48.2 | 5.7 | 4.5 | 5.2 | 0.24 | 0.1 | 0.12 | 10.4 |
Таблица 4.
Относительная доля углерода функциональных групп (%) и молекулярных фрагментов ГК и ФК по данным 13С ЯМР спектроскопии
| Горизонт, глубина, см | Химический сдвиг, ppm | Интегральные показатели | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| AR/AL* | fa**, % |
|||||||||
| 0–47 | 47–60 | 60–108 | 108–144 | 144–164 | 164–183 | 183–190 | 190–204 | |||
| алкиль-ные | O,N-алкильные | ароматические | карбо-ксильные | хинон-ные | карбо-нильные | |||||
| Разрез 2014-1 Гуминовые кислоты |
||||||||||
| Т1, 0–10 | 40.4 | 10.4 | 22.0 | 13.6 | 3.9 | 8.4 | 0.3 | 1.0 | 0.22 | 17.8 |
| Т2, 10–20 | 46.6 | 10.5 | 20.3 | 11.2 | 3.8 | 7.4 | 0.2 | 0.1 | 0.18 | 15.2 |
| Т3, 20–40 | 37.6 | 10.2 | 22.2 | 15.4 | 5.3 | 8.3 | 0.3 | 0.7 | 0.27 | 21.0 |
| Т4, 40–60 | 35.5 | 10.4 | 23.2 | 16.9 | 4.9 | 7.7 | 0.7 | 0.7 | 0.29 | 22.5 |
| Т5, 60–80 | 35.6 | 11.4 | 22.1 | 16.9 | 4.8 | 7.5 | 0.9 | 0.9 | 0.29 | 22.6 |
| Т6, 80–100 | 30.4 | 14.5 | 20.4 | 19.4 | 5.3 | 7.9 | 1.1 | 1.0 | 0.35 | 25.8 |
| Т7, 100–150 | 34.8 | 15.8 | 21.5 | 16.0 | 3.1 | 8.0 | 0.5 | 0.2 | 0.24 | 19.6 |
| T8, 150–175 | 32.1 | 11.9 | 19.9 | 20.7 | 5.9 | 8.8 | 0.2 | 0.6 | 0.36 | 26.7 |
| T9, 175–200 | 33.2 | 12.2 | 18.5 | 20.6 | 5.1 | 9.1 | 0.1 | 1.4 | 0.35 | 25.8 |
| Фульвокислоты | ||||||||||
| Т1, 0 –10 | 12.1 | 6.6 | 74.0 | 1.6 | 0.0 | 5.7 | 0.0 | 0.0 | 0.02 | 1.6 |
| Т2, 10–20 | 7.1 | 4.5 | 80.1 | 2.3 | 0.1 | 5.7 | 0.0 | 0.1 | 0.02 | 2.3 |
| Т3, 20–40 | 11.7 | 7.2 | 72.4 | 3.0 | 0.1 | 5.5 | 0.0 | 0.1 | 0.03 | 3.1 |
| Т4, 40–60 | 9.8 | 5.0 | 64.7 | 10.2 | 2.2 | 6.7 | 0.5 | 1.0 | 0.15 | 12.8 |
| Т5, 60–80 | 16.2 | 9.0 | 61.2 | 4.5 | 1.0 | 7.3 | 0.1 | 0.6 | 0.06 | 5.6 |
| Т6, 80–100 | 10.7 | 5.0 | 70.8 | 3.4 | 0.2 | 9.6 | 0.0 | 0.2 | 0.04 | 3.6 |
| Т7, 100–150 | 15.3 | 10.0 | 61.9 | 3.1 | 0.5 | 9.1 | 0.0 | 0.1 | 0.04 | 3.6 |
| T8, 150–175 | 14.5 | 7.7 | 55.0 | 9.2 | 2.2 | 11.1 | 0.0 | 0.2 | 0.13 | 11.4 |
| T9, 175–200 | 16.9 | 10.1 | 56.4 | 3.7 | 0.8 | 11.5 | 0.0 | 0.5 | 0.05 | 4.5 |
| Разрез 2014-2 Гуминовые кислоты |
||||||||||
| Ткриог, 0–5 | 40.8 | 10.9 | 22.2 | 14.0 | 2.9 | 8.5 | 0.1 | 0.5 | 0.20 | 17.0 |
| Т1, 5–20 | 36.1 | 12.6 | 24.0 | 14.9 | 4.7 | 7.5 | 0.1 | 0.2 | 0.25 | 19.7 |
| Т2, 20–40 | 19.0 | 8.9 | 24.6 | 25.1 | 10.8 | 9.7 | 0.4 | 1.5 | 0.57 | 36.3 |
| Т3, 40–60 | 20.7 | 12.6 | 23.5 | 25.1 | 7.5 | 8.7 | 0.9 | 1.1 | 0.50 | 33.4 |
| Т4, 60–80 | 39.3 | 12.2 | 22.8 | 14.2 | 5.0 | 6.1 | 0.2 | 0.1 | 0.24 | 19.5 |
| T5, 80–100 | 38.4 | 12.6 | 18.0 | 17.0 | 3.5 | 8.0 | 0.9 | 1.6 | 0.27 | 21.4 |
| T6, 100–150 | 38.0 | 13.4 | 18.8 | 16.1 | 2.7 | 8.3 | 1.3 | 1.5 | 0.25 | 20.1 |
| T7, 150–175 | 27.6 | 9.4 | 17.2 | 25.3 | 9.3 | 10.3 | 0.0 | 1.0 | 0.53 | 34.5 |
| T8, 175–200 | 39.8 | 10.2 | 16.7 | 17.3 | 4.8 | 10.0 | 0.3 | 0.9 | 0.29 | 22.4 |
| Фульвокислоты | ||||||||||
| Ткриог, 0–5 | 11.2 | 6.8 | 69.8 | 4.6 | 0.4 | 6.8 | 0.2 | 0.2 | 0.06 | 5.2 |
| Т1, 5–20 | 17.2 | 8.6 | 59.0 | 4.6 | 1.1 | 8.7 | 0.1 | 0.7 | 0.06 | 5.8 |
| Т2, 20–40 | 24.2 | 8.9 | 54.0 | 5.8 | 0.7 | 6.1 | 0.0 | 0.2 | 0.07 | 6.5 |
| Т3, 40–60 | 18.2 | 7.9 | 61.1 | 2.5 | 1.3 | 8.1 | 0.0 | 0.9 | 0.04 | 3.8 |
| Т4, 60–80 | 18.3 | 8.1 | 55.8 | 6.8 | 1.6 | 9.4 | 0.0 | 0.1 | 0.09 | 8.3 |
| T5, 80–100 | 15.0 | 7.9 | 57.9 | 3.4 | 1.2 | 12.4 | 0.5 | 1.8 | 0.05 | 5.1 |
| T6, 100–150 | 15.4 | 8.8 | 59.2 | 3.0 | 1.3 | 10.6 | 0.5 | 1.3 | 0.05 | 4.8 |
| T7, 150–175 | 17.9 | 9.8 | 47.4 | 8.4 | 1.4 | 14.3 | 0.0 | 0.8 | 0.11 | 9.8 |
| T8, 175–200 | 14.9 | 9.4 | 59.3 | 3.6 | 0.4 | 12.1 | 0.0 | 0.3 | 0.04 | 4.0 |
Анализ 13С ЯМР спектров большинства препаратов ГК и образцов торфа обнаруживает наибольшую интенсивность сигнала в диапазоне 0–47 ppm, относимую резонансным колебаниям углерода незамещенных алифатических фрагментов. Высокая доля атомов алифатического углерода ГК связана с накоплением продуктов растительного происхождения – воскосмол, гликолипидов, фосфолипидов, кутина, жирных кислот [56, 58]. Метильные группы, относимые к области (15–18 ppm) по мнению [40] приурочены к высокоразветленным алифатическим фрагментам. Наиболее интенсивные линии области 29–33 ppm могут быть отнесены к метиленовым атомам углерода длинных линейных цепочек углеводородов [13, 52]. Область 35–47 ppm связана с наличием атомов углерода коротких алифатических цепей [55].
Основной вклад в резонанс атомов углерода диапазона 47–60 ppm с максимумом при 56 ppm связан с метокси-группами, в первую очередь присутствующими в составе лигниновых фрагментов – сирингил- и гваяцилпропановых единиц [13, 54]. В этой области спектра также резонируют α- и β-углеродные атомы аминокислотных фрагментов [42, 44, 55].
Наиболее интенсивный пик области 60–108 с максимумом при 70–71 ppm в 13С ЯМР спектрах относится к CH(О)-группам кольцевых атомов и принадлежит к целлюлозным или другим углеводным фрагментам [42, 52]. Также в спектрах 13С ЯМР большинства ГК были идентифицированы сигналы при 62 ppm, относимые к CH2O-группам гексоз из полисахаридных фрагментов [39]. Этот пик имеет большую интенсивность в составе препаратов ФК. В структуре ФК по данным 13С ЯМР проявляется интенсивный сигнал 101 ppm аномерных (ацетальных) атомов углерода, также принадлежащий структурным фрагментам полисахаридов [58]. В области 108–144 ppm резонируют незамещенные и/или алкилзамещенные ароматические атомы углерода, а в области 144–164 ppm – их аналоги, замещенные группами –ОН, –NH2, –OCH3. Пики 128 и 137 ppm одиночных ароматических колец связаны с остальной частью макромолекулы через алифатические цепочки или мостики [31]. Сигнал при 147–149 ppm типичен в спектрах структурных блоков лигнина и его относят к кислородзамещенным атомам углерода ароматических колец – сирингил- и гваяцилпропановых единиц [13, 42]. 13С ЯМР спектры ГК имеют более интенсивные сигналы в этой области по сравнению с ФК. В области (164–183 ppm) наблюдается максимум при 172–174 ppm, в значительной степени относимый к углероду карбоксильных групп, но также он может принадлежать и карбонил-группе амидов и полипептидов [17, 42]. Атомы углерода хинонных фрагментов и карбонильных групп альдегидов и кетонов вносят свой вклад в очень слабые сигналы в области 183–190 и 190–204 ppm соответственно.
13С ЯМР анализ состава образцов торфа двух исследованных разрезов демонстрирует значительный вклад веществ и фрагментов алифатической природы. Доля парафиновых структур достигает 61%, углеводных фрагментов 56%. Эти компоненты преобладают в составе торфообразующих бриофитов и кустарничков [43]. Несмотря на однотипность ботанического состава, распределение молекулярных групп и фрагментов для двух почв имеет значительные отличия (табл. 3). Степень ароматичности образцов торфа почв оголенных торфяных пятен обусловлена преимущественно составом ГК, доля которых на границе сезонно-талого слоя в 1.5–5.0 раз выше по сравнению с почвами под растительным покровом. В составе почв оголенных торфяных пятен более значительна доля окисленных “лигниновых” ароматических структур и метокси-групп.
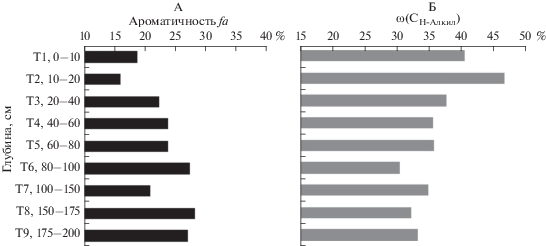
13С ЯМР анализ структурных фрагментов выявил высокую долю неокисленных алифатических фрагментов в молекулах ГВ. Минимальная интенсивность сигнала диапазона 0–47 ppm наблюдается для препаратов ГК слоя 40–60 см разреза 2014-2 на границе многолетней мерзлоты, максимальная – для ГК верхних слоев торфа (рис. 2Б, рис. 3Б). Анализ данной области спектра показывает, что наибольшую интенсивность сигналов имеют линии, обусловленные атомами углерода неразветвленных алифатических фрагментов. Вниз по стратифицированному профилю вклад разветвленных структур в общую структуру молекул возрастает, особенно для ГК на границе СТС почв оголенных торфяных пятен (рис. 1).
Рис. 2.
Показатели состава ГК почв оголенных торфяных пятен: степень ароматичности (А) и доля неокисленных алифатических фрагментов (Б).

Рис. 3.
Показатели состава ГК сухоторфяной мерзлотной почвы бугров (13С ЯМР): степень ароматичности (А) и доля неокисленных алифатических фрагментов (Б).
Собственные данные 13С ЯМР спектроскопии липидной фракции гумуса данных почв показывают наличие лишь одного интенсивного пика 29–33 ppm длинных линейных алифатических цепей. Накопление алифатических фрагментов в структуре ГВ обусловлено фракцией свободных насыщенных и ненасыщенных жирных кислот (смол) и сложных эфиров (восков) растений в северных условиях [14, 20, 25]. Основная масса липидов (достигающая 15.7%) в исследованных торфяных почвах приходится на верхние слои торфа (табл. 1), что обусловливает наибольший вклад парафиновых структур в составе молекул ГВ политрихового и кустарничковых видов торфа. Это хорошо согласуется с данными литературы [15, 43]. В процессе торфообразования содержание липидной фракции способно к уменьшению до 10 раз [21]. В результате гумификации происходит частичная трансформация линейной структуры с появлением более стерически разветвленных молекулярных ансамблей парафиновых фрагментов, что напрямую связано с биологической активностью торфяных почв [7].
Анализ относительного содержания структурных фрагментов в препаратах ГВ выявил низкую долю атомов углерода ароматических компонентов, составляющую от 15.2 до 36.3% для ГК, от 1.6 до 12.8% для ФК, при этом характеры распределения данного показателя для двух разрезов имеют существенные отличия. Оценка содержания функциональных групп и молекулярных фрагментов в ГК сухоторфяных мерзлотных почв свидетельствует о различии их молекулярного состава при переходе от верхних к нижним слоям торфа и характеризуется увеличением доли ароматических фрагментов и метокси-групп и уменьшением относительной доли парафиновых групп (рис. 3). Это является прямым отражением взаимосвязи структурно-функциональных параметров ГК с климатическими параметрами в голоцене, указывая на более теплые периоды их формирования [4]. Наблюдается тренд, проявляющийся в снижении доли окисленных фрагментов, в составе ароматических структур ГК (рис. 4).
Рис. 4.
Показатели состава ГК сухоторфяной мерзлотной почвы бугров (13С ЯМР): степень окисленности ароматических фрагментов (А) и доля углеводных фрагментов (Б).

В пределах СТС почвы оголенных торфяных пятен относительная доля ароматических фрагментов ГК значительно увеличивается с глубиной. Динамические процессы оттаивания и замерзания на границе многолетней мерзлоты почв оголенных торфяных пятен, вероятно, определяют более высокую ароматичность и меньшую долю неокисленных алифатических фрагментов ГК на границе СТС (рис. 2). Эти показатели коррелируют с данными элементного состава и ИК-спектроскопии, показывающими большую конденсированность молекул этих препаратов [4]. Как показали исследования Арчеговой [2] при вымораживании растворов ГВ происходит их перераспределение по степени сложности, связанное с мерзлотной деструкцией исходных молекул за счет расклинивающего действия пленок замерзающей воды. В результате трансформации макромолекул ГК и отщепления от них наиболее лабильных фрагментов происходит увеличение доли ФК и степени ароматичности исходных ГК.
Поскольку почвы оголенных торфяных пятен лучше прогреваются в период метеорологического лета, это определяет более высокую степень разложения торфа, возрастающую от верхних горизонтов до границы СТС с 20–25 до 45–50%, соответственно при этом увеличивается доля осок в составе торфообразователей – до 55%. Для почв, сформированных под растительным покровом, степень разложения несколько меньше: от 20–25 до 30–35% соответственно. Именно с этими показателями связана более глубокая гумификация органического материала в акротельме почв оголенных торфяных пятен, продолжающаяся, вероятно, со времени формирования многолетней мерзлоты территории 2000–2500 лет назад [50]. Важно отметить, значительные отличия структурно-функциональных параметров гуминовых кислот СТС двух исследуемых почв, напрямую связанных с образованием оголенных пятен на поверхности почв – современный процесс и вероятно, произошедший несколько сот лет назад [5]. Полевые эксперименты Савельевой с соавт. [22], а также данные Инишевой с соавт. [10] свидетельствуют, что процесс гумификации осоковых видов торфа протекает наиболее быстро и начинается еще в торфообразователях и диагностируется в усилении сигналов от ароматических атомов углерода (по данным 13С ЯМР спектроскопии). Из вышесказанного следует, что сезонно-талый слой мерзлотных торфяников представляет современный этап преобразования органического материала, наиболее активно проявляющийся для разреза почв без растительного покрова. Высокие показатели суммы положительных и биологически активных температур почв оголенных торфяных пятен, по сути, моделируют современное потепление климата, ведут к существенной трансформации структурно-функциональных параметров гумусовых веществ.
Низкая дифференциация показателей состава гумусовых веществ ниже границы СТС связана с тем, что интенсивное торфонакопление в периоды раннего и среднего голоцена приводило к перекрыванию торфогенных горизонтов (катотельм) новыми слоями (акротельм). Дальнейший распад органического материала сильно замедлялся, сохраняя почти ту же степень разложения торфа. Таким образом, нижние слои оказывались своего рода погребенными почвами с затухающими почвенными процессами [29], которые полностью прекратились с образованием многолетней мерзлоты в суббореальный период. Для исследованного реликтового торфяного слоя 150–175 см обнаружены интенсивные максимумы содержания ароматических фрагментов, как ГК, так и ФК (табл. 4, рис. 2–3), приходящиеся на период голоценового оптимума [49] около 7000 кал. л. н. (ИГРА-Н 4645, 4646), отражая наиболее теплый климатический период своего формирования.
Состояние лабильных компонентов в структуре ГВ связано со слабой биологической активностью и восстановительными режимами торфяников. Органическое вещество, находясь в законсервированном состоянии, трансформируется крайне медленно. Доля лабильных углеводных фрагментов в структуре ГК имеет слабый тренд уменьшения с глубиной. Похожие данные получены для верховых торфяных болот Латвии [43]. Считается, что бактерии принимают более активное участие в процессе гумификации органического вещества торфяников, чем плесневые грибы, дрожжи и актиномицеты. При этом бактериям, участвующим в разложении растительных остатков, практически не доступен углеводный комплекс [29].
ФК торфа обогащены кислородсодержащими фрагментами и меньшим количеством парафиновых структур (до 24.2%). Отмечается близкое содержание карбоксильных групп в ГК и ФК в торфяниках, что не свойственно для минеральных почв, в которых массовая доля –СOOH ФК значительно выше, чем в ГК [17]. В процессе карбоксилирования фульвокислот доля –СOOH-групп ФК растет вниз по профилю и заметно превышает их долю в составе ГК нижних слоев. Высокая доля углеводных фрагментов (до 80.1%) делает молекулы ФК более предпочтительным объектом питания микроорганизмов по сравнению с ГК (до 24.6%), которые более чем на половину состоят из гидрофобных термобиоустойчивых алифатических цепочек и ароматических фрагментов. Отличительной особенностью ФК от ГК является различия в содержании метокси-групп и аминокислотных фрагментов (диапазон 47–60 ppm), а также ароматических и алифатических карбонильных групп. Более низкая доля групп диапазона химического сдвига 47–60 ppm (до 10.0% у ФК и до 15.8% у ГК) обусловлена меньшим содержанием азота аминогрупп молекул ФК и метокси-групп при ароматических фрагментах [3]. Изменение структурно-функциональных параметров ФК, как наиболее лабильной совокупности ГВ, восприимчиво к условиям почвообразования. Дифференциация содержания алкильных, метокси- и аминогрупп, углеводных фрагментов ФК слоев торфа, вероятно, связана с различиями температурных режимов, составом ботанического и палинологического материала в периоды голоцена. Вероятно, именно с этим связано максимальное содержание ароматических фрагментов ФК в слое Т4 исследованных почв, находящемся на границе многолетней мерзлоты и испытывающим динамические процессы оттаивания–замерзания, что приводит к трансформации ГК до структур ФК.
Представительная выборка препаратов позволила проведение статистической обработки результатов молекулярной структуры ГВ с основными характеристиками образцов торфа – ботаническим составом, степенью разложения торфа, и выделить основные направления трансформации ГВ. Корреляционный анализ проводили с использованием критерия Пирсона. Значимость влияния фактора (ароматичности, содержание неокисленных алифатических фрагментов, содержание спин-электронов) на структурно-функциональные параметры ГВ в стратифицированных торфяных горизонтах оценена с применением однофакторного дисперсионного анализа (ANOVA) с использованием критерия Фишера для пар со значимой корреляцией. Все статистические расчеты осуществляли при заданном уровне значимости p ≤ 0.05. Для последующего анализа на основании данных ботанического состава отдельные виды растений были объединены в группы торфообразователей. Содержание лигнина в сухом беззольном веществе лишайников и мхов (8–10%) меньше, чем в злаковой (15–20%), кустарниковой и древесной (20–30%) растительности [1, 18]. На их основании с учетом ботанического состава торфа была рассчитана доля лигнина в исходных растительных остатках.
Метокси-группы в большей степени приурочены фенилпропановым фрагментам “лигниновых” ароматических компонентов. Последнее положение подтверждается достоверной корреляцией содержания метокси-групп с долей окисленных ароматических фрагментов ГК и ФК (n = 36; r = 0.50, rcr = 0.33, P = 0.95). Взаимосвязаны также показатели ароматичности и доли карбоксильных групп ГК (n = 18; r = 0.64, rcr = 0.47, P = 0.95), отражая основные направления эволюции ГВ вследствие гумификации – карбоксилирование и отбор термобиодинамически устойчивых структур.
Достоверная отрицательная корреляция содержания неокисленных ароматических и неокисленных алифатических фрагментов ГК (n = = 18; r = –0.95, rcr = 0.47, P = 0.95), а также данные дисперсионного анализа (F = 15.77, p = 0.0014) для этих факторов (ANOVA) не могут быть объяснены только процессами “отщепления” парафиновых структур в результате “естественного отбора”, а вероятно, является следствием циклизации алифатических звеньев с последующим дегидрированием до ароматических фрагментов.
Установлена достоверная корреляция между степенью разложения торфа и содержанием метокси-групп (r = 0.47) и карбоксильных (r = 0.61) групп ФК (n = 18, rcr = 0.47, P = 0.95), отрицательная достоверная корреляция с долей углеводных фрагментов ГК (r = –0.56). Расчетная доля лигнина имеет взаимосвязь с долей окисленных (лигниновых) ароматических фрагментов (r = 0.49) и содержанием карбоксильных групп ФК (r = = 0.52). Анализ показывает, что степень ароматичности молекул ГК не всегда является показателем степени разложения торфа, а зависит от его ботанического состава. Состав ароматических фрагментов ГВ связан с долей древесных остатков (r = 0.57, rcr = 0.47, P = 0.95), осок (r = 0.53), парафиновых фрагментов – с составом кустарничков (r = 0.53), углеводных фрагментов – с составом кустарничков (r = 0.72), мхов (r = 0.51). Корреляция отдельных представительных видов и родов растений имеет весьма существенную взаимосвязь: например, Carex aquatilis (r = 0.54), Carex cespitosa (r = 0.47) и Menyanthes (r = 0.55) с долей неокисленных ароматических фрагментов ГК, Carex rostrata (r = 0.63), Carex cespitosa (r = 0.48) с долей метокси-групп ГК (rcr = 0.47, P = 0.95).
Парамагнитная активность гумусовых веществ. Анализ формы ЭПР спектров исследованных образцов торфа и гуминовых кислот, снятых в сравнительно узком диапазоне в области сигналов от органических свободных радикалов показал, что все они представляют собой интенсивную и относительно симметричную синглетную линию с g‑фактором, близким к 2, что свидетельствует о присутствии свободных радикалов, локализованных на ароматических структурах. Наличие сигнала ЭПР лоренцовой формы, переходящего на крыльях в кривую гаусовского распределения свидетельствует, что наряду со спин и спин-решетчатым взаимодействием, неспаренный электрон имеет достаточно свободы для спин-спиновых контактов [33].
Расчеты интегральной интенсивности линии поглощения позволили оценить концентрации неспаренных электронов в образцах. Установлено, что концентрация парамагнитных центров в препаратах ГК выше, чем в торфе, что обусловлено большим содержанием ароматических и других полисопряженных структур в молекулах ГК, на которых могут делокализоваться неспаренные электроны (табл. 5).
Таблица 5.
Парамагнитные свойства торфа и ГК бугристых торфяников
| Горизонт | Глубина, см | Массовая концентрация свободных радикалов, 1015 спин/г | |
|---|---|---|---|
| торф | гуминовые кислоты | ||
| Разрез 2014-1 | |||
| T1 | 0–10 | 1.54 | 3.76 |
| T2 | 10–20 | 0.64 | 2.41 |
| T3 | 20–40 | 0.55 | 1.88 |
| T4 | 40–60 | 0.40 | 1.32 |
| T5 | 60–80 | 0.31 | 1.34 |
| Т6 | 80–100 | – | 5.79 |
| Т7 | 100–150 | – | 6.03 |
| Т8 | 150–175 | – | 1.97 |
| Т9 | 175–200 | – | 1.18 |
| Разрез 2014-2 | |||
| Ткриог | 0–5 | 0.57 | 1.65 |
| T1 | 5–20 | 0.30 | 0.72 |
| T2 | 20–40 | 0.39 | 0.50 |
| T3 | 40–60 | 0.46 | 0.31 |
| T4 | 60–80 | 1.37 | 1.20 |
| T5 | 80–100 | – | 3.41 |
| Т6 | 100–150 | – | 3.76 |
| Т7 | 150–175 | – | 0.31 |
| Т8 | 175–200 | – | 1.01 |
Выявлена достоверная корреляция между концентрациями свободных радикалов торфа и ГК (r = 0.65, n = 10, P = 0.95, rcr = 0.63), что свидетельствует о локализации ПМЦ органического вещества торфяников преимущественно в структуре ГК.
Содержание свободных радикалов в препаратах ГК обоих разрезов имеет аккумулятивный характер распределения по профилю до глубины 60 см. Ниже 60 см, наблюдается увеличение парамагнитной активности ГК, вызванное изменением ботанического состава исходного торфа и увеличением доли древесных остатков и осок, обогащенных сирингил- и гваяцилпропановыми единицами лигниновых фрагментов, способствующих стабилизации свободных радикалов и формированию парамагнитных свойств ГК. Косвенным подтверждением этого факта служит достоверная корреляция между концентрацией ПМЦ и массовой долей метоксильных групп в ГК r = 0.68 (n = 18, P = 0.95, rcr = 0.47). Выявлено влияния факторов доли хинноных фрагментов (F = = 6.94, p = 0.017) и метокси-групп (F = 5.28, p = = 0.0086) ГК на свободорадикальную активность.
ЗАКЛЮЧЕНИЕ
Дана характеристика молекулярной структуры ГВ бугристых торфяников Большеземельской тундры Европейского Северо-Востока России. Установлено, что исследованные препараты ГК и ФК представлены слабоконденсированными молекулярными структурами с низкой долей атомов углерода ароматических компонентов. Отмечено близкое содержание карбоксильных групп в ГК и ФК торфяников, что не свойственно для минеральных почв, в которых массовая доля –СOOH групп в структуре ФК значительно выше и обусловлено доминированием анаэробных условий в торфяных почвах.
Оценка содержания функциональных групп и молекулярных фрагментов в ГВ свидетельствует о функционировании специфических почвенных процессов, приводящих к трансформации их состава. Для СТС отмечен тренд на уменьшение относительной доли парафиновых групп и увеличение доли ароматических фрагментов в ГК и карбоксильных групп в ФК вниз по профилю в результате их естественной эволюции. Протекающие процессы отбора, либо трансформации линейных алифатических незамещенных гетероатомами фрагментов на стерически разветвленные структуры могут приводить к циклизации парафиновых цепочек в устойчивые ароматические фрагменты. Вследствие низкой биологической активности торфяных почв по всему профилю лабильные углеводные фрагменты подвержены низкой трансформации. Отмечен заметный рост доли ароматических фрагментов в ГК на границе СТС, что может быть обусловлено длительным воздействием низких температур, приводящих к отщеплению алифатических структур от их макромолекул.
Климатические особенности периода формирования торфяных слоев определяют качественный состав основных торфообразователей и степень деструкции природных биополимеров. Показано, что более высокие значения сумм положительных и биологически активных температур почв оголенных торфяных пятен ведут к более глубокой гумификации органического материала и к существенной трансформации ГВ СТС торфа. Полученные соотношения основных функциональных групп и молекулярных фрагментов ГВ могут послужить основой для разработки биомаркеров климатических изменений, как в реликтовых слоях торфа, сформированных в атлантический и суббореальный периоды голоцена, так в и процессе современного диагенеза.
Благодарность. Работа выполнена при поддержке госбюджетной темы Института биологии № Гр. АААА-А17-117122290011-5.
Список литературы
Александрова Л.Н. Органическое вещество почвы и процессы его трансформации. Л.: Наука, 1980. 287 с.
Арчегова И.Б. Влияние промораживания на сорбцию, состав, свойства гумусовых веществ // Почвоведение. 1979. № 11. С. 39–49.
Василевич Р.С., Безносиков В.А. Аминокислотный состав гумусовых веществ тундровых почв // Почвоведение. 2015. № 6. С. 685–692. doi 10.7868/ S0032180X1506012X
Василевич Р.С., Безносиков В.А. Влияние изменения климата в голоцене на профильное распределение состава гумусовых веществ бугристых торфяников лесотундры // Почвоведение. 2017. № 11. С. 1312–1324. doi 10.7868/S0032180X17090106
Васильчук Ю.К., Васильчук А.К., Юнгер Х., Ван дер Плихт Й. Формирование сингенетических повторно-жильных льдов во время голоценового оптимума в условиях быстрого накопления торфа на Ямале // Криосфера Земли. 1999. Т. III. № 1. С. 11–12.
Вертс Дж, Болтон Дж. Теория и практическое применение метода ЭПР. М.: Мир, 1975. 548 с.
Виноградова Ю.А., Каверин Д.А., Пастухов А.В., Лаптева Е.М. Пространственное распределение почвенных микроорганизмов в бугристых торфяниках восточно-европейского сектора Арктики // Тез. докл. VII съезда Общества почвоведов им. В.В. Докучаева и Всеросс. с междунар. участием науч. конф. “Почвоведение – продовольственной и экологической безопасности страны” (Белгород, 15–22 августа 2016 г.). Ч. II. М.–Белгород: Изд. дом “Белгород”, 2016. С. 105–106.
Гостищева М.В. Сравнительная характеристика гуминовых кислот ряда торфов Томской области // Изв. Томского политехнического ун-та. 2007. Т. 310. № 2. С. 163–166.
Дергачева М.И., Дедков В.С. Влияние промерзания-оттаивания на органическое вещество почв приобской лесотундры // Экология. 1977. № 2. С. 23–32.
Инишева Л.И., Юдина Н.В., Соколова И.В., Ларина Г.В. Характеристика гуминовых кислот представительных видов торфов // Химия растительного сырья. 2013. № 4. С. 179–185. doi 10.14258/jcprm.1304179
Каверин Д.А., Пастухов А.В. Генетическая характеристика мерзлотных оголенных пятен на плоскобугристых торфяниках Большеземельской тундры // Изв. Самарского научного центра РАН. 2013. Т. 15. № 3. С. 55–62.
Князев Д.А., Фокин А.Д., Очкин А.В. Свободно-радикальная конденсация как естественный механизм образования гуминовых кислот // Почвоведение. 2009. № 9. С. 1061–1065.
Ковалева Н.О., Ковалев И.В. Лигниновые фенолы в почвах как биомаркеры палеорастительности // Почвоведение. 2015. № 9. 1073–1086. doi 10.7868/ S0032180X15090063
Козловская Л.С., Медведева В.М., Пьявченко Н.И. Динамика органического вещества в процессе торфообразования. Л.: Наука, 1978. 176 с.
Ларина Г.В., Кайзер М.И., Вышнякова Т.В. Состав органического вещества и гуминовых кислот торфяного месторождения Балакнак (Горный Алтай) // Вестник ТГПУ. 2013. № 8. С. 222–226.
Левашенко Д.В., Малясова Е.С. Климатический оптимум в дельте реки Печоры // Известия РАН. Сер. геогр. 2007. № 4. С. 125–132.
Лодыгин Е.Д., Безносиков В.А., Василевич Р.С. Молекулярный состав гумусовых веществ тундровых почв (13С-ЯМР-спектроскопия) // Почвоведение. 2014. № 5. С. 546–552. doi 10.7868/S0032180X14010079
Орлов Д.С. Гумусовые кислоты почв и общая теория гумификации. М.: Изд-во Моск. ун-та, 1990. 325 с.
Память почв: Почва как память биосферно-геосферно-антропосферных взаимодействий / Отв. ред. В.О. Таргульян, С.В. Горячкин. М.: Из-во ЛКИ, 2008. 692 с.
Розенцвет O.A., Филин В.Р., Саксонов C.B., Мещеряков В.В. Сезонная динамика полярных липидов в листьях папоротников Dryopteris filix-mas и Mattteuccia struthiopteris // Биохимия. 2002. Т. 67. № 9. С. 1215–1221.
Савельева А.В., Юдина Н.В. Изменение химического состава болотных растений в процессе торфообразования // Химия растительного сырья. 2003. № 3. С. 17–20.
Савельева А.В., Юдина Н.В., Инишева Л.И. Состав гуминовых кислот торфов разной степени гумификации // Химия твердого топлива. 2010. № 5. С. 21–25.
Сартаков М.П. Спектроскопия ЯМР 13С гуминовых кислот торфов Среднего Приобья // Химия растительного сырья. 2008. №3. С. 135–139.
Сартаков М.П., Тихова В.Д. Графостатистический анализ и спектроскопия 13С-ЯМР молекул гуминовых кислот торфов Среднего Приобья // Вестник КрасГАУ. 2009. № 6. С. 76–80.
Селянина С.Б., Парфенова Л.Н., Труфанова М.В., Боголицын К.Г., Мальцева Е.В., Богданов М.В., Ярыгина О.Н. Экстракция битумов из верхового торфа // Вестник Северного (Арктического) Федерального университета. Серия: естественные науки. 2013. № 1. С. 43–50.
Трускавецкий Р.С. Баланс углерода в осушенных торфяниках украинского полесья // Почвоведение. 2014. № 7. С. 829–836. doi 10.7868/ S0032180X14050232
Фридланд Е.В. Методика изучения липидной (растворимой в спиртобензоле) фракции почвенного гумуса // Биол. науки. 1978. № 5. С. 127–133.
Холодов В.А., Константинов А.И., Кудрявцев А.В., Перминова И.В. Строение гуминовых кислот почв зонального ряда по данным спектроскопии ЯМР 13С // Почвоведение. 2011. № 9. С. 1064–1073.
Чимитдоржиева Г.Д., Андреева Д.Б., Вишнякова О.В., Мильхеев Е.Ю. Гуминовые вещества в природных объектах. Улан-Удэ: Изд-во БНЦ CO РАН, 2007. 190 с.
Чичагова О.А. Радиоуглеродное датирование гумуса почв. Метод и его применение в почвоведении и палеогеографии. М.: Наука, 1985. 158 с.
Чуков С.Н. Структурно-функциональные параметры органического вещества почв в условиях антропогенного воздействия. СПб.: Изд-во С.-Петерб. ун.-та, 2001. 216 с.
Чуков С.Н., Голубков М.С., Рюмин А.Г. Внутригоризонтная дифференциация структурно-функциональных параметров гуминовых кислот чернозема типичного // Почвоведение. 2010. № 11. С. 1353–1361.
Чуков С.Н., Ехаркью Е., Абакумов Е.В. Характеристика гуминовых кислот почв тундровой зоны севера Западной Сибири методом спектроскопии электронного парамагнитного резонанса // Почвоведение. 2017. № 1. С. 35–39. doi 10.7868/ S0032180X17010051
Шпынова Н.В., Сартаков М.П. Спектральные характеристики гуминовых кислот органогенных отложений Обь-Иртышского междуречья // Вестник Югорского гос. ун-та. 2010. № 4. С. 88–91.
Ariese F., Assema S., Gooijer C., Bruccoleri A.G., Langford C.H. Comparison of Laurentian Fulvic Acid luminescence with that of the hydroquinone/quinone model system: Evidence from low temperature fluorescence studies and EPR spectroscopy // Aquatic Sciences. 2004. V. 66. № 1. P. 86–94. doi 10.1007/s00027-003-0647-8
Bayer C., Martin-Neto L., Mielniczuk J., Dieckow J., Amado T.J.C. C and N stocks and the role of molecular recalcitrance and organomineral interaction in stabilizing soil organic matter in a subtropical Acrisol managed under no-tillage // Geoderma. 2006. V. 133. № 3–4. P. 258–268. doi 10.1016/j.geoderma.2005.07.012
Cano A.F., Mermut A.R., Ortiz R., Benke M.B., Chatson B. 13C CP/MAS-NMR spectra of organic matter as influenced by vegetation, climate, and soil characteristics in soils from Murcia, Spain // Canadian J. Soil Science. 2002. V. 82. № 4. P. 403–411.
Dick D.P., Goncalves C.N., Dalmolin R.S.D., Knicker H., Klamt E., Kogel-Knabner I., Simoes M.L., Martin-Neto L. Characteristics of soil organic matter of different Brazilian Ferralsols under native vegetation as a function of soil depth // Geoderma. 2005. V. 12. № 3–4. P. 319–333. doi 10.1016/j.geoderma.2004.05.008
Duarte R.M.B.O., Silva A.M.S., Duarte A.C. Two-dimensional NMR studies of water-soluble organic matter in atmospheric aerosols // Environ. Sci. Technol. 2008. V. 42. P. 8224–8230. doi 10.1021/es801298s
Hatcher P.G., Schnitzer M., Dennis L.W., Maciel G.E. Aromaticity of humic substances in soils // Soil Sci. Soc. Am. J. 1981. V. 45. P. 1089–1093. doi 10.2136/sssaj1981.03615995004500060016x
Jezierski A., Czechowski F., Jerzykiewicz M., Chen Y., Drozd J. Electron paramagnetic resonance (EPR) studies on stable and transient radicals in humic acids from compost, soil, peat and brown coal // Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2000. V. 56. № 2. P. 379–385. doi 10.1016/S1386-1425(99)00249-8
Keeler C., Kelly E.F., Maciel G.E. Chemical-structural information from solid-state 13C NMR studies of a suite of humic materials from a lower montane forest soil, Colorado, USA // Geoderma. 2006. V. 130. P. 124–140. doi 10.1016/j.geoderma.2005.01.015
Klavins M., Purmalis O. Properties and structure of raised bog peat humic acids // J. Molecular Structure. 2013. V. 1050. P. 103–113. doi 10.1016/j.molstruc.2013.07.021
Knicker H., Hilscher A., González-Vila F.J., Almendros G. A new conceptual model for the structural properties of char produced during vegetation fires // Org. Geochem. 2008. V. 39. № 8. P. 935–939. doi 10.1016/j.orggeochem.2008.03.021
Kononova M. Soil organic matter. Its nature, its role in soil formation and in soil fertility. Second English Edition. Oxford: Pergamon Press, 1966. 544 p.
Lodygin E.D., Beznosikov V.A. The molecular structure and elemental composition of humic substances from Albeluvisols // Chemistry and Ecology. 2010. V. 26. № 4. P. 87–95. doi 10.1080/02757540.2010.497759
Manhaes R.S.T., Auler L.T., Sthel M.S., Alexandreb J., Massunaga M.S.O., Carrio J.G., Santos D.R., Silva E.C., Garcia-Quiroz A., Vargas H. Soil characterisation using X-ray diffraction, photoacoustic spectroscopy and electron paramagnetic resonance // Applied Clay Science. 2002. V. 21. № 5–6. P. 303–311. doi 10.1016/ S0169-1317(02)00092-3
Mao J., Cao X., Olk D.C., Chu W., Schmidt-Rohr K. Advanced solid-state NMR spectroscopy of natural organic matter // Progress in Nuclear Magnetic Resonance Spectroscopy. 2017. V. 100. P. 17–51. doi 10.1016/ j.pnmrs.2016.11.003
Roland T.P., Daley T.J., Caseldine C.J., Charman D.J., Turney C.S.M., Amesbury M.J. Thompson G.J., Woodley E.J. The 5.2 ka climate event: Evidence from stable isotope and multi-proxy palaeocological peatland records in Ireland // Quaternary Science Reviews. 2015. V. 124. P. 209–223. doi 10.1016/j/quascirev.2015.07.026
Routh J., Hugelius G., Kuhryb P., Filley T., Tillman P.K., Becher M., Crill P. Multi-proxy study of soil organic matter dynamics in permafrost peat deposits reveal vulnerability to climate change in the European Russian Arctic // Chemical Geology. 2014. V. 368. P. 104–117. doi 10.1016/j.chemgeo.2013.12.022
Schuur E.A.G., Bockheim J., Canadell J.G., Euskirchen E., Field C.B., Goryachkin S.V., Hagemann S., Kuhry P., Lafleur P.M., Lee H., Mazhitova G., Nelson F.E., Rinke A., Romanovsky V. E., Shiklomanov N., Tarnocai C., Venevsky S., Vogel J.G., Zimov S.A. Vulnerability of permafrost carbon to climate change: Implications for the global carbon cycle // BioScience. 2008. V. 58. № 8. P. 701–714. doi 10.1641/B580807
Simpson A.J., Simpson M.J. Nuclear magnetic resonance analysis of natural organic matter. Biophysico-chemical processes involving natural nonliving organic matter in environmental systems / Eds.: N. Senesi, B. Xing, P.M. Huang. John Wiley & Sons Inc. New Jersey, 2009. P. 589–650.
Swift R.S. Methods of soil analysis / Ed.: D.L. Sparks et al. Methods of soil analysis. Part 3. Chemical methods. Soil Sci. Soc. Am. Book Series: 5. Soil Sci. Soc. Am. Madison. WI, 1996. P. 1018–1020.
Tadini A.M., Pantano G., Toffoli A.L., Fontaine B., Spaccini R., Piccolo A., Moreira A.B., Bisinoti M.C. Off-line TMAH-GC/MS and NMR characterization of humic substances extracted from river sediments of northwestern São Paulo under different soil uses. Original Research Article // Sci. Total Environ. 2015. V. 506–507. P. 234–240. doi 10.1016/j.scitotenv.2014.11.012
Wilson M.A. Applications of nuclear magnetic resonance spectroscopy to the study of the structure of soil organic matter // J. Soil. Sci. 1981. V. 32. P. 167–186. doi 10.1111/j.1365-2389.1981.tb01698.x
Winkler A., Haumaier L., Zech W. Insoluble alkyl carbon components in soils derive mainly from cutin and suberin // Org. Geochem. 2005. V. 36. № 4. P. 519–529. doi 10.1016/j.orggeochem.2004.11.006
Zaccone C., Miano T.M., Shotyk W. Qualitative comparison between raw peat and related humic acids in an ombrotrophic bog profile // Org. Geochem. 2007. V. 38. P. 151–160. doi 10.1016/j.orggeochem.2006.06.023
Zech W., Hempfling R., Haumaier L., Schulten H.-R., Haider K. Humification in subalpine Rendzinas: chemical analyses, IR and 13C NMR spectroscopy and pyrolysis-field ionization mass spectrometry // Geoderma. 1990. V. 47. № 1–2. P. 123–138. doi 10.1016/0016-7061(90)90050-J
Zimov S.A., Schuur E.A.G., Chapin F.S. Permafrost and the global carbon budget // Science. 2006. V. 312. № 5780. P. 1612–1613. doi 10.1126/science.1128908
Дополнительные материалы отсутствуют.


