Почвоведение, 2019, № 4, стр. 489-496
Влияние аллелотоксичности почв на прорастание семян зерновых культур
Г. Н. Федотов 1, *, С. А. Шоба 1, М. Ф. Федотова 1, И. В. Горепекин 1
1 МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: gennadiy.fedotov@gmail.com
Поступила в редакцию 24.05.2018
После доработки 06.06.2018
Принята к публикации 24.10.2018
Аннотация
На основе сравнения прорастания семян и развития из них растений в почвах и песке установлено наличие торможения прорастания семян зерновых культур в почвах Восточно-Европейской равнины по сравнению с песком. Из вегетационных опытов следует, что замедление прорастания семян и развития проростков семян, наблюдаемое за первые двое суток в лабораторных экспериментах, не нивелируется при дальнейшем развитии растений, и отставание в росте растений хорошо заметно через 14 дней. Различные культуры и сорта замедляют свое развитие одними и теми же почвами по-разному, что делает необходимым изучать аллелотоксикоз почв не на тестовых растениях, а исследовать замедление развития конкретных растений на изучаемых почвах. Выбор культур (сортов) для посева на конкретных полях в хозяйствах путем оценки для этих сортов аллелотоксикоза почв по длине проростков семян, на наш взгляд, выглядит особенно перспективно для подбора яровых культур.
ВВЕДЕНИЕ
Ранее проведенные исследования показали, что микроорганизмы выделяют в почву большое количество различных веществ, среди которых присутствуют токсины растений [1, 6, 17, 21]. Токсичные для растений вещества выделяются также и самими растениями вследствие конкурентной борьбы между ними за ресурсы [1]. Этот процесс назван аллелопатией. Позднее определение аллелопатии расширили и стали трактовать ее как процесс с участием вторичных метаболитов, производимых растениями, микроорганизмами, вирусами и грибами, которые влияют на рост и развитие биологических систем [19].
Почва представляет собой связующее звено между растениями и микроорганизмами. Ее высокая сорбционная способность приводит к накоплению большого количества биологически активных соединений, в том числе и токсинов [5, 6, 18, 20, 21, 23].
Способность почв подавлять развитие растений известна давно. Еще Красильников [6], исследовав нескольких тысяч незагрязненных поллютантами образцов подзолистых почв, установил, что практически все они обладали токсичностью не только по отношению к высшим растениям, но и к микроорганизмам, в частности азотобактеру.
Существует несколько механизмов образования токсичных для растений веществ. Они выделяются фитопатогенами (для подавления иммунитета растений) [16], растениями (для борьбы с конкурентами) [1, 9, 13, 17], из разлагающихся в почве растительных остатков [1, 16, 18] и вырабатываются микроорганизмами, разлагающими растительные остатки [1, 6, 8, 17, 21]. Также к появлению в почве токсичных соединений приводят воздействия, меняющие ее микробиологический состав: деградация [7, 11] или избыточное использование минеральных удобрений [3, 8].
Определена природа фитотоксинов, которые были разбиты на 14 групп [22]. По мнению ряда авторов, наиболее распространенными из них являются производные фенолов [1]. Однако исследование химического состава почв не позволяет однозначно определять токсикоз у почв и его величину, так как токсины во многих случаях представляют собой смесь различных веществ, некоторые из которых сами по себе не являются неблагоприятными, но значительно усиливают действие токсинов (например, глюкоза) [18]. Наиболее сильно токсикоз почв проявляется на стадии прорастания семян и развития растений в ювенильной фазе [5, 18]. Основными способами изучения токсикоза почв являются методы биотестирования [1, 9, 13, 17]. Однако в большинстве случаев изучают влияние вытяжек из почв на развитие семян [1, 17], и лишь иногда оценивают развитие в изучаемых почвах набора тест-культур [4, 14], что дает возможность получать качественную информацию о токсикозе почв.
Следует отметить, что растения обладают разной толерантностью к аллелотоксинам [9, 13], практически значимую информацию можно получить, только оценивая развитие в почвах семян тех культур, которые предполагают в них сеять.
Цель работы – получение при помощи лабораторной экспресс-методики количественной информации об ингибировании развития семян различных культур и сортов в конкретных почвах.
ОБЪЕКТЫ И МЕТОДЫ
Исследования проводили на семенах яровой пшеницы (Triticum) сортов “Лиза” и “Злата”, озимой пшеницы (Triticum) сорта “Безенчукская 380”, озимого тритикале (Triticosecale) сорта “Немчиновский 56”, ярового ячменя (Hordeum) сортов “Нур” и “Раушан” и озимой ржи (Secale cereale) сорта “Татьяна”.
В работе использовали сухой отмытый речной песок с размером частиц 0.5–0.8 мм, образцы дерново-подзолистой почвы из окрестностей поймы р. Яхрома влажностью 18.1% (после зерновых), серой лесной почвы из Тульской области (Щекинский район) влажностью 21.6% (после зерновых), чернозема типичного из Липецкой области (Данковский район) влажностью 33.1% (после картошки), а также каштановой почвы из Волгоградской области (Иловлинский район) влажностью 19.3% (залежь). Свойства почв11 представлены в табл. 1.
Таблица 1.
Некоторые физико-химические свойства используемых в работе почв
| Почва | pH | K2O | P2O5 | С | N |
|---|---|---|---|---|---|
| мг/кг почвы | % | ||||
| Серая лесная (освоенная) | 6.5 ± 0.04 | 249 ± 2 | 21 ± 7 | 1.88 | 0.13 |
| Чернозем выщелоченный (освоенный) | 7.5 ± 0.03 | 133 ± 9 | 41 ± 3 | 4.50 | 0.45 |
| Каштановая (залежь) | 8.2 ± 0.1 | 125 ± 9 | 72 ± 1 | 0.88 | 0.11 |
| Дерново-подзолистая почва (освоенная) | 6.3 ± 0.1 | 127 ± 8 | 27 ± 1 | – | – |
Изучено влияние почв на изменение длины проростков22 7.5 г семян (~200 шт.) при их прорастании в различных почвах. Длину проростков определяли, используя экспресс-метод, основанный на существовании линейной зависимости между насыпным объемом проросших семян в воде и длиной их проростков [15]. Проросшие в почве или песке семена отмывали от субстрата и помещали порциями в мерный цилиндр на 100 мл с водой, размещенный на вибростоле33, колеблющемся с частотой 50 Гц. После помещения каждой порции проросших семян в цилиндр, которые создавали ажурную пористую структуру на них на 15–20 с помещали небольшой грузик массой 8 г в виде резиновой пробки, что приводило к уплотнению структуры. После помещения всех проросших семян в цилиндр на них клали грузик и проводили дополнительное уплотнение структуры легкими постукиваниями (30–40) цилиндра с семенами о стол. Эти операции позволяли создать однородную структуру, а нижняя граница груза позволяла определять насыпной объем с точностью до 0.5 мл. На рис. 1 показаны проросшие семена россыпью и в цилиндре после уплотнения.
Рис. 1.
Проросшие семена ярового ячменя сорт “Нур” (исходный вес 7.5 г) россыпью (А) и в цилиндре с водой после виброуплотнения (Б).

При проведении экспериментов на дно чашки диаметром 95 мм помещали 30 г почвы или песка, затем ровным слоем размещали 7.5 г семян, а сверху – 30 г почвы или песка соответственно. После этого в чашку равномерно добавляли воду из мерной пипетки. Использовали шестикратную повторность с последующей статистической обработкой результатов. В связи с использованием в одном опыте 1000–1200 семян удавалось минимизировать ошибку, связанную с разнокачественностью семян [12]. В результате ошибка опыта не превышала 7% при 95%-ном уровне значимости.
Выделение углекислоты определяли, помещая в стаканчик с диаметром дна 55 мм 10 г почвы или песка, на нем располагали ровным слоем 2.5 г семян и засыпали их 10 г почвы или песка соответственно, добавляли из пипетки необходимое количество воды, чтобы она равномерно увлажняла субстрат. Площадь дна стаканчиков была в 3 раза меньше площади дна используемых для определения длины проростков чашек диаметром 95 мм, что позволяло для достижения одинаковых условий изучения прорастания семян в чашках и стаканчиках использовать в 3 раза меньшие навески субстрата (почвы или песка), семян и воды. После добавления воды стаканчики с семенами и субстратом ставили в стеклянную емкость объемом 3 л, которую герметично закрывали44. Емкости термостатировали при температуре 22°С в камере, в которую входила 21 емкость.
Опыты проводили в 7-кратной повторности с последующей статистической обработкой результатов. Ошибка не превышала 5% при 95%-ном уровне значимости.
Концентрацию углекислоты измеряли при помощи прибора Testo 535, который позволяет определять концентрацию СО2 в газовой смеси при содержании 0–9999 ppm.
Вегетационные опыты проводили, высевая по 10 семян в пластиковые горшки диаметром 150 мм, содержащие по 800 г почв. Надземную часть растений срезали через 12–14 дней и взвешивали. Повторность – четырехкратная.
Для получения количественной информации по влиянию изучаемых почв на развитие семян конкретных культур и сортов необходимо проводить сравнение с некими стандартными образцами. В связи с тем, что изучали развитие семян в течение двух суток, а, следовательно, развитие зерновок идет за счет накопленных питательных веществ, и поступление элементов питания из почв не оказывает значимого влияния на развитие семян, лучшим образцом сравнения, не содержащим токсинов, является промытый речной песок.
Влажность субстратов оказывает большое влияние на прорастание в них семян и развитие проростков, поэтому возник естественный вопрос: при какой влажности почв и песка проводить сравнение? Очевидно, что при недостаточной влажности прорастание семян и развитие проростков будут замедляться из-за недостатка воды или при избыточной влажности из-за недостатка кислорода. Прорастание семян и развитие проростков в оптимальных водно-воздушных условиях позволяет исключить влияние этих факторов (недостатка воды и кислорода) как негативных, что позволяет количественно определять ингибирование прорастания семян и развития проростков токсинами, содержащимися в почвах.
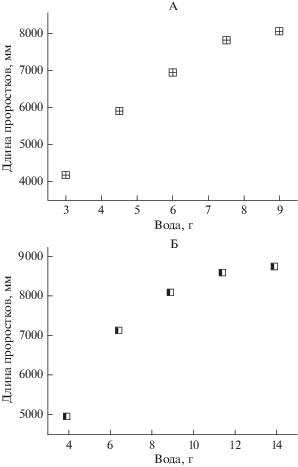
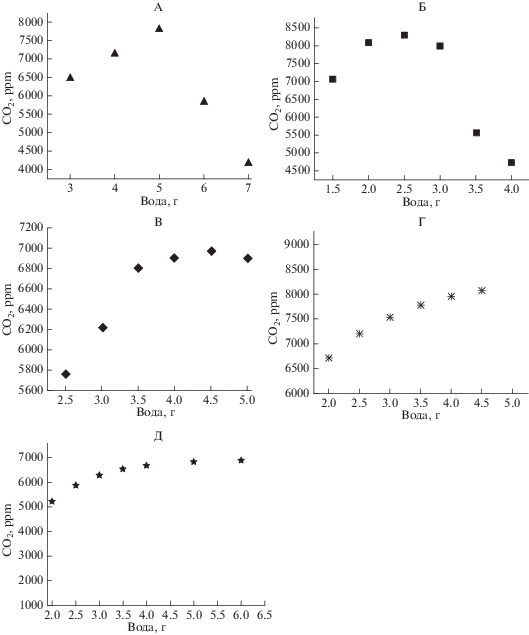
Навеску воды для песка и почв подбирали по максимальному количеству углекислоты, выделяемому системой за двое суток (на вторые сутки начинается развитие проростков). Следует отметить, что оптимальность добавляемого количества воды для прорастания семян и развития проростков в различных почвах55, определенная по максимуму выделения углекислоты в опыте прорастающие семена–субстрат на тритикале сорт “Немчиновский 56” (рис. 2), была выборочно проверена и подтверждена путем изучения влияние влажности на максимальную длину проростков семян других культур (рис. 3).
Рис. 2.
Влияние количества добавляемой воды в стаканчик с 2.5 г семян озимого тритикале сорт “Немчиновский 56” на изменение концентрации углекислоты в трехлитровой емкости за двое суток: 20 г песка (А), дерново-подзолистая почва с влажностью 18.1% (Б), чернозем с влажностью 33.1% (В), серая лесная почва с влажностью 21.6% (Г) и каштановая почва с влажностью 19.3% (Д).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После определения оптимальной для каждой почвы влажности была изучена относительно песка способность зональных почв ингибировать прорастание семян и развитие проростков ряда зерновых культур. Проведенные эксперименты показали (табл. 2), что негативное влияние на прорастание семян проявляется практически на всех изученных почвах и культурах.
Таблица 2.
Прорастание семян различных культур на почвах по сравнению с песком, определяемое по увеличению суммарной длины проростков за двое суток при температуре 22°С, %
| Культура, сорт | Почва | |||
|---|---|---|---|---|
| Дерново-подзолистая | Серая лесная | Чернозем | Каштановая | |
| Яровая пшеница, “Лиза” | –38 ± 5 | –67 ± 5 | –76 ± 6 | –25 ± 5 |
| Яровая пшеница, “Злата” | –54 ± 6 | –97 ± 7 | –82 ± 7 | –27 ± 5 |
| Яровой ячмень, “Нур” | +6 ± 6 | –52 ± 6 | –21 ± 5 | –5 ± 6 |
| Яровой ячмень, “Раушан” | +14 ± 7 | –72 ± 6 | –38 ± 5 | –1 ± 7 |
| Озимая рожь, “Татьяна” | –4 ± 6 | –73 ± 6 | –55 ± 6 | –14 ± 6 |
| Озимый тритикале, “Немчиновский 56” | –20 ± 5 | –77 ± 6 | –67 ± 6 | –19 ± 5 |
| Озимая пшеница, “Безенчукская 380” | –36 ± 5 | –80 ± 7 | –50 ± 6 | –27 ± 6 |
Хорошо видно, что для одних культур ингибирование выражено слабее (ячмень, рожь), а для пшеницы и тритикале, изученных сортов – заметно сильнее. Полученные данные подтверждаются результатами вегетационных опытов (рис. 4, табл. 3). На фотографии видно, что растения, выращенные из семян яровой пшеницы сорт “Лиза” в черноземе (ингибирование 76%) за две недели заметно отставали в развитии от растений, выращенных из таких же семян в дерново-подзолистой почве (ингибирование 38%). Масса надземной части выросших растений отличалась почти в 2 раза. Аналогично вели себя и другие сравниваемые пары культура–почва: в тех случаях, когда ингибирование семян почвами за двое суток было выше, надземная фитомасса, выросшая за две недели, была заметно меньше. Используемое в опытах количество семян позволяет говорить о получении только полуколичественных результатов, но полученные данные свидетельствуют, что ингибирование прорастания семян и развития проростков, которое хорошо видно через двое суток не нивелируется при дальнейшем развитии растений.
Рис. 4.
Проростки семян яровой пшеницы сорт “Лиза”, выращенные за 2 недели в черноземе (Б) и дерново-подзолистой почве (А).

Таблица 3.
Результаты вегетационных опытов по сравнению прорастания семян разных культур и развития из них растений в дерново-подзолистой почве и черноземе за две недели, %
| Сравниваемые пары, культура–почва | Величина ингибирования развития семян почвами | Разница в приросте надземной фитомассы |
|---|---|---|
| Яровая пшеница сорт “Лиза” в черноземе – | –76 ± 6 | – |
| яровой ячмень сорт “Нур” в черноземе | –21 ± 5 | +64 ± 22 |
| Яровая пшеница сорт “Лиза” в дерново-подзолистой почве – | –38 ± 5 | – |
| яровой ячмень сорт “Раушан” в дерново-подзолистой почве | +14 ± 7 | +45 ± 18 |
| Яровая пшеница сорт “Лиза” в черноземе – | –76 ± 6 | – |
| яровая пшеница сорт “Лиза” в дерново-подзолистой почве | –38 ± 5 | +88 ± 25 |
Отметим еще один важный момент, который иллюстрируется фотографиями проросших за двое суток семян яровой пшеницы сорт “Лиза” в дерново-подзолистой почве и черноземе (рис. 5). Видно, что количество непроросших семян в черноземе заметно больше, то есть в почвах, содержащих токсины, замедляется не только развитие проростков, но и прорастание семян. Это может приводить на сильно пораженных токсикозом почвах к заметной потере всхожести семян и дополнительной потере урожая из-за изреженности посевов. Данный эффект хорошо объясняет заметно меньшую полевую всхожесть семян по сравнению с их лабораторной [12].
Рис. 5.
Семена яровой пшеницы (7.5 г) сорта “Лиза”, выросшие за двое суток в дерново-подзолистой почве (А) и черноземе (Б).

Обращает на себя внимание, что соотношение ингибирующей способности различных почв на прорастание семян не является постоянным. Так, на дерново-подзолистой почве озимая пшеница сорта “Безенчукская 380” заметно угнетается по сравнению с рожью сорта “Татьяна”, ингибирование для которой практически отсутствует, а на черноземе эти культуры угнетаются примерно в равной степени. Похожая ситуация несовпадения эффектов ингибирования наблюдается также для яровой пшеницы сорта “Лиза” и ярового ячменя сорта “Нур” на дерново-подзолистой и серой лесной почвах. Это позволяет, во-первых, подтвердить существование отличающейся восприимчивости к патогенам отдельных культур и сортов [2, 9, 13]. Во-вторых, сделать вывод о том, что для каждой пары культура(сорт)–почва результат взаимодействия является индивидуальным, и нельзя характеризовать токсикоз почвы, не связывая этого свойства с конкретными семенами, как это рекомендуется делать в некоторых работах [1, 14]. Однако полученные данные подтверждают применимость и подобного, качественного подхода, так как наиболее сильно ингибирование выражено для всех культур на черноземе и серой лесной почве, и заметно слабее – на дерново-подзолистой и каштановой почвах.
Считается, что применение севооборотов предотвращает возникновение почвоутомления. Однако полученные данные этого не подтверждают, так как вне зависимости от предыстории все изученные в работе почвы обладали заметной или даже высокой ингибирующей способностью. В результате сохранения у почв способности ингибировать прорастание семян (токсикоза почв) даже при применении севооборотов возникает практический вопрос о выборе культур и сортов сельско-хозяйственных растений для посева, которые ингибируются конкретными почвами в наименьшей степени и, следовательно, можно ожидать, что на этих почвах они будут лучше развиваться и дадут максимальные урожаи.
Хорошо видно как сделать подобный выбор на примере полученных данных. Для посева на дерново-подзолистой, каштановой почвах и черноземе из яровых культур следует выбрать ячмень сорт “Нур”, а среди озимых культур на дерново-подзолистой почве – рожь “Татьяна”, которые ингибируются в наименьшей степени.
Предлагаемый способ определения влияния токсикоза почв на развитие семян позволяет выбрать культуру (сорт) для посева на конкретной почве, которые будут наименее восприимчивы к токсинам, находящимся в почве, следовательно, будут меньше угнетаться и дадут максимальный урожай. Выбор культур (сортов) для посева на конкретных полях в хозяйствах путем оценки для этих сортов токсикоза почв по длине проростков семян, на наш взгляд, выглядит особенно перспективно для подбора яровых культур, так как образцы почвы можно отобрать осенью, имея достаточно времени для проведения лабораторных испытаний.
ВЫВОДЫ
1. Изучение почв методом биотестирования путем определения длины проростков семян, развивающихся за двое суток, показало, что ингибирование проявляется практически во всех парах почва–семена зерновых культур.
2. Вегетационные опыты показали, что ингибирование, наблюдаемое нами за первые двое суток, не нивелируется при дальнейшем развитии растений и хорошо заметно через 14 дней.
3. Различные культуры и сорта ингибируются одними и теми же почвами по-разному, что делает необходимым исследование не токсикоза почв на тестовых растениях, а ингибирование конкретных растений на конкретных почвах.
4. Выбор культур (сортов) для посева на конкретных полях в хозяйствах путем оценки для этих сортов токсикоза почв по длине проростков семян, на наш взгляд, выглядит перспективно для подбора яровых культур, так как образцы почвы можно отобрать осенью, имея достаточно времени для проведения лабораторных испытаний.
Благодарность. Работа выполнена при поддержке гранта РНФ № 17-14-01120.
Список литературы
Гродзинский А.М., Богдан Г.П., Головко Э.А., Дзюбенко Н.Н., Мороз П.А., Прутенская Н.И. Аллелопатическое почвоутомление. Киев: Наукова думка, 1979. 248 с.
Животков Л.А., Бирюков С.В., Степаненко А.Я. и др. Пшеница. Киев: Урожай, 1989. 320 с.
Зинченко М.К., Селицкая О.В. Биологическая токсичность серой лесной почвы в зависимости от систем удобрений // Агрохимический вестник. 2011. № 5. С. 38–40.
Качество почвы. Биологические методы. Хроническая фитотоксичность в отношении высших растений. ГОСТ Р ИСО 22030–2009.
Коношина С.Н. Влияние различных способов использования почвы на ее аллелопатическую активность. Дис. … канд. с.-х. наук. Орел, 2000. 145 с.
Красильников Н.А. Микроорганизмы почвы и высшие растения. М.: Изд-во АН СССР, 1958. 464 с.
Лобко В.Т. Экологические основы почвоутомления в полевых агроценозах центрально-черноземной полосы России. Автореф. дис. … докт. с.-х. наук. Курск, 1994. 32 с.
Мирчинк Т.Г. Почвенная микология. М.: Изд-во Моск. ун-та, 1988. 220 с.
Млечко Е.А., Мотренко А.В. Аллелопатическое действие водного экстракта шалфея эфиопского (Salvia Aethiopis L.) на прорастание семян тест-растений // Вестник ВолГУ. 2015. Сер. 9. Вып. 13. С. 10–14.
Обручева Н.В., Антипова О.В. Физиология инициации прорастания семян // Физиология растений. 1997. Т. 44. № 2. С. 287–302.
Рудаков В.О., Рудаков О.Л. Природа почвенных фитоксикозов и проблема защиты растений // А-гро ХХl. 2009. № 1–3. С. 11–13.
Сечняк Л.К., Киндрук Н.А., Слюсаренко О.К., Иващенко В.Г., Кузнецов Е.Д. Экология семян пшеницы. М.: Колос, 1983. 349 с.
Симагина Н.О. Аллелопатический потенциал древесных растений // Ученые записки Таврического национального университета им. В.И. Вернадского. Сер. Биология, химия. 2013. Т. 26(65). № 1. С. 186–193.
Стаценко А.П., Гришин Г.Е., Чернышов В.Е. Способ оценки почвоутомления. Пат. РФ 2181238. 2002.
Федотов Г.Н., Шалаев В.С., Батырев Ю.П., Горепекин И.В. Методика для оценки эффективности действия стимуляторов прорастания семян // Лесной вестник. 2018. № 5. С. 3–10.
Шутко А.П. Биологическое обоснование оптимизации системы защиты озимой пшеницы от болезней в Ставропольском крае. Автореф. дис. … докт. с.-х. наук. СПб–Пушкин, 2013. 41 с.
Allelopathy. A Physiological Process with Ecological Implications / Ed. M.J. Reigosa, N. Pedrol, L. Gonzalez. Springe, 2006. 637 p.
Blum U. Allelopathy: A Soil System Perspective // Allelopathy. A Physiological Process with Ecological Implications / Ed. M.J. Reigosa, N. Pedrol, L. Gonzalez. Springer, 2006. P. 299–340.
Cheng F., Cheng Z. Research Progress on the use of Plant Allelopathy in Agriculture and the Physiological and Ecological Mechanisms of Allelopathy // Frontiers in Plant Science. 2015. V. 6. Article 1020.
Ghulam J., Shaukat M., Arshad N.C., Imran H., Muhammad A. Allelochemicals: sources, toxicity and microbial transformation in soil – a review // Annals of Microbiology. 2008. V. 58(3). P. 351–357.
McCalla T.M., Haskins F.A. Phytotoxic Substances from Soil Microorganisms and Crop Residues // Bacteriological Rev. 1964. V. 28. № 2. P. 181–207.
Rice E.L. Allelopathy. N.Y.–London: Academic Press, 1984. 422 p.
Vokou D., Chalkos D., Karamanoli K. Microorganisms and Allelopathy: A One-Sided Approach / Allelopathy. A Physiological Process with Ecological Implications / Eds. M.J. Reigosa, N. Pedrol, L. Gonzalez. Springer, 2006. P. 341–371.
Дополнительные материалы отсутствуют.