Почвоведение, 2019, № 4, стр. 507-514
Сравнение элюатных и контактных методов биотестирования при оценке почв, загрязненных тяжелыми металл(оид)ами
М. А. Пукальчик 1, *, В. А. Терехова 2, 3, М. М. Карпухин 2, В. М. Вавилова 2
1 Сколковский институт наук и технологий
121205 Москва, ул. Нобеля, 3, Россия
2 МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
3 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский пр., 33, Россия
* E-mail: m.pukalchik@skoltech.ru
Поступила в редакцию 27.03.2017
После доработки 06.07.2018
Принята к публикации 24.10.2018
Аннотация
Сравнительные испытания элюатных и контактных методов биотестирования проводили на образцах аллювиальных луговых насыщенных почв (Eutric Fluvisols), загрязненных набором металл(оид)ов, агродерново-подзолистых пахотных почв (Albic Retisols (Loamic, Aric, Cutanic, Ochric)), искусственно загрязненных высокими концентрациями цинка и свинца (550 мг/кг Pb + 880 мг/кг Zn), а также дерново-подзолистых типичных почв (Albic Retisols (Loamic, Cutanic, Ochric)), искусственно загрязненных фосфогипсом (40%). Приведены экспериментальные данные по валовому составу и содержанию водорастворимых форм токсикантов и биофильных элементов в исследованных почвах. Методом анализа главных компонент выявлены взаимосвязи между химическим составом проб и откликами биотестов. Показано, что отклики тест-организмов широко применяемых для оценки токсичности элюатов – водных вытяжек из образцов почв (Ceriodaphnia affinis, Paramecium caudatum, Scenedesmus quadricauda, бактериальная тест-система “Эколюм”) характеризовали изученные почвы как значительно менее токсичные, чем тест-организмы, непосредственно контактировавшие с почвами (Eisenia fetida и Sinapis alba). Обсуждаются пути повышения информативности экотоксикологической оценки почв.
ВВЕДЕНИЕ
Биологические методы анализа получили широкое распространение при исследовании экологического благополучия различных природных сред. По сравнению с химическими методами анализа, они имеют ряд преимуществ, в частности, способность оценивать кумулятивное действие набора загрязняющих веществ. Однако, если возможности стандартизированных методов биотестирования в целях изучения контроля водных объектов не вызывает сомнений [17], то в вопросе применимости водных вытяжек из почв в целях прогнозирования последствий загрязнения для биоты почв, промышленных отходов и других твердых субстратов остаются дискуссионные моменты [3, 15, 21].
Репрезентативность водной вытяжки обусловлена двумя важными факторами пробоподготовки: 1) характеристикой воды, применяемой для экстракции; 2) временем контакта почва/вода. Влияние качества воды, используемой для пробоподготовки, на результаты исследований рассмотрены в обзоре [16]. Актуальным вопросом остается информативность водных вытяжек из образцов почв целей биотестирования, так как полнота перехода токсикантов в водную фазу зависит не только от их химического строения, гидрофильности или гидрофобности, но и от физико-химических параметров почвенных сред [1]. Например, значительная часть водорастворимых форм металлов в почвах – их комплексные соединения с компонентами органического вещества, и содержание этих форм металлов в почвах – тем выше, чем больше концентрация органического углерода [2]. Известны десятки методик биотестирования, предполагающих изучение отклика гидробионтов в отечественной практике изучения экотоксичности почв [13]. Результаты экотоксикологической оценки находят применение в процедурах оценки экологических рисков загрязненных почв во многих странах [20, 25].
Отечественные подходы к процедуре подготовки водных вытяжек из почв предусматривают время контакта вода : почва, равное 2 ч. Однако по некоторым сведениям этого времени может быть недостаточно для достижения химического равновесия между составом твердой фазы почв и раствором [23]. По вопросу сопоставимости результатов тестирования водных вытяжек и твердых почвенных образцов в литературе приводятся противоречивые данные. Сообщается как о сходных результатах [27, 30], так и о фактах существенной несогласованности данных [14, 18, 26, 28].
Цель работы – сравнительные испытания трех почв, отличающихся контрастным уровнем загрязнения тяжелыми металл(оида)ми, по ответной реакции тест-организмов разных трофических уровней в вариантах элюатного и контактного биотестирования проб водных вытяжек и твердых образцов, охарактеризованных по химическому составу.
ОБЪЕКТЫ И МЕТОДЫ
Изучали токсичность трех образцов почв, отобранных в 2015/2016 г.: 1) аллювиальные луговые насыщенные почвы (АлЛ) (Eutric Fluvisols) в районе р. Литавка, Прибрам, Чешская Республика, характеризующиеся экстремально высокими концентрациями тяжелых металлов в результате воздействия отходов гальванического производства [33], гранулометрический состав – глина 6%, илистая фракция 49%, песок 45%; 2) агродерново-подзолистые пахотные среднегумусированные среднесуглинистые почвы (Albic Retisols (Loamic, Aric, Cutanic, Ochric)), Московская область, Россия, искусственно загрязненные высокими концентрациями нитрата свинца и цинка (550 мг/кг Pb + 880 мг/кг Zn в форме нитратов) в лабораторном опыте (АдпPb + Zn), содержание глины 27%; 3) дерново-подзолистые типичные маломощные глубокоосветленные среднегумусированные среднесуглинистые почвы (Albic Retisols (Loamic, Cutanic, Ochric)) (Московская область, Россия), искусственно загрязненные отходами производства минеральных удобрений фосфогипса (400 г/кг ФГ) в лабораторном опыте (ДППфг). Характеристика образцов представлена в табл. 1. Следует отметить, что выбранные для сравнительных испытаний образцы являлись резко контрастными по свойствам, что, в теории, должно было помочь выявить специфичность отклика биотестов к набору загрязняющих веществ в пробах.
Таблица 1.
Характеристика испытуемых почвенных образцов (среднее арифметическое ± стандартное отклонение)
| Показатель | АлЛ | АдпPb + Zn | ДППфг |
|---|---|---|---|
| рНKCl | 6.0 ± 0.1 | 5.6 ± 0.0 | 3.2 ± 0.4 |
| Сорг, % | 3.60 ± 0.00 | 2.5 ± 0.2 | 1.0 ± 0.0 |
| Mgобщ, мг/кг | 120 ± 7.8 | 219.8 ± 6.6 | 225.9 ± 25.1 |
| Caобщ, мг/кг | 1400 ± 102 | 1201.0 ± 7.8 | 46 593.7 ± 10 333.6 |
| Sобщ, мг/кг | Менее 50 | Менее 50 | 38 926.7 ± 8093.4 |
| Feобщ, мг/кг | 1176 ± 165 | 2467.2 ± 154.7 | 2456.7 ± 331.0 |
| Znобщ, мг/кг | 7595.65 ± 194.76 | 891.1 ± 3.1 | 21.2 ± 0.4 |
| Cdобщ, мг/кг | 80.82 ± 6.45 | 0.1 ± 0.0 | 0.1 ± 0.0 |
| Сuобщ, мг/кг | 62.51 ± 6.45 | 11.3 ± 0.1 | 9.4 ± 0.7 |
| Pbобщ, мг/кг | 4346.13 ± 140.08 | 449.2 ± 11.1 | 5.0 ± 0.3 |
| Niобщ, мг/кг | 5.61 ± 0.25 | 2.1 ± 0.1 | 2.3 ± 0.3 |
| Asобщ, мг/кг | 77.5 ± 5.2 | 1.9 ± 0.3 | 2.9 ± 0.00 |
| Srобщ, мг/кг | 10.1 ± 0.8 | 14.1 ± 4.0 | 3190.1 ± 791.3 |
| Crобщ, мг/кг | 14.06 ± 0.8 | 3.0 ± 0.1 | 2.9 ± 0.8 |
| Ваобщ, мг/кг | Не опр. | 21.4 ± 1.1 | 140.2 ± 11.5 |
Пробы хранили в воздушно-сухом состоянии, перед биотестированием почвы просеивали через сито (1 мм), усредняли методом сбрасывания на конус, перед экстракцией образцы делили на три части (технические повторности) для получения объективной информации о составе водной вытяжки и токсичности в ней.
Подготовка водных вытяжек из образцов. Водные вытяжки из почв готовили с применением культивационной воды в соответствии с требованиями методики измерения токсичности: к 1 части почвы приливали 4 части воды и перемешивали при 120 об./мин в течение 2 ч, после 30‑минутного отстаивания взвесь сифонировали и фильтровали через бумажные фильтры “белая лента”. Подготовленные вытяжки незамедлительно делили на две части, в одной определяли концентрацию водорастворимых элементов методом масс-спектрометрии с индуктивно связанной плазмой (ICP-MS 7500a, США), а в другой – ответную реакцию гидробионтов. Краткая характеристика методов исследования водных вытяжек и почв приведена в табл. 2.
Таблица 2.
Краткая характеристика процедуры биотестирования проб
| Показатель | Тест-организм | |||||
|---|---|---|---|---|---|---|
| Ceriodaphnia affinis | Paramecium caudatum | Scenedesmus quadricauda | биосенсор “Эколюм” | Eisenia fetida | Sinapis alba | |
| Анализируемая проба | Водная вытяжка из образцов почв (элюаты) | Почва | ||||
| Методика измерения | [9] | [10] | [8] | [7] | [22] | [29] |
| Длительность опыта | 48 ч | 24 ч | 72 ч | 15–30 мин | 30 сут | 72 ч |
| Объем тестируемой пробы (в одной повторности) | 50 см3 | 10 см3 | 100 см3 | 2 см3 | 250 г | 10 г |
| Количество повторностей для одного образца, ед. | 15 | 15 | 15 | 15 | 3 | 15 |
| Количество тест-организмов в одной повторности, ед. | 5 | 10–12 | 25–35 тыс. кл./см3 | – | 10 | 10 |
| Анализируемый показатель | Иммоби-лизация | Иммобилизация | Изменение уровня флуоресценции | Изменение уровня люминесценции | Смертность | Длина корней |
| Контрольный образец | Культивационная вода Aqua minerale | Искусственный грунт (10% торф, 20% глина, 70% песок) | ||||
Статистическая обработка. Результаты измерений обработаны в Excel 2010 как среднее ± стандартное отклонение. В целях выявления приоритетных факторов и оценки закономерностей наблюдаемых значений проводили анализ методом главных компонент с использованием корреляционной матрицы в программе Statistica 8.0.
Сравнение токсикологических откликов гидробионтов, полученных для водных вытяжек, с данными для педобионтов проводили путем присвоения каждому значению индекса токсичности балла, в соответствии с определенными граничными значениями (табл. 3), и дальнейшему расчету среднего по каждому почвенному образцу дифференцированно для элюатного и контактного теста. Получали усредненные баллы токсичности методов биотестирования водной вытяжки и контактного теста, в которых 0 соответствовал отсутствию токсичности, а 3 – сильной степени токсичности.
Таблица 3.
Схема перевода значений индекса токсичности в баллы (цит. по [27])
| Балл | Граничные значения индекса токсичности | Характеристика пробы |
|---|---|---|
| 0 | $\left| {0 < {\text{И Т }} \leqslant 5} \right|$ | Отсутствие токсичности |
| 1 | $\left| {5 < {\text{И Т }} \leqslant 20} \right|$ | Слабая токсичность/малотоксичные пробы |
| 2 | $\left| {20 < {\text{И Т }} \leqslant 60} \right|$ | Средняя токсичность |
| 3 | $\left| {{\text{И Т }} > 60} \right|$ | Сильная степень токсичности |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Исследованные образцы почв характеризовались вариабельностью рНKCl в интервале 3.1–6.1, основной их особенностью являлось высокое загрязнение металл(оид)ами в валовых формах, что оказало влияние на состав водных вытяжек (табл. 4). Доля водорастворимых форм поллютантов зависела от рН почвенных сред, содержания органического углерода, а также от исходного уровня загрязнения. В случае АлЛ, загрязненных чрезвычайно высокими концентрациями мышьяка, цинка, кадмия, меди и свинца, водные вытяжки также характеризовались повышенным уровнем этих элементов. Однако доля водорастворимых форм не превышала 1% от валовых значений для свинца, цинка, кадмия, и 3% для меди. Водные вытяжки из АдпPb + Zn, искусственно загрязненные цинком свинцом, характеризовались высоким содержанием водорастворимого цинка и практически полным отсутствием ионов свинца. Существенные различия в концентрациях металлов в растворе могут быть объяснены с позиции конкуренции металлов за почвенные реакционные центры при высоких дозах внесения металлов. Свинец в таких условиях обладает преимуществом в виде меньшего радиуса иона и большего сродства к поверхности почвенных агрегатов по сравнению с цинком, что отражается на большей интенсивности его сорбции при совместном присутствии металлов [5, 6, 11]. ДППфг, модельно загрязненные отходом производства минеральных удобрений (фосфогипса), характеризовались высокими концентрациями стронция, кальция, серы, бария по сравнению с другими почвами, связанными с растворимостью отдельных компонентов фосфогипса в водных растворах.
Таблица 4.
Характеристика водных вытяжек из почв (среднее арифметическое ± стандартное отклонение, в скобках – доля водорастворимых форм относительно валового содержания, %) и предельно допустимые концентрации вредных веществ в воде [12]
| Показатель | АлЛ | АдпPb + Zn | ДППфг | Норматив ПДК, мг/л* |
|---|---|---|---|---|
| As, мг/кг | 0.63 ± 0.09** (0.8) | <0.01 | <0.01 | 0.05 |
| Pb, мг/кг | 1.28 ± 0.08 (0.03) | 0.01 ± 0.00 (<0.02) | <0.01 | 0.006 |
| Zn, мг/кг | 11.07 ± 1.18 (0.15) | 1.32 ± 0.30 (0.15) | 3.91 ± 0.81 (18.44) | 0.01 |
| Cr, мг/кг | 0.08 ± 0.05 (0.57) | <0.01 | <0.01 | 0.07 |
| Cd, мг/кг | 0.18 ± 0.05 (0.22) | <0.01 | <0.01 | 0.005 |
| Ni, мг/кг | 0.13 ± 0.05 (2.32) | <0.01 | <0.01 | 0.01 |
| Fe, мг/кг | 16.83 ± 2.58 (1.43) | 0.42 ± 0.22 (0.06) | 63.13 ± 2.54 (2.57) | 0.1 |
| Cu, мг/кг | 1.71 ± 0.27 (2.73) | <0.01 | <0.01 | 0.001 |
| Sr, мг/кг | 0.46 ± 0.26 (4.54) | 0.60 ± 0.02 (4.25) | 370.71 ± 27.69 (11.62) | 0.4 |
| Ba, мг/кг | Не опр. | 0.24 ± 0.01 (1.12) | 1.29 ± 0.24 (0.92) | 0.74 |
| Ca, мг/кг | 118.42 ± 25.14 (8.42) | 90.76 ± 4.55 (7.56) | 8034.43 ± 499.23 (17.24) | 180.0 |
| Mg, мг/кг | 15.93 ± 9.32 (13.27) | 17.29 ± 0.87 (0.08) | 16.56 ± 8.16 (7.1) | 40.0 |
| Mn, мг/кг | 1.68 ± 0.43 (Не опр.) | 0.92 ± 0.09 (Не опр.) | 73.49 ± 24.39 (Не опр.) | 0.01 |
| Na, мг/кг | 5.63 ± 2.40 (Не опр.) | 4.92 ± 0.36 (Не опр.) | 394.91 ± 42.57 (Не опр.) | 120.0 |
| K, мг/кг | 47.92 ± 5.92 (Не опр.) | 11.26 ± 1.26 (Не опр.) | 111.34 ± 21.41 (Не опр.) | 50.0 |
| S, мг/кг | 34.24 ± 10.55 (Не опр.) | 9.07 ± 1.08 (Не опр.) | 9260.19 ± 497.09 (Не опр.) | Не опр. |
| P, мг/кг | 2.95 ± 1.00 (Не опр.) | 1.83 ± 0.17 (Не опр.) | 212.68 ± 44.06 (Не опр.) | Не опр. |
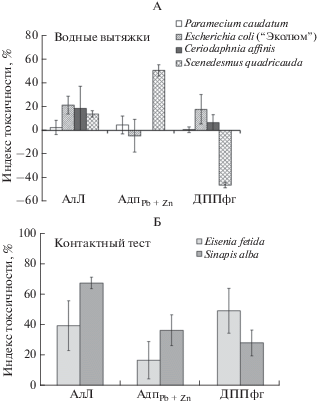
Исследование экотоксичности водных вытяжек из образцов проводили с применением распространенного в отечественной практике оценки набора биотестов (пресноводные рачки, микроводоросли, простейшие и бактериальный сенсор “Эколюм”) на основе генномодифицированного биолюминесцентного штамма Escherichia coli. В предыдущих исследованиях показано, что такой набор тест-организмов характеризуется высокой чувствительностью к наличию в почвах тяжелых металлов, а также фосфогипса [4, 19, 32]. Результаты биотестирования показали, что в соответствии с категориями токсичности аттестованных методик измерения, водные вытяжки из образцов почв АдпPb + Zn и ДППфг характеризовались как нетоксичные для инфузорий (индекс таксичности (ИТ) < 10%), бактериального препарата “Эколюм” (ИТ < 10%), пресноводных рачков цереодафний (ИТ < 10%), и свидетельствовали о факте наличия острой токсичности для микроводорослей сценедесмус (ИТ > 20% для пробы с ТМ, ИТ < –30% для пробы с ФГ). Проба АлЛ, отличающаяся от остальных полиметаллическим загрязнением, характеризовалась как нетоксичная для инфузорий, малотоксичная для бактериального препарата “Эколюм”, токсичная для цериодафний и нетоксичная для микроводорослей (рис. 1А).
Контактные методы анализа в отличие от тестов на вытяжке проявили высокую чувствительность к наличию в почвенных пробах токсикантов (рис. 1Б). Значения длины корней проростков горчицы белой, так же как показатели смертности червей в почвах относительно контрольных проб, свидетельствовали о наличии токсичности образцов.
Многокомпонентный анализ позволил установить зависимости отклика гидробионтов от содержания отдельных элементов в пробах (рис. 2А), а также влияние валового химического состава на тест-функции педобионтов (рис. 2Б). Отклик гидробионтов условно можно разделить на три группы. В первую выделены пресноводные рачки C. affinis, для которых увеличение индекса токсичности было тесто связанно с повышенными концентрациями алюминия, меди, никеля, хрома, свинца, кадмия, мышьяка, цинка и молибдена, в то время как увеличение содержания калия, железа, марганца, натрия, кальция, серы, стронция, магния и фосфора, напротив, снижало индекс токсичности. Полученные данные подтверждают известный по литературным источникам факт, что ионы кальция, фосфора, калия и магния в водных растворах способны оказывать протекторное действие по отношению к гидробионтам в стрессовых условиях [31].
Рис. 2.
Диаграммы проекции взаимосвязи химического состава образцов и отклика биотестов в плоскости двух главных действующих факторов: А – вариант тестирования водных вытяжек, представлены водорастворимые формы элементов, Б – вариант контактного тестирования проб, приведены данные по валовому составу образцов.
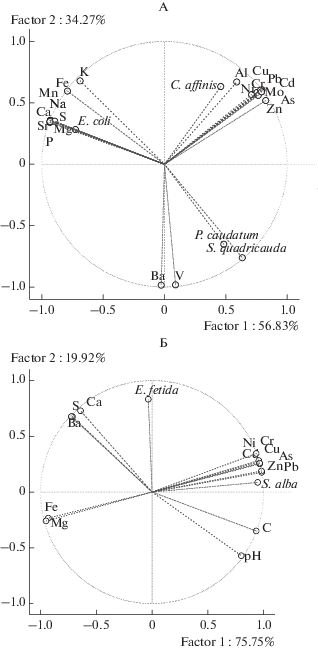
Во вторую группу можно выделить отклик бактериального препарата “Эколюм”, увеличение индекса токсичности которого коррелировало с повышенным содержанием калия, железа, марганца, натрия, кальция, серы, стронция, магния и фосфора, в свою очередь уменьшение содержания этих элементов и увеличение концентрации остальных снижало индекс токсичности. Обособленно от этих групп выделились ответные реакции инфузорий и микроводорослей, индекс токсичности которых увеличивался при повышении концентраций бария и ванадия, но практически не зависел от содержания всех остальных элементов в растворе.
Индекс токсичности для горчицы характеризовался высоким коэффициентом корреляции с показателями валового содержания цинка, свинца, мышьяка, хрома, никеля, кадмия. Увеличение валового содержания этих металл(оид)ов в пробах достоверно уменьшало длину корней по сравнению с контролем. В то же время увеличение содержания кальция, серы, бария, железа и магния оказывало обратное воздействие и снижало токсический эффект металлов (рис. 2В). Высокий уровень индекса токсичности почв по отношению к E. fetida не зависел от концентрации тяжелых металлов в пробах, а определялся высоким содержанием кальция, серы и бария, и снижался при увеличении рН проб.
Как показали исследования, оцениваемые тест-функции гидробионтов и педобионтов реагируют на сложный набор элементов в водных вытяжках из почв и почвенных компонентов. В ряду гидробионтов (цереодафнии, водоросли, инфузории, бактериальный препарат “Эколюм”) только показатель смертности цереодафний положительно коррелировал с концентрациями тяжелых металлов и металлоидов в водных вытяжках (Ni, Cu, As, Cd, Pb), тогда как измеренные тест-функции других биотестов либо не изменялись во время экспозиции, либо зависели от иных показателей. Что касается опыта использования педобионтов, то отмеченные для почв высокие уровни токсичности, могут быть объяснены как с позиции различий в химическом составе проб (почвенные образцы содержат значительно большее количество токсикантов в доступных для биоты формах, чем водные вытяжки из почв), так и отличными от гидробионтов механизмами поступления токсикантов.
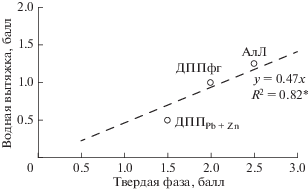
Значения усредненных баллов токсичности, рассчитанных для варианта тестирования водных вытяжек (4 биотеста) и контактных тестов (2 биотеста) показали, что исследование водной вытяжки более чем в 2 раза занизило данные по токсичности почв по сравнению с контактными тестами (рис. 3).
ЗАКЛЮЧЕНИЕ
Результаты проведенной работы наглядно показывают, как выбор биотеста и тестируемой фазы оказывает влияние на результаты, что, в свою очередь, приводит к недооценке экологических рисков химического загрязнения почв. Выявлена существенная несогласованность данных, получаемых при исследовании водных вытяжек из почв, с данными о химическом составе проб и откликом, полученным для варианта тестирования почвенных сред.
Возможный выход из данной ситуации мы видим в следующих вариантах. Во-первых, целесообразно гармонизировать отечественные критерии пробоподготовки с мировым опытом. Согласно международным стандартам биотестирования [24], срок подготовки водной вытяжки из почв варьирует от 12 до 24 ч в зависимости от методики исследования. Увеличение времени контакта водной фазы и почвенной матрицы, безусловно, может обеспечивать более полную экстракцию и увеличить информативность вытяжки. Во-вторых, можно ввести дифференцированные критерии оценки токсичности проб в зависимости от чувствительности тест-организмов к загрязнению. Короме того, ограничиваться анализом острой токсичности почв нецелесообразно. Для надежной оценки качества почв необходимо вводить в нормативные документы, регламентирующие экологическую экспертизу почв и земель, в качестве обязательных токсикометрические показатели хронической токсичности с продолжительным сроком экспозиции почвенных образцов и тест-организмов.
Благодарность. Работа выполнена при частичной поддержке грантов РНФ 14-50-00029 и РФФИ 18-04-01218. Авторы признательны Л. Ворониной и М. Гладковой за помощь в биотестировании.
Список литературы
Водяницкий Ю.Н., Плеханова И.О. Биогеохимия тяжелых металлов в загрязненных переувлажненных почвах (аналитический обзор) // Почвоведение. 2014. № 3. С. 273–282.
Добровольский В.В. Биосферные циклы тяжелых металлов и регуляторная роль почвы // Почвоведение. 1997. № 4. С. 431–441.
Добровольский Г.В., Терехова В.А., Дгебуадзе Ю.Ю. Биодиагностика в экологической оценке почв и сопредельных сред // Поволжский экологический журнал. 2013. № 4. С. 365–367.
Ефремова В.А., Дабах Е.В., Кондакова Л.В. Химико-биологическая оценка состояния городских почв // Сибирский экологический журн. 2013. № 5. С. 741–750.
Ладонин Д.В., Пляскина О.В. Изучение механизмов поглощения Cu(II), Zn(II) и Pb(II) дерново-подзолистой почвой // Почвоведение. 2004. № 5. С. 537–545.
Манджиева С.С., Минкина Т.М., Мотузова Г.В., Головатый С.Е., Мирошниченко Н.Н., Лукашенко Н.К., Фатеев А.И. Фракционно-групповой состав соединений цинка и свинца как показатель экологического состояния почв // Почвоведение. 2014. № 5. С. 118–126.
Методика определения интегральной токсичности поверхностных, в том числе морских, грунтовых, питьевых, сточных вод, водных экстрактов почв, отходов, осадков сточных вод по изменению бактериальной биолюминесценции тест-системой “Эколюм”. ПНДФ Т. 14.1:2:3:4.11-04. Т. 16.1:2:3:3.8-04. М.: ООО “Нера-С”, 2010. 30 с.
Методика определения токсичности вод, водных вытяжек из почв, осадков сточных вод и отходов по изменению уровня флуоресценции хлорофилла и численности клеток водорослей. М.: АКВАРОС, 2007. 48 с.
Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости цериодафний. ФР.1.39.2007.03221. М.: АКВАРОС, 2007. 56 с
Методика определения токсичности отходов, почв, осадков сточных, поверхностных и грунтовых вод методом биотестирования с использованием равноресничных инфузорий Paramecium caudatum Ehrenberg. ФР.1.39.2006.02506. М., 2006. 30 с.
Пинский Д.Л., Минкина Т.М., Гапонова Ю.И. Сравнительный анализ моно- и полиэлементной адсорбции меди, свинца и цинка черноземом обыкновенным из растворов азотнокислых и уксуснокислых солей // Почвоведение. 2010. № 7. С. 801–811.
Приказ Министерства сельского хозяйства РФ от 13 декабря 2016 года № 552 “Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения”.
Росстандарт. Федеральный информационный фонд по обеспечению единства измерений. Сведения об аттестованных методиках (методах) измерений. Биологические и биомедицинские документы. [Электронный ресурс] http://www.fundmetrology.ru/ 06_metod/2list.aspx?r=39.
Селивановская С.Ю., Галицкая П.Ю., Латыпова В.З., Семанов Д.А. Оценка эффективности контактного и элюатного методов оценки почв // Уч. записки Казанского федерального ун-та. Сер. Естественные науки. 2007. Т. 149. Кн. 1. С. 88–96.
Терехова В.А. Биотестирование почв: подходы и проблемы // Почвоведение. 2011. № 2. С. 190–198.
Федосеева Е.В., Гладкова М.М., Учанов П.В., Терехова В.А. Требования национальных и международных стандартов к качеству культивационной воды в практике применения гидробионтов для оценки экологической токсичности // Использование и охрана природных ресурсов в России. 2016. № 4. С. 44–49.
Филенко О.Ф. Задачи и возможности биологического контроля загрязнения водной среды // Вода Magazine. 2012. № 1. С. 24–28.
Фокина А.И., Домрачева Л.И., Олькова А.С., Скугорева С.Г., Лялина Е.И., Березин Г.И., Даровских Л.В. Исследование токсичности проб урбаноземов, загрязненных тяжелыми металлами // Изв. Самарского научного центра РАН. 2016. Т. 18. № 2(2). С. 544–550.
Яковлев А.С., Каниськин М.А., Терехова В.А. Экологическая оценка почвогрунтов, подверженных воздействию фосфогипса // Почвоведение. 2013. № 6. С. 737–743.
Critto A., Torresan S., Semenzin E., Giove S., Mesman M., Schouten A.J. et al. Development of a site-specific ecological risk assessment for contaminated sites: Part I. A multi-criteria based system for the selection of ecotoxicological tests and ecological observations // Sci. Total. Environ. 2007. V. 379. P. 16–33.
Dott et al. Methods for toxicological/ecotoxicological assessment of soils // DECHEMA ad-hoc-Committee (headed by W. Dott): Bioassays for soils / Eds. G. Hrsg. J. Kreysa, Wiesner. 4th Report of the interdisciplinary DECHEMA committee – Environmental biotechnology – Soil (headed by J. Klein). Deutsche Gesellschaft für Chemisches Apparatewesen, Chemische Technik und Biotechnologie. V. Frankfurt am Main, 1995. ISBN 3 926959-52 5
Earthworm reproduction test (Eisenia fetida/Eisenia andei) Guideline 222. Paris, France: Organization for Economic Cooperation and Development (OECD). 1984. 18 p.
Gamst J., Kjeldsen P., Christensen T.H. Determination of solute organic concentration in contaminated soils using a chemical-equilibrium soil column system // Water, Air and Soil Pollution. 2007. V. 183. № 1–4. P. 377–389.
ISO. Soil quality Guidance on the ecotoxicological characterization of soils and soil materials. ISO 15799. Geneva, Switzerland: International Organization for Standardization; 2003.
Jensen J., Mesman M. (eds). Ecological risk assessment of contaminated land–Decision support for site specific investigations. RIVM report 711701047. The Netherlands, 2006.
Leitgib L., Kalman J., Gruiz K. Comparison of bioassays by testing whole soil and their water extract from contaminated sites // Chemosphere. 2007. V. 66. P. 428–434.
Lors C., Ponge J.F., Martínez Aldaya M. Comparison of solid-phase bioassays and ecoscores to evaluate the toxicity of contaminated soils // Environ. Poll. 2010. V. 158. P. 2640–2647.
Manzo S., De Nicola F., De Luca Picione F., Maisto G., Alfani A. Assessment of the effects of soil PAH accumulation by a battery of ecotoxicological tests // Chemosphere. 2008. V. 71. P. 1937–1944.
Martignon G. Linee guida per la misura della tossicità dei suoli. Test di fiotossicità per il suolo. 2009. Retrieved from http://doc.rse-web.it/doc/doc-sfoglia/ 09000808-1996/09000808-1996.htm.
Maxam G., Rila J.P., Dott W., Eisentraeger A. Use of bioassays for assessment of water-extractable ecotoxic potential of soils // Ecotoxicology and Environmental Safety, Section B, Environmental Research. 2000. V. 45. P. 240–246.
Mertens J., Degryse F., Springael D., Smolders E. Zinc toxicity to nitrification in soil and soilless culture can be predicted with the same biotic ligand model // Environ. Sci. Technol. 2007. V. 41. P. 2992–2997.
Terekhova V.A., Pukalchik M.A., Yakovlev A.S. The triad approach to ecological assessment of urban soils // Eurasian Soil Science. 2014. V. 47. № 9. P. 952–958. doi https://doi.org/10.1134/S1064229314090129
Vaněk A., Ettler V., Grygar T., Borůvka L., Šebek O., Drábek O. Combined chemical and mineralogical evidence for heavy metal binding in mining- and smelting-affected alluvial soils // Pedosphere. 2005. V. 18. № 4. P. 464–478.
Дополнительные материалы отсутствуют.
Инструменты
Почвоведение