Почвоведение, 2019, № 5, стр. 586-594
Оценка влияния аллелотоксичности почв и токсичности фунгицидов на развитие зерновых культур
Г. Н. Федотов 1, *, С. А. Шоба 1, 2, М. Ф. Федотова 1, И. В. Горепекин 1
1 МГУ им. М.В. Ломоносова, факультет почвоведения
119991 Москва, Ленинские горы, 1, Россия
2 МГУ им. М.В. Ломоносова, аграрный центр
119991 Москва, Ленинские горы, 1, Россия
* E-mail: gennadiy.fedotov@gmail.com
Поступила в редакцию 06.07.2018
После доработки 21.08.2018
Принята к публикации 28.11.2018
Аннотация
Аллелотоксичность почв негативно влияет на развитие на них растений, что ярко проявляется в задержке появления всходов в полевых условиях – возникновении временного сдвига в развитии зерновых культур. Разработана методика, позволяющая в лабораторных условиях определить величину временного сдвига. Показано, что, сопоставляя полученные результаты с имеющимися в литературе данными о влиянии сроков посева на снижение урожайности, можно оценить воздействие на нее аллелотоксичности почв. Для этого в работе использовали задержку времени прорастания семян и развития их проростков в почвах по сравнению с кварцевым песком, не содержащим токсинов. Установлено, что зависимость временного сдвига, выраженного в процентах, от величины аллелотоксичности почв носит экспоненциальный характер. В результате при значительных величинах аллелотоксичности почв временной сдвиг может в разы превышать время развития семян на инертном субстрате. Показано, что предпосевная обработка семян фунгицидами в некоторых случаях очень сильно увеличивает совместное ингибирование прорастания семян и развития их проростков почвами и фунгицидами. Для предотвращения снижения урожайности перед применением фунгицидов на конкретных культурах (сортах) и почвах требуется проверка возможности их использования по разработанной лабораторной методике.
ВВЕДЕНИЕ
Негативное влияние почв на развитие растений известно довольно давно [1, 7, 23]. Обусловлено оно накоплением в почве токсинов [6, 7, 20, 23, 25] из-за ее высокой сорбционной способности.
Известны различные пути поступления в почву фитотоксинов. Растения используют химические вещества для борьбы со стрессовыми воздействиями и конкурентами [1, 10, 14, 19]. В процессе эволюции растения создали универсальные вещества, которые помогают им бороться одновременно со многими видами негативных воздействий. В результате проявление любых негативных факторов в процессе вегетации приводит к усилению выработки растениями токсинов, выделению их и повышению аллелотоксичности почв [21, 22, 25]. Токсичные вещества вырабатываются микроорганизмами, разлагающими растительные остатки [1, 7, 9, 19, 23], и выделяются из самих растительных остатков при их разложении в почвах [1, 18, 20]. Они выделяются фитопатогенными микроорганизмами [18], к их появлению в почвах приводят воздействия, меняющие микробиологический состав почв [8, 12]. Отмечается заметное усиление аллелотоксичности почв при избыточном использовании минеральных удобрений [4, 9].
Природа естественных фитотоксинов весьма разнообразна. Среди них были обнаружены: простые водорастворимые органические кислоты, спирты с неразветвленной цепью, алифатические альдегиды и кетоны, простые ненасыщенные лактоны, жирные кислоты с длинной цепью, нафтохиноны, антрахиноны и сложные хиноны, терпеноиды и стероиды, простые фенолы, бензойная кислота и их производные, коричная кислота и ее производные, кумарины, флавоноиды, танины, аминокислоты и полипептиды, алколоиды и циангидрины, сульфиды и гликозиды горчичного масла, пурины и нуклеозиды – 14 групп химических соединений [24].
Исследование химического состава почв не позволяет однозначно определять наличие аллелотоксинов в почвах и их содержание. Связано это с тем, что, во-первых, как показано выше, соединений, которые могут ингибировать развитие растений, достаточно много, что делает количественный анализ содержания этих веществ в почвах трудновыполнимой задачей. Во-вторых, токсины закреплены в почвах (прежде всего, в органическом веществе почв) связями с сильно отличающейся энергией [1]. В результате практически невозможно определить какая часть молекул токсинов, находящихся в почве, будет оказывать негативное влияние на растения, а к каким из них растения будут нечувствительны. В-третьих, токсины во многих случаях представляют собой смесь различных веществ, причем концентрация каждого из компонентов смеси может быть ниже порога ингибирования, а суммарное угнетение может быть очень сильным [19]. В-четвертых, некоторые из веществ сами по себе не являются токсичными (сахара), но значительно усиливают действие токсинов [20].
В связи с трудностью получения значимой информации методами химического анализа основными способами изучения аллелотоксичности почв должны являться методы биотестирования, которые имеют определенные недостатки [1, 10, 14, 19].
Эффекты ингибирования фитотоксинами особенно сильно проявляются при прорастании семян и развития из них растений [6, 20], поэтому аллелотоксичность почв изучали, как правило, ориентируясь на прорастание семян. Наиболее распространено изучение влияния вытяжек из почв на развитие семян [1, 19], но существуют методы оценки аллелотоксичности почв при помощи набора тест-культур [5, 15]. Первая группа методов фактически позволяет на качественном уровне получить ответ на вопрос о наличии аллелотоксичности, так как переход токсинов из почвы в вытяжку с последующим воздействием вытяжки на семена может не соответствовать воздействию аллелотоксинов на семена, прорастающие в почве, содержащей эти токсины. Метод тест-культур тоже имеет свои ограничения из-за того, что растения обладают разной толерантностью к фитотоксинам [10, 14] и, установив степень токсичности почв на тестовых объектах, невозможно предсказать поведение на этих почвах конкретных культур.
Эти недостатки были преодолены в методике, позволяющей определять ингибирование прорастания и развития семян в изучаемых почвах по сравнению с инертным субстратом – песком при оптимальных влажностях песка и почв по суммарной длине проростков больших массивов семян (1000–1200 шт.) [17].
Однако при переходе к практике возник закономерный вопрос: как полученные данные о соотношении суммарных длин проростков семян, выросших за двое суток на песке и почвах, выраженные в процентах, могут характеризовать развитие растений в реальных условиях и влияют на урожайность?
Целью работы являлся поиск связи между данными по ингибированию развития семян почвами, получаемыми в лабораторных условиях, и вероятным снижением урожайности зерновых культур.
Подход основывался на литературных данных о влиянии задержки в сроках посева на снижение урожайности. Для ярового ячменя были получены результаты, которые свидетельствуют, что задержка на 5 дней приводит к изменению урожайности с 34.7 до 31.8 ц/га (–8.4%), на 10 дней – до 27.7 ц/га (–20.2%), на 15 дней – до 20.9 ц/га (‒39.8%) [3]. Целью авторов было выяснение наличия связи между сроками посева и урожайностью ячменя, чтобы показать, что ранние сроки сева ячменя приводят к увеличению его урожайности. Поэтому они проводили посев ячменя в одних и тех же условиях в 5–6 сроков. В работе [3] представлены результаты, полученные другими исследователями, и данные, полученные самими авторами в разные годы. Во всех случаях общая зависимость урожайности от запаздывания в сроках сева сохраняется. Эти данные привлекли наше внимание в связи с тем, что запаздывание в сроках посева по своему влиянию на развитие растений и урожайность должно быть аналогично (близко) замедлению прорастания семян и развития из них растений за счет ингибирования почвенными токсинами. Мы можем сеять в оптимальные сроки, но аллелотоксичность почв (ингибирование почвенными аллелотоксинами развития семян) приведет к тому, что всходы появятся с запаздыванием, величина которого будет определяться величиной аллелотоксичности почв. В результате сравнение с “идеальной” почвой, не содержащей токсинов, дает возможность определить время запаздывания (временной сдвиг). Используя полученные для ячменя данные по влиянию сроков сева на урожайность, можно приблизительно оценить потери урожая от аллелотоксичности почв.
Из этого следовало, что для установления связи между ингибированием развития семян почвами и снижением урожайности растений в реальных условиях необходимо установить время задержки прорастания семян при их развитии в почвах по сравнению с их развитием в песке.
ОБЪЕКТЫ И МЕТОДЫ
Исследования проводили на семенах яровой пшеницы (Triticum) сорт Лиза, озимого тритикале (Triticosecale) сорт Немчиновский 56, ярового ячменя (Hordeum) сортов Нур и Раушан и озимой ржи (Secale cereale) сорт Татьяна.
В работе использовали сухой отмытый речной песок с размером частиц 0.5–0.8 мм, образцы дерново-подзолистой почвы из окрестностей поймы р. Яхрома влажностью 18.1% (после зерновых), серой лесной почвы из Тульской области (Щекинский район) влажностью 21.6% (после зерновых), а также чернозема типичного из Липецкой области (Данковский район) влажностью 33.1% (после картофеля).
Было изучено влияние почв на изменение длины проростков11 7.5 г семян (~200 шт.) при их прорастании в различных почвах. Длину проростков определяли, используя экспресс-метод, основанный на существовании линейной зависимости между насыпным объемом проросших семя в воде и длиной их проростков [16]. Проросшие в почве или песке семена отмывали от субстрата и помещали порциями в мерный цилиндр на 100 мл с водой, размещенный на вибростоле22, колеблющемся с частотой 50 Гц. После помещения каждой порции проросших семян в цилиндр, которые создавали ажурную пористую структуру на них на 15–20 с помещали небольшой груз массой 8 г в виде резиновой пробки, что приводило к уплотнению структуры. После помещения всех проросших семян в цилиндр на них клали груз и осуществляли дополнительное уплотнение структуры легкими постукиваниями (30–40) цилиндра с семенами о стол. Эти операции позволяли создать достаточно однородную структуру, а нижняя граница груза давала возможность определять насыпной объем с точностью до 0.5 мл.
При проращивании семян на дно чашки диаметром 95 мм помещали 30 г почвы или песка, затем ровным слоем размещали 7.5 г семян, а сверху – 30 г почвы или песка соответственно. После этого в чашку равномерно добавляли из мерной пипетки воду. Использовали шестикратную повторность с последующей статистической обработкой результатов. В связи с применением в одном опыте 1000–1200 семян, удалось минимизировать ошибку, связанную с разнокачественностью семян [13]. В результате ошибка опыта не превышала 7% при 95%-ной доверительной вероятности. Большую часть экспериментов проводили при температуре 23–25°С, но для получения информации о соотношении скоростей развития семян яровых культур при этих температурах и в реальных условиях часть сравнительных экспериментов была проведена при температуре 10–12°С.
Для определения аллелотоксичности почв (ингибирования прорастания семян почвами) измеряли суммарную длину проростков семян, развившихся в почве по сравнению с прорастанием в песке за одинаковое время. Затем определяли величину ингибирования, выражая ее в процентах, по формуле:
В связи с существованием линейной зависимости между длиной проростков и насыпным объемом проросших семян, величину ингибирования можно было рассчитать напрямую, используя определяемые величины насыпных объемов:
Для обработки семян использовали фунгициды:
– “Фитоспорин М” с концентрацией раствора 100 г/л при расходе раствора 20 л/т семян;
– “Раксил Ультра” с концентрацией раствора 50 г/л при расходе раствора 20 л/т семян;
– “Тебу 60” с концентрацией раствора 100 г/л при расходе раствора 20 л/т семян.
Для этого 50 г семян помещали в пластиковую лодочку размером 20 × 7 см, глубиной 4 см, добавляли навеску раствора фунгицида 1 г и тщательно перемешивали примерно 1 мин до достижения равномерной окраски семян.
Вегетационные опыты проводили, высевая по 10 семян в пластиковые вегетационные сосуды диаметром 150 мм, содержащие по 800 г почв. Надземную часть растений срезали через 12–14 дней и взвешивали. Повторность – четырехкратная.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные в результате проведения экспериментов кинетические зависимости изменения длины проростков для ряда культур при проращивании их семян на различных почвах имели линейный характер (рис. 1). Затем был определен временной сдвиг – время, за которое проростки достигают в почвах той же суммарной длины, что и при выращивании на песке.
Рис. 1.
Длина проростков 7.5 г семян в зависимости от времени их прорастания и развития проростков в различных почвах: А – тритикале, сорт Немчиновский 56 в дерново-подзолистой почве; Б – ячмень сорт Раушан в черноземе; В – пшеница, сорт Лиза в дерново-подзолистой почве; Г – пшеница, сорт Лиза в серой-лесной почве; Д – рожь, сорт Татьяна в черноземе; Е – ячмень, сорт Нур в серой лесной почве. Значками изображены экспериментальные значения длины проростков, которые определяли через разные промежутки времени. Линией, построенной по экспериментальным данным, показана зависимость длины проростков семян от времени прорастания.
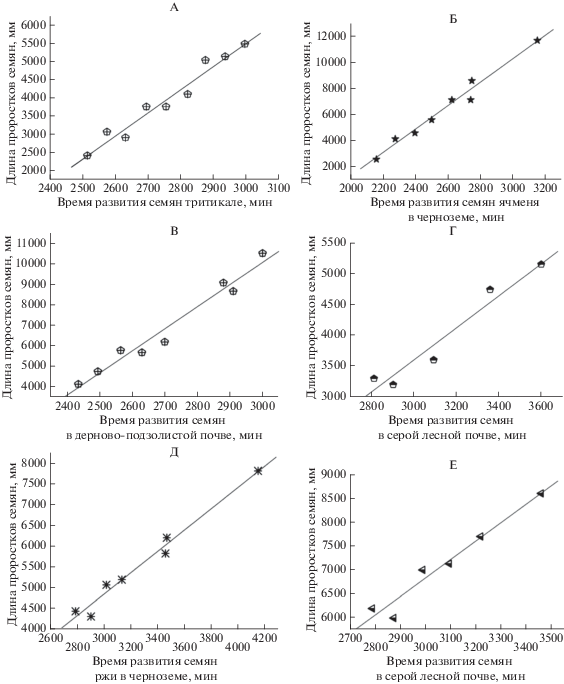
Временной сдвиг выражали в процентах от времени развития семян до того же состояния, что и на песке, так как удобно получать информацию при комнатной температуре, а яровые культуры прорастают при пониженных температурах, что приводит к заметному замедлению их развития.
Проведенные эксперименты на яровой пшенице сорта Лиза показали, что при 10–12°С семена прорастают примерно в 3.5 раза медленнее по сравнению с температурой 23–25°С. При этом пропорционально увеличивается и величина временного сдвига при прорастании семян на почве по сравнению с их прорастанием на песке. Поэтому в дальнейших расчетах для оценки временного сдвига для яровых культур использовали коэффициент 3.5, характеризующий влияние температуры на развитие семян.
Кроме того, выражение временного сдвига в процентах от времени развития семян в почвах до того же состояния, что и в песке, позволяет нанести все полученные данные для различных пар культура – почва (табл. 1) на один график (рис. 2).
Таблица 1.
Взаимосвязь временного сдвига с ингибированием прорастания семян, полученных для разных пар “культура–почва”
| Культура | Почва | Ингибирование | Временной сдвиг |
|---|---|---|---|
| % | |||
| Тритикале, сорт Немчиновский 56 | Дерново-подзолистая | 20 ± 5 | 6 |
| Яровой ячмень, сорт Раушан | Чернозем | 38 ± 5 | 18 |
| Пшеница яровая, сорт Лиза | Дерново-подзолистая | 38 ± 5 | 11 |
| Озимая рожь, сорт Татьяна | Чернозем | 55 ± 6 | 44 |
| Пшеница яровая, сорт Лиза | Серая лесная | 67 ± 5 | 92 |
| Яровой ячмень, сорт Нур | Серая лесная | 52 ± 6 | 45 |
Рис. 2.
Зависимость временного сдвига от ингибирования при развитии семян в почвах по сравнению с песком. Обозначения: 1 – озимый тритикале, сорт Немчиновский 56 – дерново-подзолистая почва; 2 – яровой ячмень, сорт Раушан – чернозем, 3 – яровая пшеница, сорт Лиза – дерново-подзолистая почва; 4 – озимая рожь, сорт Татьяна – чернозем; 5 – яровая пшеница, сорт Лиза – серая лесная почва; 6 – яровой ячмень, сорт Нур – серая лесная почва.
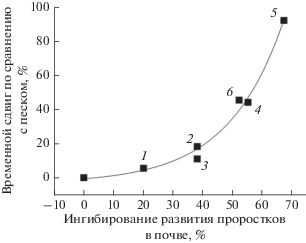
Хорошо видно, что расположение точек на графике аппроксимируется экспоненциальной кривой первого порядка с коэффициентом корреляции около 99%. Из полученной зависимости следует, что до величин ингибирования прорастания семян почвами 40–50% временной сдвиг достаточно мал и не превышает 20–35%. Влияние, которое может оказывать задержка в развитии семян такой величины на урожайность, не будет очень большим. Так, при прорастании семян яровых культур в реальных условиях на песке в течение 8–10 дней, временной сдвиг обеспечит увеличение времени прорастания на почвах до 10–13 дней (20–35% от 8–10 дней). Это следует из представленных данных (рис. 1 и 2) с учетом температурного коэффициента 3.5. На основе данных работы [3] мы можем оценить, что потери урожая не будут очень значительными – в пределах 5–10%. Следовательно, при уровне аллелотоксичности почв, замедляющем прорастание семян и развитие их проростков на величину менее 30–40%, проявление в полевых условиях аллелотоксичности почв малозаметно. Оно составляет по потерям урожая менее 5%, что находится в рамках статистической погрешности при проведении полевых испытаний.
Однако ситуация меняется при превышении величины ингибирования 60%. Временной сдвиг начинает резко возрастать, превышая время прорастания семян на песке в разы при величине ингибирования более 70%. Следовательно, семена будут прорастать уже не 8–10 дней, а 16–20 дней и более. Для ячменя согласно представленным данным [3] это составит потерю урожая 20–40%.
Таким образом, по полученной экспоненциальной зависимости замедления прорастания семян и развития проростков (временного сдвига) от ингибирования развития проростков почвами, выраженном в процентах, можно получить замедление времени развития семян (в процентах). Используя полученный коэффициент пересчета (3.5) при температурах почв, соответствующих прорастанию в них яровых культур, можно перейти к временному сдвигу в сутках. Далее, принимая, что замедление прорастания идентично более позднему посеву, на основе данных, имеющихся в литературе для ячменя [3], можно оценить снижение урожайности за счет аллелотоксичности почв.
Вполне очевидно, что данная процедура позволяет получить только приближенную оценку, но даже она являются шагом вперед по сравнению с абстрактными величинами ингибирования, получаемыми в лабораторных условиях, которые надо как-то переносить на развитие растений в реальных условиях.
В связи с тем, что при построении зависимости ингибирование–временной сдвиг пары культура–почва подбирались произвольно, можно ожидать, что полученная экспоненциальная зависимость будет отражать не только их поведение.
Получаемая таким методом информация может оказаться очень важной для изучения совместного влияния фунгицидов и аллелотоксичности почв на прорастание семян и их последующее развитие. Связано это с тем, что многие фунгициды оказывают угнетающее влияние на развитие семян, причем степень угнетения зависит от индивидуальной реакции на конкретные фунгициды различных сортов и культур (табл. 2).
Таблица 2.
Ингибирование прорастания семян (%), обработанных фунгицидами и прорастающих в дерново-подзолистой почве и черноземе
| Культура (сорт) – почва | Фунгицид | ||
|---|---|---|---|
| “Фитоспорин-М” | “Раксил Ультра” | “Тебу 60” | |
| Яровая пшеница (Лиза) – дерново-подзолистая почва | –37 ± 5 | –44 ± 6 | –48 ± 6 |
| Яровой ячмень (Раушан) – чернозем | –40 ± 5 | –62 ± 7 | –83 ± 8 |
Отметим, что речь идет не об отказе от фунгицидов из-за их токсичности, а о выборе для конкретных культур наименее токсичных для этих культур фунгицидов – подборе фунгицидов под семена.
Полученные данные свидетельствуют, что важна не столько токсичность фунгицида для определенных семян, сколько совместное ингибирование развития семян аллелотоксинами почв и фунгицидом. При токсичности фунгицида (возьмем для примера ингибирование 30%) потери урожайности будут очень сильно зависеть от аллелотоксичности почв, на которых высевают обработанные фунгицидом семена. При малой аллелотоксичности почв, при нахождении на левой ветви экспоненциальной зависимости (рис. 2) потери урожая не будут очень заметными, а при суммарном ингибировании (почвами и фунгицидами) более 70–80% (ингибирование почвами 40–50%) мы попадаем на правую часть кривой, где урожай можно потерять практически полностью. Именно проверку величины совместного ингибирования развития конкретных семян, выбранных для работы с фунгицидами на почвах, в которые семена предполагается сеять, мы и предлагаем проводить, чтобы в случае высоких величин совместного ингибирования подобрать более подходящий фунгицид.
Так, ингибирование прорастания семян пшеницы сорт Лиза дерново-подзолистой почвой и ячменя сорт Раушан черноземом составляет около 38% (табл. 1). Однако суммарное ингибирование почвами и фунгицидами для этих семян сильно отличается. Для пшеницы увеличение ингибирования при обработке фунгицидами имеет достаточно небольшую величину, для наиболее токсичного фунгицида “Тебу 60” ингибирование возрастает с 38 до 48%. Для ячменя сорт Раушан для фунгицидов “Раксил Ультра” и “Тебу 60” наблюдается совершенно другая ситуация. Для фунгицида “Раксил Ультра” ингибирование возрастает с 38 до 62%, что соответствует временному сдвигу около 60% (5–6 сут). Пересчет предлагаемым выше способом приводит к оценке возможных потерь урожайности около 10%. Для фунгицида “Тебу 60” ингибирование увеличивается с 38 до 83%, что соответствует временному сдвигу порядка 150% (12–15 сут) и потере урожайности около 40%.
Фотографии проросших за двое суток семян ячменя сорт Раушан, необработанных (рис. 3, II, А) и обработанных фунгицидом “Тебу 60” (рис. 3, II, Б) и данные вегетационных опытов за 2 нед. (рис. 3, I, А и Б) подтверждают справедливость сделанных выводов.
Рис. 3.
Фотографии растений ярового ячменя, сорт Раушан, выросших за 2 недели (I) и за двое суток (II) в черноземе из семян, необработанных (А) и обработанных (Б) фунгицидом “Тебу 60”.

На фотографиях проросших семян (рис. 3, II, А и Б) хорошо видно, что проростков у обработанных фунгицидом “Тебу 60” семян намного меньше, и многие семена даже не проклюнулись.
Негативное влияние проявляется и при дальнейшем росте растений (рис. 3, II, А и Б). В контроле из 40 семян дали всходы 36 шт., а при обработке фунгицидом “Тебу 60” всего 15 шт. При этом надземная фитомасса у выросших за 2 нед. растений отличается почти в 3 раза.
Таким образом, выбор фунгицидов для предпосевной обработки семян для посева на конкретных полях в хозяйствах путем оценки для изучаемых сортов суммарного ингибирования развития семян почвами и фунгицидами, на наш взгляд, выглядит особенно перспективно для яровых культур, так как образцы почвы можно отобрать осенью, и есть достаточно времени для проведения лабораторных испытаний.
ВЫВОДЫ
1. Для оценки влияния аллелотоксичности почв на урожайность растений предлагается использовать временной сдвиг – задержку времени прорастания семян и развития их проростков в почвах по сравнению с песком.
2. Зависимость временного сдвига, выраженного в процентах, от величины ингибирования развития семян почвами имеет экспоненциальный характер. В результате при величине ингибирования более 70% временной сдвиг может в несколько раз превышать время прорастания и развития семян в песке.
3. Предпосевная обработка семян фунгицидами может при значительной аллелотоксичности почв очень сильно увеличивать ингибирование прорастания и развития семян. В результате применение фунгицидов для их использования на конкретных культурах (сортах) и почвах требует предварительной проверки, чтобы значительно не понизить урожайность.
Список литературы
Гродзинский А.М., Богдан Г.П., Головко Э.А., Дзюбенко Н.Н., Мороз П.А., Прутенская Н.И. Аллелопатическое почвоутомление. Киев: Наукова думка, 1979. 248 с.
Животков Л.А., Бирюков С.В., Степаненко А.Я. и др. Пшеница. Киев: Урожай, 1989. 320 с.
Зарецкий А.Ф. Посевные и урожайные качества семян ярового ячменя. Минск: Ураджай, 1979. 88 с.
Зинченко М.К., Селицкая О.В. Биологическая токсичность серой лесной почвы в зависимости от систем удобрений // Агрохимический вестник. 2011. № 5. С. 38–40.
Качество почвы. Биологические методы. Хроническая фитотоксичность в отношении высших растений. ГОСТ Р ИСО 22030-2009.
Коношина С.Н. Влияние различных способов использования почвы на ее аллелопатическую активность. Дис. … канд. с.-х. н. Орел, 2000. 145 с.
Красильников Н.А. Микроорганизмы почвы и высшие растения. М.: Изд-во АН СССР, 1958. 464 с.
Лобко В.Т. Экологические основы почвоутомления в полевых агроценозах Центрально-черноземной полосы России. Автореф. дис. … докт. с.-х. н. Курск, 1994. 32 с.
Мирчинк Т.Г. Почвенная микология. Учебник. М.: Изд-во Моск. ун-та, 1988. 220 с.
Млечко Е.А., Мотренко А.В. Аллелопатическое действие водного экстракта шалфея эфиопского (Salvia Aethiopis L.) на прорастание семян тест-растений // Вестник ВолГУ. 2015. Сер. 9. Вып. 13. С. 10–14.
Обручева Н.В., Антипова О.В. Физиология инициации прорастания семян // Физиология растений. 1997. Т. 44. № 2. С. 287–302.
Рудаков В.О., Рудаков О.Л. Природа почвенных фитоксикозов и проблема защиты растений // А-гро ХХI. 2009. № 1–3. С. 11–13.
Сечняк Л.К., Киндрук Н.А., Слюсаренко О.К., Иващенко В.Г., Кузнецов Е.Д. Экология семян пшеницы. М.: Колос, 1983. 349 с.
Симагина Н.О. Аллелопатический потенциал древесных растений // Уч. зап. Таврического национ. ун-та им. В.И. Вернадского. Сер. Биология, химия. 2013. Т. 26(65). № 1. С. 186–193.
Стаценко А.П., Гришин Г.Е., Чернышов В.Е. Способ оценки почвоутомления. Патент РФ 2181238, 2002.
Федотов Г.Н., Шалаев В.С., Батырев Ю.П. Проблема разработки стимуляторов развития семян // Мат-лы междунар. научно-практической конф. Воронеж, 2018. Т. 1. С. 615–623.
Федотов Г.Н., Шоба С.А., Федотова М.Ф., Горепекин И.В. Влияние аллелотоксичности почв на прорастание семян зерновых культур // Почвоведение. 2019. № 4. doi https://doi.org/10.1134/S0032180X19040051
Шутко А.П. Биологическое обоснование оптимизации системы защиты озимой пшеницы от болезней в Ставропольском крае. Автореф. дис. … докт. с.-х. н. СПб. – Пушкин. 2013. 41 с.
Allelopathy. A Physiological Process with Ecological Implications / Eds.: M.J. Reigosa, N. Pedrol, L. Gonzalez. Published by Springer. Printed in the Netherlands. 2006. 637 p.
Blum U. Allelopathy: A Soil System Perspective // Allelopathy. A Physiological Process with Ecological Implications / Eds.: M.J. Reigosa, N. Pedrol and L. Gonzalez. Published by Springer. Printed in the Netherlands. 2006. P. 299–340.
Cheng F., Cheng Z. Research Progress on the use of Plant Allelopathy in Agriculture and the Physiological and Ecological Mechanisms of Allelopathy // Frontiers in Plant Science. November 2015. V. 6. Article 1020.
Ghulam J., Shaukat M., Arshad N.C., Imran H., Muhammad A. Allelochemicals: sources, toxicity and microbial transformation in soil – a review // Annals of Microbiology. 2008. V. 58(3). P. 351–357.
McCalla T.M., Haskins F.A. Phytotoxic Substances from Soil Microorganisms and Crop Residues // Bacteriological Reviews. 1964. V. 28. № 2. P. 181–207.
Rice E.L. Allelopathy. N.Y.-London: Academic Press, 1984. 422 p.
Vokou D., Chalkos D., Karamanoli K. Microorganisms and Allelopathy: A One-Sided Approach / Allelopathy. A Physiological Process with Ecological Implications. Edited by M.J. Reigosa, N. Pedrol and L. Gonzalez. Published by Springer. Printed in the Netherlands. 2006. P. 341–371.
Дополнительные материалы отсутствуют.


