Почвоведение, 2019, № 8, стр. 946-955
Температурная чувствительность дыхания почв бугристых торфяников севера Западной Сибири
М. О. Тархов 1, *, Г. В. Матышак 1, И. М. Рыжова 1, О. Ю. Гончарова 1, А. А. Бобрик 1, Д. Г. Петров 1, Н. М. Петржик 1
1 МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: tarkhov.mo@gmail.com
Поступила в редакцию 06.06.2018
После доработки 18.12.2018
Принята к публикации 15.02.2019
Аннотация
В лабораторных условиях методами последовательного увеличения температур (ПУТ) и равных времен (РВ) изучена реакция верхних (Т1) и нижних (Т2) торфяных горизонтов торфяно-криозема (Turbic Histic Cryosol (Dystric)) севера Западной Сибири на увеличение температуры. Методом ПУТ оценен отклик скорости минерализации органического углерода (R) на последовательное увеличение температуры с 5 до 30°C, методом РВ – отклик базального (микробного) дыхания на одновременную инкубацию при 5, 15 и 25°C. По результатам экспериментов рассчитан коэффициент температурной чувствительности Q10. В гор. Т1 при повышении температуры увеличение отклика составило 91 и 84%, в гор. Т2 – 93 и 91% для методов ПУТ и РВ соответственно. Несмотря на стабильное увеличение отклика, расчет значений Q10 выявил разные закономерности температурной чувствительности. Установлено, что наибольшие значения Q10 для обоих горизонтов относятся к холодному 5–15°C интервалу температур. В большинстве интервалов температур Q10 выше для гор. Т2, чем для Т1. Для гор. Т1 в случае метода ПУТ Q10 изменялся слабо и находился в диапазоне 2.7–3.0, тогда как в случае метода РВ снижался в 3.3 раза от холодного (4.9) к теплому 15–25°C (1.5) интервалу температур. Для гор. Т2 при использовании метода ПУТ Q10 также изменялся слабо и варьировал в диапазоне 3.0–3.5, а при использовании метода РВ уменьшался в 1.5 раза от холодного (4.3) к теплому (2.8) интервалу. Таким образом, метод РВ по сравнению с методом ПУТ приводит к более контрастной динамике значений Q10, что свидетельствует о его большей применимости для задач по оценке температурной чувствительности торфяных почв криолитозоны в лабораторных условиях.
ВВЕДЕНИЕ
Торфяные почвы – один из наиболее репрезентативных объектов биосферы в контексте изучения эффекта прогнозируемых климатических изменений [52, 55]. При моделировании реакции экосистем криолитозоны на возможное потепление им отводится особая роль [28, 29]. Данные почвы являются крупным резервуаром углерода: на их долю приходится приблизительно 1/5 часть от величины общего запаса углерода в почвах Земли [26], что определяет их значительный вклад в регулирование наземного углеродного баланса [18]. Запас углерода, законсервированный в органогенных почвах криолитозоны, характеризуется повышенной чувствительностью к изменениям климата [42, 43, 45], которые могут привести к существенной дополнительной эмиссии углеродсодержащих парниковых газов [31, 50]. На территории криолитозоны России торфяные почвы широко распространены, заболачивание является одним из самых активных современных процессов в Западной Сибири, достигая своего максимума в зоне островного и локального распространения многолетнемерзлых пород [9]. Вклад торфяных почв криолитозоны России в общую величину углеродного стока торфяниками Земли существенен и превышает 35% [54]. Перечисленные факты определяют необходимость тщательного изучения реакции торфяных почв Севера на климатические изменения.
Общепринятым параметром для оценки отклика почв на потепление является температурная чувствительность [30]. В современной литературе под этим термином понимается отклик дыхания почв [17, 32], в разных работах рассматриваемый как изменение величины эмиссии парниковых газов [21, 47], скорости минерализации органического вещества [37, 51] или скорости базального дыхания [15, 23]. Температурную чувствительность почв также принято оценивать на основании анализа динамики таких показателей, как содержание водорастворимого органического углерода [25, 27] или содержание углерода микробной биомассы [20]. Для количественной оценки температурной чувствительности почв используют коэффициент Q10, который отражает отклик исследуемых показателей на повышение или снижение температуры на 10°C [34].
Вопросы температурной чувствительности почв широко освещены в современной литературе, но в основном для минеральных почв бореальных регионов. Среди таких публикаций встречаются как экспериментальные исследования [33, 41], так и работы по моделированию отклика почв [38, 40]. В отечественной литературе известны немногочисленные работы, которые рассматривают температурную чувствительность минеральных почв [6] или температурную чувствительность торфяных почв, формирующихся вне пределов криолитозоны [5, 12]. Вместе с тем количество публикаций, посвященных температурной чувствительности почв торфяников криолитозоны, по-прежнему невелико.
Цель работы – количественно оценить температурную чувствительность дыхания почв бугристых торфяников севера Западной Сибири по результатам лабораторных экспериментов. Задачи исследования: 1) изучить температурную чувствительность дыхания торфяных горизонтов разной степени разложения; 2) оценить особенности отклика образцов почв бугристых торфяников в зависимости от используемых лабораторных методов исследования температурной чувствительности.
ОБЪЕКТ ИССЛЕДОВАНИЙ
Территория исследований расположена на севере Западной Сибири (Надымский район, Тюменская область, ЯНАО) на границе распространения северо-таежных и лесотундровых экосистем (65°20′ N, 72°55′ E), на междуречье рек Хейгияха, Левая Хетта. Для территории характерно прерывистое распространение многолетнемерзлых пород (ММП) и высокая контрастность почвенного и растительного покровов. Наиболее распространены два типа ландшафта: автоморфные лесные экосистемы, характеризующиеся отсутствием ММП, и гидроморфные/полугидроморфные ландшафты с наличием ММП в пределах 0.5–1.0 м [10]. Последние преимущественно представлены комплексом верховых олиготрофных болот и бугристых торфяников – специфических вариантов болотных экосистем, образование которых обусловлено активно идущими процессами криогенного пучения/протаивания. В растительном покрове бугристых торфяников преобладают кустарничково-багульниково-лишайниковые и кустарничково-багульниково-сфагновые сообщества [11], развитые на комплексе торфяных олиготрофных почв, торфяно-криоземов и торфяно-глееземов. Почвообразующие породы представлены, в основном, аллювиальными песчаными отложениями [10].
Объект исследования – наиболее типичные для заболоченных экосистем района исследований почвы бугристых торфяников – торфяно-криоземы [7] (Turbic Histic Cryosol (Dystric), O–T–CR–C⊥), функционирующие в условиях слабоотрицательных среднегодовых температур и активно идущих криогенных процессов. Близость расположения ММП, залегающих в пределах 1 м, определяет высокую неоднородность свойств торфяно-криоземов. Для них характерно чередование торфяных горизонтов разного типа, вихреватые границы, сильное варьирование мощностей и инверсии горизонтов в результате морозобойного растрескивания, пучения и криотурбаций. Мощность органопрофиля редко превышает 0.5 м. Он представлен 2–3 торфяными горизонтами различного ботанического состава и степени разложения, характеризующими современные условия развития торфяника. В рамках данной работы изучена реакция органопрофиля торфяно-криозема, представленного двумя торфяными горизонтами. Гор. Т1 – мощность 23 см, желто-бурый, слаборазложенный (сфагнум), сильноволокнистый, много мелких корней, рыхлый, граница волнистая, переход резкий по цвету и составу торфа. Гор. Т2 – мощность 7 см, темно-коричневый, сильноразложенный, мажущийся, мало мелких корней, плотный, граница языковатая с резким слабопрокрашенным переходом к минеральной части профиля, представленной сильнотурбированным супесчаным гор. CR светло-коричневого цвета.
МЕТОДЫ ИССЛЕДОВАНИЙ
Полевой этап. В августе 2016 г. для изучения параметров функционирования почв в полевых условиях проведены исследования на типичном участке бугристого торфяника. В трех точках на ровной основной поверхности торфяника ежедневно измеряли влажность и температуру торфяно-криозема в слое 0–10 см, мощность сезонно-талого слоя, эмиссию СО2. Температурные наблюдения проводили с использованием термозондов Taylor 9841 RB и логгеров Thermochron iButtonTM. Влажность почв определяли потенциометрически с использованием полевого влагомера FieldScout TDR 100 (Spectrum). Глубину протаивания измеряли методом зондирования щупом по ГОСТ 26262-2014. Эмиссию СО2 исследовали методом закрытых камер [13] на предварительно подготовленных участках с удаленным растительным покровом. Использовали стальные камеры (объемом 850 мл) с герметичным клапаном для отбора проб воздуха с помощью шприца объемом 10 мл. Подробно примененная методика описана в публикации Бобрик и соавт. [1]. В дополнение к описанной методике для повышения герметичности камеры использовали пластиковые основания диаметром 10 см и высотой 5 см с желобом для установки камеры, предварительно заглубленные в почву на глубину 3 см. В желоб оснований приливали воду для снижения диффузии и уменьшения возможных газообразных потерь. Концентрацию СО2 определяли на портативном инфракрасном газоанализаторе RMT DX6210.
После окончания мониторинговых наблюдений непосредственно из точек опробования отобрали образцы почвенных горизонтов торфяно-криозема: Т1 (5–28 см) и Т2 (28–35 см). При отборе предварительно удаляли верхний сфагновый/мохово-ягелевый очес. Отдельно отбирали образцы ненарушенного строения в поливинилхлоридные кюветы диаметром и высотой 10 см. Далее образцы ненарушенного строения и прочие образцы транспортировали в лабораторию: образцы ненарушенного строения хранили в нативном виде в кюветах при температуре 5°C, накрыв герметизирующей пленкой (парафильм) для предотвращения потерь влаги; прочие образцы хранили в полиэтиленовых пакетах также при 5°C до старта лабораторных исследований (свежие образцы).
Лабораторный этап. Методы исследования температурной чувствительности почв. Для оценки температурной чувствительности почв использовали два метода: последовательного увеличения температуры (ПУТ, Sequential method) и равных времен (РВ, Equal-time method) [30].
Методом ПУТ проводили оценку отклика скорости минерализации органического углерода почв [6] (R) на увеличение температуры. Метод подразумевает изучение воздействия последовательного увеличения температуры на один и тот же почвенный образец. Для данного метода использовали почвенные образцы ненарушенного строения, помещенные в поливинилхлоридные кюветы диаметром и высотой 10 см, с пластиковым желобом по периметру (для установки камер) – микрокосмы. Высота образцов почв в микрокосмах составляла 8 см, а их масса варьировала от 27 ± 6.0 (в среднем для гор. Т1) до 102 ± 6.5 г (в среднем для гор. Т2) абсолютно-сухой почвы. Использование образцов ненарушенного строения обусловлено двумя факторами: а) необходимостью изучения отклика нативных торфяных образцов – образцов с морфологическими свойствами, максимально приближенными к естественным условиям; б) спецификой метода ПУТ, который предполагает возможность фиксации отклика не только быстро разлагающихся и легкодоступных фракций органического углерода, но также медленно разлагающихся и труднодоступных фракций с пролонгацией инкубационного периода [30]. В эксперименте участвовало 16 микрокосмов – образцы из гор. Т1 и Т2 в 8-кратной повторности каждый. Микрокосмы предварительно инкубировали при 5°C в течение недели для стабилизации фонового выделения СО2 [44]. Далее микрокосмы подвергали последовательному увеличению температуры с 5 до 30°C с шагом в 5°C раз в 3 дня. Измерение R проводили каждый день и оценивали по приросту выделения СО2 за 30 мин инкубации методом закрытых камер [13]. Использовали камеры, конструктивно аналогичные камерам, применявшимся для измерения эмиссии СО2 в рамках полевого этапа. Камеры устанавливали в пластиковый желоб микрокосма, заполненный водой (водяной замок) для снижения диффузии и уменьшения возможных газообразных потерь, и отбирали стартовую пробу СО2. Через 30 мин отбирали результирующую пробу СО2. В микрокосмах ежедневно контролировали влажность образцов почв путем взвешивания, при необходимости добавляя воду до исходного уровня массовой влажности, определенного на старте эксперимента – 853% для гор. Т1 и 193% для гор. Т2.
Скорость дыхания (R) выражали в мкг С–СО2/(г почвы ч) и рассчитывали по формуле [6]:
(1)
$R = {{(dC \times 12V \times 1000)} \mathord{\left/ {\vphantom {{(dC \times 12V \times 1000)} {(m \times 22.4t \times 100)}}} \right. \kern-0em} {(m \times 22.4t \times 100)}},$Методом РВ проводили оценку отклика базального (микробного) дыхания (БД) на увеличение температуры. Метод применим для экспресс-оценки отклика быстро разлагающихся и легкодоступных фракций органического углерода и подразумевает одновременную инкубацию почвенных образцов при разных температурах [30] – в рамках данной работы при 5, 15 и 25°C. БД отражает катаболическую активность гетеротрофных микроорганизмов почв в естественных условиях и в классическом варианте определяется по скорости выделения СО2 почвой за 24 ч инкубации при комнатной температуре [3, 15, 23]. Согласно общепринятым методикам [16], для измерения БД использовали гомогенизированные почвенные образцы естественной влажности (свежие образцы). Материал образцов из гор. Т1 измельчали ножницами и далее пропускали через сито с диаметром ячеек 3 мм, из гор. Т2 – пропускали через сито с диаметром ячеек 2 мм, без использования ножниц. До начала эксперимента образцы торфа, эквивалентные 1 г абсолютно-сухой почвы, в шестикратной повторности, предварительно инкубировали в течение 5 дней при температурах, соответствующих экспериментальным: 5, 15, 25°C [39]. После этого проводили измерение БД. Образцы инкубировали в течение 12 ч в герметично закрывающихся флаконах объемом 125 мл. В течение предварительной инкубации и экспериментальной инкубации контролировали влажность образцов путем взвешивания, при необходимости добавляя воду до исходного уровня массовой влажности, определенного на старте эксперимента – 853% для гор. Т1 и 193% для гор. Т2. Измерение концентрации СО2 во флаконе проводили до и после завершения инкубации на портативном инфракрасном газоанализаторе RMT DX6210. Пробу воздуха, объемом 5 мл, отбирали из флакона с помощью шприца через герметичный клапан. Результат выражали в мкг C–CО2/(г почвы ч), расчет вели по формуле (1).
Для количественной оценки температурной чувствительности дыхания торфяных почв рассчитывали коэффициент Q10 [34]. Он показывает, во сколько раз изменяется скорость дыхания почв при изменении температуры на 10°С. Q10 рассчитали для а) эксперимента по оценке R методом ПУТ в интервалах температур 5–15, 10–20, 15–25 и 20–30°С; б) эксперимента по оценке скорости БД методом РВ в интервалах 5–15 и 15–25°С. Интервалы температур выбрали в соответствии с общепринятыми в литературе [30]. Расчет вели по формуле:
(2)
${{Q}_{{10}}} = \left( {{{{{c}_{2}}} \mathord{\left/ {\vphantom {{{{c}_{2}}} {c_{1}^{{\left[ {{{10} \mathord{\left/ {\vphantom {{10} {\left( {{{t}_{2}} - {{t}_{1}}} \right)}}} \right. \kern-0em} {\left( {{{t}_{2}} - {{t}_{1}}} \right)}}} \right]}}}}} \right. \kern-0em} {c_{1}^{{\left[ {{{10} \mathord{\left/ {\vphantom {{10} {\left( {{{t}_{2}} - {{t}_{1}}} \right)}}} \right. \kern-0em} {\left( {{{t}_{2}} - {{t}_{1}}} \right)}}} \right]}}}}} \right),$Методы исследования общих химических свойств почв. Степень разложения торфяных образцов определяли в полевых условиях по методике фон Поста. Результаты представлены в процентах на основе соотношения классификации фон Поста со степенью разложения, определенной в лабораторных условиях [8]. Плотность образцов определяли методом режущего кольца по ГОСТ 5180-2015. Содержание сырой золы и ${\text{р }}{{{\text{Н }}}_{{{{{\text{Н }}}_{2}}{\text{О }}}}}$ (соотношение торф : : раствор 1 : 25) оценивали по руководству Воробьевой [14]. Влажность определяли термогравиметрически на приборе OHAUS MB 35. Полную влагоемкость определяли методом цилиндров [2]. Содержание общего углерода (Собщ) и общего азота (Nобщ) определяли на элементном C, N, H, S-анализаторе Element Analyzer Vario EL III фирмы Elementar. Статистическую обработку данных проводили с использованием пакетов Statistica 10 и Microsoft Excel 2010. Данные в табл. 1, 2 приведены с указанием среднего ± стандартное отклонение.
Таблица 1.
Общие химические и физические свойства торфяно-криозема
| Гори-зонт | Степень разложе-ния, % | Плотность, г/см3 | % от полной влагоемкости | Массовая влажность, % | Сырая зола, % | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | Собщ, % | Nобщ, % |
|---|---|---|---|---|---|---|---|---|
| Т1 | 15–25 | 0.08 ± 0.03 | 34 | 853 | 8.1 ± 4.7 | 4.3 ± 0.3 | 43.6 ± 3.3 | 1.0 ± 0.6 |
| Т2 | 35–45 | 0.2 ± 0.02 | 53 | 193 | 9.8 ± 3.5 | 4.6 ± 0.3 | 42.1 ± 2.8 | 0.9 ± 0.3 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Параметры функционирования исследованного торфяно-криозема. Торфяно-криоземы имеют специфический характер распределения среднегодовых температур по профилю почвы: слабоположительную (0.5°С) для верхних гор. Т1 и слабоотрицательную (–0.3°С) для гор. Т2 [4]. В пик вегетационного сезона 2016 г. средняя температура в слое 0–10 см равнялась 5.4 ± 1.9°С, ее максимум 10.5°С, а минимум 2.0°С. Среднее значение объемной влажности для слоя 0–10 см составило 36 ± 3.2%. Глубина протаивания достигает 47 см. Величина эмиссии СО2 с поверхности торфяно-криозема в период исследований в среднем составляла 148 ± 46.6 мг СО2/(м2 ч).
Химические и физические свойства торфяно-криозема. Гор. Т1 и Т2 торфяно-криозема отличаются по химическим и физическим свойствам, что обусловлено их различным генезисом и временем формирования [10]. Так, плотность гор. Т1 в 2 раза ниже, чем плотность гор. Т2 (табл. 1). Соответственно, существенная разница между горизонтами наблюдается и для массовой влажности: для гор. Т1 она составила 853%, для гор. Т2 – 193%, что эквивалентно 34 и 53% от полной влагоемкости. Степень разложения варьирует от 20% в гор. Т1 до 40% в гор. Т2. Содержание сырой золы схоже в обоих горизонтах и находится в диапазоне 8.1–9.8%. Верхний горизонт (Т1) более кислый – 4.3, чем нижний (Т2) – 4.6. Содержание общего углерода незначительно снижается от гор. Т1 (43.6%) к Т2 (42.1%), азота от 1.0 до 0.9% соответственно.
В целом значения степени разложения, сырой золы, величины ${\text{р }}{{{\text{Н }}}_{{{{{\text{Н }}}_{2}}{\text{О }}}}}$, содержания общего углерода и азота соответствуют типичным значениям для почв бугристых торфяников исследуемой территории [10].
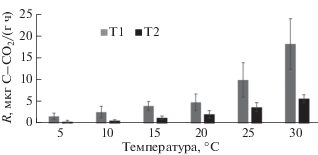
Отклик R на увеличение температуры методом ПУТ. В гор. Т1 величина R изменялась в диапазоне 1.6–18.1 мкг C–CО2/(г ч) с минимальным значением скорости минерализации при 5°С и с максимальным при 30°С (рис. 1). Для гор. Т1 величина R возрастала равномерно: в 1.2–2 раза при каждом повышении температуры на 5°С. В целом при повышении температуры с 5 до 30°С установлен 11-кратный рост R.
В гор. Т2 значение R изменялось в диапазоне 0.4–5.6 мкг С–СО2/(г ч) с минимальным значением скорости минерализации при 5°С и с максимальным при 30°С. Для гор. Т2 величина R также возрастала равномерно: в 1.5–2 раза при каждом повышении температуры на 5°С. В целом при повышении температуры с 5 до 25°С установлен 14-кратный рост R.
Значение R отличалось по горизонтам: установлено в среднем 3.3-кратное превышение значений гор. Т1 над значениями гор. Т2. При этом характер отклика скорости минерализации органического углерода одинаков: для обоих горизонтов величина R устойчиво возрастала при увеличении температуры с 5 до 30°С.
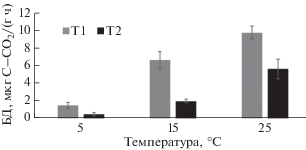
Отклик БД на увеличение температуры методом РВ. В гор. Т1 значения БД варьировали в диапазоне 1.5–9.7 мкг C–CО2/(г ч) (рис. 2). Минимальное значение БД зафиксировано при 5°С, максимальное – при 25°С. При повышении температуры величина БД увеличивалась неравномерно: в интервале 5–15°С отмечен ее резкий отклик (с 1.5 до 6.6 мкг C–CО2/(г ч), в интервале 15–25°С – более плавное увеличение (с 6.6 до 9.7 мкг C–CО2/г ч). При возрастании температуры с 5 до 25°С установлен 6-кратный рост величины БД.
В гор. Т2 значения БД варьировали в диапазоне 0.5–5.6 мкг C–CО2/(г ч). Минимальное значение БД зафиксировано при 5°С, максимальное – при 25°С. При повышении температуры величина БД также увеличивалась неравномерно: в интервале 5–15°С отмечен ее резкий скачок (с 0.5 до 2.0 мкг C–CО2/(г ч), в интервале 15–25°С – более равномерное увеличение (с 2.0 до 5.6 мкг C–CО2/(г ч)) При возрастании температуры с 5 до 25°С установлен 11-кратный рост величины БД.
Значение БД также отличалось по горизонтам. Гор. Т1 более активен, его величина БД в среднем в 2.7 раз превышала величину БД для гор. Т2. При этом аналогично показателю R, динамика отклика БД одинакова: для обоих горизонтов отмечен ее устойчивый рост при увеличении температуры с 5 до 25°С.
Закономерности температурной чувствительности дыхания, оцененной методами ПУТ и РВ. Для гор. Т1 значения Q10, оцененные методами ПУТ и РВ, отличались для одних и тех же интервалов температур (табл. 2). Методом ПУТ установлен равномерный отклик Q10 в интервалах температур 5–15, 10–20, 15–25 и 20–30°С: значения Q10 варьировали в диапазоне 2.7–3.0 и с увеличением температуры изменялись слабо. Методом РВ выявлен более контрастный отклик Q10: его значения снижались от 4.9 в интервале 5–15°С до 1.5 в интервале 15–25°С. Таким образом, методы ПУТ и РВ выявили различную динамику температурной чувствительности гор. Т1: в случае метода ПУТ Q10 при повышении температуры с 5 до 30°С менялся незначительно, тогда как в случае метода РВ снижался в 3.3 раза при повышении температуры с 5 до 25°С.
Для гор. Т2 значения Q10, рассчитанные методами ПУТ и РВ, также отличались для одних и тех же интервалов температур. Методом ПУТ установлен однородный отклик Q10 в интервалах температур 5–15, 10–20, 15–25 и 20–30°С: значения Q10 варьировали в диапазоне 3.0–3.5 и с увеличением температуры изменялись слабо. Методом РВ выявлен более резкий отклик Q10: его значения снижались от 4.3 в интервале 5–15°С до 2.8 в интервале 15–25°С. Как и для гор. Т1, методы ПУТ и РВ выявили различную динамику температурной чувствительности: в случае метода ПУТ Q10 при повышении температуры с 5 до 30°С менялся незначительно, тогда как в случае метода РВ снижался в 1.7 раз при повышении температуры с 5 до 25°С.
Данные, полученные методом РВ, согласуются с известными в литературе результатами о зависимости величины Q10 от температуры [24, 36, 49]. Метод РВ для обоих горизонтов свидетельствует о снижении температурной чувствительности с ростом температуры. Максимальные значения Q10 соответствовали холодному (5–15°С) интервалу температур, а минимальные – теплому (15–25°С).
По результатом метода ПУТ не удалось выявить статистически значимых различий значений Q10 для разных температурных интервалов, что, вероятно, может быть обусловлено высокой вариабельностью R при повторных определениях, а также отмеченной в литературе субстратной проблемой метода, выражающейся в снижении отклика быстро разлагающихся и легкодоступных фракций органического углерода с увеличением длительности инкубации [30]. Напротив, использование метода РВ обусловило статистически значимые различия Q10 в изученных температурных интервалах, что можно объяснить высоким откликом быстроразлагающихся и легкодоступных фракций органического углерода в течение непродолжительного инкубационного периода [30]. Таким образом, для количественной оценки температурной чувствительности дыхания почв бугристых торфяников криолитозоны в лабораторных условиях предпочтительнее использовать метод РВ.
Оба метода показали, что температурная чувствительность нижнего гор. Т2 выше по сравнению с верхним гор. Т1: в большинстве рассматриваемых температурных интервалов значения Q10 гор. Т2 выше, чем гор. Т1 – несмотря на более низкие абсолютные значения R и БД. Возможно, это обусловлено различиями в соотношении лабильной и устойчивой составляющих в составе органического вещества сравниваемых горизонтов.
Использование экспоненциальной функции для описания температурной чувствительности дыхания методами ПУТ и РВ. Из-за сложности состава органического вещества почв и большого количества факторов, от которых зависит температурная чувствительность его разложения, в настоящее время нет общей теории, которая могла бы использоваться для ее количественного описания [35]. Поэтому в моделях круговорота углерода для описания зависимости дыхания почв от температуры применяют различные эмпирические функции [48].
Из-за простоты наибольшее распространение получила экспоненциальная функция r(T) = aebT, где r – скорость дыхания, T – температура, а коэффициенты а и b > 0. Коэффициент а отражает интенсивность отклика дыхания горизонтов почв на старте эксперимента (“стартовая” интенсивность), а коэффициент b – интенсивность отклика в процессе эксперимента (“суммарная” интенсивность). Таким образом, использование экспоненциальной функции позволяет оценить изначальные различия в температурной чувствительности исследуемых горизонтов (коэффициент а), а также различия в интенсивности ее отклика при увеличении температуры (коэффициент b). Предполагается, что Q10 постоянная величина: Q10 = e10b.
Для описания полученных результатов использовали экспоненциальную модель (табл. 3, рис. 3). Достаточно высокие значения коэффициентов детерминации (r2 > 0.78 метод ПУТ) и (r2 > 0.86 метод РВ) допускают использование этой модели для аппроксимации полученных экспериментальных данных в первом приближении. Следует помнить, что она не отражает зависимость Q10 от температуры.
ЗАКЛЮЧЕНИЕ
По результатам серии лабораторных экспериментов методами ПУТ и РВ установлен идентичный характер отклика горизонтов торфяно-криозема на увеличение температуры: величина R при увеличении температуры с 5 до 30°С возрастала в 11–14 раз, величина БД при увеличении с 5 до 25°С – в 6–11 раз. Несмотря на однотипный характер отклика, выявлены значительные отличия в температурной чувствительности разложения органического вещества верхнего и нижнего горизонтов.
Установлено, что для гор. Т1, функционирующего в условиях слабоположительных годовых температур, характерны наибольшие абсолютные значения исследуемых показателей: так, значения R и БД для гор. Т1 при увеличении температуры в среднем в 3 раза выше, чем для гор. Т2. Несмотря на существенное превышение абсолютных значений, максимальные значения коэффициента температурной чувствительности Q10, оказались выше для гор. Т2. Закономерность, при которой нижележащие горизонты почв криолитозоны характеризуются большей температурной чувствительностью по сравнению с поверхностными горизонтами, неоднократно отмечена в литературе [19, 50]. Такую реакцию нижележащих горизонтов принято связывать с большим содержанием в них труднодоступных фракций органического углерода, разложение которых сопровождается более высокой энергией активации, и, следовательно, большей температурной чувствительностью по сравнению с поверхностными горизонтами [22, 24, 53]. В проведенных экспериментах полученные значения Q10 в целом находились в диапазоне 2–4, что соответствует типичным значениям для почв торфяников (2.3) и тундр (2.3) [30].
Апробированные методы исследования температурной чувствительности (ПУТ и РВ) выявили различную динамику значений коэффициента Q10 горизонтов торфяно-криозема. Так, метод ПУТ обусловил слабые изменения значений Q10 при увеличении температуры с 5 до 30°С: 2.7–3 и 3.5–3.0 для гор. Т1 и Т2 соответственно, что можно объяснить известной “субстратной” проблемой метода [30]. Методом РВ при увеличении температуры с 5 до 25°С выявлено четкое уменьшение значений Q10 от 4.9 до 1.5 и от 4.3 до 2.8 для гор. Т1 и Т2 соответственно. Проведенный интервальный анализ температурной чувствительности показал, что в случае метода ПУТ реакция изученных горизонтов статистически значимо не отличается как в холодном (5–15°С), так и теплом (15–25°С) интервалах температур. Напротив, по результатам метода РВ отклик горизонтов в холодном интервале в 1.5–3 раза выше, чем в теплом. Можно заключить, что использование метода РВ приводит к более экспрессной реакции исследуемых показателей, и, как следствие, к более контрастной динамике значений Q10 – следовательно, метод РВ более применим для задач по количественной оценке температурной чувствительности почв бугристых торфяников криолитозоны в лабораторных условиях.
Список литературы
Бобрик А.А., Гончарова О.Ю., Матышак Г.В., Рыжова И.М., Макаров М.И. Влияние геокриологических условий и свойств почв на пространственное варьирование эмиссии СО2 почвами плоскобугристых болот островной криолитозоны Западной Сибири // Почвоведение. 2016. № 12. С. 1445–1456. https://doi.org/10.7868/S0032180X1610004X
Вадюнина А.Ф., Корчагина З.А. Методы исследования физических свойств почв. М.: Агропромиздат, 1986. 416 с.
Васенев В.И., Ананьева Н.Д., Макаров О.А. Особенности экологического функционирования конструктоземов на территории Москвы и Московской области // Почвоведение. 2012. № 2. С. 224–235.
Гончарова О.Ю., Матышак Г.В., Бобрик А.А., Москаленко Н.Г., Пономарева О.Е. Температурные режимы северо-таежных почв Западной Сибири в условиях островного распространения многолетнемерзлых пород // Почвоведение. 2015. № 12. С. 1462–1473.
Инишева Л.И., Дырин В.А., Ларина Г.В. Биологическая активность торфяных почв разного генезиса // Агроэкология. 2015. № 9. С. 47–53.
Каганов В.В., Курганова И.Н. Оценка скорости минерализации органического вещества основных типов почв европейской части России при различных температурных режимах // Научные ведомости БелГУ. Сер. Естественные науки. 2011. № 15. С. 145–152.
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Ларгин И.Ф., Корчунов С.С., Малков Л.М. Справочник по торфу. М.: Недра, 1982. 760 с.
Лисс О.Л., Абрамова Л.И. Аветов Н.А., Березина Н.А., Инишева Л.И., Курнишкова Т.В., Слука З.А., Толпышева Т.Ю., Шведчикова Н.К. Болотные системы Западной Сибири и их природоохранное значение. Тула: Гриф и К°, 2001. 584 с.
Матышак Г.В., Богатырев Л.Г., Гончарова О.Ю., Бобрик А.А. Особенности развития почв гидроморфных экосистем северной тайги Западной Сибири в условиях криогенеза // Почвоведение. 2017. № 10. С. 1155–1164.
Москаленко Н.Г. Антропогенная динамика растительности равнин криолитозоны России. Новосибирск: Наука, Сибирская издательская фирма РАН, 1999. 280 с.
Сергеева М.А., Хохлова А.М. Микробная биомасса и ее активность в торфяных болотах Сибири // Вестник ТГПУ. 2015. № 2. С. 143–149.
Смагин А.В. Газовая фаза почв. М.: Изд-во Моск. ун-та, 2005. 301 с.
Теория и практика химического анализа почв / Под ред. Л.А. Воробьевой. М.: Геос, 2006. 400 с.
Ananyeva N.D., Susyan E.A., Chernova O.V., Wirth S. Microbial respiration activities of soils from different climatic regions of European Russia // European J. Soil Biol. 2008. V. 44. P. 147–157.
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biol. Biochem. 1978. V. 10. P. 215–221.
Bekku Y.S., Nakatsubo T., Kume A., Adachi M., Koizumi H. Effect of warming on the temperature dependence of soil respiration rate in arctic, temperate and tropical soils // Appl. Soil Ecology. 2003. V. 22. P. 205–210.
Biasi C., Jokinen S., Marushchak M.E., Hamalainen K., Trubnikova T., Oinonen M., Martikainen P.J. Microbial Respiration in Arctic Upland and Peat Soils as a Source of Atmospheric Carbon Dioxide // Ecosystems. 2014. V. 17. P. 112–126.
Bracho R., Natali S., Pegoraro E., Crummer K.G., Schadel C., Celis G., Hale L., Wu L. Yin H., Tiedje J.M., Konstantinidis K., Luo Y., Zhou J., Schuur E.A.G. Temperature sensitivity of organic matter decomposition of permafrost-region soils during laboratory incubations // Soil Biol. Biochem. 2016. V. 97. P. 1–14.
Brouns K., Keuskamp J.A., Potkamp G., Verhoeven J.T.A., Hefting M.M. Peat origin and land use effects on microbial activity, respiration dynamics and exo-enzyme activities in drained peat soils in the Netherlands // Soil Biol. Biochem. 2016. V. 95. P. 144–155.
Chowdhury T.R., Herndon E.M., Phelps T.J., Elias D.A., Gu B., Liang L., Wullschleger S.D., Graham D.E. Stoichiometry and temperature sensitivity of methanogenesis and CO2 production from saturated polygonal tundra in Barrow, Alaska // Global Change Biology. 2015. V. 21. P. 722–737.
Conant R., Ryan M., Agren G., Birge H., Davidson E., Eliasson P., Evans S., Frey S., Giardina C., Hopkins F., Hyvonen R., Kirschbaum M., Lavallee J., Leifeld J., Parton W., Steinweg J., Wallenstein M., Wetterstedt J., Bradford M. Temperature and soil organic matter decomposition rates – synthesis of current knowledge and a way forward // Global Change Biology. 2011. V. 17. № 11. P. 3392–3404.
Creamer R.E., Schulte R.P.O., Stone D., Gal A., Krogh P.H., Lo Papa G., Murray P.J., Peres G., Foerster B., Rutgers M., Sousa J.P., Winding A. Measuring basal soil respiration across Europe: Do incubation temperature and incubation period matter? // Ecological Indicators. 2014. V. 36. P. 409–418.
Davidson E.A., Janssens I.A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change // Nature. 2006. V. 440. P. 165–173.
Delarue F., Gogo S., Buttler A., Bragazza L., Jassey V.E.J., Bernard G., Laggoun-Defarge F. Indirect effects of experimental warming on dissolved organic carbon content in subsurface peat // J. Soils Sediments. 2014. V. 14. P. 1800–1805.
Euskirchen E.S., Edgar C.W., Turetsky M.R., Waldrop M.P., Harden J.W. Differential response of carbon fluxes to climate in three peatland ecosystems that vary in the presence and stability of permafrost // J. Geophys. Res.: Biogeosciences. 2014. V. 119. P. 1576–1595.
Fang C., Smith P., Moncrieff J.B., Smith Jo.U. Similar response of labile and resistant soil organic matter pools to changes in temperature // Nature. 2005. V. 433. P. 57–59.
Frolking S., Roulet N., Lawrence D. Carbon Cycling in Northern Peatlands. Geophysical Monograph Series, 2013. 299 p.
Grosse G., Harden J., Turetsky M., McGuire A.D., Camill P., Tarnocai C., Frolking S., Schuur E.A.G., Jorgenson T., Marchenko S., Romanovsky V., Wickland K.P., French N., Waldrop M., Bourgeau-Chavez L., Striegl R.G. Vulnerability of high-latitude soil organic carbon in North America to disturbance // J. Geophys. Res.: Biogeosciences. 2011. V. 116. P. 1–23.
Hamdi S., Moyano F., Sall S., Bernoux M., Chevallier T. Synthesis analysis of the temperature sensitivity of soil respiration from laboratory studies in relation to incubation methods and soil conditions // Soil Biol. Biochem. 2013. V. 58. P. 115–126.
Harden J.W., Koven C.D., Ping C.L., Hugelius G., David McGuire A., Camill P., Jorgenson T., Kuhry P., Michaelson G.J., O’Donnell J.A., Schuur E.A.G., Tarnocai C., Johnson K., Grosse G. Field information links permafrost carbon to physical vulnerabilities of thawing // Geophys. Res. Lett. 2012. V. 39. P. 1–6.
Inglett K.S., Inglett P.W., Reddy K.R., Osborne T.Z. Temperature sensitivity of greenhouse gas production in wetland soils of different vegetation // Biogeochemistry. 2012. V. 108. P. 77–90.
Karhu K., Fritze H., Tuomi M., Vanhala P., Spetz., Kitunen V., Liski J. Temperature sensitivity of organic matter decomposition in two boreal forest soil profiles // Soil Biol. Biochem. 2010. V. 42. P. 72–82.
Kirschbaum M.U.F. The temperature dependence of soil organic matter decomposition and the effect of global warming on soil organic C storage // Soil Biol. Biochem. 1995. V. 27. P. 753–760.
Kirschbaum M.U.F. The temperature dependence of organic-matter decomposition – still a topic of debate // Soil Biol. Biochem. 2006. V. 38. P. 2510–2518.
Lloyd J., Taylor J.A. On the temperature dependence of soil respiration // Functional Ecology. 1994. V. 8. P. 315–323.
Moni C., Lerch T.Z., Knoth de Zarruk K., Strand L.T., Forte C., Certini G., Rasse D.P. Temperature response of soil organic matter mineralisation in arctic soil profiles // Soil Biol. Biochem. 2015. V. 88. P. 236-246.
Reichstein M., Subke J.A., Angeli A.C., Tenhunen J.D. Does the temperature sensitivity of decomposition of soil organic matter depend upon water content, soil horizon, or incubation time? // Global Change Biology. 2005. V. 11. P. 1754–1767.
Rey A., Petsikos C., Jarvis P.G., Grace J. Effect of temperature and moisture on rates of carbon mineralization in a Mediterranean oak forest soil under controlled and field conditions // European J. Soil Sci. 2005. V. 56. P. 589–599.
Rey A., Pegoraro E., Jarvis P.G. Carbon mineralization rates at different soil depths across a network of European forest sites (FORCAST) // European J. Soil Sci. 2008. V. 59. P. 1049–1062.
Schütt M., Borken W., Spott O., Stange C.F., Matzner E. Temperature sensitivity of C and N mineralization in temperate forest soils at low temperatures // Soil Biol. Biochem. 2014. V. 69. P. 320-327.
Schuur E.A.G., Bockheim J., Canadell J.G., Euskirchen E., Field C.B., Goryachkin S.V., Hagemann S., Kuhry P., Lafleur P. M., Lee H., Mazhitova G., Nel-son F.E., Rinke A., Romanovsky V.E., Shiklomanov N., Tarnocai C., Venevsky S., Vogel J.G., Zimov S.A. Vulnerability of Permafrost Carbon to Climate Change: Implications for the Global Carbon Cycle // BioScience. 2008. V. 58. P. 701–714.
Sjogersten S., Caul S., Daniell T.J., Jurd A.P.S., O’Sullivan O.S., Stapleton C.S., Titman J.J. Organic matter chemistry controls greenhouse gas emissions from permafrost peatlands // Soil Biol. Biochem. 2016. V. 98. P. 42–53.
Smith V.R. Moisture, carbon and inorganic nutrient controls of soil respiration at a sub-Antarctic island // Soil Biol. Biochem. 2005. V. 37. P. 81–91.
Tarnocai C., Canadell J.G., Schuur E.A.G., Kuhry P., Mazhitova G., Zimov S. Soil organic carbon pools in the northern circumpolar permafrost region // Global Biogeochemical Cycles. 2009. V. 23. № 2. GB2023. https://doi.org/10.1029/2008GB003327
Thiessen S., Gleixner G., Wutzler T., Reichstein M. Both priming and temperature sensitivity of soil organic matter decomposition depend on microbial biomass – An incubation study // Soil Biol. Biochem. 2013. V. 57. P. 739–748.
Treat C.C., Wollheim W.M., Varner R.K., Grandy A.S., Talbot J., Frolking S. Temperature and peat type control CO2 and CH4 production in Alaskan permafrost peats // Global Change Biology. 2014. V. 20. P. 2674–2686.
Tuomi M., Vanhala P., Karhu K., Fritze H., Liski J. Heterotrophic soil respiration - comparison of different models describing its temperature dependence // Ecological Modelling. 2008. V. 211. P. 182–190.
Vanhala P., Karhu K., Tuomi M., Bjorkllof K., Fritze H., Liski J. Temperature sensitivity of soil organic matter decomposition in southern and northern areas of the boreal forest zone // Soil Biol. Biochem. 2008. V. 40. P. 1758–1764.
Walz J., Knoblauch C., Bohme L., Pfeiffer E.-M. Regulation of soil organic matter decomposition in permafrost-affected Siberian tundra soils – Impact of oxygen availability, freezing and thawing, temperature, and labile organic matter // Soil Biol. Biochem. 2017. V. 110. P. 34–43.
Wang X., Li X., Hu Y., Lv J., Sun Ju, Li Z., Wu Z. Effect of temperature and moisture on soil organic carbon mineralization of predominantly permafrost peatland in the Great Hing’an Mountains, Northeastern China // J. Environ. Sci. 2010. V. 22. P. 1057–1066.
Weider R., Yavitt J.B. Peatlands and global climate change: insights from comparative studies of sites along a latitudinal gradient // Wetlands. 1994. V. 14. P. 229–238.
Wetterstedt J., Persson T., Agren G.I. Temperature sensitivity and substrate quality in soil organic matter decomposition: results of an incubation study with three substrates // Global Change Biology. 2010. V. 16. P. 1806–1819.
Yu Z.C. Northern peatland carbon stocks and dynamics: a review // Biogeosciences. 2012. V. 9. P. 4071–4085.
Zhaojun B., Joosten H., Hongkai L., Gaolin Z., Xingxing Z., Jinze M., Jing Z. The response of peatlands to climate warming: A review // Acta Ecologica Sinica. 2011. V. 31. P. 157–162.
Дополнительные материалы отсутствуют.