Почвоведение, 2019, № 8, стр. 910-922
Сравнение свойств препаратов гуминовых кислот, выделенных из почв щелочной экстракцией в присутствии и отсутствии кислорода
А. Г. Заварзина 1, *, Е. Г. Кравченко 1, А. И. Константинов 1, И. В. Перминова 1, С. Н. Чуков 2, В. В. Демин 1
1 МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, 16-я линия Васильевского острова, 29, Россия
* E-mail: zavarzina@mail.ru
Поступила в редакцию 20.10.2018
После доработки 12.12.2018
Принята к публикации 25.12.2018
Аннотация
Гуминовые кислоты (ГК) составляют 30–50% органического вещества почв, которое является главным резервуаром Сорг в биосфере. ГК выделяют из почв щелочной экстракцией с последующим осаждением минеральной кислотой при рН 2. Международным обществом по изучению гуминовых веществ (IHSS) рекомендовано выделять ГК в атмосфере азота для предотвращения окислительной трансформации молекулярным кислородом в процессе экстракции. В российской школе почвоведения экстракцию в атмосфере азота или инертного газа используют редко. В настоящей работе проведено сравнение физико-химических свойств препаратов ГК, выделенных из почв 0.1 M NaOH с продувкой азотом и без его использования. Изучали ГК из горизонтов A1 двух контрастных по условиям гумусообразования типов почв: дерново-подзолистой и чернозема, являющихся зональными почвами южной тайги и степи. Проводили сравнение препаративного выхода гуминовых веществ (по Сорг), элементного, структурно-группового, функционально-группового и молекулярно-массового составов ГК, парамагнитных свойств, а также спектров поглощения в видимой, УФ- и ИК-областях. Для обеих изученных почв установлено отсутствие статистически значимых различий в количественном выходе, молекулярно-массовом распределении, спектрах поглощения в видимой, УФ- и ИК-областях между препаратами ГК, выделенными щелочной экстракцией в атмосфере азота и без его использования. В то же время элементный анализ, потенциометрическое титрование, спектроскопия ЯМР на ядрах 1H и 13С и электронный парамагнитный резонанс выявили, соответственно, более высокие отношения O : C, большее содержание хинонных и карбоксильных групп и существенно большее содержание свободных радикалов в препарате ГК дерново-подзолистой почвы, выделенном без азота. В ГК чернозема указанные различия практически отсутствуют. Полученные результаты свидетельствуют о процессах окисления компонентов щелочной вытяжки из дерново-подзолистой почвы при экстракции в присутствии О2. Гумификация в черноземах сопровождается, видимо, настолько глубокой окислительной трансформацией соединений органических остатков, что щелочные условия и присутствие молекулярного кислорода не вызывают дальнейшего окисления ГК. Применение азота для выделения ГК из минеральных горизонтов черноземов можно считать нецелесообразным. В случае дерново-подзолистых почв экстракцию в атмосфере азота следует использовать, если в дальнейшем предполагается изучать реакции окисления ГК, например, при ферментативном катализе.
ВВЕДЕНИЕ
Гуминовые вещества широко распространены в почвах, осадках и природных водах [30]. Они представляют собой темноокрашенные аморфные продукты трансформации органических остатков (гумификации) и составляют до 90% органического вещества (ОВ) почв [6, 19] – главного резервуара Сорг в биосфере [14]. Классификация гуминовых веществ основана на их растворимости: выделяют растворимые в щелочах, но нерастворимые при рН < 2 гуминовые кислоты (ГК), растворимые при всех значениях рН фульвокислоты (ФК) и нерастворимый остаток от щелочной экстракции – гумин.
Гуминовые вещества во многом обусловливают плодородие и биосферные функции почв, однако их происхождение, молекулярная структура и устойчивость являются предметом дискуссий [27, 33]. В последнее время поставлена под сомнение концепция гумификации и факт существования гуминовых веществ как отдельного класса органических соединений; ОВ почв предложено рассматривать как континуум биомолекул на разных стадиях деградации [22]. Для описания органического вещества почв и природных вод вместе с термином “гуминовые вещества” входит в употребление термин “природное органическое вещество” [24]. Тем не менее, результаты количественной твердофазной 13С ЯМР спектроскопии показали, что гуминовые кислоты (ГК) черноземов и торфов существенно отличаются от биомолекул органических остатков (лигнина, целлюлозы, белков) высоким содержанием конденсированных и О-замещенных ароматических фрагментов, углерода кетонов и карбоксильных групп [15]. Эти результаты опровергают мнение, что ЯМР сигналы гуминовых веществ могут быть приписаны исключительно интактным или разрушающимся биомолекулам [20], что вещества щелочных экстрактов представляют собой промежуточные продукты трансформации органических остатков [22].
Одной из главных проблем изучения почвенного ОВ является его прочная связь с минеральными компонентами и способ извлечения, основанный на щелочной экстракции. В щелочной экстракт переходит 40–80% от Сорг в зависимости от типа почвы [32], существенная часть ОВ остается во фракции гумина. В щелочных условиях, особенно в присутствии молекулярного кислорода, может происходить окисление фенольных соединений [35], являющихся ключевыми ароматическими компонентами почвенного гумуса. В результате окисления возможны как деструкция соединений гумуса, так и их окислительная конденсация [6, 32]. Поэтому считается, что щелочная экстракция создает артефакты, а соединения щелочных экстрактов имеют мало общего с нативным ОВ почв [22]. Развиваются недеструкционные методы анализа ОВ почв [13], а также последовательное извлечение компонентов ОВ органическими растворителями [17, 25]. Тем не менее, щелочная экстракция является единственным общепринятым методом извлечения ГК из почв в препаративных количествах, это также способ получения гуминовых препаратов для их использования в сельском хозяйстве [29]. Международным обществом по изучению гуминовых веществ (www.ihss.org) рекомендовано выделять ГК в атмосфере азота, чтобы снизить влияние окислительных превращений на структуру извлекаемых соединений [34]. Метод выделения ГК, принятый в Российской школе почвоведения, применение азота или инертного газа не предусматривает [7]. Существует большой массив данных по свойствам препаратов ГК, выделенных из различных объектов без использования азота [1, 6, 10, 26]. Работы по сравнению структуры и физико-химических свойств ГК, выделенных из минеральных горизонтов почв щелочной экстракцией в присутствии и отсутствии O2, крайне малочисленны и ограничиваются изучением отдельных свойств ГК, например, их молекулярно-массовых распределений [3]. Это не позволяет сопоставлять данные, полученные экстракцией в атмосфере азота и без него, и оценить влияние присутствия О2 в щелочных экстрактах на свойства ГК из различных типов почв.
Цель настоящей работы – сравнить структуру и физико-химические свойства ГК, выделенных из почв щелочной экстракцией в атмосфере азота и без его использования. В качестве объектов исследования были выбраны гумусовые горизонты двух контрастных по условиям гумусообразования типов почв: дерново-подзолистой (ДПП) и чернозема. Эти почвы являются зональными типами почв в южной тайге и степи, а препараты ГК из них часто используются в качестве модели в исследованиях свойств почвенного гумуса.
ОБЪЕКТЫ И МЕТОДЫ
Почвы. Использовали образцы гумусовых горизонтов (A1) дерново-подзолистой среднесуглинистой почвы (ДПП) (Московская область, Россия, N 56.226819, E 37.951602) и чернозема выщелоченного (Липецкая область, Россия, N 53.496117, E 38.990066). Дерново-подзолистая почва (Stagnic Retisol (Loamic, Humic), согласно WRB 2015) развита под ельником мертвопокровным и имеет профиль O(0–1 см)–A(1–6(10) см)–AE(6–20 см)–EB(20–36 см)–Bg(36–70 см). Выщелоченный чернозем (Luvic Chernozem (Siltic, Pachic), согласно WRB 2015), залежь 20 лет, развит под степной растительностью и имеет профиль A1(0–43 см)–AB(43–67 см)–Bt(67–100 см)–BCk(100–122 см). Смешанный образец гор. A1 дерново-подзолистой почвы (10 кг) отобрали в начале мая 2017 г. с глубины 2–10 см на площади около 3 м2. Смешанный образец гор. A1 чернозема (10 кг) отобрали в июне 2017 г. с глубины 10–40 см на площади около 2 м2. Почвы высушивали на воздухе, растирали и просеивали через сито 1 мм. В почвах определяли ${\text{р }}{{{\text{Н }}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ (в вытяжках твердая фаза : раствор 1 : 5), содержание органического углерода и азота на анализаторе Vario LIII (Германия), соотношение CГК/CФК методом Пономаревой и Плотниковой с небольшой модификацией [7]. Для этого образец почвы экстрагировали 0.1 M NaOH (24 ч) после промывки 0.1 M H2SO4, затем экстрагировали 0.02 M NaOH (6 ч при 80°C). ГК в экстрактах отделяли от ФК подкислением раствора до рН 2. Концентрацию общего растворенного органического углерода (Сорг) и CФК в экстрактах определяли на TOC-анализаторе (Shimadzu, Japan) после фильтрации растворов через бумажный фильтр, отмытый дистиллированной водой. CГК находили по разности между общим растворенным Сорг и СФК. Отношение CГК: CФК находили с учетом содержания ГК и ФК в двух последовательных экстракциях. Некоторые свойства почв приведены в табл. 1. Гумусовый горизонт дерново-подзолистой почвы характеризовался кислой реакцией среды (рН 3.80 в слое 0–6 см, 5.01 в слое 6–10 см, среднее – 4.49), содержанием углерода 5.12%, азота – 0.32% и гуматно-фульватным типом гумуса (CГК/СФК 0.6). Гор. A1 выщелоченного чернозема имел рН 5.31, содержание углерода составляло 4.35%, азота – 0.33%, тип гумуса – гуматный (CГК/СФК 2.6). В целом, почвы обладали характерными для своего типа свойствами, за исключением содержания углерода. Достаточно высокое его содержание в дерново-подзолистой почве может быть связано с примесью тонких фракций детрита. Низкое содержание углерода в черноземе может быть обусловлено его потерями за период сельскохозяйственного использования.
Таблица 1.
Некоторые свойства изученных почв
| Почва | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | С, % | N, % | CГК/СФК |
|---|---|---|---|---|
| Дерново-подзолистая | 4.41 | 5.12 | 0.32 | 0.60 |
| Чернозем | 5.28 | 4.68 | 0.33 | 2.61 |
Экстракция и очистка ГК. К образцам почвы (3 кг) добавляли 0.1 M NaOH в отношении 1 : 5. Проводили три последовательные экстракции (каждая по 24 ч) в атмосфере азота (${\text{Г }}{{{\text{К }}}_{{{{{\text{N}}}_{2}}}}}$) и без него (ГК). Чернозем предварительно декальцировали 0.1 M HCl (48 ч, соотношение почва : раствор 1 : 5), почву промывали 2 раза дистиллированной водой (по 15 л, 24 ч). Щелочные экстракты подкисляли до pH 2 (HClконц), ГК отделяли центрифугированием (10 мин, 7000 g). Зольность неочищенных ГК, определенная сжиганием препарата при 800°C (4 ч), составляла 30–60%. ГК очищали от зольных компонентов высаливанием 0.4 M NaCl [7]. Осадок (зольность >70%) отделяли центрифугированием (16000 g, 10 мин). Очищенную ГК в надосадочном растворе переводили в H-форму трехкратным переосаждением HClконц. Осадок ГК отмывали от избытка Cl– H2Oдист на центрифуге и высушивали на водяной бане при 50°C. Все процедуры с ${\text{Г }}{{{\text{К }}}_{{{{{\text{N}}}_{2}}}}}$ в щелочных условиях проводили в атмосфере N2.
Выход ГК в щелочной экстракт в присутствии и отсутствии О2. Для того, чтобы оценить количество ГК, переходящих в щелочной экстракт в присутствии и отсутствии О2, проводили три последовательные экстракции 0.1 М NaOH в атмосфере азота и без него. Экстракции проводили в микроцентрифужных пробирках Eppendorf объемом 2 мл в трехкратной повторности, к 300 мг почвы добавляли 1.5 мл 0.1 М NaOH, экстракты встряхивали 24 ч на термошейкере при 22°С (Biosan, Латвия). В случае вытяжки с использованием азота щелочь предварительно продували этим газом 15 мин, затем продували щелочной раствор сразу после добавления его к почве (2 мин). Надосадочные растворы отделяли центрифугированием (18000 g, 15 мин), а почву между экстракциями промывали H2O (2 раза по 1 мл). Общий растворенный углерод в экстрактах и СФК после осаждения ГК определяли на TOC-анализаторе (Shimadzu, Япония). Растворы перед определением разбавляли H2Oдист. СГК находили по разности между Собщ и СФК.
Молекулярно-массовые распределения гумусовых кислот при последовательной щелочной экстракции. Молекулярно-массовые распределения гуминовых веществ щелочных экстрактов были получены гель-фильтрацией на Сефадексе G-75. Использовали колонку Amicon (1.2 × 60 см, Amicon Corporation) и 0.025 М Трис-HCl (pH 8.2) буфер, в который добавляли 0.05 M NaCl и 0.1% SDS для подавления ионных и гидрофобных взаимодействий соответственно. Скорость элюирования составляла 7 мл/ч. Профили элюирования записывали при 280 нм, используя детектор 2238 UVICORD SII (LKB, Швеция). Свободный и конечный объем колонки определяли с помощью голубого декстрана 2000 и (NH4)2Cr2O7 соответственно. Пробы надосадочного раствора (2 мл) пропускали через обессоливающую колонку (1.5 × 8 см), наполненную гелем Сефадекс G-10 для перевода их в элюирующий буфер. Относительное содержание фракций оценивали по площадям под хроматографическими пиками как описано в работе [36].
Физико-химические свойства ГК. Элементный состав. Элементный состав определяли на CNH-анализаторе (Vario LIII, Германия). Содержание кислорода находили по разности. Зольность препаратов исследовали после озоления при 800°C, 4 ч.
Содержание функциональных групп и константы диссоциации. Содержание функциональных групп и значения рКа (где Ка – константа диссоциации) определяли потенциометрическим титрованием. Образцы ГК (50 мг) растворяли в 25 мл 0.05 M NaOH, добавляли 5 мл 1 М KCl и 8.5 мл 0.1 M HCl. Объем раствора доводили до 50 мл с помощью H2Oдист. Конечная концентрация ГК перед титрованием была 1 мг/мл, pH раствора около 11.2 и ионная сила 0.1. Раствор ГК титровали 0.01 M HCl (добавляя по 0.1 мл раствора) на автоматическом титраторе (Mettler Toledo DG58, США) в атмосфере азота. Количество функциональных групп и величины pKa определяли как описано ранее [1].
Спектры поглощения в видимой и ИК-областях. Спектры ГК в видимой области снимали на спектрофотометре Specord M40. ГК растворяли в 0.05 M NaOH, насыщенной N2. Инфракрасные спектры снимали методом KBr-техники на спектрофотометре Bruker Tensor 27 (Германия).
1H ЯМР и 13C ЯМР спектроскопия препаратов ГК. Для спектроскопии 1H ЯМР и 13C ЯМР в жидкой фазе использовали дейтериевую воду (D2O, 99.95% D) и 40% NaOD в D2O (99+%D) (Aldrich, Milwaukee, WI).
Спектры ЯМР на ядрах 1H и 13C регистрировали в ампулах для ЯМР спектроскопии диаметром 5 мм на спектрофотометре Bruker Avance 400 (Германия) с несущей частотой для протонов 400 МГц. Преобразование Фурье, фазовую коррекцию и интегрирование преобразованного спектра осуществляли с помощью программного обеспечения MestReC (Mestrelab Research, США). Интегрирование полученных спектров ЯМР осуществляли с использованием программного обеспечения GelTreat, разработанного А.В. Кудрявцевым (Химический факультет МГУ).
Для регистрации спектров 1H ЯМР 10 мг ГК растворяли в 0.5 мл 0.3 M NaOD/D2O. Спектры регистрировали с релаксационной задержкой 2 с, количество накоплений спектра составило от 30 до 40 сканов. Распределение скелетных протонов по структурным фрагментам (% от общей площади под спектром) определяли интегрированием спектральных областей, используя следующие отнесения (в миллионных долях, м.д.): 0.0–1.8 – Н алкильных звеньев (CHn – протоны); 1.8–2.9 – Н алкильных звеньев, находящихся в α-положении по отношению к СООН-группам или ароматическому кольцу (α-CHn); 2.9–4.5 – Н алкоксигрупп (CHnO); 6.0–12.0 – ароматические протоны (HAr) [21].
Для регистрации спектров 13C ЯМР 40 мг ГК растворяли в 0.5 мл 0.3 M NaOD/D2O. Смесь гомогенизировали на встряхивателе Вортекс в течение 10 мин и центрифугировали 5 мин при 10000 об./мин. При регистрации спектров 13C ЯМР использовали импульсную технику INVGATE (для исключения ядерного эффекта Оверхаузера и получения количественного спектра) и импульсную последовательность CPMG, как описано в [10]. Время регистрации сигнала составило 0.2 с, время релаксационной задержки – 7.8 с, продолжительность одного ЯМР эксперимента – 10 ч. Распределение атомов углерода по основным структурным фрагментам ГК определяли интегрированием спектральных областей, используя следующие отнесения [4] (м.д.): 220–185 – карбонильный углерод кетонных и хинонных групп (C=O); 185–165 – углерод карбоксильных, сложноэфирных и амидных групп (С=О)–O,N); 165–145 – ароматический углерод, замещенный гетероатомами (СAr–O,N); 145–108 – незамещенный или С-замещенный ароматический углерод (СAr–H,C); 108–90 – углерод, соединенный одинарными связями с двумя гетероатомами (в ГК это в основном ацетальный углерод в циклических сахаридах ОС–О,N); 90–48 – углерод, связанный одинарной связью с гетероатомом и входящий в состав алифатических фрагментов; 48–0 – углерод алкильных звеньев, не связанный с гетероатомами (CHn). Спектральный диапазон от 90 до 48 м.д. делили на три части: 90–64 – углерод в группах (CH–O,N); 64–58 – углерод в группах СH2–O,N; 58–48 – углерод метоксильных групп (CH3O).
Содержание свободных радикалов в ГК по данным электронного парамагнитного резонанса (ЭПР). Регистрацию спектров ЭПР выполняли на спектрометре Radiopan SE/X-2547 (Польша) в X-диапазоне при комнатной температуре, высокочастотной мощности 1 мВт и амплитуде высокочастотной модуляции 0.06 мТл. Концентрацию свободных радикалов в образцах почв и ГК определяли путем сравнения площадей под кривыми относительных интегральных интенсивностей сигналов ЭПР стандарта и образца [5, 12]. В качестве стандарта использовали дифенилпикрилгидразил. Ошибка определения концентрации свободных радикалов в таком случае не превышает 5% [5, 12, 28]. Ширину линии (в Гауссах) вычисляли по расстоянию между экстремальными точками линии поглощения.
Молекулярно-массовые распределения препаратов ГК. Молекулярно-массовые распределения ГК были получены гель-фильтрацией на Сефадексе G-75 как описано выше. Пробы ГК (1 мг/мл в 0.05 M NaOH) предварительно пропускали через колонку Сефадекс G-10 (1.5 × 8 см) для перевода их в элюирующий буфер. Молекулярные массы середины хроматографического пика рассчитывали по формуле Детермана для глобулярных белков, а относительное содержание фракций – по площадям под хроматографическими пиками как описано в работе [36].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Количественный выход и молекулярно-массовые распределения гумусовых кислот при их экстракции в атмосфере азота и без его использования. Экстракция гуминовых веществ в щелочной среде сопровождается потреблением кислорода [32]. Щелочная среда и O2 могут оказывать влияние не только на гуминовые вещества (окисление, конденсация) [34], но и на минеральные компоненты почв (растворение оксидов, гидроксидов, силикатов) [16]. Мы предположили, что если присутствие кислорода при щелочной экстракции оказывает деструктивное влияние на свойства минеральной матрицы почв, то это в первую очередь скажется на количественном выходе гумусовых кислот (он увеличится). Окислительная же полимеризация гуминовых веществ в щелочной среде в присутствии кислорода должна привести к увеличению доли ГК в экстрактах. Был изучен общий выход гумусовых кислот (ГК и ФК), а также отдельно фракции ГК при трех последовательных экстракциях в атмосфере азота и без его использования. Содержание углерода гумусовых кислот (ГК + ФК) и отдельно фракции ГК оказалось очень близким в каждой из трех последовательных щелочных экстракций для вариантов с продувкой азотом и без нее (рис. 1). Суммарный выход СГК + ФК трех экстракций с азотом (без него) составил, соответственно, 38.9 ± 0.8% (40.4 ± 1.2%) от Собщ в дерново-подзолистой почве и 69.2 ± 3.5% (67.6 ± 4.3%) от Собщ в черноземе. Суммарное содержание СГК в вариантах с азотом (без него) составило 27.8 ± 0.8% (28.5 ± 0.8%) от Собщ в дерново-подзолистой почве и 64.9 ± 3.4% (62.8 ± ± 4.3%) от Собщ – в черноземе. Таким образом, установлено, что присутствие кислорода в щелочных экстрактах не влияет на количество ГВ, экстрагируемых щелочью из гумусовых горизонтов дерново-подзолистой почвы и чернозема. Методом гель-фильтрации установлено также отсутствие полимеризующего воздействия кислорода на ОВ в щелочных экстрактах. Органическое вещество щелочных экстрактов изученных почв содержит высоко- (>75 кДа) и низкомолекулярную фракции (10–30 кДа), соотношение которых не отличалось в вариантах экстракции с азотом и без него ни в дерново-подзолистой почве, ни в черноземе (рис. 2). Действительно, показано, что для полимеризации ГК в присутствие кислорода даже в щелочных условиях необходимо наличие биокатализатора (лакказы) [23].
Рис. 1.
Содержание углерода гумусовых кислот (ГК + ФК) и гуминовых кислот (ГК) в щелочных экстрактах из дерново-подзолистой почвы (ДПП) и чернозема: 1 – выделено в атмосфере азота; 2 – без его использования.

Рис. 2.
Содержание высокомолекулярной фракции (>75 кДа) в органическом веществе трех последовательных щелочных экстракций (номер экстракции показан римской цифрой). N2 – экстракция в атмосфере азота.
Содержание углерода гумусовых кислот резко уменьшалось от первой ко второй и третьей экстракциям (рис. 1). В первую вытяжку в дерново-подзолистой почве переходило около 75% от Сорг трех экстракций, во вторую и третью – около 20 и 5% соответственно. Та же тенденция выявлена и в черноземе. В первый щелочной экстракт переходило около 86% от Сорг трех экстракций, во второй и третий экстракты – около 10 и 3% соответственно. Изучение молекулярно-массовых распределений гумусовых кислот щелочных экстрактов показало нарастание доли высокомолекулярной фракции от первой ко второй и третьей экстракциям в обеих почвах (рис. 2). Высокомолекулярные компоненты, присутствующие в щелочных экстрактах из чернозема, скорее всего, представляют собой органо-минеральные комплексы с высокой зольностью, так как они удаляются на стадии очистки высаливанием. Увеличение содержания этих компонентов от первой ко второй экстракции может быть связано с растворением минеральных частиц и переходом в раствор металл-органических соединений с высокой молекулярной массой. Следует отметить, что в работе [11] показано отсутствие различий в молекулярно-массовых распределениях ГК от экстракции к экстракции, что может быть связано с использованием геля Toyopearl, обладающего сродством к гидрофобным соединениям. Относительная гидрофобность компонентов ГК увеличивается с возрастанием их молекулярной массы [2]. Гидрофобные/высокомолекулярные компоненты ГК сорбируются на геле (данные не показаны), что может быть причиной их кажущегося низкого содержания на хроматограммах в работе [11]. В целом, результаты последовательных экстракций согласуются с литературными данными, полученными для серой лесной [9], дерново-подзолистой почв и чернозема [11], и свидетельствуют о целесообразности использования одной щелочной вытяжки при экстракции гумусовых кислот в препаративных количествах, что дает возможность получить представительный препарат и существенно снизить трудозатраты. Особенно это касается чернозема, где вторая и третья вытяжка сопровождаются выраженной пептизацией коллоидов, что существенно увеличивает время осаждения минеральных частиц и затрудняет дальнейшую очистку препарата.
Физико-химические свойства гуминовых кислот. Элементный состав препаратов ГК находится в интервале значений, характерных для изученных типов почв. Содержание азота в ГКД (2.6–3.0 ат. %, табл. 2) несколько выше средних значений для ГК дерново-подзолистых почв (2.4 ат. %, [6]), но в целом согласуется с данными других авторов [10]. У препарата ГКД без азота несколько выше отношение O : C по сравнению с препаратом, выделенными в атмосфере азота. Это отношение является одним из показателей степени окисленности [6]. Других различий в элементном составе препаратов, выделенных в атмосфере азота и без него, не выявлено.
Таблица 2.
Элементный состав гуминовых кислот и их оптические свойства
| ГК | Зола, % | Содержание, мас. %/ат. % | Атомные отношения | $E_{{465}}^{{0.001\% \,{\text{Г К }}}}$ | E465/E650 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| C | H | N | O | H : C | O : C | C : N | ||||
| ГКД | 2.6 | 52.9/35.3 | 5.2/42.1 | 4.5/2.6 | 40.0/20.0 | 1.2 | 0.6 | 13.7 | 0.03 | 5.0 |
| ${\text{Г К }}{{{\text{Д }}}_{{{{{\text{N}}}_{2}}}}}$ | 4.8 | 59.6/38.6 | 5.4/41.6 | 5.3/2.9 | 34.7/16.9 | 1.1 | 0.4 | 13.1 | 0.03 | 5.0 |
| ГКЧ | 2.0 | 57.4/45.3 | 3.2/29.9 | 3.7/2.5 | 37.7/22.3 | 0.7 | 0.5 | 18.0 | 0.12 | 3.1 |
| ${\text{Г К }}{{{\text{Ч }}}_{{{{{\text{N}}}_{2}}}}}$ | 3.3 | 55.7/45.3 | 2.8/27.0 | 3.5/2.4 | 41.5/25.3 | 0.6 | 0.6 | 18.6 | 0.11 | 3.1 |
Спектры препаратов ГК и ${\text{Г }}{{{\text{К }}}_{{{{{\text{N}}}_{2}}}}}$ в видимой и УФ-областях оказались идентичны (данные не показаны). Оптические свойства ГК в видимой области (величины Е) согласуются с литературными данными [6, 32]. Значительно большую оптическую плотность ГК черноземов по сравнению с ГК дерново-подзолистых почв связывают с более развитой цепью сопряженных двойных связей и большей степенью окисленности [6].
Препараты ГК из дерново-подзолистой почвы (ГКД) и чернозема (ГКЧ), выделенные с продувкой азотом и без нее, практически не отличаются по содержанию функциональных групп, за исключением ГК из дерново-подзолистой почвы. В ГКД по сравнению с ${\text{Г К }}{{{\text{Д }}}_{{{{{\text{N}}}_{2}}}}}$ несколько больше содержание групп, титруемых в диапазоне рН 3.9–5.6 и 5.6–8.7 (табл. 3). В первом интервале значений рН предположительно титруются карбоксильные группы, а во втором – карбоксильные, азотсодержащие и, частично, фенольные группы [1]. Повышенное содержание кислых функциональных групп в ${\text{Г К }}{{{\text{Д }}}_{{{{{\text{N}}}_{2}}}}}$ по сравнению с ГКД согласуется с данными элементного анализа (отношение O : C, табл. 2) и может свидетельствовать о несколько более высокой степени окисленности препарата, выделенного без использования азота.
Таблица 3.
Содержание функциональных групп и значения pKa гуминовых кислот по данным обратного потенциометрического титрования
| Препарат | Функциональные группы, ммоль/г | pKa | |||||
|---|---|---|---|---|---|---|---|
| pH 3.9–5.6 | pH 5.6–8.7 | pH 8.7–10.3 | ∑ | pKa-1 | pKa-2 | pKa-3 | |
| ГКД | 1.64 | 2.05 | 1.23 | 4.92 | 4.7 | 6.7 | 9.7 |
| ${\text{Г К }}{{{\text{Д }}}_{{{{{\text{N}}}_{2}}}}}$ | 1.45 | 1.87 | 1.24 | 4.56 | 4.8 | 6.6 | 9.5 |
| ГКЧ | 1.84 | 2.45 | 1.02 | 5.31 | 4.5 | 6.4 | 9.6 |
| ${\text{Г К }}{{{\text{Ч }}}_{{{{{\text{N}}}_{2}}}}}$ | 1.86 | 2.48 | 1.03 | 5.37 | 4.6 | 6.4 | 9.3 |
ИК-спектры препаратов ГКД и ГКЧ оказались идентичны для вариантов экстракции с азотом и без него (рис. 3). Спектры содержат набор полос поглощения, типичных для гуминовых кислот из почв [6, 31, 32]. Между спектрами препаратов ГКД и ГКЧ выявлены существенные различия (табл. 4). ГК из обеих почв содержат широкую полосу валентных колебаний ОН- и NH-групп, связанных межмолекулярными водородными связями (3300 см–1), однако эта полоса имеет намного большую интенсивность у ГКД. ГК обеих почв содержат плечо в области 3050 см–1, приписываемое валентным колебаниям ароматических С–Н-групп [31]. Слабая интенсивность этой полосы может быть связана с наличием заместителей в ароматических кольцах ГК или ее перекрытием за счет полосы валентных колебаний ОН-групп [31]. Препарат ГКД содержит выраженные пики валентных колебаний алифатических СН2- и СН3-групп (2930 и 2845 см–1), которым соответствует также слабый пик деформационных колебаний этих групп при 1450 см–1. Эти полосы отсутствуют в ГКЧ, но этот препарат, в отличие от ГКД, содержит интенсивную полосу колебаний ароматических групп С=С (1610 см–1). Таким образом, данные ИК-спектроскопии свидетельствуют о более высокой степени ароматичности ГКЧ по сравнению с ГКД, что согласуется с данными элементного анализа (отношения H : C) и спектроскопии в видимой области и характерно для ГК данных типов почв [6]. В области 1710–1030 см–1 ИК-спектр препарата ГКД содержит широкий набор полос поглощения различной интенсивности (рис. 3), тогда как в спектре ГКЧ присутствуют три сильных полосы поглощения при 1720, 1610 и 1230 см–1 и две полосы в виде плеча (1390 и 1080–1030 см–1) (рис. 3). В области 1710–1720 см–1 проявляется характерная для препаратов ГК полоса колебаний свободной СООН-группы, соответствующей Н-форме препарата [6, 31]. Эта полоса хорошо выражена в препарате ГКЧ, ей соответствуют также сильная полоса при 1610 см–1 и полоса при 1390 см–1, которые отчасти обусловлены, соответственно, симметричными и ассиметричными валентными колебаниями ионизированных СОО-групп. В препарате ГКД полоса СООН-групп (1710 см–1) выражена в виде плеча, так как почти полностью перекрывается интенсивной полосой амидных групп (амид I, 1650 см–1). О присутствии N-содержащих компонентов в ГКД свидетельствуют также узкие полосы слабой интенсивности при 1535 (амид II) и 1420 см–1 (амид III). Аналогичные спектры ГК, в которых полоса карбоксильных групп перекрыта полосой амид I, описаны в литературе, в частности, для ГК коричневых и подзолистых лесных почв реферативной базы EUROSOILS (рендзин, камбисолей и лювисолей) [31]. Такие спектры свидетельствуют о высоком содержании в ГКД пептидов или белков, с чем может быть связано и повышенное содержание азота в этом препарате. Полосы колебаний С–О и О–Н в СООН (1260–1220 см–1) намного более выражены в ГКЧ по сравнению с ГКД, что согласуется с более высоким содержанием в ГКЧ функциональных групп, титруемых в диапазоне рН < 8. В области 1080–1030 см–1 в ГКД проявляется интенсивная полоса валентных колебаний С–О полисахаридов, выраженная в ГКЧ в виде плеча. Таким образом, данные ИК-спектроскопии свидетельствуют о большем содержании алифатических, азотсодержащих и полисахаридных компонентов в ГКД по сравнению с ГКЧ, что согласуется с условиями гумусообразования в этих почвах и меньшей степенью гумификации ОВ дерново-подзолистых почв [6, 31].
Рис. 3.
Инфракрасные спектры гуминовых кислот. ГКД – ГК дерново-подзолистой почвы, ГКЧ – ГК чернозема, N2 – препарат выделен в атмосфере азота.
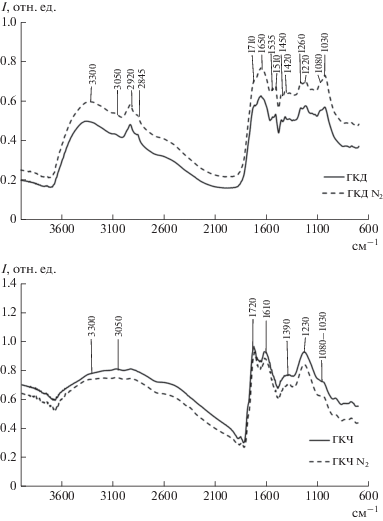
Таблица 4.
Полосы поглощения в ИК-спектрах гуминовых кислот*
| Максимум полосы поглощения, см–1 | Группа и колебания | |
|---|---|---|
| ГКД и ${\text{Г К }}{{{\text{Д }}}_{{{{{\text{N}}}_{2}}}}}$ | ГКЧ и ${\text{Г К }}{{{\text{Ч }}}_{{{{{\text{N}}}_{2}}}}}$ | |
| 3300 с | 3300 с | О–Н (частично N–H), связанные межмолекулярными водородными связями; валентные |
| 3050 сл | 3050 сл | С–Н ароматические; валентные |
| 2920, 2845 ср | – | С–Н в СН2, СH3; валентные |
| 1710 плечо | 1720 с | С=О в СООН, частично С=О альдегидов и кетонов; валентные |
| – | 1610 c | C=C ароматические; валентные СОО–; валентные, симметричные |
| 1650 с | – | С=О амидных групп (aмид I), C=O хинонов и/или H-связанных коньюгированных кетонов; валентные |
| 1535 сл | – | N–H деформационные и С–N валентные (амид II) |
| 1510 | – | С=С ароматические; валентные |
| 1450 сл | – | C–H в CH2 (или СН3); деформационные |
| 1420 сл | – | С=N первичных амидов (амид III); валентные |
| – | 1390 ср | СОО–; валентные, ассиметричные О–Н (деформационные) и С–О (валентные) фенольных ОН-групп |
| 1260, 1220 ср | 1230 с | С–О в СООН; валентные О–Н в СООН; деформационные С–О ароматических эфиров и фенолов; валентные |
| 1030 с | 1080–1030 плечо | С–О полисахаридов; валентные |
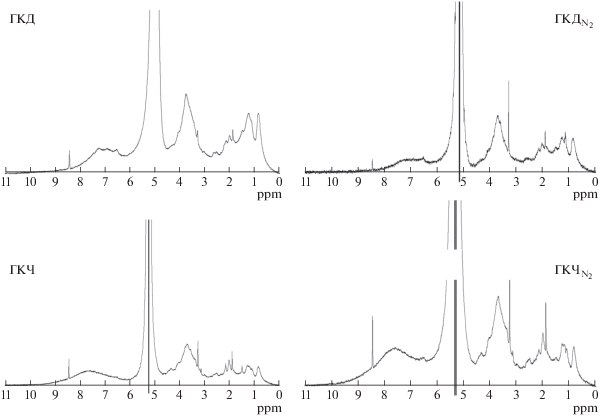
Протонные ЯМР-спектры содержат характерные для гуминовых кислот пики (рис. 4). Содержание протонов ароматических фрагментов в ГКЧ несколько выше, чем в ГКД (табл. 5), что согласуется с данными видимой и ИК-спектроскопии и свидетельствует о большей ароматичности ГКЧ. Различий между вариантами щелочной экстракции (с азотом и без) в черноземе не выявлено, тогда как в ГКД в варианте без азота несколько выше содержание алкоксигрупп (3.0–4.4 ppm), α-CHn-групп (2.05–3.2 ppm) и несколько ниже содержание ароматических протонов. Однако эта тенденция не сохраняется (за исключением CHnO-групп) на спектрах 13С ЯМР (табл. 6). Спектры 13С ЯМР содержат характерные для ГК пики хинонных (187–220 ppm) и карбоксильных (165–187 ppm) групп, ароматического углерода (108–165 ppm), замещенного (48–108 ppm) и незамещенного (5–48 ppm) алифатического углерода. Содержание карбоксильных групп в ГКЧ существенно ниже, чем в ГКД, что не вполне согласуется с данными потенциометрического титрования (содержание групп, титруемых в кислом диапазоне, несколько больше в ГКЧ). Общее содержание ароматического углерода (108–165 ppm) в ГКЧ несколько выше, а алифатического (108–5 ppm) – несколько ниже, чем в ГКД (табл. 7), что согласуется с большей степенью ароматичности ГКЧ по данным элементного анализа, видимой и ИК-спектроскопии и 1H ЯМР. Качественный спектр препарата ГКЧ, выделенного в атмосфере азота, получить не удалось, что не позволяет сравнить данные разных вариантов экстракции. У ГКД вариант экстракции без азота отличается более высоким относительным содержанием хинонных и карбоксильных групп и замещенных кислородом ароматических фрагментов кислородом ароматических фрагментов, что согласуется с данными элементного анализа (отношение O : C больше в ГКД) и может свидетельствовать об окислении ГК данной почвы в процессе экстракции.
Таблица 5.
Распределение скелетных протонов по структурным фрагментам в препаратах ГК по данным ПМР, % от общей площади ЯМР-спектра
| Препарат | Структурная группа (спектральная область, ppm) | |||
|---|---|---|---|---|
| CHn (0–2.05) |
α-CHn (2.05–3.2) |
CHnO (3.0–4.4) |
HАR (6.2–12.0) |
|
| ГКД | 26.2 | 19.4 | 35.2 | 19.3 |
| ${\text{Г К }}{{{\text{Д }}}_{{{{{\text{N}}}_{2}}}}}$ | 26.8 | 16.0 | 33.0 | 24.2 |
| ГКЧ | 16.6 | 16.1 | 35.4 | 31.9 |
| ${\text{Г К }}{{{\text{Ч }}}_{{{{{\text{N}}}_{2}}}}}$ | 15.8 | 16.4 | 34.8 | 33.1 |
Таблица 6.
Распределение атомов углерода по структурным фрагментам в препаратах ГК по данным 13С ЯМР, % от общей площади ЯМР-спектра
| Препарат | Структурная группа (спектральная область, ppm) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| алифатические фрагменты | поли-сахариды | ароматические фрагменты |
карбоксилы, кетоны, хиноны | ||||||
| CHn (5–48) |
CH3–O,N (48–58) |
CH2–O,N (58–64) |
CH–O (64–90) |
OC–O,N (90–108) |
CAR (108–145) |
CARO (145–165) |
COO (165–187) |
C=O (187–220) |
|
| ГКД | 13 | 7 | 3 | 13 | 3 | 21 | 13 | 20 | 8 |
| ${\text{Г К }}{{{\text{Д }}}_{{{{{\text{N}}}_{2}}}}}$ | 20 | 5 | 4 | 12 | 9 | 24 | 9 | 12 | 4 |
| ГКЧ | 15 | 5 | 7 | 11 | 7 | 31 | 8 | 8 | 7 |
Таблица 7.
Содержание свободных радикалов в почвах и препаратах ГК по данным ЭПР
| Образец | Спин/г | Ширина линии, Гаусс |
|---|---|---|
| Чернозем | 1.30 × 1016 | 5.01 |
| ГКЧ | 1.51 × 1018 | 3.56 |
| ${\text{Г К }}{{{\text{Ч }}}_{{{{{\text{N}}}_{2}}}}}$ | 1.30 × 1018 | 3.83 |
| Дерново-подзолистая почва | 3.49 × 1015 | 5.20 |
| ГКД | 8.06 × 1016 | 5.58 |
| ${\text{Г К }}{{{\text{Д }}}_{{{{{\text{N}}}_{2}}}}}$ | 6.89 × 1016 | 4.26 |
Методом ЭПР установлено несколько большее содержание органических свободных радикалов семихиноидного типа во всех препаратах ГК по сравнению с исходной почвой (табл. 7), что можно объяснить действием щелочного гидролиза [12]. Аналогичные данные были получены ранее другими авторами [18, 28]. Разброс энергетических характеристик свободных радикалов (соответствует ширине спектральной линии ЭПР) в препаратах ГК заметно ниже, чем в спектрах ЭПР почвенных образцов за исключением ГКД без азота. Содержание свободных радикалов в черноземе и выделенной из него ГК выше, чем в дерново-подзолистой почве и ГКД на один и два порядка соответственно. При этом в ГКЧ содержание свободных радикалов только на 15% выше, чем в ${\text{Г К }}{{{\text{Ч }}}_{{{{{\text{N}}}_{2}}}}},$ тогда как в дерново-подзолистой почве эффект присутствия кислорода при выделении препаратов ГК оказался более значительным – ГКД содержит в два раза больше свободных радикалов, чем ${\text{Г К }}{{{\text{Д }}}_{{{{{\text{N}}}_{2}}}}}.$ Кроме того, в ГКД значительно увеличилась ширина спектральной линии ЭПР (табл. 7). Это свидетельствует о большем разбросе энергетических характеристик свободных радикалов в ГКД, который превысил разброс даже для спектров ЭПР почвенных образцов. Данные ЭПР подтверждают результаты ЯМР спектроскопии, потенциометрического титрования и определения элементного состава и свидетельствуют об исходно меньшей степени окисленности органического вещества дерново-подзолистых почв, что подтверждается и литературными данными [12, 28]. В результате, щелочная экстракция без азота приводит к существенному увеличению концентрации индуцированных кислородом свободных радикалов в ГК из этой почвы.
Помимо оптических свойств, структурно-группового и элементного состава, были изучены молекулярно-массовые распределения ГК. Препарат ГКД состоит из двух фракций: высокомолекулярной, выходящей в свободном объеме колонки (молекулярная масса >75 кДа, относительное содержание 23%) и низкомолекулярной с массой середины пика около 29 кДа, относительное содержание которой составляет 77–78% (табл. 8). Препарат ГКЧ более низкомолекулярный: содержание высокомолекулярной фракции – 2%, низкомолекулярной фракции – 98%, ее молекулярная масса – 10 кДа. Различий между препаратами, выделенными с продувкой азотом или без нее, не выявлено. Результаты, полученные для ГКЧ, согласуются с литературными данными. Показано, что O2 не влияет на молекулярно-массовые распределения гуминовых веществ, выделенных щелочной экстракцией из обыкновенного чернозема [3]. Таким образом, присутствие кислорода в щелочных экстрактах не приводит к окислительной полимеризации или деполимеризации ГК изученных почв. Относительно низкомолекулярная природа ГКЧ согласуется с условиями гумусообразования в черноземах. В этих почвах достаточно высокий период биологической активности, что способствует глубокой переработке растительных остатков и гуминовых веществ в результате более окисленные и низкомолекулярные [6]. В дерново-подзолистых почвах, являющихся зональными для средней и южной тайги, за счет холодного и влажного климата деструкция растительных остатков и их гумификация замедлены. Поэтому в почвах создаются условия для сохранения и накопления высокомолекулярных соединений гумуса.
Таблица 8.
Молекулярные массы ГК и содержание фракций по данным гель-фильтрации
| Препарат | Высокомолекулярная фракция | Низкомолекулярная фракция | ||
|---|---|---|---|---|
| ММ, кДа | доля, % | ММ, кДа | доля, % | |
| ГКД | >75 | 23 | 27 | 77 |
| ${\text{Г К }}{{{\text{Д }}}_{{{{{\text{N}}}_{2}}}}}$ | >75 | 24 | 27 | 76 |
| ГКЧ | >75 | 2 | 13 | 98 |
| ${\text{Г К }}{{{\text{Ч }}}_{{{{{\text{N}}}_{2}}}}}$ | >75 | 2 | 12 | 98 |
ЗАКЛЮЧЕНИЕ
Изучение структуры и физико-химических свойств ГК из дерново-подзолистой почвы и чернозема показало отсутствие различий в препаративном выходе, молекулярно-массовых распределениях, спектрах поглощения в УФ-, видимой и ИК-областях между препаратами, выделенными щелочной экстракцией в присутствии азота и без его использования. Элементный анализ, потенциометрическое титрование и спектроскопия ЯМР на ядрах 1H и 13С выявили несколько бóльшее отношения O : C, немного более высокое содержание кислых групп, титруемых в диапазоне рН 3.9–8.7, и повышенное содержание хинонных (187–220 ppm) и карбоксильных (165–187 ppm) групп в препарате ГКД по сравнению с ${\text{Г К }}{{{\text{Д }}}_{{{{{\text{N}}}_{2}}}}},$ что свидетельствует о процессах окисления компонентов щелочной вытяжки из дерново-подзолистой почвы при экстракции в присутствии молекулярного кислорода. Об окислении свидетельствует также увеличение содержания свободных радикалов в ГКД по сравнению с ${\text{Г К }}{{{\text{Д }}}_{{{{{\text{N}}}_{2}}}}}.$ Данных отличий для ГКЧ не выявлено, что может свидетельствовать о глубокой окислительной трансформации ОВ при гумификации в черноземах, поэтому дальнейшего окисления при экстракции в щелочной среде в присутствии кислорода не происходит. Применение инертного газа для выделения ГК из минеральных горизонтов черноземов можно считать нецелесообразным. В случае дерново-подзолистых почв, экстракцию в атмосфере азота следует использовать, если в дальнейшем предполагается изучать реакции окисления ГК – например, при ферментативном катализе.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена при финансовой поддержке Российского научного фонда, грант 17-14-01207 (отбор проб почв, выделение препаратов гуминовых веществ и их характеристика методами элементного анализа, УФ- и ИК-спектроскопии, гель-хроматографии и потенциометрии) и гранта РФФИ 18-29-25065 (исследование препаратов гуминовых веществ методами спектроскопии ЯМР на ядрах 1Н и 13С).
Список литературы
Заварзина А.Г., Демин В.В. Кислотно-основные свойства гуминовых кислот различного происхождения по данным потенциометрического титрования // Почвоведение. 1999. № 10. С. 1246–1254.
Заварзина А.Г., Ванифатова Н.Г., Степанов А.А. Фракционирование гуминовых кислот по относительной гидрофобности, размеру и заряду методом высаливания // Почвоведение. 2008. № 12. С. 1466–1474.
Завгородняя Ю.А., Демин В.В., Кураков А.В., Бирюкова О.Н. Характеристика физико-химических свойств грибных меланинов // Вестн. Моск. ун-та. 2001. Сер. 17, почвоведение. № 3. С. 39–47.
Ковалевский Д.В., Пермин А.Б., Перминова И.В., Коннов Д.В., Петросян В.С. Выбор условий регистрации количественных 13С ЯМР спектров гумусовых кислот // Вестн. Моск. ун-та. 2000. Сер. 2, химия. Т. 41. № 1. С. 39–42.
Лодыгин Е.Д., Безносиков В.А., Василевич Р.С. Парамагнитные свойства гумусовых веществ таежных и тундровых почв европейского северо-востока России // Почвоведение. 2018. № 8. С. 985–993.
Орлов Д.С. Гумусовые кислоты почв и общая теория гумификации. М.: Изд-во Моск. ун-та, 1990.
Орлов Д.С., Гришина Л.А. Практикум по химии гумуса. М: Изд-во Моск. ун-та, 1981.
Холодов В.А., Константинов А.И., Беляева Е.Ю., Кирюшин А.В., Куликова Н.А., Перминова И.В. Сравнительная характеристика строения гуминовых кислот, извлекаемых в ходе последовательной щелочной экстракции из типичного чернозема // Почвоведение. 2009. № 10. С. 1177–1183.
Холодов В.А., Константинов А.И., Перминова И.В. Распределение углерода по функциональным группам в гуминовых кислотах при последовательных щелочных экстракциях из серой лесной почвы // Почвоведение. 2009. № 11. С. 39–44.
Холодов В.А., Константинов А.И., Кудрявцев А.В., Перминова И.В. Строение гуминовых кислот почв зонального ряда по данным спектроскопии ЯМР 13С // Почвоведение. 2011. № 9. С. 1064–1073. https://doi.org/10.1134/S1064229311090043
Холодов В.А., Ярославцева Н.В., Константинов А.И., Перминова И.В. Препаративный выход и свойства гуминовых кислот при последовательных щелочных экстракциях // Почвоведение. 2015. № 10. С. 1222–1231.
Чуков С.Н. Структурно-функциональные параметры органического вещества почв в условиях антропогенного воздействия. СПб.: Изд-во СПбГУ, 2001. 216 с.
Angst G., Mueller K.E., Kögel-Knabner I., Freeman K.H., Mueller C.W. Aggregation controls the stability of lignin and lipids in clay-sized particulate and mineral associated organic matter // Biogeochem. 2017. V. 132. P. 307–324.
Batjes N.H. Total carbon and nitrogen in the soils of the world // Eur. J. Soil. Sci. 2014. V. 65. P. 4–21.
Cao X., Schmidt-Rohr K. Abundant nonprotonated aromatic and oxygen-bonded carbons make humic substances distinct from biopolymers // Environ. Sci. Technol. Let. 2018. https://doi.org/10.1021/acs.estlett.8b00107
Crundwell F.K. The mechanism of dissolution of minerals in acidic and alkaline solutions: Part II Application of a new theory to silicates, aluminosilicates and quartz // Hydrometallurgy. 2014. V. 149. P. 265–275.
Drosos M., Savy D., Spiteller M., Piccolo A. Structural characterization of carbon and nitrogen molecules in the Humeome of two different grassland soils // Chem. Biol. Technol. Agric. 2018. V. 5. P. 1–15.
Gonzalez-Perez M., Martin-Neto L., Colnago L.A., Milori D.M.B.P., Camargo O.A., Berton R., Bettiol W. Characterization of humic acids extracted from sewage sludge-amended oxisols by electron paramagnetic resonance // Soil and Tillage Research. 2006. V. 91. № 1–2. P. 95–100. https://doi.org/10.1016/j.still.2005.11.007
Hayes M.H.B., Swift R.S. An appreciation of the contribution of Frank Stevenson to the advancement of studies of soil organic matter and humic substances // J. Soil. Sediments. 2018. V. 18. P. 1212–1231.
Kelleher B.P., Simpson A.J. Humic substances in soils: are they really chemically distinct? // Environ. Sci. Technol. 2006. V. 40. P. 4605–4611.
Kovalevskii D.V., Permin A.B., Perminova I.V., Konnov D.V., Petrosyan V.S. Quantitative 1H NMR spectroscopic determination of exchangeable and backbone protons of humic substances // Moscow University Chemistry Bulletin. 1999. V. 40. № 6. P. 375–380.
Lehmann J., Kleber M. The contentious nature of soil organic matter // Nature. 2015. V. 528. P. 60–68.
Lisov A.V., Trubitsina L.I., Lisova Z.A., Trubitsin I.V., Zavarzina A.G., Leontievsky A.A. Transformation of humic acids by two-domain laccase from Streptomyces anulatus // Proc. Biochem. 2019. V. 76. P. 128–135. https://doi.org/10.1016/j.procbio.2018.11.001
Nebbioso A., Piccolo A. Molecular characterization of dissolved organic matter (DOM): a critical review // Anal. Bioanal. Chem. 2013. V. 405. P. 109–124.
Nebbioso A., Piccolo A. Basis of a humeomics science: chemical fractionation and molecular characterization of humic biosuprastructures // Biomacromol. 2011. V. 12. P. 1187–1199.
Perminova I.V. Database on molecular compositions of natural organic matter and humic substances as measured by high resolution mass spectrometry // Chem. Int. 2017. V. 39. P. 21–21.
Piccolo A. The supramolecular structure of humic substances // Soil Sci. 2001. V. 166. P. 810–832.
Saab S.C., Martin-Neto L. Studies of semiquinone free radicals by EPR in the whole soil, HA, FA and humin substances // J. Braz. Chem. Soc. 2004. V. 15. № 1. P. 34–37.
Saito B., Seckler M.M. Alkaline extraction of humic substances from peat applied to organic-mineral fertilizer production // Braz. J. Chem. Engin. 2014. V. 31. № 3. P. 675–682.
Senesi N. Humic substances as natural nanoparticles ubiquitous in the environment // Molecular environmental soil science at the interfaces in the Earth’s critical zone / Eds. J. Xu, P.M. Huang. Berlin-Heidelberg: Springer, 2010. P. 249–251.
Senesi N., D’Orazio V., Ricca G. Humic acids in the first generation of EUROSOILS // Geoderma. 2003. V. 116. P. 325–344.
Stevenson F.J. Humus chemistry: genesis, composition, reactions. N.Y.: John Wiley & Sons, 1994.
Sutton R., Sposito G. Molecular structure in soil humic substances: the new view // Environ. Sci. Technol. 2005. V. 39. P. 9009–9015.
Swift R.S. Organic matter characterization (chap 35) // Methods of soil analysis. Madison, WI: Soil Science Society of America. 1996. P. 1018–1020.
Vermerris W., Nicholson R. Phenolic Compound Biochemistry. Springer, 2006.
Zavarzina A.G., Demin V.V., Nifant’eva T.I., Shkinev V.M., Danilova T.V., Spivakov B.Ya. Extraction of humic acids and their fractions in polyethylene glycol-based aqueous biphasic systems // Anal. Chim. Acta. 2002. V. 452. P. 95–103.
Дополнительные материалы отсутствуют.