Почвоведение, 2020, № 11, стр. 1341-1352
Особенности круговорота биофильных элементов в подстилках экосистем полупустыни Северного Прикаспия
Н. Ю. Кулакова *
Институт лесоведения РАН
143030 с. Успенское, Московская обл., Советская, 21, Россия
* E-mail: nkulakova@mail.ru
Поступила в редакцию 29.01.2020
После доработки 30.03.2020
Принята к публикации 24.04.2020
Аннотация
С использованием данных натурного четырехлетнего эксперимента по разложению растений-доминантов степных и пустынных фитоценозов, опада дуба черешчатого, интродуцированного в условия полупустыни, и фекалий овец, поступающих на пастбища, определены скорости круговорота и основные механизмы аккумуляции биофильных элементов (С, N, P, K) в подстилках нативных, лесных и пастбищных экосистем Северного Прикаспия (Волгоградская область, Джаныбекский стационар Института лесоведения РАН). Найдено, что в подстилках нативных степных ассоциаций накапливается в 16–19 раз больше С и N и в 2–2.5 раза больше K и Р, чем в пастбищных. Нативные растительные сообщества пустыни аккумулируют в подстилке C, N, P и K в 1.5 раза интенсивнее, чем пастбищные. В подстилке дубового насаждения запасы основных биофильных элементов в 5–8 раз больше, чем в степной подстилке. Показано, что в 6–7 раз более низкая, чем в степной подстилке, скорость круговорота биофильных элементов в подстилке дубового насаждения соответствуют более низким, чем у растений-доминантов степных ассоциаций значениям констант разложения листьев дуба. На порядок более высокая, чем в нативных степных ассоциациях, скорость разложения подстилок в фитоценозах с разреженной растительностью (степных пастбищных и пустынных нативных и пастбищных), вероятно, связана с усилением фотодеградации растительных остатков под действием света. Особенности формирования подстилок необходимо учитывать при оценке стабильности антропогенных экосистем в регионе.
ВВЕДЕНИЕ
Степные биоценозы отличаются низкой скоростью разложения органического материала, поступающего на поверхность почвы [1]. Скорость разложения подстилки в первую очередь определяется климатическими параметрами и химическим составом органических остатков [19, 22]. На скорость разложения влияют свойства почвы [24], разнообразие состава растений [31, 34], а также другие факторы, например, находится ли подстилка под пологом леса или на поляне [28] и соприкасается ли опад с поверхностью почвы [24]. Показано, что на активность процесса разложения указывают, в частности, такие особенности напочвенного покрова, как долевое участие в опаде олиготрофных и нитрофильных видов растений [18]. В условиях дефицита влаги и низкой активности биоты важную роль в процессах разложения играет фотодеградация растительных остатков под действием света [27].
Скорость разложения растительного опада, как правило, уменьшется со временем, при этом высокая концентрация азота в первой фазе, когда разложению подвергается целлюлоза, способствует увеличению скорости разложения, а когда разложению подвергается лигнин – препятствует [21]. Одним из наиболее быстро выщелачиваемых из подстилки элементом является калий [23, 35 ]. Иммобилизация или потеря фосфора в лесных подстилках определяются соотношениями лигнин/Р [35] или углерод (С)/P [23].
В аридных условиях низкая скорость разложения растительных остатков может быть связана с незначительной численностью растительноядных беспозвоночных, особенно характерной для микроповышений с солонцовыми почвами [5]. В лесных искусственных насаждениях мезофауна более активно участвует в процессах разложения. В основном это сапротрофные личинки двукрылых, среди которых преобладают Bibionidae (Bibio marci), Tipulidae (Tipula peliostigma) [6]. Однако воздействие даже этих, наиболее активных сапротрофов, локализовано и их распространение очень неравномерно [6].
В последние десятилетия из-за усилившегося антропогенного прессинга и естественной цикличности в изменении численности животного населения [11], резко уменьшилось влияние диких травоядных млекопитающих на скорость и емкость круговорота биофильных элементов. Так, плотность расселения сусликов (Spermophilus pygmaeus) уменьшилась от 25–35 особей на га в 80-ых годах ХХ в. [11] до единично встречающихся в наши дни. В этот же период сократилась и численность сайгаков [11]. Хозяйственная деятельность человека привела к возникновению новых экосистем в полупустыне. Земли, не занятые под сельскохозяйственные культуры, используются под пастбища с разной интенсивностью выпаса. Созданы лесные экосистемы, выполняющие важные социальные и хозяйственные функции (это зоны рекреации, полезащитные кулисы, солнцезащитные зонты для скота). Наиболее долговечны насаждения на лугово-каштановых почвах понижений (Haplic Kastanozem по классификации WRB 2014 [32]), а одной из перспективных пород для лесоразведения в засушливых регионах является дуб черешчатый [15].
В антропогенно-преобразованных экосистемах изменяются не только количество и состав поступающих на поверхность почвы растительных остатков, но и условия их разложения, в частности температура, влажность, освещенность. Поэтому кардинально изменяются скорость круговорота элементов и их депонирование в подстилке, что определяет устойчивость и продуктивность экосистем [3, 4, 12]. Влияние антропогенного фактора на особенности круговорота основных биофильных элементов в условиях полупустыни Северного Прикаспия ранее не изучалось, хотя такие исследования актуальны для получения прогнозных оценок стабильности созданных экосистем.
Цель представляемого исследования состояла в сравнении объема и скорости круговорота C, N, P и K в подстилках естественных (степных и пустынных) растительных сообществ, созданных лесных насаждений и пастбищных экосистем, а также в выявлении механизмов, определяющих особенности круговорота этих элементов в антропогенных экосистемах.
Район исследований. Работа проводилась на Джаныбекском стационаре Института лесоведения РАН, расположенном в северо-западной части Прикаспийской низменности (49°25′ N, 46°46′ E). Естественные растительные сообщества относят к пустынному, сухостепному и степному типам. Исследовались пустынные и степные сообщества, занимающие в равных долях примерно 80% территории [13]. Пустынные сообщества приурочены к микроповышениям с солонцами (Gypsic Salic Solonetz (Albic, Loamic, Columnic, Cutanic, Differentic) по классификации WRB 2014 [32]) [13]. Эдификаторами растительных ассоциаций в них являются полынь черная (Artemísia pauciflora Web.) и прутняк (Kochia prostrata Schrad.). Степные фитоценозы на лугово-каштановых почвах (Haplic Kastanozem (Loamic)) приурочены к микро- и мезопонижениям. Здесь преобладают дерновинные злаки – ковыль (Stipa lessingiana, Trin.&Rupr) и типчак (Festuca valesiaca Gaudin).
Для исследования нативных и антропогенно-нарушенных растительных ассоциаций степного и пустынного типов были выбраны 2 участка с комплексным почвенным покровом, включающим солонцы и лугово-каштановые почвы [13]: 1 – заповедный – площадью ~20 га, с очень ограниченной пастьбой животных; 2 – пастбище с более чем 20-летним выпасом животных, преимущественно овец. Исследовалось также мертвопокровное насаждение дуба черешчатого 70-летнего возраста на лугово-каштановых почвах. Расстояние между деревьями в ряду составляет 1 м, между рядами – 2.5 м.
Методы исследования. Исследовали скорость разложения пяти видов растений: листья, стебли и соцветия с семенами злаков – типчака (Festuca valesiaca Gaudin) и ковыля (Stipa lessingiana Trin. & Rupr), однолетние побеги полукустарничков – полыни (Artemísia pauciflora Web) и прутняка (Kochia prostrata Schrad), опад дуба черешчатого (Quercus robur L.), а также овечий помет. С этой целью были сформированы специальные сетчатые пакеты с растительным материалом или с пометом, которые помещали в тех местах, куда этот материал поступает в естественных условиях: типчак и ковыль – в микропонижениях, полынь черная и прутняк – на микроповышениях. Пакеты с опадом дуба закрепляли на поверхности почвы в насаждении, а с образцами овечьего помета – и в микропонижениях, и на микроповышениях. Растения отбирались в конце вегетационного периода и не измельчались, а брались целиком, чтобы воспроизвести условия разложения, складывающиеся в естественных условиях, когда отмерший растительный материал попадает на поверхность почвы. Из-за мозаичности растительного покрова произрастание видов и поступление опада каждого вида растений локализовано, поэтому пакеты содержали растения только одного вида. Их укладывали на поверхность почвы, предварительно выкопав имеющиеся на площадке растения и слегка утрамбовав поверхность площадки. Масса образцов составляла 50 г. На специально огороженные площадки закладывали по 6 пакетов каждого вида растений. Ячейки верхней сетки пакетов имели диаметр 2 мм, нижней – 0.2 мм, что было связано с очень небольшим размером семян некоторых растений. Образцы компостировали в течение четырех лет (с осени 2011 по осень 2015 г.). Каждый год в конце вегетационного периода пакеты аккуратно переносили в лабораторию, с помощью лупы убирали минеральные частицы почвы, занесенные в сетку, и взвешивали образец. Из каждого пакета изымали часть образца для анализа. В изъятой части определяли массу и влажность, концентрацию C, N, P, K. Оставшуюся часть образца взвешивали, пересчитывали массу с учетом влажности, измеренной в изъятой части, и затем пакеты возвращали на прежнее место.
Для оценки массы растительного опада в степных и в пустынных фитоценозах мы воспользовались данными 60-летнего мониторинга динамики продуктивности, проводимом на Джаныбекском стационаре ИЛАН РАН [16], считая, что средняя многолетняя наземная продуктивность фитоценозов приблизительно соответствует величине среднего ежегодного поступления мортмассы на поверхность почвы. Учет опада дуба проводили в 2014 и 2015 гг. с помощью опадоуловителей площадью 1 м2 в трех- и четырехкратной повторности. Массу горизонтов подстилки (горизонты L – листовой, F – ферментации, H – гумификации) определяли осенью на площадках 0.4 м2 в шестикратной повторности в течение трех лет. Масса фекалий животных, поступающих на поверхность почвы в условиях выпаса, была определена на пробных площадях исследуемого пастбища Абатуровым [8]. Для вычисления изъятой животными фитомассы на пастбище воспользовались данными Абатурова по пересчету массы фекалий на потребленную кормовую массу [2, 8].
Концентрацию С и N в образцах, компостируемых на поверхности почвы, и пробах подстилки определяли на автоматическом анализаторе элементного состава Mario MICRO (Elementar, Германия), Р и К – рентгенфлуоресцентным методом (РФА) на Спектроскане МАКС-GV (“НПО "СПЕКТРОН”, Россия). Все определения проводили в сухих образцах, растертых до состояния пудры.
Обработка данных. Массу образца в % от массы предыдущего года рассчитывали по формуле:
(1)
${{M}_{{it}}} = ({{{{M}_{t}}} \mathord{\left/ {\vphantom {{{{M}_{t}}} {{{M}_{{t - 1}}}}}} \right. \kern-0em} {{{M}_{{t - 1}}}}}) \times 100,$Массу образца в текущий год исследований, в % от массы образца до компостирования определяли по уравнению:
(2)
${{М}_{{0--t}}} = {{{{M}_{0}}{{M}_{{i1}}}} \mathord{\left/ {\vphantom {{{{M}_{0}}{{M}_{{i1}}}} {100}}} \right. \kern-0em} {100}}{{{{M}_{{i2}}}} \mathord{\left/ {\vphantom {{{{M}_{{i2}}}} {100}}} \right. \kern-0em} {100}} \ldots {{{{M}_{{it}}}} \mathord{\left/ {\vphantom {{{{M}_{{it}}}} {100}}} \right. \kern-0em} {100}},$Массу элемента x в компостируемом образце в год t, выраженную в % от массы элемента до компостирования, вычисляли согласно формуле:
(3)
${{M}_{{[x]0--t}}} = {{{{M}_{{0--t}}}{{{[x]}}_{t}}} \mathord{\left/ {\vphantom {{{{M}_{{0--t}}}{{{[x]}}_{t}}} {{{{[x]}}_{0}}}}} \right. \kern-0em} {{{{[x]}}_{0}}}},$Массу органических остатков, аккумулирующихся на поверхности почвы за 4 года, вычисляли по формуле:
где m – масса опада, M0–1 … M0–4 вычисляли по формуле (2).Массу элемента, накапливающуюся на поверхности почвы за 4 года, определяли согласно уравнению:
(5)
$\begin{gathered} {{M}_{{[x]}}} = m{{[x]}_{0}}({{M}_{{[x]0 - 1}}} + {{M}_{{[x]0 - 2}}} + \\ + \,\,{{M}_{{[x]0 - 3}}} + {{M}_{{[x]0 - 4}}}), \\ \end{gathered} $Константу разложения (k) вычисляли по формуле, предложенной Berg and McClaugherty [22]:
(6)
$k = --\ln {{({{{{M}_{{t - 1}}}} \mathord{\left/ {\vphantom {{{{M}_{{t - 1}}}} {{{M}_{t}}}}} \right. \kern-0em} {{{M}_{t}}}})} \mathord{\left/ {\vphantom {{({{{{M}_{{t - 1}}}} \mathord{\left/ {\vphantom {{{{M}_{{t - 1}}}} {{{M}_{t}}}}} \right. \kern-0em} {{{M}_{t}}}})} T}} \right. \kern-0em} T},$Статистическую обработку данных проводили в программах MS Base Statistica 6 и Excel 2010. С помощью двухфакторного дисперсионного анализа (ANOVA) исследовали влияние вида образцов и времени их компостирования на скорость потери массы образцами и изменение концентрации биофильных элементов в образцах. После знака ± в таблицах и с помощью планок погрешностей на графиках показан доверительный интервал при уровне значимости α < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изменение массы образцов в процессе компостирования. Скорость потери массы компостируемыми образцами определялась главным образом видом растительных остатков. Двухфакторный дисперсионный анализ с повторениями (ANOVA) данных по изменению массы образцов в процессе компостирования (табл. 1) показал, что воздействие этого фактора составило 47% от влияния всех учтенных и неучтенных (температуры, влажности и т.д.) факторов (F = 73.27, P < 0.001 при Fк = 2.28). Выявлено также отсутствие зависимости скорости разложения всего объема образцов от фактора времени.
Таблица 1.
Ежегодные изменения массы образцов (над чертой *) и значений констант разложения (k, под чертой) при компостировании
| Образец | Год исследования | k разложения за 4 года | |||
|---|---|---|---|---|---|
| первый | второй | третий | четвертый | ||
| Ковыль Лессинга | $\frac{{60.13 \pm 6.17}}{{0.51}}$ | $\frac{{59.71 \pm 6.21}}{{0.52}}$ | $\frac{{53.16 \pm 7.28}}{{0.63}}$ | $\frac{{50.53 \pm 4.20}}{{0.68}}$ | 0.58 |
| Типчак | $\frac{{71.73 \pm 3.8}}{{0.33}}$ | $\frac{{62.80 \pm 5.01}}{{0.47}}$ | $\frac{{52.37 \pm 4.51}}{{0.65}}$ | $\frac{{38.58 \pm 6.04}}{{0.95}}$ | 0.60 |
| Прутняк | $\frac{{55.17 \pm 5.92}}{{0.59}}$ | $\frac{{69.73 \pm 6.37}}{{0.36}}$ | $\frac{{82.91 \pm 5.24}}{{0.19}}$ | $\frac{{98.36 \pm 3.03}}{{0.02}}$ | 0.29 |
| Полынь | $\frac{{69.37 \pm 5.5}}{{0.37}}$ | $\frac{{64.59 \pm 7.22}}{{0.44}}$ | $\frac{{77.43 \pm 7.28}}{{0.26}}$ | $\frac{{67.08 \pm 5.10}}{{0.40}}$ | 0.36 |
| Листья дуба | $\frac{{97.50 \pm 4.46}}{{0.03}}$ | $\frac{{82.22 \pm 3.44}}{{0.20}}$ | $\frac{{89.71 \pm 2.67}}{{0.11}}$ | $\frac{{82.14 \pm 5.09}}{{0.20}}$ | 0.13 |
| Фекалии овец | $\frac{{55.22 \pm 1.10}}{{0.59}}$ | $\frac{{79.78 \pm 8.37}}{{0.23}}$ | $\frac{{73.14 \pm 5.11}}{{0.31}}$ | $\frac{{58.22 \pm 5.36}}{{0.54}}$ | 0.42 |
* Масса образца выражена в % от значений предыдущего года (формула (1)).
Константы разложения, подсчитанные по формуле (6) для каждого года, показывают, что скорость разложения злаков увеличивалась со временем, в то время как скорость разложения образцов прутняка уменьшалась. В остальных образцах изменения не имели определенного тренда.
Различия в скорости потери массы растительными образцами частично объясняются особенностями морфологии растений. У прутняка высокая скорость разложения в начальный период связана с разложением листвы, составляющей до 50% от массы взрослого растения. Более грубые стебли этого растения разлагаются медленнее. У полыни доля ветвей больше по массе, поэтому фазы разложения, связанные с морфологией, менее выражены.
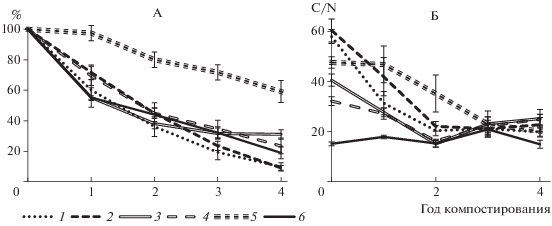
В результате четырехлетнего компостирования осталось менее 10% от первоначальной массы злаков, 20–30% – от массы помета и кустарничков и около 60% – от массы образцов листьев дуба (рис. 1, А). За четырехлетний период на поверхности почвы в пустынных сообществах накапливается около 27% от массы опада первого года, около 34% от растительных остатков, поступивших во второй год, приблизительно 42% – от поступивших на поверхность в третий год и около 62% – в четвертый год. То есть масса растительных остатков, депонирующихся на поверхности почвы за 4 года в пустынных сообществах, составляет 41% от поступившего за этот период опада, в степных – достаточно близкая цифра – около 35%, в насаждении дуба – 77%. От поступившего помета сохраняется 39% массы.
Рис. 1.
Динамика: А – массы компостируемых образцов за 4 года исследований (% от исходной массы, формула (2)); Б – соотношения C/N в компостируемых образцах. Здесь и далее в рисунках: 1 – ковыль, 2 – типчак, 3 – прутняк, 4 – полынь, 5 – дуб, 6 – фекалии.
Изменение концентрации элементов в процессе компостирования. Содержание N в растениях до компостирования различалось: наименьшие значения отмечены в злаках – 0.72–0.76% (рис. 2, А), близкие – в листьях дуба, больше в 1.5–2 раза в кустарничках, и в два с половиной раза больше в помете. В конце четырехлетнего периода образцы оказались более однородными по содержанию N: наименьшие значения, отмеченные в образцах типчака – 1.76%, были в 1.3 раза меньше, чем наибольшие, наблюдаемые в образцах помета.
Рис. 2.
Изменение концентрации элементов: азота (А), углерода (Б), фосфора (В) и калия (Г) при компостировании образцов (% от абсолютно сухого веса).
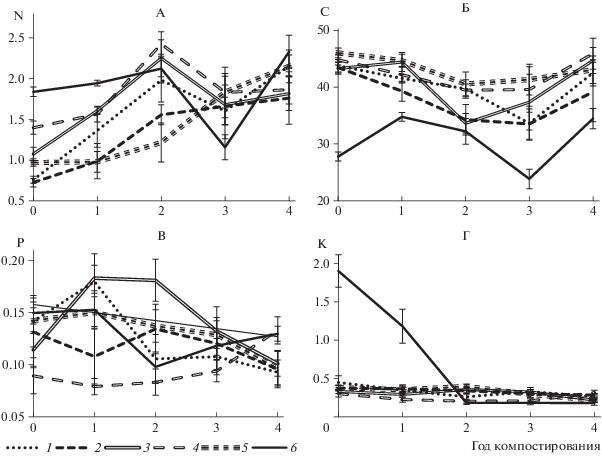
Двухфакторный дисперсионный анализ с повторениями показал, что на содержание N в образцах влияет как вид образцов (F = 84.4 при Р < < 0.001, Fк = 2.4), так и фактор времени (F = 18.3 при Р < 0.001, Fк = 2.4). Влияние первого фактора оценивается в 52%, второго – в 11%.
Содержание C в растительных образцах до компостирования было достаточно однородным (рис. 2, Б), более высоким содержанием выделялись только образцы листьев дуба, достоверно отличаясь по этому показателю (при Р = 0.95, n = 6) от всех образцов, кроме растений полыни. В растительных образцах содержание C уменьшалось от начала компостирования (44–46%) к третьему году (33–40%), затем вновь увеличилось (40–45%). В помете овец содержание C до компостирования было в 1.6 раза меньше, чем среднее содержание в растительных образцах, но уже через год оно приблизилось к значениям в растительных образцах.
Через 4 года значимых различий между растительными образцами в содержании C не обнаружено, хотя внутри одного вида образцов, возможно, в силу немного разного увлажнения в естественных условиях, значения варьировали сильнее, чем в начале эксперимента. Двухфакторный дисперсионный анализ с повторениями показал влияние обоих факторов – и вида образцов и времени компостирования на содержание в образцах C. Большее влияние на содержание C оказывал первый фактор – 47% (при F = 74.9, P < 0.001, Fк = 2.3), а фактор времени – 22% (при F = 43.5, P < 0.001, Fк = 2.4) от влияния всех факторов. Так как содержание C в растительных образцах было близким, при анализе только растительных образцов (без помета) влияние фактора вида растений на содержание C составило только 15%, а фактора времени – 40%.
Соотношение С/N. Самые высокие значения соотношения C/N были у злаков – около 60, в образцах дуба – несколько более низкие – около 48, еще более низкие значения – в образцах полукустарничков – между 30 и 40, самые низкие – в образцах помета – 15. Соотношение C и N в процессе разложения растительных образцов (рис. 1, Б) уменьшалось от начала компостирования к третьему году, что объясняется газообразными потерями C и микробиологической фиксацией N, а затем практически не изменялось. В образцах помета оно мало изменялось, оставалось в течение всего времени эксперимента на уровне 15–21, что связано с изначально высоким содержанием N.
Значения соотношения С/N во всех образцах к третьему и четвертому году компостирования стали близкими: 15 в образцах помета и 20–25 в растительных образцах. Корреляционный анализ всего блока образцов показал отсутствие зависимости между соотношением С/N и потерей массы образцами, что связано, очевидно, с существенным влиянием на начальные фазы процесса разложения морфологии растений.
Содержание Р изменялось от 0.09 до 0.15% в исходных растительных образцах и от 0.09 до 0.13% в образцах после компостирования, не различаясь достоверно между разными образцами в эти периоды. Двухфакторный дисперсионный анализ с повторениями показал менее значительное влияние на содержание Р, чем на содержание других биофильных элементов в образцах, и фактора вида образца (10% при F = 8.3; P < 0.001, Fк = 2.4), и фактора времени (15% при F = 10.5, P < 0.001, Fк = 2.3).
Содержание К в растительных образцах в процессе компостирования имело слабый тренд на снижение, только в образцах полыни, за время компостирования оно практически не изменилось.
В начальный момент и после первого года компостирования содержание К существенно, более чем в 5 раз было больше в образцах помета, чем в других образцах. Но уже на второй год компостирования его содержание резко упало и стало минимальным. Двухфакторный дисперсионный анализ с повторениями показал, что влияние фактора вида образцов на содержание К составляло 18.6% (при F = 109.9; Р < 0.001, Fк = 2.3), а фактора времени – 21.4% (при F = 126.4, Р < 0.001, Fк = 2.4).
Изменение запасов биофильных элементов при компостировании. В процессе компостирования в исследуемых материалах изменялись запасы основных биофильных элементов (рис. 3). В образцах злаков, полыни и помета после четырех лет компостирования запасы N составили 20–30% от первоначальных, в образцах прутняка – немного более 50%, в образцах листьев дуба запасы N, напротив, увеличились на 30% (рис. 3, А). Такое увеличение мы предположительно связываем с изменением состава и численности микроорганизмов. Этому процессу способствует, вероятно, как изменение состава растительности, так и более высокая влажность подстилки в дубовых насаждениях (на 6–13% больше, чем на участках со степной растительностью [9]), отсутствие ультрафиолетового облучения, которое снижает иммобилизацию N [26] и ведет к сокращению его запасов [30]. Более высокое содержание N в верхнем пятисантиметровом слое гумусового горизонта почв под насаждением, чем в этом слое гумусового горизонта нативных лугово-каштановых почв (4.50 ± 0.36 и 3.25 ± 0.37% соответственно) [8], также создает предпосылки для более интенсивного процесса иммобилизации N в лесной подстилке [24].
Рис. 3.
Изменение запасов азота (А), углерода (Б), фосфора (В) и калия (Г) за 4 года исследований (% от исходных запасов).
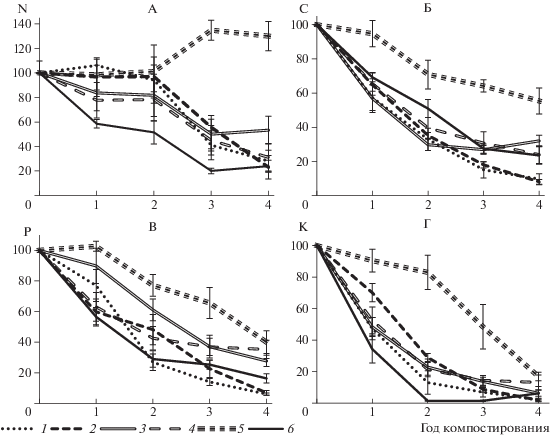
Запасы С в результате четырехлетнего компостирования сократились во всех исследуемых образцах (рис. 3, Б). Так, в злаках (St. lessingiana и F. valesiaca) осталось около 10% первоначальных запасов С, в образцах полукустарничков и помета – около 20–30%, а в образцах листьев дуба – около 55%. Запасы Р в исследуемых материалах также существенно уменьшились по сравнению с таковыми до начала эксперимента (рис. 3, В). В образцах злаков осталось только 6–7% от первоначальных запасов Р, в образцах кустарничков – 28–35%, 16% – в образцах помета и 40% – в образцах листьев дуба. Наибольшему выносу при разложении образцов подвергался К (рис. 3, Г). В образцах злаков его осталось около 2% от исходного количества, в прутняке и помете – около 6%, в образцах полыни – 13%, а в образцах листьев дуба – 17%.
Масса ежегодно поступающих органических остатков и С, N, P, K в исследуемых экосистемах. Поступление отмерших растительных остатков на поверхность почвы в экосистемах за многолетний период приблизительно равно продуктивности наземной фитомассы экосистем. Средняя продуктивность в степных ассоциациях составляет 300 г/м2, а пустынных – 100 г/м2 [16]. По данным Абатурова [8], на пастбищном участке ежегодный опад меньше, чем в экосистемах без выпаса и составляет около 60% в степных растительных ассоциациях и 66% – в пустынных. Чтобы рассчитать количество мортмассы, поступающей на поверхность почвы в пастбищных экосистемах, мы умножили среднюю ежегодную продуктивность фитоценозов на 0.60 в степных растительных ассоциациях и на 0.66 – в пустынных. Затем к полученным значениям мортмассы прибавили значения массы фекалий, поступающих в течение года. Согласно расчетам Абатурова, интенсивность накопления фекалий зависела от типа растительной ассоциации и составила в среднем за 4 года наблюдений 8.4 ± 1.5 г/м2 в степных ассоциациях западин и 6.1 ± 1.4 г/м2 в полупустынных ассоциациях микроповышений [8]. То есть с фекалиями в степные ассоциации пастбищ вносится в 14 раз, а в пустынные – в 6 раз меньше органических остатков, чем изымается при поедании зеленой массы, так как значительная часть фекалий откладывается в местах ночевок животных на фермах. Для расчета поступления элементов учли концентрацию элементов в растительных остатках доминантов и в фекалиях.
В насаждении дуба запасы опада составили 242 ± 36.8 г/м2, или около 80% массы опада в степных ассоциациях.
Поступление C было приблизительно пропорционально поступлению органических остатков, что связано с близким содержанием элемента в растительных остатках и незначительной массой поступающих фекалий, в то время как поступление других элементов определялось химическим составом растений. В нативные степные растительные ассоциации с опадом растений поступало почти в 3 раза больше С, в два раза больше N и приблизительно в 4 раза больше K и P, чем в пустынные (табл. 2).
Таблица 2.
Расчетные данные по ежегодному поступлению C, N, P и K на поверхность почвы и депонированию этих элементов за четырехлетний период
| Экосистемы | Растительная ассоциация | $\frac{{{\text{Поступление элементов, }}{{\text{г}} \mathord{\left/ {\vphantom {{\text{г}} {{{{\text{м}}}^{{\text{2}}}}}}} \right. \kern-0em} {{{{\text{м}}}^{{\text{2}}}}}}\,\,{\text{в год}}}}{{{\text{Депонирование элементов за 4 года, }}{{\text{г}} \mathord{\left/ {\vphantom {{\text{г}} {{{{\text{м}}}^{{\text{2}}}}}}} \right. \kern-0em} {{{{\text{м}}}^{{\text{2}}}}}}}}$ | |||
|---|---|---|---|---|---|
| C | N | P | К | ||
| Нативные | Степная | $\frac{{131}}{{158}}$ | $\frac{{2.2}}{{6.0}}$ | $\frac{{0.4}}{{0.54}}$ | $\frac{{1.2}}{{0.83}}$ |
| Пустынная | $\frac{{44}}{{67}}$ | $\frac{{1.2}}{{3.1}}$ | $\frac{{0.1}}{{0.20}}$ | $\frac{{0.3}}{{0.27}}$ | |
| Антропогенные | Насаждения дуба | $\frac{{111}}{{318}}$ | $\frac{{2.4}}{{10.9}}$ | $\frac{{0.3}}{{0.98}}$ | $\frac{{0.9}}{{2.20}}$ |
| Пастбищная степная | $\frac{{81}}{{95}}$ | $\frac{{1.5}}{{3.6}}$ | $\frac{{0.3}}{{0.32}}$ | $\frac{{0.9}}{{0.50}}$ | |
| Пастбищная пустынная | $\frac{{31}}{{44}}$ | $\frac{{0.9}}{{2.0}}$ | $\frac{{0.1}}{{0.13}}$ | $\frac{{0.3}}{{0.18}}$ | |
Примечание. Депонирование элементов подсчитано по формуле (6).
В пастбищные степные ассоциации с опадом поступало в 1.6–1.4 раза меньше C, N, P, K, чем в экосистемы без выпаса. В пастбищные пустынные экосистемы С и N поступало в 1.4–1.3 раза меньше, чем в нативные, а поступление К и Р практически не зависело от режима использования (выпаса). В насаждения дуба черешчатого с опадом поступало в 1.2–1.3 раза меньше С, Р и K, чем в степные растительные ассоциации, в то время как количество поступающего N было близким.
Депонирование органических остатков на поверхности почвы. Согласно нашим расчетам, в степных фитоценозах за 4 года аккумулировалось около 400 г/м2 органического материала, в пустынных – в 2.5 раза меньше, в насаждении дуба – в 1.8 раза больше. В подстилках пастбищных фитоценозов депонировалось в 1.4–1.6 раза меньше органических остатков, чем в нативных (табл. 3).
Таблица 3.
Запасы горизонтов подстилки (ЗП, г/м2) в исследованных экосистемах и данные по депонированию органического вещества (ДепОВ, г/м2), рассчитанные по материалам четырехлетнего эксперимента
| Показатель | Экосистема | ||||
|---|---|---|---|---|---|
| нативная степная | нативная пустынная | насаждение дуба | пастбищная степная | пастбищная пустынная | |
| ДепОВ | 412 | 164 | 746 | 260 | 118 |
| ЗП(L) | 670 ± 195 | 31.2 ± 32.5 | 860 ± 545 | 78.3 ± 41.4 | 21.2 ± 19.6 |
| ЗП(F) | F-H: | – | 3089 ± 485 | – | – |
| ЗП(H) | 1298 ± 478 | – | 5689 ± 802 | – | – |
| ЗП(L)/ДепОВ | 1.6 | 0.2 | 1.2 | 0.3 | 0.2 |
Мощность естественных подстилок и запасы в них C, N, P и K сильно варьировали. В нативных пустынных и в пастбищных степных и пустынных ассоциациях подстилка была представлена фрагментарно и состояла из одного листового горизонта L. Помимо горизонта L, в подстилке степных нативных фитоценозов выделялся ферментативно-гумусовый горизонт F-H, а в подстилке лесного насаждения – горизонты F (ферментации) и H (гумификации). Формирование горизонтов F-H, F и H связано, видимо, с особенными условиями увлажнения в понижениях, резко отличающимися от условий в автоморфных позициях. Дополнительное поступление влаги за счет талых снеговых вод и ливневых осадков, тяжелосуглинистый гранулометрический состав почв, способствующий задержанию влаги на поверхности, периодическое затопление понижений в осенний и зимний периоды определяют формирование азональных типов подстилки. Запасы подстилки в степных нативных биоценозах были близки к таковым в лугово-степной зоне [14]. Запасы подстилки в насаждении дуба были в 6 и более раз больше, чем в лесостепных дубравах [14], что объясняется, как нам кажется, с одной стороны, достаточно большой плотностью деревьев в исследуемом насаждении и значительным количеством поступающего опада, сравнимым с поступлением опада в лесостепи [10], и, с другой стороны, отсутствием лесной сапротрофной мезофауны, разлагающей подстилку. Успешная интродукция червей вида E. nordenskioldi, разлагающих подстилку, проведенная в 1966 г. в насаждении, отстоящим на расстоянии около 3 км от исследуемого, привела к сокращению массы подстилки до 1900 г/м2 [6]. Накоплению материала подстилки способствует также более сухой летний период, чем в лесостепной зоне.
Так как образцы после четырех лет компостирования на поверхности почвы по морфологии относились к слою L подстилки, мы сравнили запасы именно этих горизонтов с нашими расчетными данными (табл. 3). Оказалось, что запас слоя L в степной ассоциации в 1.6 раза больше рассчитанной массы органических остатков, аккумулирующихся в нем за 4 года, а в насаждении дуба это превышение составляет 1.4 раза, что может свидетельствовать о немного большем, чем четырехлетний срок, периоде формирования горизонта L подстилки в этих экосистемах. В пастбищных и в нативных пустынных экосистемах, наоборот, масса подстилки была в 5–10 раз меньше, чем расчетные значения депонированного органического вещества. Такое несоответствие вызвано рядом причин. Во-первых, в пустынных растительных ассоциациях и на пастбищах из-за разреженности растительности органические остатки значительно лучше освещены, чем образцы, расположенные в сетках, где верхний слой затеняет нижележащие слои, и чем подстилка в степной растительной ассоциации с густой растительностью. Процесс разложения в пастбищных и в пустынных нативных сообществах ускоряется за счет абиотического разложения остатков под действием света. Известно, что выход CO2 через фотодеградацию может составлять от 1 до 4 г С/м2 в сутки в засушливых экосистемах [25], а скорость продукции СО2 зависит от площади поверхности образцов [20]. В пастбищных экосистемах, очевидно, более быстрому разложению подстилки способствовало механическое размельчение остатков копытами животных.
Таким образом, в пустынных и пастбищных экосистемах скорость разложения слоя L подстилки в большей степени определяется не составом растительных остатков, но другими факторами.
Депонирование C, N, P и K на поверхности почвы. Опираясь на данные по поступлению растительного опада и фекалий и по депонированию C, N, P и K на поверхности почвы при разложении растений-доминантов, мы рассчитали приблизительное количество исследуемых элементов, накапливающихся за 4 года на поверхности почвы в разных экосистемах (табл. 4). Для пастбищных экосистем учитывали изъятие растительного материала копытными и поступление фекалий.
Таблица 4.
Запасы основных биофильных элементов в разных горизонтах подстилок в нативных и антропогенных экосистемах
| Экосистемы | Растительная ассоциация | Запасы элементов в подстилках, г/м2 | |||
|---|---|---|---|---|---|
| C | N | P | K | ||
| Нативные | Степная | L: 176 ± 39 F-H: 122 ± 45 |
L: 6.8 ± 1.7 F-H: 9.9 ± 2.9 |
L: 0.36 ± 0.07 F-H: 0.72 ± 0.22 |
L: 2.30 ± 0.82 F-H: 2.75 ± 0.81 |
| Пустынная | L: 8 ± 8 | L: 0.4 ± 0.4 | L: 0.19 ± 0.19 | L: 0.86 ± 0.82 | |
| Антропогенные | Насаждения дуба | L: 284 ± 140
F: 488 ± 47 H: 805 ± 44 |
L:9.8 ± 4.7 F: 44.5 ± 5.2 H: 76.5 ± 10.2 |
L: 0.61 ± 0.42 F: 1.95 ± 0.25 H: 2.96 ± 0.33 |
L: 2.15 ± 1.19 F: 9.87 ± 3.47 H: 28.53 ± 4.00 |
| Пастбищная степная | L: 19 ± 8 | L: 0.9 ± 0.5 | L: 0.44 ± 0.21 | L: 2.51 ± 1.07 | |
| Пастбищная пустынная | L: 6 ± 5 | L: 0.3 ± 0.3 | L: 0.14 ± 0.13 | L: 0.51 ± 0.47 | |
Оказалось, что запасы С и N в слое L в степной подстилке и в подстилке дубового насаждения были близки к рассчитанным нами величинам запасов этих элементов, аккумулирующихся за 4 года на поверхности почвы. В пустынных ассоциациях имеющиеся в подстилке запасы С и N на порядок меньше, чем расчетные данные, а в пастбищных экосистемах – в 5–10 раз меньше, что соответствует тенденциям в накоплении органических остатков в этих фитоценозах. Накопление K в подстилках имело другие особенности: соотношение запасов этого элемента в слое L подстилок и расчетных данных по его депонированию в подстилках за 4 года изменялось от 3 до 5 (то есть существенно превышало единицу) во всех экосистемах, кроме насаждения дуба. На наш взгляд, выявленные большие запасы K в слое L подстилок степных и пустынных растительных ассоциаций объясняются накоплением пыли. Известно, что исследуемые почвы богаты иллитами –содержащими К глинистыми минералами [17]. Содержание валового К в верхних горизонтах исследуемых почв в несколько раз больше, чем в растениях (около 3%) [7], поэтому аккумуляция пыли приводит к обогащению степных и пустынных подстилок K. В насаждении дуба перемещение пыли ветром менее выраженно, поэтому столь заметной аккумуляции К не происходит. Содержание С и N в растительных тканях больше, чем в минеральной части почвы. Так, содержание С изменяется от менее чем 1% в солонцах до 3.5–4% в лугово-каштановых почвах, а N – от 0.1–0.2% – в солонцах до 0.8% – в лугово-каштановых почвах [33]. Таким образом, перемещение и накопление пыли в степных и пустынных ассоциациях, напротив, приводит к относительному уменьшению концентрации этих элементов в подстилках.
Концентрация валового Р в почве (0.15–0.19%) [7] больше или равна концентрации этого элемента в органических остатках. Процессы накопления пыли и органического вещества по-разному накладываются друг на друга, что приводит к большому разбросу данных по соотношению запасов Р в подстилке и рассчитанной массы Р, сохраняющейся после четырех лет компостирования в разных растительных сообществах: близкие к 1 значения были характерны для пустынных нативных и пастбищных экосистем, а меньше 1 – в насаждении дуба и в подстилке степного фитоценоза. Таким образом, накопление K и Р в подстилках степных и пустынных фитоценозов не определяются скоростью их биологического круговорота.
Скорость биологического круговорота С и N в подстилках характеризуется соотношением запасов элементов в подстилках и их массы, ежегодно поступающей с растительными остатками и фекалиями. Мы подсчитали (табл. 4), что в подстилках степных фитоценозов запасы С в 2.3 раза, а N в 7.6 раз больше, чем ежегодное поступление элементов. В пустынных нативных и пастбищных фитоценозах соотношение массы запасов и поступления С и N составляют 0.2 и 0.3 соответственно, в степных пастбищных фитоценозах – 0.2 и 0.6, а в насаждении дуба – 14 и 54. Таким образом, скорость круговорота этих элементов в подстилке насаждения дуба замедляется в 6–7 раз относительно степных фитоценозов, а в пастбищных степных экосистемах ускоряется в 10 раз. В пустынных нативных и пастбищных экосистемах скорость круговорота С и N почти одинакова, при этом скорость круговорота С не менее чем в 10 раз, а N в 20 раз больше, чем в степных нативных экосистемах.
ВЫВОДЫ
1. С растительными остатками на поверхность почвы в степных растительных ассоциациях поступает приблизительно в 3 раза больше С, в 2 раза больше N и в 4 раза больше K и Р, чем в пустынных. В насаждении дуба черешчатого поступление биофильных элементов близко к таковому в степных растительных ассоциациях. Интенсивная пастьба домашних животных, изымающая из круговорота около 40% фитомассы, приводит к невосполнимым потерям элементов на пастбищах: с поступлением фекалий домашних животных возвращается менее 10% от изъятого количества C и Р, 10–17% – N и от 30 до 60% – K.
2. При компостировании образцов основных видов растений и помета овец было выяснено, что скорость потери массы в процессе разложения в значительной степени определялась видом органического субстрата. Значения констант разложения растений-доминантов пустынных фитоценозов были почти в 2 раза меньше, а опада дуба – в 4.5 раза меньше, чем у растений-доминантов степных ассоциаций.
3. В подстилке насаждения дуба скорость круговорота С и N, рассчитанная как отношение запаса к массе поступления, оказалась в 6–7 раз медленнее, чем в степном растительном сообществе. Скорость круговорота С и N в подстилках нативной пустынной ассоциации и в пастбищных экосистемах была в 10 и более раз выше, чем на заповедном степном участке, что связано, видимо, с усилением физико-химического разложения растительных остатков под действием света, а в пастбищных экосистемах и с механическим измельчением растительных остатков копытами животных.
4. Аккумуляция K и Р в подстилках степных и пустынных фитоценозов связана с накоплением пыли.
5. Запасы С и N в подстилке степных фитоценозов более чем в 30 раз превышают запасы в подстилках пустынных растительных ассоциаций, запасы K и Р – в 6 раз; при этом период формирования слоя L степных подстилок составляет более 4 лет, а пустынных – менее года.
6. В подстилках нативных степных ассоциаций накапливается в 16–19 раз больше С и N и в 2–2.5 раза больше K и Р, чем в пастбищных. В нативных пустынных растительных сообществах аккумулируется в 1.5 раз больше C, N, P и K, чем в пастбищных. В подстилке дубового насаждения запасы всех биофильных элементов в 5–8 раз выше, чем в степной подстилке.
Список литературы
Абатуров Б.Д. Пастбищный тип функционирования степных и пустынных экосистем // Успехи современной биологии. 2006. Т. 126. № 5. С. 435–448.
Абатуров Б.Д., Дмитриев И.А., Жаргалсайхан Л., Омаров К.З. Утилизация фитомассы и отложение экскрементов копытными млекопитающими на степных пастбищах Восточной Монголии // Известия Российской академии наук. Сер. биологическая. 2008. № 3. С. 350–359.
Абатуров Б.Д., Кулакова Н.Ю. Роль выпаса животных и степных палов в круговороте азота и зольных элементов в степных пастбищных экосистемах // Аридные экосистемы. 2010. Т. 16. № 42. С. 54–64.
Базилевич Н.И., Титлянова А.А. Биологический круговорот на пяти континентах: азот и зольные элементы в природных наземных экосистемах. Новосибирск: Изд-во СО РАН, 2008. 381 с.
Всеволодова-Перель Т.С., Сиземская М.Л., Колесников А.В. Изменение видового состава и трофической структуры почвенного населения при создании искусственных лесных насаждений в полупустыне Прикаспия // Поволжский экологический журн. 2010. № 2. С. 142–150.
Всеволодова-Перель Т.С., Сиземская М.Л. Лесная подстилка и роль почвообитающих беспозвоночных в ее формировании в условиях глинистой полупустыни Северного Прикаспия // Почвоведение. 2005. № 7. С. 864–870.
Кулакова Н.Ю. Влияние искусственных лесных экосистем на состояние основных элементов питания в почвах глинистой полупустыни Северного Прикаспия: на примере Джаныбекского стационара. Автореф. дис. …. канд. биол. наук. М., 2008. 24 с.
Кулакова Н.Ю., Абатуров Б.Д., Нухимовская Ю.Д. Элементы круговорота С и N в природных и антропогенных экосистемах полупустыни Северного Прикаспия // Аридные экосистемы. 2017. Т. 23. № 1(70). С. 17–25.
Кулакова Н.Ю., Соколова Т.А. Влияние лесных культур на состояние калия и фосфора в черноземовидных почвах больших падин полупустынной зоны Северного Прикаспия // Вестник Моск. ун-та. Сер. 17: Почвоведение. 2003. № 3. С. 14–21.
Лобова С.Л., Каплина Н.Ф. Фитомасса и поверхность листьев и их повреждение насекомыми-филлофагами в дубравах Теллермановского леса // Леса Евразии. Мат-лы XII Междунар. конф. молодых ученых, посвященной 145-летию со дня рождения профессора Г.Ф. Морозова. М.: ФГБОУ ВПО МГУЛ, 2012. С. 279–282.
Линдеман Г.В., Абатуров Б.Д., Быков А.В., Лопушков В.А., Магомедов М.Р. Динамика населения позвоночных животных Заволжской полупустыни. M.: Наука, 2005. 252 с.
Попова Н.В. Методы использования данных по скорости освобождения химических элементов из подстилки для диагностики устойчивости экосистем // Вестник Российского ун-та дружбы народов. Сер. Экология и безопасность жизнедеятельности. 2007. № 1. С. 19–26.
Роде А.А., Польский М.Н. Почвы Джаныбекского стационара, их морфологическое строение, механический и химический состав и физические свойства // Тр. Почв. ин-та им. В.В. Докучаева. 1961. Т. 56. С. 3–214.
Родин Л.Е., Базилевич Н.И. Динамика органического вещества и биологический круговорот зольных элементов и азотв в основных типах растительности Земного шара. М.: Наука, 1965. 264 с.
Сапанов М.К. Экология лесных насаждений в аридных регионах. Тула: Гриф и К, 2003. 248 с.
Сапанов М.К., Сиземская М.Л. Изменение климата и динамика целинной растительности в Северном Прикаспии // Поволжский экологический журн. 2015. № 3. С. 307–320.
Талызина И.В., Соколова Т.А., Кулакова Н.Ю., Сапанов М.К. Химико-минералогическая характеристика и некоторые показатели калийного состояния черноземовидной почвы и лиманной солоди // Почвоведение. 1994. № 9. С. 61–67.
Телеснина В.М., Семенюк О.В., Богатырев Л.Г. Свойства лесных подстилок во взаимосвязи с напочвенным покровом в лесных экосистемах Подмосковья (на примере УОПЭЦ “Чашниково”) // Вестник Моск. ун-та. Сер. 17. Почвоведение. 2017. № 4. С. 11–20.
Aerts R. Climate, leaf litter chemistry and leaf litter decomposition in terrestrial ecosystems // Oikos. 1997. V. 79. P. 439–449.
Austin A.T., Vivanco L. Plant litter decomposition in a semi-arid ecosystem controlled by photodegradation // Nature. 2006. V. 442. № 7102. P. 555–558. https://doi.org/10.1038/nature05038
Berg B. Decomposition patterns for foliar litter: A theory for influencing factors // Soil Biol Biochem. 2014. V. 78. P. 222–232. https://doi.org/10.1016/j.soilbio.2014.08.005
Berg B., McClaugherty C. Decomposition, humus formation, carbon sequestration // Plant Litter. 2008. Springer: Berlin Heidelberg. 264 p.
Blair J.M. Nitrogen, sulfur and phosphorus dynamics in decomposing deciduous leaf litter in the southern Appalachians // Soil Biol. Biochem. 1988. V. 20. № 5. P. 693–701.
Bonanomi G., Cesarano G., Gaglione S.A., Ippolito F., Sarker T., Rao M.A. Soil fertility promotes decomposition rate of nutrient poor, but not nutrient rich litter through nitrogen transfer // Plant Soil. 2017. V. 412. № 12. P. 397–411. https://doi.org/10.1007/s11104-016-3072-1
Brandt L.A., Bohnet C., King J.Y. Photochemically induced carbon dioxide production as a mechanism for carbon loss from plant litter in arid ecosystems // J. Geophys. Res.: Biogeosci. 2009. V. 114. № G2. P. 1–13. https://doi.org/10.1029/2008JG000772
Brandt L.A., King J.Y., Milchunas D.G. Effects of ultraviolet radiation on litter decomposition depend on precipitation and litter chemistry in a shortgrass steppe ecosystem // Glob. Chang. Biol. 2007. V. 3. P. 2193–2205. https://doi.org/10.1111/j.1365-2486.2007.01428.x
Day T.A., Zhang E.T., Ruhland C.T. Exposure to solar UV-B radiation accelerates mass and lignin loss of Larrea tridentata litter in the Sonoran Desert // Plant Ecol. 2007. V. 193. P. 185–194. https://doi.org/10.1007/s11258-006-9257-6
Gliksman D., Haenel S., Osem Y., Yakir D., Zangy E., Preisler Y., Grünzweig J.M. Litter decomposition in Mediterranean pine forests is enhanced by reduced canopy cover // Plant Soil. 2018. V. 422. № 1–2. P. 317–329. https://doi.org/10.1007/s11104-017-3366-y
Hodge A., Fitter A.H. Substantial nitrogen acquisition by arbuscular mycorrhizal fungi from organic material has implications for N cycling // Proceedings of the National Academy of Sciences of the United States of America. 2010. V. 107. № 31. P. 13754–13759. https://doi.org/10.1073/pnas.1005874107
Huang G., Zhao H.M., Li Y. Litter decomposition in hyper-arid deserts: Photodegradation is still important // Sci. Total Environ. 2017. V. 601. P. 784–792. https://doi.org/10.1016/j.scitotenv.2017.05.213
Hui D., Jackson R.B. Assessing interactive responses in litter decomposition in mixed species litter // Plant Soil. 2009. V. 314. № 1–2. P. 263–271. https://doi.org/10.1007/s11104-008-9726-x
IUSS Working Group WRB. World Reference Base for Soil Resources 2014: International soil classification system for naming soils and creating legends for soilmaps. World Soil Resources Reports No 106. FAO, Rome, 2014. 181 p.
Kulakova N. Impact of plant species on the formation of carbon and nitrogen stock in soils under semi-desert conditions // Eur. J. For. Res. 2012. V. 131. № 6. P. 1717–1726.https://doi.org/10.1007/s10342-012-0613-x
Lin G., Zeng D.H. Functional identity rather than functional diversity or species richness controls litter mixture decomposition in a subtropical forest // Plant Soil. 2018. V. 428. № 1–2. P. 179–193. https://doi.org/10.1007/s11104-018-3669-7
Osono T., Takeda H. Potassium, calcium, and magnesium dynamics during litter decomposition in a cool temperate forest // J. For. Res. 2004. V. 9. № 1. P. 23–31. https://doi.org/10.2307/1932179
Дополнительные материалы отсутствуют.


