Почвоведение, 2020, № 11, стр. 1316-1327
Аккумуляция полиаренов в растениях бугристых торфяников побережья Баренцева моря
Е. В. Яковлева a, *, Д. Н. Габов a, А. Н. Панюков a
a Институт биологии Федерального исследовательского центра Коми научного центра Уральского отделения Российской академии наук
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: kaleeva@ib.komisc.ru
Поступила в редакцию 03.03.2020
После доработки 20.04.2020
Принята к публикации 24.04.2020
Аннотация
Проведены исследования накопления полициклических ароматических углеводородов в растениях и торфяниках тундровых болот побережья Баренцева моря Ненецкого автономного округа. Установлено, что в растениях тундровых болот значительно преобладали 2–3-ядерные полиарены, их доля в общей сумме ПАУ варьировала в пределах 81–97%. Наибольшим общим содержанием полиаренов отличались Sphagnum lindbergii Shimp., Cárex aquátilis Wahlenb. и Eriophorum russeolum Fr. Показано, что качественный и количественный состав ПАУ растений тундровой и лесотундровой зоны идентичен, что позволяет экстраполировать данные по составу ПАУ болотных растений на другие торфяники фоновых территорий. Выявлена тесная корреляция состава ПАУ верхних слоев торфяной залежи и растений, доминирующих в ботаническом составе торфа. Обнаружено уменьшение коэффициентов корреляции с глубиной, что обусловлено повышением степени разложения торфа. В торфе мочажин и бугров болот северной тундры не выявлено пика накопления тяжелых ПАУ в сезонно-талом слое и слоях многолетней мерзлоты, что определяет уменьшение общей массовой доли полиаренов на порядок по сравнению с торфяниками лесотундровой зоны. Вероятно, это связано с замедленным разложением лигнина в условиях тундры.
ВВЕДЕНИЕ
Принято считать, что торф состоит из легкоразлагаемых соединений, например, полисахаридов и относительно устойчивых веществ, таких как лигнин и сложных ароматических соединений, а также продуктов их взаимной трансформации и комбинации, таких как гумусовые вещества. Торф формируется в результате процессов накопления и распада, действующих на растительные остатки. После отмирания растительность начинает распадаться аэробно; по мере накопления торфяной толщи аэробные условия сменяются анаэробными [17]. Химический состав торфа является результатом комбинации химического состава тканей болотных растений и микроорганизмов, почвенных вод и вторичных веществ, образующихся при его разложении.
В значительных количествах в составе торфа присутствуют полициклические ароматические углеводороды (ПАУ) – органические соединения бензольного ряда, которые могут иметь как природное, так и антропогенное происхождение. Они являются суперэкотоксикантами [18, 19, 21, 23] с одной стороны и необходимыми органическими компонентами для растений с другой.
Высокая химическая устойчивость ПАУ в сочетании с кислой и анаэробной средой торфяной залежи препятствует их деградации [12]. Показано, что с увеличением длительности пребывания ПАУ в почвах их экстракционная способность, разлагаемость и токсичность уменьшаются [24, 29].
Выявлено, что различные фракции почвенного органического вещества могут обладать различными способностями связывания с ПАУ. Связи между гуминами и ПАУ были более прочными для низкомолекулярных (с двумя и тремя кольцами) ПАУ (r = 0.77, р < 0.05), чем для высокомолекулярных (≥ четырех колец) ПАУ (r = 0.68, р < 0.05). Фракции фульвокислот и гуминовых кислот не демонстрировали значимой связи с углеводородами. Более сильные связи между гуминами и низкомолекулярными ПАУ, по мнению авторов, напрямую связаны с их более высокой подвижностью и более легкой диффузией в стабильные фракции почвенного органического вещества [26]. Сходные данные получили китайские исследователи. Ими было изучено содержание ПАУ в шестнадцати гуминовых кислотах и фракции гумина, выделенных из торфяной почвы. Полученные данные показали, что гумин является основным поглотителем ПАУ в почве благодаря своему химическому составу, богатому алифатическим углеродом, и высококонденсированной физической структуре его углеродных доменов. Авторы связывают с этим фактом устойчивость и слабую биоразлагаемость ПАУ в торфяниках [20].
На основании корреляционного и дисперсионного анализов была показана достоверная взаимосвязь между степенью ароматичности фульво- и гуминовых кислот и содержанием тяжелых полиаренов в разных слоях торфа [4].
Низкая водорастворимость полиаренов также увеличивает их сорбцию почвенными частицами и ограничивает доступность для микробиологического разложения [12].
Как показали недавние исследования, видовой состав растений болот оказывает влияние на состав ПАУ торфяников в большей степени, чем микробное разложение. Был исследован состав ПАУ торфяников омбротрофного болота в Китае с доминированием в растительном покрове видов рода Sphagnum и Ledum. Содержание полиаренов в исходных растениях было примерно одинаковым и варьировало в пределах погрешности, что определяло, по мнению авторов, их схожесть в способности к накоплению ПАУ. При этом торф, образованный исследованными растениями, характеризовался разным органическим составом. На глубине 5–30 см торфяной залежи содержание полиаренов в торфе, сформированном сфагнумом было больше, чем в багульниковом. Это объясняется более высокой скоростью разложения Ledum по сравнению со Sphagnum [28]. Ранее авторами было показано, что при разложении Sphagnum в лабораторных условиях, содержание ПАУ в нем уменьшалось на 50% через 120 дней [27]. Известно, что наиболее устойчивы к разложению сфагновые мхи, затем следуют кустарнички, наименее устойчивы травянистые растения [5].
Цель работы – изучить особенности накопления полиаренов в растениях и торфяных отложениях тундровых болот побережья Баренцева моря, в сравнении с болотами лесотундровой подзоны.
ОБЪЕКТЫ И МЕТОДЫ
Исследования проведены в северной тундре на побережье Баренцева моря (Ненецкий АО) в пределах плоско-бугристо-мочажинного комплекса на сухоторфяных мерзлотных почвах бугров и в болотной верховой почве мочажин. Район исследования – территория между реками Муровая и Алексеевка.
Участок располагается на выровненной поверхности прибрежной равнины, которая характеризуется обширными депрессиями и, соответственно, вследствие слабого дренажа практически вся занята плоскобугристыми болотными комплексами, перемежающимися с сетью малых рек, ручьев и озерной мозаикой.
Характеристика растительного покрова. В районе исследований в соответствии с ботанико-географическим районированием Арктики и Субарктики входит в Восточноевропейскую подпровинцию Восточноевропейско-Западносибирской провинции субарктических тундр Циркумполярной тундровой области. По широтной зональности район находится в пределах средней полосы субарктических [7] или северных гипоарктических тундр. В южной части этой полосы к ней примыкают южные – кустарниковые или южные субарктические тундры. Эта территория в ботаническом отношении является малоизученной из-за ее труднодоступности. Здесь проводили преимущественно прикладные исследования флоры и растительности в связи с разработкой месторождений полезных ископаемых [9].
Для плакоров полосы северных (типичных) тундр данного района характерны травянисто-моховые, кустарничково-моховые, кустарничково-лишайниковые сообщества, образующими разные пространственные комбинации. Встречаются мелкоивняковые и мелкоерниковые моховые тундры. Вetula nana L. почти всегда принимает постоянное и значительное участие в сложении зональных сообществ, при этом часто имеет стелющуюся форму роста. В растительном покрове велика роль гипоарктических кустарничков и ив Salix lapponum L. Ярусная структура сообществ выражена нечетко. Из болот наиболее распространены плоскобугристые.
Растительность болотных комплексов по внешности довольно однообразна. Гряды заняты преимущественно кустарничково-лишайниковыми сообществами. Общее проективное покрытие яруса кустарничков – 50%, высота 10–15 см, как правило, не выше расположенных рядом бугорков. Доминантом на грядах является Ledum decumbens (Aiton) Lodd. ex Steud. Часто встречаются Rubus chamaemorus L., Andromeda polifolia L., Empetrum hermaphroditum Hagerup., Eriophorum scheuchzeri Hoppe. Остальная травяно-кустарничковая растительность представлена единичными экземплярами Vaccinium vitis-idaea L., V. uliginosum L. Из кустарников почти всегда присутствует Betula nana L. Моховой покров практически отсутствует, а в напочвенном покрове господствуют лишайники Alectoria nigricans (Асh.) Nyl., Flavocetraria nivalis (L.) Kärnefelt et A. Thell, Cladonia arbuscula (Wallr.) Flot., C. coccifera (L.) Willd., C. gracilis (L.) Willd., C. crispate (Ach.) Flot. и др.
Растительность мочажин резко отличается от растительности гряд. Здесь развит практически сплошной (ПП 90–95%) покров сфагновых мхов, иногда с примесью представителей родов Calliergon, Drepanocladus. Нередко встречаются пятна черно-бурого цвета с деградированным моховым покровом, занятые водорослевыми корками и единичными экземплярами пушиц и осок. Травяный ярус в целом разрежен, его проективная поверхность не превышает 20%. Фон составляет Eriophorum scheuchzeri, Eriophorum russeolum, Cárex aquátilis единично отмечены мелкие арктические осоки (Carex rariflora (Wahlenb.) Sm., C. rotundata Wahlenb.).
Названия почв даны согласно Классификации и диагностике почв СССР 1977 г., легенда к листу Q-41 “Воркута”.
Тундровая мерзлотная остаточно-торфяная почва бугров (Hemic Folic Cryic Histosol) [8]. Координаты: 68°35′ с. ш., 55°55′ в. д. Центр гряды плоскобугристого болота. Форма бугра сложная, многоугольная, вытянутая с севера на юг. Форма бугров различна: от вытянутых овальных до многоугольных, ограниченных по бортам озерково-мочажинными депрессиями. На бугре присутствуют морозобойные трещины, пересекающие гряды поперек и криогенные оголенные пятна без растительного покрова d = 0.3–0.7 м. Поверхность бугра характеризуется хорошо выраженным микрорельефом, в значительной степени, обусловленным мерзлотными процессами. Рельеф бугров мелко- и среднебугорковатый. Диаметр бугорков от 50 до 100 см. Диаметр гряды в месте отбора около 8 м, высота 0.5–0.7 м, расстояние от мочажины 0.5–1.0 м. Расстояние от озера (d = 250 м) 40–42 м. Растительность: лишайники, бриевые мхи, багульник, морошка, подбел, водяника, брусника. Многолетняя мерзлота на глубине 29–30 см. Формула профиля почвы TO(0–60 см)–TT (80–133 см)–TE (133–150)–G (151–190 см).
Болотная верховая торфяная мерзлотная почва мочажин (Fibric Floatic Cryic Histosol). Координаты: 68°35′ с. ш., 55°55′ в. д. Понижение рельефа, мочажина. Многолетняя мерзлота залегает на глубине 38–40 см, с глубины 60–70 см минеральные включения. Формула профиля почвы TO (0–70 см)–G(70–100 см).
Исследованы виды растений разных групп доминирующие в растительном покрове болот и ботаническом составе торфа: лишайники – Flavocetraria nivalis и Alectoria nigricans, мхи – Sphagnum lindbergii, травянистые растения – Cárex aquátilis, Eriophorum russeolum, Ledum decumbens, кустарничек – Rubus chamaemorus и кустарники – Betula nana, Salix lapponum.
Отбор и пробоподготовка проб торфа проведены согласно ГОСТ 17644-83 и ГОСТ 11306-2013. До границы многолетней мерзлоты послойный отбор проб произведен через каждые 10 см, далее каждые 10–20 см.
Образцы почв и растений высушивали при комнатной температуре, измельчали и проводили химический анализ на содержание полиаренов. Химико-аналитические исследования почв и растений выполняли в ЦКП “Хроматография” Института биологии Коми НЦ УрО РАН. Для извлечения ПАУ из почв и растений использовали систему ускоренной экстракции растворителями ASE-350 (Dionex Corporation, США). Пробу почвы или растения массой 1 г помещали в экстракционную ячейку и трижды экстрагировали смесью хлористый метилен : ацетон (1 : 1) при температуре 100°С. Затем экстракты концентрировали с применением аппарата Кудерна-Даниша при температуре в термостате 70°С и заменяли растворитель на гексан. Полученный концентрат пробы объемом 3 см3, очищали от неорганических примесей методом колоночной хроматографии, с использованием оксида алюминия II степени активности по Брокману. В качестве элюэнта использовали 50 см3 смеси гексан:хлористый метилен (4 : 1). Элюат концентрировали с применением аппарата Кудерна–Даниша при температуре в термостате 85°С, до объема 5 см3, затем добавляли 3 см3 ацетонитрила и упаривали при температуре 90°С до полного удаления гексана. Концентрат пробы в ацетонитриле анализировали на содержание ПАУ методом ВЭЖХ [14]. Контроль точности результатов измерений проводили с использованием стандартного образца Certified reference material BCR-683 (European commission community bureau of reference) для растений и Standard Reference Material 1944 “New York/New Jersey Waterway Sediment” (National Institute of Standards & Technology, USA) для почв.Статистическая обработка результатов проведена с использованием программного пакета Statistica 6.1.
Анализ ботанического состава и степени разложения торфа выполнены в лаборатории болотных экосистем Института биологии Кар НЦ РАН.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
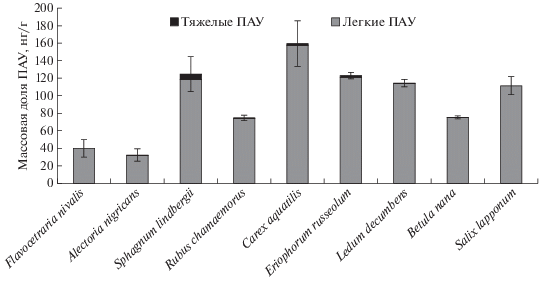
В растениях напочвенного покрова бугристых торфяников побережья Баренцева моря выявлено присутствие 11-ти структур ПАУ: нафталин, флуорен, фенантрен, антрацен, флуорантен, пирен, хризен, бенз[a]антрацен, бензо[b]флуорантен, бензо[k]флуорантен, бенз[a]пирен. Массовая доля тяжелых ПАУ в растениях составляла 0–5%. Значительно преобладали 2–3-ядерные полиарены их доля в общей сумме ПАУ варьировала в пределах 81–97%. Сходные данные были получены китайскими учеными при исследовании состава ПАУ Sphagnum и Ledum омбротрофного болота [28].
Наибольшим содержанием тяжелых структур среди растений тундровых болот отличались Sphagnum lindbergii, накапливающий полиарены из окружающей среды всей поверхностью и травянистые растения: Cárex aquátilis и Eriophorum russeolum, для которых возможен корневой путь поступления ПАУ (рис. 1). Для растений лесотундровых болот данные идентичны [15]. В осоке и пушице болот лесотундры также были обнаружены наибольшие содержания тяжелых ПАУ по сравнению с другими растениями. Китайскими учеными были выявлены обратные закономерности [28] доля тяжелых 5–6 ядерных ПАУ была выше в Ledum относительно Sphagnum и составила 40% против 20%, тогда как в нашем случае это 0.5% против 1.9%. Присутствие полиаренов в растениях тундровых болот могло быть обусловлено рядом факторов: внутриклеточным синтезом в растениях, поглощением ПАУ растениями из почвы и поступлением полиаренов из атмосферы в процессе дальнего переноса воздушных масс в условиях безлесной тундры. Вероятно, соотношение источников накопления ПАУ в тундровых болотах и болотах Китая определяло различия в составе полиаренов растений одного рода. Польские исследователи при анализе торфяников восточной Польши, Ledum palustre и хвои сосны не выявили в исследуемых объектах присутствия тяжелых полиаренов и констатировали, что отсутствие 5- и 6-кольцевых ПАУ в растительном и почвенном материале указывало на отсутствие каких-либо прямых источников выбросов этих соединений [22].
Видовой состав растений плоскобугристого болота побережья Баренцева моря частично совпадал с видовым составом ранее изученного нами болота в лесотундровой подзоне (табл. 1). Следует отметить, что содержание полиаренов во мхах (Sphagnum lindbergii в тундре и Sphagnum riparium в лесотундре) и травянистых растениях (Cárex aquátilis и Eriophorum russeolum) тундровых и лесотундровых торфяников примерно одинаково. Для кустарников ивы и карликовой березки наблюдали повышенное содержание нафталина в условиях лесотундры, главным образом в ветвях и корнях до 7–10 раз. Возможно, это связано со значительным поступлением нафталина из почвы в корни кустарников лесотундровой подзоны. Содержание других полиаренов в кустарниках разных зон было близким. Меньшее содержание полиаренов в целом характерно и для торфяников побережья Баренцева моря, если сравнивать их с лесотундровыми торфяниками. Такой факт во многом связан с более низкими среднегодовыми температурами, влияющими на активность почвенных микроорганизмов, продуцирующих полиарены в процессе жизнедеятельности, и самих растений. Результаты инкубационного эксперимента по влиянию температуры (2, 12, 22°C) на скорость разложения растительного опада основных растений-торфообразователей болотных экосистем южно-таежной подзоны Западной Сибири (Sphagnum fuscum, Chamaedaphne calyculata, Eriophorum vaginatum) показали, что при повышении температуры для всех образцов наблюдали значимое увеличение константы разложения [10].
Таблица 1.
Массовая доля ПАУ в растениях тундровой зоны и лесотундровой подзоны, нг/г
| ПАУ | Зона типичных северных тундр | Зона предтундровых редколесий (лесотундра) | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Sphagnum lindbergii | Cárexa-quátilis | Eriophorum russeolum |
Betulanana | Salix lapponum, листья | Salix lapponum, ветви | Sphagnumr iparium | Cárex aquátilis | Eriophorum russeolum |
Betula nana | Salix lapponum, листья | Salix lapponum, ветви | |||||||||||||
| $\bar {X}$ | $S\bar {x}$ | $\bar {X}$ | $S\bar {x}$ | $\bar {X}$ | $S\bar {x}$ | $\bar {X}$ | $S\bar {x}$ | $\bar {X}$ | $S\bar {x}$ | $\bar {X}$ | $S\bar {x}$ | $\bar {X}$ | $S\bar {x}$ | $\bar {X}$ | $S\bar {x}$ | $\bar {X}$ | $S\bar {x}$ | $\bar {X}$ | $S\bar {x}$ | $\bar {X}$ | $S\bar {x}$ | $\bar {X}$ | $S\bar {x}$ | |
| Нафталин | 55 | 9.9 | 59.6 | 4.0 | 63.6 | 6 | 31.7* | 2.2 | 33.9* | 9.5 | 30.8 | 6.7 | 56.9 | 2.6 | 39.5 | 3.3 | 64.7 | 2.1 | 242.7 | 13.5 | 44.2 | 2 | 232.1 | 4.6 |
| Флуорен | 8.4* | 0.2 | 7.5* | 0.5 | 5.8 | 0.5 | 5.2 | 0.4 | 9.7 | 0.4 | 3.9 | 0.3 | 6.8 | 0.3 | 4.7 | 0.1 | 7.9 | 0.5 | 5.6 | 0.1 | 4.6 | 0.2 | 4.3 | 0 |
| Фенантрен | 36.7 | 5.6 | 69.1 | 13.2 | 31.9* | 2.2 | 27.9 | 2 | 52.8 | 5.4 | 18.6 | 3.8 | 55.1 | 7 | 44.9 | 7.5 | 55.4 | 3.4 | 19.4 | 3.5 | 51.8 | 6.6 | 18.2 | 1.2 |
| Антрацен | 1.6 | 0.2 | 1.5 | 0.4 | 1.7 | 0.3 | 1.1 | 0.2 | 1.5 | 0.1 | 0.9* | 0.1 | 0.7 | 0.2 | 2.6 | 2.8 | 1.6 | 0.4 | 1 | 0.5 | 0.5 | 0.1 | 1.9 | 0 |
| Флуорантен | 7.5 | 2.1 | 9.4* | 0.6 | 8.6* | 0.2 | 6.2 | 1 | 7.9 | 2.3 | 5.1 | 1.6 | 6.5 | 1.2 | 6.3 | 0.3 | 14.8 | 0.3 | 4.4 | 0.3 | 13.3 | 2.5 | 7.4 | 0.2 |
| Пирен | 6.3 | 1.3 | 6.8 | 0.2 | 7.1 | 0.3 | 2.8 | 1.7 | 8.6 | 2.4 | 0 | 1.7 | 4.8 | 0.8 | 6 | 1.5 | 10.7 | 1.7 | 2.6 | 3.2 | 11.3 | 1.8 | 4.8 | 0.1 |
| Бенз[а]антрацен | 0.6 | 0.4 | 0.9 | 0.3 | 0.7 | 0.3 | 0 | 0 | 0 | 0 | 0 | 0 | 1.1 | 0.2 | 0.9 | 0.1 | 1.3 | 0.2 | 0.2 | 0.3 | 0.7 | 0.1 | 0 | 0 |
| Хризен | 2.2 | 0.4 | 2.7* | 0.4 | 1.8* | 0.4 | 0.2 | 0.2 | 0 | 0.9 | 1.4 | 0.6 | 2 | 0.3 | 2.1 | 0.5 | 3.3 | 0.3 | 0.5 | 0.7 | 0.7 | 0.1 | 1.7 | 0 |
| Бенз[b]флуорантен | 4.1* | 0.9 | 0.6 | 0.8 | 0 | 0 | 0.3 | 0.4 | 0 | 0 | 0 | 0 | 0 | 0 | 0.9 | 1.1 | 0.7 | 0.8 | 0 | 0 | 0 | 0 | 0 | 0 |
| Бенз[к]флуорантен | 0.9 | 0.2 | 0.6 | 0.1 | 0.7 | 0.1 | 0.1 | 0.1 | 0 | 0 | 0 | 0 | 0.6 | 0 | 0.5 | 0.1 | 0.7 | 0.2 | 0.1 | 0.2 | 0.5 | 0.5 | 0 | 0 |
| Бенз[а]пирен | 1.5 | 0.2 | 0.8* | 0.1 | 1.2 | 0.1 | 0 | 0 | 0 | 0 | 0 | 0 | 0.2 | 0.2 | 0 | 0 | 0.6 | 0.2 | 0.1 | 0.2 | 0 | 0 | 0 | 0 |
| Сумма ПАУ | 124.8 | 20.1 | 159.5 | 16.6 | 122.9* | 3.7 | 75.4* | 1.7 | 114.3* | 14.6 | 60.7 | 10.3 | 134.7 | 7.2 | 108.4 | 5.1 | 161.6 | 8.2 | 276.7 | 21.9 | 127.4 | 6.9 | 270.5 | 18.5 |
| Легкие ПАУ | 118.3 | 15 | 157.5 | 16.2 | 121 | 3.8 | 75 | 1.9 | 114.3 | 14.6 | 60.7 | 10.3 | 134 | 1.7 | 107 | 6.4 | 159.6 | 4.3 | 276.4 | 21.9 | 127 | 6.7 | 270.5 | 18.5 |
| Тяжелые ПАУ | 6.5 | 1.1 | 2.0 | 0.9 | 1.9 | 0.1 | 0.4 | 0.5 | 0 | 0 | 0 | 0 | 0.7 | 0 | 1.4 | 0 | 2 | 0.1 | 0.3 | 0.4 | 0.5 | 0.5 | 0 | 0 |
Кроме того, нафталин, как летучий компонент выбросов различного рода производств, способен перемещаться на дальние расстояния и достигать фоновых участков в лесотундровой зоне при этом, не долетая до побережья. Одним из источников дополнительных количеств нафталина в лесотундре мог быть дальний перенос полиаренов от Воркутинской промышленной агломерации. С другой стороны, присутствие значительных количеств нафталина в почве могло объясняться активными разложением более сложных структур ПАУ до 2-кольчатого нафталина, в процессе интенсивной деятельности микробиоты.
То есть в целом растения фоновых участков тундровых и лесотундровых болот довольно близки по составу полиаренов. Коэффициенты корреляции составляли 0.96–0.99 для мха и травянистых растений, и листьев ивы и березки, для ветвей и корней кустарников 0.67–0.87. Статистически подтверждено, что различия для большинства соединений ПАУ растений одного вида тундровой и лесотундровой зон не значимы. Статистическую обработку для оценки достоверности расхождений средних данных проводили при помощи t-критерия Стьюдента, Р = 0.95. Для проведения статистического анализа использовали программу Statistica-6. Это определяет возможность экстраполировать данные по составу ПАУ исследованных растений на другие фоновые бугристые торфяники, предполагая, что они будут характеризоваться сходным составом и содержанием полиаренов.
Исследование содержания полиаренов торфяных бугров и мочажин позволило идентифицировать 13 структур ПАУ. В почвах по сравнению с растениями выявлено присутствие 5,6-ядерных дибенз[a,h]антрацена, бенз[ghi]перилена. Первоисточником легких полиаренов в торфяниках могли быть растительные материалы, тогда как тяжелые полиарены могли формироваться в процессе почвообразования из сложных органических структур, присутствовавших в растениях, в том числе пентациклических терпенов, ароматических структур, а также структур с диеновыми или полиеновыми связями в алифатических углеводородных цепях, липидах [11, 29].
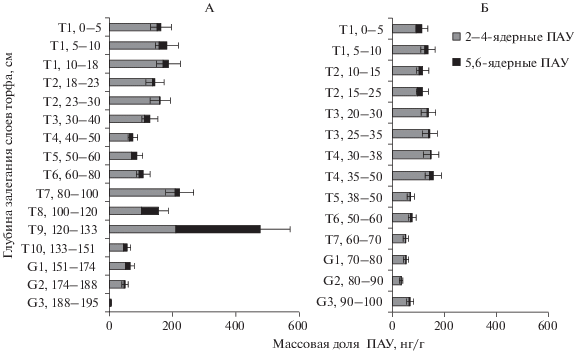
Массовая доля ПАУ в почвах торфяных бугров варьировала в зависимости от глубины почвенного профиля (рис. 2). В слоях 0–23 см и на границе многолетней мерзлоты выявлено близкое содержание полиаренов. При этом на границе многолетней мерзлоты обнаружено минимальное содержание тяжелых ПАУ, в 3–12 раз меньше, чем в верхних слоях в связи с отсутствием бензо[b]флуорантена, бенз[a]пирена и бенз[ghi]перилена. Затем в слоях многолетнемерзлых пород на глубинах 30–80 см суммарная массовая доля ПАУ уменьшалась до 1.5–2 раз. Содержание тяжелых структур было близким к массовой доле полиаренов в верхних слоях. С глубины 80 см начинается возрастание массовой доли ПАУ с пиком на глубине 120–133 см, главным образом за счет высокомолекулярных ПАУ. На глубинах 133–188 см, в минеральных горизонтах, отмечено резкое уменьшение массовой доли полиаренов до 30% от содержания в верхних слоях. Низкое содержание ПАУ является характерной чертой минеральных слоев фоновых почв [2, 3]. В естественных биоценозах отмечается равномерное уменьшение содержания полиаренов с глубиной [6]. На глубине 188–195 см в почвах присутствовали лишь фенантрен и бензо[b]флуорантен в минимальных количествах. В лесотундровых торфяниках выявлены иные закономерности накопления ПАУ, на границе многолетней мерзлоты был обнаружен пик накопления полиаренов, обусловленный значительным количеством бенз[ghi]перилена. Для торфа мерзлотных бугров побережья Баренцева моря такие закономерности не прослеживались. В результате общее содержание ПАУ в почвах бугров и мочажин болотных комплексов побережья Баренцева моря было на порядок меньше, чем в торфяниках лесотунды. Следует отметить, в условиях побережья также были выявлены обратные тенденции в накоплении нафталина и бенз[ghi]перилена в слоях 0–100 см, характерные для всего профиля торфяного бугра лесотундровой зоны. Пик накопления бенз[ghi]перилена в слоях торфа является индикатором активного разложения лигнина травянистых растений. Пик повышения массовой доли нафталина свидетельствует о том, что в данном горизонте идут процессы расщепления тяжелых ПАУ до более легких структур.
В профиле мочажины выявлены сходные изменения с профилем торфяного бугра. Содержание ПАУ в верхних слоях торфа до границы многолетней мерзлоты примерно одинаково. С глубины мерзлотного слоя (38 см) происходит уменьшение общего содержания ПАУ в 2–4 раза по сравнению с верхним слоем. При этом пика накопления полиаренов в слоях вечной мерзлоты выявлено не было.
Результаты радиоуглеродного датирования образцов, проведенного в ЦКП “Лаборатория радиоуглеродного датирования и электронной микроскопии” Института географии РАН показывают, что верхний слой торфа 5–10 см, как бугра 66 кал. л. н. (медиана) (ИГРАН 7174), так и мочажины 119 кал. л. н. (медиана) (ИГРАН 7184) сформировался в последние 100 лет. Содержание полиаренов в данных слоях торфа бугра и мочажины, формирующихся довольно быстро в условиях современного потепления, было близким. Датирование слоев 40–50 см показывает, что в мочажине данные слои сформировались 4275 кал. л. н. (медиана) (ИГРАН 7185), на бугре 5331 кал. л. н. (медиана) (ИГРАН 7177). Формирование в условиях более холодного и сухого суббореального периода, вело к замедлению темпов торфонакопления в процессе изменения климата [1]. В большей степени процесс замедления торфообразования был выражен для торфяного бугра, в меньшей степени для мочажины. При этом процессы торфообразования, по-видимому, были сходными, так как содержание полиаренов в данных слоях примерно одинаково 70 нг/г в торфе мочажин и 74 нг/г в торфе бугра.
Таким образом, следует отметить, что массовая доля ПАУ в слоях торфа бугра и мочажины на одинаковых глубинах довольно близка до глубины 60 см, в более глубоких слоях (60–90 см) содержание полиаренов в мочажинном торфе было в 2–7 раза меньше по сравнению с торфом бугров. Радиоуглеродный возраст данного слоя для торфа бугра соответствует 7379 кал. л. н. (медиана) (ИГРАН 7178), для мочажины данные отсутствуют. Данный период торфонакопления относится к раннему атлантическому периоду AT1, характеризующемуся активным накоплением торфа, которое могло сопровождаться образованием и консервацией полиаренов в процессе формирования торфяного бугра [1].
Торф на глубине 60 см и ниже в мочажине уже представлен минеральными горизонтами, что подтверждается и данными его ботанического состава (табл. 2). Торф мочажин представлен в основном остатками сфагновых мхов (60–95%) разной степени разложения – от 5–10% до 10 см глубины, до 30% в более глубоких слоях. Вклад осок и пушиц в ботанический состав торфа составлял 5–30% и закономерно уменьшался с глубиной. Вклад остальных видов был незначительным. Выявлена тесная значимая корреляция между составом торфа по всей глубине залегания и Sphagnum lindbergii, коэффициенты корреляции составили r = 0.81 (n = 163, p < 0.05, rcr = 0.16). Также высокие коэффициенты выявлены для Eriophorum russeolum присутствующей по всей толще торфяной залежи мочажины. Для Cárex aquátilis были выявлены более низкие, но значимые коэффициенты корреляции r = 0.50 (n = 163, p < 0.05, rcr = 0.16), что объясняется присутствием в ботаническом составе торфа других видов осок, и незначительной долей их вклада в формирование состава торфа, особенно в нижних слоях.
Таблица 2.
Ботанический состав (%) и виды торфа болотной верховой торфяной мерзлотной почвы мочажин
| Горизонт, глубина, см | Тип и вид торфа | Степень разложе-ния, % | Betula | Eriophorum | Carex paupercula | Carex rotundata | Sphagnum angustifolium | Sphagnum balticum | Sphagnum jensenii | Sphagnum lindbergii | Sphagnum russowii | Sphagnum sect. acutifolia | Calliergon | Warnstorfia fluitans | Стебли гипно-вых мхов | Пече-ноч-ники |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Т1, 0–10 | Сфагновый мочажинный, В | 5–10 | 0 | 10 | 5 | 0 | 0 | 40 | 0 | 40 | 0 | 0 | 0 | 5 | 0 | + |
| Т2, 10–20 | Осоково-сфагновый, В | 25–30 | 5 | 5 | 10 | 15 | 0 | 30 | 0 | 30 | 0 | 0 | 0 | 3 | 2 | 0 |
| Т3, 20–30 | Сфагновый, В | 25–30 | 5 | 5 | 5 | 5 | + | 30 | 5 | 35 | 0 | + | 0 | 10 | + | 0 |
| Т4, 30–38 | Сфагновый, В | 30 | + | 5 | 5 | 0 | + | 45 | 0 | 40 | 0 | 0 | 0 | 5 | 0 | 0 |
| Т5, 38–50 | Сфагновый, В | 25–30 | + | 10 | + | 0 | 10 | 30 | 0 | 40 | + | 0 | 5 | 5 | 0 | 0 |
| Т6, 50–60 | Сфагновый, В | 25–30 + + песок | + | 5 | + | + | 10 | 35 | 0 | 40 | 0 | 0 | 5 | 5 | 0 | 0 |
| Т7, 60–70 | Отсут-ствует | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
Ботанический состав торфа бугра несколько отличался, что было обусловлено особенностями условий формирования (табл. 3). Поверхностные горизонты торфа (0–28 см) были представлены в основном пушицами на 55–60% с примесью сфагновых мхов 15–25%. Коэффициенты корреляции состава ПАУ Eriophorum russeolum и слоев торфяника на глубинах 0–28 см составили r = 0.96 (n = 65, p < 0.05, rcr = 0.24). Также высоки они и для Sphagnum lindbergii, r = 0.93 (n = 65, p < 0.05, rcr = 0.24). Данные слои сильно разложены – на 40%, что связано с высокой скоростью разложения пушиц [5]. На глубинах 28–80 см в ботаническом составе начинают преобладать сфагновые мхи (50–95%) с включением пушиц (5–20%). Слой 28–40 см также сильно разложен (35–40%), и представлен в основном стеблями сфагновых мхов, что может быть связано с полным разложением пушиц, которые могли изначально составлять его основу. Коэффициенты корреляции с составом ПАУ соответствующих растений составили r = 0.98 для Sphagnum lindbergii и r = 0.97 для Eriophorum russeolum (n = 13, p < 0.05, rcr = 0.55) соответственно. В слоях 40–80 см степень разложения была небольшой, что связано с медленным разложением сфагновых мхов составляющих их основу. Коэффициенты корреляции для Sphagnum lindbergii и Eriophorum russeolum довольно высоки и значимы и составили r = 0.87 и r = 0.91 (n = 39, p < 0.05, rcr = 0.32) соответственно. На глубине 80–100 см выявлен значительный вклад карликовой березки (45%) в состав торфа, существенный вклад в формирование горизонта вносили сфагновые мхи (30%), осоки и пушицы (25%). Пик накопления ПАУ на глубине 120–133 см в условиях мерзлотного бугра, определяемый ростом содержания высокомолекулярных структур, мог быть обусловлен значительным вкладом в состав данного горизонта хорошо разложенных осок и пушиц (60% ботанического состава). Степень разложения составила 40–45%. Выявлены значимые коэффициенты корреляции состава ПАУ растений и торфа данного слоя, они составили r = 0.75 для Betula nana, r = 0.91 для Eriophorum russeolum, r = 0.84 для Sphagnum lindbergii и r = 0.62 Cárex aquátilis (n = 13, p < 0.05, rcr = 0.55).Следует отметить, что наблюдалось некоторое уменьшение коэффициентов корреляции для растений разных видов с глубиной, что во многом связано с высокой степенью разложения торфа. С дальнейшим продвижением по профилю вклад карликовой березки в состав торфа уменьшался, доля осок и пушиц возрастала до 25–70%, в составе торфа появлялись хвощи (15–45%). Установленные корреляции были низкими r = 0.46 для Eriophorum russeolum, r = 0.37 для Betula nana и r = 0.42 для Sphagnum lindbergii (n = 52, p < 0.05, rcr = 0.27). Для осок – не значимыми: r = 0.25 Cárex aquátilis. В более глубоких слоях торф сильно разложен и минерализован. Сходные закономерности были получены для торфяников лесотундровой зоны, наблюдалось уменьшение коэффициентов корреляции с глубиной, что во многом было обусловлено увеличением степени разложения торфа, как и в рассматриваемом случае.
Таблица 3.
Ботанический состав (%), тип и вид торфа тундровой мерзлотной остаточно-торфяной почвы бугров
| Горизонт, глубина, см | Тип и вид торфа | Степень разложения, % | Betula | Salix | Empetrum + Vaccinium | Eriophorum | Carex aquatilis | Carex rostrata | Carex rotundata | Trichophorum | Calamagrostis | Equisetum | Sphagnum angustifolium | Sphagnum balticum | Sphagnum lindbergii | Sphagnum russowii | Sphagnum sect. acutifolia | Sphagnum sect. cuspidata | Стебли сфагнов | Aulacomnium | Dicranum | Pohlia | Warnstorfia | Стебли гипновых мхов | Печеночники |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Т1, 0–10 |
Кустарничково-пушицевый, В | 40 | 0 | 0 | 30 | 60 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 10 | 0 | 0 | 0 | 0 | 0 | 0 |
| Т1, 10–18 | |||||||||||||||||||||||||
| Т2, 18–28 | Пушицевый, В | 40 очень разложен | 0 | 0 | 5 | 55 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 25 (sect. Cusp) | 0 | 0 | + | 15 | + | |
| Т3, 28–40 | Пушицево-сфагновый, П нет |
35–40 очень разложен отсутствует |
5 | 0 | + | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 50 | 0 | 0 | 10 | 5 | 10 | 0 |
| 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |||
| Т4, 40–50 | Сфагновый мочажинный, В | 15 | 0 | 0 | 0 | 5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 55 | 40 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Т5, 50–60 | Сфагновый, В | 15–20 | 5 | 0 | + | 10 | 0 | 0 | 0 | 0 | 0 | 0 | 40 | 10 | + | 30 | 0 | 0 | 0 | + | 5 | + | 0 | 0 | |
| Т6, 60–80 | Кустарниково-сфагновый, П | 30–35 | 45 | 0 | 0 | 20 | + | 0 | 5 | + | 0 | 0 | 20 | + | + | 10 | 0 | 0 | 0 | 0 | 0 | 0 | + | 0 | 0 |
| Т7, 80–100 | Кустарниково-осоково-хвощовый, П | 35–40 + + песок | 20 | 0 | 0 | 15 | 5 | 0 | 25 | + | 0 | 30 | 5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | + | 0 | 0 |
| Т8, 100–120 | Осоковый, П | 35 | 5 | 0 | 0 | 20 | 35 | 0 | 15 | 0 | 5 | 20 | 0 | 0 | 0 | 0 | 0 | + | + | 0 | 0 | 0 | + | 0 | 0 |
| Т9, 120–133 | Осоковый, П | 40–45 | 10 | 0 | 0 | 10 | 30 | 0 | 20 | 0 | 0 | 15 | 5 | 0 | 0 | 10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Т10, 133–151 | Хвощовый, Н | 45 + тина, песок | 10 | 0 | 0 | 5 | 5 | 0 | 15 | 0 | 0 | 45 | 5 | 0 | 0 | 15 | 0 | 0 | 0 | 0 | 0 | 0 | + | 0 | 0 |
| + | |||||||||||||||||||||||||
| >50 + тина, песок | + | + | 0 | + | 0 | + | 0 | 0 | 0 | + | + | 0 | 0 | 0 | + | 0 | 0 | 0 | 0 | 0 | + | 0 | 0 | ||
| + | + | ||||||||||||||||||||||||
| G1, 151–174 | Хвощовый, Н | + | |||||||||||||||||||||||
| + | |||||||||||||||||||||||||
| + | |||||||||||||||||||||||||
| 50 + тина, песок | + | 0 | 0 | + | + | 0 | 0 | 0 | + | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |||
| + | + | ||||||||||||||||||||||||
| G2, 174–188 | Хвощовый, Н | + |
Таким образом, формирование почвенного профиля до глубины 40 см происходило одинаково для торфа бугра и мочажины, затем ввиду изменения гидрологических условий и смены растительности в условиях формирования торфяного бугра (сфагновые мхи сменились осоками и пушицами) появились различия в ботаническом составе торфа. Эти данные позволяют предполагать, что исследуемый торфяной бугор сформировался в недавнее время. Данные ботанического состава указывают на то, что до глубины 80 см, формирование торфа бугра и мочажины также происходило в разных условиях.
Следует отметить, что по сравнению с лесотундровой подзоной в торфе мочажин на побережье Баренцева моря не выявлено пика накопления полиаренов в слоях СТС и многолетней мерзлоты. Это во многом связано с особенностями ботанического состава торфа мочажин, который по всему профилю был представлен в основном сфагновыми мхами. Ранее на основании рассмотрения природной модели формирования мочажинного торфяника лесотундры нами было установлено, что высокомолекулярные полиарены формировались при разрушении лигнина, поступающего в торф в процессе интенсивного разложении Eriophorum sp. В природе наиболее эффективную биодеградацию лигнина осуществляют базидиомицеты, принадлежащие к группе “грибы белой гнили”. Многие из них разлагают лигнин, гемицеллюлозы и целлюлозу, в то время как другие представители этой группы более активно разлагают лигнин. Так, например, Ceriporiopsis subverispora (Pilát) Gilb. & Ryvarden, Phlebiasрр., Physisporinus rivulosus (Berk. & M.A. Curtis) и Dichomituss qualens (P. Karst.). D.A. Reid. способны интенсивно разрушать лигнин [13]. Канадскими учеными, на основании модельного эксперимента по влиянию потепления на микробиоту бореальных торфяников, показано, что изменения в функциональных группах грибов, зависели от температуры [16]. Так грибы потенциально способные разлагать целлюлозу доминировали при +4°C, тогда как при температуре +8°С преобладали потенциально разлагающие лигноцеллюлозу грибы. Подобные изменения в функциональных группах наблюдались в сообществе корневых грибов. При температуре +4°C доминировали корневые ассоциации микоризы, принадлежащие к Basidiomycota, в то время как повышение температуры до +8°C привело к уменьшению их количества и увеличению содержания грибов, связанных с корневой микоризой Ascomycota. Авторы утверждают, что в процессе потепления происходит сдвиг в составе грибкового сообщества в пользу разложителей более устойчивых соединений углерода (таких как лигнин). Кроме того, они ясно демонстрируют, что этот сдвиг происходит вместе с увеличением корневых ассоциатов сосудистых растений (эндофитов и микоризных грибов), что совпадает с увеличением доминирования сосудистых растений в исследованных авторами слоях торфа.
Эксперимент по потеплению в бореальном лесу Аляски и изучению изменения распространенности грибковых таксонов показал сходные результаты. Свободноживущие нитчатые грибы и эктомикоризные грибы в среднем положительно реагировали на потепление, дрожжи – отрицательно. Авторы сделали выводы, что в целом, вызванные потеплением сдвиги в грибковых сообществах могут сопровождаться их повышенной способностью разрушать лигнин. Это изменение в потенциальной функции может уменьшить накопление C в почве в условиях глобального потепления [25].
На основании подобных исследований можно предполагать, что в случае торфяников побережья Баренцева моря в условиях более холодного климата и сильного обводнения разложение лигнина травянистых растений может быть замедлено. Следует отметить, что при большой степени разложения растений (до 40%) в нижних слоях торфа мочажин образовавшийся лигнин, по-видимому, в дальнейшем не разрушался, и новообразования полиаренов не происходило. Данный факт подтверждали и высокие значения коэффициентов корреляции состава ПАУ торфа и растений по всей глубине мочажинной торфяной залежи.
ЗАКЛЮЧЕНИЕ
Исследования накопления полиаренов в растениях плоскобугристых болот северной тундры побережья Баренцева моря позволили выявить, что в целом растения фоновых участков тундровых и лесотундровых болот близки по составу полиаренов. Различия для большинства соединений ПАУ растений одного вида тундровой и лесотундровой зон статистически не значимы, что позволяет экстраполировать данные по составу ПАУ исследованных растений на другие фоновые бугристые торфяники при предположении, что они будут характеризоваться сходным составом и содержанием полиаренов.
Выявлены различия в накоплении полиаренов в торфяной залежи тундровых и лесотундровых болот. Общее содержание полиаренов в тундровых торфяниках было на порядок меньше, чем в лесотундровых [15]. Для торфа мерзлотных бугров и мочажин побережья Баренцева моря не выявлено значительного прироста содержания бенз[ghi]перилена и других тяжелых полиаренов на границе многолетней мерзлоты. Предположительно, в условиях более холодного климата и сильного обводнения разложение лигнина травянистых растений – основного источника образования тяжелых ПАУ – может быть замедлено. При большой степени разложения растений до 40% в нижних слоях торфа мочажин образовавшийся лигнин, по-видимому, в дальнейшем не разрушался, и новообразования полиаренов не происходило. Данный факт подтверждали и высокие значения коэффициентов корреляции состава ПАУ торфа и растений по всей глубине мочажинной торфяной залежи.
Для почв бугров и мочажин показано уменьшение коэффициентов корреляции состава ПАУ растений и торфа с глубиной, что во многом было обусловлено увеличением степени разложения торфа. Сходные закономерности были получены для торфяников лесотундровой зоны.
Установлено, что формирование почвенного профиля до глубины 40 см происходило одинаково для торфа бугра и мочажины, затем ввиду изменения гидрологических условий и смены растительности в условиях формирования торфяного бугра (сфагновые мхи сменились осоками и пушицами) появлялись различия в ботаническом составе торфа.
Список литературы
Василевич Р.С., Безносиков В.А. Влияние изменения климата в голоцене на профильное распределение гумусовых веществ бугристых торфяников лесотундры // Почвоведение. 2017. № 11. С. 1312–1324.
Габов Д.Н., Безносиков В.А. Полициклические ароматические углеводороды в тундровых почвах Республики Коми // Почвоведение. 2014. № 1. С. 30–38.
Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Яковлева Е.В. Закономерности формирования полициклических ароматических углеводородов в почвах северной и средней тайги // Почвоведение. 2008. № 11. С. 1334–1343.
Габов Д.Н., Василевич Р.С., Яковлева Е.В., Зуева О.М. Ароматические соединения в бугристых торфяниках криолитозоны // Геоэкология. Инженерная геология. Гидрогеология. Геокриология. 2017. № 6. С. 15–29.
Головацкая Е.А., Никонова Л.Г. Разложение растительных остатков в торфяных почвах олиготрофных болот // Вестник Томск. гос. ун-та. Биология. 2013. № 3(23). С. 137–151. https://doi.org/10.17223/19988591/23/13
Жидкин А.П., Геннадиев А.Н., Кошовский Т.С. Поступление и поведение полициклических ароматических углеводородов в пахотных, залежных и лесных почвах таежной зоны (Тверская область) // Почвоведение. 2017. № 3. С. 311–320.
Исаченко Т.И., Лавренко Е.М. Ботанико-географическое районирование // Растительность европейской части СССР. Л.: Наука, 1980. С. 10–23.
Каверин Д.А., Пастухов А.В., Лаптева Е.М., Биази К., Марущак М., Мартикайнен П. Строение и свойства почв многолетнемерзлых торфяников юго-востока большеземельской тундры // Почвоведение. 2016. № 5. С. 542–556.
Королева Н.Е., Кулюгина Е.Е. История ботанических исследований и уровень изученности растительности европейской субарктики // Биоразнообразие, охрана и рациональное использование растительных ресурсов Севера // Мат-лы XI Перфильевских науч. чтений (Архангельск, 23–25 мая 2007 г.). Архангельск, 2007. Ч. 1. С. 70–75.
Никонова Л.Г., Курганова И.Н., Лопес де Гереню В.О., Жмурин В.А., Головацкая Е.А. Влияние абиотических факторов на разложение опада растений-торфообразователей в инкубационном эксперименте // Вестник Томского государственного университета. Биология. 2019. № 46. С. 148–170. https://doi.org/10.17223/19988591/46/8
Орлов Д.С. Гумусовые кислоты почв и общая теория гумификации. М.: Изд-во Моск. ун-та, 1990. 325 с.
Пастухов А.В., Каверин Д.А., Габов Д.Н. Полициклические ароматические углеводороды в мерзлотных бугристых торфяниках на европейском северо-востоке // Почвоведение. 2017. № 7. С. 814–823.
Феофилова Е.П., Мысякина И.С. Лигнин: химическое строение, биодеградация, практическое использование // Прикладная биохимия и микробиология. 2016. Т. 52. № 6. С. 559–569.
Яковлева Е.В., Габов Д.Н., Безносиков В.А., Кондратенок Б.М. Накопление полициклических ароматических углеводородов в почвах и мхах южной тундры на разных расстояниях от теплоэлектростанции // Почвоведение. 2018. № 5. С. 563–572.
Яковлева Е.В., Габов Д.Н., Василевич Р.С., Гончарова Н.Н. Участие растений в формировании состава полициклических ароматических углеводородов торфяников // Почвоведение. 2020. № 3. С. 1–14.
Asemaninejada A., Greg Thorna R., Branfireuna B.A., Lindoa Z. Climate change favours specific fungal communities in boreal peatlands Soil // Biology and Biochemistry. 2018. V. 120. P. 28–36. https://doi.org/10.1016/j.soilbio.2018.01.029
Bozkurt S., Lucisano M., Moreno L., Neretnieks I. Peat as a potential analogue for the long-term evolution in landfills // Earth-Science Reviews. 2001. V. 53. P. 95–147. https://doi.org/10.1016/S0012-8252(00)00036-2
Brien L.O., Langlois P.H., Lawson C.C. et al. Maternal Occupational Exposure to Polycyclic Aromatic Hydrocarbons and Craniosynostosis among Offspring in the National Birth Defects Prevention Study // Birth Defects Res A Clin Mol Teratol. 2016. V. 106. № 1. P. 55–60. https://doi.org/10.1002/bdra.23389
Cheng Y., Kong S., Yan Q., Liu H., Wang W., Chen K., Yin Y., Zheng H., Wu J., Yao L., Zeng X., Zheng S., Wu F., Niu Z., Zhang Y., Yan Y., Zheng M., Qi S. Size-segregated emission factors and health risks of PAHs from residential coal flaming/smoldering combustion // Environ Sci Pollut Res Int. 2019. V. 26. № 31. P. 31793–31803. https://doi.org/10.1007/s11356-019-06340-2
Chen W., Wang H., Gao Q., Chen Y., Li S., Yang Y., Werner D., Tao S., Wang X. Association of 16 priority polycyclic aromatic hydrocarbons with humic acid and humin fractions in a peat soil and implications for their long-term retention // Environmental Pollution. 2017. V. 230. P. 882–890. https://doi.org/10.1016/j.envpol.2017.07.038
Herbstman J.B., Tang D., Zhu D., Qu L., Sjodin A., Li Z., Camann D., Perera F.P. Prenatal Exposure to Polycyclic Aromatic Hydrocarbons, Benzo[a]pyrene-DNA Adducts, and Genomic DNA Methylation in Cord Blood // Environmental Health Perspectives. 2012. V. 120. № 5. P. 733–738. https://doi.org/10.1289/ehp.1104056
Malawska M., Ekonomiuk A. The use of wetlands for the monitoring of non-point source air pollution // Polish J. Environmental Studies. 2008. V. 17. № 1. P. 57–70.
Ren A. Environmental Pollutants and Neural Tube Defects // Reproductive and Developmental Toxicology (Second Edition). 2017. V. 61. P. 1139–1166.
Thuens S., Blodau C., Radke M. How suitable are peat cores to study historical deposition of PAHs // Science of the Total Environment. 2013. V. 450–451. P. 271–279. https://doi.org/10.1016/j.scitotenv.2013.01.091
Treseder K.K., Marusenko Y., Romero-Olivares A.L., Maltz M.R. Experimental warming alters potential function of the fungal community in boreal forest // Glob Chang Biol. 2016. V. 22. № 10. P. 3395–404. https://doi.org/10.1111/gcb.13238
Ukalska-Jaruga A., Smreczak B., Klimkowicz-Pawlas A. Soil organic matter composition as a factor affecting the accumulation of polycyclic aromatic hydrocarbons // J. Soils and Sediments. 2019. V. 19. № 4. P. 1890–1900. https://doi.org/10.1007/s11368-018-2214-x
Wang Z., Liu S., Bu Z.-J.,Wang S. Degradation of polycyclic aromatic hydrocarbons (PAHs) during Sphagnum litters decay //Environmental Science and Pollution Research. 2018. V. 25. P. 18642–18650. https://doi.org/10.1007/s11356-018-2019-x
Wang Z., Li H., Liu S. Different distribution of polycyclic aromatic hydrocarbons (PAHs) between Sphagnum and Ledum peat from an ombrotrophic bog in Northeast China // J. Soils and Sediments. 2019. V. 19. P. 1735–1744. https://doi.org/10.1007/s11368-018-2178-x
Wilcke W. Polycyclic aromatic hydracarbons (PAHs) in soil – a review // J. Plant Nutr. Soil Sci. 2000. V. 163. P. 229–248. https://doi.org/10.1002/1522-2624(200006)163:3<229::AID-JPLN229>3.0.CO;2-6
Дополнительные материалы отсутствуют.