Почвоведение, 2020, № 2, стр. 219-229
Моделирование технологии “контурного заводнения” в микрокосмах
Т. Н. Щемелинина a, Е. М. Анчугова a, *, Е. М. Лаптева a, Р. С. Василевич a, М. Ю. Маркарова a, Е. Н. Глазачева b, М. В. Успенская b
a Институт биологии Коми научного центра Уральского отделения РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
b Санкт-Петербургский национальный исследовательский университет информационных технологий,
механики и оптики
197101 Санкт-Петербург, Кронверкский пр-т, 49, Россия
* E-mail: anchugova@ib.komisc.ru
Поступила в редакцию 25.04.2019
После доработки 05.07.2019
Принята к публикации 24.09.2019
Аннотация
Представлены результаты моделирования комплексной биотехнологии “контурного заводнения” для очистки сильнозагрязненной нефтью агродерново-подзолистой почвы (Albic Retisols (Loamic)) при помощи бактериально-дрожжевого консорциума, микроводорослей и альго-бактериально-дрожжевого консорциума с применением минеральных удобрений. Выявлены закономерности изменения биотических показателей и содержания нефтепродуктов на различных этапах деструкции нефти в микрокосмах. Показано, что изменения численности углеводородокисляющих микроорганизмов в изучаемых микрокосмах (микроэкосистемах) имеют различную направленность в зависимости от внесенного биологического агента. При внесении микроводорослей численность данной группы микроорганизмов снижается на порядок в конце эксперимента, а при внесении бактериально-дрожжевого и альго-бактериально-дрожжевого консорциума – восстанавливает численность к 90 суткам. Биохимическая активность в микрокосмах оставалась на высоком уровне во всех случаях. Показана эффективность использования нефтеокисляющих микробных консорциумов, в том числе с применением культур микроводорослей. Бактериально-дрожжевой и альго-бактериально-дрожжевой консорциумы в присутствии минеральных добавок оказывают максимальный эффект очистки при моделировании технологии в микрокосмах. Эффективность очистки почвы от нефтепродуктов за 90 суток лабораторного эксперимента составила 60–63%. Данные ИК-спектроскопии диагностируют уменьшение доли насыщенных алифатических структур, накопление ароматических углеводородов и кислородсодержащих соединений, которые являются промежуточными продуктами метаболизма при микробном окислении углеводородов нефти.
ВВЕДЕНИЕ
В настоящее время отсутствуют универсальные методы очистки почв от нефти и нефтепродуктов (НП) [14, 23]. В зависимости от масштаба загрязнения, качества и количества поллютантов (нефти и нефтесодержащих жидкостей), биоклиматических условий территории, особенностей почвенного покрова осуществляется дифференцированный подход к проведению биоремедиационных мероприятий [6, 10, 15, 33]. В ряде работ [7, 14] предложены технологии, направленные на очистку почв, которые либо обусловлены незначительными по масштабам нефтеразливами, либо достигаются проведением технического этапа очистки нефтезагрязненных земель, включающего механическую уборку нефти и НП [21]. Физические методы удаления загрязнений не способствуют восстановлению почв и могут нанести дополнительный ущерб окружающей среде [38]. Химическая обработка нефтезагрязненных почв путем экстракции растворителями или окислением оказывает влияние на изменение агрохимических характеристик почв, а также химические показатели грунтовых вод [28, 40].
Огромный потенциал и конкурентные преимущества по сравнению с вышеперечисленными способами имеет метод биоремедиации, прежде всего, из-за экологической безопасности и низкой стоимости [25]. В предлагаемых технологиях очистки нефтезагрязненной почвы in situ используют внесение биопрепаратов совместно с сорбентами или без них [13]. В условиях севера, где в силу специфики биоклиматических условий широко распространены заболоченные ландшафты, оптимальны технологии, предусматривающие предварительную глубокую очистку водоемов и заболоченных территорий от нефти и НП путем уборки подвижной нефти с последующим внесением минеральных удобрений и биопрепаратов [30]. Существуют технологии, предусматривающие активизацию десорбции нефти на поверхность путем насыщения воды кислородом, где в процессе аэрации очистка происходит наиболее эффективно, заводнение зоны загрязнения создается естественным или искусственным путем с помощью дамб и отсыпок [8, 14].
Существующая проблема утилизации персистентных загрязнений предполагает разработку новых технологий очистки, в том числе с применением ассоциаций микроорганизмов, которые составляют основу биопрепаратов. Состав биопрепаратов, представляемых на российском рынке, различен – от одного (“Путидойл”, “Аллегро”, “Торнадо”, “Лидер”, “Родер” и др.) до 3–15 штаммов микроорганизмов (“Экойл”, “Олеворин”, “Деворойл”, “Биоойл”, “ВиO”, “Универсал”, “Биотрин”, “Рага-Вас” и др.). Такие биопрепараты, как “Биоойл-СН”, “Биоойл-АА”, в состав которых входят штаммы углеводородокисляющих микроорганизмов (УОМ) из родов Enterobacter, Acinetobacter и Bacillus [2, 24], используются в настоящее время в производственных масштабах для очистки в условиях Крайнего Севера нефтезагрязненных почв и водных объектов совместно с торфосорбентами и сорбентами на основе графена [1]. Микробная ассоциация, состоящая из штаммов родов Rhodococcus, Pseudomonas, Acinetobacter и содержащая катабoлические плазмиды, является основой биопрепарата “ВиO” [30] для биоремедиации загрязненных нефтью и НП почвенных и водных экосистем, способна к деструкции углеводородов нефти в диапазоне температур 4–42°С при концентрации ее в природных средах до 30%, присутствии солей до 5% и величине рН от 4 до 10. Эффективность опытного образца биопрепарата “ВиO” в полевых испытаниях по очистке грунта от нефти на территории Пограничного месторождения Ямало-Ненецкого автономного округа составила 80%. В основном представленные биопрепараты включают штаммы бактерий и дрожжей. Исследования биорекультивации с помощью комплекса микроорганизмов, в состав которых входят микроводоросли [27], немногочисленны и требуют дальнейшего изучения.
Внедрение новых технологий в практику природопользования требует детального анализа процессов, лежащих в основе биотрансформации поллютантов в природной среде. В частности, необходима оценка процессов биоокисления нефти и НП на разных этапах ремедиации нефтезагрязненных почв. Особого внимания требуют вопросы разработки методологических подходов к контролю экологического состояния биотических и абиотических компонентов восстанавливаемых экосистем. С этой целью могут быть использованы показатели содержания в почвах окислительно-восстановительных ферментов, углеводородокисляющих микроорганизмов, остаточного содержания НП.
Цель работы – разработка эффективной комплексной биотехнологии очистки сильнозагрязненных нефтью почв на основе оценки закономерностей динамики индикационных параметров.
ОБЪЕКТЫ И МЕТОДЫ
Изучение эффективности деструкции нефти консорциумом углеводородокисляющих микроорганизмов проводили в лабораторном эксперименте. В качестве основных деструкторов использовали штаммы Rhodotorula sp. VKM Y-2993D, Pseudomonas libanensis VKM B-3041D, выделенные из нефтезагрязненных почв Усинского района Республики Коми, а также штаммы микроводорослей Acutodesmus obliquus IPPAS S-2016, Chlorella sp. IPPAS C-2024, Monoraphidium sp., Anabaena sp. из коллекции SykoA Института биологии Коми НЦ УрО РАН [18].
В лабораторных условиях создали микрокосмы (микроэкосистемы): в вегетационные сосуды помещали минеральный субстрат массой 0.5 кг и загрязняли его высокой концентрацией нефти (30 мас. %). В качестве субстрата использовали образцы пахотного горизонта агродерново-подзолистой почвы (Albic Retisols (Loamic)). В емкости с почвой добавляли минеральные соли (азотно-калийно-фосфорное удобрение NPK-15), тщательно перемешивали, затем вносили биологические агенты (бактерии, дрожжи и микроводоросли, выращенные раздельно) в соответствии со схемой, представленной в табл. 1. Технологию “контурного заводнения”, когда предварительно гидроизолированный загрязненный участок заполняют водой, моделировали добавлением в микрокосмы воды объемом 1 дм3. Слой воды, располагающийся над поверхностью минерального субстрата, аэрировали с помощью компрессора Tetratec APS 400. Лабораторный эксперимент проводили в трехкратной повторности при комнатной температуре. Продолжительность эксперимента составила 90 сут.
Таблица 1.
Схема проведения эксперимента
| Вариант | N15P15K15 | Суспензия консорциума | |
|---|---|---|---|
| бактериально-дрожжевого* | микрово-дорослей** | ||
| Контроль | – | – | – |
| I | + | – | – |
| II | + | + | – |
| III | + | – | + |
| IV | + | + | + |
Изменение биологической активности почвы (минерального субстрата) оценивали по динамике численности УОМ и активности окислительно-восстановительных ферментов. Численность УОМ определяли методом высева на твердую среду Раймонда 10-кратных разведений почвенных суспензий [17]. Активность фермента каталазы оценивали перманганатным методом, дегидрогеназную активность определяли на основе колориметрического определения формазана [32]. Дегидрогеназную активность водной суспензии исследовали в соответствии с методикой ВНИИ ВОДГЕО [22].
Все полученные результаты по величине ферментативной активности сводили к расчетному показателю среднего геометрического GMea [36]:
где GMea – среднее геометрическое ферментативной активности; Сat – каталаза; Deh – дегидрогеназа.Относительные баллы для показателей ферментативной активности Саt и Deh рассчитывали по формуле Девятовой [9]. Например, для показателей каталазной активности расчет вели по формуле:
где Сat – относительный оценочный балл показателя; Сatф – фактическое значение показателя, см3 0.1 М КМnO4 на 1 г сухой почвы за 20 мин; Сat0 – значение показателя в незагрязненной почве, см3 0.1 М КМnO4 на 1 г сухой почвы за 20 мин.Аналогично рассчитывали значение относительного оценочного балла для показателей дегидрогеназной активности.
Микроскопирование образцов проводили с помощью микроскопа Nikon Eclipse80i при увеличении до ×1000, оборудованного системой дифференциального интерференционного контраста и видеофиксации изображений. Микрофотографии выполнены с помощью камер Nikon Digital Sight Ds-2Mv (Nikon, Japan).
Интенсивность деструкции нефти оценивали по изменению содержанию НП в образцах почв [16] и водной среды. Содержание НП определяли гравиметрическим методом, экстрагируя НП из образцов почв и водной среды хлороформом. ИК-спектроскопию образцов почв проводили после их высушивания, тщательного перемешивания и измельчения в ступке до однородного состояния. Измельченный образец помещали на приставку НПВО (кристалл ZnSe с алмазным напылением) ИК-спектрометра Tensor 37 фирмы Bruker (Германия). ИК-спектры поглощения каждого образца снимали в трех различных участках, перемещая его по столику приставки НПВО в трех повторностях. ИК-съемку проводили в спектральном диапазоне 600–4000 см–1 при разрешении 2 см–1, число сканирований 32. ИК-спектры подвергали процедуре коррекции базовой линии. Для качественной и количественной идентификации компонентного состава нефти использовали следующие спектральные коэффициенты [11, 26]:
С1 = D1608/D723 – условное отношение ароматических углеводородов к нормальным парафиновым структурам (коэффициент ароматичности);
С2 = D1608/D1460 – условное содержание ароматических структур, т.е. отношение ароматических к сумме парафиновых углеводородов;
С3 = D2852/D1608 – условное содержание парафиновых структур, т.е. отношение интенсивности валентных колебаний метиленовых групп к сумме ароматических углеводородов;
С4 = D723/D1460 – условное содержание парафиновых структур, т.е. отношение нормальных парафиновых структур к сумме парафиновых углеводородов (индекс разветвленности);
С5 = (D723 + D1380)/D1608 – условное содержание насыщенных алифатических структур (индекс алифатичности);
С6 = (D1705)/D1608, С7 = (D1730)/D1608 – отношение интенсивности образования продуктов окисления углеводородов к сумме ароматических углеводородов (коэффициенты окисленности).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Биологическая активность в микрокосмах
Согласно теории индуцированного синтеза ферментов Кошланда [29], в ответ на присутствие в среде специфического субстрата или метаболита микроорганизмы вырабатывают соответствующие ферменты, что необходимо клетке для подготовки и усвоения труднодоступных источников питания. Окислительно-восстановительные ферменты: дегидрогеназа и каталаза – синтезируются микроорганизмами. Их присутствие в почве характеризует общую метаболическую активность почвенных микробных сообществ. Дегидрогеназа принимает непосредственное участие в биохимическом окислении углеводородов [20], а свободный кислород, образующийся при разложении перекиси водорода в присутствии фермента каталазы, способствует активизации деятельности микроорганизмов, участвующих в процессах деструкции углеводородов. Изменение каталазной активности в этом случае коррелирует с изменением численности нефтеокисляющих микроорганизмов [12].
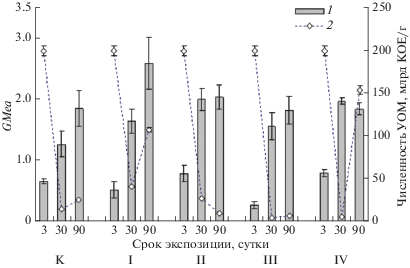
Изучение содержания в микрокосмах нефтеокисляющих микроорганизмов показало, что вне зависимости от варианта опыта во всех микрокосмах динамика численности УОМ имела сходную картину (рис. 1). В первые дни эксперимента во всех образцах почв, включая контроль, наблюдалась высокая концентрация УОМ (2 × 109 КОЕ/г). По всей видимости, это обусловлено введением в почвы микрокосмов специфического субстрата – нефти. Массированное нефтяное загрязнение сопровождается острым токсическим действием на микробные сообщества, что обусловливает подавление жизнедеятельности микроорганизмов и преимущественное присутствие в почвенной среде микроорганизмов из группы УОМ. Как видно, численность данной группы к 30-му дню эксперимента резко (на порядок) снижается и либо остается на этом уровне до конца эксперимента (контроль, варианты II и III), либо возрастает (варианты I и IV). Последнее может свидетельствовать о более выраженной адаптации микробоценозов к сложившимся условиям в варианте без внесения консорциума микроорганизмов, но при наличии стимулирующего для развития аборигенной микрофлоры фактора (внесение NPK) – вариант I, и с внесением дополнительного количества углеводородокисляющих микроорганизмов в присутствии микроводорослей – вариант IV.
Рис. 1.
Изменение величины расчетного показателя среднего геометрического ферментативной активности (1) и динамика численности углеводородокисляющих микроорганизмов (2) в образцах почв исследуемых микрокосмов. Номера вариантов приведены в соответствии с табл. 1.
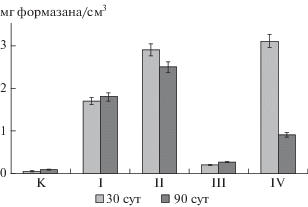
Оценка параметров биохимической активности образцов почв в микрокосмах показала, что каталазная активность в них варьировала в пределах от 0.71 до 2.23 см3 КMnO4/г почвы за 20 мин, дегидрогеназаная – от 3.08 до 47.27 мг формазана/г за 24 ч. При этом минимальные показатели ферментативной активности были отмечены во всех вариантах опыта в первый срок отбора. В ходе эксперимента произошло возрастание каталазной активности. На 30-е сут эксперимента во всех вариантах опыта она увеличилась в 1.1–2.8 раза и сохранялась на этом уровне до конца срока экспозиции микрокосмов.
Для дегидрогеназной активности также отмечено увеличение в ходе эксперимента. В зависимости от варианта опыта она увеличилась относительно первого срока отбора (3 дня экспозиции) в 1.2–6.7 раза. Однако в отличие от каталазной активности к концу эксперимента (90 дней экспозиции) степень обогащенности образцов почв ферментом дегидрогеназой либо возрастала (контроль, варианты I и III), либо снижалась (варианты II и IV) относительно второго срока отбора проб (30 дней экспозиции).
Следует отметить, что с течением времени взаимосвязь между этими показателями в микрокосмах меняется: при трехдневном сроке экспозиции корреляция между каталазной и дегидрогеназной активностью в микрокосмах оценивалась как средняя (r = 0.5), спустя месяц экспозиции – слабая (r = 0.4), к концу трехмесячного срока коэффициент корреляции между этими показателями имел нулевое значение. Для адекватной интерпретации параметров и направленности биохимических реакций в почвах используют интегральные показатели, позволяющие учесть эти изменения. Таким интегральным показателем может быть величина среднего геометрического ферментативной активности GMea [5, 35]. Как видно (рис. 1), несмотря на близкий порядок численности УОМ во всех микрокосмах, зафиксированный на третьи сутки эксперимента, по ферментативной активности их минеральные субстраты несколько различались. Минимальные значения расчетного показателя GMea отмечены в контроле и вариантах I и III, максимальные – в вариантах II и IV, т.е. где в качестве биологических агентов нефтеокисления введены бактериально-дрожжевой и альго-бактериально-дрожжевой консорциумы. Снижение численности УОМ в ходе эксперимента не привело к подавлению окислительно-восстановительных процессов в микрокосмах. Спустя месячный срок экспозиции во всех микрокосмах наблюдалось возрастание величины GMea по сравнению с контролем, а спустя три месяца – только в вариантах опыта I, II и IV. Таким образом, биохимическая активность в микрокосмах оказалась на высоком уровне в случае совместного введения в систему микроводорослей и бактериально-дрожжевого консорциума микроорганизмов (вариант IV), отдельного внесения бактериально-дрожжевого консорциума (вариант II) и стимуляции аборигенного микробного сообщества биофильными компонентами (вариант I).
Эффективность очистки от НП в микрокосмах
Влияние комплекса микроорганизмов на процессы деструкции НП в лабораторном эксперименте оценивали по динамике изменений содержания НП в почве микрокосмов на третьи сутки, спустя месяц и спустя 3 мес. Как показали проведенные исследования (рис. 2А), в контрольном варианте содержание НП в почве за все время эксперимента практически не изменилось. Все различия в концентрации нефти на третьи, 30- и 90-е сут экспозиции были не существенны для 0.05% уровня значимости.
Рис. 2.
Динамика содержания нефтепродуктов в микрокосмах: А – в почве (мг/г) в разные сроки эксперимента; Б – в почве (мг/г) и в водной среде (мг/100 см3) спустя 90 сут эксперимента: К – контроль; I, II, III, IV – варианты опыта в соответствии с табл. 1.
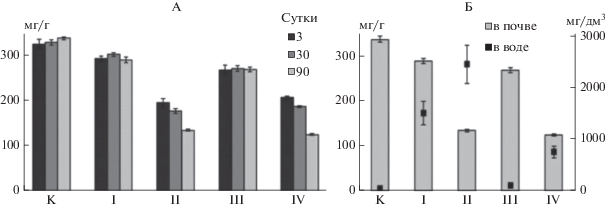
Внесение только одних минеральных удобрений (вариант I) в загрязненную почву привело к стимуляции аборигенной микрофлоры снижению содержания НП за весь период экспозиции на 10.5%, минеральных удобрений в сочетании с введением в систему микроводорослей (III) – на 20.3%. Биологические агенты – бактериально-дрожжевой (II) и альго-бактериально-дрожжевой (IV) консорциумы – в комплексе с минеральными удобрениями оказались наиболее эффективными в очистке почвы от НП. Уменьшение содержания НП в почве вариантов II и IV составило за 90 сут эксперимента соответственно 60 и 63%.
При анализе процессов, происходящих в микрокосмах в результате взаимодействия биологических агентов с НП, особое внимание следует уделить вопросу десорбции углеводородов из загрязненной почвы в водную среду. Дегидрогеназная активность, определяемая в пробах воды, покрывающей слой минерального субстрата и аэрируемой в течение всего срока проведения эксперимента напрямую зависела от содержания НП в воде микрокосмов (рис. 2Б, 3). В микрокосмах ІІ и ІV, благодаря жизнедеятельности микроорганизмов происходило эффективное снижение содержания НП в почве за счет их десорбции в водную среду, где отмечено более большое количество НП по сравнению с контролем. Однако при сравнении соотношения НП в почве и воде вариант ІV отличался от варианта ІІ большей эффективностью очистки почвы. Более низкие значения содержания НП могут свидетельствовать об активной нефтедеструкции в водной фазе микрокосма варианта IV за счет комплексного действия микроорганизмов, входящих в состав альго-бактериально-дрожжевого консорциума, и процессов дегидрирования. Увеличение в почве варианта IV к концу экспозиции показателя GMea, характеризующего уровень ферментативной активности биотического комплекса, и численности УОМ может свидетельствовать об определенных сукцессионных изменениях в их составе, способствующих активизации процессов деструкции НП в присутствии штаммов микроорганизмов Rhodotorula sp., P. libanensis и микроводорослей A. obliquus, Chlorella sp., Monoraphidium sp., Anabaena sp. Самоочищение почвы (контрольный микрокосм) будет проходить значительно дольше, чем при внесении биологических агентов.
Теоретическое обоснование возможности десорбции нефти биосурфактантами, выделяемыми микроорганизмами, основано на двух гипотезах. Первая состоит в том, что биосурфактанты, как и синтетические поверхностно-активные вещества (ПАВ), образуют мицеллы [39, 42], с помощью которых часть углеводородов, сорбированная на почвенной матрице, может быть отделена от твердой фазы [34]. Вторая гипотеза основана на представлении о гидрофобном характере строения внутренней среды мицелл, которые образуют молекулы биосурфактантов, что определяет растворимость неполярных соединений, в том числе нефтеуглеводородов [4, 37]. По всей видимости, оба процесса могут способствовать более эффективному отделению углеводородов нефти от твердой фазы (почв, минеральных субстратов, донных отложений) в загрязненных нефтью природных экосистемах.
Рис. 3.
Динамика дегидрогеназной активности в образцах воды, покрывающей поверхность минерального субстрата в микрокосмах эксперимента.
В проведенном эксперименте отмечен эффект эмульгирования и десорбции НП в водную среду (рис. 2Б), связанный с деятельностью внесенных в микрокосмы микроорганизмов. Подтверждение эффекта десорбции наблюдали при микроскопирование проб воды из микрокосмов, которое показало наличие клеток бактерий, дрожжей (варианты ІІ, ІV) и микроводорослей (вариант ІV), делящихся на диспергированной нефти (рис. 4).
Оценка трансформации НП методом ИК-спектроскопии
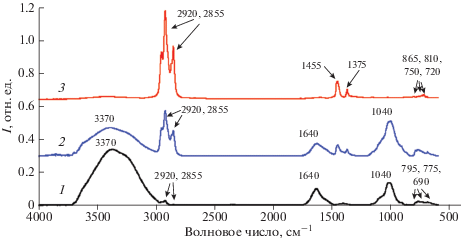
ИК-спектроскопия является информативным и чувствительным методом, позволяющим проведение оценки утилизации углеводородов и трансформации функциональных групп в процессе деструкции органических соединений нефти [3, 26]. Анализ ИК-спектров исходной незагрязненной почвы, почвы, подвергнутой загрязнению нефтью (контроль) и нефти показал, что влияние нефти проявляется в почве в виде увеличившихся по интенсивности полос поглощения валентных колебаний –С–Н в группах СН2 и СН3 (2950, 2920, 2850 см–1) и деформационных колебаний –С–Н (1460 и 1380 см–1). В длинноволновой области спектра наблюдаются полосы поглощения, которые сложно разделить. Скорее всего, они относятся к связям свойственным гумусовым кислотам [19, 41], так как их массовая доля в почве очень велика. К таким полосам поглощения относятся 873 см–1 (–С–Н внеплоскостные колебания, которые могут свидетельствовать о 1,2,4-замещении в ароматическом кольце), 796 см–1 (–С–Н внеплоскостные колебания в метазамещенном ароматическом кольце), 743 см–1 (–С–Н внеплоскостные колебания в ортозамещенном ароматическом кольце), 725–720 см–1 (маятниковые колебания группы СН2), 692 см–1 (либо =С–Н связь в алкенах, либо –С–Н внеплоскостные колебания в монозамещенных ароматических кольцах). На спектральные характеристики почвы, загрязненной нефтью, сильное влияние оказывает присутствие полосы 1600 см–1, свойственной колебаниям –С–Н в ароматическом кольце, обусловленное, в основном, гумусовыми кислотами в почве, а также линии оксида кремния (полоса поглощения 1020 см–1). Это оказывает значительные ограничения в использовании данного метода при оценке изменения состава НП в процессе биодеструкции (рис. 5).
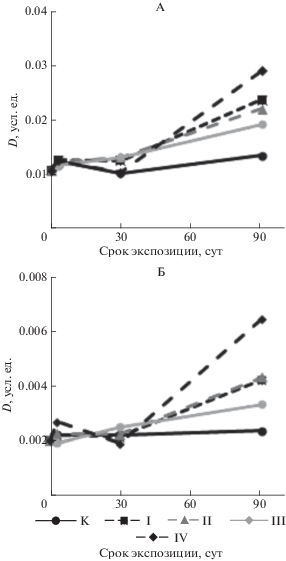
Показателями биодеградации нефти служат изменения спектральных коэффициентов (соотношений оптических плотностей характеристических полос поглощения), рассчитанных из ИК-спектров. Использование спектральных коэффициентов нивелирует мешающее влияние почвенных компонентов (доля которых в процессе эксперимента остается постоянной) на характеристические полосы поглощения компонентов нефти.
На рис. 6 представлены зависимости интенсивности линии колебаний связи С=О в карбоксильных группах (А) и 1730 см–1 – колебание связи С=О в альдегидах или сложных эфирах (Б) в зависимости от длительности биодеградации. Интенсивность данных линий на трехнедельном интервале не показывает роста и резко возрастает спустя 90 сут биодеградации для всех исследованных вариантов по сравнению с контролем. В результате наблюдается рост количества кислородсодержащих остаточных компонентов нефти, которые являются промежуточными продуктами метаболизма при микробном окислении углеводородов нефти [26, 31]. Аналогичные закономерности проявляются при анализе спектральных коэффициентов окисленности углеводородов С6 и С7, обнаруживающие значительный рост через 90 сут эксперимента. Наиболее интенсивный процесс окисления углеводородов в почве наблюдается для варианта IV. Вероятно, микроорганизмы-нефтедеструкторы окисляют углеводороды только по боковой цепи, не раскрывая ароматического кольца [7].
Рис. 6.
Изменение интенсивности полос 1705 (А) и 1730 см–1 (Б) в зависимости от времени биодеструкции.
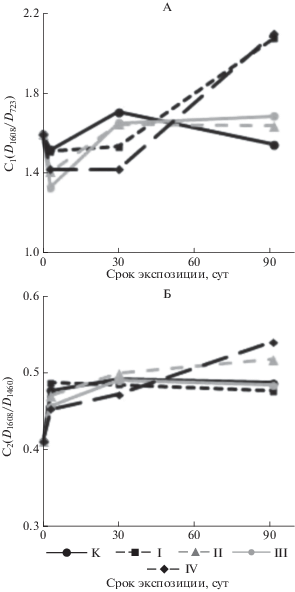
В процессе биодеструкции нефти происходит увеличение спектральных коэффициентов C1 и С2, указывающих на увеличение относительной доли устойчивых ароматических углеводородов (рис. 7). Рост степени ароматичности исследованных проб сопровождается уменьшением доли насыщенных алифатических структур (уменьшение С3 и С5). В процессе ферментативного окисления НП также увеличивается показатель разветвленности парафиновых углеводородов (С4) (рис. 8). Указанные процессы протекают наиболее активно в почве варианта IV с применением альго-бактериально-дрожжевого консорциума.
ЗАКЛЮЧЕНИЕ
Показано, что наиболее эффективными биоремедиантами нефтезагрязненных субстратов являются бактериально-дрожжевой (Rhodotorula sp., Pseudomonas libanensis) и альго-бактериально-дрожжевой (Rhodotorula sp., Pseudomonas libanensis, Acutodesmus obliquus, Chlorella sp., Monoraphidium sp., Anabaena sp.) консорциумы. Эффективность очистки почвы от НП за 90 сут проведения эксперимента составила 60–63%.
Численность углеводородокисляющих микроорганизмов существенно изменялась в ходе эксперимента. Будучи высокой в начале эксперимента, численность данной группы микроорганизмов снижалась на порядок в связи с острым токсическим действием нефти, а затем в вариантах I и IV численность УОМ возрастала, что указывает на адаптацию микробоценоза к сложившимся условиям и ускорению процесса биодеградации.
Отмечен эффект эмульгирования и десорбции НП в водную среду из почвы, связанный с деятельностью внесенных в микрокосмы микроорганизмов. Данные ИК-спектроскопии диагностируют уменьшение доли насыщенных алифатических структур и накопление устойчивых ароматических углеводородов и остаточных компонентов нефти, которые являются промежуточными продуктами метаболизма при микробном окислении углеводородов нефти.
Полученные данные позволяют рекомендовать использование альго-бактериально-дрожжевого консорциума с минеральными добавками в комплексе с технологией “контурного заводнения” и насыщения кислородом водной фазы с помощью аэрирующих устройств для очистки нефтезагрязненных почв. Такая технология позволит в короткие сроки снизить нагрузку нефтяных углеводородов на наземные экосистемы с высокой степенью загрязнения почв нефтью.
Список литературы
Адаменко Л.С., Алексеев А.Ю. Забелин В.А., Филатов Д.А., Шаршов К.А., Шестопалов А.М. Метод утилизации нефтяных разливов с водной поверхности с применением сорбента на основе мультиграфена и микробного препарата в условиях, приближенных к естественным // Экологический вестник России. 2014. № 3. С. 32–34.
Алексеев А.Ю., Смородина Е.А., Адаменко Л.С., Емельянова Е.К., Забелин В.А., Ильичева Т.Н., Резников В.А., Шестопалов А.М. Подбор ассоциации микроорганизмов-деструкторов нефтяной фракции твердых алканов при низких положительных температурах // Современные проблемы науки и образования. 2011. № 6. http://www.science-education.ru/ru/article/view?id=4939
Алтунина Л.К., Сваровская Л.И., Филатов Д.А. Влияние света, трансформированного фотолюминесцентными пленками, на деструктивную активность микроорганизмов нефтезагрязненных почв // Оптика атмосферы и океана. 2012. № 11. С. 1014–1018.
Анчугова Е.М., Маркарова М.Ю., Щемелинина Т.Н. Эффективность и экологические аспекты применения растворов поверхностно-активных веществ для разделения фаз механических примесей и нефти из нефтешламов // Известия Самарского НЦ РАН. 2009. Т. 11(1). С. 202–207.
Анчугова Е.М., Мелехина Е.Н., Маркарова М.Ю., Щемелинина Т.Н. Подходы к оценке методов рекультивации нефтезагрязненных почв // Почвоведение. 2016. № 2. С. 257–260.
Аренс В.Ж., Гридин О.М., Яншин А.Л. Нефтяные загрязнения: как решить проблему // Экология и промышленность России. 1999. № 9. С. 33–36.
Водяницкий Ю.Н., Трофимов С.Я., Шоба С.А. Перспективные подходы к очистке почв и почвенно-грунтовых вод от углеводородов (обзор) // Почвоведение. 2016. № 6. С. 755–764.
Воробьев Ю.Л., Акимов В.А., Соколов Ю.И. Предупреждение и ликвидация аварийных разливов нефти и нефтепродуктов М.: Ин-октаво, 2005. С. 315.
Девятова Т.А. Биоэкологические принципы мониторинга и диагностики загрязнения почв // Вестник Воронежского гос. ун-та. Сер. Химия. Биология. Фармация. 2005. № 1. С.103–106.
Емельянова Е.К., Алексеев А.Ю., Мокеева А.В., Тарасова М.В., Шестопалов М.А., Карпова Е.В., Забелин В.А., Шестопалов А.М., Ильичева Т.Н. Биорекультивация загрязненных объектов в Тюменской области // Вестник НГУ. Сер. Биология, клиническая медицина. 2010. Т. 8. № 4. С. 155–161.
Иванова Л.В., Кошелев В.Н., Буров Е.А., Стоколос О.А. Применение ИК-спектрометрии в исследовании нефтей // Труды Российского государственного университета нефти и газа им. И.М. Губкина. 2010. № 2. С. 76–80.
Исмаилов Н.М. Нефтяное загрязнение и биологическая активность почв // Добыча полезных ископаемых и геохимия природных экосистем. М.: Наука, 1982. С. 227–235.
Костенков Н.М., Ознобихин В.И. Особенности биоремедиации нефтезагрязненных почв вусловиях Северного Сахалина // Международный журнал прикладных и фундаментальных исследований. 2013. Т. 8. № 2. С. 224–227.
Маганов Р.У., Маркарова М.Ю., Муляк В.В., Загвоздкин В.К., Заикин И.А. Природоохранные работы на предприятиях нефтегазового комплекса. Ч. І. Рекультивация загрязненных нефтью земель в Усинском районе Республики Коми. Сыктывкар, 2006. 208 с.
Маслов М.Н., Маслова О.А., Ежелев З.С. Микробиологическая трансформация органического вещества в нефтезагрязненных тундровых почвах после рекультивации // Почвоведение. 2019. № 1. С. 70–78. https://doi.org/10.1134/S0032180X19010106
Методика выполнения измерений массовой доли нефтепродуктов в пробах почв на анализаторе жидкости “Флюорат-02”. ПНД Ф 16.1.21-98. М., 1998. 15 с.
Методы почвенной микробиологии и биохимии / Под ред. Звягинцева Д.Г. М.: Изд-во Моск. ун-та, 1991. 304 с.
Новаковская И.В., Патова Е.Н. Коллекция живых штаммов микроводорослей Института биологии Коми НЦ УрО РАН и перспективы ее использования // Известия Коми научного центра УрО РАН. 2012. № 2(10). С. 36–41.
Патраков Ю.Ф., Счастливцев Е.Л., Мандров Г.А. Изучение буроугольных гуминовых и фульвокислот методом ИК-спектроскопии // Химия твердого топлива. 2010. № 5. С. 9–14.
Пиковский Ю.И. Трансформация техногенных потоков нефти в почвенных экосистемах // Восстановление нефтезагрязненных почвенных экосистем. М.: Наука, 1988. С. 7–22.
Подавалов Ю.А. Экология нефтегазового производства. М.: Инфра-Инженерия, 2010. 175 с.
Роговская П.И., Оргианская Ф.Е. Рекомендации по методам производства анализов на сооружениях биохимической очистки промышленных сточных вод. М.: Стройиздат, 1970. 104 с.
Рогозина Е.А. Актуальные вопросы проблемы очистки нефтезагрязненных почв. Нефтегазовая геология. Теория и практика. www.ngtp.ru.
Розанова М.С., Мыльникова О.И., Кляйн О.И., Филиппова О.И., Холодов В.А., Листов Е.Л., Куликова Н.А. Оценка эффективности растворов гуминовых препаратов как промывных агентов для нефтезагрязненных почв и торфа в условиях модельного эксперимента // Почвоведение. 2018. № 9. С. 1160–1166. https://doi.org/10.1134/S0032180X18090101
Руденко Е.Ю. Влияние отходов пивоварения на ферментативную активность нефтезагрязнённой чернозёмной почвы // Теоретическая и прикладная экология. 2011. № 3. С. 60–64.
Сваровская Л.И., Филатов Д.А., Гэрэлмаа Т., Алтунина Л.К. Оценка степени биодеструкции нефти методами ИК- и ЯМР 1Н-спектроскопии // Нефтехимия. 2009. Т. 49(2). С. 153–158.
Сопрунова О.Б. Использование цианобактериального комплекса для ремедиации нефтезагрязненных сред // Биотехнология. 2006. № 5. С. 52–56.
Трофимов С.Я., Караванова Е.И. Жидкая фаза почв: учебное пособие по некоторым главам курса химии почв. М.: Университетская книга, 2009. 111 с.
Фершт Э. Структура и механизм действия ферментов. M.: Мир, 1980. 432 с.
Филонов А.Е., Петриков К.В., Якшина Т.В., Пунтус И.Ф., Власова Е.П., Нечаева И.А., Самойленко В.А. Режимы раздельного и совместного культивирования микроорганизмов-деструкторов нефти родов Pseudomonas и Rhodococcus // Биотехнология. 2008. № 6. С. 80–85.
Фонкен Г., Джонсон Р. Микробиологическое окисление. М.: Мир, 1976. С. 82.
Хазиев Ф.Х. Методы почвенной энзимологии. М.: Наука, 2005. 252 с.
Aitken C.M., Jones D.M., Maguire M.J., Gray N.D., Sherry A., Bowler B.F.J., Ditchfield A.K., Larter S.R., Head I.M. Evidence that crude oil alkane activation proceeds by different mechanisms under sulfate-reducing and methanogenic conditions // Geochim. Cosmochim. Acta. 2013. V. 109. P. 162–174. https://doi.org/10.1016/j.gca.2013.01.031
Allen C.C.R., Boyd D.R., Hempenstall F. Contrasting effects of a nonionic surfactant on the biotransformation of polycyclic aromatic hydrocarbons by soil bacteria // Appl. Environ. Microbiol. 1999. V. 65. P. 1335–1339.
Comino F., Aranda V., García-Ruiz R., Ayora-Cañada M.J., Domínguez-Vidal A. Infrared spectroscopy as a tool for the assessment of soil biological quality in agricultural soils under contrasting management practices // Ecological Indicators. 2018. V. 87. P. 117–126. https://doi.org/10.1016/j.ecolind.2017.12.046
Gao Y.-C., Wang J.-N., Xu J.-B., Kong X., Zhao L., Zeng D.-H. Assessing the quality of oil-contaminated saline soil using two composite indices // Ecological Indicators. 2013. V. 24. P. 105–112. https://doi.org/10.1016/j.ecolind.2012.06.005
Grimberg S.J., Stringfellow W.T., Aitken M.D. Quantifying the biodegradation of phenanthrene by Pseudomonas stutzeri P16 in the presence of a nonionic surfactant // App-l. Environ. Microbiol. 1996. V. 62. P. 2387–2392.
Khan F.I., Husain T., Hejazi R. An overview and analysis of site remediation technologies // J. Environ. Manage. 2004. V. 71. P. 95–122.
Roy D., Liu M., Wang G. Modeling of anthracene removal from soil columns by surfactant // J. Environ. Sci. Health Part Environ. Sci. Eng. 1994. V. 29. P. 197–213.
Sarkar D., Ferguson M., Datta R., Birnbaum S. Bioremediation of petroleum hydrocarbons in contaminated soils: Comparison of biosolids addition, carbon supplementation, and monitored natural attenuation // Environ. Pollution. 2005. V. 136. P. 187–195.
Stevenson F.J., Goh K.M. Infrared spectra of humic acids and related substances // Geochim. Cosmochim. Acta. 1971. V. 35. P. 471–483. https://doi.org/10.1016/0016-7037(71)90044-5
Stelmack P.L., Gray M.R., Pickard M.A. Bacterial adhesion to soil contaminants in the presence of surfactants // Appl. Environ. Microbiol. 1999. V. 65. P. 163–168.
Дополнительные материалы отсутствуют.