Почвоведение, 2020, № 3, стр. 366-371
Температурная чувствительность (Q10) базального дыхания как функция количества доступного углеродного субстрата, температуры и влажности
М. С. Громова a, А. И. Матвиенко a, М. И. Макаров b, Ш. К. Ченг c, О. В. Меняйло a, *
a Институт леса им. В.Н. Сукачева СО РАН, ФИЦ КНЦ СО РАН
660036 Красноярск, Академгородок, Россия
b МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
c Национальный университет Тайваня
10617 Тайбэй, Тайвань
* E-mail: menyailo@hotmail.com
Поступила в редакцию 22.10.2018
После доработки 06.05.2019
Принята к публикации 27.09.2019
Аннотация
Модифицирована методология определения температурной чувствительности базального дыхания. Она заключается в инкубации почвенных образцов при постоянной температуре (20 или 25°С) и высокочастотном измерении скорости образования СО2, с периодическим понижением температуры на 10°С на короткое время (2 ч), благодаря дополнительному автоматическому варьированию температуры почвенных образцов. Значение Q10 при этом рассчитывается как отношение средней скорости образования СО2 при высокой температуре (перед и после понижения температуры) от скорости, измеренной при низкой температуре. Показано, что концентрация вносимой глюкозы наиболее сильно влияет на Q10 минерализации углерода только в низких диапазонах температур (20–10°С). Температурный диапазон оказывает большее влияние на Q10 минерализации углерода, чем внесение глюкозы. Подтвержден эффект влажности почвы на температурную чувствительность минерализации С (Q10), которая убывает при увеличении влажности.
ВВЕДЕНИЕ
Повышение активности минерализации почвенного органического вещества и увеличение эмиссии СО2 из почв в атмосферу при потеплении – ключевой механизм положительного обратного отклика экосистем на глобальное изменение климата [8–14]. Положительным он называется потому, что потепление приводит к увеличению эмиссии СО2 – главного парникового газа, который дополнительно ускоряет потепление [17–19]. Большинство моделей глобального цикла углерода учитывают это взаимодействие, принимая, что скорость минерализации углерода увеличивается в два раза при повышении температуры на каждые 10°С (Q10 = 2) [12, 14]. Поскольку почвы являются главным источником СО2 в атмосфере [24, 26, 27], высокая вариабельность значений Q10 у разных типов почв может являться одной из причин неточностей моделей глобального цикла углерода.
Несмотря на наличие большого числа работ по температурной чувствительности, механизмы отклика и факторы, его обусловливающие, недостаточно изучены [20, 21]. Большинство исследователей измеряют скорость выделения СО2 при температурах, не позволяющих прямо рассчитать Q10. Полученные данные аппроксимируют различными моделями (Аррениуса [7], Вант Гоффа [29], Ллойда-Тэйлора [22] и др.), на основе которых рассчитывают Q10 и другие параметры температурной чувствительности. Неодинаковость моделей и математические ошибки являются источником высокой вариации значений Q10, полученных разными авторами [11, 12, 14, 18, 28, 31, 32].
В данной работе мы усовершенствовали методологию оценки Q10 базального дыхания – одного из ключевых индикаторов минерализации углерода в почвах путем автоматического регулярного изменения температуры [16]. Модификация заключается в дополнительном автоматическом варьировании температуры почвенных образцов: регулярном краткосрочном (на 2 ч) понижении температуры на 10°С. Краткосрочность понижения важна для предотвращения изменений в видовом составе микробного сообщества. Многие исследователи при определении Q10, наоборот, повышают температуру. При этом скорость минерализации увеличивается, что приводит к быстрому уменьшению доступного микроорганизмам субстрата [12, 18]. Дефицит субстрата занижает скорость выделения СО2 и, соответственно, Q10 минерализации почвенного органического вещества.
Цель работы – апробация усовершенствованного метода определения температурной чувствительности С-минерализации и установление влияния (1) добавления легкоразлагаемого органического субстрата (глюкозы) в широком диапазоне концентраций, (2) температурного диапазона и (3) влажности почвы (и взаимодействия этих факторов) на Q10 С-минерализации в серой лесной почве.
ОБЪЕКТЫ И МЕТОДЫ
Объект исследования
Исследовали образцы верхнего минерального горизонта серой лесной почвы (горизонт А), отобранные на глубине 0–10 см в трех березняках разнотравных в районе Академгородка (г. Красноярск). 80-летние березняки являются типичными экосистемами Красноярской лесостепи. Образцы, отобранные в разных березняках, смешивали в один. Полученный образец просеивали через сито (1 мм) для гомогенизации и удаления крупных корней. Время от сбора образцов до начала измерения потока СО2 составляло менее 2 ч, что позволяет говорить о динамике минерализации свежего органического вещества.
Измерение скорости образования СО2, расчет Q10 и варианты обработки
В 16 стеклянных сосудов объемом 0.5 л помещали по 100 г почвы, и в каждые два сосуда добавляли по 5 мл водного раствора глюкозы в концентрации 0 (контроль), 25, 125, 250, 500, 1250, 2500 и 5000 мкг С/г. Сосуды помещали в инкубатор с Пельте-охлаждением и программируемым температурным режимом фирмы (Memmert, Germany). Каждый сосуд соединяли через 16-портовый мультиплексер Li-Cor 8150 с инфракрасным анализатором СО2 Li-Cor 8100 (Li-Cor Incorporated, Lincoln, Nebraska, USA). Мультиплексер поочередно замыкал каждый из 16-ти сосудов в герметичную цепь на 1.5 мин, и по скорости накопления СО2 в сосуде рассчитывали скорость образования СО2 почвенным образцом. Пока в одном сосуде проводили измерение, остальные сосуды продували комнатным воздухом для предотвращения накопления СО2, избыточная концентрация которого лимитирует скорость образования СО2.
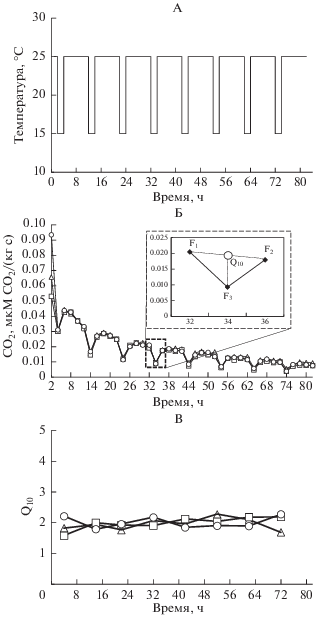
Всего провели три цикла измерений, каждый из которых длился трое суток. В циклах 1 (низкая влажность) и 3 (повышенная влажность) инкубацию проводили при 25°С с регулярным (каждые 8 ч) кратковременным (на 2 ч) понижением температуры до 15°С. График температурного режима во время инкубации представлен на рис. 1А. В цикле 3 помимо внесения раствора глюкозы была увеличена влажность почвенных образцов с 30 до 100% почвенной полевой влагоемкости. В цикле 2 (пониженная температура) температурный диапазон был на 5°С ниже (20–10°С). Измерение скорости образования СО2 проводили каждые 2 ч таким образом, чтобы при температуре 20 или 25°С было 4 измерения, а при температуре 10 или 15°С – одно (рис. 1В). Значение Q10 рассчитывали для каждого цикла понижения/повышения температуры по формуле: Q10 = (F1 + F2)/(2F3), где F1 и F2 – активность выделения СО2 при 25°С, до и после понижения температуры, F3 – активность выделения СО2 при 15°С.
Статистический анализ данных
Скорости образования СО2 и рассчитанные значения Q10 тестировали на нормальность распределения (тест Колмогорова–Смирнова) и однородность выборки (тест Левина). Затем раздельно для скорости образования СО2 и для значений Q10 проводили двухфакторный дисперсионный анализ вариации с повторяющимися измерениями. Двумя главными факторами были концентрация глюкозы (8 уровней – 8 концентраций, включая контроль) и цикл (три уровня – циклы 1–3). Повторяющимися измерениями были 40 временных точек для скорости образования СО2 и 8 точек для Q10. Анализ выявил отсутствие влияния времени на Q10, т.е. значения не изменялись во времени (рис. 1В). Поэтому для каждого варианта были посчитаны средние значения и проведен двухфакторный дисперсионный анализ как описано выше, но без повторяющихся измерений. Все эффекты были достоверными при Р < 0.050.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Q10 для скорости реакции определяется как коэффициент, показывающий во сколько раз скорость реакции возрастает с повышением температуры на каждые 10°С [7, 29]. Температурную чувствительность (Q10) минерализации углерода и базального дыхания изучают сейчас во всем мире [1, 5, 31]. Предложенная методика имеет следующие преимущества: 1) она основана на регулярном кратковременном понижении температуры, что позволяет учесть лимитирование скорости реакции субстратом, 2) расчет Q10 проводится без подгонки экспоненциальных моделей, что исключает математические ошибки и уменьшает трудозатраты, 3) автоматизация измерений увеличивает точность измерений, стандартизацию времени пребывания при той или иной температуре, повышает производительность [16]. Автоматизация измерений и высокая производительность потенциально позволяют экспериментально протестировать множество гипотез относительно влияния тех или иных субстратов или экологических факторов на Q10. Отметим, что автоматизация измерений скорости образования СО2 была предложена ранее [16], наш вклад заключается в автоматическом варьировании температуры и способе расчета Q10, учитывающим уменьшение скорости образования СО2 со временем. В настоящей работе тестировали влияние добавления глюкозы в разных концентрациях, а также влажности и температурного диапазона на Q10 базального дыхания.
На рис. 1А показан температурный режим во время инкубации в циклах 1 и 3, где температура периодически снижается с 25 до 15°С. Скорость образования СО2 в процессе инкубации почвы постепенно снижается, как в каждом цикле понижения температуры, так и на протяжении всего эксперимента (рис. 1Б). Последнее объясняется потерей легкодоступного углерода и постепенным высыханием образца из-за вентиляции сосудов воздухом [16]. Однако, несмотря на уменьшение активности со временем, рассчитанные значения Q10 колебались около 2, не изменялись со временем (рис. 1В), и не сильно различались между повторностями, т.е. метод дает стабильные результаты.
Скорость выделения СО2, как и предполагалось, оказалась ниже при 20°С, чем при 25°С (рис. 2). При увеличении влажности почвы наблюдалось резкое увеличение скорости потока СО2, т.е. свежие образцы были сухими, и влажность ограничивала активность микроорганизмов. Также ожидаемо фиксировали увеличение скорости образования СО2 с ростом концентрации глюкозы, поскольку скорость реакции зависит от количества субстрата.
Рис. 2.
Скорость образования СО2 при разных концентрациях добавленной глюкозы при максимальной температуре в трех циклах измерения (1 – низкая влажность (цикл 1), 2 – низкие температуры (цикл 2), 3 – повышенная влажность (цикл 3)).

Таблица 1.
Результаты двухфакторного дисперсионного анализа (значения Р). Показано влияние времени инкубации для первого дисперсионного анализа, влияние всех остальных факторов взято из второго дисперсионного анализа, где время не учитывалось, а были рассчитаны средние значения по времени
| Фактор | Значение P | |
|---|---|---|
| скорость выделения СО2 | Q10 | |
| Концентрация глюкозы | <0.001 | 0.235 |
| Цикл инкубации | <0.001 | <0.001 |
| Время | 0.045 | 0.187 |
| Концентрация × цикл | 0.160 | <0.001 |
Наибольший эффект на Q10 оказал температурный диапазон, т.е. при низких температурах (10–20°С), величина Q10 была значимо больше (рис. 3), чем при более высоких температурах (15–25°С). Уменьшение температурной чувствительности при повышении температурного диапазона отмечено Аррениусом [7, 12], причина этого явления заключается в том, что при увеличении температуры растет скорость реакции, но и уменьшается доступность (концентрация) субстрата, причем доступность субстрата уменьшается быстрее.
Рис. 3.
Зависимость Q10 для каждого из трех циклов от концентрации вносимой глюкозы (1 – низкая влажность (цикл 1), 2 – низкие температуры (цикл 2), 3 – повышенная влажность (цикл 3)).

Эффект концентрации вносимого С был отрицательным и наблюдался только в низких диапазонах температур (цикл 2). В высоких диапазонах температур, как при низкой, так и при высокой влажности, добавление глюкозы в разных концентрациях не оказывало сколько-нибудь существенного влияния на Q10 базального дыхания.
Ранее предложено две концепции влияния температуры на минерализацию углерода, связанные с качеством и доступностью органического вещества [12]. Концепция о качестве (кинетическая теория Аррениуса [7]) предполагает, что органическое вещество почвы – смесь разных веществ, каждое из которых обладает своей энергией активации, т.е. для минерализации этих веществ необходима некая минимальная температура. Большинство молекул органического вещества почв стабильно, т.е. имеет высокую энергию активации и начинает разлагаться при высоких температурах [12]. Напротив, глюкоза обладает низкой энергией активации может минерализоваться при более низких температурах, по этой же причине при внесении глюкозы микроорганизмы разлагают ее много быстрее, чем органическое вещество почв [12, 14]. Поэтому поток СО2 при внесении глюкозы, а также температурная чувствительность минерализации С должны определяться именно минерализацией глюкозы [10, 12, 20, 25, 28]. Таким образом, внесение глюкозы должно уменьшать Q10 минерализации С. Противоположное действие на Q10 оказывает доступность микроорганизмам органического субстрата. Причем речь идет о его доступности в местах ферментативной активности, т.е. в почвенном образце органического вещества в среднем может быть много, но его концентрация в местах реакций низкая. Возникает диффузионный транспорт, который зависит и от влажности, и от температуры. В целом уменьшение концентрации доступного субстрата приводит к занижению Q10, и именно этим объясняется уменьшение величины Q10 в более высоких диапазонах температур. В нашем исследовании экспериментально подтвердилась кинетическая теория Аррениуса, и наблюдалось увеличение значений Q10 при низких диапазонах температур (цикл 3) по сравнению с высокими диапазонами температур (рис. 3). Однако ни кинетическая теория Аррениуса, ни концепция о доступности не объясняют отсутствие влияния глюкозы и ее концентрации на Q10 базального дыхания в циклах 2 и 3. В более современных работах говорится о существенном влиянии на Q10 минерализации С прайминга – кратковременного изменения скорости минерализации С при добавлении углерода или азота [2, 32]. Мы предполагаем, что уменьшение величины Q10 минерализации С при увеличении концентрации глюкозы, которое наблюдали в низких диапазонах температур, связано именно с праймингом. Причем, прайминг, скорее всего, существует и в высоких диапазонах температур. Но при низких температурах величина Q10 базального дыхания стала больше, что сделало участие новых фракций органического вещества в минерализации более контрастными по Q10.
Если бы показатель Q10 минерализации глюкозы существенно отличался от Q10 минерализации органического вещества почв, то эффект добавления глюкозы наблюдали и в высоких диапазонах температур. В низких диапазонах температур, согласно кинетической теории Аррениуса, уменьшилась доля минерализуемого органического вещества, значимо вырос Q10 минерализации С. Мы предполагаем, что добавление глюкозы вызвало лимитацию развития микроорганизмов по азоту. Для его добычи микроорганизмы стали минерализовать то органическое вещество, которое минерализовалось при высоком диапазоне температур, но перестало – при низком. Минерализация этой фракции органического вещества за счет прайминга приблизила Q10 к значениям, наблюдаемым в верхних диапазонах температур. Это предположение подтверждает тот факт, что величина Q10 базального дыхания уменьшалась при добавлении глюкозы в тех концентрациях (25–1250 мкг С/г), при котором отмечается максимальный прайминг [15].
Не менее важный факт, подтвержденный в данном эксперименте – это уменьшение значений Q10 с увеличением влажности почвы (рис. 3). Наиболее вероятным объяснением уменьшения Q10 при повышении влажности является увеличение скорости диффузии органического вещества к местам локализации центров ферментативных реакций [3, 4, 6, 11, 23, 30], что подтверждает концепцию о влиянии доступности органического вещества на Q10 минерализации углерода.
Итак, экологические факторы по-разному влияют на Q10 минерализации почвенного органического вещества. Превалирующие теории (кинетическая Аррениуса и о доступности органического вещества) не объясняют всего многообразия эффектов. Добавление к ним теории о прайминге органического вещества и его температурной чувствительности может существенно улучшить понимание и предсказуемость поведения Q10 минерализации углерода при изменяющихся факторах окружающей среды.
ВЫВОДЫ
1. Подтверждено, что Q10 базального дыхания почв выше при низких диапазонах температур, а в высоких диапазонах уменьшается (согласно кинетической теории Аррениуса).
2. Впервые показано, что добавление глюкозы уменьшает Q10, наиболее четко этот эффект виден в низких диапазонах температур. Предложено, что прайминг ответственен за влияние глюкозы на величину Q10 минерализации С при низких температурах.
3. Подтвержден эффект влажности почвы на Q10. Повышение влажности почв уменьшает Q10 из-за увеличения диффузии органического вещества к местам локализации ферментативных реакций, подтверждая концепцию о влиянии лимитации субстратом Q10 минерализации С.
Список литературы
Евдокимов И.В., Юсупов И.А., Ларионова А.А., Быховец С.С., Глаголев М.В., Шавнин С.А. Тепловое воздействие факела попутного газа на биологическую активность почвы // Почвоведение. 2017. № 12. С. 1485–1493.
Журавлева А.И., Алифанов В.М., Благодатская Е.В. Влияние контрастных трофических условий на величины затравочного эффекта в серых лесных почвах // Почвоведение. 2018. № 2. С. 203–210.
Иванов А.В., Браун М., Татауров В.А. Сезонная и суточная динамика эмиссии СО2 из почв кедровых лесов южного Сихотэ-Алиня // Почвоведение. 2018. № 3. С. 297–303.
Курганова И.Н., Лопес де Гереню В.О., Галлардо Ланчо Х.Ф., Ем К.Т. Оценка скорости минерализации органического вещества почв в лесных экосистемах внутриконтинентального умеренного, средиземноморского и тропического муссонного климата // Почвоведение. 2012. № 1. С. 82–94.
Ларионова А.А., Квиткина А.К., Евдокимов И.В., Быховец С.С., Стулин А.Ф. Влияние температуры на интенсивность разложения лабильного и устойчивого органического вещества агрочернозема // Почвоведение. 2013. № 7. С. 803.
Ларионова А.А., Мальцева А.Н., Лопес де Гереню В.О., Квиткина А.К., Быховец С.С., Золотарева Б.Н., Кудеяров В.Н. Влияние температуры и влажности на минерализацию и гумификацию лиственного опада в модельном инкубационном эксперименте // Почвоведение. 2017. № 4. С. 438–448.
Arrhenius S. Uber die Reaktions geschwindigkeit bei der Inversion von Rohrzucker durch Sauren // Z. Phys. Chem. 1889. V. 4. P. 226–248.
Chapin S.F. III, McFarland J., McGuire D.A., Euskirchen E.S., Ruess R.W., Kielland K. The changing global C cycle: linking plant-soil C dynamics to global consequences // J. Ecology. 2009. V. 97. P. 840–850.
Cox P.M., Betts R.A., Jones C.D., Spall S.A., Totterdell I.J. Acceleration of global warming due to carbon-cycle feedbacks in a coupled climate model // Nature. 2000. V. 408. P. 184–187.
Dai S.S., Li L.J., Ye R., Zhu-Barker X., Horwath W.R. The temperature sensitivity of organic carbon mineralization is affected by exogenous carbon inputs and soil organic carbon content // Eur. J. Soil Biol. 2017. V. 81. P. 69–75.
Davidson E.A., Belk E., Boone R.D. Soil water content and temperature as independent or confound factors controlling soil respiration in a temperate mixed hardwood forest. // Global Change Biology. 1998. V. 4. P. 217–227.
Davidson E.A., Janssens I.A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change // Nature. 2006. V. 440. P. 166–169.
Davidson E.A., Janssens I.A., Luo Y. On the variability of respiration in terrestrial ecosystems: moving beyond Q10 // Global Change Biology. 2006. V. 12. P. 154–155.
Davidson E.A., Trumbore S.E., Amundson R. Soil warming and organic carbon content // Nature. 2000. V. 408. P. 789–790.
de Graaff M., Classen A.T., Castro H.F., Schadt C.W. Labile soil carbon inputs mediate the soil microbial community composition and plant residue decomposition rates // New Phytologist. 2010. V. 188. P. 1055–1064.
Heinemeyer H., Insam O., Kaiser E. A., Walenzik G. Soil microbial biomass and respiration measurements: An automated technique based on infra-red gas analysis // Plant and Soil. 1989. V. 116. № 2. P. 191–195.
Houghton R.A., Davidson E.A., Woodwell G.M. Missing sinks, feedbacks, and understanding the role of terrestrial ecosystems in the global carbon balance // Global Biogeochemical Cycles. 1998. V. 12. P. 25–34.
Karhu K., Auffret M.D., Dungait J.A., Hopkins D.W., Prosser J.I., Singh B.K., Subke J.A., Wookey P.A., Agren G.I., Sebastià M.T. et al. Temperature sensitivity of soil respiration rates enhanced by microbial community response // Nature. 2014. V. 513. № 7516. P. 81–84.
Kirschbaum M.U.F. The temperature dependence of soil organic matter decomposition, and the effect of global warming on soil organic C storage // Soil Biol. Biochem. 1995. V. 27. P. 753–760.
Larionova A.A., Yevdokimov I.V., Bykhovets S.S. Temperature response of soil respiration is dependent on concentration of readily decomposable C // Biogeosciences. 2007. V. 4. P. 1073–1081.
Liski J., Ilvesniemi H., Makela A., Westman K.J. CO2 emissions from soil in response to climatic warming are overestimated-The decomposition of old soil organic matter is tolerant of temperature // Ambio. 1999. V. 28. P. 171–174.
Lloyd J., Taylor J.A. On the temperature dependence of soil respiration // Funct. Ecology. 1994. V. 8. P. 315–323.
Lopes de Gerenyu V.O., Kurganova I.N., Rozanova L.N., Kudeyarov V.N. Effect of soil temperature and moistureon CO2 evolution rate of cultivated Phaeozem: analysis of a long-term field experiment // Plant Soil Environ. 2005. V. 51. № 5. P. 213–219.
Luo Y. Terrestrial carbon cycle feedback to climate warming // Annu. Rev. Ecol. Evol. Syst. 2007. V. 38. P. 683–712.
Min K., Lehmeier C.A., Billings S.A. Carbon availability modifies temperature responses of heterotrophic microbial respiration, carbon uptake affinity, and stable carbon isotope discrimination // Frontiers in Microbiology. 2016. V. 7. P. 2083.
Raich J.W., Schlesinger W.H. The global carbon dioxide flux in soil respiration and its relationship to vegetation and climate // Tellus B. 1992. V. 44. P. 81–99.
Schimel D.S., Braswell B.H., Holland E.A., McKeown R., Ojima D.S., Painter T.H., Parton W.J., Townsend A.R. Climatic, edaphic, and biotic controls over storage and turnover of carbon in soils // Global Biogeochemistry Cycles. 1994. V. 8. P. 279–293.
Song M., Jiang J., Cao G., Xu X. Effects of temperature, glucose and inorganic nitrogen inputs on carbon mineralization in a Tibetan alpine meadow soil // Eur. J. Soil Biol. 2010. V. 46. № 6. P. 375–380.
Van’t Hoff J.H. Lectures on Theoretical and Physical Chemistry. London: Edward Arnold, 1898. Part 1. Chemical Dynamics.
Zheng Z.M., Yu G.R., Fu Y.L., Wang Y.S., Sun X.M., Wang Y.H. Temperature sensitivity of soil respiration is affected by prevailing climatic conditions and soil organic carbon content: A trans-China based case study // Soil Biol. Biochem. 2009. V. 41. № 7. P. 1531–1540.
Zhou T., Shi P., Hui D., Luo Y. Global pattern of temperature sensitivity of soil heterotrophic respiration (Q10) and its implications for carbon-climate feedback // J. Geophysical Res. 2009. V. 114. P. 1–2.
Zhu B., Cheng W. Rhizosphere priming effect increases the temperature sensitivity of soil organic matter decomposition // Global Change Biology. 2011. V. 17. P. 2172–2183.
Дополнительные материалы отсутствуют.