Почвоведение, 2020, № 4, стр. 414-420
Изотопный состав углерода гумусовых кислот дерново-подзолистых почв и черноземов
М. И. Макаров a, *, Т. И. Малышева a, А. А. Гончаров b, А. В. Тиунов b
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт проблем экологии и эволюции им. А.Н. Северцова РАН
117071 Москва, Ленинский пр., 33, Россия
* E-mail: mmakarov@soil.msu.ru
Поступила в редакцию 24.05.2019
После доработки 25.07.2019
Принята к публикации 27.11.2019
Аннотация
Результаты изотопного анализа углерода органического вещества почв часто используются в палеоэкологических исследованиях для реконструкции климата и состава фитоценоза (типа фотосинтеза). Сложность интерпретации изотопных данных состоит в том, что соотношение изотопов 13С/12С в растениях и почвах контролируется комплексом факторов, включающих как условия окружающей среды, так и особенности состава органического вещества почв. На примере дерново-подзолистых почв (Albic Retisols) и черноземов выщелоченных (Luvic Chernozems) показано, что экстрагируемые гумусовые кислоты обогащены тяжелым изотопом 13С относительно общего органического вещества почв. В дерново-подзолистых почвах повышенные значения δ13С характерны для гуминовых кислот глубже гумусового горизонта и для фульвокислот во всем профиле, а в черноземах более “тяжелым” является только углерод фульвокислот. Таким образом, изменение изотопного состава углерода в почвах, в частности его “утяжеление” с глубиной, может быть связано с миграцией лабильных органических соединений по профилю и их аккумуляцией в более глубоких горизонтах.
ВВЕДЕНИЕ
Изучение изотопного состава биогенных элементов находит широкое применение в почвенных и экологических исследованиях. В частности, соотношение стабильных изотопов углерода (13С/12С) в почве используют в палеоэкологических исследованиях для реконструкции состава растительности и климата [8]. Такая возможность связана с существованием разных типов фотосинтеза, в результате чего формируется органическое вещество, различающееся по изотопному составу углерода (разница δ13С у растений с С3 и С4 типами фотосинтеза составляет ~14‰), и с наличием определенной связи между преобладающим в фитоценозе типом фотосинтеза и климатом. Поскольку изотопный состав углерода органического вещества, синтезированного растениями, в последующих процессах трансформации растительных остатков и гумификации изменяется несильно [2], то предоставляется возможность, изучая органическое вещество почв, определить, какой именно тип фотосинтеза доминировал при формировании почвенного гумуса.
Однако часто выводы об участии растений с разным типом фотосинтеза в формировании органического вещества почв основываются на незначительных (не более 2–4‰) изменениях δ13С в почвенном профиле [1, 3]. Но подобные и даже большие вариации (отличие δ13С на 5–6‰) могут наблюдаться среди растений одного типа фотосинтеза, и могут быть обусловлены как генетическими особенностями растений, так и влиянием факторов окружающей среды [27].
Факторы внешней среды оказывают влияние на изотопный состав углерода растений посредством регулирования эффективности фотосинтеза через изменение 1) газообмена между растением и атмосферой и 2) активности ферментной системы фотосинтеза. Главные среди таких факторов – это водный и осмотический стрессы, доступность элементов минерального питания, изменение температуры, освещенности и парциального давления СО2 [10, 27].
Другая возможная причина изменения изотопного состава углерода растений – это изменение δ13С углекислого газа атмосферного воздуха. Такое изменение (уменьшение) наблюдается при участии в процессе фотосинтеза значительной доли респираторного СО2, обедненного изотопом 13С, а также вследствие эффекта Зюсса – постепенного смещения изотопного отношения 13С/12С в СО2 атмосферы в сторону легкого изотопа в связи с поступлением в атмосферу все большего количества СО2, образующегося при сжигании ископаемого топлива [9, 27].
Кроме того, изменение δ13С органического вещества почвы в диапазоне нескольких единиц ‰ может контролироваться процессами трансформации растительного опада ‒ его минерализации, гумификации, миграции органических компонентов в почвенном профиле [20, 30]. При этом процессы фракционирования изотопов в почвах и в отдельных почвенных горизонтах также разнообразны. Среди наиболее обсуждаемых можно отметить 1) фракционирование в процессе микробного метаболизма, когда из почвы в составе СО2 удаляется преимущественно легкий изотоп 12С, и в составе органического вещества происходит прогрессивное увеличение доли микробного углерода, обогащенного тяжелым изотопом 13С [28]; 2) перераспределение в профиле отдельных органических продуктов фотосинтеза и их дериватов (гидрофильные углеводы обогащены, а гидрофобные липиды и лигнин обеднены изотопом 13С) [23]; 3) относительное обогащение изотопом 13С органического вещества тонких коллоидов, способных к миграции [7]; 4) более тяжелый изотопный состав углерода корней в сравнении с надземной частью растений [7, 28].
Причиной различий δ13С органического вещества почвы может быть также изменение состава гумуса (соотношение гуминовых кислот (ГК) и фульвокислот (ФК)) [6]. Однако подобные свидетельства единичны, и мы поставили задачу определить, насколько распространенным может быть влияние этого фактора на изотопный состав углерода органического вещества в профиле почв. Для этого мы изучили изменение δ13С общего органического вещества и отдельных групп гумусовых кислот (ГК и ФК) в профилях двух достаточно контрастных типов почв – дерново-подзолистой и чернозема.
ОБЪЕКТЫ И МЕТОДЫ
Образцы дерново-подзолистых почв (Albic Retisols) собраны в Центрально-лесном государственном природном заповеднике (Тверская область, Нелидовский район). Образцы отбирали из трех разрезов, профили которых заметно отличались по строению и мощности горизонтов в верхних 35–45 см: O(1–2 см)–AY (1–7/20 см)–EL(7–35/45 см) или АЕL(20–36 см)–BEL(35–60/65 см)–BT1(60–72/84 см)–BT2 (72–110/120 см). Образцы отобраны с поверхности горизонта AY–0–2 см, далее через каждые 10 см до глубины 50 см, затем через 20 см до глубины 90 см.
Образцы черноземов глинисто-иллювиальных (Luvic Chernozems) собраны в Островцовской лесостепи (Пензенская область, Колышлейский район, водораздел рек Арчада и Хопёр). Образцы отбирали также из трех разрезов. Все профили черноземов близки по строению: AU(0–60/70 см)–AUB(70–90/100 см)–BI(100–110/120 см)–BCA(120–200 см). Отобраны образцы с поверхности горизонта AU–0–2 см, далее через каждые 20 см до глубины 120 см.
На обоих участках были также отобраны образцы растений (листья отдельных видов деревьев, смешанные образцы надземной части травянистых растений и тонкие корни с глубины 0–10 см).
В почвах определяли общее содержание углерода (Собщ) и его изотопный состав (δ13Собщ). Из образцов экстрагировали гуминовые кислоты (ГК) и фульвокислоты (ФК) с использованием 0.1 н NaOH при соотношении почва/раствор 1/8. Образцы черноземов перед щелочной экстракцией проверялись на вскипание при взаимодействии с 10% HCl (во вскипающих образцах карбонаты разрушали 2%-ной HCl и отмывали от кальция 0.1 н. HCl).
При щелочной экстракции в раствор добавляли 0.5 М K2SO4 (конечная концентрация 0.05 М) для коагуляции коллоидов. После суточного настаивания проводилось центрифугирование (15 мин, 5000 об./мин). В полученном экстракте (сумма ГК и ФК) определяли концентрацию углерода (СГК + ФК). После этого проводили осаждение ГК, добавляя в экстракт 10% H2SO4. Разделение ГК и ФК проводили центрифугированием. В растворе ФК определяли концентрацию углерода (СФК). Концентрацию углерода ГК (СГК) рассчитывали по разности между СГК + ФК и СФК. Таким образом, в данной работе в качестве ФК мы рассматриваем общую кислоторастворимую фракцию экстрагируемого щелочью органического вещества почв, а не специфическую фракцию, получаемую на каких-либо сорбентах (активированный уголь, XAD, DAX).
Для определения изотопного состава углерода гумусовых кислот пробы раствора ФК (δ13СФК) и осадка ГК (δ13СГК) выпаривали на водяной бане в фарфоровых чашках при 60°C, и образовавшийся осадок использовали для анализа (для ГК только верхние 5 образцов, из которых удалось получить необходимое для анализа количество препарата).
Общее содержание углерода в почвах определяли на анализаторе Carlo Erba NC 2500 (Carlo Erba, Rodano, Italy), концентрацию в жидких пробах ‒ на анализаторе TOC-VCPN (Shimadzu Corporation, Kyoto, Japan) (растворы перед анализом разбавляли в 10–100 раз в зависимости от исходной концентрации). Изотопный состав углерода в почвах, гумусовых кислотах и растениях определяли на масс-спектрометре Delta V Plus (Thermo Fisher Scientific, USA).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Содержание и состав органического вещества в почвах. В соответствии с различием в строении и мощности горизонтов в верхней части профиля трех разрезов дерново-подзолистых почв концентрация Собщ в образцах, отобранных по глубинам, сильно варьировала (табл. 1). В поверхностном слое гумусового горизонта содержится 34.7–114.3 мг С/г, на глубине 10 см – 10.9–54.2 мг/г, а на глубине 20 см – 3.3–21.5 мг/г. Только с глубины 40–50 см во всех разрезах концентрация углерода приблизительно одинаково низкая (убывает с глубиной с 6.4–3.1 до 1.3–3.1 мг/г). В табл. 1 приведены средние концентрации для двух типов почв.
Таблица 1.
Средняя концентрация углерода разных фракций органического вещества в трех разрезах дерново-подзолистой почвы и чернозема (n = 3), мг/г, среднее ± стандартное отклонение
| Горизонт | Глубина, см | Cобщ | CГК | CФК | CГК + ФК, % от Cобщ | СГК/СФК |
|---|---|---|---|---|---|---|
| Дерново-подзолистая почва | ||||||
| AY | 2 | 73.5 ± 39.8 | 5.5 ± 3.9 | 7.1 ± 3.0 | 17.2 ± 1.3 | 0.7 ± 0.3 |
| AY | 10 | 32.0 ± 21.7 | 2.3 ± 1.8 | 2.7 ± 1.6 | 16.0 ± 2.1 | 0.8 ± 0.2 |
| AE | 20 | 12.4 ± 9.1 | 1.1 ± 0.8 | 1.2 ± 0.6 | 21.6 ± 7.3 | 0.8 ± 0.3 |
| AE | 30 | 7.5 ± 5.3 | 0.5 ± 0.3 | 0.8 ± 0.3 | 19.9 ± 5.2 | 0.7 ± 0.2 |
| EB | 40 | 4.5 ± 1.7 | 0.4 ± 0.2 | 0.7 ± 0.3 | 24.2 ± 4.8 | 0.7 ± 0.3 |
| EB | 50 | 4.0 ± 2.2 | 0.4 ± 0.3 | 0.6 ± 0.4 | 23.5 ± 4.8 | 0.6 ± 0.2 |
| BT | 70 | 2.1 ± 0.9 | 0.16 ± 0.02 | 0.3 ± 0.1 | 25.5 ± 8.4 | 0.5 ± 0.2 |
| BT | 90 | 2.1 ± 0.9 | 0.13 ± 0.04 | 0.3 ± 0.1 | 22.5 ± 8.5 | 0.5 ± 0.2 |
| Чернозем | ||||||
| AU | 2 | 141.8 ± 25.3 | 14.2 ± 1.6 | 8.3 ± 0.6 | 16.3 ± 4.1 | 1.7 ± 0.3 |
| AU | 20 | 61.2 ± 0.5 | 7.0 ± 1.0 | 4.1 ± 0.6 | 18.2 ± 1.8 | 1.7 ± 0.3 |
| AU | 40 | 48.9 ± 0.9 | 4.7 ± 0.4 | 2.9 ± 0.5 | 15.5 ± 1.0 | 1.6 ± 0.4 |
| AU | 60 | 33.4 ± 0.7 | 3.3 ± 0.3 | 1.9 ± 0.5 | 15.6 ± 2.3 | 1.7 ± 0.4 |
| AUB | 80 | 20.3 ± 8.7 | 3.4 ± 0.8 | 1.9 ± 0.7 | 28.0 ± 5.8 | 1.9 ± 0.4 |
| BI | 100 | 7.2 ± 1.3 | 0.7 ± 0.2 | 1.0 ± 0.3 | 25.6 ± 11.3 | 0.7 ± 0.1 |
| BCA | 120 | 7.4 ± 2.1 | 0.6 ± 0.1 | 0.9 ± 0.2 | 22.0 ± 9.0 | 0.7 ± 0.2 |
В разных разрезах черноземов концентрация Собщ различается гораздо меньше (112.8–159.0 мг/г в приповерхностном слое гумусового горизонта, 48.0–49.8 мг/г на глубине 40 см и 5.7–7.9 мг/г глубже гумусового горизонта).
В составе экстрагируемого органического вещества дерново-подзолистых почв преобладают ФК, участие которых возрастает с глубиной. Соотношение СГК/СФК составляет 0.7–0.8 в верхней части профиля и 0.5–0.6 – в нижней. В индивидуальных разрезах этот показатель, подобно содержанию органического вещества, также заметно различается, составляя 0.5–1.0 в верхней части профиля и 0.3–0.7 – в нижней.
Среди экстрагируемых гумусовых кислот черноземов до глубины 80 см преобладают ГК. Среднее соотношение СГК/СФК составляет 1.6–1.9, хотя в индивидуальных разрезах варьирует от 1.3 до 2.2. С глубины 100 см (в подгумусовой части профиля) начинают преобладать ФК, и соотношение СГК/СФК уменьшается до 0.7 (0.5–0.9 в индивидуальных разрезах).
Изотопный состав углерода органического вещества почв. Изотопный состав углерода органического вещества в изученных почвах соответствует С3 фотосинтезу. Величина δ13Собщ в верхней части гумусового горизонта составляет от –27.2 до ‒28.3‰ в дерново-подзолистых почвах и от –26.4 до –26.6‰ в черноземах (рис. 1). Несколько больший показатель для органического вещества черноземов соответствует различию в изотопном составе углерода растений, произрастающих на разных почвах. Так, у растений на дерново-подзолистых почвах величина δ13С составляет от –28.7 до –29.3‰ в листьях и от –31.1 до –32.7‰ в корнях. Растения же на черноземах характеризуются величиной δ13С от –27.1 до –27.9‰ в листьях и от –25.9 до –26.8‰ в корнях. Таким образом, подтверждается наследование изотопного состава углерода растений углеродом органического вещества почв и хорошо известная отрицательная взаимосвязь между изотопным составом углерода растений (величиной δ13С) и их водообеспеченностью [1, 12, 21, 25, 26, 29]. Очевидно, что меньшая водообеспеченность растений на черноземах контролирует снижение проводимости устьиц и, следовательно, повышенную эффективность фотосинтеза, которая, в свою очередь, ведет к меньшему фракционированию изотопов углерода и большей (менее отрицательной) величине δ13С в растениях.
Рис. 1.
Изотопный состав углерода разных фракций органического вещества в дерново-подзолистой почве (А) и черноземе (Б), n = 3, среднее ± стандартное отклонение: 1 – Cобщ, 2 – CГК, 3 – CФК.
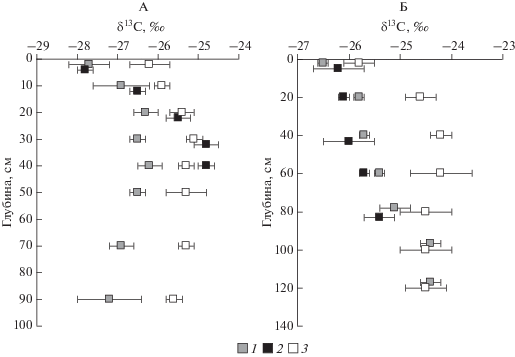
С глубиной в почве изотопный состав углерода становится более “тяжелым”. В дерново-подзолистых почвах “утяжеление” происходит до глубины 40–50 см (δ13Собщ ~ –26‰), а затем величина δ13С снова уменьшается до величин, характерных для верхней части профиля. В черноземах δ13Собщ увеличивается до глубины 100 см (до ~–24‰) и только глубже стабилизируется.
Изменение δ13Собщ с глубиной в профиле изученных почв, как по направленности (увеличение), так и по величине (1.5–2.0‰) соответствует показанному во многих работах “утяжелению” углерода органического вещества от верхних к нижним горизонтам почвы [4, 14, 15, 22]. Относительно небольшое увеличение δ13Собщ, на первый взгляд, может показаться неожиданным, так как в почвенном профиле одновременно могут действовать несколько факторов, способствующих аккумуляции 13С в нижних горизонтах.
Прежде всего, это изотопное фракционирование в процессе трансформации органического вещества, которое представлено относительно “молодыми” компонентами вблизи поверхности и более “старыми”, подвергшимися большему селективному отбору устойчивых и минерализации лабильных соединений, в более глубоких горизонтах. Микроорганизмы, разлагающие органическое вещество, преимущественно используют для дыхания легкий изотоп 12С, который теряется из почвы в составе СО2. В итоге происходит обогащение тяжелым изотопом 13С остаточного органического вещества и биомассы почвенных организмов. В процессе гумификации происходит увеличение доли микробного углерода, обогащенного 13С, в составе органического вещества почв, более выраженное в глубоких горизонтах [2, 14, 20, 28, 31].
Помимо этого, перераспределение в почвенном профиле отдельных групп биохимических соединений и тонких гранулометрических фракций также направлено на “утяжеление” изотопного состава углерода с глубиной. Гидрофильные компоненты, например углеводы, несколько обогащенные изотопом 13С, могут относительно легко мигрировать вниз по профилю с потоками растворенного органического углерода и накапливаться там. Гидрофобные же компоненты, такие как липиды или лигнин, обедненные 13С, избирательно сорбируются в верхней части почвенного профиля [13, 17, 18, 23]. Также в профиле преимущественно мигрируют тонкие коллоиды, углерод органического вещества которых в большей степени представлен микробными метаболитами, относительно обогащенными изотопом 13С [7, 19].
Наконец, в поверхностный горизонт почвы может поступать преимущественно опад надземных частей растений, тогда как более глубокие горизонты получают органическое вещество в виде корневого опада. Известно, что δ13С в корнях на 1–2‰ больше, чем в надземных частях растений [5, 7, 28]. Таким образом, с глубиной влияние “легкого” углерода надземных частей растений может ослабевать, а влияние более “тяжелого” углерода корней усиливаться.
Несмотря на совокупное однонаправленное действие нескольких факторов, обеспечивающих аккумуляцию изотопа 13С с глубиной, селективный отбор разных биохимических компонентов растительного опада в поцессе гумификации, вероятно, оказывается эффективным механизмом сглаживающим профильную дифференциацию величины δ13Собщ. Известно, что изотопный состав углерода отличается в разных биохимических соединениях. Так, в наибольшей степени изотопом 13С обогащены углеводы и белки, тогда как величина δ13С у липидов и лигнина на 3–5‰ меньше [11, 16, 17]. В результате, на продукцию СО2 преимущественно расходуются быстрее утилизируемые микроорганизмами относительно обогащенные 13С соединения, тогда как медленно трансформируемые компоненты, обедненные тяжелым изотопом углерода, накапливаются в почве в составе органического вещества, что и способствует уменьшению суммарного эффекта от процессов, способствующих аккумуляции 13С в почвенном профиле.
Изотопный состав углерода экстрагируемых гумусовых кислот (ФК и ГК) существенно различается. В дерново-подзолистой почве δ13СГК соответствует δ13Собщ в гумусовом горизонте и превышает ее на 1–1.5‰ в более глубоких горизонтах. Таким образом, для ГК характерно наибольшее увеличение δ13С с глубиной (от ~–28 до ~–25‰). Величина δ13СФК на 1–1.5‰ больше, чем δ13Собщ по всему профилю, увеличивается на ~1‰ глубже гумусового горизонта и характеризуется стабильностью во всей подгумусовой части профиля (рис. 1).
В черноземе δ13СГК соответствует δ13Собщ во всем профиле. Вплоть до 80 см увеличение δ13СГК только в одном разрезе достигает 2‰, тогда как в двух других этот показатель увеличивается не более чем на 1‰. Подобно подзолистой почве, δ13СФК в черноземе на 1–1.5‰ больше, чем δ13Собщ (до глубины 60 см) и, увеличиваясь на ~1‰ от поверхности к глубине 20 см, остается стабильной по всему профилю, включая его гумусовую и подгумусовую части.
Таким образом, различия в изотопном составе углерода отдельных гумусовых соединений не являются универсальными. В разных почвах и горизонтах наиболее “тяжелым” оказывается СГК (нижние горизонты дерново-подзолистой почвы) или СФК (чернозем и гумусовый горизонт дерново-подзолистой почвы). Ранее указывалось, что δ13СФК на 1.2–2.0‰ превышает δ13СГК, что может быть связано с разным участием углерода индивидуальных биохимических соединений в составе молекул разных групп гумусовых кислот (фульвокислоты в большей степени наследуют гидрофильные компоненты относительно обогащенные изотопом 13С) [6, 24]. Кроме того, различия в изотопном составе СГК и СФК в разных условиях почвообразования лишь отчасти соответствуют различию изотопного состава общего углерода органического вещества почвы. Так, величина δ13СФК в черноземе характеризуется на ~1‰ большими значениями в сравнении с дерново-подзолистой почвой, но величина δ13СГК, напротив, больше в нижних горизонтах дерново-подзолистой почвы.
ЗАКЛЮЧЕНИЕ
Сопоставление изотопного состава углерода трех изученных пулов органического вещества почв показывает, что углерод экстрагируемого органического вещества характеризуется повышенными значениями δ13С в сравнении с общим углеродом. В дерново-подзолистой почве наибольшие значения δ13С отмечены для ГК в нижней части профиля, тогда как в черноземе – для ФК. Утяжеление изотопного состава углерода органического вещества почв с глубиной может быть связано с миграцией по профилю лабильных органических соединений, представленных преимущественно фульвокислотами, и их аккумуляцией в более глубоких горизонтах. Состав гумуса, миграция и относительная аккумуляция геохимически лабильных компонентов органического вещества в профиле могут вносить вклад в формирование изотопного состава органического вещества почвы в разных горизонтах, что следует учитывать, в частности, при интерпретации результатов изотопного анализа погребенных почв.
Список литературы
Алексеев А.О., Калинин П.И., Алексеева Т.В. Почвенные индикаторы параметров палеоэкологических условий на юге Восточно-Европейской равнины в четвертичное время // Почвоведение. 2019. № 4. С. 389–399.
Моргун Е.Г., Ковда И.В., Рысков Я.Г., Олейник С.А. Возможности и проблемы использования методов геохимии стабильных изотопов углерода в почвенных исследованиях (обзор литературы) // Почвоведение. 2008. № 3. С. 299–310.
Рысков Я.Г., Величко А.А., Николаев В.И., Олейник С.А., Тимирева С.Н., Нечаев В.П., Панин П.Г., Морозова Т.Д. Реконструкция палеотемператур и осадков в плейстоцене по изотопному составу гумуса и карбонатов лёссов Русской равнины // Почвоведение. 2008. № 9. С. 1062–1070.
Acton P., Fox J., Campbell E., Rowe H., Wilkinson M. Carbon isotopes for estimating soil decomposition and physical mixing in well-drained forest soils // J. Geophys. Res.: Biogeosciences. 2013. V. 118. P. 1532–1545.
Badeck F.W., Tcherkez G., Nogues S., Piel C., Ghashghaie J. Post-photosynthetic fractionation of stable carbon isotopes between plant organs ‒ a widespread phenomenon // Rapid Communications in Mass Spectrometry. 2005. V. 19. P. 1381–1391.
Balesdent J., Mariotti A. Measurement of soil organic matter turnover using 13C natural abundance // Mass Spectrometry of Soils / Eds. Boutton T.W., Yamasa-ki S.-I. New York: Marcel Dekker, 1996. P. 83–111.
Bird M., Kracht O., Derrien D., Zhou Y. The effect of soil texture and roots on the stable carbon isotope composition of soil organic carbon // Australian J. Soil Res. 2003. V. 41. P. 77–94.
Boutton T.W. Stable carbon isotope ratios of soil organic matter and their use as indicators of vegetation and climate change // Mass Spectrometry of Soils / Eds.: Boutton T.W., Yamasaki S.-I. New York: Marcel Dekker, 1996. P. 47–82.
Brooks J.R., Flanagan L.B., Varney G.T., Ehleringer J.R. Vertical gradients in photosynthetic gas exchange characteristics and refixation of respired CO2 within boreal forest canopies // Tree Physiol. 1997. V. 17. P. 1–12.
Buchmann N., Brooks J.R., Flanagan L.B., Ehleringer J.R. Carbon isotope discrimination of terrestrial ecosystems // Stable isotopes – Integration of biological, ecological and geochemical processes / Ed. Griffiths H. Oxford: BIOS Scientific Publishers, 1998. P. 203–221.
Deiness P. The isotopic composition of reduced organic carbon // Handbook of Environmental Isotope Geochemistry. Amsterdam: Elsevier, 1980. P. 329–406.
Diefendorf A.F., Mueller K.E., Wing S.L., Koch P.L., Freeman K.Y. Global patterns in leaf 13C discrimination and implications for studies of past and future climate // Proceedings National Academy Sci. 2010. V. 107. P. 5738–5743.
Dümig A., Rumpel C., Dignac M.F., Kögel-Knabner I. The role of lignin for the δ13C signature in C-4 grassland and C-3 forest soils // Soil Biol. Biochem. 2013. V. 57. P. 1–13.
Ehleringer J.R., Buchmann N., Flanagan L.B. Carbon isotope ratios in belowground carbon cycle processes // Ecolog. Appl. 2000. V. 10. P. 412–422.
Garten C.T., Cooper L.W., Post W.M., Hanson P.J. Climate controls on forest soil C isotope ratios in the Southern Appalachian Mountains // Ecology. 2000. V. 81. P. 1108–1119.
Hayes J.M. Fractionation of carbon and hydrogen isotopes in biosynthetic processes // Rev. Mineral. Geochem. 2001. V. 43. P. 225–277.
Hobbie E.A., Werner R.A. Intramolecular, compound–specific, and bulk carbon isotope patterns in C–3 and C–4 plants: a review and synthesis. New Phytologist. 2004. V. 161. P. 371–385.
Kaiser K., Kalbitz K. Cycling downwards ‒ dissolved organic matter in soils // Soil Biol. Biochem. 2012. V. 52. P. 29–32.
Kahle M., Kleber M., Torn M.S., Jahn R. Carbon storage in coarse and fine clay fractions of illitic soils // Soil Sci. Soc. Am. J. 2003. V. 67. P. 1732–1739.
Lerch T.Z., Nunan N., Dignac M.F., Chenu C., Mariotti A. Variations in microbial isotopic fractionation during soil organic matter decomposition // Biogeochemistry. 2011. V. 106. P. 5–21.
Marshall J.D., Brooks J.R., Lajtha K. Sources of variation in the stable isotopic composition of plants // Stable Isotopes in Ecology and Environmental Science / Eds. Michener R., Lajtha K. Blackwell Publishing, 2007. P. 22–60.
Marty C., Houle D., Garton C. Effect of the relative abundance of conifers versus hardwoods on soil δ13C enrichment with soil depth in Eastern Canadian forests // Ecosystems. 2015. V. 18. P. 629–642.
Nakanishi T., Atarashi-Andoh M., Koarashi J., Saito-Kokubu Y., Hirai K. Carbon isotopes of water-extractable organic carbon in a depth profile of forest soil imply a dynamic relationship with soil carbon // Eur. J. Soil Sci. 2012. V. 63. P. 495–500.
Nissenbaum A., Kaplan I.R. Chemical and isotopic evidence for in situ origin of marine humic substances // Limnology and Oceanography. 1972. V. 17. P. 570.
Stewart G.R., Turnbull M.H., Schmidt S., Erskine P.D. 13C natural abundance in plant communities along a rainfall gradient: a biological integrator of water availability // Functional Plant Biol. 1995. V. 22. P. 51–55.
Swap R.J., Aranibar J.N., Dowty P.R., Gilhooly W.P., Macko S.A. Natural abundance of 13C and 15N in C3 and C4 vegetation of southern Africa: patterns and implications // Global Change Biol. 2004. V. 10. P. 350–358.
Tieszen L.L. Natural variations in the carbon isotope values of plants: Implications for archaeology, ecology, and paleoecology // J. Archaeol. Sci. 1991. V. 18. P. 227–248.
Werth M., Kuzyakov Y. 13C fractionation at the root–microorganisms–soil interface: a review and outlook for partitioning studies // Soil Biol. Biochem. 2010. V. 42. P. 1372–1384.
Wu Y., Wang B., Chen D. Regional-scale patterns of δ13C and δ15N associated with multiple ecosystem functions along an aridity gradient in grassland ecosystems // Plant and Soil. 2018. V. 432. P. 107–118.
Wynn J.G. Carbon isotope fractionation during decomposition of organic matter in soils and paleosols: Implications for paleoecological interpretations of paleosols // Palaeogeography Palaeoclimatology Palaeoecology. 2007. V. 251. P. 437–448.
Wynn J.G., Bird M.I., Wong V.N.L. Rayleigh distillation and the depth profile of 13C/12C ratios of soil organic carbon from soils of disparate texture in Iron Range National Park, Far North Queensland, Australia // Geochim. Cosmochim. Acta. 2005. V. 69. P. 1961–1973.
Дополнительные материалы отсутствуют.


