Почвоведение, 2020, № 5, стр. 547-558
Влияние растений с эрикоидной микоризой и эктомикоризой на свойства почвы злакового луга в горной тундре Хибин
М. И. Макаров a, *, Т. И. Малышева a, М. С. Кадулин a, Н. В. Верховцева a, Р. В. Сабирова a, В. О. Лифанова a, А. И. Журавлева b, М. М. Карпухин a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт физико-химических и биологических проблем почвоведения, Пущинский НЦ РАН
142290 Московская область, Пущино, ул. Институтская, 2, Россия
* E-mail: mmakarov@soil.msu.ru
Поступила в редакцию 21.08.2019
После доработки 17.09.2019
Принята к публикации 27.11.2019
Аннотация
Изучение влияния растений с разным типом микоризного симбиоза на процессы трансформации соединений углерода, азота и фосфора в почвах важно в связи с необходимостью прогноза изменения циклов биогенных элементов при изменении структуры фитоценозов в меняющихся условиях окружающей среды. Изучено влияние на свойства почвы (Umbric Leptosol) злакового луга в горной тундре Хибин присутствия в составе фитоценоза кустарничков (Empetrum hermaphroditum, Vaccinium myrtillus, Vaccinium uliginosum, Vaccinium vitis-idaea) с эрикоидной микоризой (ЭРМ) и кустарника (Betula nana) с эктомикоризой (ЭКМ). Показано, что при наличии растений с ЭРМ и ЭКМ в почве увеличивается содержание подвижного минерального и органического фосфора, экстрагируемого органического азота, соотношение С/N в микробной биомассе, но уменьшается содержание нитратов, активности N-минерализации и нитрификации, а также соотношения С/N и С/P в экстрагируемом органическом веществе. Повышенная активность глюкозидазы, хитиназы и фосфатазы свидетельствует об активности экзоферментов ЭРМ грибов даже при высокой доступности неорганических азота и фосфора.
ВВЕДЕНИЕ
В последние десятилетия отмечается повышение участия кустарничков и кустарников в составе фитоценозов арктической/субарктической тундры и альпийских лугов [19, 23, 38, 42]. Растения в процессе жизнедеятельности могут изменять почвенные свойства через разные механизмы, например, в результате избирательного поглощения элементов минерального питания, поступления в почву органического вещества и ассоциированных с ним элементов в составе растительного опада или в составе корневых выделений, имеющих разный химический и биохимический состав [34]. Изменение соотношения растений, образующих разные типы микоризы, может привести к сдвигу таких ключевых параметров функционирования экосистем, как круговорот углерода и азота. Это связано с разной ферментативной активностью грибов, образующих эктомикоризу (ЭКМ) и эрикоидную микоризу (ЭРМ) у кустарников и кустарничков, с одной стороны, и арбускулярную микоризу (АРМ), характерную для трав – с другой. Первые продуцируют окислительные и гидролитические ферменты, активно воздействующие на органическое вещество почвы и мобилизующие из него элементы минерального питания, тогда как вторые обладают гораздо меньшей ферментативной активностью [4, 21, 24, 37, 43].
Вопрос о роли разных типов микоризы в биогеохимических циклах важнейших биогенных элементов и обеспечении минерального питания растений изучается преимущественно при сравнении почв лесных экосистем, в которых доминируют древесные виды растений с ЭКМ или АРМ [17, 27, 28]. Вместе с тем ЭРМ вересковых кустарничков характеризуется наибольшей активностью экзофементов, способных трансформировать органическое вещество почв [39, 49, 50]. С другой стороны, вересковые растения продуцируют большое количество полифенолов (танинов), образующих в почве устойчивые полифенол-белковые комплексы [26, 30], что может способствовать повышенной аккумуляции органического вещества в почве [18]. К этому же может приводить снижение активности разложения органического вещества свободноживущими сапротрофными микроорганизмами, которые начинают испытывать дефицит азота из-за поглощения его микоризными грибами [35].
Вересковые кустарнички широко распространены в экосистемах холодного климата, но исследования, в которых роль ЭРМ и ЭКМ в циклах углерода и элементов минерального питания оценивалась в арктических/субарктических и высокогорных экосистемах, представлены несравнимо меньше, чем исследования ЭКМ и АРМ в лесах. Подобные работы основаны, преимущественно, на сравнении разных экосистем с доминированием растений с разными типами микоризы [42]. Такой подход подразумевает формирование экосистем в исходно разных геоморфологических или литологических условиях и затрудняет оценку влияния типа микоризы на биогеохимические процессы.
Ранее мы оценили влияние брусники (Vaccinium vitis-idaea), образующей ЭРМ, на свойства почвы альпийской лишайниковой пустоши на Северном Кавказе. Исследование показало, что различия в свойствах почвы в присутствии и отсутствии кустарничка в составе фитоценоза, в целом, соответствуют представлениям о мобилизации органического вещества почвы экзоферментами, продуцируемыми ЭРМ. Концентрации углерода и азота экстрагируемого органического вещества и микробной биомассы, рост микробной активности свидетельствуют о повышении доступности азота для питания почвенных микроорганизмов и растений в присутствии V. vitis-idaea [7].
В горной тундре Хибин кустарнички и кустарники с ЭРМ и ЭКМ не только являются основными компонентами фитоценозов тундровых пустошей на бедных почвах, но и произрастают в аккумулятивных геохимических позициях на тундровых луговинах, характеризующихся высокими концентрациями доступных форм элементов минерального питания в почве [3, 5]. Такие местообитания принципиально отличаются от альпийских лишайниковых пустошей Кавказа, почвы которых содержат наименьшие количества неорганических соединений азота и фосфора в сравнении с другими альпийскими экосистемами [6, 8]. Неизвестно, насколько функция ЭРМ и ЭКМ по трансформации органического вещества и мобилизации элементов минерального питания, активно протекающая в почвах с низкой доступностью азота и фосфора растениям, выражена в условиях их повышенной доступности.
Для проверки этого сравнили свойства почвы злакового луга в горной тундре Хибин при наличии и отсутствии в составе фитоценоза кустарничков и кустарника, образующих ЭРМ и ЭКМ.
ОБЪЕКТЫ И МЕТОДЫ
Объектом исследования послужила почва злакового луга, занимающего аккумулятивную геохимическую позицию в мезорельефе горной тундры Хибин на восточном склоне горы Вудъяврчорр в Ботаническом цирке Полярно-альпийского ботанического сада-института (570 м над ур. м.). Травяная растительность (преимущественно Deschampsia flexuosa, Gnaphalium norvegicum, Juncus trifidus, Nardus stricta, Solidago virgaurea), образующая арбускулярную микоризу, составляет основу фитоценоза, в котором отдельными куртинами встречаются кустарник (Betula nana) с ЭКМ, и кустарнички (Empetrum hermaphroditum, Vaccinium myrtillus, Vaccinium uliginosum, Vaccinium vitis-idaea), образующие ЭРМ.
Почва представлена литоземом перегнойно-темногумусовым (Umbric Leptosol). На поверхности присутствует маломощный (1–2 см) органогенный подстилочно-торфяный горизонт O (40.7% С, 1.4% N), под которым залегает перегнойно-темногумусовый горизонт АН, также содержащий большое количество органического вещества (14.6% С) и азота (0.91%) [3].
Для исследования отбирали по 10 образцов почвы из верхних 5 см горизонта АН на участках со злаковой растительностью (контроль) и на участках с кустарником и кустарничками (всего 6 вариантов). При отборе образцов оценивали мощность почвы (щупом до глубины залегания камня). Образцы замораживали в течение нескольких часов после отбора и хранили в таком состоянии до проведения лабораторных исследований.
После размораживания в образцах определяли влажность, каменистость (>2 мм), кислотность (pH водной суспензии), содержание подвижного неорганического фосфора (Рмин) по методу Кирсанова (экстракция 0.2 M HCl). Лабильные соединения С, N и P экстрагировали раствором 0.05 M K2SO4 при взбалтывании в течение 1 ч и соотношении почва : раствор 1 : 5. В экстракте определяли концентрации C органических соединений (Cорг), аммонийного N (N–${\text{NH}}_{{\text{4}}}^{ + }$), нитратного N (N–${\text{NO}}_{{\text{3}}}^{--}$), общее содержание N (Nэкстр) и общее содержание Р (Рэкстр). Концентрацию N органических соединений (Nорг) рассчитывали по разности между концентрациями Nэкстр и неорганических форм N (N–${\text{NH}}_{{\text{4}}}^{ + }$ + N–${\text{NO}}_{{\text{3}}}^{--}$).
Определяли также ряд показателей биологического и биохимического состояния почвы. Углерод и азот микробной биомассы (Смикр и Nмикр) анализировали методом фумигации-экстракции [15, 47]. Из фумигированных хлороформом образцов экстрагировали C и N как описано выше. Концентрацию Смикр и Nмикр вычисляли по разности содержания Cорг и Nэкстр в фумигированных и исходных образцах без использования коэффициентов, учитывающих неполную экстрагируемость компонентов микробной биомассы.
Активности минерализации органических соединений азота (N-минерализация) и нитрификации определяли после инкубации образцов почвы в термостате Sanyo MIR-153 в течение 21 дня при температуре 22°С и полевой влажности. Минерализацию рассчитывали как разницу концентраций суммы N неорганических соединений (N–${\text{NH}}_{{\text{4}}}^{ + }$ + N–${\text{NO}}_{{\text{3}}}^{--}$) в почве после и до инкубации, нитрификацию – как разницу соответствующих концентраций N–${\text{NO}}_{{\text{3}}}^{--}.$
Базальное дыхание (БД) почвы определяли после инкубации образцов при 22°C в течение 24 ч. Скорость дыхания выражали в мг C–CО2/(кг ч). На основании определения Смикр и БД рассчитывали микробный метаболический коэффициент (qСО2) как отношение БД к Смикр [2].
Активность гидролитических ферментов определяли методом флюорогенно-меченых субстратов [31]. Сущность метода заключается в гидролизе ферментного субстрата, меченного флюоресцирующим соединением, которое высвобождается при гидролизе, и его количество определяется флюорометрически. Использовали субстраты, специфичные для β-D-глюкозидазы, хитиназы и фосфатазы, меченные 4-метилумбеллиферилом (MUF) (MUF-β-D-glucopyranoside, MUF-N-acetil-β-D-glucosaminide и MUF-phosphate соответственно), а также субстрат для лейцинаминопептидазы (L-leucine-7-amino-4-methylcoumarin), меченный 7-амино-4-метилкумарином (AMC). Количество флюоресцирующих MUF и AMC, образующихся в результате распада субстратов, измеряли на мультимодальном микропланшетном ридере FilterMax F5 при длине волны возбуждения эмиссии 355 нм и испускания 460 нм. Измерения проводили через 60, 120 и 180 мин после внесения субстрата, активность ферментов выражали в мкM МУФ(AMC)/(г ч).
Структуру микробного сообщества оценивали в смешанных образцах почвы из каждого изученного варианта по составу жирных кислот (ЖК) – мембранных структур клеток микроорганизмов, которые экстрагировали и анализировали методом масс-спектрометрии микробных маркеров (МСММ) согласно [40]. Суть метода заключается в экстракции ЖК из почвы кислым метанолизом (1 М HCl в метаноле), силилировании БСТФА (N,O, бис-триметилсилилом(трифтарацетамид)) и анализе метил-триметилсилилированных эфиров на хромато-масс-спектрометре AT-5880/5975 Agillent Technologies. Преимущество метода МСММ по сравнению с анализом жирных кислот фосфолипидов (PLFA) [14, 22, 48] состоит в расширении спектра анализируемых ЖК, альдегидов и стеринов [40].
В качестве биомаркеров отдельных таксономических групп микроорганизмов использовали специфические ЖК (разветвленные i15:0, a15:0, i16:0, i17:0 для грамположительных бактерий; мононенасыщенные и циклопропановые 16:1ω9c, 16:1ω9t, cy17:0, cy19:0 для грамотрицательных бактерий; 10-метил-разветвленные 10Me16:0, 10Me18:0 для актиномицетов и 18:2ω6с для грибов) [14, 22, 48]. По результатам анализа рассчитывали соотношение между грибными и бактериальными ЖК. Хотя концентрации специфических биомаркеров не дают представления о реальном соотношении грибной и бактериальной биомассы в почве [13, 29], а лишь отражают влияние какого-либо изучаемого фактора на содержание отдельных таксономических групп микроорганизмов, соотношение между грибными и бактериальными биомаркерами используют для индикации сдвигов в соотношении биомассы грибов и бактерий [14, 36].
Концентрацию Cорг и Nэкстр определяли на анализаторе TOC-VCPN. Неорганические формы азота и фосфора анализировали колориметрически на спектрофотометре GenesysTM 10UV. При определении N–${\text{NH}}_{{\text{4}}}^{ + }$ использовали салицилат-нитропрусидный метод, N–${\text{NO}}_{{\text{3}}}^{--}$ определяли при восстановлении ${\text{NO}}_{{\text{3}}}^{ - }$ до ${\text{NO}}_{{\text{2}}}^{ - }$ на кадмиевой колонке и реакции с сульфаниламином и N-(1-нафтил)-этилендиамин-дигидрохлоридом, Рмин – восстановлением молибдена фосфорномолибденовой кислоты аскорбиновой кислотой по Мэрфи и Райли в модификации Ватанабе–Олсена. Содержание Рэкстр исследовали методом оптико-эмиссионной спектрометрии с индуктивно-связанной плазмой (ICP OES) на спектрометре Agilent 5110. Концентрацию СО2 определяли на газовом хроматографе Кристалл-2000.
Полученные данные подвергали анализу в программе Statistica 8.0. Для всех результатов рассчитывали средние значения и стандартные отклонения. С использованием U-критерия Манна–Уитни устанавливали статистическую значимость отличия изученных показателей в почве под травяной растительностью злакового луга (контроль) и под куртинами кустарничков и кустарника (для всей совокупности образцов, и для отдельных видов растений).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Почва злакового луга характеризуется малой мощностью, кислой реакцией среды, большим содержанием микробной биомассы, экстрагируемого органического вещества, которое относительно обогащено азотом (Сорг/Nорг = 13.1), но содержит мало фосфора (Сорг/Pэкстр = 435). Активности N-минерализации и нитрификации, концентрации минеральных форм азота и фосфора также высокие (табл. 1, 2). Эти свойства являются типичными для почв лугов в горной тундре Хибин и в районе Абиско (северная Швеция) [3, 10]. Величины БД (3.0 мг С–СО2/(кг ч)) и qСО2 (3.7 мкг С–СO2/(мг Cмикр ч)) (табл. 3) примерно соответствуют значениям, типичным для лесных почв европейской территории России [2, 11, 12].
Таблица 1.
Свойства почвы под разными растениями, средние значения ± стандартное отклонение
| Вариант | Влажность, % | Глубина залегания камня, см | Каменистость, % | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | Рмин, мг/кг |
|---|---|---|---|---|---|
| Контроль | 130 ± 10 | 16.5 ± 5.1 | 0.3 ± 0.6 | 4.93 ± 0.10 | 132 ± 77 |
| Все растения с ЭРМ и ЭКМ | 114 ± 27 | 12.9 ± 3.5** | 4.2 ± 6.0* | 4.86 ± 0.15 | 408 ± 349* |
| Betula nana | 122 ± 29 | 14.6 ± 5.6 | 4.8 ± 7.1 | 4.79 ± 0.10** | 597 ± 316*** |
| Empetrum hermaphroditum |
89 ± 28*** | 10.8 ± 5.5** | 5.5 ± 6.7* | 4.75 ± 0.06*** | 747 ± 373*** |
| Vaccinium myrtillus | 128 ± 17 | 13.9 ± 5.5 | 2.4 ± 4.4 | 4.97 ± 0.07 | 251 ± 234 |
| Vaccinium uliginosum | 102 ± 20** | 13.9 ± 5.4 | 2.9 ± 4.5 | 4.80 ± 0.21 | 236 ± 235 |
| Vaccinium vitis-idaea | 125 ± 24 | 11.4 ± 4.2** | 5.6 ± 5.2** | 4.98 ± 0.08 | 244 ± 263 |
Таблица 2.
Экстрагируемые C, N, P и активности трансформации азотсодержащих соединений в почве под разными растениями, средние значения ± ± стандартное отклонение
| Вариант | Сорг | Nорг | Рэкстр | $\frac{{{{{\text{C}}}_{{{\text{орг}}}}}}}{{{{{\text{N}}}_{{{\text{орг}}}}}}}$ | $\frac{{{{{\text{C}}}_{{{\text{орг}}}}}}}{{{{{\text{Р}}}_{{{\text{экстр}}}}}}}$ | N–${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$ | N–${\text{NO}}_{3}^{ - }$ | N-минерализация | Нитрификация |
|---|---|---|---|---|---|---|---|---|---|
| мг/кг | мг/кг | мг N/(кг день) | |||||||
| Контроль | 364 ± 44 | 28 ± 4 | 0.84 ± 0.12 | 13.1 ± 1.3 | 435 ± 45 | 21 ± 4 | 10.6 ± 2.8 | 4.4 ± 1.1 | 5.1 ± 1.1 |
| Все растения с ЭРМ и ЭКМ | 400 ± 109 | 39 ± 14* | 1.21 ± 0.49* | 10.6 ± 1.5*** | 350 ± 83** | 18 ± 6 | 3.2 ± 3.4*** | 2.8 ± 1.2*** | 3.2 ± 1.3*** |
| Betula nana | 497 ± 148* | 53 ± 22** | 1.36 ± 0.65* | 9.8 ± 1.5*** | 392 ± 82 | 22 ± 7 | 1.5 ± 0.7*** | 3.2 ± 1.4* | 3.5 ± 1.3** |
| Empetrum hermaphroditum |
441 ± 116 | 41 ± 11** | 1.71 ± 0.56*** | 11.0 ± 2.1* | 270 ± 64*** | 17 ± 7 | 1.0 ± 0.7*** | 1.7 ± 1.4*** | 2.3 ± 1.4*** |
| Vaccinium myrtillus | 321 ± 41* | 29 ± 5 | 0.93 ± 0.11 | 11.3 ± 1.2** | 347 ± 36*** | 20 ± 3 | 9.3 ± 3.0 | 3.4 ± 1.3 | 3.9 ± 1.5 |
| Vaccinium uliginosum | 345 ± 33 | 34 ± 6* | 1.11 ± 0.30* | 10.4 ± 1.2*** | 322 ± 54*** | 15 ± 4** | 2.7 ± 0.5*** | 3.0 ± 0.9** | 3.3 ± 1.0*** |
| Vaccinium vitis-idaea | 399 ± 71 | 38 ± 7** | 1.01 ± 0.26 | 10.6 ± 1.1*** | 413 ± 90 | 17 ± 4* | 1.5 ± 0.5*** | 2.8 ± 0.5*** | 2.7 ± 0.5*** |
Таблица 3.
Микробная биомасса, биологическая и ферментативная активность почвы под разными растениями, средние значения ± стандартное отклонение
| Вариант | Cмикр | Nмикр | $\frac{{{{{\text{C}}}_{{{\text{микр}}}}}}}{{{{{\text{N}}}_{{{\text{микр}}}}}}}$ | БД, С–СО2, мг/(кг ч) |
qСO2, мкг С–СO2/ (мг Cмикр ч) |
Глюкозидаза | Хитиназа | Фосфатаза | Лейцинами-нопептидаза,мкмоль AMC/(г ч) |
|---|---|---|---|---|---|---|---|---|---|
| мг/кг | мкмоль MUF/(г ч) | ||||||||
| Контроль | 817 ± 78 | 84 ± 8 | 9.7 ± 1.1 | 3.0 ± 0.5 | 3.7 ± 0.5 | 0.51 ± 0.12 | 0.31 ± 0.11 | 1.59 ± 0.32 | 0.11 ± 0.02 |
| Все растения с ЭРМ и ЭКМ | 801 ± 195 | 74 ± 18 | 10.9 ± 1.2** | 3.6 ± 2.2 | 4.5 ± 2.1 | 0.94 ± 0.37*** | 0.63 ± 0.26*** | 2.81 ± 1.28* | 0.09 ± 0.04 |
| Betula nana | 788 ± 167 | 76 ± 20 | 10.5 ± 1.3 | 5.8 ± 3.0** | 7.1 ± 2.4*** | 0.48 ± 0.12 | 0.40 ± 0.14 | 1.53 ± 0.36 | 0.11 ± 0.03 |
| Empetrum hermaphroditum |
979 ± 286 | 90 ± 20 | 10.8 ± 1.4 | 5.0 ± 1.9** | 5.1 ± 1.2** | 1.07 ± 0.32*** | 0.64 ± 0.29** | 2.39 ± 0.70* | 0.07 ± 0.02** |
| Vaccinium myrtillus | 843 ± 104 | 82 ± 12 | 10.4 ± 1.3 | 3.2 ± 0.6 | 3.8 ± 0.9 | 1.09 ± 0.34*** | 0.82 ± 0.23*** | 3.58 ± 1.61** | 0.07 ± 0.02** |
| Vaccinium uliginosum | 714 ± 162 | 62 ± 13*** | 11.5 ± 0.7*** | 2.1 ± 0.5*** | 3.1 ± 1.3 | 1.06 ± 0.35*** | 0.61 ± 0.18*** | 2.74 ± 0.66** | 0.08 ± 0.02* |
| Vaccinium vitis-idaea |
699 ± 111* | 62 ± 9*** | 11.2 ± 0.6*** | 2.2 ± 0.3*** | 3.2 ± 0.6 | 1.01 ± 0.32*** | 0.66 ± 0.29** | 3.83 ± 1.21*** | 0.13 ± 0.04 |
Свойства почвы под растениями с ЭРМ и ЭКМ. При наличии на лугу растений с ЭРМ и ЭКМ многие из изученных свойств почвы значимо отличаются от контроля: мощность, каменистость, Pмин, Nорг, Pэкстр, Сорг/Nорг, Cорг/Рэкстр, Смикр/Nмикр, N–${\text{NO}}_{{\text{3}}}^{ - },$ N-минерализация, нитрификация, активности глюкозидазы, хитиназы и фосфатазы. Под кустарничками и кустарником мощность почвы, содержание N–${\text{NO}}_{{\text{3}}}^{ - },$ соотношения Сорг/Nорг и Сорг/Pэкстр, активности N-минерализации и нитрификации значимо меньше, а каменистость, содержание Pмин, Pэкстр, Nорг, соотношение Смикр/Nмикр и активности глюкозидазы, хитиназы и фосфатазы – больше. Значимо не отличаются в контрольной почве под злаковой растительностью и в почве под ЭРМ и ЭКМ растениями рН, Сорг, N–${\text{NH}}_{{\text{4}}}^{ + },$ Смикр, Nмикр, БД и qCO2.
Указанные отличия (или их отсутствие) основаны на сравнении всей совокупности почв под разными видами растений с ЭРМ и ЭКМ с почвой контрольного варианта. Если с контролем сравнивать почвы под индивидуальными видами растений, то для многих показателей выявляется специфическое влияние отдельных видов, которое может заключаться, как в большей или меньшей выраженности изменения свойства почвы (большинство показателей), так и в разнонаправленном изменении (Сорг, БД, qCO2).
Влажность, мощность и каменистость. Эти морфологические показатели характеризуют свойства почвы, которые могут определять исходное поселение кустарничков в специфических местах, связанных с различиями в микрорельефе и аккумуляции мелкозема. Значимо меньшая влажность почвы характерна лишь для двух видов растений: водяники (89%) и голубики (около 100%). Вместе с тем почва под брусникой на альпийской лишайниковой пустоши в Тебердинском заповеднике оказалась более влажной [7]. Поэтому нельзя говорить о том, что поселение кустарничков на лугу связано с принципиально меняющимися условиями увлажнения.
По мощности почвы и каменистости в верхних 5 см горизонта AH почва под кустарничками и кустарником отличается от контроля более явственно. Значимое уменьшение мощности и увеличение каменистости, характерное для всей совокупности объектов, отмечается также в почве под брусникой и водяникой. Такая тенденция прослеживается и в почве под всеми другими видами растений, вероятно, поэтому кустарнички и кустарники изначально поселяются на более каменистых участках с меньшим накоплением мелкозема. С этим может быть связана и пониженная влажность почвы под некоторыми видами.
Кислотность (pH). Кислотность почвы под травами и кустарничками в целом значимо не отличается, но она выше в почве под карликовой березой и водяникой. При поселении брусники на альпийской лишайниковой пустоши почва также оказалась более кислой [7]. Такой результат вполне ожидаем, так как ЭРМ и ЭКМ грибы выделяют в почву много органических соединений, в том числе кислотной природы [35]. Кроме того, наземный и подземный опад вересковых кустарничков способствует формированию кислых продуктов при его трансформации [26, 30, 49].
Содержание минерального азота и фосфора и активности N-минерализации и нитрификации. В почве под луговой растительностью содержится примерно в два раза больше N–${\text{NH}}_{{\text{4}}}^{ + },$ чем N–${\text{NO}}_{{\text{3}}}^{ - }.$ Эти компоненты по-разному реагируют на присутствие растений с ЭРМ и ЭКМ в составе лугового фитоценоза. Хотя концентрация N–${\text{NH}}_{{\text{4}}}^{ + }$ в почве под травами и кустарничками в целом значимо не отличается, тем не менее, она уменьшается под голубикой и брусникой. Гораздо более резко в присутствии кустарничков уменьшается концентрация N–${\text{NO}}_{{\text{3}}}^{--}$ (значимо во всех случаях, кроме черники). Такие изменения соответствуют заметному снижению активностей N-минерализации и нитрификации под всеми видами растений, кроме черники, по сравнению с контрольным участком. В изученной почве нитрификация обеспечивает полное окисление ${\text{NH}}_{{\text{4}}}^{ + },$ образующегося в процессе лабораторной инкубации образцов, в ${\text{NO}}_{{\text{3}}}^{--}.$ Поэтому она является процессом, отражающим одновременно и N-минерализацию, а аммонификация приобретает отрицательные значения.
Ранее мы предположили [7], что снижение нитрификации может быть связано с большей кислотностью почвы под растениями с ЭРМ, но на злаковом лугу в горной тундре Хибин кислотность повышается не сильно и не под всеми видами. Вероятно, микоризные грибы или опад растений с ЭРМ/ЭКМ могут снижать активность нитрифицирующих бактерий в почве.
Более низкое содержание N–${\text{NO}}_{{\text{3}}}^{--}$ в почве под растениями с ЭРМ и ЭКМ, чем под злаковой растительностью, соответствует сложившемуся представлению о том, что почвы в экосистемах с преобладанием растений, образующих АРМ, характеризуются более высокими концентрациями неорганических форм азота и скоростями их трансформации [27, 37]. В частности, сравнение лесных почв, где древесные виды представлены симбионтами либо с АРМ, либо с ЭКМ показало, что концентрация неорганических соединений N и активности N-минерализации и нитрификации были всегда выше в почвах лесов с АРМ [28].
Высокая концентрация Pмин в почве, очевидно, связана со спецификой минералогического состава почвообразующих пород в Хибинах, содержащих большое количество апатита. Хотя значимое увеличение этого показателя характерно лишь для почвы под двумя видами (карликовая береза и водяника), для всех других почв под кустарничками прослеживается общая тенденция большей концентрации Pмин по сравнению с контролем.
Большее содержание Pмин в почве при наличии растений с ЭРМ и ЭКМ, чем в варианте с их отсутствием, может быть связано с повышением минерализации органических фосфатов под действием экзоферментов микоризы и с повышенной мобилизацией минеральных фосфатов при повышении кислотности. Роль микоризы в мобилизации фосфора и питании им растений хорошо известна, не только для АРМ, но и для ЭКМ, продуцирующей фосфатазы, активность которых не уступает активности фосфатаз сапротрофных грибов [20, 21]. В то же время известна и большая эффективность ЭКМ в выветривании минералов благодаря выделению в почву органических кислот [44]. Именно под карликовой березой и водяникой почва вместе с наибольшей концентрацией Pмин характеризуется наиболее кислой реакцией. Повышенное содержание Рмин в почве альпийской лишайниковой пустоши в присутствии брусники также сопровождалось более кислой реакцией [7].
Углерод, азот и фосфор экстрагируемого органического вещества. Содержание Сорг в почве под травами и кустарничками в целом значимо не отличается. Но для двух видов отмечено разнонаправленное изменение – пониженная концентрация под черникой и повышенная под карликовой березой. Такое поведение Сорг в почве под растениями с ЭРМ и ЭКМ не вполне соотносится с гипотезой о влиянии этих типов микоризы на органическое вещество [21, 24, 37]. Хотя в целом считается, что ЭКМ растения выделяют в почву больше углерода через микоризу, чем АМ растения [35], в некоторых работах не выявлено значимого влияния ЭКМ на содержание лабильного органического вещества в почвах [28]. Эрикоидная же микориза рассматривается как обладающая наибольшей активностью экзофементов, способных трансформировать органическое вещество почв [39, 49, 50], и мы также ранее обнаружили повышение концентрации Сорг в почве под брусникой в условиях альпийской лишайниковой пустоши [7].
В отличие от Сорг содержание в почве N и P, входящих в состав лабильного органического вещества, значимо выше, как под всей совокупностью растений с ЭРМ и ЭКМ, так и под большинством индивидуальных видов. Отдельные исключения (черника для N и P, и брусника для P) также демонстрируют общую с другими растениями тенденцию. Это может свидетельствовать либо о деполимеризации крупных органических молекул и мобилизации органических азот- и фосфорсодержащих соединений в почве под действием экзоферментов микоризных грибов, образующих ЭРМ и ЭКМ, либо об уменьшении их минерализации. Как показано выше, N-минерализация в почве под кустарничками действительно снижается.
Соотношение Сорг/Nорг является показателем, по которому почва под растениями с ЭРМ и ЭКМ определенно отличается от контроля – характерно значимое его уменьшение в почве под всеми видами по сравнению с контрольным участком. Повышенная насыщенность экстрагируемого органического вещества азотом под кустарничками и кустарниками несколько неожиданна, поскольку, например, для лесных почв под растениями с ЭКМ характерно большее соотношение С/N и меньшее содержание лабильного азота в сравнении с АРМ растениями [28]. В случае поселения брусники на бедной почве альпийской лишайниковой пустоши также наблюдалась совершенно иная картина [7]. Здесь увеличение концентрации Сорг и тенденция к повышению Nорг свидетельствовали о возможном воздействии ферментов на высокомолекулярные компоненты органического вещества с продуцированием небольших, более биогеохимически подвижных (легкоэкстрагируемых) молекул. Уменьшение же соотношения Сорг/Nорг говорило о том, что экстрагируемое органическое вещество могло выступать в качестве важного источника азотного питания для микоризных грибов и других почвенных микроорганизмов [7]. В противоположность этому, на фоне высоких концентраций неорганических форм азота в почве злакового луга азотсодержащие органические соединения, вероятно, не поглощаются активно микоризными грибами и сапротрофными микроорганизмами.
Известно, что ЭКМ грибы демонстрируют отрицательную реакцию на азотные удобрения [25]. В частности, продукция ими протеазы подавляется при повышении концентраций ${\text{NH}}_{{\text{4}}}^{ + }$ и ${\text{NO}}_{{\text{3}}}^{ - },$ демонстрируя адаптацию продуцирования N-мобилизующих экзоферментов к доступности неорганических соединений N в почве [33]. На примере горно-тундровых экосистем Хибин мы ранее показали, что уменьшение фракционирования изотопов азота между корнями и листьями растений в условиях большей доступности азота, вероятно, является следствием уменьшения участия микоризы в их азотном питании [5]. Не исключено, что уменьшение соотношения Сорг/Nорг в присутствии вересковых кустарничков соответствует закреплению N в составе стабильного органического вещества и снижению его доступности для микроорганизмов и растений [18, 26, 28].
Соотношение Сорг/Рэкстр (как и Сорг/Nорг) значимо уменьшается под растениями с ЭРМ и ЭКМ в целом. Из индивидуальных видов значимое уменьшение характерно для черники, голубики и вороники, но общая тенденция характерна и для других видов (табл. 2). Возможно, что некоторый вклад в уменьшение соотношение Сорг/Рэкстр может вносить неорганический фосфор, присутствующий в экстракте 0.05 М K2SO4. Косвенно об этом может свидетельствовать одновременно самая большая концентрация Рмин и наименьшее соотношение Сорг/Рэкстр в почве под водяникой. Однако такой вклад, определенно, не является критическим. Во-первых, концентрация неорганического ортофосфата в экстракте настолько низкая, что он не дает окрашивания с молибденово-кислым аммонием. Во-вторых, соотношения между концентрацией Рмин и соотношением Сорг/Рэкстр в почвах под другими видами растений с ЭРМ и ЭКМ не связаны отрицательной зависимостью. Наконец, соотношение Сорг/Рэкстр в диапазоне 270–413 соответствует органическому веществу почв. Например, в органогенных горизонтах почв горной тундры соотношение между углеродом и фосфором органического вещества (Рорг) варьирует от 125 до 328 [9], а субальпийских и альпийских болот – от 215 до 422 [6].
Обогащенность органического вещества почвы фосфором зависит от того, насколько общая минерализация органических соединений превышает минерализацию Рорг. Согласно концепции “биохимической минерализации” [32], уровень аккумуляции фосфора в органическом веществе почвы контролируется доступностью минеральных фосфатов для питания микроорганизмов. При достаточном содержании в почве доступных минеральных фосфатов минерализация Рорг невелика, и он накапливается в составе органического вещества. Наши результаты полностью соответствуют этому – при увеличении концентрации Рмин в почвах под растениями с ЭРМ и ЭКМ соотношение Сорг/Рэкстр в экстрагируемом органическом веществе уменьшается. Подобно соотношению Сорг/Nорг, уменьшение соотношения Сорг/Рэкстр свидетельствует, что в условиях высоких концентраций Рмин, мобилизуемые органические фосфаты в почве под растениями с ЭРМ и ЭКМ не подвергаются преимущественной минерализации и использованию для питания растений.
Углерод и азот микробной биомассы и структура микробного сообщества. Концентрации Смикр и Nмикр значимо не различаются в почве под травами и всей совокупностью растений с ЭРМ и ЭКМ. Это подтверждается и сравнением почв под большинством индивидуальных видов растений. Так, значимо меньшая концентрация Смикр характерна только для почвы под брусникой, а Nмикр – под брусникой и голубикой. Таким образом, повышение концентраций лабильных форм азота (как минеральных, так и органических) на фоне его общей высокой доступности не приводит к дополнительной аккумуляции элемента в микробной биомассе. При этом соотношение C/N в микробной биомассе в присутствии растений с ЭРМ и ЭКМ возрастает. Это отличает реакцию микробного сообщества почвы от обнаруженной нами при изучении влияния брусники на бедную доступными формами азота почву альпийской лишайниковой пустоши. В том случае повышение доступности азота в почве под брусникой также не приводило к увеличению суммарной микробной биомассы (Cмикр), но вызывало рост концентрации Nмикр и уменьшение соотношения Cмикр/Nмикр [7].
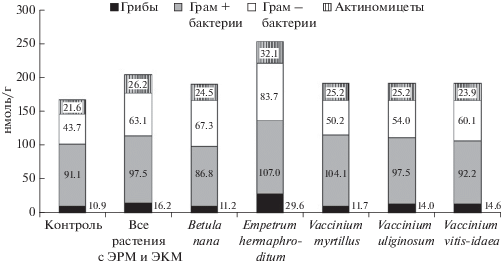
Можно предположить, что увеличение соотношения Cмикр/Nмикр связано с разной структурой микробного сообщества в почвах под разными растениями. При поступлении более трудноразлагаемого опада кустарничков в микробном сообществе могут быть в большей степени представлены относительно бедные азотом грибы, включая внешний мицелий микоризных грибов. Однако это не подтверждается результатом определения структуры микробного сообщества по данным анализа ЖК (рис. 1). Согласно последнему, в почве под злаками содержится меньше ЖК всех основных таксономических групп микроорганизмов, но соотношение между ЖК грибов и бактерий принципиально не меняется, составляя 0.08–0.10 в большинстве случаев. Лишь в почве под водяникой, которая характеризуется наибольшим содержанием ЖК всех рассмотренных групп микроорганизмов, оно возрастает до 0.16. Наибольшее содержание ЖК в этом случае (252 нмоль/г) соответствует максимальным концентрациям Смикр и Nмикр, хотя они значимо не отличались от контроля из-за высокого варьирования. Повышенное содержание ЖК микроорганизмов в почвах под растениями с ЭРМ и ЭКМ (около 190 нмоль/г под всеми видами, кроме водяники) также не соответствует закономерности стабильной или даже пониженной (под брусникой) концентрации Смикр в присутствии кустарничков.
Рис. 1.
Концентрация жирных кислот (специфических биомаркеров основных таксономических групп микроорганизмов) в почве злакового луга под разными растениями.
Биологическая и ферментативная активность. Базальное дыхание, характеризующее скорость минерализации органического вещества в почвах под разными видами растений с ЭРМ и ЭКМ, разнонаправлено отличается от контроля. В почве под голубикой и брусникой БД меньше, а в почве под карликовой березой и водяникой больше, чем в почве под злаками. Таким образом, на примере БД наиболее контрастно проявляется видоспецифичность влияния кустарничков на почвенные свойства. Согласно литературным данным, большее почвенное и микробное дыхание обычно характерно для экосистем с доминированием растений с АРМ, как в умеренном, так и в субарктическом поясах [41, 45].
Поскольку микробная биомасса в целом стабильна в почвах под разными растениями, то qCO2 в большой мере повторяет отличия, характерные для БД. Особенно выделяются повышенные значения этого показателя в почве под карликовой березой и водяникой. В первом случае qCO2 превышает максимальное значение в 6.1–6.4 мкг С–СO2/(мг Cмикр ч), обнаруженное при изучении большого разнообразия почв [1]. Микробный метаболический коэффициент часто рассматривается в качестве показателя устойчивости микробного сообщества [1, 2, 11, 12], связь которого с содержанием органического вещества и микробной биомассы в почве неопределенна [1]. Предполагается, что повышенное значение qCO2 может иллюстрировать большие затраты микроорганизмов на поддержание жизнедеятельности, но выявленные нами различия qCO2 в почвах под разными растениями могут быть связаны с разной доступностью углерода для микроорганизмов и, соответственно, более эффективным его использованием (низкие потери на единицу биомассы) при низкой доступности. Об этом может свидетельствовать положительная корреляция между qCO2 и Cорг в изученной совокупности почв (r = 0.86, P < 0.05).
Активности глюкозидазы, хитиназы и фосфатазы значимо выше в почве под всеми растениями с ЭРМ, тогда как под карликовой березой, образующей ЭКМ, они не отличаются от контроля. Эти результаты подтверждают мнение о том, что ЭРМ характеризуется набольшей активностью экзофементов, способных трансформировать органическое вещество почв [39, 49, 50]. В частности, в комплексе полевых экспериментов ЭРМ рододендрона (Rhododendron maximum) демонстрировала высокую активность экзоферментов, превосходящую активность ЭКМ и АРМ других видов растений [49, 50]. В то же время ЭКМ, как правило, характеризуется большей активностью ферментов в сравнении с АРМ в лесах умеренного пояса [16, 37, 51]. Большая способность грибов, образующих ЭКМ, и особенно ЭРМ, в продуцировании ферментов, трансформирующих углеводы, подтверждается их геномным анализом [46]. Характерно, что высокая активность ферментов ЭРМ грибов сохраняется в почве тундрового злакового луга при высоких концентрациях неорганических соединений азота и фосфора. В противоположность другим ферментам, лейцинаминопептидаза, катализирующая расщепление полипептидов с образованием свободных аминокислот, не проявляет повышенную активность в почве под растениями с ЭРМ и ЭКМ. Напротив, в почве под тремя вересковыми кустарничками она значимо ниже.
Результаты определения активности ферментов не вполне соответствуют показателям состояния лабильного (экстрагируемого) органического вещества. Повышенная активность глюкозидазы не сопровождается повышением концентрации Cорг, а ферменты, мобилизующие органические азотсодержащие соединения, хитиназа и лейцинаминопептидаза ведут себя противоположным образом – первая способствует повышению концентрации Nорг, но вторая – нет. Также и повышенная активность фосфатазы, с одной стороны, соответствует повышению концентрации Pмин, но экстрагируемое органическое вещество при этом относительно обогащено фосфором.
ЗАКЛЮЧЕНИЕ
Растения с ЭРМ и ЭКМ в составе фитоценоза злакового луга в горно-тундровом поясе Хибин оказывают влияние на свойства почвы, увеличивая содержание подвижного минерального и органического фосфора, экстрагируемого органического азота, соотношение Смикр/Nмикр, и уменьшая содержание нитратов, активности N-минерализации и нитрификации, а также соотношения С/N и С/P в экстрагируемом органическом веществе. Выявленные различия в свойствах гумусового горизонта литозема в отсутствии и в присутствии вересковых кустарничков, образующих ЭРМ, и карликовой березы, образующей ЭКМ, свидетельствуют о специфическом влиянии экзоферментов микоризных грибов на органическое вещество почвы и на процессы трансформации азот- и фосфорсодержащих соединений даже при высокой доступности неорганических азота и фосфора. В частности, высокое содержание Nорг и более низкие активности N-минерализации и нитрификации в почве под растения с ЭРМ и ЭКМ в сравнении с почвой под злаковой растительностью подтверждают разные предпочтения в источниках азотного питания растений с разным типом микоризы.
Проведенное исследование ограничено изучением почвы одного злакового луга в горной тундре Хибин. Очевидно, что для уточнения выявленных закономерностей и понимания, насколько объективными являются некоторые несоответствия между ферментативной активностью почвы и характеристиками экстрагируемого органического вещества, необходимо изучение большего числа объектов.
Список литературы
Ананьева Н.Д., Благодатская Е.В., Демкина Т.С. Пространственное и временное варьирование микробного метаболического коэффициента в почвах // Почвоведение. 2002. № 10. С. 1233–1241.
Ананьева Н.Д., Сусьян Е.А., Рыжова И.М., Бочарникова Е.О., Стольникова Е.В. Углерод микробной биомассы и микробное продуцирование двуокиси углерода дерново-подзолистыми почвами постагрогенных биогеоценозов и коренных ельников южной тайги (Костромская область) // Почвоведение. 2009. № 9. С. 1108–1116.
Бузин И.С., Макаров М.И., Малышева Т.И., Кадулин М.С., Королева Н.Е., Маслов М.Н. Трансформация соединений азота в почвах горно-тундровых экосистем Хибин // Почвоведение. 2019. № 5. С. 570–577. https://doi.org/10.1134/S0032180X1903002X
Макаров М.И. Роль микоризы в трансформации соединений азота в почве и в азотном питании растений (обзор) // Почвоведение. 2019. № 2. С. 220–233. https://doi.org/10.1134/S0032180X19020102
Макаров М.И., Бузин И.С., Тиунов А.В., Малышева Т.И., Кадулин М.С., Королева Н.Е. Изотопный состав азота в почвах и растениях горно-тундровых экосистем Хибин // Почвоведение. 2019. № 10. С. 1185–1197. https://doi.org/10.1134/S0032180X19100071
Макаров М.И., Волков А.В., Малышева Т.И., Онипченко В.Г. Фосфор, азот и углерод в почвах субальпийского и альпийского поясов Тебердинского заповедника // Почвоведение. 2001. № 1. С. 62–71.
Макаров М.И., Кадулин М.С., Турчин С.Р., Малышева Т.И., Аксенова А.А., Онипченко В.Г., Меняйло О.В. Влияние Vaccinium vitis-idaea на свойства горно-луговой почвы альпийской лишайниковой пустоши // Экология. 2019. № 4. С. 270–275. https://doi.org/10.1134/S0367059719040115
Макаров М.И., Леошкина Н.А., Ермак А.А., Малышева Т.И. Сезонная динамика минеральных форм азота в горно-луговых альпийских почвах // Почвоведение. 2010. № 8. С. 969–978.
Маслов М.Н., Макаров М.И. Органическое вещество почв горной тундры Северной Фенноскандии // Вестн. Моск. ун-та. Сер. 17, почвоведение. 2013. № 3. С. 3–7.
Маслов М.Н., Макаров М.И. Трансформация соединений азота в тундровых почвах северной Фенноскандии // Почвоведение. 2016. № 7. С. 813–821. https://doi.org/10.7868/S0032180X16070078
Стольникова Е.В., Ананьева Н.Д., Чернова О.В. Микробная биомасса, ее активность и структура в почвах старовозрастных лесов европейской территории России // Почвоведение. 2011. № 4. С. 479–494.
Сусьян Е.А., Ананьева Н.Д., Гавриленко Е.Г., Чернова О.В., Бобровский М.В. Углерод микробной биомассы в профиле лесных почв южной тайги // Почвоведение. 2009. № 10. С. 1233–1240.
Bååth E., Anderson T.H. Comparision of soil fungal/bacterial ratios in a pH gradient using physiological and PLFA based techniques // Soil Biol. Biochem. 2003. V. 35. P. 955–963.
Brant J.B., Sulzman E.W., Myrold D.D. Microbial community utilization of added carbon substrates in response to long-term carbon input manipulation // Soil Biol. Biochem. 2006. V. 38. P. 2219–2232.
Brooks P.C., Landman A., Pruden G., Jenkinson D.S. Chloroform fumigation and release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen // Soil Biol. Biochem. 1985. V. 17. P. 837–842.
Brzostek E.R., Dradoni D., Brown Z.A., Phillips R.P. Mycorrhizal type determines the magnitude and direction of root-induced changes in decomposition in a temperate forest // New Phytologist. 2015. V. 206. P. 1274–1282.
Chagnon P.-L., Rineau F., Kaiser C. Mycorrhizas across scales: A journey between genomics, global patterns of biodiversity and biogeochemistry // New Phytologist. 2016. V. 209. P. 913–916.
Clemmensen K.E., Finlay R.D., Dahlberg A., Stenlid J., Wardle D.A., Lindahl B.D. Carbon sequestration is related to mycorrhizal fungal community shifts during long-term succession in boreal forests // New Phytol. 2015. V. 205. P. 1525–1536.
Collier F.A., Bidartondo M.I. Waiting for fungi: the ectomycorrhizal invasion of lowland heathlands // J. Ecol. 2009. V. 97. P. 950–963.
Colpaert J.V., Van Laere A. A comparison of the extracellular enzyme activities of two ectomycorrhizal and a leaf-saprotrophic basidiomycete colonizing beech leaf litter // New Phytol. 1996. V. 134. P. 133–141.
Courty P.E., Buée M., Diedhiou A.G. Frey-Klett P., Le Tacon F., Rineau F., Turpault M.-P., Uroz S., Garbaye J. The role of ectomycorrhizal communities in forest ecosystem processes: New perspectives and emerging concepts // Soil Biol. Biochem. 2010. V. 42. P. 679–698.
Frostegard A., Bååth E., Tunlid A. Shifts in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty-acid analysis // Soil Biol. Biochem. 1993. V. 25. P. 723–730.
Hallinger M., Manthey M., Wilmking M. Establishing a missing link: Warm summers and winter snow cover promote shrub expansion into alpine tundra in Scandinavia // New Phytol. 2010. V. 186. P. 890–899.
van der Heijden M.G.A., Martin F.M., Selosse M.A., Sanders I.R. Mycorrhizal ecology and evolution: the past, the present, and the future // New Phytol. 2015. V. 205. P. 1406–1423.
Kivlin S.N., Emery S.M., Rudgers J.A. Fungal symbionts alter plant responses to global change // Am. J. Bot. 2013. V. 100. P. 1445–1457.
Kraus T.E.C., Dahlgren R.A., Zasoski R.J. Tannins in nutrient dynamics of forest ecosystems – a review // Plant Soil. 2003. V. 256. P. 41–66.
Liese R., Lübbe T., Albers N.W., Meier I.C. The mycorrhizal type governs root exudation and N uptake of temperate tree species // Tree Physiol. 2018. V. 38. P. 83–95.
Lin G., McCormack M.L., Ma C., Guo D. Similar below-ground carbon cycling dynamics but contrasting modes of nitrogen cycling between arbuscular mycorrhizal and ectomycorrhizal forests // New Phytol. 2017. V. 213. 1440–1451.
Lin Q., Brookes P.C. Comparison of selective inhibition and biovolume measurements of microbial biomass and its community structure in unamended, ryegrass-amended, fumigated and pesticide-treated soils // Soil Biol. Biochem. 1999. V. 31. P. 1999–2014.
Mallik A.U. Conifer regeneration problems in boreal and temperate forests with ericaceous understories: role of disturbance, seedbed limitation, and keystone species change // Critical Rev. Plant Sci. 2003. V. 22. P. 341–366.
Marx M.-C., Wood M., Jarvis S.C. A microplate fluorometric assay for the study of enzyme diversity in soils // Soil Biol. Biochem. 2001. V. 33. P. 1633–1640.
McGill W.B., Cole C.V. Comparative aspects of cycling of organic C, N, S and P through soil organic matter // Geoderma. 1981. V. 26. P. 267–286.
Molecular mycorrhizal symbiosis / Ed. Martin F. Wiley-Blackwell, 2016.
Onipchenko V.G., Makarov M.I., van der Maarel E. Influence of alpine plants on soil nutrient concentrations in a monoculture experiment // Folia Geobot. 2001. V. 36. P. 225–241.
Orwin K.H., Kirschbaum M.U.F., St John M.G., Dickie I.A. Organic nutrient uptake by mycorrhizal fungi enhances ecosystem carbon storage: a model-based assessment // Ecol. Lett. 2011. V. 14. P. 493–502.
Phillips R.L., Zak D.R., Holmes W.E., White D.C. Microbial community composition and function beneath temperate trees exposed to elevated atmospheric carbon dioxide and ozone // Oecologia. 2002. V. 131. P. 236–244.
Phillips R.P., Brzostek E., Midgley M.G. The mycorrhizal-associated nutrient economy: a new framework for predicting carbon-nutrient couplings in temperate forests // New Phytol. 2013. V. 199. P. 41–51.
Post E., Forchhammer M.C., Bret-Harte M.S., Callaghan T.V., Christensen T.R., Elberling B., Fox A.D., et al. Ecological dynamics across the Arctic associated with recent climate change // Science. 2009. V. 325. P. 1355–1358.
Read D.J., Leake J.R., Perez-Moreno J. Mycorrhizal fungi as drivers of ecosystem processes in heathland and boreal forest biomes // Can. J. Bot. 2004. V. 82. P. 1243–1263.
Shekhovtsova N.V., Marakaev O.A., Pervushina K.A., Osipov G.A. The underground organ microbial complexes of moorland spotted orchid Dactylorhiza maculata (L.) Soó (Orchidaceae) // Advances Biosci. Biotechnol. 2013. V. 4. P. 35–42.
Soudzilovskaia N., van der Heijden M.G.A., Cornelissen J.H.C., Makarov M.I., Onipchenko V.G., Maslov M.N., Akhmetzanova A.A., van Bodegom P.M. Quantitative assessment of the differential impacts of arbuscular and ectomycorrhiza on soil carbon cycling // New Phytologist. 2015. V. 208. P. 280–293.
Sørensen M.V., Strimbeck R., Nystuen K.O., Kapas R.E., Enquist B., Graae B.J. Draining the pool? Carbon storage and fluxes in three alpine plant communities // Ecosystems. 2018. V. 21. P. 316–330.
Sulman B.N., Shevliakova E., Brzostek E.R., Kivlin S.N., Malyshev S., Menge D.N.L., Zhang X. Diverse mycorrhizal associations enhance terrestrial C storage in a global model // Global Biogeochem. Cycles. 2019. V. 33. P. 501–523.
Taylor L.L., Leake J.R., Quirk J., Hardy K., Banwart S.A., Beerling D.J. Biological weathering and the long-term carbon cycle: integrating mycorrhizal evolution and function into the current paradigm // Geobiology. 2009. V. 7. P. 171–191.
Taylor M.K., Lankau R.A., Wurzburger N. Mycorrhizal associations of trees have different indirect effects on organic matter decomposition // J. Ecology. 2016. V. 104. P. 1576–1584.
Tedersoo L., Bahram M. Mycorrhizal types differ in ecophysiology and alter plant nutrition and soil processes // Biol. Rev. 2019. V. 94. P. 1857–1880.
Vance E.D., Brookes P.C., Jenkinson D.S. An extraction method for measuring soil microbial biomass C // Soil Biol. Biochem. 1987. V. 19. P. 703–707.
White D.C., Ringelberg D.B. Signature biolipid biomarker analysis // Techniques in Microbial Ecology / Eds: Burlage R.S. N.Y.: Oxford University Press, 1998. P. 255–272.
Wurzburger N., Hendrick R.L. Rhododendron thickets alter N cycling and soil extracellular enzyme activities in southern Appalachian hardwood forests // Pedobiologia. 2007. V. 50. P. 563–576.
Wurzburger N., Hendrick R.L. Plant litter chemistry and mycorrhizal roots promote a nitrogen feedback in a temperate forest // J. Ecol. 2009. V. 97. P. 528–536.
Yin H., Wheeler E., Phillips R.P. Root-induced changes in nutrient cycling in forests depend on exudation rates // Soil Biol. Biochem. 2014. V. 78. P. 213–221.
Дополнительные материалы отсутствуют.


