Почвоведение, 2020, № 7, стр. 850-859
Зависимость свойств почвы альпийской лишайниковой пустоши от влажности и присутствия Vaccinium vitis-idaea в составе фитоценоза
М. И. Макаров a, *, Р. В. Сабирова a, М. С. Кадулин a, Т. И. Малышева a, А. И. Журавлева b, В. Г. Онипченко a, А. А. Аксенова a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт физико-химических и биологических проблем почвоведения, Пущинский НЦ РАН
142290 Московская область, Пущино, ул. Институтская, 2, Россия
* E-mail: mmakarov@soil.msu.ru
Поступила в редакцию 29.10.2019
После доработки 21.12.2019
Принята к публикации 26.12.2019
Аннотация
Увеличение участия кустарничков и кустарников в составе фитоценозов альпийских лугов и наблюдающаяся тенденция уменьшения количества атмосферных осадков теплого периода в горных регионах определяют актуальность оценки роли эктомикоризы и эрикоидной микоризы и влажности почвы в изменении доступности элементов питания для растений и микроорганизмов. Изучены свойства горно-луговой почвы (Umbric Leptosol) альпийской лишайниковой пустоши в Тебердинском заповеднике, характеризующие лабильные формы углерода, азота и фосфора, а также биологическую и ферментативную активность при разной влажности и при наличии или отсутствии верескового кустарничка Vaccinium vitis-idaea в составе фитоценоза. Показано, что под V. vitis-idaea почва характеризуется большей кислотностью и в меньшей степени реагирует на изменение ее влажности. Различия в свойствах при наличии и отсутствии V. vitis-idaea преимущественно определяются выраженной реакцией почвы на изменение влажности в отсутствие кустарничка. Под травяной растительностью при уменьшении влажности почвы снижаются концентрации неорганических соединений азота, активности процессов N-минерализации и нитрификации, микробная биомасса и базальное дыхание, но увеличивается концентрация лабильных органических соединений углерода, азота и активности экзоферментов. Такие изменения свидетельствуют о сдвиге трансформации органического вещества от минерализации к деполимеризации, больше характерной для экосистем с доминированием эктомикоризы и эрикоидной микоризы.
ВВЕДЕНИЕ
В последние десятилетия отмечается увеличение участия кустарничков и кустарников в составе фитоценозов арктической/субарктической тундры и альпийских лугов [12, 15, 28]. В частности, 40‑летние наблюдения за динамикой альпийских биогеоценозов в Тебердинском заповеднике выявили увеличение доли Vaccinium vitis-idaea L. в надземной биомассе альпийской лишайниковой пустоши (АЛП) [13].
Изменения в составе фитоценоза могут приводить к изменению почвенных свойств в связи с особенностями ассимиляции и диссимиляции элементов и соединений отдельными видами растений [24]. Например, растения, образующие разные типы микоризы, по-разному влияют на органическое вещество почвы и связанные с ним элементы минерального питания, воздействуя, таким образом, на ключевые параметры функционирования экосистем ‒ круговорот углерода и азота. Это обусловлено разной ферментативной активностью грибов, образующих эктомикоризу (ЭКМ) и эрикоидную микоризу (ЭРМ), с одной стороны, и арбускулярную микоризу (АРМ) – с другой. Грибы, образующие ЭКМ и ЭРМ, продуцируют окислительные и гидролитические ферменты, способные деполимеризовать органическое вещество почвы и мобилизовать входящие в его состав элементы минерального питания, тогда как АРМ грибы обладают гораздо меньшей продукцией и активностью ферментов [2, 16, 26, 33].
Вместе с тем, хотя результаты лабораторных экспериментов свидетельствуют об активном разложении комплексных органических соединений (лигнин, полифенолы) и мобилизации N из хитина и полифенол-белковых комплексов грибами, образующими ЭКМ и ЭРМ [8, 27, 29], вопрос об эффективности этих процессов в естественных экосистемах далек от количественного решения. В естественных условиях продукция экзоферментов микоризными грибами регулируется разными факторами, влияющими на активность обмена углерода растений на азот грибов ‒ это и физиологическое состояние обоих симбионтов, и почвенные условия [19, 22, 35]. Кроме того, микоризные грибы представляют несколько функциональных групп, некоторые из которых имеют ограниченную способность воздействовать на органическое вещество почв, тогда как другие могут активно мобилизовать из него элементы минерального питания [9, 32].
Ранее мы предположили, что повышение участия V. vitis-idaea, образующей ЭРМ, в составе фитоценоза АЛП может изменять почвенные свойства, связанные с мобилизацией органического вещества и элементов минерального питания под действием экзоферментов микоризных грибов. Для проверки этой гипотезы мы сравнили горно-луговую почву АЛП в присутствии и отсутствии кустарничка в составе фитоценоза. Повышение концентрации экстрагируемого углерода, азота микробной биомассы, подвижного фосфора, рост микробной активности при наличии V. vitis-idaea соответствовали представлениям о повышении доступности биогенных элементов для питания почвенных микроорганизмов и растений [4].
Одновременно оказалось, что почва в варианте с V. vitis-idaea была более влажной, что могло быть связано с особенностями водно-физических свойств почвы, определяющих поселение этого вида, и также могло повлиять на состав органического вещества и на функционирование микробного сообщества. В связи с наблюдающейся тенденцией уменьшения количества атмосферных осадков теплого периода и прогнозируемым ростом числа и интенсивности засух в горных регионах [14, 18] оценка значения фактора влажности почвы в изменении доступности элементов питания также становится актуальной.
С целью уточнения влияния факторов присутствия V. vitis-idaea и влажности почвы на процессы трансформации органического вещества и содержание лабильных форм углерода, азота и фосфора мы изучили свойства почвы АЛП в градиенте изменения влажности на разных участках склонов, но при одинаковой влажности в присутствии и отсутствии кустарничка.
ОБЪЕКТЫ И МЕТОДЫ
Объектом исследования послужила легкосуглинистая горно-луговая почва (Umbric Leptosol) АЛП на высокогорном стационаре Малая Хатипара в Тебердинском государственном биосферном заповеднике (2800 м над ур. м.). В июле 2018 г. для исследования было выбрано два участка АЛП. Один располагался на крутом (15°) склоне юго-восточной экспозиции; второй – в верхней выположенной части склона восточной экспозиции. На участках были выбраны пятна растительности с участием V. vitis-idaea и без кустарничка, на которых отбирали образцы почвы.
Отбор проводили при контроле объемной влажности почвы до глубины 10 см датчиком TRIME-EZ (IMKO Micromodultechnic GMBH, Германия) так, чтобы она в двух вариантах (с кустарничком и без кустарничка) была примерно одинаковой. При этом на первом участке влажность почвы была значительно меньше (около 15%), а на втором образцы были отобраны при двух разных влажностях (около 21 и 27%). Таким образом, мы получили три пары вариантов контроль‒брусника при разной влажности: объект 1 – влажность около 15%, объект 2 – около 21%, объект 3 – около 27%.
С каждого варианта было отобрано по 10 образцов почвы с глубины 0–5 см. Образцы были заморожены и в таком виде доставлены в лабораторию для дальнейшего анализа.
После размораживания образцов в них определяли кислотность (рН водной суспензии), содержание подвижного неорганического фосфора (Рмин) по методу Кирсанова (экстракция 0.2 M HCl), лабильные соединения С и N (экстракция 0.05 M K2SO4). В экстракте определяли концентрации C органических соединений (Cорг), аммонийного N (N–${\text{NH}}_{4}^{ + }$), нитратного N (N–${\text{NO}}_{3}^{--}$) и общее содержание N (Nэкстр). Концентрацию N органических соединений (Nорг) рассчитывали по разности между концентрациями Nэкстр и неорганических форм N (N–${\text{NH}}_{4}^{ + }$ + N–${\text{NO}}_{3}^{--}$).
Из показателей, характеризующих биологические свойства почвы, определяли С и N микробной биомассы (Смикр и Nмикр) методом фумигации-экстракции [10, 34]. Из фумигированных парами хлороформа образцов экстрагировали C и N с использованием 0.05 M K2SO4. Концентрации Смикр и Nмикр вычисляли по разности концентраций Cорг и Nэкстр в фумигированных и исходных образцах без использования коэффициентов, учитывающих неполную экстрагируемость компонентов микробной биомассы.
Активности минерализации органических соединений азота (N-минерализация) и нитрификации определяли после инкубации образцов почвы в течение 20 суток при 22°С и полевой влажности (термостат SANYO MIR-153). Минерализацию рассчитывали, как разницу концентраций N неорганических соединений (N–${\text{NH}}_{4}^{ + }$ + N–${\text{NO}}_{3}^{--}$) в почве после и до инкубации, а нитрификацию – как разницу соответствующих концентраций N–${\text{NO}}_{3}^{--}.$
Базальное дыхание (БД) почвы определяли после инкубации образцов в течение 24 ч при 22°C. Скорость дыхания выражали в мг C–CО2/кг в час. На основании определения БД и Смикр рассчитывали микробный метаболический коэффициент (qСО2) как отношение БД к Смикр [1].
Активность гидролитических ферментов определяли методом флюорогенно-меченых субстратов [21]. Принцип метода состоит в том, что фермент-селективные субстраты с присоединенным к ним флуоресцентным соединением метилумбеллифероном (MUF) или 7-амино-4-метилкумарином (AMC), при взаимодействии с почвенным экстрактом подвергаются гидролизу. При этом происходит высвобождение флуоресцентного соединения и его количество определяется флюорометрически. Субстраты, меченные MUF, использовали для определения активностей β-D-глюкозидазы (MUF-β-D-glucopyranoside), хитиназы (MUF-N-acetil-β-D-glucosaminide) и фосфатазы (MUF-phosphate). Субстрат, меченный AMC, применяли для оценки активности лейцинаминопептидазы (L-leucine-7-amino-4-methylcoumarin). Количества флюоресцирующих MUF и AMC, образующихся в результате распада субстратов, измеряли на мультимодальном микропланшетном ридере FilterMax F5 при длине волны возбуждения эмиссии 355 нм и испускания 460 нм. Измерения проводили через 60, 120 и 180 мин после внесения субстрата, активность ферментов выражали в мкM MUF(AMC)/г в час.
Концентрации Cорг и Nэкстр определяли на анализаторе TOC-VCPN. Неорганические формы азота и фосфора анализировали колориметрически на спектрофотометре GENESYSTM 10UV. При определении N–${\text{NH}}_{4}^{ + }$ использовали салицилат-нитропрусидный метод, N–${\text{NO}}_{3}^{--}$ определяли после восстановления ${\text{NO}}_{3}^{--}$ до ${\text{NO}}_{2}^{--}$ на кадмиевой колонке с последующей реакцией с сульфаниламином и N-(1-нафтил)-этилендиамин-дигидрохлоридом, Рмин ‒ восстановлением молибдена фосфорномолибденовой кислоты аскорбиновой кислотой по Мэрфи и Райли в модификации Ватанабе-Олсена. Концентрацию СО2 определяли на газовом хроматографе Кристалл-2000.
Статистический анализ данных был проведен в программе STATISTICA 8.0. Данные были проверены на нормальность распределения (критерий Шапиро-Уилка) и равенство дисперсий (тройной тест Кохрана, Хартли и Бартлетта). Свойства, отклоняющиеся от нормального распределения и не имеющие равных дисперсий, были log-трансформированы. Далее был проведен двухфакторный дисперсионный анализ для оценки влияния на изученные свойства влажности почвы (3 варианта), наличия/отсутствия V. vitis-idaea (2 варианта) и взаимодействия этих факторов. Влияние факторов и их сочетания считалось значимым при P < 0.05. Если влияние фактора или сочетания факторов было значимым, использовали тест Фишера для оценки значимости воздействия присутствия или отсутствия V. vitis-idaea на почвенные свойства для каждого объекта. Аналогично оценивали влияние изменения влажности почвы в вариантах контроль и брусника.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Горно-луговая почва АЛП характеризуется кислой реакцией среды, высоким содержанием Cмикр, Nмикр и Cорг, преобладанием органических соединений в составе Nэкстр и преобладанием N‒${\text{NH}}_{4}^{ + }$ в составе неорганических соединений азота, низким содержанием Pмин. Эти свойства почвы исследованных участков являются типичными для АЛП [4, 7].
Большинство изученных свойств почвы испытывают значимое влияние присутствия V. vitis-idaea, изменяющейся влажности и сочетания этих факторов (табл. 1).
Таблица 1.
Результат двухфакторного дисперсионного анализа по влиянию наличия брусники, влажности почвы и их взаимодействия на свойства горно-луговой альпийской почвы
| Свойство | Фактор | F | P |
|---|---|---|---|
| pH | Брусника | 28.76 | 0.000 |
| Влажность | 1.62 | 0.207 | |
| Брусника × влажность | 0.901 | 0.412 | |
| Рмин | Брусника | 3.966 | 0.051 |
| Влажность | 0.869 | 0.425 | |
| Брусника × влажность | 0.526 | 0.594 | |
| N–${\text{NH}}_{4}^{ + }$ | Брусника | 3.639 | 0.050 |
| Влажность | 4.077 | 0.022 | |
| Брусника × влажность | 1.853 | 0.167 | |
| N–${\text{NO}}_{3}^{ - }$ | Брусника | 19.52 | 0.000 |
| Влажность | 8.770 | 0.000 | |
| Брусника × влажность | 5.491 | 0.006 | |
| Nорг | Брусника | 15.47 | 0.000 |
| Влажность | 18.20 | 0.000 | |
| Брусника × влажность | 5.041 | 0.009 | |
| Сорг | Брусника | 5.247 | 0.026 |
| Влажность | 1.960 | 0.151 | |
| Брусника × влажность | 2.870 | 0.065 | |
| Сорг/Nорг | Брусника | 2.025 | 0.160 |
| Влажность | 1.651 | 0.211 | |
| Брусника × влажность | 1.201 | 0.309 | |
| Смикр | Брусника | 0.081 | 0.777 |
| Влажность | 0.957 | 0.391 | |
| Брусника × влажность | 2.447 | 0.096 | |
| Nмикр | Брусника | 0.627 | 0.432 |
| Влажность | 0.785 | 0.461 | |
| Брусника × влажность | 3.603 | 0.034 | |
| Cмикр/Nмикр | Брусника | 6.355 | 0.015 |
| Влажность | 4.425 | 0.017 | |
| Брусника × влажность | 1.137 | 0.328 | |
| N-минерализация | Брусника | 7.635 | 0.008 |
| Влажность | 1.181 | 0.314 | |
| Брусника × влажность | 1.703 | 0.191 | |
| Нитрификация | Брусника | 15.56 | 0.000 |
| Влажность | 2.713 | 0.075 | |
| Брусника × влажность | 3.559 | 0.035 | |
| БД | Брусника | 4.615 | 0.036 |
| Влажность | 1.026 | 0.365 | |
| Брусника × влажность | 2.658 | 0.079 | |
| qCO2 | Брусника | 4.217 | 0.045 |
| Влажность | 0.170 | 0.844 | |
| Брусника × влажность | 1.295 | 0.282 | |
| Лейцинамино-пептидаза | Брусника | 4.726 | 0.034 |
| Влажность | 8.169 | 0.000 | |
| Брусника × влажность | 1.848 | 0.168 | |
| Глюкозидаза | Брусника | 4.099 | 0.048 |
| Влажность | 5.745 | 0.006 | |
| Брусника × влажность | 15.74 | 0.000 | |
| Хитиназа | Брусника | 4.023 | 0.049 |
| Влажность | 4.048 | 0.023 | |
| Брусника × влажность | 4.266 | 0.019 | |
| Фосфатаза | Брусника | 17.46 | 0.000 |
| Влажность | 9.480 | 0.000 | |
| Брусника × влажность | 4.116 | 0.022 |
Кислотность почвы. Это единственное из изученных свойств, которое значимо изменяется при наличии V. vitis-idaea в составе фитоценоза вне зависимости от влажности (рис. 1). Повышение кислотности в почве под брусникой соответствует результату нашего предыдущего исследования [4] и представлению о том, что наземный и подземный опад вересковых кустарничков способствует формированию кислых продуктов при его трансформации [17]. Кроме того, ЭРМ грибы выделяют в почву органические соединения кислотной природы [25]. При этом изменение влажности почвы в вариантах “контроль” и “брусника” не оказывает влияние кислотность.
Рис. 1.
Свойства горно-луговой почвы альпийской лишайниковой пустоши (среднее и стандартное отклонение). Здесь и на рис. 2: черный кружок, сплошная линия тренда ‒ при отсутствии Vaccinium vitis-idaea в составе фитоценоза; белый кружок, пунктирная линия тренда ‒ при наличии V. vitis-idaea (1, 2 и 3 – объекты с влажностью почвы 15, 21 и 27% соответственно). Символ * показывает значимое различие между вариантами контроль и брусника при фиксированной влажности. Одинаковые буквенные индексы показывают отсутствие значимых различий при разной влажности почвы в варианте контроль (прописные) и брусника (строчные).
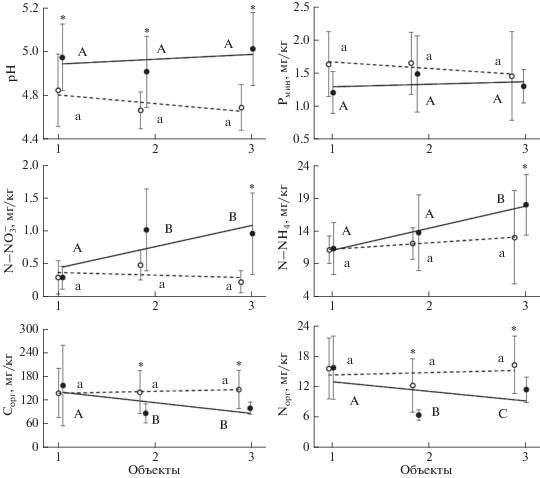
Содержание неорганических форм азота и фосфора и активности N-минерализации и нитрификации. Концентрации N–${\text{NH}}_{4}^{ + }$ и N–${\text{NO}}_{3}^{--},$ несмотря на то, что различаются в почве АЛП на порядок [5], демонстрируют схожие закономерности изменения под влиянием V. vitis-idaea и влажности. При низкой влажности они не отличаются в почве вариантов “контроль” и “брусника”, но при ее повышении оказываются значимо меньшими в присутствии брусники. Определяется такая динамика отсутствием влияния влажности на содержание N–${\text{NH}}_{4}^{ + }$ и N–${\text{NO}}_{3}^{--}$ в почве при наличии V. vitis-idaea и повышением их концентраций в почве контрольного варианта с ростом влажности (рис. 1).
Такая же закономерность характерна для активностей N-минерализации и нитрификации. В целом, при очень низких показателях (вплоть до отрицательных значений N-минерализации) наблюдается их повышение в почве контрольного варианта и значимое превышение над вариантом брусника при высокой влажности (рис. 2). Известно, что растения, образующие АРМ, произрастают на почвах, более обеспеченных неорганическими соединениями азота [3, 20]. Такая закономерность интерпретируется как преимущественная специализация АРМ грибов на поглощении N–${\text{NH}}_{4}^{ + }$ и N–${\text{NO}}_{3}^{--}$ [30] или же свидетельствует о незначительном вкладе АРМ симбиоза в азотное питание растений [8, 31]. Одновременно показано, что АРМ грибы могут косвенно влиять на процессы трансформации органического вещества и азотсодержащих соединений, воздействуя на комплекс свободноживущих микроорганизмов [23]. Однако оказывается, что трансформация соединений азота (особенно нитрификация) изменяется при разной увлажненности почвы АЛП под АРМ растениями, тогда как при наличии V. vitis-idaea эти показатели демонстрируют устойчивость. Такой результат соответствует данным о том, что биологическая активность почв (дыхание) под АРМ растениями в большей степени реагирует на изменение влажности, тогда как под ЭКМ растениями (больше соответствуют ЭРМ по активности экзоферментов) температура оказывается более важным фактором [35].
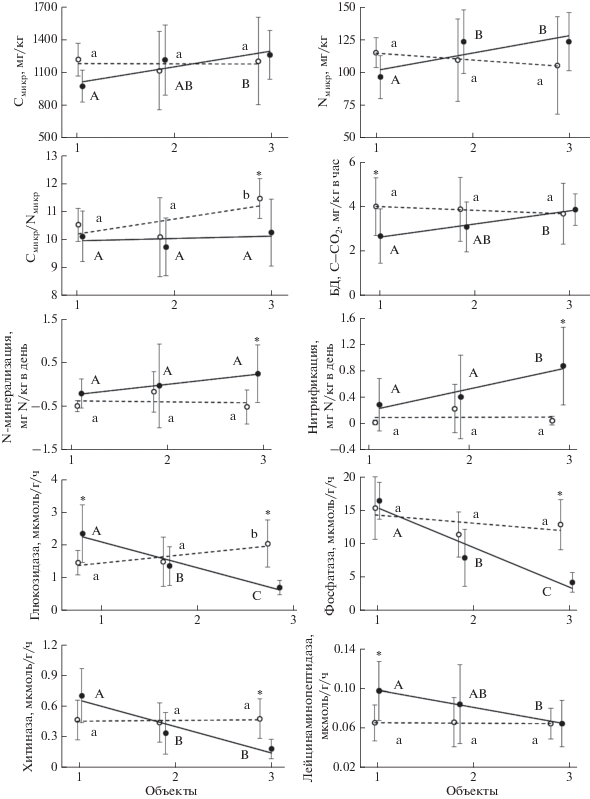
Рис. 2.
Биологические свойства и биологическая активность горно-луговой почвы альпийской лишайниковой пустоши.
Концентрация Pмин в почве низкая, что характерно для почвы АЛП, и не показала значимой реакции на присутствие V. vitis-idaea в составе фитоценоза или на изменение влажности. Тенденция к появлению разницы между вариантами “контроль” и “брусника” (больше Pмин в почве под V. vitis-idaea) отмечена только при снижении влажности почвы (рис. 1). Ранее была показана более выраженная мобилизация Pмин в почве под растениями с ЭРМ и ЭКМ, что соответствовало большей кислотности почвы и активности фосфатазы [4, 6].
Углерод и азот экстрагируемого органического вещества. Концентрации Cорг и Nорг в присутствие V. vitis-idaea не изменяются при изменении влажности, тогда как в почве контрольного варианта они уменьшаются с повышением влажности. В результате при низкой влажности они также, как и в случае неорганических форм азота, не отличаются в почве вариантов контроль и брусника, но с увеличением влажности концентрации Cорг и Nорг под V. vitis-idaea становятся значимо бóльшими. В противоположность этому, в тепличном эксперименте было показано, что повышенное выделение в почву экссудатов при снижении влажности почвы было характерно для растений с ЭКМ микоризой, но не для АРМ [19].
Концентрация элементов экстрагируемого органического вещества в почве регулируется многими факторами, включая влияние микоризных грибов. В теории такое влияние может проявляться как в повышении концентрации Cорг и Nорг в почве с ЭКМ и ЭРМ растениями за счет деполимеризации органического вещества под действием гидролитических ферментов [16, 36] или выделения большего количества органического вещества через микоризу [25], так и, напротив, в закреплении C и N в составе стабильного органического вещества за счет продуцирования большого количества полифенолов и формирования полифенол-белковых комплексов [11, 17, 20]. В экспериментальных исследованиях также было показано, как наличие эффекта мобилизации органического вещества под влиянием растений с ЭКМ и ЭРМ [4, 6], так и его отсутствие или даже уменьшение концентрации Сорг [6, 20].
Микробная биомасса и биологическая активность. Концентрации Смикр и Nмикр в почве являются достаточно устойчивыми показателями, которые согласно результату двухфакторного дисперсионного анализа в наименьшей степени реагируют на появление ЭРМ-симбиоза на АЛП или на изменение влажности почвы. Ранее мы показали на примере почвы АЛП [4] и почвы тундрового луга в Хибинах [6], что концентрация Смикр под травами и вересковыми кустарничками не отличалась, но Nмикр и соотношение С/N в микробной биомассе двух изученных почв демонстрировали разнонаправленные изменения. Соотношение Смикр/Nмикр – это один из немногих показателей, который изменяется в почве под V. vitis-idaea в большей степени, чем в отсутствие кустарничка. Его увеличение при повышении влажности приводит к значимому превышению над соответствующим соотношением в почве контрольного варианта (рис. 2), но причина такого различия пока не очевидна. Большее соотношение C/N в микробной биомассе в присутствии растений с ЭРМ и ЭКМ было получено нами и для почвы тундрового луга в Хибинах, где мы предположительно связали это с изменением структуры микробного сообщества [6].
Базальное дыхание, подобно микробной биомассе, демонстрирует стабильность при изменении влажности в почве под V. vitis-idaea и повышается с ростом влажности почвы контрольного варианта. Результатом такой динамики является значимое превышение БД и qСО2 в почве с V. vitis-idaea при низкой влажности.
Таким образом, для Смикр и Nмикр, как и для других свойств почвы, характеризующих биологическую активность, связанную с функционированием живых клеток (N-минерализация, нитрификация, базальное дыхание), и результат такой активности (концентрации N–${\text{NH}}_{4}^{ + }$ и N–${\text{NO}}_{3}^{--}$), характерно постоянство при изменении влажности в варианте с V. vitis-idaea и увеличение при повышении влажности почвы в контрольном варианте. Этот результат свидетельствует о большей чувствительности микробного сообщества почвы под АРМ растениями к доступности воды и соответствует ранее полученным данным по реакции биологической активности почв биогеоценозов с доминированием растений, образующих АРМ, на количество атмосферных осадков [35].
Ферментативная активность. Активности всех изученных ферментов демонстрируют схожие закономерности. Они достаточно стабильны при изменении влажности почвы в варианте брусника (лишь активность глюкозидазы возрастает с увеличением влажности) и уменьшаются с ростом влажности при отсутствии V. vitis-idaea в составе фитоценоза (рис. 2). В результате активности глюкозидазы, хитиназы и фосфатазы значимо выше в почве с V. vitis-idaea при высокой влажности. Это соответствует значимому росту концентраций Cорг и Nорг, вероятно, в результате воздействия ферментов (глюкозидазы и хитиназы) на высокомолекулярные компоненты органического вещества с продуцированием небольших, более биогеохимически подвижных (легкоэкстрагируемых) молекул [4]. В то же время, хотя наблюдается общая тенденция изменения в почве контрольного варианта при разной влажности активностей глюкозидазы, хитиназы и лейцинаминопептидазы, с одной стороны, и концентраций Cорг и Nорг, с другой, повышение активностей этих ферментов при низкой влажности не сопровождается ростом концентраций Cорг и Nорг. Также и динамика активности фосфатазы не соответствует динамике Pмин в почве. Ранее нами было обнаружено повышение концентрации Pмин в почвах под кустарничками, образующими ЭРМ [4, 6], но это не сопровождалось увеличением соотношения C/P в экстрагируемом органическом веществе при росте фосфатазной активности [6]. Возможно, подобные несоответствия связаны с некорректностью прямого сопоставления динамики изученных минеральных и органических фракций фосфора в силу их разной биогеохимической лабильности.
Таким образом, результаты исследования лишь частично подтверждают мнение о большей активности экзоферментов ЭРМ, которая проявляется только при повышенном увлажнении почвы АЛП, но происходит это скорее в результате уменьшения активности соответствующих ферментов в почве в отсутствие V. vitis-idaea. При снижении влажности почвы активность ферментов под травяной растительностью, напротив, возрастает. Реакция ферментной системы микоризы на изменение влажности почвы может быть следствием адаптации для обеспечения микробной активности и питания растений в неблагоприятных засушливых условиях. Однако в противоположность нашему результату, данные, полученные в условиях тепличного эксперимента, демонстрировали, что снижение влажности почвы сопровождалось меньшим откликом продукции экссудатов растениями, образующими АРМ [19]. Примечательным фактом явилось то, что биологические (микробная биомасса, трансформация соединений азота, дыхание) и биохимические (активность экзоферментов) свойства почвы меняются разнонаправлено при изменении влажности.
ЗАКЛЮЧЕНИЕ
Кислотность почвы АЛП повышается в присутствии V. vitis-idaea в составе фитоценоза. Динамика других изученных свойств более сложна и определяется как наличием V. vitis-idaea, так и влажностью почвы. Более стабильные показатели содержания лабильных форм C и N, биологической и ферментативной активности в почве под V. vitis-idaea при изменении влажности свидетельствуют о меньшей чувствительности ЭРМ грибов и ассоциированного с ЭРМ сапротрофного микробного сообщества к доступности почвенной влаги. Меньшие концентрации N–${\text{NH}}_{4}^{ + },$ N–${\text{NO}}_{3}^{--}$ и меньшие активности N-минерализации и нитрификации в почве под V. vitis-idaea при высокой влажности демонстрирует меньшую зависимость растения от минеральных соединений в азотном питании. Под травяной растительностью при уменьшении влажности почвы снижаются концентрации неорганических соединений азота и активности процессов N-минерализации и нитрификации, а также микробная биомасса и базальное дыхание почвы. Одновременно концентрации лабильных органических соединений углерода, азота и активности экзоферментов повышаются, свидетельствуя о сдвиге трансформации органического вещества от минерализации к деполимеризации, больше характерной для экосистем с доминированием ЭКМ и ЭРМ. Это обстоятельство следует принимать во внимание при прогнозе изменения функционирования альпийских экосистем в связи с наблюдающейся тенденцией повышения участия кустарничков и кустарников в составе фитоценозов альпийских лугов и уменьшения количества атмосферных осадков теплого периода при прогнозируемом росте числа и интенсивности засух в горных регионах.
Список литературы
Ананьева Н.Д., Сусьян Е.А., Рыжова И.М., Бочарникова Е.О., Стольникова Е.В. Углерод микробной биомассы и микробное продуцирование двуокиси углерода дерново-подзолистыми почвами постагрогенных биогеоценозов и коренных ельников южной тайги (Костромская область) // Почвоведение. 2009. № 9. С. 1108–1116.
Макаров М.И. Роль микоризы в трансформации соединений азота в почве и в азотном питании растений (обзор) // Почвоведение. 2019. № 2. С. 220–233.
Макаров М.И., Бузин И.С., Тиунов А.В., Малышева Т.И., Кадулин М.С., Королева Н.Е. Изотопный состав азота в почвах и растениях горно-тундровых экосистем Хибин // Почвоведение. 2019. № 10. С. 1185–1197.
Макаров М.И., Кадулин М.С., Турчин С.Р., Малышева Т.И., Аксенова А.А., Онипченко В.Г., Меняйло О.В. Влияние Vaccinium vitis-idaea на свойства горно-луговой почвы альпийской лишайниковой пустоши // Экология. 2019. № 4. С. 270‒275.
Макаров М.И., Леошкина Н.А., Ермак А.А., Малышева Т.И. Сезонная динамика минеральных форм азота в горно-луговых альпийских почвах // Почвоведение. 2010. № 8. С. 969‒978.
Макаров М.И., Малышева Т.И., Кадулин М.С., Верховцева Н.В., Сабирова Р.В., Лифанова В.О., Журавлева А.И., Карпухин М.М. Влияние растений с эрикоидной микоризой и эктомикоризой на свойства почвы злакового луга в горной тундре Хибин // Почвоведение. 2020. № 5.
Макаров М.И., Малышева Т.И., Мулюкова О.С., Меняйло О.В. Влияние замораживания горно-луговых альпийских почв на процессы трансформации соединений азота и углерода // Экология. 2015. № 4. С. 257–264.
Смит С.Э., Рид Д.Дж. Микоризный симбиоз. Пер. с 3-го англ. издания Е.Ю. Ворониной. М.: Товарищество научных изданий КМК, 2012.
Bödeker I.T.M., Clemmensen K.E., Boer W., Martin F., Olson E., Lindahl B.D. Ectomycorrhizal Cortinarius species participate in enzymatic oxidation of humus in northern forest ecosystems // New Phytol. 2014. V. 203. P. 245–256.
Brooks P.C., Landman A., Pruden G., Jenkinson D.S. Chloroform fumigation and release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen // Soil Biol. Biochem. 1985. V. 17. P. 837–842.
Clemmensen K.E., Finlay R.D., Dahlberg A., Stenlid J., Wardle D., Lindahl B.D. Carbon sequestration is related to mycorrhizal fungal community shifts during long-term succession in boreal forests // New Phytol. 2015. V. 205. P. 1525–1536.
Collier F.A., Bidartondo M.I. Waiting for fungi: the ectomycorrhizal invasion of lowland heathlands // J. Ecol. 2009. V. 97. P. 950–963.
Elumeeva T.G., Aksenova A.A., Onipchenko V.G., Werger M.J.A. Effects of herbaceous plants functional groups on the dynamics and structure of an alpine lichen heath: the results of a removal experiment // Plant Ecology. 2018. V. 219. P. 1435‒1447.
Gebetsroither E., Züger J., Loibl W. Drought in Alpine areas under changing climate conditions // Management strategies to adapt Alpine space forests to climate change risks. InTech. 2013. P. 165–189.
Hallinger M., Manthey M., Wilmking M. Establishing a missing link: Warm summers and winter snow cover promote shrub expansion into alpine tundra in Scandinavia // New Phytol. 2010. V. 186. P. 890–899.
van der Heijden M.G.A., Martin F.M., Selosse M.A., Sanders I.R. Mycorrhizal ecology and evolution: the past, the present, and the future // New Phytol. 2015. V. 205. P. 1406–1423.
Kraus T.E.C., Dahlgren R.A., Zasoski R.J. Tannins in nutrient dynamics of forest ecosystems – a review // Plant Soil. 2003. V. 256. P. 41–66.
Leitinger G., Ruggenthaler R., Hammerle A., Lavorel S., Schirpke U., Clement J.-C., Lamarque P., Obojes N., Tappeiner U. Impact of droughts on water provision in managed alpine grasslands in two climatically different regions of the Alps // Ecohydrology. 2015. V. 8. P. 1600–1613.
Liese R., Lübbe T., Albers N.W., Meier I.C. The mycorrhizal type governs root exudation and N uptake of temperate tree species // Tree Physiol. 2018. V. 38. P. 83–95.
Lin G., McCormack M.L., Ma C., Guo D. Similar below-ground carbon cycling dynamics but contrsting modes of nitrogen cycling between arbuscular mycorrhizal and ectomycorrhizal forests // New Phytol. 2017. V. 213. P. 1440–1451.
Marx M.C., Wood M., Jarvis S.C. A microplate fluorometric assay for the study of enzyme diversity in soils // Soil Biol. Biochem. 2001. V. 33. P. 1633–1640.
Molecular mycorrhizal symbiosis / Ed. Martin F. Wiley-Blackwell, 2016.
Nuccio E.E., Hodge A., Pett-Ridge J., Herman D.J., Weber P.K., Firestone M.K. An arbuscular mycorrhizal fungus significantly modifies the soil bacterial community and nitrogen cycling during litter decomposition // Environ. Microbiol. 2013. V. 15. P. 1870–1881.
Onipchenko V.G., Makarov M.I., van der Maarel E. Influence of alpine plants on soil nutrient concentrations in a monoculture experiment // Folia Geobot. 2001. V. 36. P. 225–241.
Orwin K.H., Kirschbaum M.U.F., St John M.G., Dickie I.A. Organic nutrient uptake by mycorrhizal fungi enhances ecosystem carbon storage: a model-based assessment // Ecol. Lett. 2011. V. 14. P. 493–502.
Phillips R.P., Brzostek E., Midgley M.G. The mycorrhizal-associated nutrient economy: a new framework for predicting carbon–nutrient couplings in temperate forests // New Phytol. 2013. V. 199. P. 41–51.
Phillips L.A., Ward V., Jones M.D. Ectomycorrhizal fungi contribute to soil organic matter cycling in sub-boreal forests // ISME J. 2014. V. 8. P. 699–713.
Post E., Forchhammer M.C., Bret-Harte M.S., Callaghan T.V., Christensen T.R., Elberling B., Fox A.D., Gilg O., Hik D.S., Høye T.T., Ims R.A., Jeppesen E., Klein D.R., Madsen J., McGuire A.D., Rysgaard S., Schindler D.E., Stirling I., Tamstorf M.P., Tyler N.J.C., van der Wal R., Welke J., Wookey P.A., Schmidt N.M., Aastrup P. Ecological dynamics across the Arctic associated with recent climate change // Science. 2009. V. 325. P. 1355–1358.
Read D.J., Leake J.R., Perez-Moreno J. Mycorrhizal fungi as drivers of ecosystem processes in heathland and boreal forest biomes // Can. J. Bot. 2004. V. 82. P. 1243–1263.
Read D.J., Perez-Moreno J. Mycorrhizas and nutrient cycling in ecosystems: a journey towards relevance? // New Phytol. 2003. V. 157. P. 475–492.
Reynolds H.L., Hartley A.E., Vogelsang K.M., James D. Bever J.D., Schultz P.A. Arbuscular mycorrhizal fungi do not enhance nitrogen acquisition and growth of old-field perennials under low nitrogen supply in glasshouse culture // New Phytol. 2005. V. 167. P. 869–880.
Rineau F., Roth D., Shah F., Smits M., Johansson T., Canbäck B., Olsen P.B., Persson P., Grell M.N., Lindquist E., Grigoriev I.V., Lange L., Tunlid A. The ectomycorrhizal fungus Paxillus involutus converts organic matter in plant litter using a trimmed brown-rot mechanism involving Fenton chemistry // Environ. Microbiol. 2012. V. 14. P. 1477–1487.
Sulman B.N., Shevliakova E., Brzostek E.R., Kivlin S.N., Malyshev S., Menge D.N.L., Zhang X. Diverse mycorrhizal associations enhance terrestrial C storage in a global model // Global Biogeochem. Cycles. 2019. V. 33. P. 501–523.
Vance E.D., Brookes P.C., Jenkinson D.S. An extraction method for measuring soil microbial biomass C // Soil Biol. Biochem. 1987. V. 19. P. 703–707.
Vargas R., Baldocchi D.D., Querejeta J.I., Curtis P.S., Hasselquist N.J., Janssens I.A., Allen M.F., Montagnani L. Ecosystem CO2 fluxes of arbuscular and ectomycorrhizal dominated vegetation types are differentially influenced by precipitation and temperature // New Phytologist. 2010. V. 185. P. 226–236.
Wurzburger N., Hendrick R.L. Rhododendron thickets alter N cycling and soil extracellular enzyme activities in southern Appalachian hardwood forests // Pedobiologia. 2007. V. 50. P. 563–576.
Дополнительные материалы отсутствуют.


