Почвоведение, 2020, № 8, стр. 996-1006
Начальные этапы хлоритизации смектита в горизонте AELоа подзолистой почвы в условиях модельного полевого эксперимента
И. И. Толпешта a, Т. А. Соколова a, *, Ю. Г. Изосимова a, М. К. Постнова a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, Россия
* E-mail: sokolt651@mail.ru
Поступила в редакцию 25.10.2019
После доработки 14.01.2020
Принята к публикации 30.01.2020
Аннотация
Проведен полевой эксперимент по моделированию начальных этапов хлоритизации (алюминизации) смектита (фракция <1 мкм) с разным составом межслоев в горизонте AELoa подзолистой почвы в условиях современного педогенеза. На основания XRD-анализа и моделирования экспериментальных дифракционных картин показано, что за один год пребывания в почве произошла хлоритизация Na-смектита и увеличение степени хлоритизации Na-Al-смектита. Хлоритизация смектита приводит к образованию неупорядоченного смешанослойного минерала, состоящего из смектитовых слоев и слоев с межслоевыми промежутками, частично заполненными полигидроксокатионами алюминия и катионами Ca2+. За один год проведения эксперимента дискретная фаза почвенного хлорита не образовалась.
ВВЕДЕНИЕ
В подзолистых почвах глинистые минералы, в том числе смектиты, благодаря небольшим размерам и большой площади удельной поверхности не только растворяются [3], но и трансформируются. Одним из продуктов трансформации смектита может быть минерал, с частично заполненными полигидроксокатионами алюминия межслоями, который в отечественной литературе называют почвенным хлоритом. Почвенные хлориты обнаружены в верхних органо-минеральных и подзолистых горизонтах подзолистых почв, сподиковых горизонтах подзолов, в верхней части профиля буроземов [4, 5, 11–13, 20, 24]. В этих горизонтах создаются благоприятные условия для полимеризации аквагидроксокомплексов алюминия в межслоях вермикулитов и смектитов, которая наиболее интенсивно протекает в диапазоне рН от 4.0 до 6 [15, 31]. Анионы комплексообразователи, прежде всего, анионы органических кислот, могут ингибировать процесс полимеризации [18, 19, 26].
Поскольку в верхних органо-минеральных горизонтах сосредоточена основная масса активных компонентов почвенной биоты, то именно в этих горизонтах наиболее активно происходит растворение и трансформация алюмосиликатов − источников ионов алюминия в почвенном растворе. Как было показано ранее, несмотря на величины рН, близкие к нижнему пределу диапазона, в котором полимеризуются аквагидроксокомплексы алюминия (рН 4.39–4.58) [6, 7], и наличию относительно больших концентраций органического вещества в почвенном растворе (от 22 до 34 мг/л Сорг) [7], в горизонте AEL подзолистых почв, развитых в условиях южно-таежных ландшафтов на территории Центрального лесного природного биосферного заповедника, почвенные хлориты содержатся в заметных количествах [8].
Полимеризация аквагидроксокомплексов алюминия в межслоях смектитов и вермикулитов приводит к уменьшению емкости катионного обмена (ЕКО) [9, 14, 21–23], способствует увеличению буферности почв к кислотным и щелочным реагентам. Горизонты, содержащие почвенные хлориты, могут рассматриваться как геохимические барьеры на пути миграции соединений алюминия как в профиле почвы, так и в ландшафте [7].
В условиях педогенеза полимеризация аквагидроксокомплексов алюминия в межслоях глинистых минералов с лабильной решеткой является обратимым процессом, направление которого может изменяться в течение одного вегетационного сезона [30].
Несмотря на то, что почвенные хлориты изучаются с середины прошлого века, до сих пор отсутствует четкое представление о структуре кристаллической решетки и механизмах образования этих минералов. По одной из теорий почвенные хлориты представляют собой минералы, образовавшиеся в результате постепенного заполнения межслоев смектита (HIS) или вермикулита (HIV) гидроксокатионами алюминия с их последующей полимеризацией [12]. Такая модель структуры почвенного хлорита не позволяет объяснить наблюдаемое в экспериментах несоответствие между уменьшением в процессе хлоритизации ЕКО и количеством алюминия, извлекаемого из межслоев [21, 32].
Согласно другой модели, почвенные хлориты являются смешанослойным образованием, в составе которого, чаще всего в беспорядке, чередуются собственно смектитовые или вермикулитовые слои, в межслоевых пространствах которых находятся обменные катионы, и алюминизированные слои, межслоевые промежутки которых заполнены полигидроксокатионами алюминия [23]. Представления о смешанослойной структуре почвенных хлоритов подтверждаются зависимостью ЕКО минерала от доли алюминизированных слоев в кристаллитах [21].
Вопрос о том, как происходит полимеризация гидроксокомплексов алюминия в межслоях, при какой степени насыщенности межслоев алюминием решетка минерала не теряет способности к расширению по оси с при гидратации или насыщении этиленгликолем, где локализуются молекулы воды в межслоях хлоритизированных структур, пока остаются без ответа [23]. Так как образование почвенных хлоритов может привести к изменению важнейших почвенных свойств, необходимо иметь представление о скорости этого процесса в условиях современного педогенеза.
Цель исследования – оценка возможности хлоритизации смектитов с разным составом межслоев в условиях горизонта AELоа подзолистой почвы.
ОБЪЕКТЫ И МЕТОДЫ
Эксперименты проводили на территории Центрального лесного государственного природного биосферного заповедника в Нелидовском районе Тверской области.
Для модельных полевых экспериментов использовали смектит, выделенный из бентонитовой глины Саригюхского месторождения (Республика Армения). Для удаления карбонатов глину обработали 10%-ной HCl и выделили из нее фракцию с размером частиц <1 мкм методом седиментации.
Смектит в составе илистой фракции переводили в Са- и Na-формы с использованием 1 М растворов хлоридов кальция и натрия соответственно. Необходимое для экспериментов количество Na-формы смектита насыщали аквагидроксокомплексами алюминия (Na-Al-смектит). Для этого готовили раствор хлорида алюминия с отношением ОН/Al ≈ 2.4, приливая к 150 мл 0.1 н. AlCl3 с рН 3.05 375 мл 0.1 н. NaOH с помощью автотитратора Mettler Toledo DL58 со скоростью 1 мл/мин для предотвращения выпадения в осадок гидроксида алюминия. К 525 мл раствора AlCl3, имеющего рН 4.90 и мольное отношение ОН/Al ≈ ≈ 2.4, добавили 48 г Na-смектита. Полученную суспензию встряхивали на ротаторе по 6−7 ч в течение трех суток, после чего оставили стареть на четверо суток. На седьмые сутки значение рН суспензии составило 4.88, а надосадочной жидкости − 5.79. Жидкую фазу суспензии отделили от твердой центрифугированием. Полученный осадок 2 раза промыли дистиллированной водой до отсутствия реакции на ионы Cl–. Центрифугирование проводили со скоростью 6000 об./мин в течение 10 мин.
Na- и Na-Al-смектита массой 1 г смешивали с 1 г отмытого 1 н. HCl и дистиллированной водой кварцевого песка с диаметром частиц 0.5 мм и помещали в контейнеры, сделанные из синтетического нетканого материала (торговая марка “Лутрасил-23”), устойчивого к биоразложению. Материал контейнера пропускает воду и воздух, а размеры пор позволяют проникать внутрь контейнера тонким корням растений, гифам грибов, актиномицетам, бактериям и вирусам.
Для прочности контейнер из нетканого полотна армировали чехлом из капроновой сетки с ячейкой 1 мм2. Контейнеры с минералами в 5-кратной повторности помещали в горизонт AELоа подзолистой почвы под елью (Picea abies (L.)) пятилетнего возраста на расстоянии от ствола, соответствующем радиусу кроны.
Исследованная почва относится к типу подзолистых почв [2], к типу подзолистых почв, отделу текстурно-дифференцированных почв по классификации почв России 2004 г. [1], по WRB 2007 − к реферативной группе Альбелювисолей (Albeluvisols), по WRB 2014 − к реферативной группe Ретисолей (Retisols) [32, 33].
В выбранном для исследований горизонте сосредоточена основная масса корней ели, он является наиболее кислым минеральным горизонтом в профиле и содержит больше органического вещества по сравнению нижележащими горизонтами.
После 1 года проведения эксперимента контейнеры извлекли из почвы, высушили и удалили из образцов зерна кварца. Удаление зерен кварца проводили путем просеивания смеси песка и смектита через сито с диаметром отверстий 0.25 мм. Полноту удаления зерен кварца контролировали под бинокуляром. В результате такого контроля установлено, что тонкие частицы смектита прочно “прилипают” к зернам кварца, и их невозможно удалить с поверхности механическим способом. В результате частичной потери смектита за счет закрепления его наиболее тонких частиц на поверхности зерен кварца и потерь образца из контейнеров за счет выноса в процессе инкубирования в почве, не все 5 повторностей тест-минерала оказались в достаточном количестве для проведения рентгендифрактометрического анализа. Образцы тест-минерала до и после инкубирования в почве исследовали методом рентгендифрактометрии (XRD-анализ). XRD-анализ смектитов до закладки в почву проводили для Са-, Na- и N-a‑Al-форм (далее Ca-смектит, Na-смектит и Na-Al-смектит). Для проведения XRD-анализа, извлеченные из почвы Na- и Na-Al-смектит переводили в Са-форму (далее Na(Са)-смектит и Na(Ca)-Al-смектит). Ориентированные препараты вышеперечисленных форм смектита и неориентированный препарат Са-смектита исследовали на рентгеновском дифрактометре ДРОН 3 с использованием CuKα-излучения, фильтрованного Ni в диапазоне 2°–62° 2θ с шагом 0.05 и временем экспозиции 10 с. Напряжение и ток на трубке составляли 35 кВ и 20 мА соответственно. Съемку образцов производили в воздушно-сухом состоянии, после насыщения этиленгликолем и после прокаливания в течение 2 ч при температурах 350 и 550°С.
ЕКО монтмориллонита определяли по метиленовому голубому по ГОСТ 21283-93.
рН точки нулевого заряда (рНТНЗ) определяли потенциометрическим методом. Для этого навески образцов заливали 0.1, 0.01 и 0.001 н. NaCl в соотношении твердая : жидкая фаза 1 : 50 и титровали на автотитраторе Mettler Toledo DL58 растворами 0.1 н. HCl и 0.1 н. NaOH от начальной точки титрования до рН 3 и 10 соответственно при постоянном перемешивании. Объем добавляемого титранта в каждой точке составлял 0.1 мл. Измерения рН производили через 2 мин после добавления титранта. Титрование проводили в атмосфере, лишенной CO2.
Термогравиметрический анализ Na- и Na-Al-смектита проводили на дериватографе Q-1500D в диапазоне 20–1000°С со скоростью нагрева 10°С в минуту.
Валовой химический состав Са-, Na- и Na-Al-смектита до их закладки в почву определяли после разложения минералов HF или сплавлением со щелочами. Определение проводили атомно-эмиссионным методом с индуктивно-связанной плазмой на спектрометре Optima-4300 DV (“Perkin-Elmer”, США). Валовое содержание Fe2+ определяли титриметрическим методом.
Площадь удельной поверхности определяли на анализаторе Quadrasorb SI/Kr (Quantachrome Instruments, Boynton Beach, FL, USA). Образцы высушивали в вакууме при 100°С. Адсорбцию N2 (чистота 99.999%) проводили при температуре 77.35 K. Для калибровки объема измерительных ячеек использовали гелий высокой чистоты (марка 6.0). Расчеты проводили по уравнению БЭТ, описывающему изотерму сорбции в диапазоне p/p0 от 0.05 до 0.30.
Моделирование экспериментальных дифракционных картин проводили с использованием программы Sybilla©, разработанной компанией Chevron [10]. Программа Sybilla© создана для моделирования спектров ориентированных препаратов глин, поэтому из моделирования исключали отражения от неглинистых минералов. Показано, что рассчитанная интенсивность дифрагированных рентгеновских лучей в малоугловой области (2θ < 4°–6° CuKα), как правило, оказывается больше экспериментальной. Поэтому для расчета интенсивности рентгеновских лучей при исследовании слоистых силикатов в области малых углов были предложены модели, учитывающие возможность агрегирования и присутствия мегакристаллов [25]. Так как в программe Sybilla© расчет интенсивности дифрагированного луча проводится без учета кристаллитов большого размера, то область малых углов от 2° до 4.05° 2θ была исключена. Моделирование проводили для образца, насыщенного этиленгликолем, и образца в воздушно-сухом состоянии. Модели для хлоритизированных слоев создавали путем замены в существующих в программе Sybilla© моделях собственно хлоритов атомов Mg на атом Al. Во всех моделях использовали постоянную величину σ* = 12°, которая отражает преимущественную ориентацию кристаллитов в препарате [20]. Рассчитанные дифракционные картины для созданных моделей сравнивали с экспериментальными дифрактограммами и оценивали ошибку моделирования.
РЕЗУЛЬТАТЫ
Состав и свойства тест-минералов до инкубирования в почве. Выделенная из бентонитовой глины илистая фракция практически мономинеральна и в основном представлена смектитом (рис. 1, А). В образце присутствуют незначительные количества кварца, диагностированного по отражениям 0.334 и 0.426 нм, и альбита, идентифицированного по межплоскостному расстоянию 0.405 нм.
Рис. 1.
Рентгендифрактограммы Ca-смектита ориентированного (А) и неориентированного препаратов (Б), Na-смектита (В) и Na–Al-смектита (Г) ориентированных препаратов в воздушно-сухом состоянии (1), насыщенных этиленгликолем (2) и прокаленных при 350 (3) и 550°С (4). Числа на кривых – d/n в нм.
Положение рефлекса 060 на рентгенограмме неориентированного образца, соответствующего межплоскостному расстоянию 0.1503 нм, свидетельствует о диоктаэдрическом характере заполнения октаэдрической сетки (рис. 1, Б).
Из результатов моделирования, проведенного с ошибкой 10.42%, для образца в воздушно-сухом состоянии следует, что использованный для экспериментов образец неоднороден и представлен кристаллитами с одинаковым числом смектитовых слоев, но разным соотношением межслоев, содержащих 2 (2W), 1 (1W) и 0 (0W) слоев молекул воды (рис. 2, табл. 1).
Рис. 2.
Экспериментальные (1) и рассчитанные (2) дифракционные картины Cа-смектита в воздушно-сухом состоянии (А) и насыщенного этиленгликолем (Б); 3−5 − модели для кристаллитов смектита, имеющих разное соотношение межслоев с различным количеством слоев воды или этиленгликоля (пояснения в тексте). Вертикальные линии и множитель над ними показывают кратность увеличения интенсивности. Штриховкой показаны области, исключенные из моделирования. Rp – ошибка моделирования.
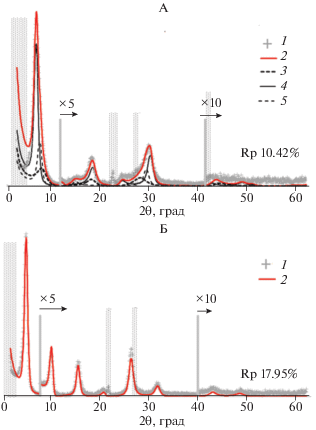
Таблица 1.
Некоторые структурные параметры исходного Са-смектита в расчете на О20(ОН)4
| Минерал | Слой | d, Å | Caint | Feoct | N | Содержание в образце, % |
|---|---|---|---|---|---|---|
| Образец в воздушно-сухом состоянии | ||||||
| R0-смектит 2W/1W/0W: 20/21/59* |
2W | 15.02 | 0.30 | 0.56 | 5 | 26 |
| 1W | 12.58 | 0.30 | 0.56 | |||
| 0W | 10.10 | 0.30 | 0.56 | |||
| R0-смектит 2W/1W: 81/19 |
2W | 14.96 | 0.30 | 0.56 | 5 | 53 |
| 1W | 12.55 | 0.30 | 0.56 | |||
| R0-смектит 2W/1W: 18/82 |
2W 1W |
14.80 12.50 |
0.30 0.30 |
0.56 0.56 |
5 | 21 |
| Образец, насыщенный этиленгликолем | ||||||
| R0 | 2Gly | 16.83 | 0.03 | 0.56 | 5 | 100 |
В образце в воздушно-сухом состоянии присутствуют три типа кристаллитов, содержание которых в образце составляет 26, 53 и 21% (кривые 3, 4 и 5, рис. 2, А). Первый тип кристаллитов представлен неупорядоченной (R0) смешанослойной структурой, в которой 20 и 21% межслоев содержат 2 (2W) и 1 (1W) слой молекул воды соответственно, а в 59% межслоев вода отсутствует (W0) (табл. 1). По данным ряда авторов, межплоскостное расстояние смектита в Са-форме, в межслоях которого размещаются два слоя молекул воды, варьирует от 14.7 до 15.2 Å. Для Са-смектитов с одним слоем воды и не содержащих межслоевую воду описаны межплоскостные расстояния около 12.3 Å и около 10 Å соответственно [16, 17, 27]. Межплоскостные расстояния смектита, полученные при моделировании, соответствуют указанным в литературе (табл. 1).
В кристаллитах второго типа содержится 81% межслоевых промежутков с двумя и 19% с одним слоем молекул воды. Кристаллиты третьего типа содержат 18% слоев 2W и 82% слоев 1W. Три типа кристаллитов содержат одинаковое количество атомов Са в межслоях (Caint), атомов железа в октаэдрической сетке (Feoct) и количество слоев в кристаллите (N).
При насыщении этиленгликолем образец становится более однородным, и с ошибкой 17.95% экспериментальная дифракционная картина может быть описана моделью смектита, во всех межслоях которого размещаются по 2 слоя молекул этиленгликоля (2 Gly) (рис. 2).
После насыщения смектита аквагидроксокомплексами алюминия межплоскостное расстояние минерала увеличивается с 1.27 нм для Na-формы до 1.30 для Na-Al-формы (кривые 1, рис. 1, В и 1, Г). Насыщенный ионами алюминия смектит не утратил способности к набуханию при насыщении этиленгликолем (кривые 2, рис. 1, В и 1, Г). После прокаливания образцов при 350°С кристаллическая решетка Na-смектита практически полностью сжимается до 1 нм (кривая 3, рис. 1, В), а для Na-Al-смектита аналогичного изменения межплоскостного расстояния не наблюдается (кривая 3, рис. 1, Г).
Учитывая, что насыщенный алюминием смектит сохраняет способность к набуханию (кривая 2, рис. 1, Г), не полностью сжимается при нагревании до 350°С, а отражение 001 ассиметрично с пологим склоном в сторону малых углов, можно предположить, что в результате алюминизации смектита образовался минерал с частично заполненными полигидроксокатионами межслоями.
Насыщение Na-смектита ионами алюминия привело к незначительному увеличению валового содержания алюминия (табл. 2).
Таблица 2.
Элементный состав Na- и Na-Al-смектита
| Форма смектита | Содержание оксидов в пересчете на прокаленную навеску, % | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Na2O | MgO | Al2O3 | SiO2 | K2O | CaO | TiO2 | MnO | FeO | Fe2O3 | |
| Na | 3.09 | 4.42 | 19.11 | 65.04 | 0.66 | 0.20 | 0.49 | 0.01 | <0.2 | 7.02 |
| Na-Al | 1.98 | 4.27 | 19.50 | 66.60 | 0.56 | 0.41 | 0.46 | 0.01 | <0.1 | 6.52 |
После насыщения аквагидроксокомплексами алюминия емкость катионного обмена смектита уменьшилась с 82 смоль(+)/кг у Na-смектита до 41 смоль(+)/кг у Na-Al-смектита (табл. 3). Учитывая, что Na-Al-смектит сохранил способность к набуханию в процессе насыщения этиленгликолем, двукратное уменьшение ЕКО, нельзя объяснить только блокировкой обменных позиций гидроксокатионами алюминия. Кроме того, количества добавленного к смектиту алюминия при синтезе HIS недостаточно, для того чтобы обеспечить наблюдаемое в эксперименте уменьшение ЕКО. Показано, что для уменьшения ЕКО на 50% в процессе алюминизации вермикулита необходимо, чтобы 30% вермикулитовых слоев трансформировались в слои, частично заполненные полигидроксикатионами алюминия (HI) [21].
Таблица 3.
Некоторые сорбционные характеристики и рНТНЗ Na- и Na–Al-смектита
| Показатель | Na-смектит | Na–Al-смектит |
|---|---|---|
| Площадь поверхности S, м2/г: | 77.2 | 38.9 |
| общая | ||
| микропор | 36.2 | 18.8 |
| остальных пор | 41.0 | 20.01 |
| Объем пор/средний размер пор, нм | 0.110/1.56 | 0.052/1.56 |
| Объем микропор, см3/г | 0.032 | 0.015 |
| ЕКО, смоль(+)/кг | 82 | 41 |
| Потеря веса, %: | ||
| от навески (20–1000°С) | 22 | 24 |
| от суммарной потери (30–250°С) | 75 | 67 |
| рН ТНЗ | Отсутствует | ≈7.2 |
Насыщение Na-смектита аквагидроксокомплексами алюминия сопровождается уменьшением площади внешней поверхности и площади поверхности пор разного размера. При одинаковом среднем размере пор обеих форм смектитов, общий объем пор и объем микропор у Na-Al-смектита оказался в 2 раза меньше по сравнению с Na-смектитом (табл. 3).
Наблюдаемое уменьшение площади поверхности и объема порового пространства можно объяснить агрегированием частиц при обработке Na-смектита гидроксокатионами алюминия.
Из вышесказанного можно заключить, что блокировка сорбционных центров совместно с уменьшением площади внешней поверхности и объема пор в процессе насыщения аквагидроксокомплексами алюминия могла привести к уменьшению ЕКО смектита.
Рассчитанные по данным термогравиметрического анализа потери веса образцов при нагревании до 1000°С для Na- и Na–Al-смектита получились близкими и составили 22 и 24% соответственно (табл. 3). Однако потеря веса за счет адсорбированной воды на поверхности частиц и в межслоевом пространстве оказалась на 8% меньше у Na–Al-смектита по сравнению Na-смектитом и составила 67%. Можно предположить, что уменьшение количества адсорбированной воды является как следствием частичного заполнения межслоев полигидроксокатионами алюминия, так и агрегированием частиц, которое сопровождается уменьшением площади внешней поверхности.
Кривые титрования Na-смектита, полученные на фоне разных концентраций электролита, не пересекаются, хотя в диапазоне рН от 5 до 8 все три линии расположены близко друг другу (рис. 3, А).
Рис. 3.
Кривые титрования Na- (А) и Na–Al-смектита (Б). 1, 2 и 3 – концентрация фонового электролита NaCl 0.1, 0.01 и 0.001 н. соответственно.
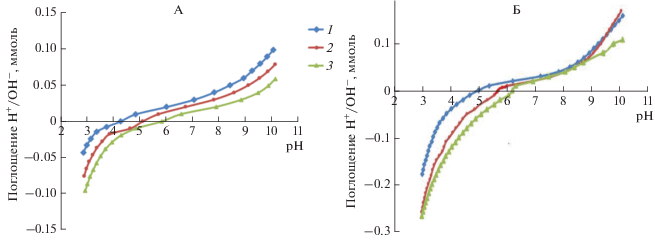
Отсутствие точки пересечения трех кривых обусловлено наличием постоянного (хотя и слабого) отрицательного заряда в решетке смектита. Наиболее близко друг к другу все три линии проходят в диапазоне значений рН от 5 до 6. На примере Na-формы вайомингского бентонита показано, что рН точки нулевого заряда, который обеспечивается алюминольными группировками на боковых сколах монтмориллонита, составляет около 6.5 единиц [29].
Две кривых титрования Na–Al-смектита, полученные для фоновых концентраций электролита 0.01 и 0.001 н. NaCl, пересеклись при рН около 7.2 (рис. 3, табл. 3). Такое смещение в сторону бòльших значений рН по сравнению с Na-смектитом можно объяснить наличием в межслоях Na-Al-смектита гидроксидов алюминия разной основности. Показано, что величина рНТНЗ для гиббсита и аморфного Al(OH)3 колеблется в пределах значений рН 7.8–9.7 [28].
Из приведенного выше экспериментального материала следует, что насыщение Na-смектита аквагидроксокомплексами алюминия привело к образованию минерала с устойчивыми к нагреванию фрагментами добавочной октаэдрической сетки, свойства которого близки к диагностированным нами ранее в горизонте AEL подзолистой почвы почвенными хлоритами [8].
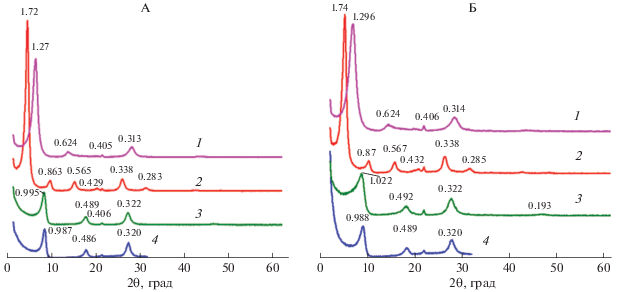
Минералогический состав тест-минералов, после их годичного пребывания в почве. Практически во всех образцах в заметных количествах присутствует кварц, который диагностируется по отражениям 0.334 нм (101) и 0.426 нм (100) (рис. 4). Присутствие кварца в образцах после проведения эксперимента в большем количестве по сравнению с его содержанием в исходных тест-минералах объясняется тем, что использованный в работе прием удаления зерен кварца, внесенного в контейнеры вместе со смектитом не позволяет полностью очистить тест-минерал от кварца.
Рис. 4.
Рентгендифрактограммы Na(Са)-смектита после 1 года пребывания в почве в воздушно-сухом состоянии (А), насыщенных этиленгликолем (Б) и прокаленных при 350 (В) и 550°С (Г). Числа на кривых – d/n в нм. 1, 3 и 5 – номера образцов.
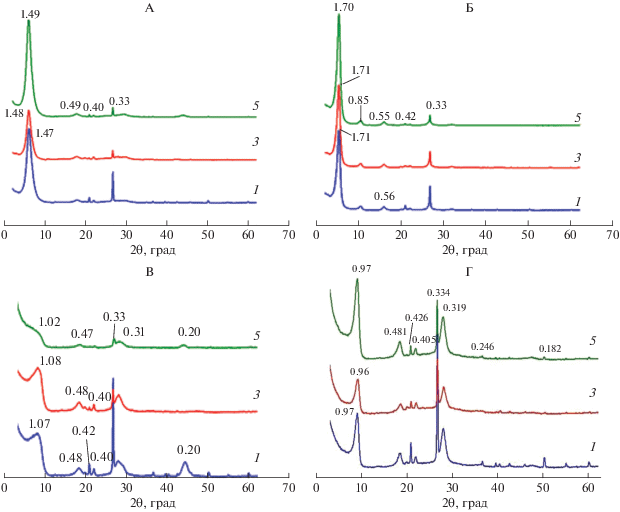
На рентгенограммах воздушно-сухих образцов Na(Са)-смектита после пребывания в почве наблюдаются отражения, соответствующие межплоскостному расстоянию в диапазоне 1.47–1.49 нм (рис. 4, А). Указанные межплоскостные расстояния сопоставимы с таковыми для Са-формы исходного смектита (кривая 1, рис. 1, А) и приблизительно на 0.3 нм больше, чем у исходного Na-смектита, помещенного в почву (кривая 3, рис. 1, В). Пребывание в почве практически не повлияло на способность бентонита увеличивать межплоскостное расстояние при насыщении этиленгликолем (рис. 1 и 4).
На дифрактограммах образцов во всех трех повторностях после прокаливания при 350°С наблюдается неполное сжатие кристаллической решетки, которое диагностируется по широкому асимметричному в сторону малых углов пику с максимумом, соответствующим d(001) 1.02–1.08 нм, что может свидетельствовать о наличии в межслоях полигидроксокатионов алюминия (рис. 4, В).
На рентгенограммах воздушно-сухих образцов Na(Са)-Al-смектита прописываются отражения первого порядка, соответствующие межплоскостному расстоянию от 1.47 до 1.50 нм в разных повторностях (рис. 5, А).
Рис. 5.
Рентгендифрактограммы Na(Са)–Al-смектита в воздушно-сухом состоянии (А), насыщенных этиленгликолем (Б) и прокаленных при 350 (В) и 550°С (Г). Числа на кривых – d/n в нм. 1–5 – номера образцов.
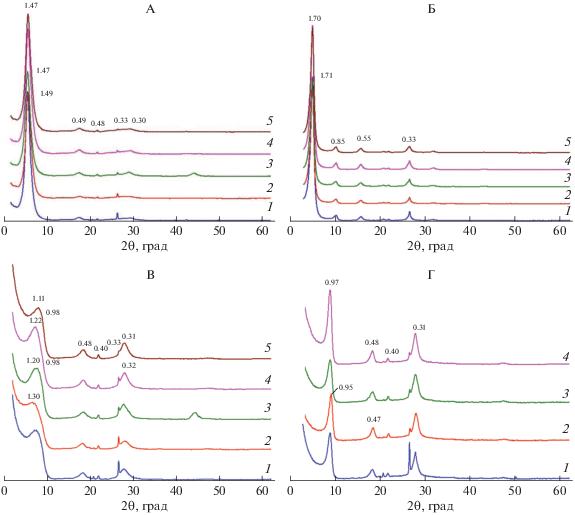
Способность к набуханию у Na(Са)-Al-смектита после пребывания в почве несколько снизилась по сравнению с Na-Al-смектитом до его закладки в почву (рис. 1, В, 5, Б). После пребывания в почве межплоскостное расстояние Na(Ca)-Al-смектита при насыщении этиленгликолем варьировало от 1.69 до 1.72 нм, в то время как перед закладкой в почву у Na-Al-смектита составляло 1.74 нм.
После пребывания в почве на всех рентгенограммах Na(Ca)-Al-смектита наблюдается неполное сжатие решетки при прокаливании при 350°С, диагностируемое по асимметрии пика в сторону малых углов (рис. 5, В), которое можно объяснить частичным заполнением межслоев полигидроксокатионами алюминия. Максимум отражения первого порядка соответствует межплоскостному расстоянию, варьирующему в диапазоне от 1.11 до 1.30 нм в разных повторностях, которое на 0.09–0.22 нм больше по сравнению с таковым у Na(Са)-смектита (рис. 4, B).
Прокаливание до 550°С приводит к практически полному сжатию решетки минерала до ≈1 нм (рис. 5, Г).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Из приведенного фактического материала следует, что основные изменения, которые произошли со смектитом, помещенным в почву в Na- и Na-Al-формах, заключаются в частичном заполнении межслоевых промежутков полигидроксокатионами алюминия, которое приводит к образованию хлоритизированных слоев (HI). Отсутствие самостоятельного отражения, соответствующего d(001), равному 1.42 нм, на рентгенограммах Na(Са)- и Na(Са)-Al-смектитов, насыщенных этиленгликолем свидетельствует о том, что за 1 год проведения эксперимента дискретная фаза почвенного хлорита не образовалась.
Описанное уменьшение способности к расширению кристаллической решетки вдоль оси с при насыщении этиленгликолем и бòльшие межплоскостные расстояния, наблюдаемые в результате прокаливания при 350°С у Na(Са)-Al-смектита, по сравнению с Na(Са)-смектитом свидетельствуют о том, межслои Na(Са)-Al-смектита оказались хлоритизированными в бòльшей степени по сравнению с таковыми у Na(Са)-смектита. Как уже было сказано, процессы хлоритизации (образования HIS и HIV) в почвах обратимы, и их направление зависит от кислотно-основного состояния почвы, концентрации в почвенном растворе мономеров аквагидроксокомплексов алюминия и состава и концентрации ингибиторов полимеризации – анионов органических кислот. Наблюдаемая в условиях проведенного эксперимента алюминизация Na(Са)-смектита и увеличение ее степени в Na(Са)-Al-смектите являются результатом того, что в течение года проведения эксперимента процесс полимеризации гидроксокомплексов алюминия в межслоях смектита в целом доминировал над процессом деполимеризации.
Для одной из повторностей Na(Са)-Al-смектита провели моделирование экспериментальных дифракционных картин. Образец в воздушно-сухом состоянии состоит из 45 и 26% кристаллитов с одинаковым числом слоев, содержащих 2 и 1 слой молекул воды (кривые 3 и 4, рис. 6, А). После насыщения этиленгликолем смектитовые слои становятся однородными и содержат два слоя молекул этиленгликоля (кривая 3, рис. 6, Б, табл. 4).
Рис. 6.
Экспериментальные (1) и рассчитанные (2) дифракционные картины Na(Са)-Al-смектита в воздушно-сухом состоянии (А) и насыщенного этиленгликолем (Б); 3, 4 − модели для кристаллитов смектита, имеющих разное соотношение межслоев с различным количеством слоев воды, 5 – модель HIS (пояснения в тексте). Вертикальные линии и множитель над ними показывают кратность увеличения интенсивности. Штриховкой показаны области, исключенные из моделирования. Rp – ошибка моделирования.
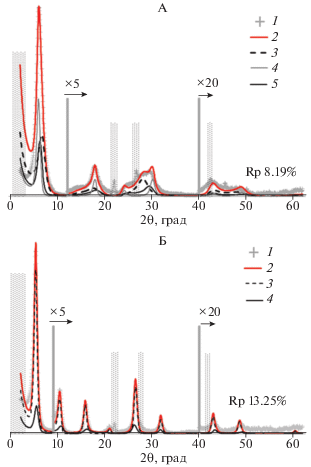
Таблица 4.
Некоторые структурные параметры Na(Са)-Al-смектита в расчете на О20(ОН)4
| Минерал | Слой | d, Å | Caint | Alint | Feoct | N | Содержание в образце, % |
|---|---|---|---|---|---|---|---|
| Образец в воздушно-сухом состоянии | |||||||
| R0-смектит 2W/1W/0W: 30/40/30* |
2W | 14.99 | 0.3 | 0 | 0.56 | 5 | 45 |
| 1W | 12.79 | 0.3 | 0 | 0.56 | |||
| 0W | 10.09 | 0.3 | 0 | 0.56 | |||
| Смектит 2W/1W: 100/0 |
2W | 14.8 | 0.3 | 0 | 0.50 | 5 | 26 |
| R0 HIS HI/1W/2W 28/37/35 |
HI | 14.0 | 0.2 | 0.4 | 0.5 | 4 | 29 |
| 2W | 15.00 | 0.3 | 0 | 0.52 | |||
| 1W | 12.50 | 0.3 | 0 | 0.52 | |||
| Образец, насыщенный этиленгликолем | |||||||
| R0-смектит 2Gly | 2Gly | 16.85 | 0.3 | 0 | 0.50 | 5 | 75 |
| R0 HIS HI/2Gly 28/72 |
HI | 14.3 | 0.2 | 0.4 | 0.50 | 4 | 25 |
| 2Gly | 16.80 | 0.3 | 0 | 0.50 | |||
Согласно подобранной модели, для воздушно-сухого и насыщенного этиленгликолем состояний 29 и 25% кристаллитов в образце соответственно представлены неупорядоченным смешанослойным минералом, состоящим из смектитовых слоев, межслоевые промежутки которых заполнены катионами Ca2+ и слоев с межслоевыми промежутками, частично заполненными полигидроксокомплексами алюминия и катионами Ca2+ (HI) (кривая 5, рис. 6, А). В таких кристаллитах содержится 28% слоев HI и 37 и 35% смектитовых слоев с двумя и одним слоем молекул воды соответственно. После насыщения этиленгликолем кристаллиты становятся более однородными и содержат 28% слов HI и 72% смектитовых слоев с двумя слоями молекул этиленгликоля (2 Gly) (кривая 4, рис. 6, табл. 4).
Количество атомов алюминия в расчете на формульную единицу в предлагаемой модели равно 0.4. Если считать, что заряд слоя смектита составляет 0.6, а 0.4 заряда компенсируется 0.2 атомами Са в расчете на формульную единицу (О20(ОН)4), то на 1 атом алюминия приходится +0.5 единиц заряда. Полученные величины заряда оказались сопоставимы с аналогичными величинами в экспериментах синтеза HIS из бентонитов [14] и были значительно меньше величин, описываемых для алюминизированных вермикулитов (от +0.8 до +1.5) [21]. Возможно, более низкий заряд слоя в смектитах по сравнению с вермикулитами способствует увеличению степени полимеризации гидроксокомплексов алюминия.
Если исходить из того, что максимальное количество атомов алюминия, которое может находиться в межслоях при условии их полного заполнения, составляет 4 на элементарную ячейку, то в изученном образце межслои в HIS заполнены алюминием на ≈10%.
Таким образом, в условиях проведенного эксперимента при наличии в образце ≈30% HIS, в составе которого содержится ≈28% HI-слоев, на ≈10% заполненных алюминием, диагностируется очень незначительная потеря способности смектита к набуханию при насыщении этиленгликолем. Однако при нагревании образца до 350°С 30% хлоритизированных слоев, описанного выше состава, оказалось достаточно, чтобы обеспечить неполное сжатие решетки минерала до 1.0 нм, наблюдаемое на рентгенограммах образцов. Можно предположить, что наблюдаемое в эксперименте неполное сжатие кристаллической решетки обеспечивается высокой степенью полимеризации относительного небольшого количества аквагидроксокомплексов алюминия в межслоях HI.
На основании моделирования экспериментальных дифракционных картин, осуществленного для одной из повторностей опыта, можно заключить, что в условиях проведенного эксперимента хлоритизация затрагивает не все кристаллиты. Это можно объяснить неравномерностью распределения в пространстве тонких корней растений и грибных гиф, а также состава почвенного раствора.
ВЫВОДЫ
1. Наблюдаемая хлоритизация Na-смектита и увеличение степени хлоритизации в Na-Al-смектита в течение года проведения эксперимента являются результатом доминирования процесса полимеризации аквагидроксокомплексов алюминия в межслоях смектита над процессом деполимеризации.
2. Хлоритизация смектита приводит к образованию неупорядоченного смешанослойного минерала, состоящего из смектитовых слоев, межслоевые промежутки которых заполнены катионами Ca2+, и слоев с межслоевыми промежутками, частично заполненными полигидроксокатионами алюминия и катионами Ca2+.
3. За один год проведения эксперимента дискретная фаза почвенного хлорита не образовалась.
4. В условиях проведенного эксперимента хлоритизация затрагивает не все кристаллиты тест-минерала. Это можно объяснить неравномерностью распределения в пространстве тонких корней растений, грибных гиф и состава почвенного раствора.
Список литературы
Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 341 с.
Классификация и диагностика почв СССР. М.: Колос, 1977. 221 с.
Роде А.А. Подзолообразовательный процесс. М.–Л.: Изд-во АН СССР, 1937. 454 с.
Соколова Т.А., Григорьева Е.Е. О количественном определении минералов группы почвенных хлоритов // Почвоведение. 1985. № 7. С. 132–135.
Таргульян В.О., Соколова Т.А., Бирина А.Г., Куликов А.В., Целищева Л.К. Организация, состав и генезис дерново-палево-подзолистой почвы на покровных суглинках. Аналитическое исследование // X межд. конгресс почвоведов. М., 1974. С. 110.
Толпешта И.И., Леман М. Пространственное варьирование и оценка аддитивности показателей кислотно-основного состояния палево-подзолистых почв Центрально-лесного заповедника // Вестник Моск. ун-та. Сер. 17, почвоведение. 2000. № 3. С. 12–19.
Толпешта И.И., Соколова Т.А. Подвижные соединения алюминия в почвах катен южной тайги (на примере почв Центрально-Лесного заповедника) // Почвоведение. 2010. № 8. С. 956–968. https://doi.org/10.1134/S1064229310080065
Толпешта И.И., Соколова Т.А., Бонифачио Э., Фальсонэ Г. Почвенные хлориты в подзолистых почвах разной степени гидроморфизма: происхождение, и условия образования // Почвоведение. 2010. № 7. С. 831–842. https://doi.org/10.1134/S1064229310070082
Толпешта И.И., Соколова Т.А., Воробьева А.А., Изосимова Ю.Г. Трансформация триоктаэдрической слюды в верхнем минеральном горизонте подзолистой почвы по результатам двухлетнего полевого эксперимента // Почвоведение. 2018. № 7. С. 868–881. https://doi.org/10.1134/S0032180X18070134
Aplin A.C., Matenaar I.F., McCarty D.K., van der Pluijm B.A. Influence of mechanical compaction and clay mineral diagenesis on the microfabric and pore-scale properties of deep-water Gulf of Mexico mudstones // Clays Clay Minerals. 2006. V. 54. P. 500–514.
Bain D.C., Strand L.T., Gustafsson J.P., Melkerud P.-A., Fraser A.R. Chemistry, mineralogy and morphology of spodosols at two Swedish sites used to assess methods of counteracting acidification // Water, Air, and Soil Pollution: Focus. 2003. V. 3. P. 29–47.
Barnhisel R.I., Bertsch P.M. Chlorites and hydroxy-inter layered vermiculite and smectite // Minerals in soil environments / Eds. Dixon J.B., Weed S.B. SSSA, Madison, WI. 1989. P. 729–788.
Bonifacio E., Falsone G., Simonov G., Sokolova T., Tolpeshta I. Pedogenic processes and clay transformations in bisequal soils of the Southern Taiga zone // Geoderma. 2009. V. 149. P. 66–75.
Dietel J., Groger-Trampe J., Bertmer M., Kaufhold S., Ufer R., Dohrmann K. Crystal structure model development for soil clay minerals – I. Hydroxyinterlayered smectite (HIS) synthesized from bentonite. A multi-analytical Study // Geoderma. 2019. V. 347. P. 135–149.
Egli M., Mirabella Al., Mancabelli A., Sartori G. Weathering of soils in Alpin areas as influenced by climate and parent material // Clays Clay Minerals. 2004. V. 52. № 3. P. 287–303.
Ferrage E., Lanson B., Sakharov B.A., Geoffroy N., Jacquot E., Drits V.A. Investigation of dioctahedral smectite hydration properties by modeling of X-ray diffraction profiles: influence of layer charge and charge location // Am. Mineralogist. 2007. V. 92. P. 1731–1743.
Ferrage E., Tournassat C., Rinnert E., Lanson B. Influence of pH on the interlayer cationic composition and hydration state of Ca-montmorillonite: analytical chemistry, chemical modelling and XRD profile modelling study // Geochim. Cosmochim. Acta. 2005. V. 69. № 11. P. 2797–2812.
Goh T.B., Huang P.M. Formation of hydroxy-Al-montmorillonite complexes influenced by citric acid // Can. J. Soil Sci. 1984. V. 64. P. 411–421.
Huang L., Tan W., Liu F., Hu H., Huang Q. Composition and Transformation of 1.4 nm Minerals in Cutan and Matrix of Alfisols in Central China // J. Soil Sediments. 2007. V. 7. № 4. P. 240–246.
Hubert F., Caner L., Meunier A., Ferrage E. Unraveling complex <2 μm clay mineralogy from soils using X-ray diffraction profile modeling on particle-size sub-fractions: Implications for soil pedogenesis and reactivity // Am. Mineralogist. 2012. V. 97. P. 384–398.
Lanson B., Ferrage E., Hubert F., Prêt D., Mareschal L., Turpault M.-P., Ranger J. Experimental aluminization of vermiculite interlayers: An X-ray diffraction perspective on crystal chemistry and structural mechanisms // Geoderma. 2015. V. 249–250. P. 28–39.
Mareschal L., Ranger J., Turpault M.P. Stoichiometry of a dissolution reaction of a trioctahedral vermiculite at pH 2.7 // Geochim. Cosmochim. Acta. 2009. V. 73. 307–319.
Meunier A. Soil Hydroxy-Interlayered Minerals: a re-Interpretation of their crystallochemical Properties // Clays Clay Minerals. 2007. V. 55. № 4. P. 380–388.
Rich C.I. Hydroxy interlayers in expansible layer silicates // Clays Clay Minerals. 1968. V. 16. P. 15–30.
Sakharov B.A., Lanson B. X-ray Identification of Mixed-Layer Structures. Modelling of Diffraction Effects. Part B: Techniques and Applications / Eds. Bergaya F., Lagaly G. Elsevier, 2013. P. 51–135.
Sartori F., Riffaldi R., Levi-Minzi R. Occurrence of chloritic intergrades in the recent sediments of the Arno river (Italy) // Clay Minerals. 1979. V. 14. № 47. P. 47–65.
Sato T., Watanabe T., Otsuka R. Effects of layer charge, charge location, and energy change on expansion properties of dioctahedral smectites // Clays Clay Minerals. 1992.V. 40. № 1. P. 103–113.
The Environmental Chemistry of Aluminum / Ed. Sposito G. CRC Press, Inc., 1996.
Tombacz E., Szekeres M. Colloidal behavior of aqueous montmorillonite suspensions: the specific role of pH in the presence of indifferent electrolytes // Appl. Clay Sci. 2004. V. 27. P. 75–94.
Turpault M.-P., Righi D., Utérano C. Clay minerals: Precise markers of the spatial and temporal variability of the biogeochemical soil environment // Geoderma. 2008. V. 147. P. 108–115.
Von Blum W. Bildung sekundärer Al-(Fe)-Chlorite // Z. Pflanzenern. Bodenk. 1976. Heft 1. P. 107–125.
World Reference Base for Soil Resources 2006, first update 2007. World Soil Resources Reports. № 103. FAO, Rome. 116 p.
World reference base for soil resources 2014. International soil classification system for naming soils and creating legends for soil maps. Update 2015 food and agriculture organization of the united nations. Rome, 2015. 192 p.
Дополнительные материалы отсутствуют.


