Почвоведение, 2021, № 1, стр. 80-89
Прокариотный компонент нефтезагрязненной торфяной олиготрофной почвы при разном уровне минерального питания
Н. А. Манучарова a, *, Н. А. Ксенофонтова a, А. А. Белов a, Н. Н. Каменский a, А. В. Арзамазова a, Г. М. Зенова a, Р. Р. Кинжаев a, С. Я. Трофимов a, А. Л. Степанов a
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: manucharova@mail.ru
Поступила в редакцию 15.04.2020
После доработки 16.05.2020
Принята к публикации 12.07.2020
Аннотация
Молекулярно-биологическими методами исследованы разнообразие и биомасса метаболически активных прокариотных клеток в олиготрофной торфяной почве, загрязненной нефтью при разных уровнях минерального питания. Установлено, что доля метаболически активных компонентов в образцах исследованного торфа составляет 0.1 часть (10%) от прокариотного сообщества. Внесение в загрязненную почву полного минерального удобрения (N40P50K50) на фоне известкования (1/2 гидролитической кислотности) приводит к возрастанию более чем в 2 раза биомассы клеток прокариот, числа копий функциональных генов (bss и nifH) и значимому уменьшению содержания нефтепродуктов. Внесение полного минерального удобрения на фоне известкования в загрязненной нефтью почве сопровождается изменением филогенетической структуры и частичным восстановлением метаболически активного прокариотного комплекса.
ВВЕДЕНИЕ
Обширные территории Российской Федерации, на которых происходят разливы нефти, приурочены к зонам торфяных почв средней и северной тайги. Основными характеристиками таких почв являются: высокая кислотность, низкие величины окислительно-восстановительного потенциала, малое содержание основных элементов питания, низкая скорость минерализации органического вещества, что негативно влияет на их способность к самовосстановлению после антропогенных нарушений [8]. Нефтяное загрязнение способно значительно влиять на свойства этих почв. Так, при разливах нефти на болотах значение окислительно-восстановительного потенциала торфяных почв уменьшается [8]. Все это приводит к изменению структуры микробного сообщества, увеличению количества микроорганизмов с анаэробным дыханием, что сопряжено и с разложением нефтепродуктов [8]. Установлено, что в средах без молекулярного кислорода или его лимитированием, микроорганизмы используют альтернативные акцепторы электронов для анаэробного дыхания [18]. Для выявления роли микроорганизмов в биодеградации поллютантов в окружающей среде следует оценивать структуру и активность их сообщества in situ прямыми методами.
Целью настоящего исследования являлась оценка разнообразия и активности прокариотного сообщества загрязненной нефтью торфяной олиготрофной почвы в условиях разного минерального питания.
ОБЪЕКТЫ И МЕТОДЫ
Объектом исследования явился верхний слой (0–20 см) торфяной олиготрофной почвы Fluvic Histosol, отобранной в периферийной части нефтезагрязненной крупной мочажины Среднеобской низменности (территория Приобского нефтяного месторождения вблизи села Селиярово, Ханты-Мансийский р-н ХМАО; GPS координаты: 61°31′24.71″ с. ш., 70°26′76.10″ в. д.). Продолжительность нефтяного загрязнения почвы при отборе ее образцов составляла более трех лет. Контролем служили образцы верхнего горизонта (0–20 см) торфяной олиготрофной почвы (Fluvic Histosol) болотного грядово-мочажинного комплекса (ГМК), не загрязненной нефтью (фон).
Определение агрохимических свойств торфяной почвы выполнено следующими методами: рНKCl (ГОСТ 26483); влажность (термостатно-весовой метод) (ГОСТ 11305-2013); гидролитическая кислотность (ГОСТ 26212); подвижные формы фосфора и обменного калия (ГОСТ 26207). Содержание нефтепродуктов в почве определяли методом ИК-спектрометрии (ПНД Ф 16.1:2.2.22-98).
рНKCl составил 3.85; гидролитическая кислотность (Нг) 127.2 ммоль/100 г, подвижные соединения фосфора (P2O5)12.2 ± 1.5 мг/кг и калия (K2O) 14.6 ± 2.6 мг/кг, содержание нефтепродуктов (НП) 129 400 ± 2225 мг/кг и их исходная влажность (W) – 326%.
В почвенные образцы вносили следующие минеральные соли: NH4NO3; Ca(H2PO4)2; K2SO4, которые служили элементами питания (NPК). Дозы этих солей составляли (мг/100 г почвы) N20P30K30 (средний уровень обеспеченности, далее 0.5 NPK) и N40P50K50 (повышенный уровень, далее 1 NPK). Уровни обеспеченности элементами минерального питания создавались в соответствии с группировками по наличию и доступности минерального азота, подвижного фосфора и обменного калия, разработанными Белорусским НИИ почвоведения и агрохимии для торфяных почв [7]. Гидролитическую кислотность (Нг) нейтрализовали Ca(OH)2 на 50% в вариантах половины гидролитической кислотности (0.5 Нг) и 100% в вариантах полной гидролитической кислотности (1 Нг). Исследуемые варианты эксперимента представлены в табл. 1.
Таблица 1.
Варианты эксперимента
| № | Вариант |
|---|---|
| 1 | Контроль (фон) |
| 2 | Контроль нефтезагрязненный (КН) |
| 3 | КН + 0.5 Нг (1/2 гидролитическая кислотность) |
| 4 | КН + 0.5 Нг + 0.5NPK (N20P30K30) |
| 5 | КН + 0.5 Нг + 1NPK(N40P50K50) |
| 6 | КН + 0.5 Нг + б. (бактериальная суспензия) |
| 7 | КН + 0.5 Нг + 0.5NPK + б. |
| 8 | КН + 0.5 Нг + 1NPK + б. |
| 9 | КН + 1Нг (полная гидролитическая кислотность) |
| 10 | КН + 1Нг + 0.5NPK |
| 11 | КН + 1Нг + 1NPK |
| 12 | КН + 1Нг + б. |
| 13 | КН + 1Нг + 0.5NPK + б. |
| 14 | КН + 1Нг + 1NPK + б. |
В ряд вариантов опыта (6–8 и 12–14 см) была внесена культура бактерий рода Pseudomonas, способных к росту на среде Эванса с нефтью в качестве единственного источника углерода [10] и на среде Эшби без источников азота [5]. Суспензию стационарных клеток бактерий вносили в концентрации 107 кл/мл.
Для проведения опыта использованы сосуды объемом 1.5 л. Почву инкубировали при комнатной температуре (20–22°С) в течение восьми недель с поддержанием первоначальной влажности (326%, весовой метод).
Численность прокариот определяли люминесцентно-микроскопическим методом с использованием различных флуорохромов: (акридиновый оранжевый, Су3). Общую численность прокариот в почве определяли с помощью красителя акридина оранжевого, который растворяли в воде в соотношении 1 : 10 000. Почвенную суспензию (разведение 1 : 100) обрабатывали ультразвуком, а затем ее аликвоту (10 мкл) наносили на предметное стекло и фиксировали пламенем горелки. Подготовленные таким образом стекла окрашивали (3 мин), а затем помещали в воду (5 мин, 2 раза). Эксперимент проводили в трехкратной повторности. Подсчет клеток бактерий проводили с использованием люминесцентного микроскопа ZEISS Microscope Axioskop 2 plus (Германия) со светофильтром Filterset 09 (λ = 450 – 490 нм). Количество микробных клеток в 1 г почвы вычисляли по формуле: N = 4an × 1010/S; где N – количество клеток в 1 г почвы, а – среднее число клеток в поле зрения, 4 × 108 – площадь фиксированного препарата (мкм2), n – показатель разведения [5]. Удельную массу микроорганизмов принимали равной 1 г/см3, а содержание воды в клетках – 80%. Сухая биомасса одноклеточных бактерий и актиномицетов вычисляли умножением их численности на средние значения массы клетки или участка мицелия. Масса бактериальной клетки принималась равной 2 × 10–14 г, актиномицетного мицелия длиной 1 м при диаметре 0.5 мкм – 3.9 × 10–8 г [3].
Метаболически активные прокариоты определяли методом in situ-гибридизации с рРНК-специфичными флуоресцентно-мечеными олигонуклеотидными зондами (FISH), меченным Cy3 красителем. Были применены зонды, специфичные для доменов Archaea и Bacteria.
Экстракция тотальной ДНК из почвы выполнена из образцов массой 0.2 г с помощью набора Power Soil DNA Isolation Kit (MO BIO Laboratories, США) согласно протоколу производителя.
Оценку численности рибосомальных генов бактерий и архей осуществляли методом полимеразной цепной реакции (ПЦР) в реальном времени [14]. Реакцию проводили в амплификаторе DТLite4 ДНК-Технология. Реакционную смесь готовили из препарата Super Mix Eva Green (“Bio-Rad”). В качестве стандартов концентрации генов 16S рРНК для бактерий использовали растворы клонированных фрагментов рибосомального оперона штамма К12 Esherichia coli, для архей – штамма FG-07 Halobacterium salinarum. Использовали следующие ДНК-специфичные праймеры:
arc915f 5'-AGGAATTGGCGGGGGAGCAC-3';
arc1059r5'-GCCATGCACCWCCTCT-3';
Eub338f5'-ACTCCTACGGGAGGCAGCAG-3';
Eub518r5'-ATTACCGCGGCTGCTGG-3'.
Протокол реакции (температурный профиль) был следующим: 95°С – 3 мин → (95°С – 10 с → → 50°С – 10 с → 72°С – 20 с + детекция флуоресценции)×49 циклов [14]. Для каждого варианта эксперимента (образца) реакцию проводили в трех повторностях. Обработка результатов измерения выполнена с использованием пакета программы Real time_PCR.
Для выявления функциональных генов, указывающих на процессы анаэробной деградации углеводородов нефти использовали следующую систему праймеров:
BssADegF15'-CTGRTYTWYGAMGARAAGAAG-3';
BssADegR1 5'-AGYACBGCVGTYGGBCCATT-3';
BssADegF2 5'-AATGGVCCRACBGCVGTRCT-3';
BssADegR2 5'-ACSMMGTTRAACTGSACRTG-3'.
Амплификацию проводили по программе: денатурация ДНК (98°С, мин) и последующие 40 циклов реакции, в которые входит денатурация ДНК (98°С, 10 с), отжиг праймеров (58°С, 10 с) и элонгация (65°С, 1 мин) [20]. В результате работы фермента бензилсукцинатсинтазы (bss – ген), толуол используется бактериями через промежуточный продукт – бензилсукцинат, что является начальным этапом деградации циклических углеводородов в анаэробных условиях [20].
Для определения наличия гена, отвечающего за способность обеспечения системы азотом (nifH) использовали следующие праймеры и условия:
Forward5'-GGTTGTGACCCGAAAGCTGA-3';
Reverse 5'-GCGTACATGGCCATCATCTC-3'.
Амплификация: 94°C –1 мин, (94°C 30 с, 50°C 1 мин, 72°C 30 с) (40 циклов), 72°C 10 мин [15].
Высокопроизводительное секвенирование. С целью выявления биоразнообразия прокариотного комплекса исследуемых почв применяли метод высокопроизводительного секвенирования консервативного участка гена 16S рРНК [22]. Для экстракции тотальной ДНК прокариот использовали набор Power Soil DNA Isolation Kit (MO BIO, США согласно инструкции производителя). Амплификацию фрагментов гена 16S рРНК осуществляли с помощью праймеров, комплементарных последовательностям бактерий и архей:
PRK341F 5'-CCTACGGGRBGCASCAG-3';
PRK806R 5'-GGACTACYVGGGTATCTAAT-3'.
Полученные ПЦР-фрагменты очищали на колонках QIAquick согласно протоколу производителя. Каждый ПЦР-фрагмент растворяли в 50 мкл ТЕ-буфера. Нуклеотидные последовательности вариабельных фрагментов генов 16S рибосомальных РНК из образцов метагеномной ДНК определяли с помощью высокопроизводительного секвенирования [22]. Секвенирование проводили на секвенаторе Illumina Miseq, время прочтения 39 ч, количество pair-endreads (парных прочтений) – 8 млн. Затем с обоих концов ДНК формировали файл с прямыми и обратными прочтениями, которые представляли собой текстовое описание первичной структуры линейных макромолекул в виде последовательности мономеров. Обработку данных секвенирования проводили с использованием автоматизированного алгоритма Quantitative Insights Into Microbial Ecology (QIIME) [13]. При помощи инструментов программы осуществлялись:
– проверка качества секвенирования и создание библиотеки сиквенсов;
– формирование ОТЕ (OTU picking) denovo на основе 97%; удаление синглтонов (“singletons” – ОТЕ, содержащих только один сиквенс) и последовательностей, относящихся к растительным хлоропластам;
– определение филогенетического состава сообществ на разных таксономических уровнях при помощи базы данных разнообразия гена RDP classifier [21].
Статистическую обработку данных проводили с помощью программы STATISTICA 6.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
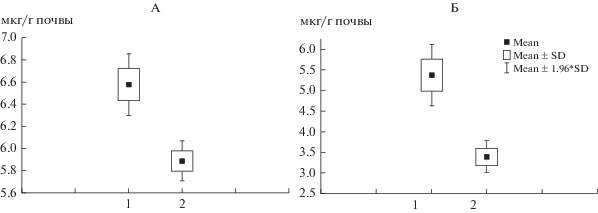
Биомасса прокариот. Выявлено, что в незагрязненной нефтью торфяной олиготрофной почве сухая биомасса прокариот достигала в среднем 65 мкг/г почвы (рис. 1, А), абиомасса метаболически активных клеток прокариот не превышала 6.5 мкг/г почвы (рис. 1, Б), что составило около 10%. В загрязненной нефтью почве наблюдали уменьшение биомассы прокариот и доли метаболически активных клеток по сравнению с контролем. Значения общей биомассы находились в диапазоне от 57 до 60 мкг/г почвы (рис. 1, А), а биомасса метаболически активных клеток в загрязненных образцах не превышала 3.5 мкг/г, что составляет только 5% от всех выявляемых прокариот (рис. 1, Б).
Рис. 1.
Биомасса прокариот (А) и их метаболически активных клеток (Б) в торфяной олиготрофной почве: 1 – контроль (без нефти), 2 –загрязненной нефтью.
Внесение минеральных солей (источники питания NPK и известь) в загрязненную нефтью почву способствовало увеличению биомассы прокариот (табл. 2). Для вариантов с внесением повышенного минерального питания (N40P50K50) и низкой (0.5 Нг) гидролитической кислотностью выявлена наибольшая биомасса прокариот, достигающая 130 мкг/г почвы, что в 2 раза больше по сравнению с загрязненной почвой без внесения солей (нефтезагрязненный вариант, КН). Внесение в почву бактериальных культур, способных к деструкции углеводородов нефти, на фоне минеральных солей не приводило к статистически значимому изменению прокариотной биомассы в исследуемых вариантах эксперимента.
Таблица 2.
Убыль нефтепродуктов и суммарная биомасса прокариот в загрязненной нефтью торфяной олиготрофной почве в фоновом варианте и с внесением удобрений и извести в соответствии со схемой опыта
| Вариант | Убыль НП, % | Количество клеток в 1 г | Биомасса прокариот, мкг/г почвы |
|---|---|---|---|
| КН | 2.2 | 2.91E+09 | 58.2 ± 2.2* |
| КН + 0.5Нг | 4.2 | 2.94E+09 | 58.7 ± 2.03 |
| КН + 0.5Нг + 0.5NPK | 6.3 | 4.28E+09 | 85.7 ± 2.8 |
| КН + 0.5Нг + 1NPK | 11.7 | 6.53E+09 | 130.5 ± 2.1 |
| КН + 0.5Нг + б. | 7.3 | 3.14E+09 | 62.8 ± 2.1 |
| КН + 0.5Нг + 0.5NPK + б. | 7.1 | 4.28E+09 | 85.6 ± 2.4 |
| КН + 0.5Нг + 1NPK + б. | 11 | 4.67E+09 | 93.4 ± 2.0 |
| КН + 1Нг | 2.8 | 3.34E+09 | 66.9 ± 2.9 |
| КН + 1Нг + 0.5NPK | 3.8 | 4.39E+09 | 87.8 ± 2.3 |
| КН + 1Нг + 1NPK | 4.5 | 3.08E+09 | 61.6 ± 2.6 |
| KН + 1Нг + б. | 7.2 | 2.75E+09 | 55.0 ± 2.5 |
| KН + 1Нг + 0.5NPK + б. | 7.8 | 3.12E+09 | 62.5 ± 2.1 |
| KН + 1Нг + 1NPK + б. | 3.1 | 3.61E+09 | 72.2 ± 2.3 |
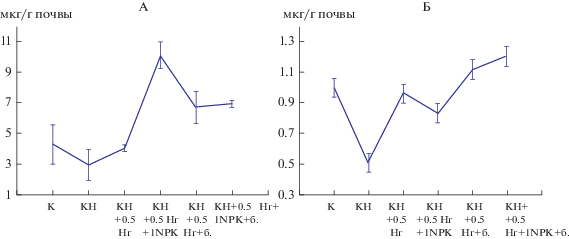
Молекулярно-биологическими методами (ПЦР в реальном времени и FISH) получены схожие результаты. Численность архейных и бактериальных компонентов сообщества по числу копий гена 16S рРНК была максимальной в вариантах с повышенным уровнем минерального питания и нейтрализованной на половину гидролитической кислотностью и достигала 1 × 1011 копий гена/мл для бактерий и 2 × 108 копий гена/мл – для архей (табл. 3). Биомасса метаболически активных клеток представителей доменов Bacteria и Archaea также увеличивалась в вариантах с повышенным уровнем минерального питания и 1/2 гидролитической кислотностью (0.5 Нг), более чем в 2 раза по сравнению с загрязненной почвой без применения ремедиации (нефтезагрязненная почва, КН) (рис. 2, А, Б).
Таблица 3.
Число копий гена 16S рРНК представителей домена Bacteria и Archaea в загрязненной нефтью торфяной олиготрофной почве в фоновом варианте и с внесением удобрений и извести в соответствии со схемой опыта*
| Вариант | Число копий гена Bacteria/мл | Число копий гена Archaea/мл |
|---|---|---|
| КН | 2.44E+10 | 4.54E+07 |
| КН + 0.5 Нг | 5.07E+10 | 4.24E+07 |
| КН + 0.5Нг + 0.5NPK | 6.35E+10 | 9.61E+07 |
| КН + 0.5Нг + 1NPK* | 1.09E+11 | 1.34E+08 |
| КН + 0.5Нг + б. | 4.18E+10 | 4.64E+07 |
| КН + 0.5Нг + 0.5NPK + б. | 8.27E+10 | 1.16E+08 |
| КН + 0.5Нг + 1NPK + б. | 9.06E+10 | 3.64E+07 |
| КН + 1Нг | 2.38E+10 | 5.39E+07 |
| КН + 1Нг + 0.5NPK | 5.39E+10 | 2.16E+07 |
| КН + 1Нг + 1NPK | 3.05E+10 | 3.51E+07 |
| KН + 1Нг + б. | 2.78E+10 | 1.12E+08 |
| KН + 1Нг + 0.5NPK + б. | 6.18E+10 | 1.90E+08 |
| KН + 1Нг + 1NPK + б. | 6.14E+10 | 2.05E+07 |
Рис. 2.
Биомасса (мкг/г почвы) метаболически активных клеток представителей домена Bacteria (А) и домена Archaea (Б) в фоновой почве и с внесением удобрений и извести в соответствии со схемой опыта.
Филогенетическая структура прокариотных сообществ исследуемых почв. Молекулярно-биологическими методами (FISH и высокопроизводительным секвенированием) в исследуемых образцах была выявлена структура метаболически активного прокариотного сообщества.
В незагрязненных нефтью образцах торфа среди домена Bacteria доминировали представители филумов Proteobacteria и Acidobacteria, занимая по 25% от всего выявляемого бактериального комплекса (рис. 3, А). Среди протеобактерий выявляли представителей альфа-, гамма- и дельта-протеобактерий. Представители филогенетических групп Planctomycetes, Actinobacteria, Verrucomicrobia, Bacteroidetes были обнаружены в сообществе в меньших количествах. Представители Firmicutes входили в спектр минорных компонентов. Известны работы отечественных исследователей, рассматривавших структуру метаболически активного прокариотного сообщества торфов, в которых выявлены схожие закономерности [2, 6].
Рис. 3.
Филогенетическая карта структуры бактериального компонента (%) болотной торфяной верховой ненарушенной почвы (контроль) (А) и почвы с сильным загрязнением нефтью (Б).
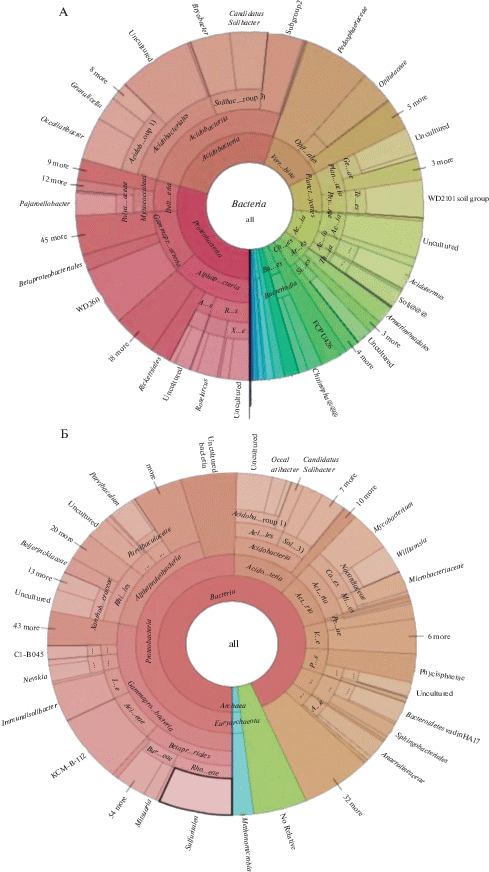
Структура бактериального комплекса в загрязненном нефтью торфе изменялась по сравнению с контрольной почвой. Доля филума Proteobacteria возрастала до 50% от всех выявляемых бактерий (рис. 3, Б). Среди протеобактерий обнаруживались альфа-, гамма- и бета- протебактерии. Стоит отметить, что увеличение протеобактерий происходит за счет появления видов, которые не встречались в незагрязненной почве, например Sulfuritalea, принадлежащим к Betaproteobacteria семейству Sterolibacteriaceae. Данный организм является хемолитоавтотрофом, окисляющим тиосульфаты, серу и водород [12]. Согласно литературным источникам, его используют для деградации ароматических соединений, в частности, для анаэробного разложения бензоатов и фенилацетатов [12]. В бактериальном комплексе загрязненного торфа возрастает доля актинобактерий, причем, если в контрольной почве среди актинобактерий доминировали представители порядка Frankiales (род Acidotermus), то в опытном варианте начинают доминировать представители порядков Micrococcales и Corinebacteriales (представители родов Micobacterim и Williamsia). В литературе имеются сведения о росте некоторых видов рода Williamsia на бензоле [17].
В загрязненной нефтью торфяной почве, подверженной ремедиации, стоит обратить внимание на вариант с большей дозой минеральных удобрений на фоне неполного известкования, где по результатам метода FISH доминирующей группой в прокариотном комплексе остаются протеобактерии и значимо возрастает доля метаболически активных представителей филума Actinobacteria (рис. 4, А). Биомасса представителей этой группы увеличивается в 2 раза – от 0.5 мкг/г почвы (для варианта с нефтью) до 1.1 мкг/ г образца (для почвенного образца с нефтью и удобрением).
Рис. 4.
Значения биомассы (мкг/г почвы) метаболически активных представителей различных филогенетических групп домена Bacteria (А) и Archaea (Б) в загрязненной нефтью торфяной олиготрофной почве в фоновом варианте и с внесением удобрений и извести в соответствии со схемой опыта.
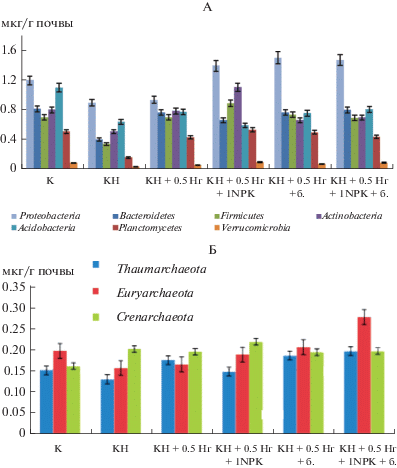
В структуре метаболически активных представителей домена Archaea в загрязненных образцах также происходит перестройка комплекса по сравнению с контрольной почвой. Если в контроле доминирует группа Euryarchaeota, то в загрязненной почве – Crenarchaeota. Применение агрохимических средств приводит к восстановлению исходной, схожей с фоновым вариантом структуры (рис. 4, Б).
Детекция функциональных генов BssA и nifH. В дополнении к характеристике филогенетической структуры прокариотного сообщества был проведен анализ функциональных генов, отвечающих за возможность самовосстановления микробного сообщества исследуемых почв. Рассматривали наличие и число копий генов бактерий анаэробов деструкторов углеводородов. Процесс окисления алканов в анаэробных условиях начинается с карбоксилирования, что приводит к образованию альдегида или жирной кислоты [11]. Так, анаэробное разложение бензола может быть инициировано метилированием в толуол. Толуол включается в метаболизм бактерий через промежуточный продукт – бензилсукцинат, образующийся в результате работы фермента бензилсукцинатсинтазы (bss), что представляет собой начальный этап деградации циклических углеводородов в анаэробных условиях. С другой стороны, рассматривали наличие копий гена бактерий азотфиксаторов (nifH), способных обеспечить систему азотом, что является одним из этапов ремедиации почв.
Ген nifH был обнаружен во всех вариантах опыта. Обращают на себя внимание 2 варианта опыта: с повышенным уровнем удобрений и неполной дозой мелиоранта без бактериального комплекса и с его наличием, где число копий гена составляло 6 × 107 и 4.8 × 107 копий гена/мл среды соответственно (рис. 5, А).
Бактериальный ген, отвечающий за катаболизм толуола, обнаружен также во всех исследуемых образцах (в том числе контрольных). Наименьшие значения, около 5 × 108 копий гена/мл принадлежали контрольным образцам. В вариантах с нефтью, несмотря на пониженную численность и биомассу прокариотного комплекса, установлено увеличение числа копий гена bssА по сравнению с контролем (до 8 × 108). Таким образом, обнаружение повышенного числа копий гена bssА может выступать в качестве показателя индикатора загрязнения (рис. 5, Б). Наибольшие значения числа копий гена bssА обнаружены в варианте с повышенной дозой удобрений и неполной дозой извести, что можно объяснить наибольшей численностью метаболически активных клеток в сообществе данного варианта опыта.
Наибольшие значения для числа копий гена bssA коррелирует с убылью содержания нефтепродуктов в исследуемых вариантах опыта. Наименьшее содержание нефтепродуктов после завершения опыта зафиксирована для варианта с большей дозой минеральных удобрений и неполной дозой мелиоранта (табл. 2).
ЗАКЛЮЧЕНИЕ
В олиготрофной торфяной почве биомасса метаболически активных (имеющих в своей структуре РНК, а, следовательно, делящихся и растущих) прокариотных клеток достигает в среднем 5 мкг/г, что составляет 0.1 часть (10%) от всего сообщества. Следует отметить, что по полученным нами ранее данным, для верхних горизонтов чернозема, серой лесной, каштановой почв доля метаболически активных представителей прокариот составляла от 30 до 45% от суммарной биомассы прокариотного комплекса, что в несколько раз превышает значения для торфяной олиготрофной почвы [4]. Из отечественной литературы известны сведения о пониженной микробной активности торфов: доля активных (участвующих в биогеоценотических циклах) бактерий для верхового торфяника составляла в среднем от 10 до 25% [1].
Загрязнение олиготрофной торфяной почвы нефтью приводит к уменьшению метаболически активной прокариотной биомассы (в 2 раза), доля которой составляет 5% от всех выявляемых прокариот. Применение ремедиации к загрязненным нефтью образцам торфа, а именно внесение полного минерального питания на фоне известкования (0.5 Нг), приводит к возрастанию (более чем в 2 раза) биомассы метаболически активных клеток бактерий и архей. Установлено изменение филогенетической структуры метаболически активного прокариотного комплекса как на уровне домена Archaea, так и Bacteria в загрязненных нефтью торфах по сравнению с фоном. Внесение полного минерального питания на фоне неполного (0.5 Нг) известкования приводит к частичному восстановлению структуры прокариотного комплекса. Наибольшие значения числа копий функциональных генов (bss и nifH) для варианта с большей дозой минеральных удобрений на фоне известкования по 0.5 Нг совпадают со значимым уменьшением содержания нефтепродуктов в исследуемых вариантах опыта. Полученные результаты могут быть полезны при биоиндикации и оценке процесса восстановления загрязненных почвенных систем.
Список литературы
Богданова О.Ю., Головченко А.В., Лысак Л.В., Глухова Т.В., Звягинцев Д.Г. Жизнеспособность бактерий в торфяниках // Почвоведение. 2014. № 4. С. 466–472. https://doi.org/10.7868/S0032180X14020038
Добровольская Т.Г., Головченко А.В., Якушев А.В., Юрченко Е.Н., Манучарова Н.А., Чернов И.Ю. Бактериальные комплексы верхового торфяника в условиях различного микрорельефа // Почвоведение. 2017. № 4. С. 483–489. https://doi.org/10.7868/S0032180X17040025
Кожевин П.А. Микробные популяции в природе. М.: Изд-во Моск. ун-та, 1989. 175 с.
Манучарова Н.А., Ксенофонтова Н.А., Каримов Т.Д., Власова А.П., Зенова Г.М., Степанов А.Л. Изменение филогенетической структуры метаболически активного прокариотного комплекса почв под влиянием нефтяного загрязнения // Микробиология. 2020. Т. 89. № 2. С. 222–234. https://doi.org/10.31857/S0026365620020093
Методы почвенной микробиологии и биохимии / Под ред. Звягинцева Д.Г. М.: Изд-во Моск. ун-та, 1991. 303 с.
Панкратов Т.А., Белова С.Э., Дедыш С.Н. Оценка филогенетического разнообразия прокариотных микроорганизмов сфагновых болотах с использованием метода FISH // Микробиология. 2005. Т. 74. № 6. С. 831–837. https://doi.org/10.1007/s11021-005-0130-8
Практикум по агрохимии / Под ред. Минеева В.Г. М.: Изд-во Моск. ун-та, 2001. 688 с.
Толпешта И.И., Трофимов С.Я., Эркенова М.И., Соколова Т.А., Степанов А.Л., Лысак Л.В., Лобаненков А.М. Лабораторное моделирование последовательного аэробного и анаэробного разложения нефтепродуктов в загрязненном нефтью верховом торфе // Почвоведение. 2015. № 3. С. 360–372.
Amann R.I., Ludwig W., Schleifer K.H. Phylogenetic Identification and In Situ Detection of Individual Microbial Cells without Cultivation // Microbiol. 1995. Rev. 59(1). P. 143–169. https://doi.org/10.1128/mmbr.59.1.143-169.1995
Anokhina T.O., Volkova O.V., Puntus I.F., Filonov A.E., Kochetkov V.V., and Boronin A.M. Plant growth-promoting Pseudomonas bearing catabolic plasmids: Naphthalene degradation and effect on plants // Process Biochem. 2006. № 41. P. 2417–2423. https://doi.org/10.1016/j.procbio.2006.06.026
Biegert T., Fuchs G., Heider F. Evidence that anaerobic oxidation of toluene in the denitrifying bacterium Thauera aromatica is initiated by formation of benzylsuccinate from toluene and fumarate // Eur. J. Biochem. 1996. V. 238. P. 661–668. https://doi.org/10.1111/j.1432-1033.1996.0661w.x
Boden R., Hutt L.P., Rae A.W. Reclassification of Thiobacillus aquaesulis (Wood & Kelly, 1995) as Annwoodia aquaesulis gen. nov., comb. nov., transfer of Thiobacillus (Beijerinck, 1904) from the Hydrogenophilales to the Nitrosomonadales, proposal of Hydrogenophilalia class. nov. within the 'Proteobacteria', and four new families within the orders Nitrosomonadales and Rhodocyclales // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 1191–1205. https://doi.org/10.1099/ijsem.0.001927
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Peña A.G., Goodrich J.K., Gordon J.I., Huttley G.A., Kelley S.T., Knights D., Koenig J.E., Ley R.E., Lozupone C.A., McDonald D., Muegge B.D., Pirrung M., Reeder J., Sevinsky J.R., Turnbaugh P.J., Walters W.A., Widmann J., Yatsunenko T., Zaneveld J., Knight R. QIIME allows analysis of high-throughput community sequencing data // Nat. Methods. 2010. V. 7. № 5. P. 335–340.
Fierer N., Jackson J.A., Vilgalys R., Jackson R.B. Assessment of Soil Microbial Community Structure by Use of Taxon-Specific Quantitative PCR Assays // App-l. Environ. Microbiol. 2005. Rev. 71(7). P. 4117–4120. https://doi.org/10.1128/AEM.71.7.4117-4120.2005
Helmut B.F., Widmer W., Sigler V., Zeyer J. New Molecular Screening Tools for Analysis of Free-Living Diazotrophs in Soil // Appl. Environ. Microbiol. 2004. V. 70. P. 240–247. https://doi.org/10.1128/AEM.70.1.240-247.2004
IUSS Working Group WRB. World Reference Base for Soil Resources 2014: International soil classification system for naming soils and creating legends for soil maps / World Soil Resources Reports No. 106. FAO. Rome, 2014. 181 p.
Jones A.L., Paynet G.D., Goodfellow M. Williamsia faeni sp. nov, an actinomycete isolated from a hay meadow // Int. J. Syst. Evol. Microbiol. 2010. V. 60. P. 2548–2551. https://doi.org/10.1099/ijs.0.015826-0
Lane D.J. 16S/23S rRNA sequencing // Nucleic Acid Techniques in Bacterial Systematic / Eds.: Stackebrandt E., Goodfellow M. John Wiley & Sons Ltd.: Hoboken. NJ. USA, 1991. P. 115–175.
Madigan M.T., Martinko J.M., Dunlap P.V., Clark D.P. Brock biology of microorganisms. Prentice-Hall. Englewood Cliffs. 2008. 1061 p.
Perry Verlin. Metabolic Activities and Diversity of Microbial Communities Associated with Anaerobic Degradation. Dissertation. Georgia State University, 2014. 250 p.
Wang Q., Garrity G.M., Tiedje J.M., Cole J.R. Naive Bayesian Classifier for Rapid Assignment of rRNA Sequences into the New Bacterial Taxonomy // Appl. Environ. Microbiol. 2007. V. 73. № 16. P. 5261–5267.
Will C., Thürmer A., Wollherr A., Nacke H., Herold N., Schrumpf M., Gutknecht J., Wubet T., Buscot F., Daniel R. Horizon-specific bacterial community composition of German grassland soils, as revealed by pyrosequencing-based analysis of 16S rRNA genes // Appl. Environ. Microbiol. 2010. V. 76. № 20. P. 6751.
Дополнительные материалы отсутствуют.



