Почвоведение, 2021, № 10, стр. 1281-1292
Изменения потока диоксида углерода из почв лесных экосистем под ВОЗДЕЙСТВИЕМ ТЕХНОГЕННОГО ЗАГРЯЗНЕНИЯ В КОЛЬСКОЙ СУБАРКТИКЕ
М. С. Кадулин a, Г. Н. Копцик a, *
a МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: koptsikg@mail.ru
Поступила в редакцию 30.12.2020
После доработки 12.04.2021
Принята к публикации 28.04.2021
Аннотация
Анализировали поток СО2 из почв и структуру его продуцирования по градиентам загрязнения лесных экосистем выбросами предприятий цветной металлургии в Кольской Субарктике. Эмиссию СО2 с поверхности почв измеряли с помощью закрытых камер, его летние потоки рассчитывали на основании регрессионных зависимостей эмиссии СО2 от температуры воздуха. Корневое и микробное дыхание разделяли полевым методом субстрат-индуцированного дыхания. Поток СО2 из почв достигает сравнительно высоких величин в фоновых сосновых (200 г С/(м2 лето)), березовых (460 г С/(м2 лето)) и еловых (420 г С/(м2 лето)) лесах. Основная часть СО2 из почв этих лесов выделяется за счет дыхания корней растений (45–70%). С приближением к источникам загрязнения в почвах наблюдаются сокращение микробной и растительной биомассы, обеднение элементами минерального питания и накопление тяжелых металлов. В результате происходит существенное уменьшение потока СО2 из лесных почв в зонах дефолиации (до 1.5 раз), техногенных редколесий (до 10 раз) и пустошей (до 20 раз). Дефолиация лесов может сопровождаться активизацией микробного дыхания в результате поступления в почву дополнительного субстрата для питания микроорганизмов. Угнетение и гибель растительности приводят к закономерному уменьшению интенсивности корневого дыхания вплоть до его полного исчезновения на техногенных пустошах. Сделан вывод о том, что мониторинг эмиссии СО2 почвами способствует выявлению особенностей функционирования лесных экосистем в ходе техногенной дигрессии и разработке эффективных методов их ремедиации в условиях промышленного загрязнения в арктической зоне.
ВВЕДЕНИЕ
Диоксид углерода (СО2) является одним из основных парниковых газов, накопление которых в атмосфере может приводить к изменению климата нашей планеты. Основной объем СО2 образуется в наземных экосистемах за счет дыхания почв [14, 40 ] . Хозяйственная деятельность человека вызывает деградацию наземных экосистем, что сопровождается газообразными потерями СО2 из почв и его поступлением в атмосферу [19].
В настоящее время детально изучено влияние сельскохозяйственного использования почв на выделение СО2 на пашне [15, 18, 31], рисовых чеках [27] и при выпасе скота [28]. Проанализировано влияние различных видов землепользования на эмиссию СО2 почвами в российской Арктике [33]. В то же время эмиссия СО2 почвами в условиях промышленного загрязнения остается практически неизученной и слабо представлена в мировых базах данных [31]. Как правило, в качестве характеристики дыхательной активности используют базальное дыхание образцов почв ex-situ [1, 3, 4, 41], на основании которого невозможно оценить абсолютные значения газообразных потерь углерода в виде CO2 из почв.
Кроме того, эти данные имеют противоречивый характер. В зависимости от типа и степени загрязнения отмечают как уменьшение [9, 13, 22, 34, 38], так и отсутствие отклика или рост [22, 34] интенсивности выделения СО2 из почвы. Причиной неоднозначного отклика выделения CO2 является специфика биохимического ответа его основных продуцентов в почве – корней растений и микроорганизмов – на техногенный стресс. Поэтому изменение биомассы или активности одного из этих компонентов влечет за собой изменение как общего потока СО2 из почвы, так и соотношения корневого и микробного дыхания. В этой связи эмиссию СО2 с поверхности почвы рассматривают как интегральный показатель биологической активности почв [20, 22].
Подразделения Кольской горно-металлургической компании (КГМК), бывшие комбинаты “Североникель” и “Печенганикель”, являются мощными источниками SO2 и тяжелых металлов (ТМ) в Кольской Субарктике. Их многолетнее воздействие привело к техногенной дигрессии лесных экосистем в результате загрязнения и деградации почв, угнетения растительности и микроорганизмов, сокращения их биомассы и видового разнообразия [6, 7, 12, 13, 17]. Таким образом, изменение эмиссии CO2 из почв в зоне влияния промышленных предприятий во многом определяется устойчивостью растений и микроорганизмов к техногенному воздействию.
Цель исследования заключалась в оценке потока СО2 из почв и структуры его продуцирования по градиентам загрязнения лесных экосистем в зоне атмосферных выбросов предприятий КГМК в Кольской Субарктике.
ОБЪЕКТЫ И МЕТОДЫ
Объектами исследования являлись автоморфные подзолы иллювиально-гумусовые (железистые) (Folic Albic Podzol (Arenic)) лесных экосистем последовательных стадий техногенной дигрессии на различном удалении от промышленных площадок КГМК (табл. 1). Работы проводили в сосновых и березовых лесах в зонах влияния площадок “Никель” и “Заполярный” и в еловых лесах в зоне влияния площадки “Мончегорск” (в окрестностях одноименных населенных пунктов). Изучали также абраземы альфегумусовые (Entic Podzol) техногенных пустошей, практически лишенных растительности, с сильнонарушенным почвенным покровом на удалении 1–5 км от промышленных площадок. Поскольку основная часть CO2 в почве продуцируется в верхнем, наиболее биологически активном слое, в лесных экосистемах образцы отбирали из подстилки, а на техногенных пустошах – из слоя 0–5 см.
Таблица 1.
Характеристика участков мониторинга экосистем сосновых и березовых лесов в окрестностях Никеля-Заполярного и еловых лесов в окрестностях Мончегорска
| Сообщество | Стадия техногенной сукцессии | Расстояние*, км |
|---|---|---|
| Сосняк беломошный с брусникой и вороникой | Условно фоновый тип состояния | 41 |
| Сосняк с березой воронично-бруснично-беломошный с подростом сосны и березы | Условно фоновый тип состояния | 34 |
| Сосняк с березой бруснично-воронично-лерхенфельдиевый с лишайниками, подростом березы и сосны | Стадия дефолиации | 16 |
| Сосняк с березой воронично-брусничный | Стадия дефолиации | 11 |
| Сосняк с березой воронично-мертвопокровный с брусникой, багульником, подростом сосны и березы | Техногенное редколесье | 8 |
| Березняк лерхенфельдиево-воронично-дерновый, зеленомошный, с подростом березы | Условно фоновый тип состояния | 31 |
| Березняк с сосной бруснично-вороничный с подростом сосны и березы | Стадия дефолиации | 12 |
| Березняк вороничный с брусникой и черникой | Техногенное редколесье | 5 |
| Березняк лерхенфельдиевый с подростом березы | Стадия дефолиации | 9 |
| Березняк кустарничково-лерхенфельдиевый с подростом березы | Техногенное редколесье | 6 (20) |
| Ельник с березой кустарничково-зеленомошный с подростом ели и березы | Условно фоновый тип состояния | 64 |
| Ельник с березой зеленомошно-черничный с подростом ели и березы | Стадия начальной дефолиации | 28 |
| Ельник с березой воронично-черничный с подростом ели и березы | Стадия дефолиации | 24 |
| Ельник с березой воронично-дерново-черничный с подростом ели и березы | Стадия интенсивной дефолиации | 21 |
| Ельник с березой воронично-чернично-брусничный с подростом ели и березы | Стадия интенсивной дефолиации | 20 |
| Ельник бруснично-воронично-черничный с подростом ели | Стадия интенсивной дефолиации | 18 |
| Елово-березовое воронично-мертвопокровное редколесье | Техногенное редколесье | 7 |
| Техногенные пустоши с погибшей растительностью или единичными угнетенными экземплярами березы пушистой и/или ивы козьей | Техногенные пустоши | 1–5 |
Методы исследования. Эмиссию СО2 с поверхности почвы и температуру приземного слоя воздуха измеряли ежегодно в июле 2010–2013 гг., а также в мае и сентябре 2012 г. (всего 5 раз). Исследования проводили методом закрытых камер с помощью инфракрасного СО2-газоанализатора AZ 7752 в 8–16 точках на каждом участке размером 20 × 20 м. Измеряемую эмиссию СО2 считали тождественной дыханию почвы, поскольку влиянием фактора задержки в результате внутрипочвенного газопереноса в автоморфных почвах легкого гранулометрического состава можно пренебречь [20].
Разделение корневого и микробного дыхания проводили полевым методом субстрат-индуцированного дыхания [5 ] . Зависимость эмиссии СО2 от температуры воздуха аппроксимировали уравнением Аррениуса в модификации Ллойда и Тейлора [35]. Летние потоки СО2 из почв (за календарное лето – с 1 июня по 31 августа) рассчитывали на основании этой зависимости как сумму трех месячных потоков, оцененных с использованием среднемесячных температур. Температурный коэффициент (Q10), показывающий во сколько раз изменяется эмиссия СО2 с поверхности почвы при изменении температуры воздуха на 10°С, рассчитывали по уравнению Вант-Гоффа. Подробнее использованные методы описаны ранее [9, 10, 13].
В свежих образцах почв определяли содержание Смикр методом фумигации–экстракции [44], концентрации углерода и азота – в водных вытяжках (1 : 40) на анализаторе Shimadzu TOC(N), концентрацию водорастворимых форм биофильных элементов (Ca, Mg, K и P) и ТМ (Ni и Cu) – с помощью масс-спектроскопии с индуктивно-связанной плазмой, рН потенциометрически.
Расчет средних значений и стандартных отклонений, корреляционный анализ, построение регрессионных моделей, а также проверку значимости различий средних значений по непараметрическому U-тесту Манна–Уитни проводили с помощью программы Statistica 8.0 (Statsoft, USA).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Потоки СО2 из почв условно фоновых лесов. Фоновые леса Кольской Субарктики на северной границе их распространения характеризуются мощными подстилками (3–19 см), пронизанными корнями растений (0.52–2.67 г/дм3), богатыми углеродом микробной биомассы (1300–2300 мг С/кг), а также лабильными формами углерода (500–1400 мг С/кг), азота (50–230 мг/кг), фосфора (2–22 мг/кг), калия (60–290 мг/кг) и кальция (35–180 мг/кг) (табл. 2). Кроме этого, лесные экосистемы Кольского полуострова функционируют в условиях полярного дня и дополнительного подогрева со стороны Гольфстрима, что обеспечивает сравнительно высокий уровень биологической активности местных почв (рис. 1, А).
Таблица 2.
Характеристика почв лесных экосистем последовательных стадий техногенной дигрессии (лето 2012 г.)
| Показатель | Никель-Заполярный | Мончегорск | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| пустошь | сосновые леса | березовые леса | пустошь | еловые леса | |||||||
| П | Р | Д | Ф | Р | Д | Ф | П | Р | Д | Ф | |
| 1 СО2 почвы | 12 | 160 | 172 | 198 | н.о. | 278 | 456 | 26 | 43 | 382 | 417 |
| 2 СО2 корней, % | 0 | 52 | 51 | 45 | н.о. | 32 | 65 | 0 | 23 | 33 | 70 |
| 3 Подстилка, см | 0 | 4–7 | 4–6 | 3–15 | 0–8 | 7–11 | 8–10 | 0–2 | 3–10 | 3–16 | 10–19 |
| 4 Корни, г/дм3 | 0.34 ± 0.25aA | 0.29 ± 0.13a | 0.38 ± 0.08a | 1.80 ± 0.68b | 0.19 ± 0.10aA | 0.42 ± 0.14aB | 1.36 ± 0.57C | 0.01 ± 0.02a | 0.39 ± 0.10b | 0.32 ± 0.19b | 0.52 ± 0.29b |
| Cмикр, мг/кг | 46 ± 28aA | 254 ± 82b | 1014 ± 336c | 1345 ± 893c | 1047 ± 234B | 817 ± 167B | 2099 ± 595C | 66 ± 42a | 351 ± 91b | 1667 ± 474c | 2305 ± 1333c |
| ${{{\text{C}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$, мг/кг | 38 ± 1aA | 124 ± 65a | 506 ± 125b | 495 ± 272b | 240 ± 125B | 440 ± 169C | 1357 ± 298D | 17 ± 13a | 276 ± 109b | 706 ± 224c | 1420 ± 679c |
| ${{{\text{N}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$, мг/кг | 13 ± 2aA | 65 ± 51b | 50 ± 17b | 52 ± 33b | 108 ± 36B | 81 ± 10B | 145 ± 16D | 3 ± 1a | 53 ± 27b | 80 ± 40b | 159 ± 72c |
| C : ${{{\text{N}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | 3.0 ± 0.6aA | 2.2 ± 0.5b | 10.9 ± 3.5c | 9.8 ± 1.5c | 2.2 ± 0.8B | 5.4 ± 1.7C | 9.3 ± 1.7D | 4.9 ± 1.5a | 5.5 ± 1.1a | 9.5 ± 2.7b | 9.0 ± 1.7b |
| Cобщ, % | 3.1 ± 0.7aA | 31.7 ± 5.0b | 42.9 ± 6.7c | 36.2 ± 5.5c | 42.0 ± 9.0B | 42.8 ± 6.0B | 43.9 ± 2.7B | 2.6 | 39.4 | 44.5 | 46.5 |
| Nобщ, % | 0.12 ± 0.08aA | 0.67 ± 0.12b | 1.24 ± 0.17c | 0.6 ± 0.1b | 1.4 ± 0.3B | 1.1 ± 0.1C | 1.6 ± 0.2B | 0.11 | 1.2 | 1.5 | 1.1 |
| C : Nобщ | 25.2 ± 2.0aA | 47.3 ± 3.6b | 34.7 ± 4.1c | 58.5 ± 10.2d | 29.9 ± 6.5BC | 38.0 ± 8.8BC | 28.1 ± 3.6B | 23.6 | 33.1 | 30.6 | 42.4 |
| ${{{\text{P}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$, мг/кг | 0 ± 0aA | 0.4 ± 0.2b | 0.6 ± 0.3b | 4.5 ± 7.4c | 4.4 ± 1.8B | 12.2 ± 7.3C | 10.8 ± 2.3C | 0 ± 0a | 1.7 ± 0.5a | 6.6 ± 3.6b | 6.8 ± 1.3b |
| ${{{\text{K}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$, мг/кг | 4 ± 3aA | 36 ± 14b | 41 ± 8b | 63 ± 44c | 102 ± 29B | 78 ± 17B | 213 ± 123B | 4 ± 1a | 14 ± 6a | 131 ± 23b | 276 ± 48c |
| ${\text{C}}{{{\text{a}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$, мг/кг | 18 ± 15aA | 125 ± 66b | 55 ± 26ab | 35 ± 23a | 598 ± 617B | 94 ± 14B | 77 ± 31B | 19 ± 17a | 27 ± 11ab | 34 ± 13b | 105 ± 23c |
| ${\text{N}}{{{\text{i}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$, мг/кг | 10.2 ± 4.3aA | 6.1 ± 2.4b | 1.3 ± 0.3c | 0.3 ± 0.2d | 15.5 ± 3.1B | 5.0 ± 1.7C | 0.7 ± 0.4D | 7.0 ± 3.0a | 4.3 ± 0.6b | 1.2 ± 0.5c | 0.7 ± 0.3d |
| ${\text{C}}{{{\text{u}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$, мг/кг | 8.6 ± 2.6aA | 2.6 ± 0.7b | 1.7 ± 0.4c | 0.8 ± 0.4d | 4.9 ± 1.2B | 3.4 ± 1.1B | 1.1 ± 0.4C | 18.5 ± 5.0a | 4.4 ± 1.5b | 4.0 ± 1.9c | 3.2 ± 0.9d |
| H2O, % | 7 ± 2aA | 125 ± 55b | 124 ± 93b | 169 ± 120b | 186 ± 58B | 155 ± 44B | 320 ± 38C | 16 ± 3a | 82 ± 21b | 230 ± 74c | 368 ± 103d |
| ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | 4.1 ± 0.2aA | 4.8 ± 0.3b | 4.7 ± 0.2b | 4.8 ± 0.1b | 4.5 ± 0.1B | 4.8 ± 0.1C | 4.8 ± 0.3C | 4.2 ± 0.1a | 4.6 ± 0.1b | 4.6 ± 0.1b | 4.5 ± 0.5b |
Примечание. 1 – поток СО2 из почв, г С/(м2 лето); 2 – вклад корней в летний поток СО2; 3 – мощность подстилки; 4 – биомасса тонких корней. Приведены средние ± ± стандартные отклонения; разные буквы показывают значимые различия между разными стадиями дигрессии в каждом из трех типов леса при p < 0.05 (заглавными буквами показаны различия для березовых лесов).
Рис. 1.
Эмиссия СО2 из почв лесных экосистем разных стадий техногенной дигрессии в окрестностях Никеля-Заполярного и Мончегорска. Здесь и далее: А – летние периоды 2010–2013 гг.; Б – 2012 г.; В – лето 2012 г. Заглавные буквы указывают стрелками стадии техногенной дигрессии: Ф – фон, Д – зона дефолиации, Р – редколесье, П – пустошь. Показаны средние и стандартные отклонения.
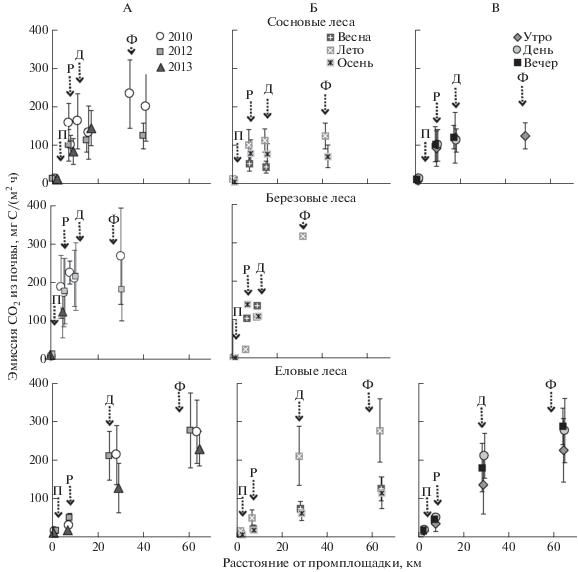
Дыхание почвы зависит от температуры среды обитания продуцентов СО2: растений и микроорганизмов [19, 40]. Для корректной характеристики и сравнения различных почвенных объектов требуется привести измеренные значения эмиссии СО2 к стандартным условиям. Для этого провели ориентировочную оценку летних потоков СО2 из исследуемых почв в диапазоне 5–25°С. В результате получено, что для фоновых лесных экосистем модель Ллойда и Тейлора [35] удовлетворительно описывает зависимость почвенной эмиссии СО2 от температуры воздуха (R2 = 0.41–0.61) (рис. 2).
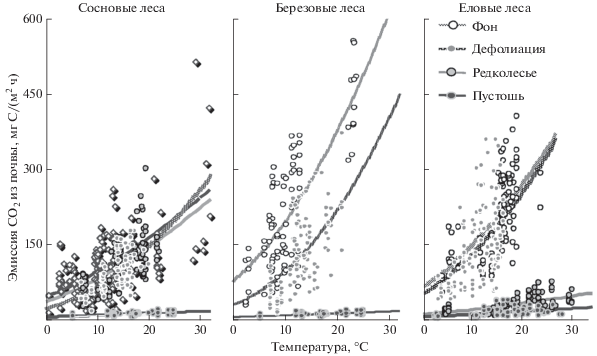
Рис. 2.
Зависимость эмиссии СО2 из почв лесных экосистем разных стадий техногенной дигрессии от температуры воздуха в окрестностях Никеля-Заполярного и Мончегорска. Линии регрессий соответствуют уравнению Аррениуса в модификации Ллойда и Тейлора [35].
Эмиссия CO2 подзолами лесных экосистем в летний период 2010–2013 гг. достигала сравнительно больших величин в фоновых сосновых кустарничково-лишайниковых (105–220 мг С/(м2 ч) или 198 г С/(м2 лето)), березовых кустарничково-зеленомошных (180–410 мг С/м2/ч или 456 г С/(м2 лето)) и еловых кустарничково-зеленомошных (230–270 мг С/(м2 ч) или 417 г С/(м2 лето)) лесах. Полученные величины эмиссии СО2 из почв в целом согласуются с литературными данными для фоновых таежных лесов [22, 34, 43], в том числе заповедных лесов Кольской Субарктики [10].
Минимальный уровень выделения СО2 приурочен к бедным почвам под кустарничково-лишайниковыми сосновыми лесами. Схожие результаты получены при изучении лесов Тугуланской котловины в долине р. Енисей [23]. При этом слабая дыхательная активность почв обусловлена не столько эдификаторной ролью сосны, сколько преобладанием лишайников в наземном ярусе. Об этом свидетельствует полученные ранее результаты по изучению почв заповедных лесов региона [10]. Низкая биологическая активность почв сосновых лесов с доминированием лишайников в наземном ярусе обусловлена наименьшим содержанием углерода микробной биомассы (1345 мг C/кг) и лабильных элементов минерального питания (52 мг N/кг, 4.4 мг P/кг, 63 мг K/кг). Низкий уровень дыхания сосняков этого типа отчасти можно объяснить рефиксацией CO2 внутри их талломов.
Максимальный уровень выделения СО2 почвами свойственен фоновому березовому лесу, характеризующемуся наибольшим содержанием углерода микробной биомассы (2100 мг C/кг) и лабильного P (10.8 мг/кг). Подобная закономерность обнаружена ранее в лесах Бельгии, где дыхание почвы под березовым лесом было вдвое больше по сравнению с сосновым за счет интенсивного микробного разложения лиственного опада, отличающегося бόльшей зольностью и лучшим качеством органического вещества (узким соотношением C : N) по сравнению с хвойным [36].
В течение вегетационного сезона 2012 г. летняя эмиссия СО2 почвами вдвое превышала эмиссию весной и осенью (рис. 1, Б), что отражает характерные сезонные изменения. Максимальный уровень освещения и прогрева, а также оптимальное увлажнение почв в летний период обеспечивают наиболее благоприятные условия для активного развития основных продуцентов СО2 в почве – корней растений и микроорганизмов [19].
Летняя внутрисуточная динамика эмиссии СО2 была слабо выражена (рис. 1, В), что объясняется незначительными изменениями освещенности и температуры в течение полярного дня. Лишь в утренние часы наблюдался слабовыраженный минимум выделения СО2 в связи с ночным понижением температуры.
Вклад корней в эмиссию СО2 почвами фоновых лесов в течение летнего периода 2010–2013 гг. варьировал от 38 до 79% (41–57% или 45% в среднем за лето в сосновых кустарничково-лишайниковых, 38–79% или 65% в среднем за лето в березовых кустарничково-зеленомошных и 58–70% или 70% в среднем за лето в еловых кустарничково-зеленомошных лесах, рис. 3, А). Полученные величины участия корневого дыхания соответствуют диапазону, характерному для почв северной тайги и тундры (30–90% [19]).
Рис. 3.
Вклад корней в поток СО2 из почв лесных экосистем разных стадий техногенной дигрессии в окрестностях Никеля-Заполярного и Мончегорска.
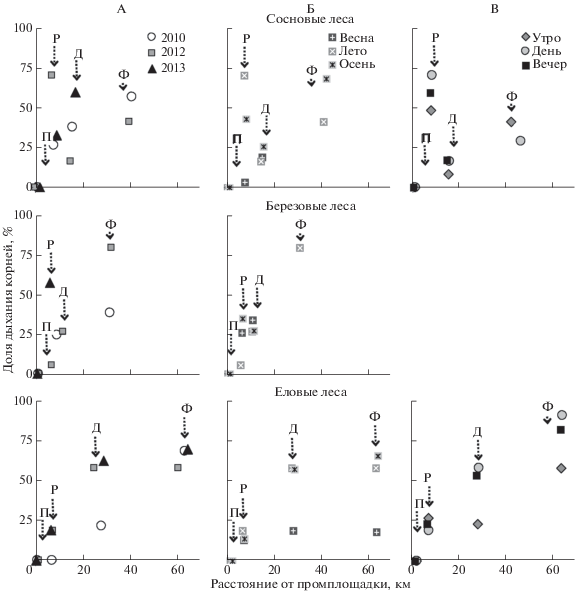
Максимум корневого дыхания приурочен к летнему и осеннему периодам (рис. 3, Б). Высокий вклад корней в поток СО2 из почв летом обусловлен их активным ростом и общим высоким уровнем метаболической активности за счет поступления большого количества продуктов фотосинтеза [24]. Высокий относительный уровень корневого дыхания в осенний период может быть связан с неполным завершением вегетации растений во время проведения наблюдений. В весенний период вклад корней в поток СО2 из почв был в 2–3 раза меньше, чем летом.
Суточная динамика доли дыхания корней в целом повторяла изменение эмиссии СО2 почвами, но была выражена в большей степени. Участие корней в продуцировании СО2 в утренние часы было до 1.5 раз меньше, чем днем и вечером (рис. 3, В). Это может быть вызвано сокращением запасов сахаров в корнях после ночной паузы в фотосинтезе.
Потоки СО2 из почв лесных экосистем последовательных стадий техногенной дигрессии. При техногенном атмосферном загрязнении, приводящем к дефолиации древесного яруса, наблюдается тенденция к уменьшению мощности подстилки (3–16 см) и 1.5–4-кратное сокращение биомассы тонких корней (0.32–0.42 г/дм3). Это сопровождается значимым, в 1.5–2 раза, обеднением подстилки углеродом микробной биомассы (1300–2300 мг С/кг), фосфором (2–22 мг/кг) и калием (60–290 мг/кг). Одновременно заметно увеличивается содержание мобильных никеля (от 0.3–0.7 до 1.2–5.0 мг/кг) и меди (от 1.7 до 4.0 мг/кг) в подстилках. Сокращение микробной и растительной биомассы и запасов биофильных элементов на фоне накопления ТМ приводит к ослаблению почвенного дыхания.
В зоне дефолиации наблюдается тенденция к уменьшению эмиссии СО2 в летние периоды 2010–2013 гг. на 10–15% из почв сосновых (113–145 мг С/(м2 ч) или 172 г С/(м2 лето), p = 0.34–0.54) и еловых (126–216 мг С/(м2 ч) или 382 г С/(м2 лето), p = 0.046–0.55) лесов. Дыхание почв березовых лесов неожиданно оказалось более чувствительным к действию техногенного загрязнения, в результате чего эмиссия СО2 снизилась на 40% (210–225 мг С/(м2 ч) или 278 г С/(м2 лето)). Это не находит пока объяснения, поскольку лиственные леса известны своей большей устойчивостью к техногенной нагрузке по сравнению с хвойными [16].
Несмотря на относительно небольшие изменения уровня дыхания лесных почв в зоне дефолиации, структура продуцирования СО2 в почве заметно трансформируется (рис. 3, табл. 2). Вклад корней в общий поток СО2 оказался в этой зоне вдвое меньше в почвах еловых (13–62% или 33% в среднем за лето) и березовых (24–26% или 32% в среднем за лето) лесов по сравнению с фоновыми экосистемами. Таким образом, угнетение растительности приводит к уменьшению корневого дыхания и возрастанию вклада микроорганизмов. В то же время наблюдается не только относительный, но и абсолютный рост уровня микробного дыхания. В результате общий уровень дыхания почв остается высоким. Активизация дыхания микроорганизмов в условиях умеренного техногенного загрязнения лесных экосистем может происходить за счет: 1) поступления дополнительной растительной массы при дефолиации – субстрата для питания микроорганизмов [21]; 2) роста энергетических затрат растений на поддержание симбиотических отношений с микроорганизмами, обеспечивающими минеральное питание и защиту корней растений от поллютантов [30, 32]; 3) изменения структуры микробного сообщества почв – снижения доли грибов и увеличения доли бактерий [6, 7], для которых характерен более высокий уровень метаболической активности [2]; 4) роста удельной метаболической активности как общей реакции на стресс, вызванный накоплением поллютантов в почвах [1, 41].
Реакция основных компонентов почвенной биоты на техногенное загрязнение в сосновых лесах зоны дефолиации выглядит иначе. Относительный вклад корней (51% в среднем за лето) не только не снижается, но даже возрастает на 6% по сравнению с фоновыми биотопами. Возможной причиной является происходящая при этом воздействии смена характера растительности наземного яруса. Фоновый сосняк относится к кустарничково-лишайниковому типу, однако в рассматриваемой зоне загрязнения в наземном ярусе сосняков лишайники погибают. В результате освобождается ниша для развития кустарничков и некоторых злаков. Таким образом, начальный уровень загрязнения создает в этих лесах условия для развития сосудистых растений в нижнем ярусе, что может увеличивать долю корневого дыхания. Кроме этого, если отправной точкой дигрессии сосновых лесов выбрать не кустарничково-лишайниковый, а кустарничково-зеленомошный вариант, то изменение доли корневого дыхания почв будет соответствовать еловым и березовым лесам. Так, высокий уровень корневого дыхания сосняков кустарничково-зеленомошных в заповеднике “Пасвик” достигает 80% от общего потока СО2 из почвы за лето [10].
При усилении загрязнения, приводящем к формированию техногенного редколесья, происходит сильное угнетение автотрофной составляющей лесной экосистемы, сопровождающееся замедлением круговорота ведущих биофильных элементов. В результате мощность подстилки снижается вплоть до ее полного исчезновения (0–10 см). Количество тонких корней уменьшается в 1.5–6 раз (0.19–0.39 г/дм3). Содержание углерода микробной биомассы сокращается в 2–7 раз (250–1500 мг С/кг), фосфора – в 2–10 раз (0.4–4.4 мг/кг), калия – в 3–14 раз (14–102 мг/кг). Одновременно происходит значительное накопление (до 30 раз по сравнению с условным фоном) никеля (4.3–15.5 мг/кг) и меди (2.6–4.9 мг/кг) в почвах.
Таким образом, ухудшение условий среды и последующее сокращение растительной и микробной биомассы в почве привело к существенному (до 10 раз) уменьшению потока CO2 из почвы березово-елового техногенного редколесья (17–49 мг С/(м2 ч) или 43 г С/(м2 лето)) вблизи Мончегорска. При этом вклад корней в поток СО2 из почвы (0–19% или 23% в среднем за лето) снизился втрое по сравнению с условным фоном и в 1.5 раза по сравнению со стадией дефолиации. В то же время общий и корневой потоки СО2 из почв березово-соснового (85–100 мг С/м2/ч мг С/(м2 ч) или 160 г С/(м2 лето); p = 0.15–0.33) и березового (124–176 мг С/(м2 ч); p = 0.34–0.60) техногенных редколесий в районе Никель-Заполярный не отличались от зоны дефолиации. В целом уровень выделения СО2 из почв дефолиирующих лесов и техногенных редколесий в летний период укладывается в диапазон значений, характерных для наземных экосистем бореального пояса, находящихся в зонах влияния предприятий цветной металлургии [22, 34].
Максимальное поступление SO2 и ТМ в наземные экосистемы происходит в непосредственной близости от горно-металлургических комбинатов, где формируются лишенные растительности техногенные пустоши. Почвы пустошей чрезвычайно бедны элементами питания (${{{\text{N}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ 7–30, ${{{\text{P}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ 0.0–0.1, ${{{\text{K}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ 4 мг/кг), характеризуются опасно высоким содержанием водорастворимых ТМ (7.0–10.2 мг Ni/кг и 8.6–18.5 мг Cu/кг) и поэтому крайне неблагоприятны для развития биоты. Согласно нашим данным, биомасса тонких корней составляет здесь 0–0.34 г/дм3, а биомасса микроорганизмов – 45–65 мг/кг.
Летний поток СО2 с поверхности почв техногенных пустошей (12–26 г С/(м2 лето)) на порядок меньше, чем в фоновых лесных экосистемах, а уровень корневого дыхания – ниже порога чувствительности метода его определения. Таким образом, под действием загрязнения растительная составляющая экосистем погибает в первую очередь, после чего СО2 в почвах продуцируется в основном за счет разложения микроорганизмами растительной мортмассы и почвенного органического вещества [9, 15].
Почвы в зоне интенсивных газо-пылевых выбросов характеризуются большой пространственной неоднородностью, обусловленной эрозионными процессами на открытых безлесных пространствах техногенных пустошей [12]. Поэтому коэффициенты вариации эмиссии СО2 почвами техногенных пустошей (40–70%) и редколесий (25–100%) заметно больше по сравнению с дефолиирующими (25–55%) и условно фоновыми (20–45%) лесами. Помимо почвенных свойств в зонах техногенных редколесий и пустошей существенное влияние на пространственную неоднородность выделения СО2 оказывают фрагменты растительности, сохранившейся в наиболее защищенных элементах рельефа.
Высокая пространственная неоднородность почв наземных экосистем в зоне техногенеза затрудняет выявление влияния отдельных факторов почвенного дыхания. В частности, из-за высокой дисперсии потоков СО2 из почв техногенных редколесий и пустошей эмиссия СО2 слабо зависела от главного фактора динамики почвенного дыхания – температуры среды (R2 = 0.22–0.39). При этом сезонная и суточная динамика эмиссии СО2 почвами хотя и повторяла закономерности, характерные для фоновых и дефолиирующих лесов, но была выражена в гораздо меньшей степени.
Динамика выделения СО2 почвами определяется его чувствительностью к изменению температуры окружающей среды (Q10). В течение летнего сезона фоновые сосновые (Q10 = 1.6), березовые (1.9) и еловые (1.8) леса характеризуются меньшим откликом выделения СО2 на изменение температуры воздуха по сравнению со среднегодовым значением Q10 для почв мира (2.4) [37].
При умеренном уровне техногенного загрязнения, приводящем к дефолиации сосновых (1.8), березовых (2.3) и еловых (2.2) лесов, чувствительность дыхательной активности почв к изменению температуры возрастает на 10–15%. Наблюдаемый рост Q10 дыхания почв, видимо, является биохимической реакцией почвенных организмов на техногенный стресс. Такой ответ может быть обусловлен необходимостью дополнительных энергетических затрат [1, 26, 29], направленных на связывание токсичных веществ, репарацию и очистку поврежденных клеток.
При повышенном уровне техногенного загрязнения, приводящем к формированию редколесий, Q10 дыхания почв сосновых лесов (2.2) возрастает более чем на 25%. По всей видимости, это обусловлено сравнительно небольшим повреждением растительности редколесий в районе Никеля. В то же время Q10 дыхания почв еловых лесов (1.6) в зоне влияния более мощного источника загрязнения в Мончегорске меньше на 10% по сравнению с условным фоном. В зоне максимального загрязнения (техногенные пустоши) отмечается наименьший уровень чувствительности почвенного дыхания к изменению температуры воздуха (1.5).
Высокий уровень загрязнения приводит к ингибированию активности ферментов микробных [29] и растительных [42] клеток, что снижает Q10 почвенного дыхания. Кроме того, из-за высокой разреженности растительности в зонах техногенного редколесья и пустошей поступление новых органических веществ существенно уменьшается. При дефиците органического субстрата активность микроорганизмов будет зависеть, в первую очередь, от наличия источника энергии и только затем – от температуры [39]. С другой стороны, с ростом температуры увеличивается растворимость и биологическая доступность ТМ в результате поглощения корнями и листьями. При высоком уровне освещенности открываются устьица растений, через которые могут активно проникать ТМ и SO2 [16]. Поэтому рост температуры может увеличивать токсичное воздействие поллютантов, что в свою очередь ингибируют дыхание почвы.
Отдельного рассмотрения заслуживает чувствительность дыхания корней растений к изменению температуры. Фоновые значения Q10 дыхания корней и почв (1.6) в бедных элементами минерального питания кустарничково-лишайниковых сосновых лесах равны. Однако в более богатых кустарничково-зеленомошных березовых (2.4) и еловых (1.9) лесах чувствительность дыхания корней к изменению температуры на 5–25% превышает значения Q10 для почв в целом. Повышенная температурная чувствительность дыхания корней по сравнению с почвами в целом хорошо согласуется с выводами [25] и нашими ранее опубликованными результатами [10]. Подобная закономерность была обнаружена в еловом лесу на Валдайской возвышенности летом, когда с ростом температуры почвы при дефиците влаги увеличивалась доля дыхания корней за счет уменьшения активности микроорганизмов [11].
В зоне дефолиации чувствительность дыхания корней растений сосновых (3.0), березовых (2.6) и еловых (4.3) лесов к изменению температуры возрастает на 10–100% по сравнению с фоном. При нарастании загрязнения биологическая устойчивость растений оказывается недостаточной для противодействия техногенному стрессу. Поэтому чувствительность дыхательной активности корней к изменению температуры в техногенном елово-березовом редколесье вблизи Мончегорска (1.7) уменьшается по сравнению с условным фоном на 10%. В то же время при умеренном загрязнении вблизи Никеля Q10 дыхания корней в сосновом редколесье (3.7) превышает фоновые значения более чем вдвое, что, по всей видимости, является физиологической реакцией растений на техногенный стресс. С другой стороны, изменение Q10 дыхания корней может быть следствием техногенной сукцессии растительности – сокращения участия видов с низкой физиологической активностью, таких как лишайники, и распространения более активных видов, таких как злаки.
ЗАКЛЮЧЕНИЕ
Деградация почв, сокращение мощности подстилки, обеднение биофильными элементами, загрязнение тяжелыми металлами в зоне распространения газо-пылевых выбросов предприятий цветной металлургии ингибирует развитие корней растений и почвенных микроорганизмов, что приводит к замедлению эмиссии СО2. Однако изменение биологической активности почв при нарастании техногенной нагрузки происходит нелинейно. Низкие дозы поллютантов могут усиливать дыхание почв. Рост поступления органического вещества в почву при дефолиации создает условия для интенсификации дыхания гетеротрофных микроорганизмов. Угнетение мхов и лишайников освобождает нишу для новых, физиологически активных и устойчивых видов с развитой корневой системой, что увеличивает вклад корней в поток СО2. С ростом техногенной нагрузки микроорганизмы оказываются более устойчивыми и остаются практически единственными источниками СО2 в почвах техногенных пустошей. Регулярный мониторинг эмиссии СО2 почвами в условиях промышленного загрязнения позволяет вскрыть механизмы функционирования лесных экосистем в ходе техногенной дигрессии и разработать эффективные подходы к их ремедиации.
Список литературы
Ананьева Н.Д. Микробиологические аспекты самоочищения и устойчивости почв. М.: Наука, 2003. 223 с.
Ананьева Н.Д., Стольникова Е.В., Сусьян Е.А., Ходжаева А.К. Грибная и бактериальная микробная биомасса (селективное ингибирование) и продуцирование CO2 и N2O дерново-подзолистыми почвами постагрогенных биогеоценозов // Почвоведение. 2010. № 11. С. 1387–1393.
Благодатская Е.В., Пампура Т.В., Богомолова И.Н., Копцик Г.Н., Лукина Н.В. Влияние выбросов медно-никелевого комбината на микробные сообщества почв лесных биогеоценозов Кольского полуострова // Известия РАН. Сер. биологическая. 2008. № 2. С. 232–242.
Богородская А.В., Пономарева Т.В., Шапченкова О.А., Шишикин А.С. Оценка состояния микробных комплексов почв лесотундровой зоны в условиях аэротехногенного загрязнения // Почвоведение. 2012. № 5. С. 582–593.
Евдокимов И.В., Ларионова А.А., Шмитт М., Лопес де Гереню В.О., Бан М. Экспериментальная оценка вклада дыхания корней растений в эмиссию углекислого газа из почвы // Почвоведение. 2010. № 12. С. 1479–1488.
Евдокимова Г.А., Калабин Г.В., Мозгова Н.П. Содержание и токсичность тяжелых металлов в почвах зоны воздействия воздушных выбросов комбината “Североникель” // Почвоведение. 2011. № 2. С. 261–268.
Евдокимова Г.А., Мозгова Н.П., Корнейкова М.В. Содержание и токсичность тяжелых металлов в почвах зоны воздействия газовоздушных выбросов комбината “Печенганикель” // Почвоведение. 2014. № 5. С. 625–631.
Кадулин М.С., Копцик Г.Н. Эмиссия диоксида углерода почвами как критерий эффективности ремедиации техногенных пустошей вблизи медно-никелевых комбинатов в Кольской Субарктике // Экология. 2019. №. 6. С. 429–437.
Кадулин М.С., Копцик Г.Н. Эмиссия CO2 почвами в зоне влияния ГМК “Североникель” в Кольской Субарктике // Почвоведение. 2013. № 11. С. 1387–1396.
Кадулин М.C., Смирнова И.Е., Копцик Г.Н. Эмиссия диоксида углерода почвами лесных экосистем заповедника “Пасвик” в Кольской Субарктике // Почвоведение. 2017. № 9. С. 1098–1112.
Карелин Д.В., Замолодчиков Д.Г., Каганов В.В., Почикалов А.В., Гитарский М.Л. Микробная и корневая составляющие дыхания дерново-подзолистых почв южной тайги // Лесоведение. 2017. № 3. С. 183–195.
Кашулина Г.М., Переверзев В.Н., Литвинова Т.И. Трансформация органического вещества почв в условиях экстремального загрязнения выбросами комбината “Североникель” // Почвоведение. 2010. № 10. С. 1265–1275.
Копцик Г.Н., Кадулин М.С., Захарова А.И. Влияние техногенного загрязнения на эмиссию диоксида углерода почвами в Кольской Субарктике // Журн. общ. биол. 2015. Т. 76. № 1. С. 48–62.https://doi.org/10.7868/S0032180X18060011
Кудеяров В.Н. Дыхание почв и биогенный сток углекислого газа на территории России (аналитический обзор) // Почвоведение. 2018. № 6. С. 643–658.
Курганова И.Н., Лопес де Гереню В.О., Жиенгалиев А.Т., Кудеяров В.Н. Углеродный бюджет степных экосистем России // Доклады АН. 2019. Т. 485. №. 6. С. 732–735.
Лесные экосистемы и атмосферное загрязнение / Под ред. В.А. Алексеева. Л.: Наука, 1990. 200 с.
Лянгузова И.В. Динамические тренды содержания тяжелых металлов в растениях и почвах при разном режиме аэротехногенной нагрузки // Экология. 2017. № 4. С. 250–260.
Некрич А.С., Люри Д.И. Изменения динамики аграрных угодий России в 1990–2014 гг. // Известия РАН. Сер. географическая. 2019. № 3. С. 64–77.
Пулы и потоки углерода в наземных экосистемах // Отв. ред. Г.А. Заварзин. М.: Наука, 2007. 315 с.
Смагин А.В. Газовая фаза почв. М.: Изд-во Моск. ун-та, 2005. 301 с.
Сморкалов И.А., Воробейчик Е.Л. Механизм стабильности эмиссии СО2 из лесной подстилки в условиях промышленного загрязнения // Лесоведение. 2016. № 1. С. 34–43.
Сморкалов И.А., Воробейчик Е.Л. Почвенное дыхание лесных экосистем в градиентах загрязнения среды выбросами медеплавильных заводов // Экология. 2011. № 6. С. 429–435.
Трефилова О.В. Интенсивность гетеротрофного дыхания в сосняках средней тайги: сравнительный анализ методов оценки // Хвойные бореальной зоны. 2007. Т. 24. № 4–5. С. 467–473.
Bond-Lamberty B., Wang C., Gower S.T. Contribution of root respiration to soil surface CO2 flux in a boreal black spruce chronosequence // Tree Physiol. 2004. V. 24. P. 1387–1395. https://doi.org/10.1093/treephys/24.12.1387
Boone R.D., Nadelhoffer K.J., Canary J.D., Kaye J.P. Roots exert a strong influence on the temperature sensitivity of soil respiration // Nature. 1998. V. 396. P. 570–572. https://doi.org/10.1038/25119
Brookes P.C. The use of microbial parameters in monitoring soil pollution by heavy metals // Biol. Fertil. Soils. 1995. V. 19. P. 269–279. https://doi.org/10.1007/BF00336094
Cui J., Zhang R., Bu N., Zhang H., Tang B., Li Z., Jiang L., Chen J., Fang C. Changes in soil carbon sequestration and soil respiration following afforestation on paddy fields in north subtropical China // J. Plant Ecol. 2013. V. 6(3). P. 240–252. https://doi.org/10.1093/jpe/rts023
Eriksen J., Jensen L.S. Soil respiration, nitrogen mineralization and uptake in barley following cultivation of grazed grasslands // Biol. Fertil. Soils. 2001. V. 33(2). P. 139–145. https://doi.org/10.1007/s003740000302
Giller K.E., Witter E., McGrath S.P. Heavy metals and soil microbes // Soil Biol. Biochem. 2009. V. 41(10). P. 2031–2037. https://doi.org/10.1016/j.soilbio.2009.04.026
Jentschke G., Godbold D.L. Metal toxicity and ectomycorrhizas // Physiol. Plant. V. 109(2). 2000. P. 107–116. https://doi.org/10.1034/j.1399-3054.2000.100201.x
Jian J., Vargas R., Anderson-Teixeira K., Stell E., Herrmann V., Horn M., Kholod N., Manzon J., Marchesi R., Paredes D., and Bond-Lamberty B. A restructured and updated global soil respiration database (SRDB-V5) // Earth Syst. Sci. Data Discuss. 2020.
Jones D.L. Organic acids in the rhizosphere – a critical review // Plant Soil. V. 205. 1998. P. 25–44. https://doi.org/10.1023/A:1004356007312
Karelin D., Goryachkin S., Zazovskaya E., Shishkov V., Pochikalov A., Dolgikh A., Sirin A. et al. Greenhouse gas emission from the cold soils of Eurasia in natural settings and under human impact: Controls on spatial variability // Geoderma Reg. 2020. V. 22. e00290. https://doi.org/10.1016/j.geodrs.2020.e00290
Kozlov M.V., Zvereva E.L., Zverev V.E. Soil Quality // Impacts of Point Polluters on Terrestrial Biota. Environmental Pollution. V. 15. Dordrecht: Springer, 2009. P. 107–131.
Lloyd J., Taylor J.A. On the temperature dependence of soil respiration // Funct. Ecol. 1994. V. 8. P. 315–323. https://doi.org/10.2307/2389824
Longdoz B., Yernaux M., Aumbinet M. Soil CO2 efflux measurements in a mixed forest: impact of chamber disturbances, spatial variability and seasonal evolution // Glob. Chang. Biol. 2000. V. 6. P. 907–917.
Raich J.W., Schlesinger W.H. The global carbon dioxide flux in soil respiration and its relationship to vegetation and climate // Tellus B. 1992. V. 44(2). P. 81–99.
Ramsey P.W., Rillig M. C., Feris K.P., Gordon N.S., Moore J.N., Holben W.E., Gannon J.E. Relationship between communities and processes; new insights from a field study of a contaminated ecosystem // Ecol. Lett. 2005. V. 8(11). P. 1201–1210. https://doi.org/10.1111/j.1461-0248.2005.00821.x
Razavi B.S., Blagodatskaya E., Kuzyakov Y. Nonlinear temperature sensitivity of enzyme kinetics explains canceling effect — a case study on loamy haplic Luvisol // Front. Microbiol. 2015. V. 6(1126). P. 1–13. https://doi.org/10.3389/fmicb.2015.01126
Schlesinger W.H., Andrews J.A. Soil respiration and the global carbon cycle // Biogeochemistry. 2000. V. 48(1). P. 7–20. https://doi.org/10.1023/A:1006247623877
Shukurov N., Pen-Mouratov S., Steinberger Y. The impact of the Almalyk Industrial Complex on soil chemical and biological properties // Environ. Pollut. 2005. V. 136(2). P. 331–340. https://doi.org/10.1016/j.envpol.2004.12.007
Smiri M., Chaoui A., El Ferjani E. Respiratory metabolism in the embryonic axis of germinating pea seed exposed to cadmium // J. Plant Physiol. 2009. V. 166(3). P. 259–269. https://doi.org/10.1016/j.jplph.2008.05.006
Subke J.A., Reichstein M., Tenhunen J.D. Explaining temporal variation in soil CO2 efflux in a mature spruce forest in Southern Germany // Soil Biol. Biochem. 2003. V. 35. P. 1467–1483. https://doi.org/10.1016/S0038-0717(03)00241-4
Vance E.D., Brookes P.C., Jenkinson D.S. An extraction method for measuring soil microbial biomass // Soil Biol. Biochem. 1987. V. 19. P. 703–707. https://doi.org/10.1016/0038-0717(87)90052-6
Дополнительные материалы отсутствуют.
Инструменты
Почвоведение


